Biopsie nádorů ledvin – indikace, provedení, výsledky
Authors:
Jiří Kolář 1; Tomáš Pitra 1; Kristýna Pivovarčíková 2; Ivan Trávníček 1; František Lepič 3; Ondřej Hes 2; Milan Hora 1
Authors‘ workplace:
Urologická klinika LF UK a FN Plzeň
1; Šiklův ústav patologie LF UK a FN Plzeň
2; Klinika zobrazovacích metod LF UK a FN Plzeň
3
Published in:
Ces Urol 2020; 24(2): 113-125
Category:
Original Articles
Overview
Cíl: Zhodnotit výsledky biopsie tumorů ledvin (BTL) provedených na našem pracovišti a tyto následně porovnat s výsledky udávanými v literatuře.
Materiál a metoda: Retrospektivní hodnocení souboru pacientů, kteří podstoupili BTL v letech 2007–2019.
Výsledky: Za časové období I/2007–XII/2019 byla na našem pracovišti provedena BTL u 200 nemocných – 128 mužů (64,0 %) a 72 žen (36,0 %). Průměrný věk pacientů byl 64,8 let (34-85 let). Ve většině případů se jednalo o biopsii pod CT kontrolou (n = 192; 96,0 %), minoritně pod kontrolou ultrasonografickou (n = 8; 4,0 %). Nejčastější indikací k biopsii ledviny byla histologická verifikace u metastatického onemocnění před určením systémové onkologické léčby (n = 162; 81,0 %), dále histologická verifikace nejasných lézí (n = 32; 16,0 %) a biopsie před radiofrekvenční ablací (n = 6; 3,0 %). Iniciální biopsie byla diagnostická u 165 pacientů (82,5 %). Histologicky byl nejčastěji nalezen světlobuněčný renální karcinom (n = 107; 53,5 %), dále papilární renální karcinom (n = 19; 9,5 %), uroteliální karcinom (n = 15; 7,5 %) a chromofobocelulární renální karcinom (n = 3; 1,5 %). Ostatní histologické nálezy byly popisovány u 21 jedinců (10,5 %). Nediagnostických bylo 35 provedených biopsií (17,5 %); re‑biopsie byla provedena v 17 případech, z toho 16× již byla diagnóza stanovena. U zbylých 18 pacientů nebyla biopsie opakována (došlo k celkovému zhoršení stavu (n = 6), re‑biopsie byla pacientem odmítnuta (n = 2), netrvalo již klinické podezření z nádorového postižení (n = 4) nebo byl indikován chirurgický výkon, kdy histologické vyšetření bylo provedeno v rámci vyšetření preparátu (n = 6)). Nejzávažnější komplikací byl perirenální hematom s nutností podání krevní transfuze (Clavien 2).
Závěr: Biopsie tumoru ledviny je bezpečná a spolehlivá diagnostická metoda. V námi hod ‑ noceném souboru byla BTL v naprosté většině prováděna pod CT kontrolou. Nejčastější indikací byla histologická verifikace před onkologickou léčbou u metastatického onemocnění a převládajícím histologickým nálezem byl světlobuněčný renální karcinom.
Klíčová slova:
Biopsie – diagnóza – histologie – karcinom – ledvina
ÚVOD
V roce 2018 zemřelo v souvislosti s renálním karcinomem (RCC – Renal Cell Carcinoma) asi 175 000 lidí, což RCC zařadilo na 16. místo v žebříčku úmrtí asociovaných s nádorem. Celosvětově je RCC 6. nejčastější nádorové onemocnění u mužů a 10. u žen (1). Navzdory pokrokům v diagnostice a léčbě nádorů ledvin mortalita u karcinomu ledviny zůstává jednou z nejvyšších v rámci urologických malignit. Incidence RCC neustále stoupá, na čemž se jistě podílí i zvýšený záchyt incidentálních nálezů na ledvinách u asymptomatických pacientů při provádění zobrazovacích vyšetření z jiné indikace. Většina nálezů jsou tumory malé, nicméně nezanedbatelnou porci tvoří lokálně pokročilá onemocnění a až 17 % pacientů je diagnostikováno v době výskytu vzdálených metastáz (2). BTL je ve vybraných indikacích důležitým článkem diagnostického procesu nádorů ledvin. Má svou nezastupitelnou roli při histologické verifikaci nejasných ložisek, je využívána u pacientů s malými renálními lézemi (SRM – Small Renal Masses), kteří jsou kandidáty pro aktivní sledování, a slouží k získání histologie před léčbou ablativními technikami. Nicméně nejvíce využívaná je u pacientů s metastatickým onemocněním, kdy je nutné získat histologii k určení nejvhodnější onkologické léčby. Prezentujeme soubor pacientů, kteří byli indikováni k renální biopsii na našem pracovišti.
MATERIÁL A METODY
V nemocničním systému byly vyhledány biopsie nádorů ledvin, které byly na našem pracovišti provedeny v časovém období I/2007–XII/2019, a tyto byly statisticky zpracovány. Mezi hodnocené parametry patřila indikace k biopsii, provedení biopsie (použití koaxiální techniky, velikost jehly, počet odebraných vzorků), výtěžnost biopsie a histologický nález (eventuálně důvod nediagnostického vzorku a výtěžnost re‑biopsie), případné komplikace biopsie a následný postup po stanovení diagnózy (aktivní sledování, chirurgické řešení, léčba ablativními technikami či onkologická léčba).
VÝSLEDKY
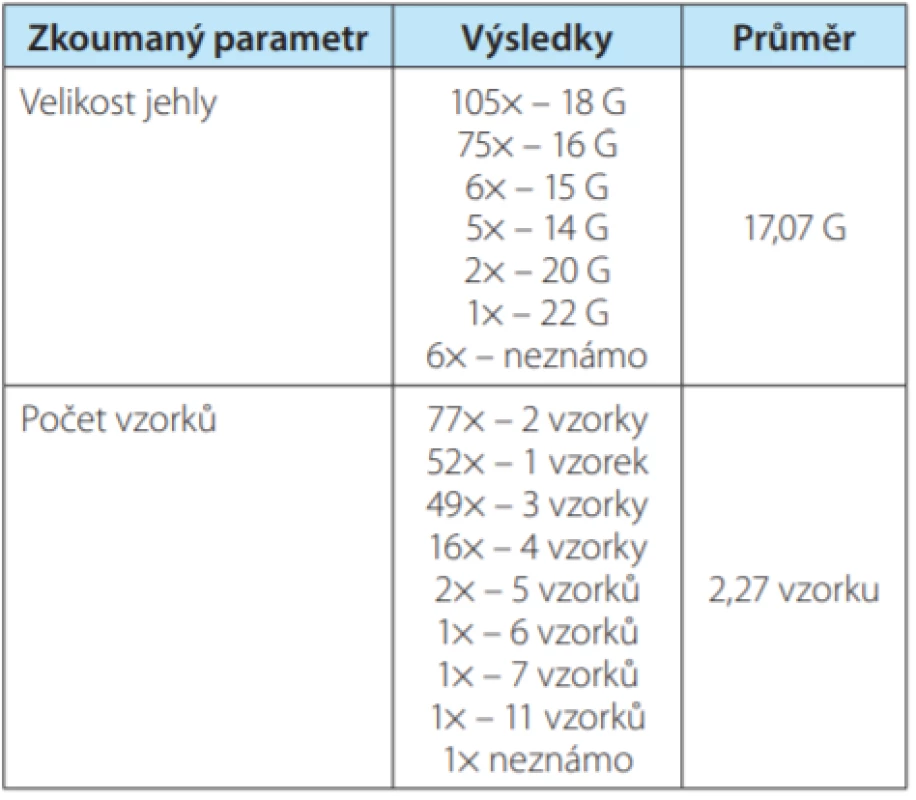
Za časové období I/2007–XII/2019 byla na našem pracovišti ve spolupráci s radiology provedena BTL u 200 nemocných – 128 mužů (64,0 %) a 72 žen (36,0 %). Nejvíce biopsií (n = 34; 17 %) bylo provedeno v roce 2019 (graf 1). Průměrný věk pacientů byl 64,8 let (34–85 let). U 107 jedinců (53,5 %) byla biopsie provedena z ledviny levé, v 92 případech (46,0 %) z ledviny pravé. V jednom případě (0,5 %) byly bioptovány ledviny oboustranně. Dle zvyklostí našeho pracoviště byla většina BTL provedena pod CT kontrolou (n = 192; 96,0 %), minoritně pod kontrolou ultrasonografickou (n = 8; 4,0 %). Všechny BTL pod CT kontrolou byly provedeny radiologem. Z osmi biopsií pod USG kontrolou byly tři provedeny radiologem a pět urologem. Ve více než polovině biopsií byla použita jehla velikosti 18 G (n = 105; 52,5 %), druhá nejčastěji používaná byla jehla 16 G (n = 75; 37,5 %). Použití koaxiální techniky nelze spolehlivě posoudit vzhledem k tomu, že ne vždy byla použitá technika radiologem ve zprávě popsána, nicméně jistě byla BTL prováděna s použitím koaxiálního kanálu v 82 případech, ve zbylých 118 biopsiích není údaj uveden. Průměrně byly při jedné biopsii odebrány dva vzorky. Kontrastní látka byla použita v 70 případech (36,5 %) ze 192 biopsií pod CT kontrolou (tabulka 1).
Tab. 1. Summary of results – size of the biopsy needle
and number of samples
Graph 1. Numbers of patients who underwent renal
tumor biopsy; sorted on a yearly basis

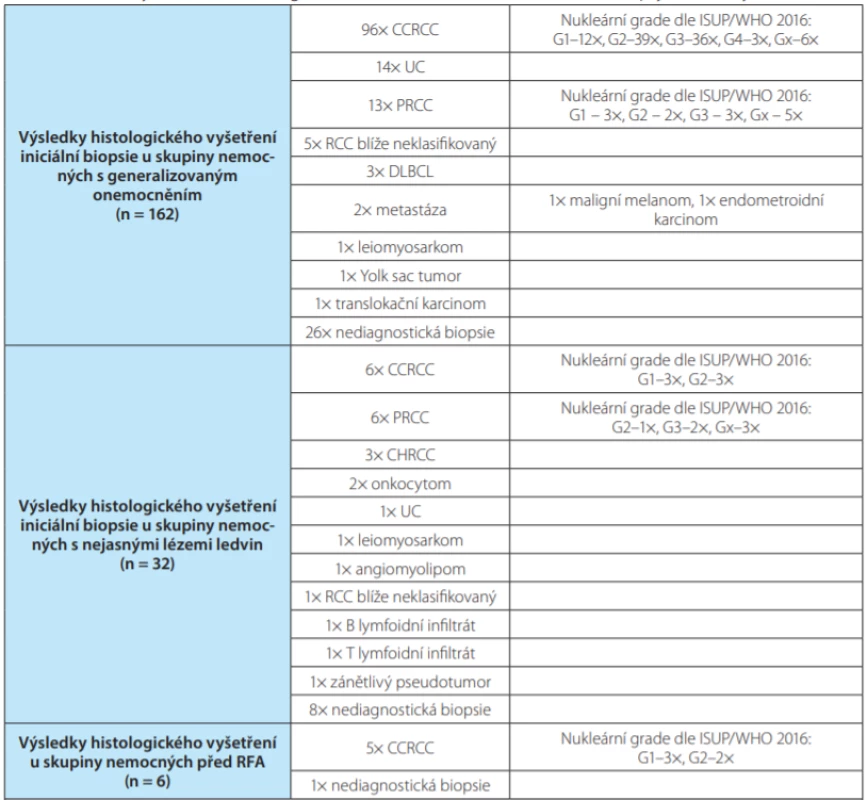
Nejčastější indikací k BTL byla histologická verifikace u metastatického onemocnění před zahájením onkologické léčby (n = 162; 81,0 %), dále histologická verifikace nejasných lézí (n = 32; 16,0 %) a biopsie před radiofrekvenční ablací (n = 6; 3,0 %).
Průměrná velikost bioptovaného tumoru ledviny byla 78,7 mm (12–220 mm). V souboru pacientů in ‑ dikovaných k BTL před provedením radiofrekvenční ablace byla průměrná velikost tumoru 25 mm, v souboru nemocných s nejasnou lézí 43,7 mm a v souboru pacientů s metastatickým onemocněním byla průměrná velikost tumoru 87,5 mm.
Histologicky byl nejčastěji nalezen světlobuněčný renální karcinom (CCRCC – Clear Cell Renal Cell Carcinoma; n = 107, 53,5 %), dále papilární renální karcinom (PRCC – Papillary Renal Cell Carcinoma; n = 19, 9,5 %), uroteliální karcinom (UC – Urothelial Carcinoma; n = 15, 7,5 %) a chromofobocelulární renální karcinom (CHRCC – CHromophobe Renal Cell Carcinoma; n = 3, 1,5 %). Mezi ostatní histologické nálezy (n = 21; 10,5 %) patřil neklasifikovatelný renální karcinom (6×), difuzní velkobuněčný B lymfom (3×), leiomyosarkom (2×), onkocytom (2×), angiomyolipom (1×), translokační karcinom (1×), metastáza maligního melanomu (1×), metastáza endometriálního adenokarciomu (1×) a Yolk sac tumor (1×). Z nenádorových nálezů byl patologem popisován zánětlivý pseudotumor (1×), B lymfoidní infiltrát (1×) a zánětlivý lymfoidní infiltrát T povahy pravděpodobně jako následek biologické léčby revmatoidní artritis (1×). Nediagnostických bylo 35 provedených biopsií (17,5 %) – nebyly zastiženy nádorové buňky (zánětlivá nebo fibrózní tkáň (14×), nekrotická tkáň (9×), normální renální tkáň (6×), nedostatek materiálu (5×), extrarenální tkáň (1×)). Průměrná velikost tumoru u nediagnostických primobiopsií byla 72,2 mm. Z 35 nediagnostických biopsií se v 15 případech jednalo o biopsii s odběrem 3 vzorků, 9× byly odebrány vzorky 2, 7× 1 vzorek, 3× 4 vzorky a 1× vzorků 6. Re‑biopsie byla provedena v 17 případech. U zbylých 18 pacientů nebyla biopsie opakována z několika důvodů. U 6 nemoc ‑ ných došlo k celkovému zhoršení stavu a byla dále indikována pouze symptomatická léčba, výsledek biopsie by již pro pacienta nepřinášel žádný benefit. Opakování BTL bylo odmítnuto 2 pacienty a u 4 již nebyla BTL indikována, protože netrvalo klinické podezření z nádorového postižení. Zbylých 6 pacientů podstoupilo chirurgický výkon a histologické vyšetření bylo provedeno v rámci vyšetření preparátu – z toho byl popsán 3× CCRCC (2× nukleární grade (G) 1 (dle ISUP/WHO 2016) a 1× G2), 1× sarkomatoidní UC, 1× eosinofilní varianta CHRCC a 1× leiomyom. Ze 17 re‑bioptovaných vzorků byla nádorová tkáň zachycena v 16 případech (94,1 %). Z toho byly 9× zachyceny struktury CCRCC (G1 – 1×, G2 – 4×, G3 – 1×, G4 – 1×, Gx – 2×), 2× PRCC (G2 – 1×, G3 – 1×), 3× high grade RCC blíže nespe ‑ cifikovaného, 1× sarkomu s rhabdomyoblastickou diferenciací a 1× onkocytomu. Jediná biopsie byla opět bez nálezu nádorových buněk. V tomto případě proběhla další re‑biopsie ze suspektního ložiska vzhledu metastázy v m. psoas, nicméně opět bez diagnózy. Pacient byl referován na neurochirurgické pracoviště a indikován k biopsii suspektní metastázy v obratli L2, nicméně na plánované vyšetření nedorazil.
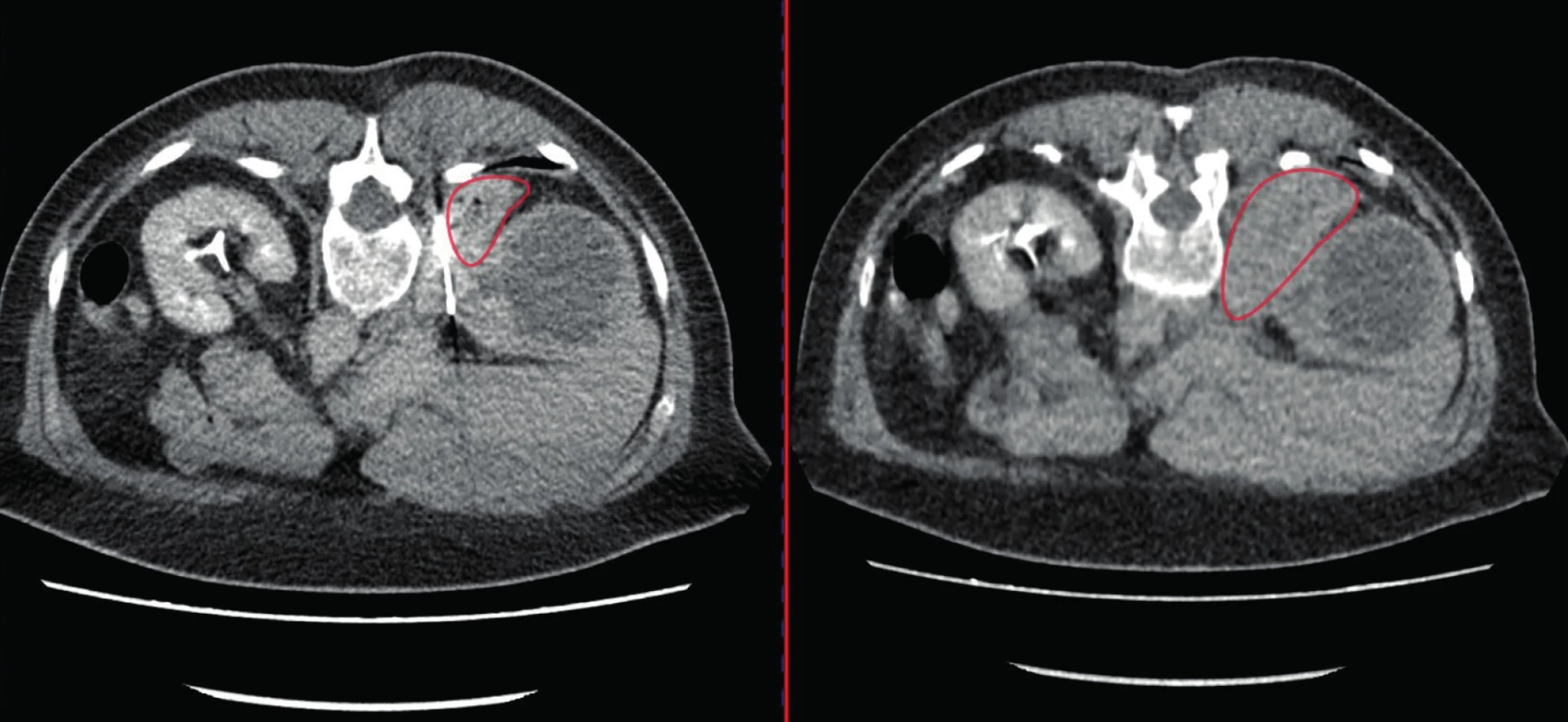
V rámci našeho souboru nebyly v souvislosti s BTL popisovány závažné komplikace. Počet subkapsulárních nebo perirenálních hematomů, které bývají většinou asymptomatické, nelze objektivně posoudit, neboť rutinní kontrolní vyšetření (USG nebo CT) nebývá po nekomplikované biopsii prová ‑ děno. Tomu je tak pouze při popisu výraznějšího he ‑ matomu na CT nebo USG bezprostředně po odběru vzorku nebo při symptomech pacienta. Jednou byla biopsie komplikována makroskopickou hematurií,při konzervativním postupu došlo k vyčeření moči (histologie z bioptického vzorku následně s popisem uroteliálního karcinomu). V jednom případě se objevila kožní alergická reakce pravděpodobně na kontrastní látku podanou při biopsii pod CT kontrolou. Nejzávažnější komplikací byl perirenální hematom (dle CT 77 × 40 × 92 mm) u nemocné s hemokoagulační poruchou (nicméně dle hematologa poruchou korigovanou) se současným poklesem v červeném krevním obraze (ČKO) a s nutností podání krevní transfuze (Clavien 2), při konzervativním postupu došlo k postupné resorpci hematomu (obrázek 1).
Tab. 2. Summary – results of histological examination after initial renal tumor biopsy; divided by the indication
Tab. 3. Summary – results of histological examination after initial renal tumor biopsy
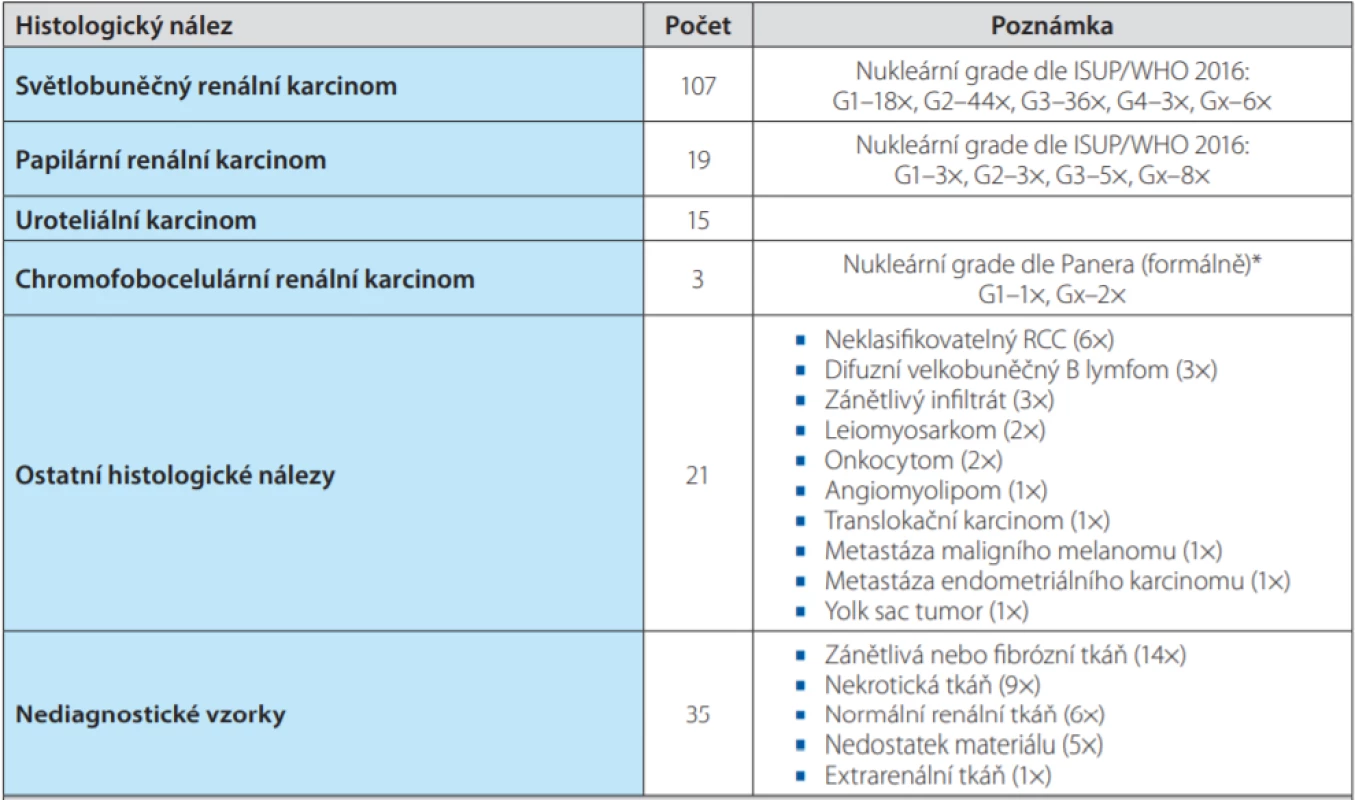
* Žádný ze současně využívaných gradingových systémů u CHRCC nekoreluje s biologickým chováním tumoru a nemá
tedy prakticky žádnou výpovědní hodnotu
Fig. 1. CT scan, transverse plane; the biopsy of the right kidney became complicated due to hematoma; in the
left picture – hematoma during the biopsy, in the right picture – hematoma after the biopsy
Z celkového souboru 200 pacientů byla biopsie u 162 z nich (81,0 %) provedena z důvodu histologické verifikace před volbou nejvhodnější onkologické léčby u generalizovaného onemocnění. Z této indikační skupiny bylo v onkologické péči v rámci naší nemocnice 155 jedinců (96,6 %), u zby ‑ lých 7 pacientů data chybí. Zpětným hodnocením bylo zjištěno, že ze 155 pacientů s histologicky verifikovaným renálním karcinomem s generalizací byla onkologická léčba podávána u 123 pacientů (79,4 %). U zbylých 32 nemocných (20,6 %) byla indikována pouze symptomatická léčba vzhledem k celkovému stavu a komorbiditám.
Tab. 4. Summary – renal tumor biopsy of the patients with unclear renal masses who subsequently underwent surgery
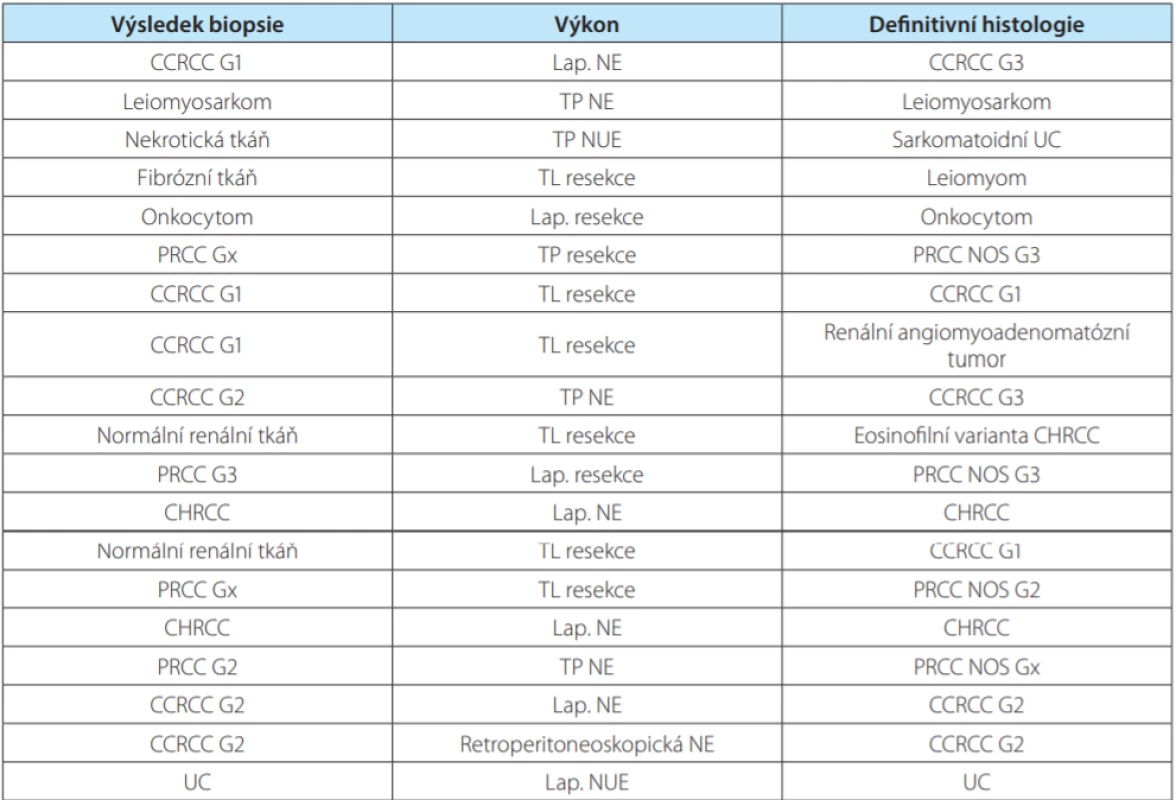
Tab. 5. Indications and contraindications for renal tumor biopsy
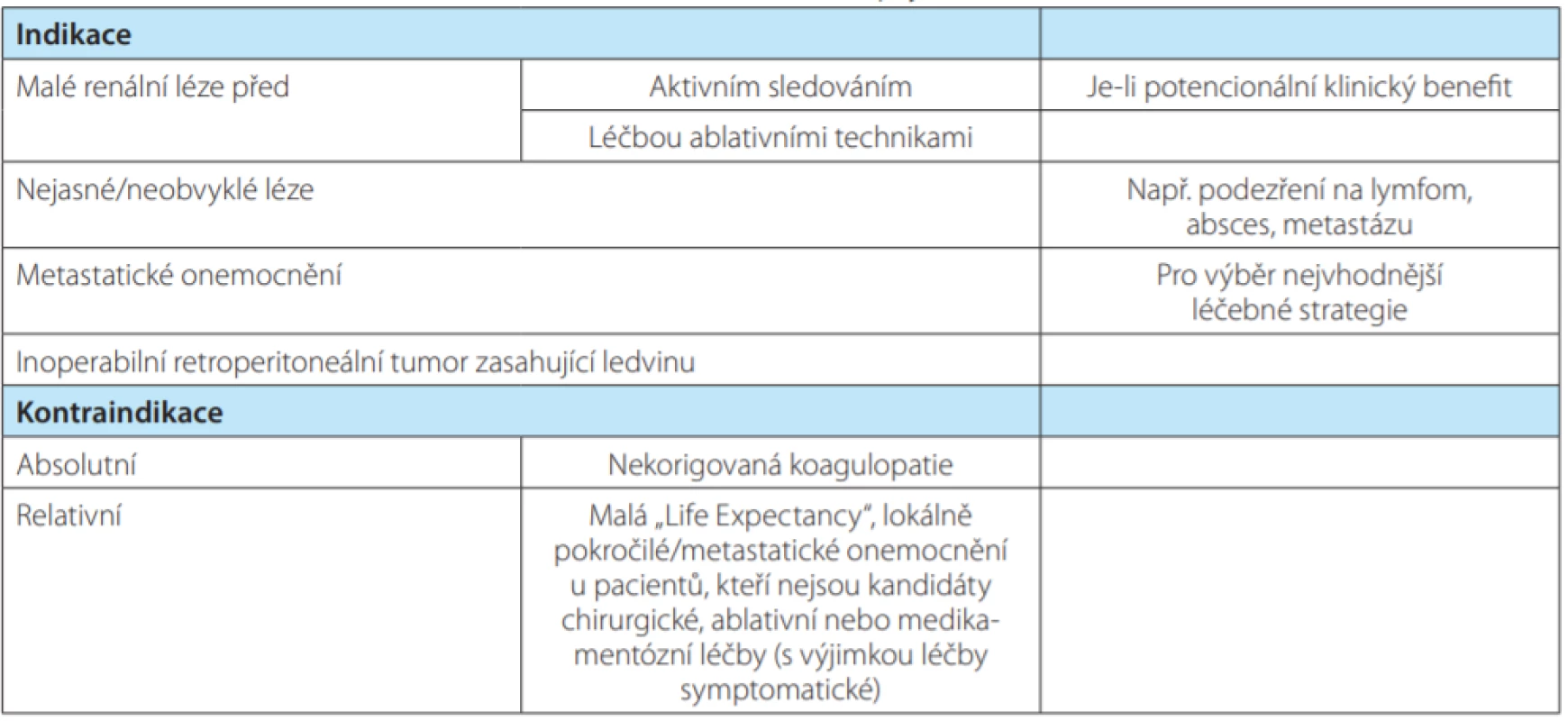
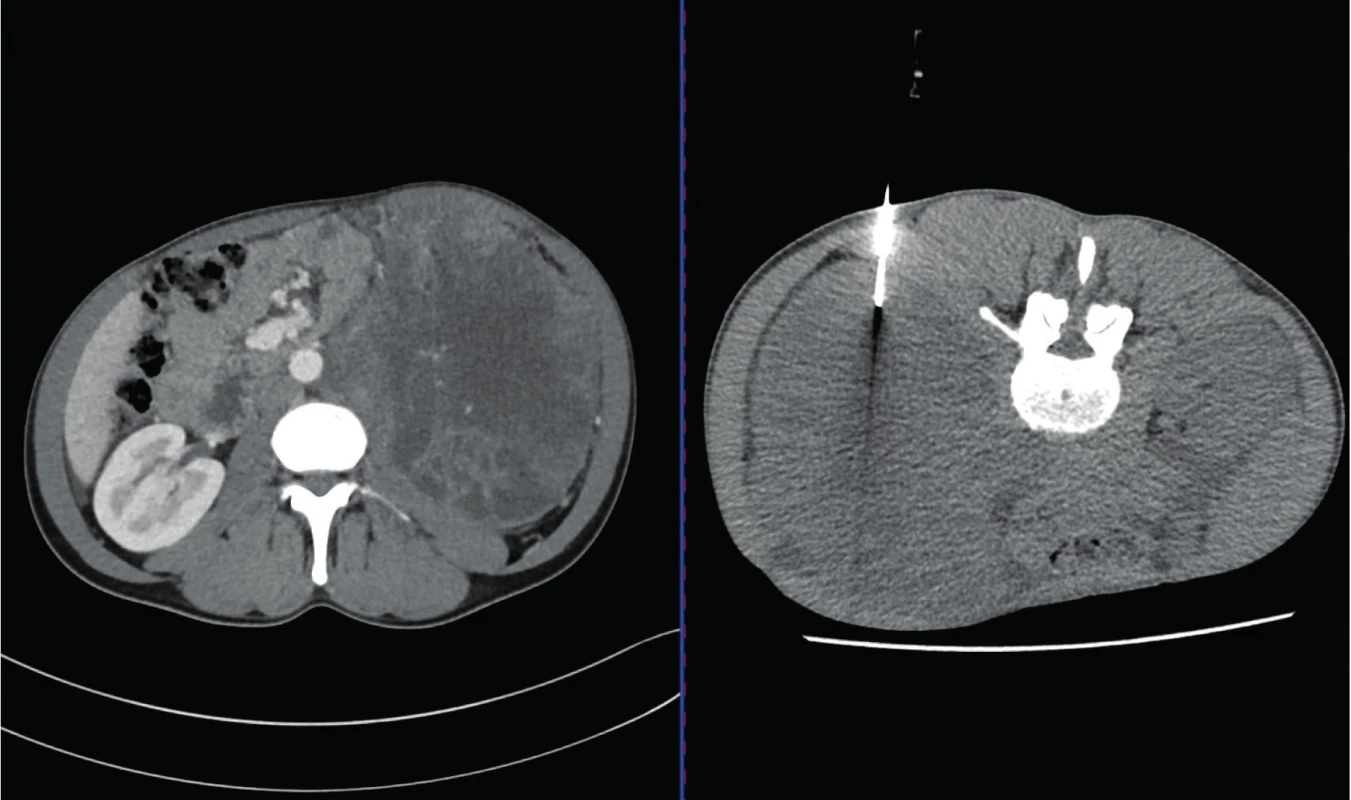
Fig. 2. CT scan, transverse plane. A thirty-five year old male. In the left picture – CT scan prior to the biopsy with
the description of the tumor of the left kidney and retroperitoneum with the vena cava inferior invasion. In the
right picture – CT scan during the biopsy. Histologically Yolk-sac tumor
DISKUZE
Strategie léčby renálních tumorů se vyvíjí spolu s využíváním nonexstirpačních technik u SRM u vybrané skupiny pacientů a současně s příchodem nových efektivních preparátů systémové léčby pro terapii metastatického renálního karcinomu. S tím souvisí i význam histologické verifikace pro zvolení správného léčebného postupu, a to jak u lokalizovaných, tak u generalizovaných lézí (3, 4). Biopsie ledviny představuje užitečný klinický nástroj, který má své specifické indikace stejně jako svá omezení (5). Vzhledem k tomu, že existuje nezanedbatelná část benigních lézí s možností jejich sledování (zejména onkocytom), je některými autory zvažováno provádění biopsie u všech nádorů ledvin (6, 7). Dle doporučených postupů Evropské urologické společnosti (EAU – European Association of Urology) je možné nabídnout aktivní sledování pacientům s biopticky verifikovaným onkocytomem, jakožto přijatelnou alternativu k chirurgickému řešení nebo ablaci (8). Patel et al. ve své meta‑analýze popisuje 64,6% shodu při srovnání biopticky stanoveného onkocytomu s následným výsledkem histologického vyšetření po chirurgické léčbě. Nicméně ostatní nálezy byly tvořeny především jinými benigními nálezy nebo lézemi s nízkým maligním potenciálem (CHRCC 18,8 %, ostatní RCC 12,5 % a ostatní benigní léze 4,2 %) (9).
BTL je metoda bezpečná. Nejčastější popisovanou komplikací bývá perirenální nebo subkapsulární hematom, který může být patrný na CT nebo USG po provedené biopsii až v 91 % (10). V naprosté většině těchto případů intervence není nutná. Klinicky signifikantní krvácení s nutností podání krevní transfuze je popisováno jen u 0–5 % biopsií (11). Uvádí se, že riziko krvácení se zvyšuje při použití větší bioptické jehly (≤ 18 G), ale žádná studie zatím přímo neporovnala četnost výskytu komplikací při užívání jehel různé velikosti. Stejně tak žádná studie jasně neposoudila korelaci mezi počtem odebíraných vzorků, lokalizací tumoru, zkušenostmi klinika provádějícího biopsii a četností výskytu komplikací (12). Nejobávanější komplikací je diseminace tumorózních buněk podél punkčního kanálu s udávaným výskytem pod 0,01 % (10, 12, 13, 14, 15, 16, 17). Toto riziko klesá při provádění biopsie koaxiální technikou umožňující odběr více vzorků skrz koaxiální kanál, který zároveň zabraňuje kontaktu bioptické jehly s okolními tkáněmi. Macklin et al. recentně popsali 7 případů rozsevu nádorových buněk při BTL, v 6 případech se jednalo o PRCC (z toho 4× PRCC typ 1, 1× PRCC typ 2 a 1× PRCC se známkami typu 1 i 2), pouze v 1 případě se jednalo o CCRCC. Ve všech případech byla koaxiální technika použita. V souboru PRCC bylo riziko diseminace výrazně vyšší (12,5 %) ve srovnání se souborem celkovým (1,2 %) (18). Na zvýšené riziko diseminace u PRCC může mít vliv fragilita nádorových papil i nedostatečně vyvinutá pseudokapsula tumoru (19, 20). Patel et al. v souboru 2 979 pacientů nezaznamenali při biopsii ledviny žádnou komplikaci ve smyslu rozsevu nádorových buněk (21). Macroni et al. ve své meta‑analýze popisují výskyt hematomů po biopsii ve 4,3 % případů, ale hematomy vyžadující krevní transfuzi jen v 0,7 % případů. Hematurie se vyskytla v 3,15 %, přičemž pouze v jediném bylo nutné provedení angio‑embolizace (Clavien 3a). Lumbalgie byly popisovány u 3 % případů, ve dvou případech byla biopsie komplikována pneumotoraxem a v jednom případě septickým šokem po biopsii pyelonefritické ledviny. Byl popsán pouze jeden případ rozsevu nádorových buněk, podezření z klinického vyšetření a ze zobrazovacích metod však nebylo potvrzeno histologickým vyšetřením peritumorózního a perirenálního tuku po chirurgickém výkonu (22, 23). Jeon et al. retrospektivně hodnotili soubor 442 pacientů podstoupivších biopsii ledviny. Pouze u tří nemocných bylo nutné podat krevní transfuzi a následně u dvou z nich provést selektivní embolizaci pro pokračující krvácení (24). V rámci našeho souboru bylo jednou nutné podat krevní transfuzi (Clavien 2) pro pokles v ČKO při perirenálním hematomu u pacientky s koagulační poruchou. Závažnější komplikace nebyly popisovány.
Dle literatury není 10–20 % vzorků primobiopsie ledviny diagnostických. Biopsie je opakována asi ve 20–30 % nediagnostických iniciálních biopsiích a re‑biopsie pak přináší diagnostický závěr v 80–100 % případů (10, 22, 25). V našem souboru byla primobiopsie výtěžná v 82,5 % (165 z 200), re‑biopsie poté v 94,1 % (16 ze 17). K zopakování biopsie došlo v 48,6 % nediagnostických iniciálních BTL (17 z 35).
Recentní meta‑analýza demonstrovala vysokou senzitivitu a specificitu core BTL (99,1 % respektive 99,7 %) při detekci malignity. Přesnost BTL při dia‑gnostice malignity u cystických lézí je inferiorní k biopsii ložisek solidních (senzitivita 83,6 %, specifi ‑ cita 98,0 %) (22). Biopsie má u cystických lézí nízkou diagnostickou výtěžnost i přesnost a její provedení není dle EAU doporučováno (8).
Jeon et al. popisují 95,1% shodu při porovnání výsledku histologického subtypu při vyšetření materiálu z biopsie ledviny s histologií popsanou při chirurgickém odstranění ložiska (24). Marconi et al. udávají ve své meta‑analýze míru shody 90,3 % (22). I vzhledem k intratumorózní heterogenitě u RCC, míra shody jaderného gradingu u pacientů, kteří podstoupili BTL následovanou chirurgickým zákrokem, byla slabá – pouze 62,5 %. Při užití dvoustupňového gradingového systému (low grade/ high grade) se míra shody zvýšila na 87 % (22, 26, 27, 28). Další retrospektivní studie 373 SRM biopsií popisuje míru shody 58 % u čtyřstupňového a 81 % u dvoustupňového gradingového systému. Všechny diskordantní tumory byly při posuzování gradingu u biopsie podhodnocené (26, 29). Biopsie tedy není v určení nukleárního gradu spolehlivá a udávaná senzitivita detekce high‑grade lézí je pod 60 % (27, 30). Na našem pracovišti byla indikací k provedení BTL ve 32 případech nejasná léze ledvin. Z tohoto souboru následně 19 pacientů podstoupilo chirurgický výkon – 10× nefrektomie a 9× resekce ledviny (tabulka 4). Při porovnání histologického výsledku ze vzorku biopsie s definitivním vyšetřením preparátu po chirurgickém výkonu byla míra shody 73,7 % (n = 14). Kouřilová et al. ve svém souboru 14 pacientů popisují míru shody 85 % (31).
Několik studií se také zabývalo prediktory diagnostického úspěchu BTL. Bylo prokázáno, že větší velikost tumoru signifikantně koreluje s diagnostickou výtěžností biopsie a že core biopsie jsou signifikantně méně informativní u lézí cystických oproti masám solidním (32, 33). Vliv na diagnostickou úspěšnost biopsie má pravděpodobně i lokalizace tumoru (větší výzvou pro klinika provádějícího biopsii jsou tumory endofytické, uložené blízko hilu nebo dutého systému, lokalizované na horním pólu či přední straně ledviny) a habitus pacienta. Stran navigace biopsie se nezdá být signifikantní rozdíl mezi CT a USG (32, 33). Ideální velikost jehly k provedení core biopsie je 18 G (12). Aby se zabránilo případnému rozsevu nádorových buněk při BTL, měla by být vždy používána koaxiální technika (7, 34). Ideální počet a lokalizace core biopsií není definován, nicméně by měly být získány alespoň dva kvalitní vzorky. U větších tumorů je preferován odběr vzorku z periferie tumoru a vyhnout se tak ložisku centrální nekrózy. U tumorů se stagingem cT2 a výše jsou doporučovány vícečetné core biopsie z alespoň čtyř oddělených solidních ložisek, což vede k vyšší diagnostické výtěžnosti a vyšší pravděpodobnosti zachycení sarkomatoidních znaků (8, 35). Kontrastní látka je při CT navigované biopsii používána u lézí malých, nepřehledných a špatně diferencovaných od jejich okolí. K zaměření léze se využívá kombinace laseru a speciální mřížky přiložené na povrch těla. Pozice jehly je při BTL průběžně kontrolována, po dokončení biopsie se provádí kontrolní CT k vyloučení komplikací (hematom či pneumotorax u vysoko uložených lézí).
Jednoznačně nejvíce biopsií (n = 34; 17 %) bylo na našem pracovišti provedeno v roce 2019, což je dáno i změnou přístupu k cytoredukční nefrektomii (CN) u metastatického RCC. Na základě výsledků studie CARMENA byly aktualizovány doporučené postupy EAU pro metastatický RCC. CN by měla být provede ‑ na u pacientů v celkově dobrém stavu, kteří nevyžadují systémovou léčbu a u nemocných s oligometastázami, které mohou být chirurgicky kompletně odstraněny. U nemocných s intermediární prognózou dle MSKCC je doporučeno zahájit systémovou léčbu a CN zvážit u jedinců s dobrou odpovědí. Není doporučeno provádět CN u pacientů se špatnou prognózou dle MSKCC (8, 36). Z tohoto plyne vyšší počet indikací ve prospěch onkologické systémové léčby a s tím související vyšší počet BTL, které jsou nutné k histologické verifikaci před volbou léčby nejvhodnější.
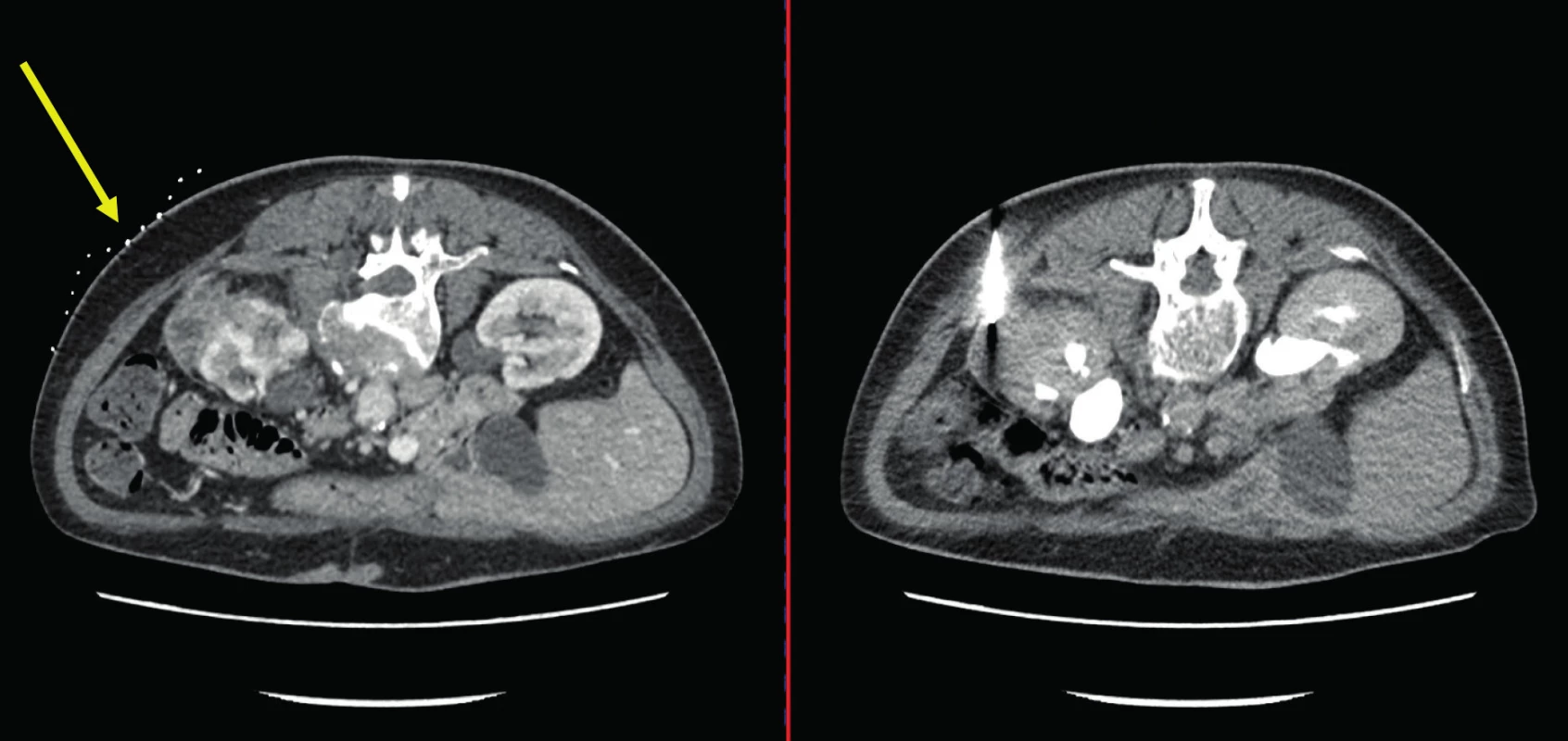
Fig. 3. CT scan, transverse plane. A sixty-six year old female. In the left picture – CT scan prior to the biopsy
with the description of the solid and cystic tumor of the left kidney and adrenal gland with the infiltration of
the retroperitoneal lymph nodes. In the right picture – CT scan during the biopsy. Histologically inflammatory
pseudotumor. Yellow arrow points to the contrast grid which is being used to focus the lession during the biopsy
Tab. 6. The European Association of Urology Guidelines on renal tumor biopsy (8)
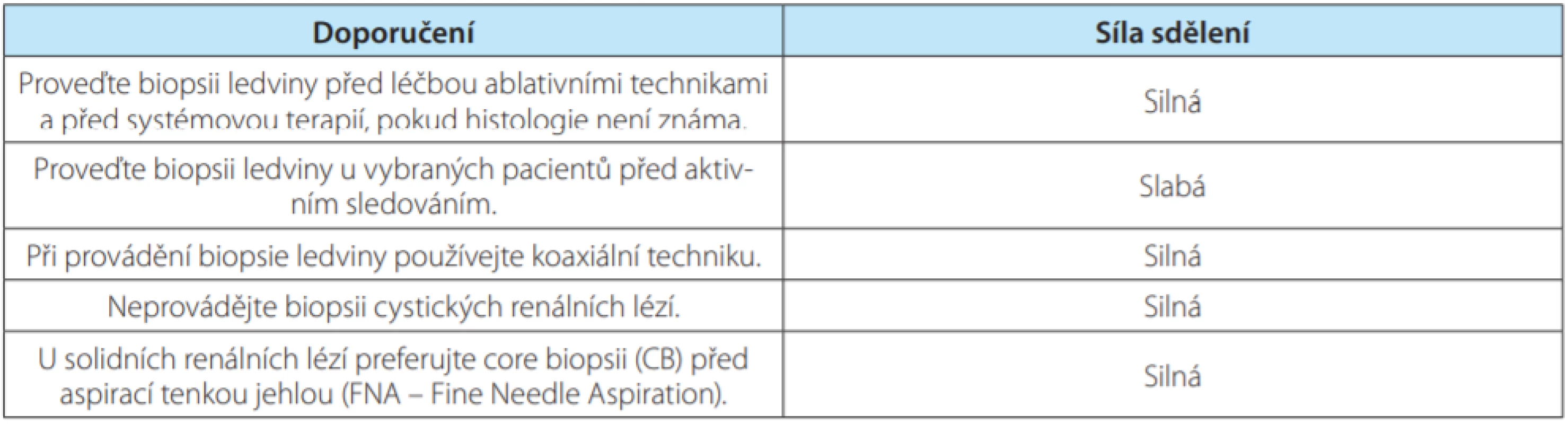
Fig. 4. CT scan, transverse plane. A fifty year old male. In the left picture – CT scan prior to the biopsy with the
description of the tumor of the left kidney, oncocytoma suspected. In the right picture – CT scan during the biopsy.
Histologically confirmed oncocytoma
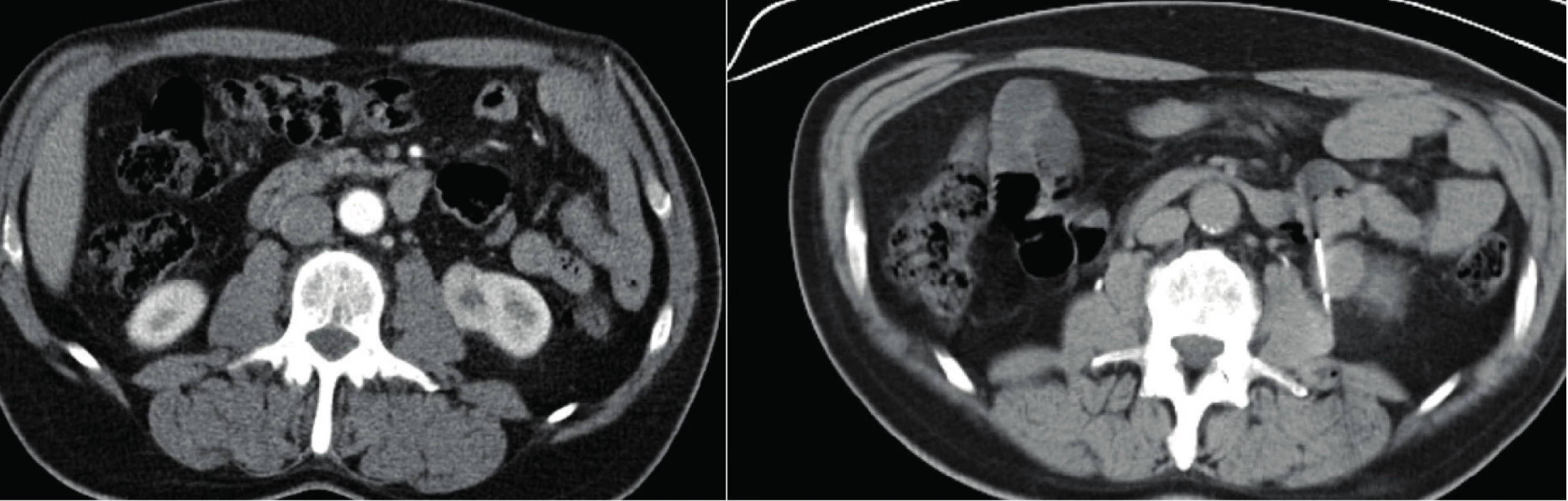
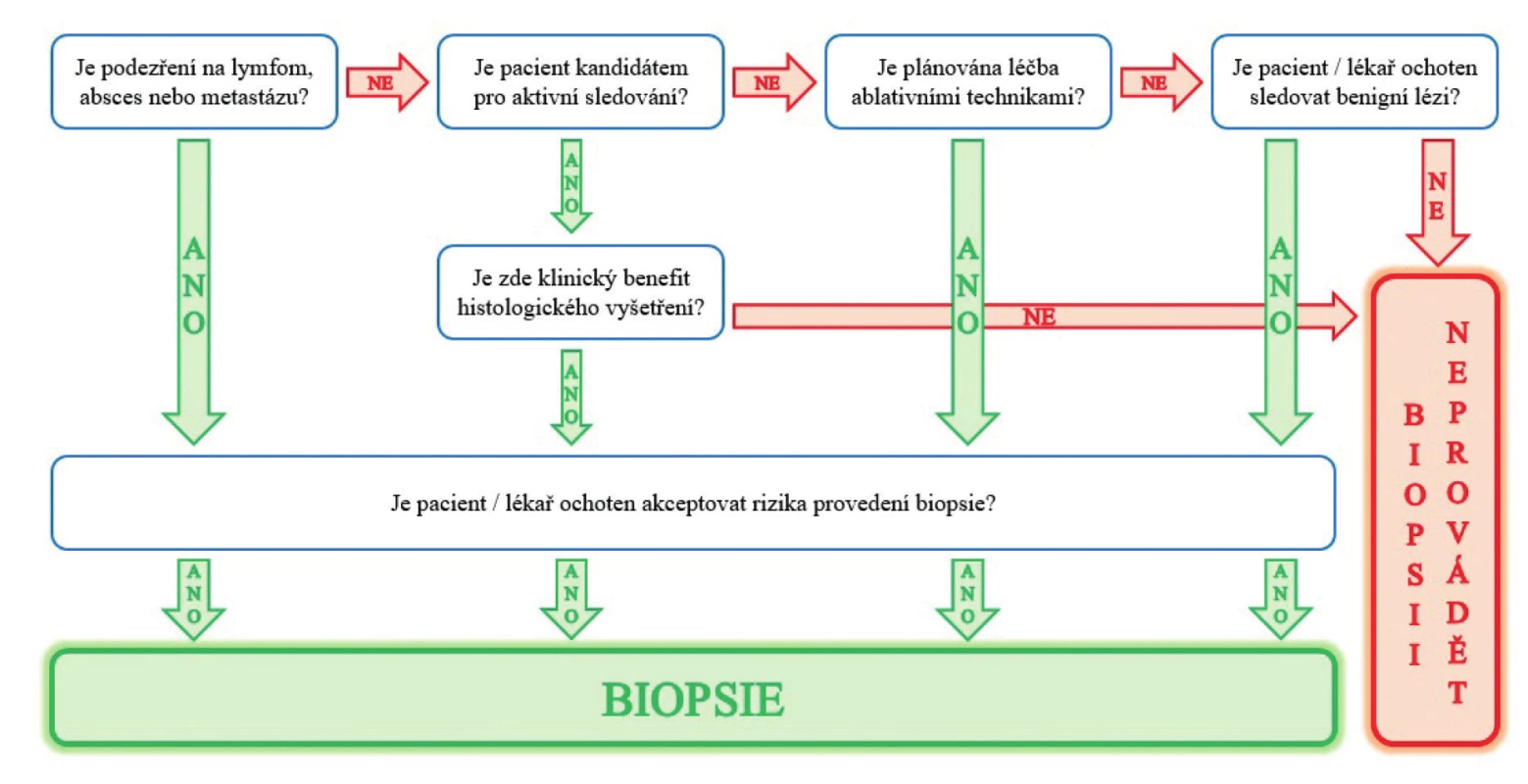
Fig. 5. The diagram illustrating clinical decision prior to renal biopsy (assumed and modified from Kutikov et al.
Renal Mass Biopsy: Always, Sometimes, or Never? Eur Urol. 2016; 70(3): 403–406.)
ZÁVĚR
Biopsie ledviny je metoda bezpečná a ve vybraných indikacích je důležitou součástí diagnostického procesu nádorů ledvin. Četnost indikací k perkutánní biopsii ledvin roste spolu se zvyšujícím se počtem náhodně zachycených SRM, dále s rozvojem konzervativních a minimálně invazivních postupů při léčbě nízce rizikového RCC a s objevováním nových prostředků cílené léčby u karcinomu metastatického. BTL je metoda spolehlivá v rozlišení benigní a maligní léze a je velmi přesná v posouzení histologického subtypu. Její hlavní limitací je nepřesné hodnocení nukleárního gradingu. Při provádění biopsie by měla být vždy použita koaxiální technika. Biopsie cystických lézí by se neměla provádět. Při indikaci BTL u pacientů s generalizovaným onemocněním je třeba zohlednit i jejich celkový stav, komorbidity, life expectancy a únosnost k případné systémové léčbě.
Prohlášení o podpoře: Zpracování tohoto sdělení bylo podpořeno programem rozvoje vědních oborů Univerzity Karlovy (Projekt Q39) a MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPI, 00669806).
Hlavní stanovisko práce: Retrospektivní hodnoce ‑ ní souboru 200 pacientů, kteří na našem pracovišti podstoupili biopsii nádoru ledviny v letech 2007–2019.
Major statement: A retrospective analysis of 200 patients who underwent renal tumor biopsy at our department in 2007–2019.
Střet zájmů: Žádný.
Došlo: 16. 2. 2020
Přijato: 13. 5. 2020
Kontaktní adresa:
MUDr. Jiří Kolář
Urologická klinika LF UK a FN Plzeň
Edvarda Beneše 13,
305 99 Plzeň
e‑mail: kolarj@fnplzen.cz
Sources
1. Capitanio U, Bensalah K, Bex A, et al. Epidemiology of Renal Cell Carcinoma. Eur Urol 2019; 75(1): 74–84.
2. Capitanio U, Montorsi F. Renal cancer. Lancet 2016; 387(10021): 894–906.
3. Lane BR, Samplaski MK, Herts BR, et al. Renal mass biopsy – a renaissance? J Urol 2008; 179(1): 20–27.
4. Golan S, Lotan P, Tapiero S, et al. Diagnostic Needle Biopsies in Renal Masses: Patient and Physician Perspectives. Eur Urol Focus 2018; 4(5): 749–753.
5. Leppert JT, Hanley J, Wagner TH, et al. Utilization of renal mass biopsy in patients with renal cell carcinoma. Urology 2014; 83(4): 774–779.
6. Ordon M, Landman J. Renal mass biopsy: „just do it“. J Urol 2013; 190(5): 1638–1640.
7. Richard PO, Jewett MA, Bhatt JR, et al. Renal Tumor Biopsy for Small Renal Masses: A Single‑center 13-year Experience. Eur Urol 2015; 68(6): 1007–1013.
8. Ljungberg B, Albiges L, Abu‑Ghanem Y, et al. European Association of Urology Guidelines on Renal Cell Carcinoma: The 2019 Update. Eur Urol 2019; 75(5): 799–810.
9. Patel HD, Druskin SC, Rowe SP, et al. Surgical histopathology for suspected oncocytoma on renal mass biopsy: a systematic review and meta‑analysis. BJU Int 2017; 119(5): 661–666.
10. Haifler M, Kutikov A. Update on Renal Mass Biopsy. Curr Urol Rep 2017; 18(4): 28.
11. Delahunt B, Samaratunga H, Martignoni G, et al. Percutaneous renal tumour biopsy. Histopathology 2014; 65(3): 295–308.
12. Volpe A, Finelli A, Gill IS, et al. Rationale for percutaneous biopsy and histologic characterisation of renal tumours. Eur Urol 2012; 62(3): 491–504.
13. Tomaszewski JJ, Uzzo RG, Smaldone MC. Heterogeneity and renal mass biopsy: a review of its role and reliability. Cancer Biol Med 2014; 11(3): 162–172.
14. Chang DT, Sur H, Lozinskiy M, Wallace DM. Needle tract seeding following percutaneous biopsy of renal cell carcinoma. Korean J Urol 2015; 56(9): 666–669.
15. Soares D, Ahmadi N, Crainic O, Boulas J. Papillary Renal Cell Carcinoma Seeding along a Percutaneous Biopsy Tract. Case Rep Urol 2015; 2015 : 925254.
16. Viswanathan A, Ingimarsson JP, Seigne JD, Schned AR. A single‑centre experience with tumour tract seeding associated with needle manipulation of renal cell carcinomas. Can Urol Assoc J 2015; 9(11–12): E890–E893.
17. Laird A, Couper CH, Glancy S, O´Donnell M, Riddick AC. Renal cell carcinoma needle biopsy: sowing the seed for later complications? BMJ Case Rep 2014; 2014.
18. Macklin PS, Sullivan ME, Tapping CR, et al. Tumour Seeding in the Tract of Percutaneous Renal Tumour Biopsy: A Report on Seven Cases from a UK Tertiary Referral Centre. Eur Urol 2019; 75(5): 861–867.
19. Hora M, Philip S, Macklin, et al. Tumour Seeding in the Tract of Percutaneous Renal Tumour Biopsy: A Report on Seven Cases from a UK Tertiary Referral Centre. Eur Urol 2019; 75 : 861–867. Eur Urol 2019; 76(4): e96.
20. Procházková K, Mírka H, Trávníček I, et al. Cystic Appearance on Imaging Methods (Bosniak III‑IV) in Histologically Confirmed Papillary Renal Cell Carcinoma is Mainly Characteristic of Papillary Renal Cell Carcinoma Type 1 and Might Predict a Relatively Indolent Behavior of Papillary Renal Cell Carcinoma. Urol Int 2018; 101(4): 409–416.
21. Patel HD, Johnson MH, Pierorazio PM, et al. Diagnostic Accuracy and Risks of Biopsy in the Diagnosis of a Renal Mass Suspicious for Localized Renal Cell Carcinoma: Systematic Review of the Literature. J Urol 2016; 195(5): 1340–1347.
22. Marconi L, Dabestani S, Lam TB, et al. Systematic Review and Meta‑analysis of Diagnostic Accuracy of Percutaneous Renal Tumour Biopsy. Eur Urol 2016; 69(4): 660–673.
23. Kockelbergh R, Griffiths L. Renal Tumour Biopsy – A New Standard of Care? Eur Urol 2016; 69(4): 674–675.
24. Jeon HG, Seo SI, et al. Percutaneous Kidney Biopsy for a Small Renal Mass: A Critical Appraisal of Re ‑ sults. J Urol 2016; 195(3): 568–573.
25. Jason Abel E. Percutaneous biopsy facilitates modern treatment of renal masses. Abdom Radiol (NY). 2016; 41(4): 617–619.
26. Ball MW, Bezerra SM, Gorin MA, et al. Grade heterogeneity in small renal masses: potential implications for renal mass biopsy. J Urol 2015; 193(1): 36–40.
27. Kutikov A, Smaldone MC, Uzzo RG, et al. Renal Mass Biopsy: Always, Sometimes, or Never? Eur Urol 2016; 70(3): 403–406.
28. Rioux‑Leclercq N, Karakiewicz PI, Trinh QD, et al. Prognostic ability of simplified nuclear grading of renal cell carcinoma. Cancer 2007; 109(5): 868–874.
29. Richard PO, Jewett MA, Tanguay S, et al. Safety, reliability and accuracy of small renal tumour biopsies: results from a multi‑institution registry. BJU Int 2017; 119(4): 543–549.
30. Millet I, Curros F, Serre I, Taourel P, Thuret R. Can renal biopsy accurately predict histological subtype and Fuhrman grade of renal cell carcinoma? J Urol 2012; 188(5): 1690–1694.
31. Kouřilová K, Fabišovský M, Dvořáčková J, et al. Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava. Ces Urol 2013; 17(3): 199–203.
32. Leveridge MJ, Finelli A, Kachura JR, et al. Outcomes of small renal mass needle core biopsy, nondia ‑ gnostic percutaneous biopsy, and the role of repeat biopsy. Eur Urol 2011; 60(3): 578–584.
33. Volpe A, Mattar K, Finelli A, et al. Contemporary results of percutaneous biopsy of 100 small renal masses: a single center experience. J Urol 2008; 180(6): 2333–2337.
34. Veltri A, Garetto I, Tosetti I, et al. Diagnostic accuracy and clinical impact of imaging‑guided needle biopsy of renal masses. Retrospective analysis on 150 cases. Eur Radiol 2011; 21(2): 393–401.
35. Abel EJ, Heckman JE, Hinshaw L, et al. Multi‑Quadrant Biopsy Technique Improves Diagnostic Ability in Large Heterogeneous Renal Masses. J Urol 2015; 194(4): 886–891.
36. Méjean A, Ravaud A, Thezenas S, et al. Sunitinib Alone or after Nephrectomy in Metastatic Renal‑Cell Carcinoma. N Engl J Med 2018; 379(5): 417–427.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology
2020 Issue 2
Most read in this issue
- Renal tumor biopsy – indications, technique, results
- Examination of circulating tumor cells in renal carcinoma
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
- Natural healing process after partial glans excision while using novel haemostatic „VerisetTM patch“: description of the technique and initial surgeon’s perspective
