-
Medical journals
- Career
Prevence tromboembolických komplikací v urologii
Authors: Kateřina Ryšánková 1; MUDr. Jaromír Gumulec 2; Martin Porzer 3; Jan Krhut 1
Authors‘ workplace: Urologická klinika Fakultní nemocnice Ostrava a katedra chirurgických oborů LF Ostravské univerzity, Ostrava 1; Klinika hematoonkologie Fakultní nemocnice Ostrava a katedra interních oborů LF Ostravské univerzity, Ostrava 2; Kardiovaskulární oddělení Fakultní nemocnice Ostrava 3
Published in: Ces Urol 2019; 23(3): 186-193
Category: Review article
Overview
Prevence tromboembolických komplikací v urologii. V přehledovém článku uvádíme aktuální pohled na prevenci tromboembolických komplikací v urologické operativě. Dále se zabýváme pravidly prevence této komplikace u pacientů užívajících léky ovlivňující krevní srážlivost jak antiagregační, tak antikoagulační terapii. A v poslední části zmiňujeme řešení krvácení z močových cest u pacientů užívajících léky ovlivňující krevní srážlivost, které je běžnou urologickou praxí.
Klíčová slova:
Antiagregancia – antikoagulancia – hematurie – prevence – tromboembolie.
ÚVOD
Termín tromboembolické komplikace zahrnuje hlubokou žilní trombózu (HŽT) a plicní embolii (PE), vznikající v souvislosti s operačním výkonem. Většina tromboembolických epizod je subklinická. Pokud ale není hluboká žilní trombóza léčena, přechází v plicní embolii až v 50 % případů a na plicní embolii samotnou umírá až 25 % pacientů. U dalších postižených se rozvíjí plicní hypertenze a u pacientů s hlubokou žilní trombózou může vznikat post‑trombotický syndrom s otoky a ulceracemi. Výskyt němých plicních embolií u asymptomatických nemocných s HŽT na plicním skenu prokážeme až ve 40–50 % (1). Například u radikální cystektomie se uvádí incidence subklinické tromboembolické nemoci (TEN) až ve 24 % případů (2).
Při vzniku tromboembolických komplikací se uplatňuje Virchowova triáda zahrnující krevní stázu, hyperkoagulaci a poranění endotelu. Navíc se velmi často jedná o operaci u onkologického pacienta, což samo o sobě zvyšuje riziko rozvoje tromboembolické nemoci 4–7× (3). Riziko tromboembolických komplikací se liší i dle typu nádorového onemocnění a urologické malignity, nádory ledvin či měchýře, patří k nejrizikovějším (4). Toto jsou faktory, které jednoznačně mluví pro užívání tromboprofylaxe, které v této době již nikdo nezpochybňuje. Nadále ale zůstávají rozpory jak, u koho a jak dlouho podávat profylaxi. Rozpory souvisejí především s odlišnými zkušenostmi jednotlivých pracovišť a rozmanitými doporučeními napříč světem.
Další velkou kapitolou jsou pacienti užívající antiagregační či antikoagulační terapii, kteří pro operatéra představují nejistotu stran rizika možného krvácení. Nic to ale nemění na faktu, že pacientů vyžadujících tyto léky je velké množství a bude jich v budoucnu jen přibývat a my se budeme muset naučit s těmito pacienty zacházet z hlediska přípravy k operaci. Znalost mechanizmu účinku jednotlivých preparátů nám umožní bezpečně přerušit léčbu a vyhnout se tak riziku krvácení.
Poslední část přehledového článku je věnována problematice krvácení právě u pacientů na antiagregační či antikoagulační terapii, kteří jsou častými návštěvníky urologických pracovišť. Řešení těchto komplikací je obvykle závislé na interdisciplinární spolupráci s hematologem či kardiologem.
PREVENCE TROMBOEMBOLICKÝCH KOMPLIKACÍ
Aplikace nízkomolekulárního heparinu (LMWH) perioperačně snižuje riziko vzniku tromboembolické nemoci o 50 %. Také ale o 50 % zvyšuje riziko významného krvácení (5, 6). Za významné krvácení je považováno takové, které vyžaduje reoperaci či jinou intervenci, nikoli však krevní převody (7). Tikkinen a spolupracovníci udávají, že 50 % krvácení se objeví do druhého dne po operaci a 90 % pacientů krvácí během prvních čtyř pooperačních dnů. Naopak riziko tromboembolických komplikací trvá nejméně čtyři týdny (8).
Je proto nutné zhodnotit jednak riziko tromboembolie u jednotlivých operačních výkonů, dále riziko TEN u pacienta na základě jeho komorbidit a na druhé straně riziko závažného krvácení u jednotlivých výkonů. Například mezi nejrizikovější výkony z hlediska tromboembolických komplikací patří radikální cystektomie a radikální prostatektomie s extenzivní lymfadenektomií. Zde je incidence až 15 % (2). Jak Americká, tak Evropská urologická společnost vycházejí z určitého typu rozdělení pacientů do rizikových skupin. Evropská urologická společnost užívá velmi jednoduché rozdělení do tří rizikových skupin (tabulka 1) (8). Někteří autoři ale považují toto rozdělení za nedostatečné a zjednodušující a upozorňují na nutnost vzít v úvahu další rizikové faktory. Například ACCP (American College of Chest Physicians) užívá k rozdělení pacientů a zhodnocení rizika tzv. Capriniho skóre. To zahrnuje mezi rizikové faktory i délku operace, přítomnost varixů, recentní infarkt myokardu či kardiální selhání, infekci či prodělanou cévní mozkovou příhodu (CMP), imobilitu, předchozí operace, zánětlivé onemocnění střev a další (4). Většina urologických pacientů tak spadá do skupiny s vysokým rizikem.
Table 1. Rizikové skupiny dle EAU
Tab. 1. EAU risk groups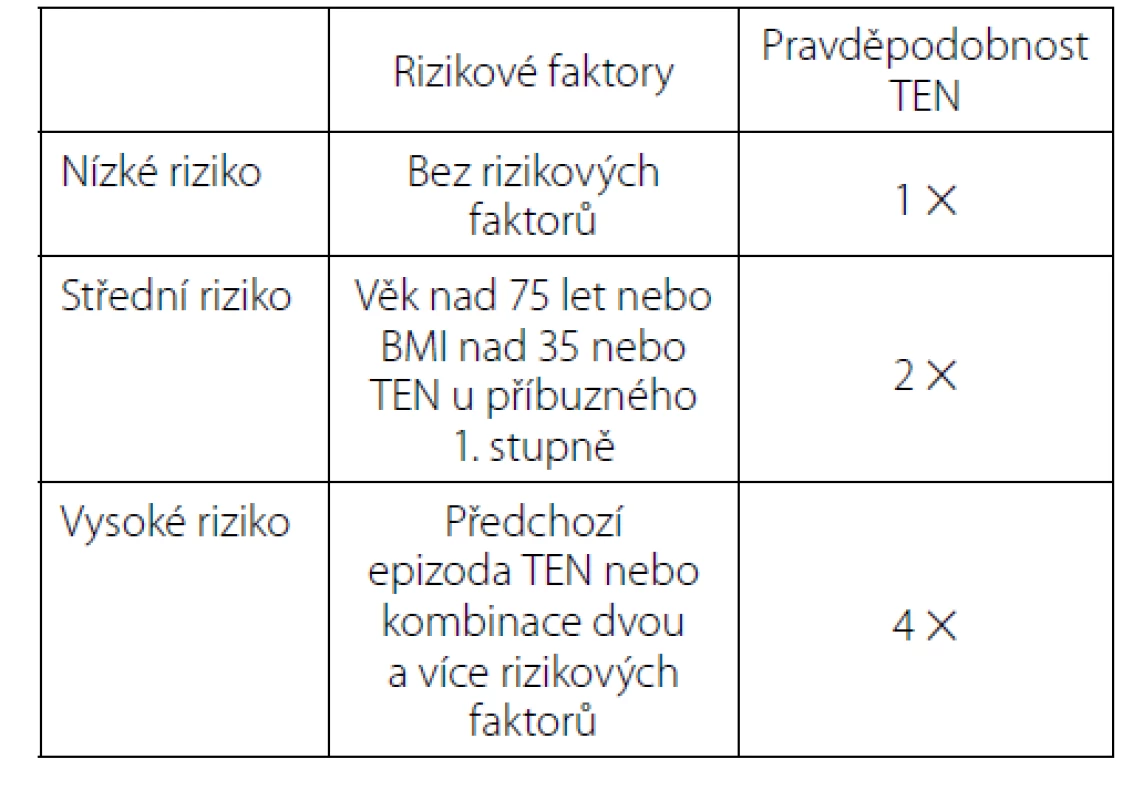
Opačná strana mince, tedy riziko krvácení, vychází obvykle z typu výkonu. Všeobecně jsou endoskopické výkony zatíženy vyšším rizikem krvácení než výkony otevřené, kde lze krvácení daleko lépe kontrolovat.
JAK A KDY PODÁVAT TROMBOPROFYLAXI?
Profylaxi tromboembolické nemoci rozdělujeme na mechanickou a farmakologickou. K mechanické patří časná mobilizace jako bod číslo jedna a kompresní punčochy, které snižují riziko hluboké žilní trombózy o 31–65 % (2). Dle Gumulce a kol. kompresní punčochy významně zvyšují účinnost farmakologických režimů profylaxe (9). Další mechanickou metodou je, některými pracovišti užívaná, pneumatická komprese. Jako farmakologická profylaxe jsou v současné praxi nejčastěji podávány nízkomolekulární hepariny. U těchto preparátů je ale nutno věnovat pozornost renálním funkcím pacienta, neboť se většina vylučuje ledvinami. Je potřeba na toto myslet především po operaci, kdy může dojít ke zhoršení renálních parametrů. Doporučuje se proto kontrolovat úroveň inhibice faktoru Xa, odběr se provádí mezi 3.–5. hodinou po aplikaci a cílová hodnota je 0,2–0,4 (9). Další možnosti zahrnují nefrakcionovaný heparin, Fondaparin event. perorální antikoagulancia jako dabigatran nebo rivaroxaban, užívaná spíše v zahraničí. Nevýhoda moderních preparátů je v tom, že neexistuje specifické antidotum rušící jejich účinek v případě významného krvácení. Užívané preparáty jsou uvedené v tabulce 2, volně převzato od Matoušková a kol. (1). Evropská urologická společnost doporučuje zahájit podávání tromboprofylaxe 24 hodin po výkonu, což snižuje riziko krvácení bez obav ze zvýšení rizika TEN. Sagalovich ale upozorňuje, že doporučení vychází ze zkušeností z ortopedických operací. Jednalo se o porovnání apixabanu podávaného perorálně s LMWH a neexistuje porovnání stejného léku před a pooperačně (4). Další důležitou otázkou je, jak dlouho v profylaxi pokračovat. Průměrně se epizoda TEN objevuje týden po výkonu, tedy obvykle již po propuštění (10). Drtivá většina pracovišť končí s podáváním v okamžiku propuštění pacienta do domácí péče. Nicméně dle studií je vhodné aplikovat LMWH až čtyři týdny, především u velkých výkonů, jakými jsou radikální cystektomie a radikální prostatektomie s lymfadenektomií (4, 11). Tabulka 3 shrnuje doporučení Evropské urologické společnosti k aplikaci tromboprofylaxe na základě typu výkonu a rizikové skupiny pacienta. Typ výkonu je sám o sobě nezávislým rizikovým faktorem pro rozvoj TEN. Například otevřená nefrektomie má 3,4× vyšší riziko než nefrektomie laparoskopická (12). Také rozšíření výkonu o lymfadenektomii zvyšuje riziko TEN 6–8 × (13). Při volbě způsobu profylaxe TEN je potřeba u každého pacienta postupovat individuálně podle typu plánovaného operačního výkonu a míry rizika (tabulka 3).
Table 2. Metody profylaxe
Tab. 2. Methods of prophylaxis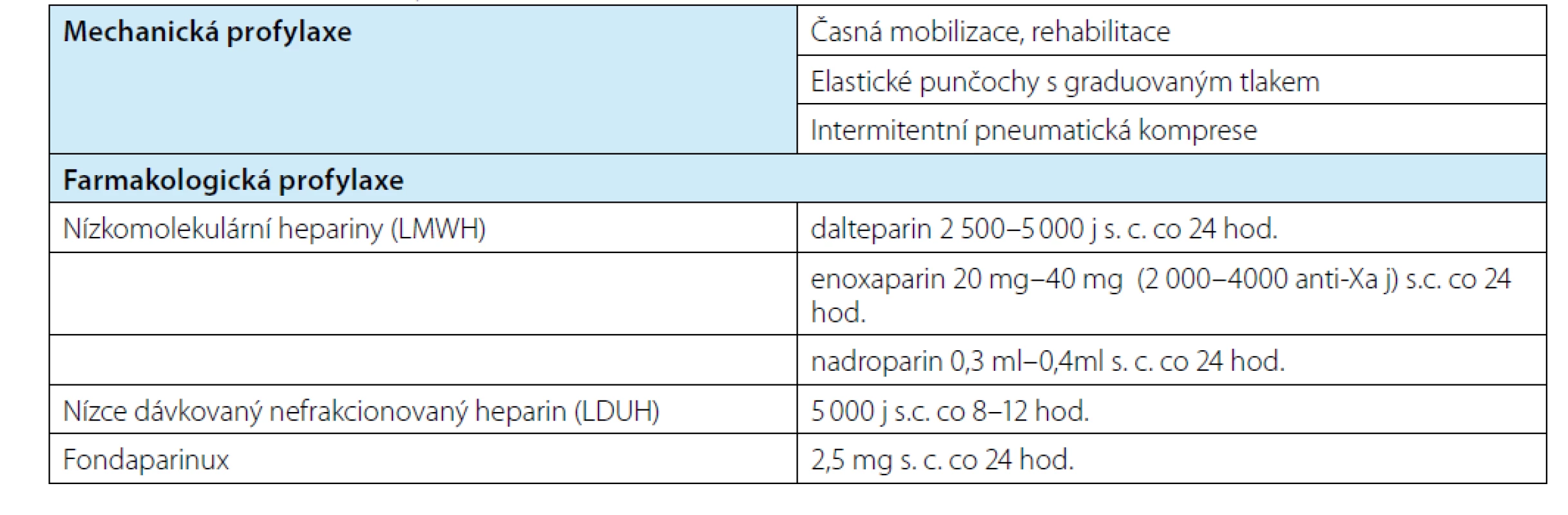
Table 3. Přehled doporučené tromboprofylaxe dle EAU (8) (TURP – transuretrální resekce prostaty, TURT – transuretrální resekce tumoru močového měchýře, PEK – perkutánní extrakce konkrementu, RACE – radikální cystektomie, RAPE – radikální prostatektomie, LAE – lymfadenektomie)
Tab. 3. Recommended thromboprophylaxis by EAU (8) (TURP – transurethral resection of prostate, TURT - transurethral resection of bladder tumor, PEK – percutaneous nephrolithotomy, RACE – radical cystectomy, RAPE – radical prostatectomy, LAE – lymphadenectomy)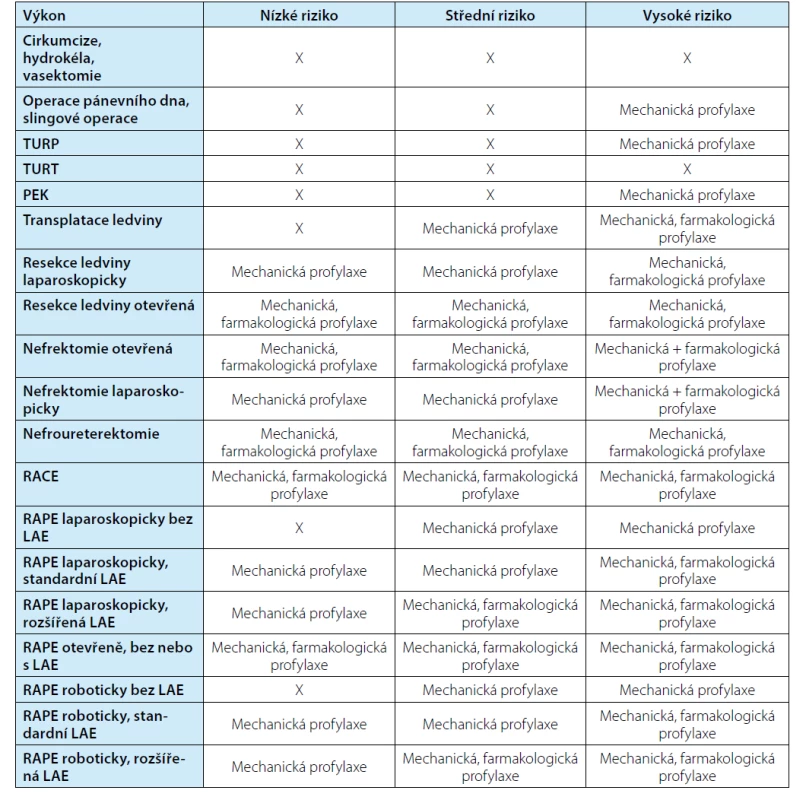
PACIENTI UŽÍVAJÍCÍ LÉKY OVLIVŇUJÍCÍ KREVNÍ SRÁŽLIVOST
Další velkou kapitolou je prevence TEN u pacientů užívajících antiagregační či antikoagulační terapii již před operací.
Antikoagulační terapii obvykle vyžadují pacienti s fibrilací síní, náhradou srdeční chlopně či předchozí epizodou TEN. Fibrilace síní je nejčastější supraventrikulární tachykardie a její prevalence se pohybuje mezi 1,5–2 % (14). Její incidence stoupá s věkem, a proto se počty pacientů na antikoagulační terapii budou se stárnutím populace jen zvyšovat. Až čtyři procenta pacientů přicházejících k transuretrální resekci prostaty jsou na antikoagulační terapii (15). Nejznámějším preparátem je samozřejmě warfarin, který se jako antikoagulans užívá již od roku 1954 (16). Mezi jeho hlavní nevýhody ale patří pomalý nástup účinku, dlouhý poločas, různý farmakologický efekt a hodně lékových a potravinových interakcí (17). Na druhou stranu lze ale jeho účinek celkem jednoduše zrušit podáním vitaminu K. Je nutno pamatovat, že po perorálním podání vitaminu K může trvat až 24 hodin než dojde k normalizaci INR (16).
Výhodou moderních preparátů, tzv. nových antikoagulancií (NOAC), je rychlý nástup účinku, není třeba kontrolovat jejich hladinu, ale jsou finančně náročné a neexistuje účinné antidotum. V zahraničí se ale uplatňují jako prevence TEN u některých typů ortopedických operací (17). Jedná se o léky s krátkým poločasem, proto je doporučeno vysadit je 24 hodin před výkonem. Pokud se ale jedná o pacienta s renální insuficiencí či výkon s vysokým rizikem krvácení, pak mají být vysazena 48 hodin před operací. Zahraniční autoři uvádějí k posuzování rizika, zda NOAC vysadit či ne tzv. HAS‑BLED skóre. Má‑li pacient více než tři rizikové faktory, je pravděpodobnost krvácení vysoká a antikoagulační terapie by měla být vysazena (tabulka 4) (17).
Table 4. HES-BLED skóre
Tab. 4. HAS-BLED score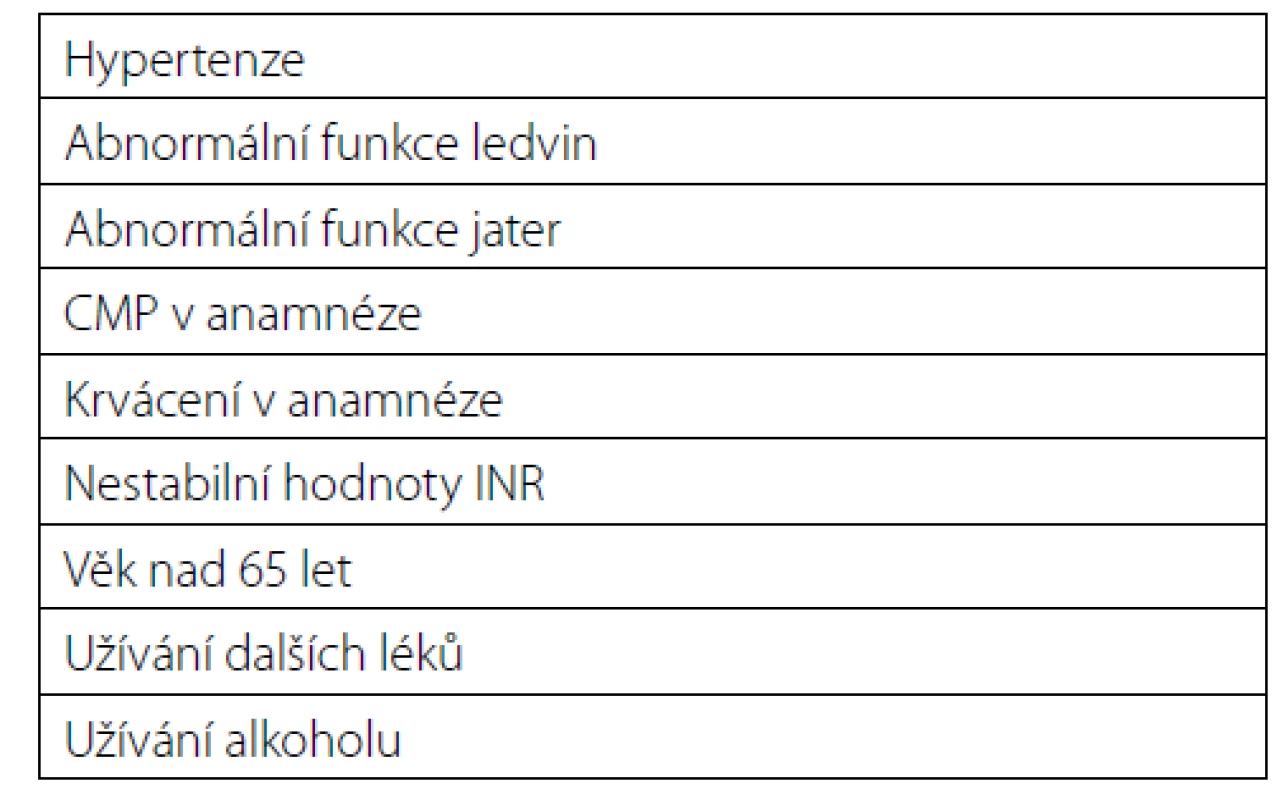
Antiagregační terapie se naopak užívá jako prevence formace trombu v arteriích, který vzniká spíše působením destiček nikoli fibrinu. Vysazení takové léčby znamená samozřejmě pro pacienta riziko kardiovaskulárních komplikací. Nejvyšší riziko je bezprostředně po vysazení a souvisí s rebound fenoménem aktivace destiček (16). K úplné náhradě funkce destiček dochází po deseti dnech, přesto je ve většině prací doporučeno vysazení těchto preparátů v různém rozmezí, obvykle 5–10 dnů. Většina urologických výkonů je natolik rizikových z hlediska krvácení, že vyžadují vysazení jak antiagregační, tak antikoagulační terapie. Na druhou stranu existuje řada obav, které nejsou jednoznačně podloženy zkušeností s velkými soubory, ale pouze zvyklostmi konkrétního pracoviště. EAU ve svém doporučení například nepovažuje antiagregační terapii za naprostou kontraindikaci k biopsii prostaty (18). V kontrastu k tomu ale Sahin dokládá, že užívání antiagregační terapie zvyšuje riziko makroskopické hematurie u pacientů absolvujících perkutánní extrakci konkrementu 5,8 ×, i když je tato terapie vysazena (19). Ideální situací by bylo, pokud protidestičkové léky nevysadíme vůbec, minimálně z kardiologického hlediska. Pokud už vysadit musíme, měli bychom znát riziko pro pacienta. Nejvyšší riziko mají pacienti s tzv. bare metal stenty a drug eluting stenty zavedenými v posledních třech měsících a dále pacienti s nedávno prodělanou CMP či tranzitorní ischemickou atakou (20). U takového pacienta je nutno zvážit odložení plánované operace. Pokud to situace neumožňuje, pak lék vysadíme s náhradou v podobě LMWH. Tabulka 5 nabízí přehled nejčastěji užívané antiagregační a antikoagulační terapie a nutnou dobu vysazení daného preparátu. Další otázkou ale je, kdy léky ovlivňující hemostázu opět vrátit do medikace pacienta. V případě NOAC se doporučuje znovuzahájit podávání 24–48 hodin po výkonu, opět dle renálních parametrů (21). Jiní autoři uvádí, že například rivaroxaban je možné vrátit do medikace již 4–6 hodin po výkonu (14). Evropská urologická společnost uvádí jako ideální dobu čtyři dny, kdy klesne riziko krvácení téměř k nule (8).
Table 5. Nejčastěji užívané antiagregační a antikoagulační léky
Tab. 5. The most commonly used antiplatelet medication and anticoagulants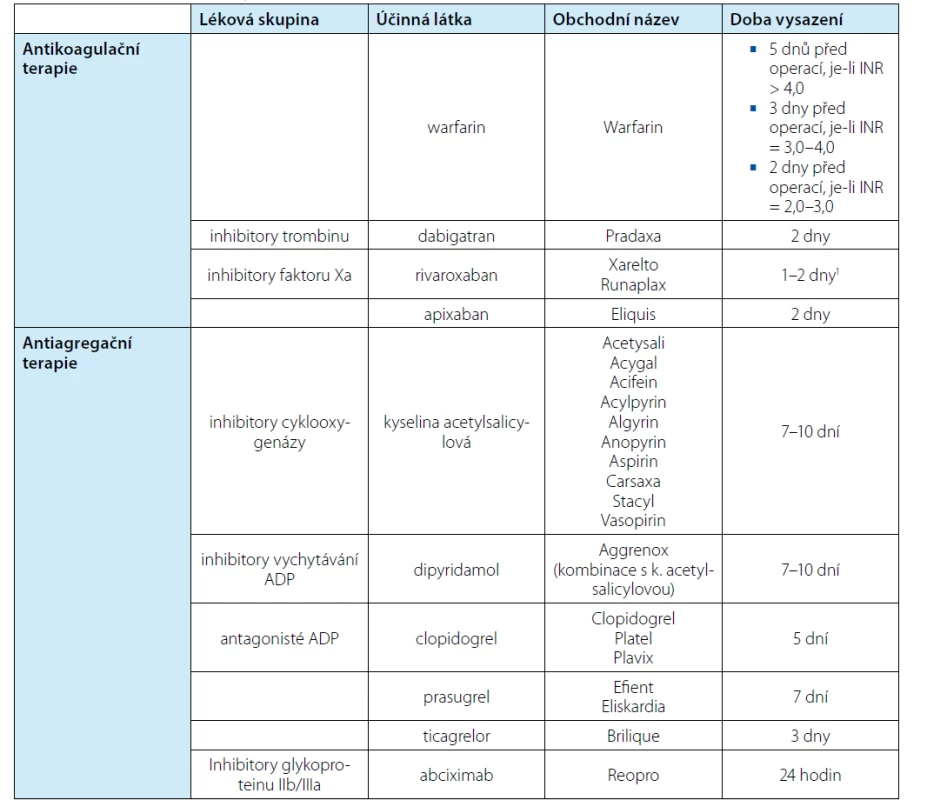
1závisí na hladině kreatininu a míře rizika krvácení, u pacientů s vysokým rizikem vysadit dříve „Bridging“ neboli náhrada antikoagulační či antiagregační terapie pomocí LMWH je další kapitolou, kterou bychom chtěli zmínit. Jak, čím a jestli vůbec nahrazovat tyto preparáty se donedávna vlastně vůbec neřešilo. Důkazy však dokládají, že například bridging u antikoagulační terapie zvyšuje riziko krvácení, ale nesnižuje riziko trombózy (22). EAU uvádí několik doporučení stran „bridgingu“ (8):
- u pacientů na antiagregační terapii a těch užívajících nová antikoagulancia má být lék vysazen bez náhrady u všech, s výjimkou těch vysoce rizikových (pacienti s tzv. bare metal stenty a drug eluting stenty zavedenými v posledních třech měsících a dále pacienti s nedávno prodělanou CMP či tranzitorní ischemickou atakou);
- doporučuje dokonce nenahrazovat ani warfarin nízkomolekulárními hepariny, jen u pacientů s vysokým rizikem ischemické příhody.
KRVÁCIVÉ KOMPLIKACE ANTIAGREGAČNÍ A ANTIKOAGULAČNÍ TERAPIE V UROLOGII
Řada pacientů užívajících terapii ovlivňující krevní srážlivost přichází do urologické ambulance s hematurií různého stupně. Další skupinou jsou pacienti indikováni k nějakému typu neodkladného výkonu, jako je například zavedení nefrostomie u obstrukční pyelonefritidy či epicystostomie u retence moči, kteří ale zároveň užívají antikoagulační či antiagregační terapii.
Rozhodnutí, jak postupovat, je v ideálním případě otázkou mezioborové spolupráce s hematologem v případě antikoagulační terapie a kardiologem či neurologem v případě antiagregační terapie (23). Je potřeba znát odpověď na řadu otázek. Mezi základní samozřejmě patří, jaký typ léku pacient užívá. U některých preparátů jsme schopni určit, zda mají účinnou hladinu či nikoli na základě laboratorních metod. Warfarin lze snadno kontrolovat pomocí INR, u nízkomolekulárních heparinů se měří inhibiční aktivita faktoru Xa a dabigatran prodlužuje trombinový čas. U těchto jsme tedy schopni určit, zda jejich účinek již odezněl či nikoli. U většiny ostatních ale žádné měřitelné hodnoty nemáme. Další je otázka, z jakého důvodu pacient lék užívá, jaká je doba, která uplynula od onemocnění či zákroku, který léčbu vyžaduje, a tak dále. Všechno toto nám pomáhá při rozhodování, zda lék vysadit a či ho něčím nahradit. Tyto otázky samozřejmě padají v okamžiku, kdy se jedná o život ohrožující krvácení.
Postup u pacienta s hematurií či uretroragií tedy obvykle zahrnuje vysazení léku ovlivňujícího krevní srážlivost, dále sympatomatickou léčbu, jako je zavedení močového katétru či mechanická komprese, náhrada cirkulujícího objemu a aplikace kyseliny tranexamové jako hemostyptika. Výhoda některých preparátů je, že existuje účinné antidotum. U warfarinu chronicky známý vitamin K – Kanavit, u nízkomolekulárních heparinů protamin hydrochlorid a např. u dabigatranu idarucizumab (Praxbind). Řada dalších antikoagulancií ale žádnou specifickou léčbu nemá. Tak třeba u NOAC není účinná aplikace mražené plazmy a je nutno aplikovat koncentráty koagulačních faktorů, jako jsou Novoseven či Prothromplex (17, 24). Pokud pacientovi podáváme trombocyty, je nutno myslet na to, že přetrvávající účinek antiagregační terapie může jejich efekt zrušit. Je proto nutno mít na paměti poločas užívaného léku (16).
Antikoagulační terapii vracíme do medikace ihned po odeznění krvácení.
ZÁVĚR
Pohled na prevenci tromboembolie zůstává nadále nejednotný a i guidelines Evropské urologické společnosti uvádějí, že jejich doporučení je většinou založeno jen na slabých důkazech, protože neexistují jednotné postupy, které by umožňovaly shromáždit opravdu velké soubory ke zhodnocení.
Přesto existuje několik bodů, kterých je dobré se držet. Přistupovat k pacientům jednotlivě, zhodnotit jejich riziko z hlediska tromboembolických komplikací a zhodnotit riziko krvácení dle plánovaného výkonu. A podle toho podávat profylaxi.
U pacientů užívajících antiagregační či antikoagulační terapii je při nejistotě velmi užitečné konzultovat kardiologa či hematologa. Je třeba si uvědomit, že těchto pacientů bude přibývat a péče o ně bude „denním chlebem“ urologa.
Došlo: 19. 2. 2019
Přijato: 31. 3. 2019
Kontaktní adresa
MUDr. Kateřina Ryšánková
Urologická klinika FN Ostrava
17. listopadu 1790/5, 708 52 Ostrava – Poruba
e‑mail: rysankovak@email.cz
Střet zájmů: Žádný.
Prohlášení o podpoře: Nezávislý článek.
Hlavní stanovisko: Článek přehledně shrnuje aktuální pohled na prevenci tromboembolických komplikací, včetně pacientů užívajících léky ovlivňující krevní srážlivost a v poslední části nabízí návod k řešení krvácení u pacientů užívajících tuto medikaci.
Sources
1. Matoušková M, Hanuš M. Tromboprofylaxe urologických a onkourologických výkonů. Urol. Praxi 2011; 12(4): 203–207. 2. Saluja M, Gilling P. Venous thromboembolism prophylaxis in urology: a review. Int J Urol. 2017; 24 : 589–593 3. Jordan BJ, Matulewicz RS, Trihn B, Kundu S. Venous thromboembolism after nephrectomy: incidence, timing and associated risk factors from a national multi‑institutional database. World J Urol. 2017; 35 : 1713–1719.4. Sagalovich D, Say R, Kaouk J, Mehrazin R. The role of extended venous thromboembolism prophylaxis following urologic pelvic surgery. Urol Oncol. 2018; 36(3): 83–87. 5. Tikkinen KAO, Craigie S, Agarwal A, et al. Procedure‑specific risks of thrombosis and bleeding in urological cancer surgery: systematic review and meta‑analysis. Eur Urol. 2018; 73 : 242–251. 6. Tikkinen KAO, Craigie S, Agarwal A, et al. Procedure‑specific risks of thrombosis and bleeding in urological non‑cancer surgery: systematic review and meta‑analysis. Eur Urol. 2018; 73 : 236–241. 7. Violette PD, Cartwright R, Briel M, Tikkinen KAO, Guyatt GH. Guideline of guidelines: thromboprophylaxis for urological surgery. BJU Int. 2016; 118 : 351–358. 8. Tikkinen KAO, Cartwright R, Gould MK, et al. EAU guidelines on thromboprophylaxis in urological surgery. EAU Guidelines. Edn. presented at the EAU Annual Congress Copenhagen 2018. ISBN 978-94-92671-01-1. 9. Gumulec J, Zänger M, Procházka V, Urbanec R, Klement P. Prevence žilního tromboembolizmu v chirurgii, laparoskopické chirurgii, urologii. Vnitř Lék. 2009; 55(3): 196–203. 10. Jordan BJ, Matulewicz RS, Trihn B, Kundu S. Venous thromboembolism after nephrectomy: incidence, timing and associated risk factors from a national multi‑institutional database. World J Urol. 2017; 35 : 1713–1719. 11. Klaassen Z, Arora K, Goldberg H, et al. Extended venous thromboembolism prophylaxis after radical cystectomy: a call for adherence to current guidelines. J Urol. 2017; 197(2): 302–307. 12. McAlpine K, Breau RH, Mallick R, et al. Current guidelines do not sufficiently discriminate venous thromboembolism risk in urology. Urol Oncol. 2017; 35 : 457. e1-457.e8. 13. Chen EC, Papa N, Lawrentschuk N, Bolton D, Sengupta S. Incidence and risk factors of venous thromboembolism after pelvic uro‑oncologic surgery – a single center experience. BJU Int. 2016; 117 (Suppl 4): 50–53. 14. Heinc P, Táborský M, Kováčik F, Lazárová M, Přeček J. Perioperační riziko v éře nových antikoagulancií. Urol. Praxi 2013; 14(2): 77–80. 15. Musil D, Študent V. Prevence a léčba tromboembolické nemoci v urologii. Urol. Praxi. 2003 : 1: 14–18. 16. Ellis G, Camm JA, Datta SN. Novel anticoagulants and antiplatelet agents; a guide for the urologist. BJU Int. 2015; 116 : 687–696. 17. Browne E, Haroon U, Davis NF, Forde JC. Perioperative management of new oral anticoagulants in urological surgery. Curr Urol. 2017; 11 : 169–174. 18. Mottet N, Bergh RCN, Briers E, et al. EAU guidelines on prostate cancer. EAU Guidelines. Edn. presented at the EAU Annual Congress Copenhagen 2018. ISBN 978-94-92671-01-1. 19. Sahin C, Can U, Eryildirim B, Sarica K. Transient cessation of antiplatelet medication before percutaneous stone surgery: does it have any safety concern on bleeding related problems? Urolithiasis. 2017; 45 : 371–378. 20. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio‑Thoracic Surgery (EACTS). Eur Heart J. 2018; 39(3): 213–260. 21. Bashar A, Kautzner J. Perioperační péče o pacienty užívající antikoagulancia. Interv Akut Kardiol. 2017; 16(1): 18–22. 22. Devereaux, PJ, Mrkobrada M, Sessler DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med. 2014; 370 : 1494–1503. 23. Gumulec J. Hematologie na JIP/ARO, management antikoagulační prevence v krizových situacích. Transfuze a hematologie dnes. 2018 : 124–132. ISSN 1213–5763. 24. Levy JH, Ageno W, Chan NC, et al. When and how to use antidotes for the reversal of direct oral anticoagulants: guidance from the SSC of the ISTH. J Thromb Haemost. 2016; 14 : 623–627.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2019 Issue 3-
All articles in this issue
- Editorial
- Prevence tromboembolických komplikací v urologii
- PSA a jeho izoformy jako moderní markery karcinomu prostaty
- Urologické komplikácie po transplantácii obličky
- Laparoskopická resekce ledviny – komplexní hodnocení perioperačních výsledků jednoho centra
- Wunderlichův syndrom – soubor pacientů s netraumatickým spontánním krvácením do retroperitonea
- Uroteliální karcinom ledvinné pánvičky vpravo a distálního močovodu vlevo
- Hranice možností záchovného výkonu u tumorů ledviny – desetinásobná resekce solitární ledviny
- Bilaterální tumor ledvin jako náhodný nález při ultrazvukovém vyšetření u 82letého pacienta s močovou retencí
- Centrálně lokalizovaná cystická renální léze nejasné biologické povahy
- 3rd Ostrava Urological-Neurological Symposium
- Report on the 7th Annual Video Seminar „Tips and tricks in urological surgery”
- Report from the 26th annual meeting of Slovak urological society
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PSA a jeho izoformy jako moderní markery karcinomu prostaty
- Urologické komplikácie po transplantácii obličky
- Wunderlichův syndrom – soubor pacientů s netraumatickým spontánním krvácením do retroperitonea
- Uroteliální karcinom ledvinné pánvičky vpravo a distálního močovodu vlevo
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

