-
Medical journals
- Career
18-F CHOLIN PET CT V PRIMODIAGNOSTICE KARCINOMU PROSTATY
: Šárka Kudláčková 1; Milan Král 1; Pavel Koranda 2; Vladimír Študent 1
: Urologická klinika Fakultní nemocnice Olomouc 1; Klinika nukleární medicíny Fakultní nemocnice Olomouc 2
: Ces Urol 2016; 20(1): 57-64
: Original Articles
Cíl:
Zjistit přínos 18F-fluorocholinového PET/ CT (18F-FCH PET/CT) pro cílenou biopsii prostaty u pacientů s opakovaně negativními biopsiemi a trvajícím podezřením na přítomnost karcinomu prostaty.Soubor pacientů a metoda:
Od ledna 2013 do května 2015 jsme provedli 18-F-FCH PET/CT cholinové PET CT vyšetření u 30 pacientů. Indikačním kritériem bylo PSA nad 10 ng/ml a prodělání více než tři biopsií prostaty, včetně biopsie saturační. Pokud to bylo možné, pak pacienti předem prodělali šestitýdenní kůru ATB terapie Doxycyklinem 100 mg 2x denně k eliminaci zánětu, a tím možným falešně pozitivním nálezům na 18F-FCH PET/CT. Poté bylo provedeno PET/CT vyšetření a následně s odstupem byla provedena cílená biopsie ložisek popsaných na 18F-FCH PET/CT. Cílená biopsie byla provedena pod sonografickou kontrolou transrektálně za pomoci kognitivní fúze PET/CT obrazu s real - time sonografickým záznamem. Byly odebírány jen vzorky z ložisek popsaných na PET/CT.Výsledky:
Od ledna 2013 do května 2015 absolvovalo 18F-FCH PET/CT 30 pacientů. Průměrný věk pacientů byl 66 let v rozmezí 57–75 let. U 14 z nich jsme potvrdili karcinom prostaty, což činí 46% záchyt ve skupině rebiopsií. Všichni tito pacienti měli Gleasonovo skóre vyšší než sedm a PSA vyšší než 20 ng/ml.Závěr:
V našem souboru jsme prokázali přínos 18F-FCH PET/CT u pacientů s opakovaně negativními biopsiemi a pokračující elevací PSA, u kterých nebyl karcinom prostaty standardním způsobem detekován. Ložisko vyznačené pomocí 18F-cholinufluorocholinu umožnilo cílenou biopsii pod sonografickou kontrolou. V současnosti není jednoznačné doporučení, jak postupovat u pacientů, u kterých máme opakovaně negativní biopsie prostaty a trvá podezření na přítomnost karcinomu. Využití 18F-FCH PET/CT se jeví jako jedna z možností.KLÍČOVÁ SLOVA:
Karcinom prostaty, rebiopsie, 18F-fluorocholin PET CT.ÚVOD
Karcinom prostaty je druhou nejčastější malignitou u mužů. V České republice je diagnostikováno cca 4 500 nových případů ročně a jeho incidence dosahuje 82 případů na 100 000 mužů. Z nich téměř 1 600 na toto onemocnění zemře. Padesátiletý český muž má 30% riziko mikroskopického nálezu karcinomu prostaty a 3% riziko úmrtí (1). Incidence karcinomu prostaty závisí na řadě faktorů, mezi nimiž jsou nejvýznamnější rasa, věk a rodinná anamnéza. Diagnostika karcinomu prostaty ve srovnání s jinými nádorovými onemocněními je výjimečná v tom, že karcinom prostaty většinou není běžnými zobrazovacími metodami znázornitelný. Biopsie prostaty je tedy prováděna systematicky pomocí multiplikované biopsie cílené do periferní zóny prostaty, kde se karcinom vyskytuje v 75 % (2). V současnosti je standardem v diagnostice karcinomu prostaty biopsie pomocí transrektální sonografie s vysokofrekvenční sondou s biplanárním zobrazením a punkčním kanálem pro odběr vzorků. Diagnóza karcinomu prostaty je v současnosti vždy histologická – tedy ke stanovení diagnózy je klíčová zejména správně indikovaná a provedená biopsie prostaty. K biopsii prostaty jsou indikováni pacienti s abnormálním nálezem per rectum či elevací PSA. Při indikační hodnotě PSA mezi 2,5–4 ng /ml byla zjištěna incidence karcinomu prostaty ve 24–26,5 % (3). V případě negativního nálezu z primobiopsie a nadále trvajícím podezřením na karcinom prostaty (při vzrůstajícím PSA či suspektním nálezu v biopsii včetně atypické proliferace malých acinů – ASAP) je indikována rebiopsie. Procento záchytu v rebiopsiích je pak udáváno kolem 10–20 % (4). Dle guidelines EAU je v současnosti doporučeno při opakovaně negativních biopsiích a trvalém podezření na karcinom prostaty doplnění multiparametrické magnetické rezonance (MP-MRI) (5, 6). Pokud ani tato metoda nepřinese pozitivní výsledky, pak nelze než vyčkávat na pokračující progresi PSA a indikaci další rebiopsie. V případech opakovaných rebiopsií je nutno zvážit načasování dle očekávaného rizika ev. lokální progrese či metastatického onemocnění. Lze říci, že čím je vyšší PSA či velocita, zejména pak, pokud PSA přesahuje hodnoty 20 ng/ml, tím je větší riziko, že v případě přítomného a nediagnostikovaného karcinomu prostaty promeškáme vhodný okamžik, kdy ještě můžeme pacientovi nabídnout kurativní léčbu. Vývoj technologií se ubírá směrem k možnosti vyznačení oblastí, ve kterých se vyskytuje karcinom a z toho plynoucí možnosti provedení cílené biopsie. Kromě MP-MRI lze využít i metody nukleární medicíny – PET či metody hybridní, tj. PET/CT a PET/ MRI (7, 8).
PET nabízí senzitivní a neinvazivní metodu ke studiu metabolické aktivity v nádorové tkání in vivo. Nejčastěji používané radiofarmakum v onkologii 18F-fluorodeoxyglukóza (18F-FDG) má nízkou senzitivitu ve znázornění karcinomu prostaty, neboť není vychytávána u pomaleji rostoucích a dobře diferencovaných tumorů, mezi něž většinou patří i karcinom prostaty. Zvýšenou akumulaci FDG vidíme jen u tumorů s vyšším Gleasonovým skóre (9). Jinak nelze pomocí 18F-FDG odlišit benigní hyperplazii od karcinomu. S ohledem na tuto skutečnost byla snaha použít alternativní radiofarmaka – cholinové deriváty, mezi nimiž se uplatnily hlavně 11C a 18F-fluorometylcholin (18F-FCH). Cholin je důležitý prekurzor pro biosyntézu fosfatidylcholinu (lecithinu), klíčové komponenty buněčných membrán (10). Většina typů nádorů včetně karcinomu prostaty vykazuje zvýšený cholinový transport a overexpresi cholinkinázy v důsledku zvýšené potřeby fosfatidylcholinu u rychle proliferujících buněk (10). 11C-cholin se vylučuje do moči minimálně, tedy nedochází k překrytí vyšetřované oblasti. Nevýhodou 11C-cholinu je ale jeho krátký poločas rozpadu (20,4 min), pro který je možno vytoto vyšetření jen na pracovištích vybavených cyklotronem (11, 12). Vzhledem k delšímu poločasu rozpadu (109,8 min) je 18F-cholin výhodnější pro rutinní klinické použití.
Po aplikaci 18F-FCH je radiofarmakum rychle eliminováno z krve. V játrech a plicích je nejvyššího vychytávání dosaženo cca v desáté minutě. Normální biodistribuce je ve slinných žlázách, játrech, slezině a pankreatu. Ve střevech je aktivita variabilní. V ledvinách a močovém měchýři je pak fyziologická aktivita následkem jeho exkrece do moči (13, 14). Normální prostata vykazuje jen slabé vychytávání, difuzní nebo fokální vychytávání však můžeme vidět u prostatitidy, benigní hyperplazie či malignity (15). Nespecifická akumulace cholinu v zánětlivých ložiscích snižuje specificitu vyšetření 18-F-FCH PET/CT vyznačit ev. ložisko karcinomu v prostatě. Uváděná senzitivita a specificita 18F ‑ -FCH PET/CT se různí v rozsahu 64–100 % senzitivity a 47–90 % specificity (16, 17, 18, 19).
MATERIÁL A METODY
Od ledna 2013 do května 2015 jsme do prospektivní studie v rámci primodiagnostiky karcinomu prostaty pomocí 18-F-FCH PET/CT zařadili 30 pacientů, kteří splňovali indikační kritéria. Mezi nimi byli jak pacienti vedení v urologické ambulanci FN Olomouc, tak pacienti mimospádoví, odeslaní ke konziliárnímu vyšetření. Průměrný věk pacientů byl 66 let v rozmezí 57–75 let. Indikačním kritériem bylo PSA nad 10 ng/ ml a prodělání více jak tří biopsií prostaty, včetně biopsie saturační. Pokud to bylo možné, pacienti předem absolvovali šestitýdenní kůru ATB terapie Doxycyklinem 100 mg 2x denně k eliminaci zánětu, a tím možným falešně pozitivním nálezům na PET/ CT (20). PET/CT vyšetření byla provedena na skeneru Biograph 16 Hi-Rez (Siemens Medical Solutions USA., Inc.). Pacientům byl intravenózně aplikován 18F-fluorometylcholin (IasoCholine, Iason, Graz) v dávce 5 MBq/1 kg hmotnosti. Bezprostředně po aplikaci byla spuštěna dynamická studie se zaměřením na pánev, sloužící k zobrazení prostaty před přítokem moči s radiofarmakem do močového měchýře. Další fáze PET/CT vyšetření byla provedena 50 minut po aplikaci radiofarmaka, po perorálním podání roztoku CT kontrastní látky a po nitrožilním podání neionické CT kontrastní látky v rozsahu od baze lební pod inguiny bez horních končetin. Následně byla provedena iterativní rekonstrukce dat s transmisní korekcí na zeslabení záření gama pomocí CT. Na PET/CT nálezech bylo popsáno, ve kterých oblastech prostaty byla akumulace radiofarmaka zvýšená, a dále bylo určeno místo s nejvyšší mírou akumulace radiofarmaka. Nálezy na PET/CT byly vyhodnoceny jako negativní, difuzní a fokální vychytávání radiofarmaka. V odstupu cca 14 dní až měsíce byla provedena cílená biopsie ložisek popsaných na 18F-FCH PET/CT. Po zaměření a vyznačení ložisek radiologem byla provedena biopsie pod sonografickou kontrolou transrektálně za pomoci kognitivní fúze PET/CT obrazu s real-time sonografickým záznamem. Pokud byl nález na PET-CT hodnocen jako fokální, pak byla naměřena vzdálenost tohoto ložiska od spodiny močového měchýře a od rekta. Tyto údaje pak byly přeneseny do sonografického záznamu. Pokud byl nález hodnocen jako difuzní, pak byla biopsie zaměřena do místa s nejvyšším „standart uptake value“ (SUV). Byly odebírány jen vzorky z ložisek popsaných na PET/CT a to přibližně 8–12 vzorků dle velikosti a počtu ložisek vyznačených PET/CT. Z jiných oblastí jsme vzorky neodebírali, neboť jsme předpokládali, že periferní zóna byla extenzivně bioptována při předchozích biopsiích. Bioptické vzorky byly zpracovány standartním způsobem. V případě, kdy nebylo patrné ložisko na 18F-FCH PET/CT, jsme rebiopsii neindikovali. Pacienti, u nichž bylo PET-CT negativní, stejně jako ti s negativní cílenou biopsií, jsou nadále sledováni dle doporučení režimu pro časnou detekci karcinomu prostaty.
VÝSLEDKY
Od ledna 2013 do května 2015 absolvovalo 18F ‑ -FCH PET/CT 30 pacientů. U 14 z nich jsme potvrdili karcinom prostaty, což činí 46% záchyt ve skupině rebiopsií. Pacienty jsme podle nálezu na 18F-FCH PET/CT rozdělili do 3 skupin: negativní nález, difuzní distribuce radiofarmaka a fokální distribuce radiofarmaka. Záchyt ve skupině s fokání distribucí byl 80 % (12 pozitivních z 15 pacientů s fokálním nálezem), ve skupině s difuzní distribucí pak byl záchyt 15 % (dva pozitivní z 13 pacientů s difuzní distribucí). U dvou pacientů pak bylo 18F-FCH PET-CT negativní a ti k rebiopsii nebyli indikováni. Anteriorně lokalizovaný tumor na 18F-FCH PET ‑ -CT jsme diagnostikovali u 88 % z nich, což bylo pravděpodobně i příčinou toho, že při standardně prováděných biopsiích nebyl tento tumor diagnostikován. Průměrný počet odebíraných vzorků byl deset, což je taktéž výrazné snížení, vedoucí zejména ke snížení morbidity oproti saturačním biopsiím. Všichni pacienti, u nichž byl tímto způsobem diagnostikován karcinom prostaty, měli Gleasonovo score vyšší než sedm, tedy šlo u nich o karcinom minimálně středně rizikový a radikální operační léčba či radioterapie byla indikována u všech těchto nemocných (tabulka 1). Z této skupiny všichni pacienti, u nichž byl karcinom prostaty potvrzen, měli PSA vyšší než 20 ng/ml. Při této hodnotě se již dala očekávat generalizace do regionálních uzlin. Žádný z těchto pacientů však neměl metastatické onemocnění ani při cholinovém PET CT ani při následném vyšetření uzlin po extenzivní lymfadenektomii. Všichni pacienti, kteří absolvovali operační léčbu, měli pooperační PSA nulové a dosud zůstávají v remisi, stejně jako pacienti, kteří podstoupili radioterapii.
1. Soubor pacientů s potvrzeným karcinomem prostaty pomocí cílené biopsie ložiska dle 18F-FCH PET/CT Tab. 1. Group of patients with prostate carcinoma confirmed by targeted biopsy 18F-FCH PET/CT 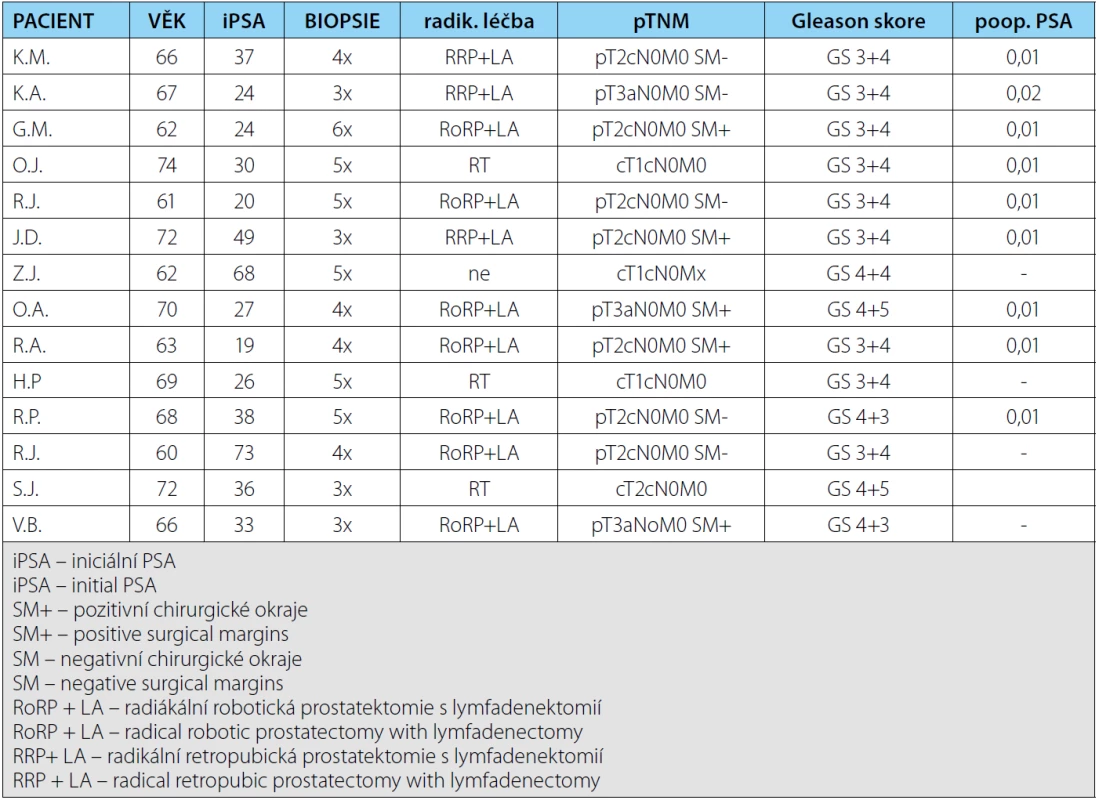
DISKUZE
Karcinom prostaty jako jeden z mála tumorů není běžnými zobrazovacími metodami znázornitelný. K jeho diagnostice tedy potřebujeme histologické vyšetření vzorků z biopsie prostaty. Ačkoliv pokrok v oblasti magnetické rezonance, zejména díky rozšíření 3T přístrojů a zavádění standardizovaných protokolů hodnocení, je nezpochybnitelný, stále není k dispozici jednoduchá, časově nenáročná a dostatečně senzitivní a specifická metoda, která by byla schopna přítomnost karcinomu prostaty detekovat. U rebiopsií prováděných standardně pomocí transrektální sonografie je udáván záchyt jen kolem 10–20 % (21). Vzhledem k multifokalitě karcinomů v prostatě se ani v blízké budoucnosti nedá očekávat, že bychom měli diagnostický nástroj, splňující tato kritéria. Nicméně již dnes je patrné, že trend ubírající se k cílené biopsii dokáže snížit počty zbytečných biopsií a s tím související snížení morbidity a mortality. 18F-FCH PET/CT vyšetření je v primodiagnostice karcinomu prostaty stále ve stadiu výzkumu. Pokud bylo použito k diagnostice časných stadií karcinomu, pak senzitivita byla od 64 do 100 % a specificita od 47 do 90 % (16, 17, 18). Omezená senzitivita je dána pravděpodobně malou rozlišovací schopností PET systémů. Specificita, stejně jako u MRI, je snižována neschopností odlišit jisté typy benigní prostatické hyperplazie a prostatitidy. Pro potřeby cílené biopsie je však vyznačení suspektního ložiska přesto přínosem. Pacienti, kteří již podstoupili opakované biopsie, mají ve standardně bioptované oblasti periferní zóny odebráno dostatečné množství vzorků k vyloučení přítomnosti karcinomu v této lokalizaci. V současnosti se zaváděním nových zobrazovacích metod se opět zájem soustředí i na tumory v anteriorní části prostaty (APC – anterior prostate cancer). Tato oblast je definována jako oblast nad rovinou proloženou uretrou (obrázek 1) a tvoří zejména u větších prostat až 80 % objemu žlázy. Je tvořena převážnou částí tranzicionální zóny, anteriorní fibromuskulární areou a předními rohy periferní zóny. Výskyt karcinomu prostaty v této oblasti je 25 % (22, 23). Provedení saturační biopsie tak, jak bylo původně definováno – odběr jednoho vzorku na 3–5 ml objemu žlázy, by tedy vedlo k navýšení počtu biopsií o několik desítek vzorků. Tímto způsobem by byla žláza rovnoměrně vyšetřena tak, abychom mohli vyloučit klinicky signifikantní karcinom i mimo predilekční oblasti (22). Saturační biopsie tak, jak je definována dnes, tj. odběr víc jak 20 vzorků včetně jen 4–6 vzorků z tranzicionální zóny, nemůže zejména tumory v anteriorní zóně vyloučit. Zvýšení počtu biopsií z tranzicionální zóny bez možnosti cílené biopsie pak nepřináší zvýšené procento záchytu karcinomu. Na základě našich výsledků doporučujeme využití 18F-FCH PET/CT u pacientů, u nichž je PSA vyšší než 20 ng/ml a opakované biopsie prostaty včetně saturačních nepotvrdily karcinom, ačkoliv máme vysoké suspicium na jeho přítomnost. Z naší analýzy je zřejmé, že v této skupině pacientů se karcinom ve většině případů vyskytoval v anteriorní oblasti prostaty. Dle guidelines EAU je na prvním místě při plánování rebiopsií doporučováno MP ‑ -MRI, které však vyžaduje nejen vhodné přístrojové vybavení, ale i edukovaného radiologa, který je schopen provést multiparametrickou analýzu a měl by být schopen vyhodnotit záznam podle standardních protokolů např. Prostate Imaging ‑ -Reporting and Data System (PI-RADS™) a jeho aktualizovaná verze PI-RADS™ 2 (24, 25, 26). V neposlední řadě pak bioptující urolog musí mít alespoň základní představu o orientaci v záznamu z magnetické rezonance. Doporučované MP-MRI však má v diagnostice anteriorních tumorů výrazně nižší senzitivitu a specifitu než v oblasti periferní zóny (27, 28). Na diagnostiku těchto tumorů jsme použili 18F-FCH PET/CT, které si v rutinní primodiagnostice místo neprosadilo. V případech, kdy konvenční metody diagnostiky pomocí standardní biopsie a rebiopsie, ev. MP-MRI neprokáží tumor prostaty a stále trvá podezření na jeho přítomnost, je dle našich výsledků 18F-FCH PET/CT metodou volby. V současnosti nemáme možnost provedení cílené biopsie v real-time znázornění ložiska a tedy může dojít k minutí ložiska při limitované přesnosti kognitivní fúze. Zpřesnění zacílení ložiska by mohly v nejbližší době poskytnout hybridní PET/MRI a PET/ CT systémy se semi-realtime fúzí sonografického obrazu s MRI či CT při provádění biopsií. Vývoj na poli nukleární medicíny pak slibuje do budoucna radiofarmaka jako ligandy PSMA (prostatický specifický membránový antigen), která by mohla zvýšit jak senzitivitu, tak specificitu tohoto vyšetření (29).
1. Schéma výskytu anteriorních tumorů. PZ post – periferní zóna posteriorně. PZ ant – anteriorní rohy periferní zóny. TZ type 1 – tranzitorní zóna 1 typu – v jednom laloku tranzitorní zóny. TZ type 2 – tranzitorní zóna 2. typu – většinou v anterolaterální lokalizaci. AFMS – anteriorní fibromuskulární stroma. Upraveno dle : Lemaitre L, et al. Dynamic contrast-enhanced MRI of anterior prostate cancer: morphometric assessment and correlation with radical prostatectomy findings. Eur Radiol 2009; 19: 470–480 Fig. 1. Definition of the location of prostate cancer. PZ post: posterior peripheral zone. PZ ant: anterolateral peripheral zone (PZ) horn. TZ type 1: within one transitional zone (TZ) lobe. TZ type 2: mostly at anterolateral location or astride the TZ-AFMS boundary. AFMS: anterior fibromuscular stroma. References: Lemaitre L, et al. Dynamic contrast-enhanced MRI of anterior prostate cancer: morphometric assessment and correlation with radical prostatectomy findings. Eur Radiol 2009; 19: 470–480 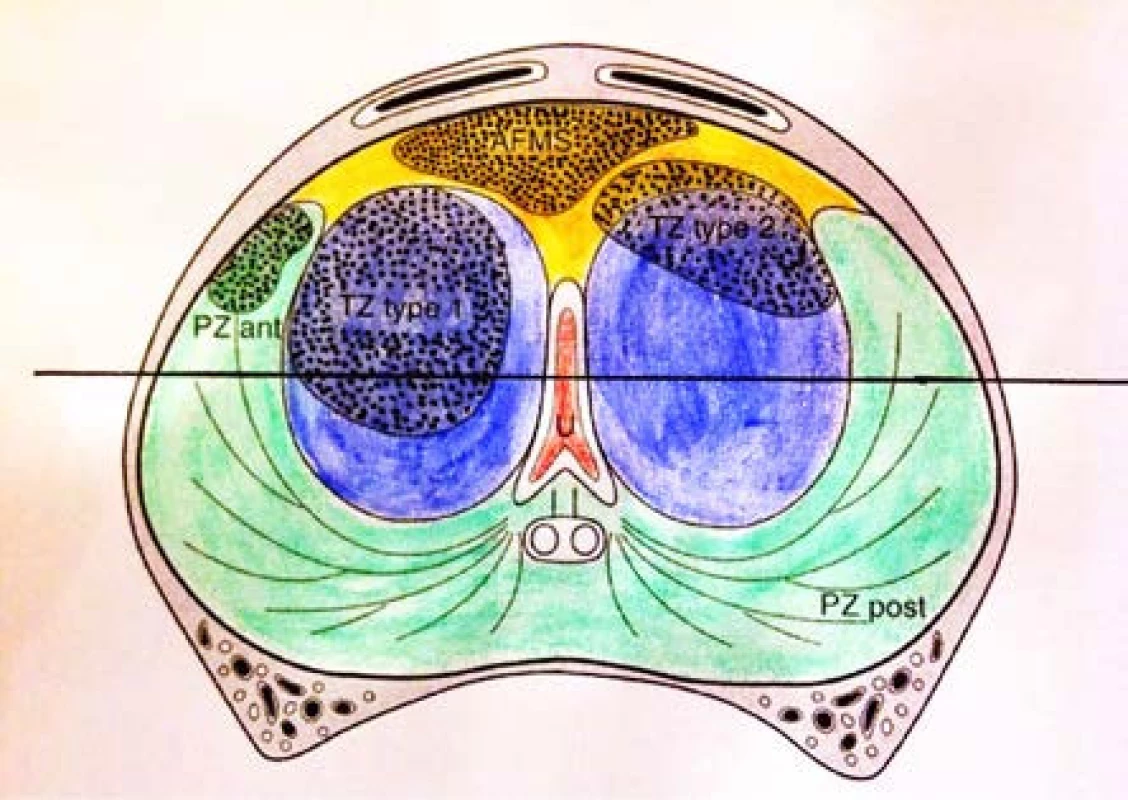
2. Ložisko tumoru v anteriorní zóně vlevo na 18-F-fluorocholin PET/CT podélný řez Fig. 2. Focus of the tumor in anterior zone of the prostate on 18F-fluorocholine PET/CT longitudinal section 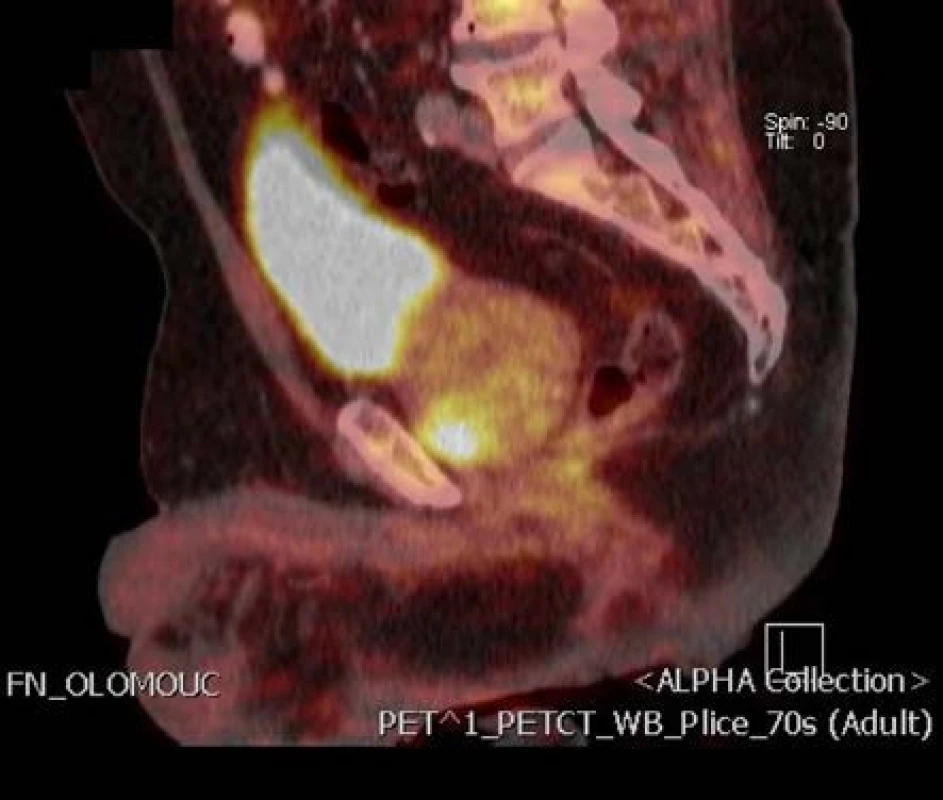
3. Obr. 3. Ložisko v levém laloku na 18-F-fluorocholin PET/CT příčný řez Fig. 3. Focus of the tumor in left anterior zone of the prostate on 18F-fluorocholine PET/CT transversal section 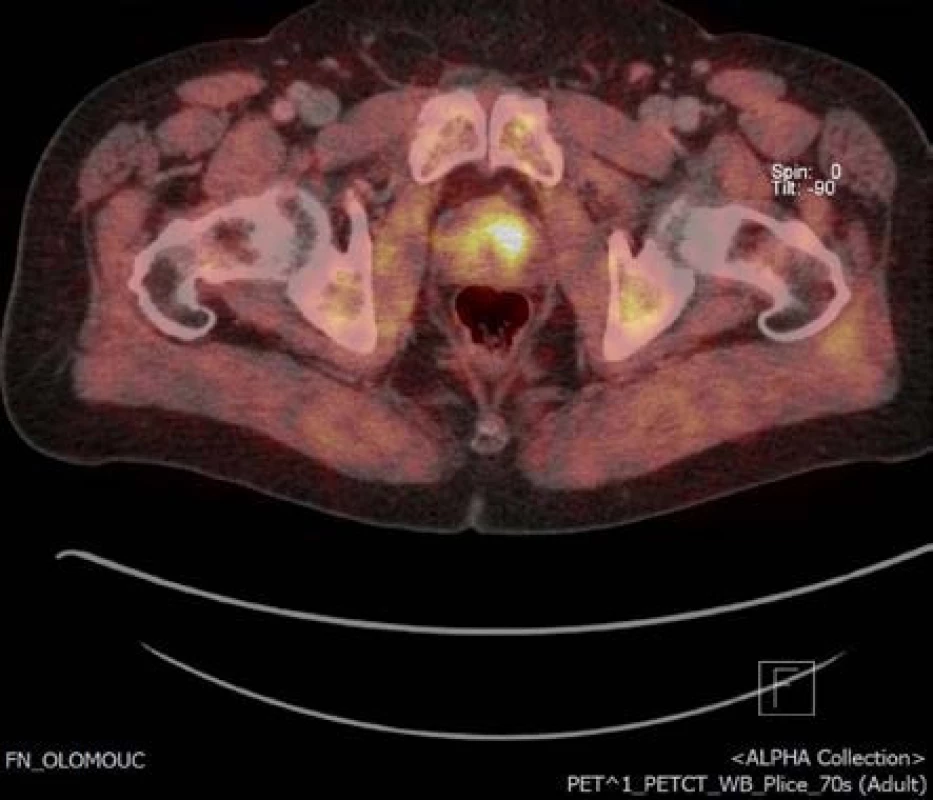
ZÁVĚR
18F-fluorocholin PET/CT se jeví jako slibná metoda napomáhající diagnostice karcinomu prostaty pomocí cílené biopsie, zejména při přetrvávajícím podezření na karcinom prostaty a stále negativních opakovaných biopsiích. V daných případech se dá předpokládat lokalizace tumoru mimo standardně bioptovanou část prostaty, a to v anteriorní části prostaty. Problémem zatím zůstává, stejně jako u jiných podobných metod, nemožnost biopsie ložiska v real-time zobrazení a tedy zejména u malých ložisek může docházet k ovlivnění výsledků způsobené minutím tohoto ložiska.
Došlo: 14. 12. 2015
Přijato: 16. 3. 2016
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Kontaktní adresa:
MUDr. Šárka Kudláčková
Urologická klinika Fakultní nemocnice Olomouc
I. P. Pavlova 6, 779 00 Olomouc
e-mail: kudlacks@seznam.cz
Sources
1. SVOD. www.svod.cz
2. Chen ME, Johnston DA, Tang K, Babaian RJ, Troncoso P. Detailed mapping of prostate carcinoma foci: biopsy strategy implications. Cancer 2000; 89 : 1800–1809.
3. Djavan B, Zlotta A, Kratzik C. PSA, PSA density, PSA density of transitional zone, free/total PSA ratio and PSA velocity for early detection of prostate cancer in men with serum PSA 2,5-to 4 ng/ml. Urology 1999; 54 : 517–522.
4. Campos-Fernandes JL, Bastien L, Nicolaiew N, et al. Prostate cancer detection rate in patients with repeated extended 21-sample needle biopsy. Eur Urol 2009; 55 : 600–606.
5. Ferda J, Hora M, Hes O, et al. Zobrazení prostaty na 3T MRI u nemocných se zvýšenou hladinou PSA. Ces Radiol 2012; 66(1): 9–17.
6. Dolejšová O, Eret V, Šobrová A, et al. Využití multiparametrické magnetické rezonance a srovnání s ostatními moderními zobrazovacími metodami v předoperační diagnostice karcinomu prostaty. Ces Urol 2014; 18(4): 300–309.
7. Wetter A, Lipponer Ch, Nensa F, et al. Evaluation of the PET component of simultaneous 18F-choline PET/MRI in prostate cancer: comparison with 18F-choline PET/CT. Eur J Nucl Med Mol Imaging 2014; 41 : 79–88.
8. Ferdová E, Ferda J, Baxa J, et al. PET/CT s 18F-fluorocholinem u karcinomu prostaty, dvouleté zkušenosti. Ces Radiol 2014; 68(1): 22–29.
9. Sanz G, Robles JE, Gimnez M, et al. Positron emission tomography with 18fluorine-labelled deoxyglucose: utility in localized and advanced prostate cancer. BJU Int 1999; 84 : 1028–1031.
10. Ackerstaff E, Glunde K, Bhujwalla ZM. Choline phospholipid metabolism: a target in cancer cells? J Cell Biochem 2003; 90(3): 525–533.
11. Hara T, Kosaka N, Kishi H. PET imaging of prostate cancer using carbon-11-choline. J Nucl Med 1998; 39 : 990–995.
12. DeGrado TR, Baldwin SW, Wang S, et al. Synthesis and evaluation of (18)F-labeled choline analogs as oncologic PET tracers. J Nucl Med 2001; 42 : 1805–1814.
13. Mertens K, Ham H, Deblaere K, et al. Distribution patterns of 18F-labelled fluoromethylcholine in normal structures and tumors of the head: a PET/MRI evaluation. Clin Nucl Med 2010; 37 : 196–203.
14. Chondrogiannis S, Marzola MC, Grassetto G, et al. New acquisition protocol of 18F-choline PET/CT in prostate cancer patients: review of the literature about methodology and proposal of standardization. BioMed Research International, 2014, article ID 215650, 10 pages.
15. Schillaci O, Calabria F, Tavolozza M, et al. 18F-choline PET/CT physiological distribution and pitfalls in image interpretation: experience in 80 patients with prostate cancer. Nucl Med Commun 2010; 31(1): 39–45.
16. Husarik DB, Miralbell R, Dubs M, et al. Evaluation of [(18)F]-choline PET/CT for staging and restaging of prostate cancer. Eur J Nucl Med Mol Imaging 2008; 35 : 253–263.
17. Igerc I, Kohlfurst S, Gallowitsch HJ, et al. The value of 18F-choline PET/CT in patients with elevated PSA-level and negative prostate needle biopsy for localisation of prostate cancer. Eur J Nucl Med Mol Imaging 2008; 35 : 976–983.
18. Kwee SA, Coel MN, Lim J, Ko JP. Prostate cancer localization with 18fluorine fluorocholine positron emission tomography. J Urol 2005; 173 : 252–255.
19. Kwee SA, Thibault GP, Stack RS, et al. Use of step-section histopathology to evaluate 18F-fluorocholine PET sextant localization of prostate cancer. Mol Imaging 2008; 7 : 12–20.
20. Lee AG, Choi Yh, Cho SY, Cho IR. A prospective study of reducing unnecessary prostate bipsy in patiens with high serum prostate-specific antigen with consideration of prostatic inflammation. Korean J Urol 2012; 53 : 50–53.
21. Djavan B, Ravery V, Zlotta A, et al. Prospective evaluation of prostate cancer detected on biopsies 1, 2, 3 and 4: when should we stop? J Urol 2001; 166 : 1679–1783.
22. Bott SRJ, Young MPA, Kellett MJ, Parkinson MC. Anterior prostate cancer: is it more difficult to diagnose? BJU Int 2002; 89 : 886–889.
23. Bouyé S, Potiron E, Puech P, Leroy X, Lemaitre L, Villers A. Transition zone and anterior stromal prostate cancers: Zone of origins and intraprostatic patterns of spread at histopatology. The Prostate 2009; 69 : 105–113.
24. Röthke M, Blondin D, Schlemmer HP, Franiel T. PI-RADS classification: structured reporting for MRI of the prostate. Fortschr Röntgenstr 2013; 185 (3): 253–261.
25. Dickinson L, Ahmed HU, Allen C, et al. Magnetic resonance imaging for the detection, localisation, and characterisation of prostate cancer: recommendations from aEuropean consensus meeting. Eur Urol 2011; 4 : 477–494.
26. Šobrová E, Eret V, Dolejšová O, et al. Komparace multiparametrické magnetické rezonance se silou magnetického pole 3 Tesla s transrektální sonografií naváděnou biopsií prostaty. Ces Urol 2014; 18(3): 225–233.
27. Namimoto T, Morishita S, Saitoh R, et al. The value of dynamic MR imaging for hypointensity lesions of the peripheral zone of the prostate. Comput Med Imaging Graph 1998; 22(3): 239–245.
28. Schwarzenböck S, Souvatzouglou M, Krause BJ. Choline PET and PET/CT in primary diagnosis and paging of prostate cancer. Theranostics 2012; 2(3): 318–330.
29. Eiber M, Maurer T, Souvatzoglou M, et al. Evaluation of Hybrid 68Ga-PSMA-Ligand PET/CT in 248 Patients with Biochemical Recurrence after Radical Prostatectomy. J Nucl Med 2015; 56 : 668–674.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2016 Issue 1-
All articles in this issue
- 31ST ANNUAL CONFERENCE EAUIN MUNICH
- THE 2015 BEST SCIENTIFIC PUBLICATION COMPETITION OF THE CZECH UROLOGICAL SOCIETY
- ASSOC. PROF. RADIM KOČVARA, M.D., CSC. TURNS 65
- LAPAROENDOSCOPIC SINGLE-SITE SURGERY (LESS) ADRENALECTOMY
- ROBOT-ASSISTED PARTIAL NEPHRECTOMY
- THE USE OF SHOCK WAVES IN THE TREATMENT OF ERECTILE DYSFUNCTION
- NEUROSTIMULATION AND NEUROMODULATION IN THE CHILDHOOD
- HOW TO PREPARE AN ABSTRACT FOR THE ANNUAL CONFERENCE OF THE CZECH UROLOGICAL SOCIETY
- INCIDENCE AND TREATMENT OF UROLOGICAL COMPLICATIONS AFTER TOTAL PELVIC EXENTERATION FOR ADVANCED PELVIC TUMORS
- 18-F CHOLINE PET CT IN PRIMARY DIAGNOSIS OF THE PROSTATE CANCER
- BLADDER CARCINOSARCOMA IN GENERAL
- HORSESHOE KIDNEY TRAUMA
- 61. LAUBOUR CONFERENCE ČUS IN 2015 OLOMOUC
- TEN YEARS OF ROBOTIC SURGERY IN CZECH REPUBLIC
- CORRECTION OF THE BIPLANAR PENILE DEFORMITIES IN PATIENTS WITH PEYRONIE’S DISEASE. DESCRIPTION OF THE MODIFIED EGYDIO’S TECHNIQUE WITH ADDITIONAL SUTURE PLACEMENT DIRECTLY ON THE BOVINE PERICARD PATCH
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- THE USE OF SHOCK WAVES IN THE TREATMENT OF ERECTILE DYSFUNCTION
- HORSESHOE KIDNEY TRAUMA
- 18-F CHOLINE PET CT IN PRIMARY DIAGNOSIS OF THE PROSTATE CANCER
- NEUROSTIMULATION AND NEUROMODULATION IN THE CHILDHOOD
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

