-
Medical journals
- Career
Současné možnosti predikce účinnosti systémové léčby metastatického karcinomu ledviny
Authors: Ivan Trávníček 1; Milan Hora 1; Ondřej Hes 2; Luboš Holubec 3
Authors‘ workplace: Urologická klinika LF UK a FN, Plzeň 1; Šiklův patologicko-anatomický ústav LF UK a FN, Plzeň 2; Onkologické a radioterapeutické oddělení FN, Plzeň 3
Published in: Ces Urol 2013; 17(4): 227-237
Category: Review article
Overview
Cílem práce je v souhrnu popsat současné možnosti využití molekulárních markerů a některých klinických biomarkerů v predikci účinnosti systémové terapie karcinomu ledviny.
Literatura byla vyhledána za použití klíčových slov v databázi PubMed, též i v domácích periodikách a publikacích. Diskutované jsou markery stanovované ve tkáni tumoru, v krvi a v moči (tab. 1), dále klinické faktory ke zhodnocení efektu již podávané léčby.
Nebyl zatím potvrzen žádný specifický prediktivní faktor efektu biologické léčby karcinomu ledviny. Existuje navíc i výrazná genetická heterogenita v rámci jedné histologické skupiny a dokonce i v rámci jediné léze, chování tumorů i účinek cílené léčby se tak může v jednotlivých případech výrazně lišit.Klíčová slova:
biologická léčba, metastatický renální karcinom, molekulární marker.ÚVOD
Karcinom ledviny představuje 2–3 % všech solidních maligních nádorů u dospělé populace západní Evropy, v České republice je incidence celosvětově nejvyšší (1, 2). V roce 2009 byla incidence karcinomu ledviny 26,9/100 000 obyvatel a rok, mortalita 10,9/100 000 (1). Až 30 % RCC má v době diagnózy již založeny současnými diagnostickými možnostmi detekovatelné vzdálené metastázy a u více než poloviny pacientů s lokalizovaným RCC onemocnění progreduje v dalším průběhu (2). Systémová léčba metastatického karcinomu ledviny (metastatic renal cell carcinoma, mRCC) v současné době využívá především preparáty tzv. cílené terapie, nebo také biologické léčby. Ve srovnání s cytokinovou terapií má tato léčba vyšší účinnost a méně výrazné nežádoucí účinky. Léčba je ovšem velice nákladná a míra jejího efektu je prakticky nepředvídatelná. Alespoň parciální regresi ložisek tumoru lze pozorovat jen asi v polovině případů. Doporučení Evropské urologické společnosti (European Association of Urology, EAU) pro systémovou léčbu mRCC se opírá o MSKCC kritéria (Memorial Sloan-Kettering Cancer Center, tzv. Motzerova kritéria) z roku 2002 (3–5) a biologická léčba je indikována dle rozdělení pacientů do prognostických skupin (tab. 2). Česká onkologická společnost užívá dle doporučení National Comprehensive Cancer Network (NCCN) tzv. modifikovaná MSKCC kritéria, kdy přidaným faktorem je dva a více metastázami postižených orgánů (6, 7). Moderní modely sestavené již v éře biologických preparátů však také predikují dle klinických faktorů přežití nemocných, k predikci efektu preparátu na tumor samotný však nejsou tyto nomogramy použitelné (8). V moderní onkologické péči je užití biomarkerů u některých diagnóz a některých typů léčby běžné již nyní (např. mutace KRAS u kolorektálního karcinomu predikuje špatnou odpověď na léčbu cetuximabem, nadměrná exprese HER2 u karcinomu prsu predikuje agresivní typ nádoru se špatnou reakcí na standardní chemoterapii a indikuje se transtuzumab. I u karcinomu ledviny je tedy snaha o nalezení biomarkerů, které by predikovaly efekt systémové léčby na tumor samotný, nebo by dokonce odhalily primárně rezistentní nádory. To by mohlo v budoucnu přispět ke snadnějšímu a rychlejšímu výběru vhodného preparátu a také léčbu podstatně zlevnit.
Table 1. Přehled diskutovaných biomarkerů Table 1. The list of discussed biomarkers 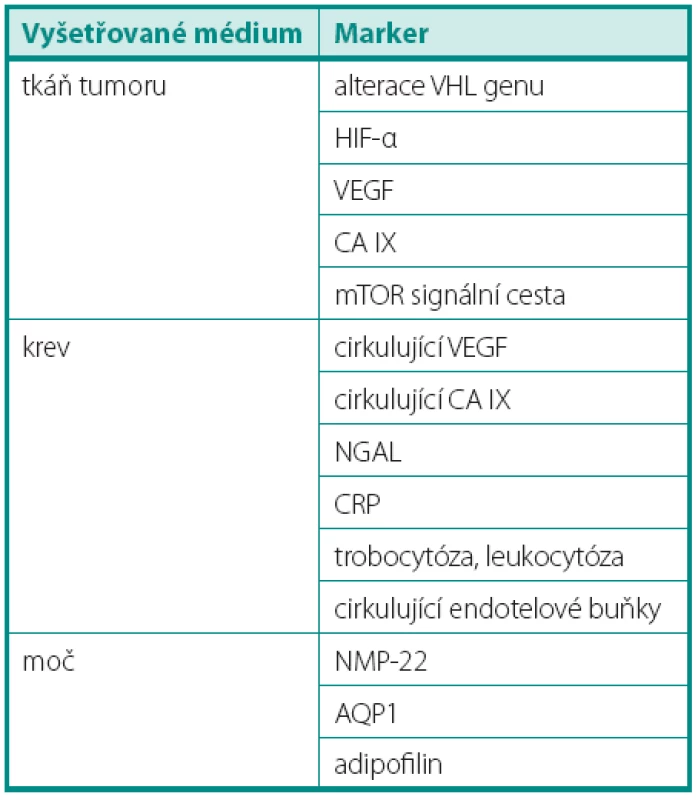
Table 2. Modifikované MSKCC prognostické faktory užívané NCCN (National Comprehensive Cancer Network) a ČOS (Českou onkologickou společností (3–5) Table 2. Modified MSKCC prognostic factors used by NCCN (National Comprehensive Cancer Network) and ČOS (Czech Society of oncology) (3–5) 
MECHANISMY BIOLOGICKÉ LÉČBY NÁDORŮ LEDVIN
Preparáty biologické léčby lze rozdělit do tří skupin.
- TKI (tyrosine kinase inhibitors) – inhibitory kináz receptorů v cestě VEGF (vascular endothelial growth factor; endoteliální růstový faktor) a PDGF (platelet derived growth factor; destičkami derivovaný růstový faktor). Pro klinické použití u mRCC jsou k dispozici sunitinib, sorafenib, pazopanib a axitinib. Tyto molekuly jsou multikinázové inhibitory, prostupují přes stěnu nádorové buňky a blokují funkci jednak tyrosinkináz receptorů pro růstové faktory (VEGF a PDGF), dále c-KIT (receptor kmenových buněk pro růstové faktory), FLT-3 (Fms-like tyrosinkinase-3; Fms-podobné tyrosinkinázy-3) a jiné. Přerušují se tak signální dráhy novotvorby cév nádoru. Sorafenib blokuje navíc Raf-kinázu, součást RAS-RAF-MEK-ERK kaskády důležité pro proliferaci buněk.
- monoklonální protilátky proti VEGF. V současné době je jediným preparátem indikovaným v léčbě mRCC bevacizumab. Vyvazuje VEGF v extracelulárním prostředí, a zabraňuje tak navázání na tyrozinkinázové receptory VEGFR1 a VEGFR2 na povrchu endotelií. Indikován je v kombinaci s interferonem u nádorů s dobrou prognózou (dle MSKCC kritérií žádný rizikový faktor) (5, 6).
- inhibitory mTOR (mammalian target of rapamycin; savčí rapamycinový receptor). Cytoplazmatická kináza mTOR reguluje signální dráhy angiogeneze, růstu a přežívání nádorových buněk. Ovlivňuje také buněčné hospodaření s živinami a energií a oxidoredukční pochody (9). Temsirolimus a everolimus jsou inhibitory mTOR používané v léčbě mRCC se špatnou prognózou (dva a více rizikových faktorů dle modifikovaných MSKCC kritérií) a nesvětlobuněčných typů nebo v 2. a 3. linii po selhání inhibitorů tyrosinkináz (6).
Cílená léčba je paliativní a svým mechanismem účinku způsobuje zmenšení hmoty nádoru, zlepšuje přežití, nevede však k vyléčení nádorového onemocnění.
PREDIKTIVNÍ NOMOGRAMY
Bylo publikováno několik modelů k predikci efektu antiangiogenních látek. Založeny jsou vesměs na klinických a biochemických faktorech. V roce 2008 publikoval Motzer et al. nomogram predikující 12 měsíční PFS (progression-free survival; přežití bez progrese) při léčbě sunitinibem (10). Součástí nomogramu jsou kromě již užívaných MSKCC kritérií též přítomnost plicních, resp. jaterních metastáz, počet metastáz, trombocytóza, hladina alkalické fosfatázy a neodstraněný primární nádor. IMDC (International mRCC Database Consortium) model publikoval Heng et al. v roce 2009, zahrnul neutrofilii a trombocytózu k MSKCC kritériím, vyloučil však elevaci LDH (8). Tento model byl opakovaně externě validován a je zmiňován v EAU doporučených postupech jako vhodný nomogram predikce přežití vyvinutý již v době biologické léčby. Karakiewicz et al. v roce 2011 komparoval výsledky predikce PFS u pacientů léčených INF + bevacizumabem a INF samotným pomocí nomogramu zahrnujícího performance status, čas od diagnózy do léčby, hladinu sérového albuminu a alkalické fostatázy s Motzerovými kritérii, výsledky byly významně zpřesněny (11). Tato studie byla opakovaně validována (12). Index konkordance těchto nomogramů je přibližně 60–75 %.
MARKERY STANOVOVANÉ Z TKÁNĚ TUMORU
Alterace VHL (von Hippel-Lindau) genu
VHL gen je tumor supresorový gen lokalizovaný na krátkém raménku 3. chromozomu kódující proteiny, tzv. pVHL, které v multiproteinových komplexech regulují expresi různých genů, ovlivňují tak tvorbu a ukládání extracelulární matrix a proteinů mikrotubulů zapojených do procesu mikroangiogeneze a nádorové invaze. Účastní se též regulace buněčného cyklu cestou p53. Díky deficitu VHL proteinů se snižuje odbourávání HIF-1α a jeho koncentrace roste i za normálních (normoxických) podmínek. Tzv. VHL syndrom je autozomálně dědičný syndrom charakterizovaný výskytem vaskularizovaných tumorů (hemangioblastomy mozku, sítnice, tumory ledvin a jater), příčinou je delece krátkého raménka 3. chromozomu obsahující VHL gen. Různé alterace VHL genu (hypermetylace či mutace) jsou však nalezeny i v téměř 70 % sporadických karcinomů ledviny (13). Přítomnost VHL alterace ve tkáni tumoru predikuje lepší prognózu, delší PFS (13, 14). Vliv na progresi tumoru mají pouze tzv. „loss-of-function“ mutace (mutace se ztrátou funkce genu) (13, 15). Rini et al. prokázal 60% výskyt alterací VHL genů u pacientů s mRCC, objektivní odpověď na léčbu TKI mělo 48% z nich oproti 35% pozitivních odpovědí u pacientů s normálním VHL genem (16). Vysoké procento, 89,2%, alterovaného VHL genu u sporadických karcinomů nalezl také Patard et al. (17). Přítomnost nealterovaného VHL genu či mutace VHL, současně však vyšší produkce VEGF, korelovala se špatnou prognózou a agresivnějším fenotypem tumoru. Vyšetření alterace VHL genu lze považovat za možný prediktor efektu antiangiogenní léčby.
HIF-α (hypoxií indukovaný faktor α)
Hypoxií indukované faktory (HIFs) jsou transkripční faktory regulující na 200 genů zapojených do zásadních signálních drah tumorigeneze. HIF-α má několik podjednotek, diskutovány jsou dvě, HIF-1α a HIF-2α. HIF-1α se kumuluje v situacích hypoxie buňky či při deficitu pVHL. HIF-1α vstupuje do jádra buňky, kde po spojení s β podjednotkou tvoří aktivní heterodimer a reguluje geny ovlivňující neoangiogenezi ve stavech hypoxie, proteiny kódované cílovými geny jsou VEGF, PDGF a další (18). Dále v jádře buňky stabilizuje protein p53, a tím indukuje apoptózu buňky jako reakci na hypoxii. Dále ovlivňuje metabolismus glukózy, erytropoézu (19) a inhibuje onkoprotein c-Myc (20). Produkce HIF-2α není ovlivněna pVHL a na rozdíl od HIF-1α stimuluje aktivaci c-Myc (20). Zvýšená exprese HIF-α byla nalezena v 75% světlobuněčných a pouze v 38% nesvětlobuněčných RCC (21). Jako prediktivní marker přežití u mRCC je kontroverzní, nezávislé studie si svými výsledky odporují. Lindgren et al. v roce 2005 popisuje zvýšenou expresi HIF-1α jako nezávislý příznivý prediktivní faktor u skupiny 66 pacientů s ccRCC (22), následující studie stejných autorů z roku 2006 se skupinou 176 pacientů tyto závěry nepotvrzuje (23). Klatte et al. V roce 2007 publikoval opačné závěry, v souboru 141 pacientů měla skupina s vysokou expresí HIF-1α signifikantně horší přežití, než pacienti s nízkou expresí (13,5 měsíců vs. 24,4 měsíce). V této studii byly HIF-1α a karboanhydráza IX (CAIX) nejsilnější prognostické faktory (24). Rozdíly ve výsledcích studií mohou být dány nesourodostí souborů, rozdílnými metodikami detekce. Lepší odpověď na léčbu sunitinibem (parciální i kompletní regrese) byla pozorována u pacientů s vysokou expresí HIF-1α nebo HIF-2α ve tkáni tumoru, např. objektivní odpověď byla zaznamenána u 76% pacientů s vysokým stupněm exprese HIF-2α a jen u 13% s nedetekovatelným HIF-2α (25). Toschi et al. prokázal rozdílnou citlivost syntézy HIF-α podjednotek na inhibitory mTOR, produkce HIF-1α je výrazně senzitivnější (26). Gordan et al. nalezl v souboru 160 pacientů s VHL inaktivací rozdílnou expresi HIF-α, skupina s expresí obou podjednotek (HIF-1α i HIF-2α – H1H2) a s expresí pouze HIF-2α (H2). U tumorů H1H2 byla výrazně aktivována Akt/mTOR cesta, u skupiny H2 exprese c-Myc. Efekt inhibitorů mTOR lze očekávat větší u H1H2 skupiny (27).
Vaskulární endoteliální růstový faktor (VEGF)
VEGF je dimerický glykoprotein podporující angiogenezi tumoru. Produkce VEGF je zvýšená u renálních karcinomů s alterací VHL genu (28), tedy hlavně světlobuněčných, nalezena byla však také u papilárních renálních karcinomů (29). Zvýšená exprese ve tkáni je spojena se stage a grade (stadium a stupeň diferenciace) tumoru, nekrózou (30) agresivnějším fenotypem tumoru a signifikantně kratším přežitím (28). K možnému užití tkáňového VEGF jako prediktoru efektu systémové léčby jsou třeba další studie. Nadějné mohou být sekvenční analýzy genů kódujících VEGF, jsou popsány konkrétní nukleotidové polymorfismy (single nucleotide polymorphism, SNP) vykazující vztah k PFS a OS u skupin pacienů léčených TKI (31).
Karboanhydráza IX (CAIX)
Jedná se o HIF-1α regulovaný transmembránový protein regulující intracelulární a extracelulární pH v závislosti na míře hypoxie v tumorózní tkáni a anaerobním metabolismu. U mnoha solidních metastatických nádorů je vysoká exprese CAIX znakem agresivního fenotypu a špatné prognózy (32, 33). U renálního karcinomu, lokalizovaného i metastatického, je popisován však vztah vysoké exprese CAIX s příznivější prognózou (34–36). Díky mutacím VHL genu ve většině renálních karcinomů je silný vztah mezi expresí CAIX a VEGF. Nízká exprese CAIX zvláště ve spojení s vysokou expresí VEGF (34) a absencí mutace VHL genu (36) ukazuje na agresivní fenotyp a špatnou prognózu renálního karcinomu. Jako prediktor efektu biologické léčby je CAIX jen omezeně využitelná. Rozdílný efekt léčby dvěma typy TKI, sunitinibem a sorafenibem, ve vztahu k expresi CAIX popsal Choueiri et al. Průměrné zmenšení nádorové masy dle RECIST kritérií u pacientů léčených sunitinibem bylo –17 % u skupiny s vysokou expresí vs. –25 % u skupiny s nízkou expresí, kdežto u pacientů léčených sorafenibem byl rozdíl mezi těmito skupinami výrazný: –13 % vs. +9 % (37).
PI3K/Akt/mTOR signální cesta
Signální cesta tzv. savčího rapamycinového receptoru (mammalian target of rapamycin, mTOR) reguluje buněčný růst, přežívání a angiogenezi. Autokrinní stimulací nádorové buňky po vazbě VEGF a PDGF a povrchové receptory ve stěně nádorové buňky aktivuje PI3K (fosfatidil inozitol 3 - kinázu). Produkty této kinázy podmiňují aktivaci Akt (jinak též PKB – protein kináza B). Aktivovaná Akt jednak působí anti-apoptoticky, podporuje buněčný růst a angiogenezi fosforylací širokého spektra substrátů v cytoplazmě včetně mTOR (18, 38). Dysregulace PI3K/pAkt/mTOR signální cesty je znakem světlobuněčného i papilárního renálního karcinomu (39, 40).
Akt/PKB
Závěry studií sledující vztah Akt a prognózy onemocnění nejsou jednoznačné. Pantuck et al. popisuje příznivější prognózu lokalizovaného karcinomu s vysokou expresí pAkt v jádře, naopak vysoká exprese cytoplazmatické pAkt byla spojena s horší prognózou mRCC. U lokalizovaného karcinomu byla nalezena vyšší exprese jádrové pAkt než v tkáni mRCC (41). Zda tato skutečnost bude potvrzena a užita k prognóze chování nádoru, musí prokázat další studie. Na souboru vzorků 19 pacientů užívajících temsirolimus prokázal Cho et al. vyšší expresi pAkt pouze u objektivních respondérů (42). Závěry však budou muset potvrdit další studie.
mTOR
mTOR vytváří s dalšími proteiny funkční komplexy (mTORC1 a mTORC2) a reguluje buněčný růst, proliferaci, motilitu, přežívání a syntézu proteinů. Výraznější exprese mTOR ve vzorcích mRCC korelovala s lepší prognózou (43).
pS6 (ribozomální protein S6)
Ribozomální protein S6 je kináza regulována mTOR, v buněčném jádře ovlivňuje mRNA translaci. Vysoká exprese byla nalezena u světlobuněčných renálních karcinomů, tumorů s vyšším gradem a stagem a u generalizovaného onemocnění (41). V multivarietní analýze se pS6 ukázal jako nejsilnější prediktor nádorově specifického přežití (41). Cho et al. v souboru 20 pacientů prokázal, že vysoká exprese pS6 koreluje s odpovědí na léčbu temsirolimem, naznačený trend byl též pro pAkt, navíc objektivní odpověď na léčbu mTOR inhibitory byla pouze u pacientů se zvýšenou expresí pS6 nebo pAkt (42).
PTEN (phosphatase and tensin homolog)
PTEN je tumor supresorový protein, regulující mTOR signální cestu inhibicí PI3K a potažmo pAkt. Mutace PTEN genu jsou v RCC poměrně vzácné a jsou spojeny s horší prognózou (44). Nízká exprese PTEN spolu s vysokou expresí pAkt korelovala s horším přežitím (45). Nicméně, jako prediktor efektu léčby temsirolimem u mRCC se PTEN neprokázal (46).
MARKERY STANOVOVANÉ V PERIFERNÍ KRVI
Cirkulující VEGF
Paule et al. v roce 2010 prokázal signifikantně vyšší hladiny cirkulujících izoforem VEGF (VEGF121 a VEGF165) u pacientů odpovídajících na léčbu sunitinibem (parciální odpověď či stabilní onemocnění). Výsledky byly stejné při analýze transkripční mRNA v tumorózní tkáni pomocí RT-PCR (47). S délkou přežití též korespondoval poměr cirkulujících izoforem VEGF121/VEGF165, u pacientů s poměrem nižším než 1,25 bylo celkové přežité signifikantně vyšší než u pacientů s poměrem vyšším 1,25. Jako prediktoru nelze cirkulující VEGF (cVEGF) užít u všech metastatických nádorů, signifikantně vyšší hladiny byly zjištěny pouze u mRCC s prokázaným deficitem pVHL. Zvýšení hladiny cVEGF může být též arteficiální při aktivaci trombocytů ve vyšetřované krvi v průběhu zpracování. Ve studii porovnávající hladiny cVEGF v různých médiích (citrátová plazma, PECT – medium obsahující inhibitory aktivace trombocytů a resuspenze trombocytů) ve skupině zdravých dobrovolníků, pacientů s metastatickými nádory jinými než renálními a mRCC byly signifikantně vyšší hladiny pouze u mRCC i při vyloučení arteficiálního zvýšení při trombocytární aktivaci (48).
Cirkulující CAIX
Solubilní cirkulující CAIX (cCAIX) v periferní krvi byla poprvé stanovena Závadou et al. v roce 2003. Zvýšené hladiny cCAIX byly nalezeny převážně u pacientů s RCC při porovnání s jinými než renálními karcinomy a zdravými kontrolami. Prokázali také, že cCAIX má původ v nádorové mase, sérové hladiny se po nefrektomii minimalizovaly (49). Byla nalezena korelace mezi hladinou cirkulující CAIX a velikostí tumoru a stage (50, 51), dále také byly zaznamenány zvyšující se hladiny při progresi či rekurenci onemocnění (51). Význam cirkulující CAIX v predikci renálního karcinomu je však ještě třeba potvrdit dalšími studiemi.
NGAL (neutrophil gelatinase associated lipocalin)
Jedná se o protein upregulovaný v buňkách vystavených zátěži a také v buňkách tumoru. Má protektivní účinky při ischémii tkání. Zvýšené hladiny jsou spojené se sníženým přežitím bez progrese u pacientů léčených sunitinibem (3,4 vs. 8,2 měsíce) (52). Jako diagnostický marker je NGAL studován v souvislosti s histologickými typy RCC – nejvyšší exprese byla nalezena u papilárního a chromofobního renálního karcinomu, a možností časné diagnostiky metastatické progrese RCC (53).
CRP (C-reaktivní protein)
CRP je protein akutní fáze, jehož plazmatické koncentrace vzrůstají jako odpověď na infekce, trauma, autoimunitní inzulty či malignitu. Zvýšené hladiny CRP (již nad 4 ng/ml) byly prokázány jako nezávislý prediktor špatné prognózy celkového přežití u pacientů s RCC (54). Jako specifický prediktivní marker efektu biologické léčby mRCC není použitelný.
Trombocytóza a leukocytóza
Trombocytóza a leukocytóza jsou součástí několika prediktivních nomogramů (8, 55, 56). Nicméně, poslední práce prognostickou hodnotu hladiny trombocytů nepotvrzují (57).
Cirkulující endoteliální buňky
Cirkulující endoteliální buňky (CECs) jsou zralé buňky endotelu cév, které se uvolňují z intimy cév při fyziologickém obratu endotelií. Zvyšují také svoji četnost při různých chorobných stavech spojených s poškozením endotelu, jako jsou infarkt myokardu, rejekce transplantovaných štěpů, infekčních nemocích nebo při maligních onemocněních (58). Byla nalezena korelace mezi hladinami cirkulujících endoteliálních buněk a PFS u pacientů léčených bevacizumabem pro kolorektální karcinom. U respondérů bylo zaznamenáno signifikantní snížení hladin CEC, signifikantně delší PFS měli pacienti s nižší výchozí hladinou CEC, tedy méně než 40 CEC/ml periferní krve (59). Korelaci mezi počty CEC a odpovědí na léčbu mRCC sunitinibem prokázal Gruenwald et al. Časné zvýšení počtu CEC u respondérů na léčbu TKI korelovalo také s delším PFS (60). Progenitorové buňky (CEP) uvolňované z kostní dřeně osídlují ischemické tkáně a podílejí se na novostavbě cév, v periferní krvi jsou též zmnožené při progresi nádorového růstu. Farace et al. popsal ve studii s pěti pacienty zvýšení počtů cirkulujících progenitorových buněk (CEP) u respondérů na antiangiogenní léčbu kombinovanou s cisplatinou (61). V další studii však vztah mezi zvýšeným počtem cirkulujících progenitorových buněk (CD45dim, CD34+ a VEGFR2+) a efektem sunitinibu u mRCC neprokázal. Signifikantně kratší však byl PFS a OS (62). Možnost užití CEC a CEP jako časných markerů efektu podávané antiangiogenní léčby musí prokázat další studie.
MARKERY STANOVOVANÉ V MOČI
NMP-22 (nuclear matrix protein-22) je biomarker užívaný ke screeningu a monitoraci karcinomu močového měchýře uznaný FDA (US Food and Drug Administration). Vyšší hladiny v moči byly nalezeny také u pacientů s RCC (63). Studovány byly též močové hladiny AQP1 (aquaporinu 1) a adipofilinu, ukázaly se jako specifické i dostatečně senzitivní biomarkery k časné diagnostice renálního karcinomu z proximálních tubulů (64).
DALŠÍ
Možnost zhodnocení efektu již podávané léčby a v krátkém intervalu od prvního podání je užitečné pro další plánování léčby. Jedním z vedlejších efektů podávání antiangiogenní léčby ovlivňující VEGF dráhu je hypertenze. Její příčiny nejsou přesně známy, udáván je negativní vliv TKI na produkci NO. Byl však nalezen signifikantní efekt léčby a lepší PFS u pacientů s rozvinutou hypertenzí (tedy více než 140/90 mm Hg) způsobenou léčbou sunitinibem (65). Rozvoj hypertenze lze tedy považovat na časný indikátor účinnosti léčby sunitinibem. Samotné vyšetřování zobrazovacími metodami v krátkém odstupu od zahájení léčby lze užít nejen jako zhodnocení efektu léčby, ale dle míry změn sledovaných parametrů je možno i predikovat další chování tumoru. Nakaigawa et al. V roce 2012 hodnotil přežití u pacientů s mRCC před léčbou vyšetřených FDG PET-CT v závislosti na hodnotě nejvyšší naměřené aktivity FDG akumulujících ložisek. S vyšším SUVmax byl trend k horší prognóze. V jiné studii Ueno et al. v roce 2013 udává, že vyšetření FDG PET-CT jeden měsíc po zahájení léčby může být použito k predikci další odpovědi na léčbu, lepší efektivita byla prokázána u případů, kdy SUVmax pokleslo o 20 % a více (66).
DISKUSE
Jako nadějné prediktory přežití pacientů léčených TKI zatím můžeme uvažovat VHL status tumorózní tkáně, kdy VHL naivní tumory vykazují horší prognózu přežití a jedná se většinou o agresivnější nádory. Cirkulující VEGF a poměr jeho izoforem může predikovat přežití při léčbě TKI u tumorů s deficitem pVHL. Nadějné výsledky přináší také genetická analýza SNP genů kódujících VEGF, nicméně jsou potřeba další studie. Příznivou prognózu lze předpokládat u tumorů s vysokou expresí tkáňové CAIX, na rozdíl od většiny solidních tumorů, kde se jedná spíše o negativní znak.
Je zřejmé, že genetická analýza je v současné době kruciální v diferenciální diagnostice tumorů (67). Zhodnocení exprese genů na úrovni mRNA přináší přesnou informaci o nitrobuněčných procesech a aktivitě sledovaných signálních drah (68), využití těchto informací v praxi je však ještě otázkou budoucnosti. Karcinom ledviny je však heterogenní skupinou nejen z hlediska histologických typů, ale z pohledu genetické diagnostiky je obrovská variabilita i v rámci jedné histologické jednotky. Dokonce i v rámci jedné jediné nádorové léze byla při sekvenčním genetickém vyšetření vzorků z více míst tumoru prokázána výrazná genetická heterogenita, kdy shodných somatických mutací pro každý vyšetřovaný region tumoru je méně než jedna třetina (69). Tyto zásadní informace mohou být klíčem pro vysvětlení odlišného chování tumorů v rámci jediné histopatologické kategorie a také odlišné léčebné odpovědi na cílenou léčbu a rozvoje rezistence k léčbě. Spoléhání se na vyšetření jediného bioptického vzorku může narušovat koncept tzv. personalizované medicíny.
ZÁVĚR
Možnost odhadnutí odpovědi na cílenou léčbu by zlepšila a zrychlila strategii léčby odhalením primárně rezistentních tumorů, podstatný je také aspekt ekonomický. Karcinom ledviny je však heterogenní skupinou jak do počtu histopatologických typů, tak z pohledu genetické variability v rámci jedné histologické kategorie a dokonce i v rámci jednoho nádoru. Snaha o nalezení vhodného molekulárního markeru je navíc ztížena i komplexností a provázáním signálních drah růstu a angiogeneze nádorů. Specifický biomarker, který by predikci umožnil, tedy zatím nemáme. Přesná diagnostika nádoru se v současné době neobejde bez genetického vyšetření a právě genetické mapování tkáně tumoru by mohlo být klíčem k aplikaci personalizované medicíny.
Došlo: 23. 7. 2013.
Přijato: 2. 10. 2013.
Kontaktní adresa
MUDr. Ivan Trávníček
Urologická klinika UK a FN
Edvarda Beneše 1128/13, 305 99 Plzeň
e-mail: travniceki@fnplzen.cz
Článek byl podpořen projektem NT 12010-5/2011 a MZ ČR RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Střet zájmů: žádný.
Sources
1. SVOD online http://www.svod.cz/
2. Kawaciuk I. Prognóza karcinomu ledviny (2. Epidemiologie). Praha: Galén 2005.
3. Motzer RJ, Mazumdar M, Bacik J, et al. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999; 17 : 2530–2540.
4. Motzer RJ, Bacik J, Murphy BA, et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20 : 289–296.
5. Ljungberg B, Cowan NC, Hanbury DC, et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010; 58(3): 398–406.
6. Vyzula R, Adámková-Krákorová D, Babjuk M, et al. Modrá kniha České onkologické společnosti. 16. vydání. 2013; 103–112.
7. Molina AM, Motzer RJ. Clinical Practice Guidelines for the Treatment of Metastatic Renal Cell Carcinoma: Today and Tomorrow The Oncologist 2011; 16(Suppl 2): 45–50.
8. Heng DYC, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol 2009; 27 : 5794–5799.
9. Slíva J. Temsirolimus. Farmakoterapie 2008; 2 : 150–151.
10. Motzer RJ, Bukowski RM, Figlin RA, et al. Prognostic nomogram for sunitinib in patients with metastatic renal cell carcinoma. Cancer 2008; 113 : 1552–1558.
11. Karakiewicz PI, Sun M, Bellmunt J, et al. Prediction of progressionfree survival rates after bevacizumab plus interferon versus interferon alone in patients with metastatic renal cell carcinoma: comparison of a nomogram to the Motzer criteria. Eur Urol 2011; 60 : 48–56.
12. Gontero P, Sun M, Antonell A, et al. External validation of the preoperative Karakiewicz nomogram in a large multicentre series of patients with renal cell carcinoma. World J Urol 2013; 31 : 1285–1290.
13. Yao M, Yoshida M, Kishida T, et al. VHL tumor suppressor gene alterations associated with good prognosis in sporadic clear-cell renal carcinoma. J Natl Cancer Inst 2002; 94 : 1569–1575.
14. Patard J-J, Fergelot P, Karakiewicz PI, et al. Low CAIX expression and absence of VHL gene mutation are associated with tumor aggressiveness and poor survival of clear cell renal cell carcinoma. Int J Cancer 2008; 123 : 395–400.
15. Schraml P, Struckmann K, Hatz F, et al. VHL mutations and their correlation with tumour cell proliferation, microvessel density, and patient prognosis in clear cell renal cell carcinoma. J Pathol 2002; 196 : 186–193.
16. Rini BI, Jaeger E, Weinberg V, et al. Clinical response to therapy targeted at vascular endothelial growth factor in metastatic renal cell carcinoma: impact of patient characteristics and Von Hippel-Lindau gene status. BJU Int 2006; 98 : 756–762.
17. Patard JJ, Rioux-Leclercq N, Masson D, et al. Absence of VHL gene alteration and high VEGF expression are associated with tumour aggressiveness and poor survival of renal-cell carcinoma. J Cancer 2009; 101 : 1417–1424.
18 Banumathy G, Cairns P. Signaling pathways in renal cell carcinoma. Cancer Biol Ther 2010; 7 : 658–664.
19. Ke Q, Costa M. Hypoxia-Inducible Factor-1 (HIF-1). Mol Pharmacol 2006; 70 : 1469–1480.
20. Eisengart LJ, MacVicar GR, Yang XJ. Predictors of Response to Targeted Therapy in Renal Cell Carcinoma. Arch Pathol Lab Med 2012; 136 : 490–495.
21. Wiesener MS, Munchenhagen PM, Berger I, et al. Constitutive activation of hypoxia-inducible genes related to overexpression of hypoxia-inducible factor-1alpha in clear cell renal carcinomas. Cancer Res 2001; 61 : 5215–2522.
22. Lidgren A, Hedberg Y, Grankvist K, et al. The expression of hypoxia-inducible factor 1alpha is a avorable independent prognostic factor in renal cell carcinoma. Clin Cancer Res 2005; 11 : 1129–1135.
23. Lidgren A, Hedberg Y, Grankvist K, et al. Hypoxia-inducible factor 1a expression in renal cell carcinoma analyzed by tissue microarray. Eur Urol 2006; 50 : 1272–1277.
24. Klatte T, Seligson DB, Riggs SB, et al. Hypoxia-inducible factor 1 alpha in clear cell renal cell carcinoma. Clin Cancer Res 2007; 13 : 7388–7393.
25. Patel P, Chadalavada R, Ishill N, et al. Hypoxia-inducible factor (HIF) 1a and 2a levels in cell lines and human tumor predicts response to sunitinib in renal cell carcinoma (RCC). J Clin Oncol (Meeting Abstracts) 2008; 26(Suppl): 5008.
26. Toschi A, Lee E, Gadir N, Ohh M, Foster DA. Differential Dependence of Hypoxia-inducible Factors 1α and 2α on mTORC1 and mTORC2. J Biol Chem 2008; 283(50): 34495–34499.
27. Gordan JD, Lal P, Dondeti VR, et al. HIF-alpha effects on c-Myc distinguish two subtypes of sporadic VHL-deficient clear cell renal carcinoma. Cancer Cell 2008; 14(6): 435–446.
28. Na X, Wu G, Ryan CK, et al. Overproduction of vascular endothelial growth factor related to von Hippel-Lindau tumor suppressor gene mutations and hypoxia-inducible factor-1 alpha expression in renal cell carcinomas. J Urol 2003; 170 : 588–592.
29. Paradis V, Lagha NB, Zeimoura L, et al. Expression of vascular endothelial growth factor in renal cell carcinomas. Virchows Arch 2000; 436 : 351–356.
30. Rioux-Leclercq N, Fergelot P, Zerrouki S, et al. Plasma level and tissue expression of vascular endothelial growth factor in renal cell carcinoma: a prospective study of 50 cases. Hum Pathol 2007; 38 : 1489–1495.
31. Scartozzi M, Bianconi M, Faloppi L, et al. VEGF and VEGFR polymorphisms affect clinical outcome in advanced renal cell carcinoma patients receiving first-line sunitinib. Br J Cancer. 2013 Mar 19; 108(5): 1126–1132. http: //www.ncbi.nlm.nih.gov/pubmed/23511629
32. Driessen A, Landuyt W, Pastorekova S, et al. Expression of carbonic anhydrase IX (CA IX), a hypoxia-related protein, rather than vascular-endothelial growth factor (VEGF), a pro-angiogenic factor, correlates with an extremely poor prognosis in esophageal and gastric adenocarcinomas. Ann Surg 2006; 243 : 334–340.
33. Maseide K, Kandel R, Bell R, et al. Carbonic anhydrase IX as a marker for poor prognosis in soft tissue sarcoma. Clin Cancer Res 2004; 10 : 4464.
34. Phuoc NB, Ehara H, Gotoh T, et al. Prognostic value of the coexpression of carbonic anhydrase IX and vascular endothelial growth factor in patients with clear cell renal cell carcinoma. Oncol Rep 2008; 20 : 525–530.
35. Bui MHT, Seligson D, Han K-R, et al. Carbonic anhydrase IX is an independent predictor of survival in advanced renal clear cell carcinoma: implications for prognosis and therapy. Clin Cancer Res 2003; 9 : 802–811.
36. Patard JJ, Fergelot P, Karakiewicz PI, et al. Low CAIX expression and absence of VHL gene mutation are associated with tumor aggressiveness and poor survival of clear cell renal cell carcinoma. Int J Cancer 2008; 123 : 395–400.
37. Choueiri TK, Regan MM, Rosenberg JE, et al. Carbonic anhydrase IX and pathological features as predictors of outcome in patients with metastatic clear-cell renal cell carcinoma receiving vascular endothelial growth factor targeted therapy. BJU Int 2010; 106 : 772–778.
38. Pópulo H, Lopes JM, Soares P. The mTOR Signalling Pathway in Human Cancer. Int J Mol Sci 2012; 13 : 1886–1918.
39. Chaux A, Schultz L, Albadine R, et al. Immunoexpression status and prognostic value of mammalian target of rapamycin and hypoxia-induced pathway members in papillary cell renal cell carcinomas. Hum Pathol 2012; 43(12): 2129–2137.
40. Schultz L, Chaux A, Albadine R, Hicks J, et al. Immunoexpression status and prognostic value of mTOR and hypoxia-induced pathway members in primary and metastatic clear cell renal cell carcinomas. Am J Surg Pathol 2011; 35(10): 1549–1556.
41. Pantuck AJ, Seligson DB, Klatte T, et al. Prognostic relevance of the mTOR pathway in renal cell carcinoma: implications for molecular patient selection for targeted therapy. Cancer 2007; 109 : 2257–2267.
42. Cho D, Signoretti S, Dabora S, et al. Potential histologic and molecular predictors of response to temsirolimus in patients with advanced renal cell carcinoma. Clin Cancer Rev 2007; 1 : 85–91.
43. Youssif T, Tanguay S, Alam-Fahmy M, Koumakpayi I, Sircar K. Expression of PI3K/AKT/mTOR pathway in renal cell carcinoma metastases: correlation with pathologic findings and survival. J Urol 2008; 179(4 Suppl): 210.
44. Velickovic M, Delahunt B, McIver B, Grebe SK. Intragenic PTEN/MMAC1 loss of heterozygosity in conventional (clear-cell) renal cell carcinoma is associated with poor patient prognosis. Mod Pathol 2002; 15 : 479–485.
45. Merseburger AS, Hennenlotter J, Kuehs U, et al. Activation of PI3K is associated with reduced survival in renal cell carcinoma. Urol Int 2008; 80(4): 372–377.
46. Figlin RA, de Souza P, McDermott D, et al. Analysis of PTEN and HIF-1alpha and correlation with efficacy in patients with advanced renal cell carcinoma treated with temsirolimus versus interferon-alpha. Cancer 2009; 115(16): 3651–3660.
47. Paule B, Bastien L, Deslandes E, et al. Soluble Isoforms of Vascular Endothelial Growth Factor Are Predictors of Response to Sunitinib in Metastatic Renal Cell Carcinomas. PLoS ONE 2010; 5(5): e10715.
48. Niers TMH, Richel DJ, Meijers JCM, Schlingemann RO. Vascular Endothelial Growth Factor in the Circulation in Cancer Patients May Not Be a Relevant Biomarker. PLoS ONE 2011; 6(5): e19873.
49. Závada J, Závadová Z, Zaťovicová M, et al. Soluble form of carbonic anhydrase IX (CA IX) in the serum and urine of renal carcinoma patients. Br J Cancer 2003; 89 : 1067–1071.
50. Zhou GX, Ireland J, Rayman P, et al. Quantification of carbonic anhydrase IX expression in serum and tissue of renal cell carcinoma patients using enzyme-linked immunosorbent assay: prognostic and diagnostic potentials. Urology 2010; 75 : 257–261.
51. Li G, Feng G, Gentil-Perret A, et al. Serum carbonic anhydrase 9 level is associated with postoperative recurrence of conventional renal cell cancer. J Urol 2008; 180 : 510–513, discussion 513–514.
52. Porta C, Paglino C, De Amici M, et al. Predictive value of baseline serum vascular endothelial growth factor and neutrophil gelatinase-associated lipocalin in advanced kidney cancer patients receiving sunitinib. Kidney Int 2010; 77 : 809–815.
53. Barresi V, Ieni A, Bolignano D, et al. Neutrophil gelatinase-associated lipocalin immunoexpression in renal tumors: correlation with histotype andhistological grade. Oncol Rep 2010; 24(2): 305–310.
54. Steffens S, Köhler A, Rudolph R, et al. Validation of CRP as prognostic marker for renal cell carcinoma in a large series of patients. BMC Cancer 2012; 12 : 399.
55. Motzer RJ, Bukowski RM, Figlin RA, et al. Prognostic nomogram for sunitinib in patients with metastatic renal cell carcinoma. Cancer 2008; 113 : 1552–1558.
56. Choueiri TK, Garcia JA, Elson P, et al. Clinical factors associated with outcome in patients withmetastatic clear-cell renal cell carcinoma treated with vascular endothelial growth factor-targeted therapy. Cancer 2007; 110 : 543–550.
57. Brookman-May S, May M, Ficarra V, et al. Does preoperative platelet count and thrombocytosis play a prognostic role in patients undergoing nephrectomy for renal cell carcinoma? Results of a comprehensive retrospective series. World J Urol 2013; 31(5): 1309–1316. doi: 10.1007/s00345-012-0931-0. Epub 19. 8. 2012.
58. Mancuso P, Burlini A, Pruneri G, et al. Resting and activated endothelial cells are increased in the peripheral blood of cancer patients. Blood 2001; 97 : 3658–3661.
59. Ronzoni M, Manzoni M, Mariucci S, et al. Circulating endothelial cells and endothelial progenitors as predictive markers of clinical response to bevacizumab-based first-line treatment in advanced colorectal cancer patients. Ann. Oncol 2010; 21 : 2382–2389.
60. Gruenwald V, Beutel G, Schuch-Jantsch S, et al. Circulating endothelial cells arean early predictor in renal cell carcinoma for tumor response to sunitinib. BMC Cancer 2010; 10 : 695.
61. Farace F, Massard C, Borghi E, Bidart JM, Soria JC. Vascular disrupting therapy-induced mobilization of circulating endothelial progenitor cells. Ann Oncol 2007; 18 : 1421–1422.
62. Farace F, Gross-Goupil M, Tournay E, et al. Levels of circulating CD45dim, CD34+, VEGFR2+ progenitor cells correlate with outcome in metastatic renal cell carcinoma patients treated with tyrosine kinase inhibitors. B J Cancer 2011; 104(7): 1144–1150.
63. Kaya K, Ayan S, Gokce G, et al. Urinary nuclear matrix protein 22 for diagnosis of renal cell carcinoma. Scand J Urol Nephrol 2005; 39 : 25–29.
64. Morrissey JJ, London AN, Luo J, Kharasch ED. Urinary biomarkers for the early diagnosis of kidney cancer. Mayo Clin Proc 2010; 85(5): 413hler421.
65. Rini BI, Cohen DP, Lu DR, et al. Hypertension as a biomarker of efficacy in patients with metastatic renal cell carcinoma treated with sunitinib. J Natl Cancer Inst 2011; 103(9): 763–773.
66. Nathan P, Vinayan A. Imaging techniques as predictive and prognostic biomarkers in renal cell carcinoma. Ther Adv Med Oncol 2013; 5(2): 119–131.
67. Branžovský J, Martínek P, Baulet K, et al. Využití molekulární genetiky v diferenciální diagnostice nádorů ledvin (The usage of molecular genetics in differential diagnosis of renal tumours). Ces Urol 2012; 16(4): 214–221.
68. Steiner P, Hora M, Stehlik P, et al. Tubulocystic renal cell carcinoma: is there a rational reason for targeted therapy using angiogenic inhibition? Analysis of seven cases. Virchows Arch 2013; 462(2): 183–192.
69. Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med 2012; 366 : 883–892.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2013 Issue 4-
All articles in this issue
- Metoda akcelerované rehabilitace v perioperační péči u urologických výkonů
- Současné možnosti predikce účinnosti systémové léčby metastatického karcinomu ledviny
- Je nutná biopsie tranzicionální zóny při rebiopsii prostaty?
- Laparoskopická adrenalektomie ve FN Olomouc – patnáctileté zkušenosti
- Kvalita života pacientov vo vybraných dialyzačných centrách na Slovensku
- Intermitentní katetrizace u pacientů po spinálním poranění: prospektivní sledování vlivu edukace pacienta na výskyt komplikací
- Abdominoskrotální hydrokéla
- Endometrióza močovodu
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza močovodu
- Abdominoskrotální hydrokéla
- Je nutná biopsie tranzicionální zóny při rebiopsii prostaty?
- Kvalita života pacientov vo vybraných dialyzačných centrách na Slovensku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

