-
Medical journals
- Career
Využití fotodynamické diagnostiky a úzkopásmového zobrazení v diagnostice a léčbě svalovinu neinfiltrujících nádorů močového měchýře
Authors: Antonín Brisuda; Jan Hrbáček; Marek Babjuk
Authors‘ workplace: Urologická klinika 2. LF UK a FN Motol, Praha
Published in: Ces Urol 2013; 17(2): 79-87
Category: Review article
Overview
Fotodynamická diagnostika (PDD) a úzkopásmové zobrazení (NBI) jsou doplňkové technologie cystoskopie a transuretrální resekce (TUR) svalovinu neinfiltrujících nádorů močového měchýře v bílém světle. Zvýšením senzitivity je umožněn dokonalejší TUR a stanovení přesnější diagnózy. Při PDD je fotosenzibilizátor instilován před TUR nebo cystoskopií do měchýře a jeho aktivita se poté projeví fluorescencí v „modrém“ světle. PDD signifikantně zvyšuje detekci především špatně diferencovaných lézí. V několika studiích byla prokázána schopnost PDD redukovat počet recidiv a prodloužení doby do vzniku recidivy. Limitací je vysoká cena a vyšší náročnost pro pacienta i personál. NBI je jednoduchá a levná metoda. Spočívá v zúžení vlnového spektra světelného paprsku filtrem. Oproti samostatnému bílému světlu má signifikantně vyšší detekční schopnost drobných lézí měchýře včetně recidiv a navíc zpřesňuje okraje nádorových lézí. Rozsáhlé prospektivní randomizované studie k určení významu NBI právě probíhají. Velmi žádoucí by bylo provedení randomizované prospektivní studie k porovnání obou metod navzájem.
Klíčová slova:
karcinom močového měchýře, svalovinu neinfiltrující nádor, transuretrální resekce, narrow band imaging, fotodynamická diagnostika.ÚVOD
Nejčastějším histologickým typem nádorů močového měchýře je uroteliální karcinom. Zhruba 75 % z nich tvoří svalovinu neinfiltrující nádory, tedy nádory patologické klasifikace pTa a pT1. Jejich významným rysem je sklon ke vzniku recidivy. V průběhu sledování může také dojít ke zhoršení stadia. Nádory byly rozděleny do prognostických skupin podle pravděpodobnosti vzniku recidivy a progrese (1). Základem pro zařazení do jednotlivých skupin je šest klinických a histologických parametrů: počet nádorů, velikost nádoru, předchozí anamnéza nádoru měchýře, patologické stadium, přítomnost karcinomu in situ (CIS) a histologická diferenciace (grade). Podle těchto parametrů jsou jednotlivých nádorům přiřazeny body, jejichž sečtením je určeno výsledné skóre (tab. 1). Toto skóre je podkladem pro zařazení do skupiny s nízkým, středním nebo vysokým rizikem pro vznik recidivy a progrese (tab. 2, 3). Dalším významným prognostickým faktorem je výsledek kontrolní cystoskopie 3 měsíce od trans-uretrální resekce (TUR) primozáchytu nádoru (2). Bylo zjištěno, že míra výskytu časných recidiv se velmi výrazně liší mezi jednotlivými institucemi (3). Za zjištěné rozdíly je do značné míry zodpovědná kvalita TUR provedená jednotlivými urology. Nezastupitelnou úlohu hrají kvalitní výukové programy pro mladé urology (4). Přítomnost svaloviny detrusoru v preparátu resekce primozáchytu nezávisle predikuje přítomnost recidivy při první kontrolní cystoskopii, a je tak zásadním indikátorem kvality resekce, která je dána zkušeností operatéra (5, 6). Cílem kvalitní TUR je odstranění nádoru z měchýře a stanovení přesné diagnózy tak, aby byla správně zvolena odpovídající léčba. Podhodnocení stadia onemocnění může mít zcela zásadní vliv na osud nemocného, neboť způsob léčby se může významně lišit. Ponechání nádoru v močovém měchýři odpovídá za vznik „časné recidivy“. Pokud se navíc jedná o CIS nebo tumor o nízkém stupni diferenciace, opět může být výsledkem nesprávný léčebný postup. Ve snaze o provedení dokonalejší endoskopie a TUR byly vyvinuty a do klinické praxe zavedeny nové technologie, které zlepšují vizualizaci maligních lézí v močovém měchýři.
Table 1. EORTC skórovací systém pro určení míry vzniku recidivy a progrese (zdroj: EAU doporučení 2012) Table 1. The EORTC scoring system for recurrence and progression (source: EAU guidelines 2012) 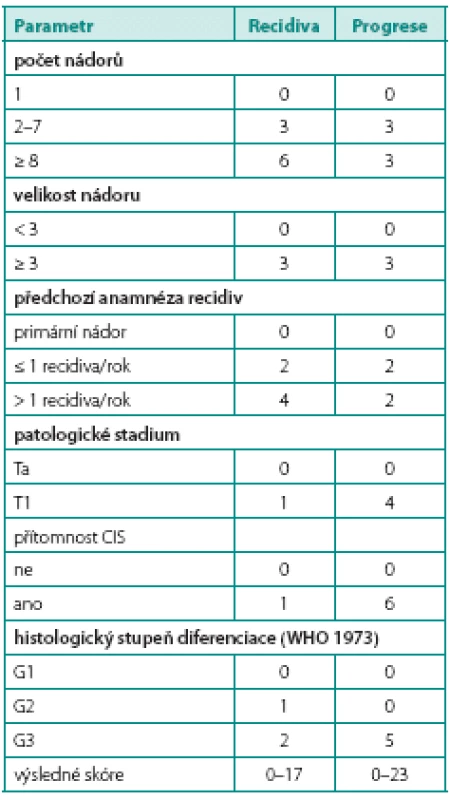
EORTC – European Organisation for Research and Treatment of Cancer, CIS – carcinoma in situ, WHO – World Health Organisation Table 2. Skóre a pravděpodobnosti výskytu recidivy (zdroj: EAU doporučení 2012) Table 2. The risk scores and probabilities of recurrence (source: EAU guidelines 2012) 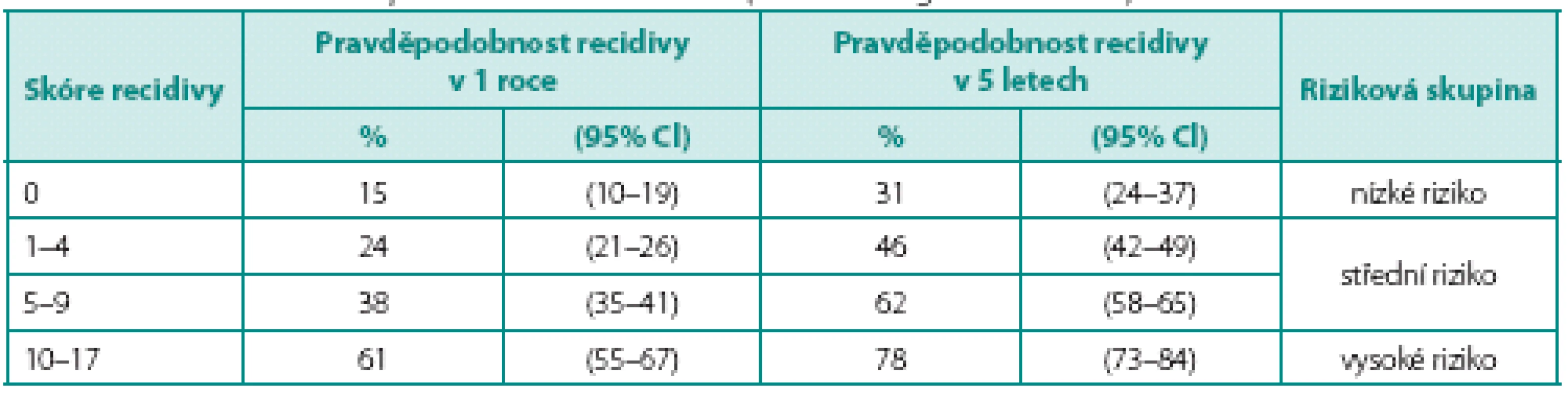
Table 3. Skóre a pravděpodobnosti výskytu progrese (zdroj: EAU doporučení 2012) Table 3. The risk scores and probabilities of progression (source: EAU guidelines 2012) 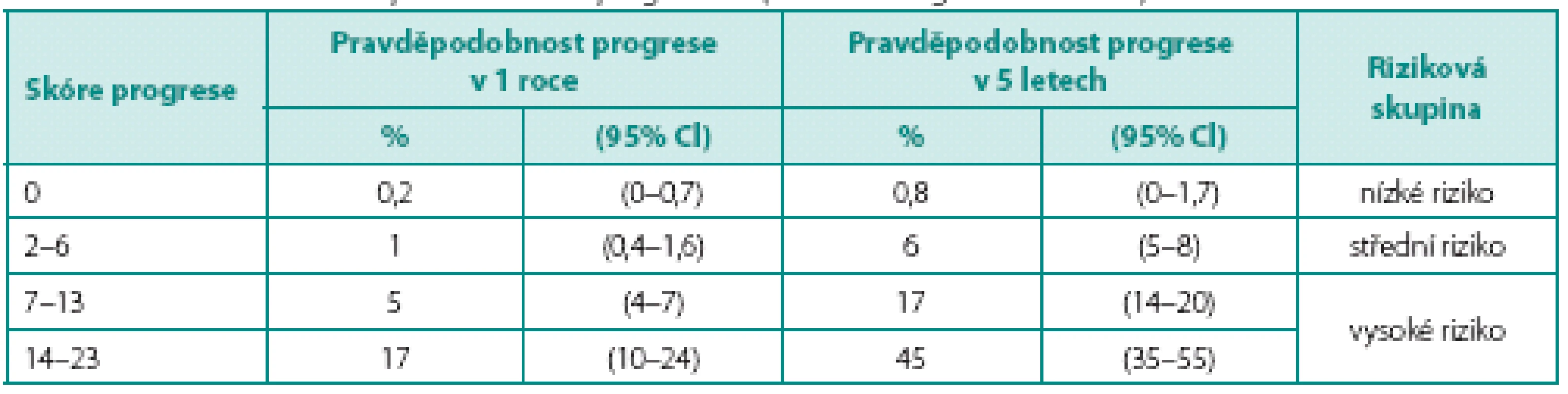
FOTODYNAMICKÁ DIAGNOSTIKA
Princip
Fotodynamická diagnostika (Photodynamic diagnosis, PDD) je založena na principu fotosenzibilizace určitých látek, které jsou absorbovány buňkami s vysokou proliferační aktivitou. Fotosenzibilizátory používané v současné době jsou absorbovány maligními buňkami v poměru 20 : 1 v porování s ostatními buňkami sliznice měchýře (7). V urologii je užívána kyselina 5-amino-levulová (ALA) a její hexyl ester (HAL). Endogenní ALA je přirozeným prekurzorem fotoaktivního protoporfyrinu IX (PpIX) při biosyntéze hemu. Biosyntéza hemu je relativně pomalá, a proto lze přidáním ALA signifikantně zvýšit koncentraci PpIX v buňce (8). Buňka se poté vizualizuje v modrém světle o vlnové délce 375–440 nm červenou fluorescencí. Maligní nádory jsou zobrazeny jako ostře ohraničené léze o jasné červené barvě, zatímco ostatní struktury, které také částečně akumulují fotosenzibilizátor, jsou růžové a neohraničené. Klinická využitelnost při detekci tumorů močového měchýře byla potvrzena v pilotních studiích v roce 1994. Její limitací je nutnost aplikace ve vysokých koncentracích na poměrně dlouhou dobu. Ani tak není její distribuce ve tkáni nádoru homogenní. Předpokladem bylo, že lipofilní derivát ALA by lépe penetroval do buněk, a tím zlepšil vizualizaci nádoru. Tyto nároky splňoval HAL. HAL produkuje minimálně dvojnásobnou fluorescenci než ALA při mnohonásobně nižší koncentraci (9). Navíc jeho distribuce probíhá ve všech vrstvách urotelu, na rozdíl od ALA, která se koncentruje pouze povrchově. V současné době je registrován pro použití v urologii pouze HAL. Kontraindikací použití HAL je přecitlivělost na kteroukoliv složku přípravku, porfyrie a těhotenství. V klinické praxi je roztok fotosenzibilizátoru aplikován zhruba 1–2 hodiny před TUR do močového měchýře pomocí katétru a na operačním sále je možné přepínat bílé světlo do modrého a naopak.
Image 1. Princip zapojení fluorescenční cystoskopie Fig. 1. Principle of fluorescent cystoscopy set up 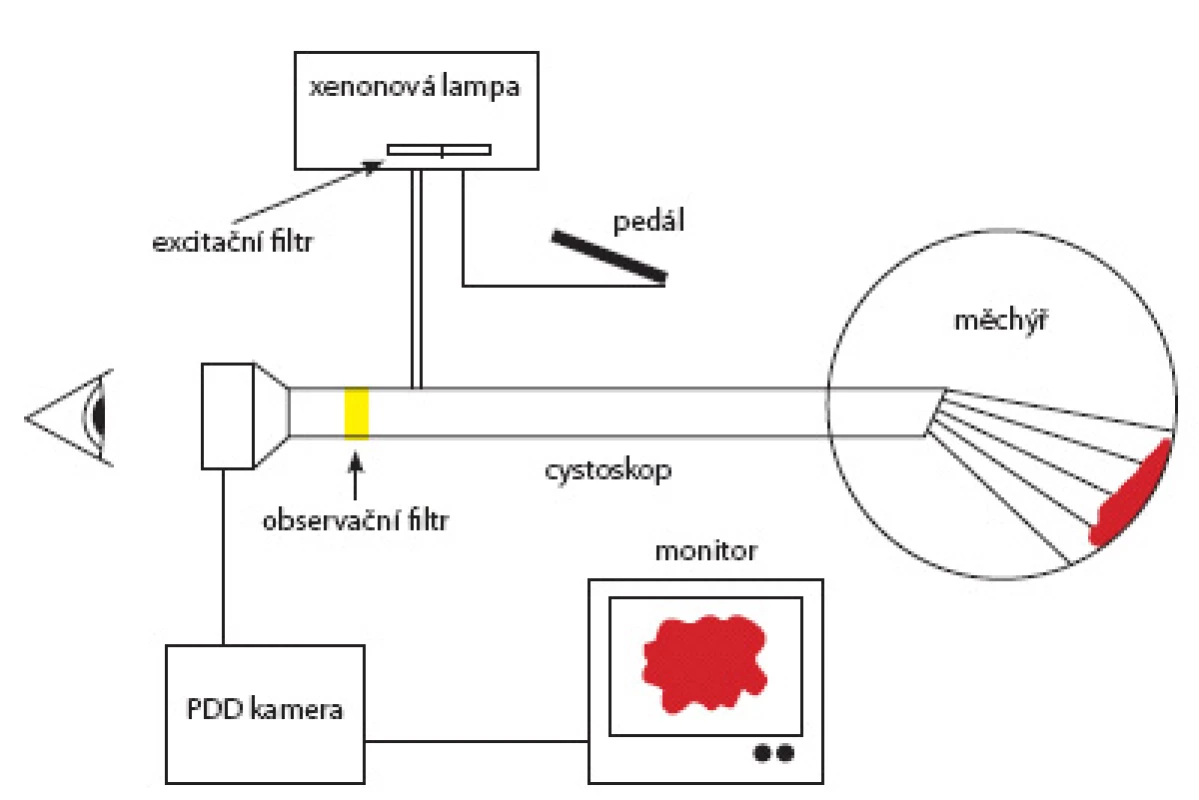
Využití
Schopnost PDD cystoskopie detekovat více tumorů než klasická cystoskopie v bílém světle byla prokázána v několika studiích (10–12). Senzitivita této metody je 80–100 %. Zejména to platí pro zlepšení detekce CIS, což může významně ovlivnit další strategii léčby a prognózu pacienta. Grossman et al. publikovali v roce 2007 výsledky multicentrické studie, ve které porovnávali schopnost PDD a cystoskopie v bílém světle (BS) detekovat CIS u 298 nemocných se známým nebo suspektním karcinomem močového měchýře. Proporce nemocných s minimálně jednou lézí CIS detekovanou pouze pomocí PDD byla statisticky významná (p = 0,0022) (13). Ve stejné studii se zabývali i schopností PDD detekovat pTa a pT1 karcinomy. Mezi 298 pacienty byl detekován pomocí PDD navíc alespoň jeden papilární Ta tumor u 29% nemocných a alespoň jeden T1 tumor u 15% nemocných. Ze 40 v PDD navíc detekovaných lézí bylo 37 pTa tumorů a 3 pT1 tumory. Senzitivita, neboli detekční schopnost (anglicky detection rate = DR) pro Ta a T1 nádory v PDD byla 95%, resp. 95%, zatímco v BS 83%, resp. 86% (14). Jocham et al. vyšetřili 146 nemocných s tumorem močového měchýře pomocí BS a PDD, odebrali vzorky ze všech detekovaných lézí zvlášť a vyhodnotili rozdíly v léčebné strategii, které vyplynuly ze získaných dat. Ze všech detekovaných tumorů bylo 96% zjištěno pomocí PDD a 77% pomocí BS. Obzvláště patrné byly rozdíly v detekci dysplazií a CIS (93% vs. 48%, resp. 95% vs. 68%) a v detekci povrchových papilárních tumorů (96% vs. 85 %). Celkem u 22% nemocných měla PDD vliv na změnu léčby (15). Při zvýšení senzitivity logicky narůstá počet nesprávně pozitivních výsledků a klesá specificita. Platí to zejména při lokalizaci nádoru v trigonu, oblasti hrdla měchýře a přední stěny. Vysvětluje to častější přítomnost zánětlivých změn v uvedených oblastech (16). Specificita je také snížena při časných re-resekcích a po předchozích intravezikálních instilacích BCG. Předpokládá se, že zlepšení detekce maligních lézí měchýře, a tedy dokonalejší TUR by se měly projevit ve snížení frekvence recidiv. Babjuk et al. hodnotili vliv PDD na délku intervalu bez recidivy (RFS). Celkem 122 nemocných s primozáchyty i recidivami bylo randomizováno do dvou skupin, jedna ošetřena ve BS a druhá v PDD (s použitím ALA). Statisticky významně nižší počet recidiv ve skupině nemocných ošetřených v PDD byl ve 3, 12 i 24 měsících. Tento výsledek platil pro mnohočetné a recidivující nádory, neplatil pro solitární a primární léze (17). Naopak švédská interinstitucionální prospektivní randomizovaná studie s ALA (300 nemocných) neprokázala žádný signifikantní rozdíl po 12 měsících sledování, co se týče intervalu bez recidivy a intervalu bez progrese. Autoři to vysvětlují vyšším počtem povrchových a recidivujících LG tumorů, nižším počtem CIS, krátkou dobou instilace ALA před endoskopií a nedostatkem zkušeností s PDD (18). Stenzl et al. uskutečnili prospektivní randomizovanou studii s 814 pacienty s recidivujícími tumory měchýře. Ve skupině PDD byla použita HAL s minimální toxicitou. Po 9 měsících sledování dospělo k recidivě signifikantně menší procento nemocných ve skupině s PDD (p = 0,026). Relativní snížení míry vzniku recidiv bylo 12% (19). V nejnovější studii s 551 nemocnými léčených pomocí HAL versus BS dosahovala doba sledování dokonce 53,0 respektive 55,1 měsíců. Ve skupině s HAL byl zaznamenán větší podíl nemocných bez recidivy (31,8% vs. 38%) a také doba do první recidivy byla signifikatně vyšší u nemocných léčených pomocí HAL (16,4 vs. 9,4 měsíců, p = 0,04). Navíc byl zaznamenán trend k zachování měchýře ve skupině s HAL (20). Geavlete et al. zařadili do prospektivní randomizované studie 362 nemocných s primozáchyty měchýře. U skupiny PDD byl použit HAL. U všech byla aplikována jednorázová instilace mitomycinu po TUR, nemocní ve středně rizikové skupině pokračovali v instilacích ambulantně a nemocní s vysokým rizikem dostali BCG. Četnost recidiv ve 3 měsících, jednom a 2 letech byla významně nižší ve skupině s HAL (21).
NARROW BAND IMAGING
Princip
Úzkopásmé zobrazení (Narrow band imaging, NBI) je nová optická metoda s vysokým rozlišením bez použití barviva nebo kontrastní látky, která zpřesňuje viditelnost patologických lézí v močovém měchýři. Využívá principu zúžení světelného spektra pouze na vlnové délky 415 a 540 nm. Obě jsou intenzivně absorbovány hemoglobinem. Kratší vlnové délky mají nižší penetraci a znázorní lépe povrchové cévní struktury. Delší vlnové délky pronikají hlouběji a znázorní hlubší silnější cévy. Vzhledem k tomu, že ostatní vlnové délky světelného spektra nejsou přítomny, znásobuje se optický kontrast pouze mezi těmito dvěma vrstvami (22). Nádor močového měchýře je většinou dobře vaskularizován. Tím se vysvětluje jeho lepší odlišení od zdravé, méně vaskularizované sliznice. Pozitivní role NBI byla již prokázána v gastroenterologii. V urologii je NBI používána k detekci neinfiltrujících tumorů močového měchýře od roku 2008. Je to jednoduchá a levná metoda, kdy není třeba žádných před-operačních instilací, a jednotlivé modality (BS a NBI) je možné mezi sebou volně přepínat. Byla prokázána vyšší detekční schopnost metody a není bez zajímavosti, že používáním NBI se zlepšuje schopnost operatéra detekovat nádory v bílém světle (23).
Obr. 2a. Drobný Ta high-grade tumor zobrazený v bílém světle Fig. 2a. Small Ta high-grade tumour visualised in white light Obr. 2b. Drobný Ta high-grade tumor zobrazený při fl uorescenčním cystoskopii s použitím ALA Fig. 2b. Small Ta high-grade tumour visualised in blue light using ALA 
Obr. 3a. Obraz carcinoma in situ v bílém světle Fig. 3a. Carcinoma in situ visualised in white light Obr. 3b. Obraz karcinomu in situ při fl uorescenčním cystoskopii s použitím ALA Fig. 3b. Carcinoma in situ visualised in blue light using ALA 
Využití
Nejlepším využitím pro tuto metodu se jeví diagnostika drobných recidivujících nádorů měchýře. Herr na toto téma publikoval studii v roce 2008 (24). V rámci dispenzarizace nemocných se svalovinu neinfiltrujícími tumory měchýře prováděl celkem 427 nemocným ambulantní cystoskopii vždy v BS a poté v NBI. Všechny léze zaznamenával do diagramu a bio-ptoval. Recidiva byla prokázána u 103 nemocných. Celkem u 56% nemocných s recidivou byly pomocí NBI nalezeny další maligní léze (včetně CIS) a u 12% nemocných byly maligní léze detekovány pouze díky NBI. Senzitivita a specificita pro detekci drobných recidiv byla tedy 87%, resp. 85% pro BS a 100%, resp. 82% pro NBI. Jako nevýhodu uvádí autor fakt, že 13% pacientů s negativní histologií bylo bio-ptováno zbytečně, nicméně v devíti případech z těchto celkem 59 nemocných byla při endoskopii přítomna denudace epitelu včetně pozitivní cytologie, poukazující na CIS. Lepší detekční schopnost NBI při TUR byla prokázána i na naší klinice. Limitujícím faktorem NBI byl vyšší počet nesprávně pozitivních nálezů, který se snižoval s narůstající zkušeností s metodou (23). V malých studiích byla v NBI prokázána vyšší detekce reziduální nádorové tkáně HG lézí při časné extenzivní re-resekci (n = 47 pacientů) (25) a lepší detekční schopnost časných recidiv HG nádorů po indukční fázi BCG (n = 61 pacientů) (26). Schopnost metody NBI snížit míru vzniku recidiv „povrchových“ tumorů je zcela zásadní a dostupných dat je zatím velmi málo. Zajímavá je studie publikovaná v roce 2010 (27). Celkem 126 nemocných s recidivujícími „povrchovými“ tumory bylo sledováno 3 roky pomocí cystoskopie v BS (à 6 měsíců) a poté stejní nemocní další 3 roky pomocí NBI. Nemocní byli sami sobě kontrolami. V prvních 3 letech mělo recidivu 94 % nemocných, zatímco v dalších 3 letech 62 %. Průměrný počet nádorů při jedné pozitivní BS cystoskopii byl 5,2 a při NBI cystoskopii 2,8. Přežití bez recidivy v BS a NBI bylo 29, resp. 13 měsíců (p = 0,001). Jako hlavní limitaci studie autor uvádí absenci randomizace. Dalším nedostatkem studie je tendence nádorů snižovat frekvence recidiv s časem. Velkou výhodou NBI je fakt, že zachytí menší recidivy a v menším množství v době, kdy je lze ambulantně koagulovat. Nemocní se pak vyhnou častějším anesteziím a hospitalizacím. Méně než třetina nemocných sledovaných v NBI potřebovala transuretrální resekci, v BS tvořila tato skupina nemocných 64 %. Zatím jediná prospektivní randomizovaná studie srovnávající TUR v NBI a BS pochází z Itálie (28). Celkem 148 pacientů bylo sledováno 12 měsíců. Riziko recidivy se ve skupině NBI snížilo o téměř 15 % (p = 0,0141). Rozsáhlá prospektivní randomizovaná studie s dlouhodobým sledováním je organizována pod záštitou CROES (Clinical Research Office of the Endourological Society) a její první výsledky se netrpělivě očekávají.
Obr. 4a. Drobný Ta low-grade tumor zobrazený v bílém světle Fig. 4a. Small Ta low-grade tumour visualised in white light Obr. 4b. Drobný Ta low-grade tumor zobrazený pomocí úzkopásmého zobrazení Fig. 4b. Small Ta low-grade tumour visualised in blue light using ALA 
Obr. 5a. Dysplastické změny urotelu zobrazené v bílém světle Fig. 5a. Urothelial dysplasia visualised in white light Obr. 5b. Dysplatické změny urotelu zobrazené pomocí úzkopásmého zobrazení Fig. 5b. Urothelial dysplasia visualised in blue light using ALA 
ZÁVĚR
PDD
Panel pro doporučené postupy Evropské urologické asociace při léčbě svalovinu neinfiltrujících tumorů močového měchýře za rok 2012 doporučuje použití PDD pouze u takových nemocných, kde trvá podezření na přítomnost nízce diferencovaného nádoru nebo CIS, tzn. nádorů, jejichž přehlédnutí může mít zásadní vliv pro další léčbu a prognózu (stupeň doporučení B). Jedná se např. o nemocné s pozitivní cytologií a negativním nálezem v bílém světle či o nemocné s historií nízce diferencovaného tumoru. Schopnost PDD snížit recidivitu nádorů je nutné potvrdit v dalších prospektivních studiích s dlouhou dobou sledování. Vzhledem k nejednoznačným závěrům dosud provedených studií nejsou v tomto směru zatím EAU vydána žádná doporučení. Data o vlivu použití PDD na progresi onemocnění a o vlivu na nádorově specifické přežití pacientů schází zcela. Nezanedbatelná je i vysoká cena přípravku, což pro Českou republiku platí dvojnásob. Některé studie nastínily možnost ušetření finančních prostředků v dlouhodobém horizontu tím, že použitím PDD je dosaženo snížení počtu recidiv a cystektomií (29, 30). Ačkoliv jsou výsledky některých studií povzbudivé, je třeba získat větší množství dat k definitivnímu stanovení přesné indikace použití PDD. V České republice zatím HAL není plátcem zdravotní péče běžně hrazen, a jeho použití tedy zatím není v klinické praxi rozšířeno.
NBI
Velkou výhodou NBI proti PDD je jednoduchost přípravy a provedení a především cena. Data týkající se prodloužení doby do recidivy zatím nejsou k dispozici. Jejich výsledky budou mít zásadní vliv na rozšíření používání této metody a stanovení indikací. Vzhledem k absenci těchto dat nebyla panelem expertů EAU za rok 2012 přijata zatím žádná konkrétní doporučení k použití NBI. Jako velmi potřebná se jeví srovnávací 3-ramenná studie k porovnání PDD, NBI a BS. Není jasné, zda NBI a PDD detekují „stejné“ nádory. Při srovnatelných výsledcích by ovšem ve prospěch NBI hrály zásadní roli celkové náklady.
Došlo: 8. 1. 2013.
Přijato: 1. 3. 2013.
Kontaktní adresa
MUDr. Antonín Brisuda, FEBU
Urologická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
e-mail: antonin.brisuda@fnmotol.cz
Práce byla podpořena grantem IGA NT 12417.
Podpořeno projektem koncepčního rozvoje výzkumné organizace 00064203.
Střet zájmů: žádný.
Sources
1. Sylvester RJ, van der Meijden AP, Oosterlinck W. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49(3): 466–465.
2. Holmang S, Johansson SL. Stage Ta-T1 bladder cancer: the relationship between findings at first follow-up cystoscopy and subsequent recurrence and progression. J Urol 2002; 167(4): 1634–1637.
3. Brausi M, Collette L, Kurth K, et al. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of bladder: a combined analysis of seven EORTC studies. Eur Urol 2002; 41(5): 523–531.
4. Brausi MA, Gavioli M, Peracchia G, et al. Dedicated teaching programs can improve the quality of TUR of non-muscle-invasive bladder tumours (NMIBT): experience of a single institution. Eur Urol Suppl 2008; 7 : 180.
5. Mariappan P, Zachou A, Grigor KM, et al. Detrusor muscle in the first, apparently complete transurethral resection of bladder tumour specimen is a surrogate marker of resection quality, predicts risk of early recurrence, and is dependent on operator experience. Eur Urol 2010; 57(5): 843–849.
6. Mariappan P, Finney SM, Head E, et al. Good quality white-light transurethral resection of bladder tumours (GQ-WLTURB) with experienced surgeons performing complete resections and obtaining detrusor muscle reduces early recurrence in new non-muscle-invasive bladder cancer: validation across time and place and recommendation for benchmarking. BJU Int. 2012; 109(11): 1666–1673.
7. Krieg R, et al. Metabolic characterization of tumor cell–specific protoporphyrin IX accumulation after exposure to 5–aminolevulinic acid in human colonic cells. Photochem Photobiol 2002; 76 : 518–525.
8. Kennedy JC, et al. Photodynamic therapy with endogenous protoporphyrin IX: basic principles and present clinical experience. J Photochem Photobiol B 1990; 6 : 143–148.
9. Marti A, et al. Optimisation of the formation and distribution of protoporphyrin IX in the urothelium: an in vitro approach. J Urol 1999; 162 : 546–552.
10. Jichlinski P, et al. Hexyl aminolevulinate fluorescence cystoscopy: a new diagnostic tool for photodiagnosis of superficial bladder cancer – a multicenter study. J Urol 2003; 170 : 226–229.
11. Schmidbauer J, et al. Improved detection of urothelial carcinoma in situ with hexaminolevulinate (HAL) fluorescence cystoscopy. J Urol 2004; 171 : 135–138.
12. Fradet Y, et al. A comparison of hexaminolevulinate (HAL) fluorescence cystoskopy and white light cystoscopy for the detection of carcinoma in situ (CIS) in patients with bladder cancer: a phase III, multicenter study. J Urol 2007; 178 : 68–73.
13. Fradet Y, Grossman HB, Gomella L, et al. A comparison of hexaminolevulinate fluorescence cystoscopy and white light cystoscopy for the detection of carcinoma in situ in patients with bladder cancer: a phase III, multicenter study. J Urol 2007; 178(1): 68–73; discussion 73.
14. Grossman H, et al. A phase III, multicenter comparison of hexaminolevulinate (HAL) fluorescence cystoscopy and white light cystoscopy for the detection of superficial papillary lesions in patiens with bladder cancer. J Urol 2007; 178 : 62–67.
15. Jocham D, Witjes F, Wagner S, et al. Improved detection and treatment of bladder cancer using hexaminolevulinate imaging: a prospective, phase III multicenter study. J Urol 2005; 174(3): 862–866; discussion 866.
16. Kriegmair M, et al. Detection of early bladder cancer by 5-aminolevulinic acid induced porphyrin fluorescence. J Urol 1996; 155 : 105–109.
17. Babjuk M, Soukup V, Petřík R, Jirsa M, Dvořácek J. 5-aminolaevulinic acid-induced fluorescence cystoscopy during transurethral resection reduces the risk of recurrence in stage Ta/T1 bladder cancer. BJU Int. 2005; 96(6): 798–802.
18. Schumacher MC, Holmäng S, Davidsson T, et al. Transurethral resection of non-muscle-invasive bladder transitional cell cancers with or without 5-aminolevulinic Acid under visible and fluorescent light: results of a prospective, randomised, multicentre study. Eur Urol 2010; 57(2): 293–299.
19. Stenzl A. Hexaminolevulinate guided fluorescence cystoscopy reduces recurrence in patients with nonmuscle invasive bladder cancer. J Urol 2010; 184(5): 1907–1913.
20. Grossman HB, Stenzl A, Fradet Y, et al. Long-term decrease in bladder cancer recurrence with hexaminolevulinate enabled fluorescence cystoscopy. J Urol 2012; 188(1): 58–62.
21. Geavlete B, Multescu R, Georgescu D, et al. Treatment changes and long-term recurrence rates after hexaminolevulinate (HAL) fluorescence cystoscopy: does it really make a difference in patients with non-muscle-invasive bladder cancer (NMIBC)? BJU Int. 2012; 109(4): 549–556.
22. Tatsugami K. Evaluation of narrow-band imaging as a complementary method for the detection of bladder cancer. J Endourol 2010; 24(11): 1807–1811.
23. Brisuda A, Hrbáček J, Čechová M, et al. Role Narrow band imaging v diagnostice a léčbě uroteliálního karcinomu močového měchýře. Vybrané otázky onkologie XVI. Praha: Galén 2012; 16–17.
24. Herr HW, Donat SM. A comparison of white-light cystoscopy and narrow-band imaging cystoscopy to detect bladder tumour recurrences. BJU Int. 2008; 102(9): 1111–1114.
25. Naselli A, Introini C, Bertolotto F, et al. Narrow band imaging for detecting residual/recurrent cancerous tissue during second transurethral resection of newly diagnosed non-muscle-invasive high-grade bladder cancer. BJU Int. 2010; 105(2): 208–211.
26. Herr HW. Narrow-band imaging cystoscopy to evaluate the response to bacille Calmette-Guérin therapy: preliminary results. BJU Int. 2010; 105(3): 314–316.
27. Herr HW, Donat SM. Reduced bladder tumour recurrence rate associated with narrow-band imaging surveillance cystoscopy. BJU Int. 2011; 107(3): 396–398.
28. Naselli A, Introini C, Timossi L, et al. A randomized prospective trial to assess the impact of transurethral resection in narrow band imaging modality on non-muscle-invasive bladder cancer recurrence. Eur Urol 2012; 61(5): 908–913.
29. Malmstrom PU, Hedelin H, Thomas YK, et al. Fluorescence-guided transurethral resection of bladder cancer using hexaminolevulinate: analysis of health economic impact in Sweden. Scand J Urol Nephrol 2009; 43 : 192.
30. Zaak D, Wieland WF, Stief CG, et al. Routine use of photodynamic diagnosis of bladder cancer: practical and economic issues. Eur Urol Suppl. 2008; 7 : 536.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2013 Issue 2-
All articles in this issue
- Využití fotodynamické diagnostiky a úzkopásmového zobrazení v diagnostice a léčbě svalovinu neinfiltrujících nádorů močového měchýře
- Osteonekróza čelistí jako nežádoucí účinek léčby urologických onkologických pacientů
- Obstrukce dolních močových cest na podkladě benigní hyperplazie prostaty u pacientů v konečném stadiu renálního onemocnění
- Srovnání dlouhodobých výsledků u pacientů po augmentaci močového měchýře ileálním a gastrickým segmentem
- Zhodnocení patologických výsledků z pohledu urologa po radikální prostatektomii z důvodu karcinomu prostaty i při „normálních“ hodnotách PSA
- Hydronefróza segmentu podkovovité ledviny raritní velikosti a jeho chirurgické řešení
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hydronefróza segmentu podkovovité ledviny raritní velikosti a jeho chirurgické řešení
- Osteonekróza čelistí jako nežádoucí účinek léčby urologických onkologických pacientů
- Obstrukce dolních močových cest na podkladě benigní hyperplazie prostaty u pacientů v konečném stadiu renálního onemocnění
- Zhodnocení patologických výsledků z pohledu urologa po radikální prostatektomii z důvodu karcinomu prostaty i při „normálních“ hodnotách PSA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career





