-
Medical journals
- Career
Osteonekróza čelistí jako nežádoucí účinek léčby urologických onkologických pacientů
: Lukáš Hauer 1; Daniel Hrušák 1; Jan Jambura ml. 1; Milan Hora 2
: Stomatologická klinika LF UK a FN, Plzeň 1; Urologická klinika LF UK a FN, Plzeň 2
: Ces Urol 2013; 17(2): 88-99
: Review article
Farmakologicky navozená osteonekróza čelistí je vzácná komplikace léčby nejen onkologických pacientů. Tyto léze jsou popsány jako nežádoucí účinek určitého typu antiresorptivní terapie a/nebo cílené léčby, která ovlivňuje kostní metabolismus. U pacientů s maligním onemocněním je riziko vzniku osteonekrózy čelistí podstatně větší než u nemocných s metabolickými kostními chorobami, přičemž pacienti s pokročilými urologickými malignitami patří mezi nejvíce rizikové. Osteonekróza čelistí svými projevy snižuje kvalitu života postižených pacientů a může i významně omezovat až znemožňovat perorální příjem stravy. Vzhledem k tomu, že se jedná o poměrně nedávno popsaný patologický jev, není dosud plně objasněna patofyziologie vzniku těchto lézí, neexistuje ani shoda mezi odborníky, jakým způsobem je léčit. Terapie je obtížná, mnohdy zdlouhavá i neúspěšná, důraz se proto klade na preventivní opatření. Autoři v předkládaném přehledovém sdělení shrnují současné poznatky týkající se těchto lézí.
Klíčová slova:
bisfosfonáty, denosumab, bevacizumab, sunitinib, nežádoucí účinky, osteonekróza čelistí, onkologický pacient.ÚVOD
Osteonekróza čelistí je patologický stav charakterizovaný různě rozsáhlou nekrózou čelistních kostí, kdy ve většině případů alespoň část nevitální kosti zeje slizniční ranou do dutiny ústní méně často pak i kožní ranou extra-orálně. Příčiny vzniku těchto lézí jsou nejčastěji iatrogenní (radioterapie, určitý typ farmakoterapie, vzácně chirurgie). Mohou ovšem vznikat i následkem rozsáhlých traumat, působením chemických faktorů (bílý fosfor, arsen, kokain aj.), v důsledku infekcí orofaciální oblasti (bakteriálních, virových, invazivních mykotických) nebo na podkladě některých systémových kostních onemocnění eventuálně i malignit hlavy a krku (např. některé sklerózující kostní dysplazie, dlaždicobuněčný karcinom, extranodální NK/T buněčný lymfom aj.) (1). Klinický i radiologický nález je nehledě na etiologii těchto lézí ve většině případů podobný. Osteonekróza čelistí se liší od osteonekróz jiných částí skeletu (tzv. avaskulárních kostních nekróz) některými etiologickými faktory, patogenezí, klinickým i radiologickým obrazem a samozřejmě i léčbou.
Osteonekróza čelistí vznikající jako nežádoucí účinek systémové farmakoterapie je raritní, ale závažná komplikace postihující pacienty s určitým typem antiresorptivní a/nebo cílené léčby. Poprvé byla popsána při terapii bisfosfonáty (v roce 2003) (2), později pak i jako následek léčby bevacizumabem (rok 2008) (3), denosumabem (rok 2010) (4, 5) a sunitinibem (rok 2011) (6). Vzhledem k tomu, že u pacientů s pokročilým maligním urologickým onemocněním (především prostaty a ledvin) může být indikována terapie kterýmkoliv z výše uvedených léků, a to často i v konkomitanci, stávají se tito nemocní jednou z nejvíce rizikových skupin pro vznik této komplikace. Přesná patofyziologie lékově navozených osteonekróz čelistních kostí není dosud známa, není ani jasný konsenzus mezi odbornou veřejností, jak tyto léze léčit. Nejlépe prozkoumána je zatím bisfosfonátová osteonekróza čelistí.
DEFINICE
Definice byla stanovena odbornou společností American Association of Oral and Maxillofacial Surgeons (AAOMS ) dosud jen pro osteonekrózu čelistí vzniklou v souvislosti s terapií bisfosfonáty. Tyto léze jsou tak definovány jako obnažená nekrotická kost v maxilofaciální oblasti při splnění všech tří následujících podmínek: 1. perzistence obnažené kosti po dobu více jak 8 týdnů, 2. anamnestický údaj o současném nebo předešlém užívání bisfosfonátů, 3. pacient bez prodělané radioterapie v oblasti hlavy a krku, kde by čelist byla v ozařovaném poli (7).
EPIDEMIOLOGIE
Epidemiologická data týkající se incidence bisfosfonátové osteonekrózy čelistí se v odborné literatuře různí. Tato komplikace vzniká přibližně u 1–10 % pacientů užívajících intravenózní bisfosfonáty z důvodu maligního onemocnění (8). Bylo zjištěno, že onkologičtí pacienti mají při nitrožilním podávání bisfosfonátů 8,8krát vyšší riziko vzniku osteonekrózy čelistí než pacienti bez bisfosfonátové terapie (9). U pacientů léčených současně bisfosfonáty a cílenou léčbou (především bevacizumabem a sunitinibem) byl publikován vznik těchto lézí až v 16 % případů (4/25) (10).
V různých epidemiologických studiích byla zjištěna osteonekróza čelistí u 2,9–6,5 % nemocných s generalizovaným karcinomem prostaty, kteří byli léčeni intravenózními bisfosfonáty (11), což z nich činí třetí až druhou nejvíce rizikovou skupinu pacientů pro vznik těchto lézí. Nejčastěji vzniká bisfosfonátová osteonekróza čelistí u pacientů s mnohočetným myelomem (až 43 % těchto lézí) (12). U nemocných s touto diagnózou léčených intravenózními bisfosfonáty bylo v různých epidemiologických studiích zaznamenáno postižení čelistní osteonekrózu ve 2,4–11 % případů (13–18). U pacientů s generalizací karcinomu prsu taktéž na intravenózní bisfosfonátové terapii pak v 1,2–6 % případů (13, 15, 17, 19, 20). Nejméně rizikovou skupinou jsou pacienti užívající perorální bisfosfonáty pro osteoporózu, u nichž byl publikován výskyt osteonekrózy čelistí u 0,1 % nemocných (9/8572) (21). Nicméně je třeba vzít v úvahu, že vzhledem k vysoké prevalenci osteoporózy v populaci existuje velké množství pacientů užívajících bisfosfonáty z této indikace (odhaduje se 190 milionů preskripcí perorálních bisfosfonátů celosvětově za jeden rok) (7). Osteonekróza čelistí u pacientů s osteoporózou užívajících perorální bisfosfonáty tak tvoří 7,8–10 % všech případů (12, 22).
Osteonekróza čelistí byla zaznamenána u 2 % (22/943) pacientů s generalizovaným kastračně rezistentním karcinomem prostaty léčených denosumabem (23). Ve třech randomizovaných, dvojitě zaslepených, placebem kontrolovaných prospektivních studiích fáze III porovnávajících účinnost denosumabu oproti kyselině zoledronové u pacientů s kostními metastázami byl zjištěn výskyt osteonekrózy čelistí u 1,8 % (52/2841) pacientů léčených denosumabem versus 1,3 % (37/2836) nemocných s terapií zoledronátem (5, 23, 24).
Dosud byly v anglosaské literatuře publikovány pouze dva případy osteonekrózy čelistí vzniklé při léčbě sunitinibem (6, 25) a devět případů při terapii bevacizumabem u pacientů, kteří nikdy neužívali bisfosfonáty (26, 27). Ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných prospektivních studiích fáze III u pacientů s HER2-negativním lokálně rekurentním nebo metastatickým karcinomem prsu byl při léčbě bevacizumabem zaznamenán výskyt osteonekrózy čelistí v 0,2 % případů (2/1,076) (28).
PATOGENEZE, RIZIKOVÉ A VYVOLÁVAJÍCÍ FAKTORY
Na začátku je třeba říci, že dosud nebyla prokázána jasná kauzalita mezi užíváním bisfosfonátů a vznikem osteonekrózy čelistí, nicméně experimentální a epidemiologické studie potvrzují silnou asociaci mezi bisfosfonátovou terapií a vznikem této komplikace (7).
Patogeneze lékově navozených osteonekróz čelistí je dosud nejasná, pravděpodobně je multifaktoriální. Ani jeden z etiopatogenetických faktorů (viz níže) sám o sobě není schopen vysvětlit vznik těchto lézí. Za hlavní patogenetický mechanismus je považováno narušení kostní homeostázy patologickým působením na monocyto-makrofágovou linii, které vede k poruše kostní remodelace i lokálních obranných mechanismů kosti (26).
Bisfosfonáty jsou syntetickými analogy anorganických pyrofosfátů s vysokou afinitu ke kostnímu hydroxyapatitu. Z této vazby jsou pak uvolňovány proteázami a acidifikačním účinkem osteoklastů, což umožňuje i jejich následný průnik a cílové působení v těchto buňkách (inhibice farnesyldifosfátsyntázy aminobisfosfonáty) (8). Aminobisfosfonáty stimulují i tvorbu osteoprotegerinu v osteoblastech, což je přirozený inhibitor ligandu RANKL (receptor activator of nuclear factor NF-kappaB-ligand). To vše vede k inhibici aktivity osteo-klastů a snížení počtu těchto buněk indukcí jejich apoptózy a inhibicí diferenciace z jejich prekurzorů (1). Výsledným efektem je tak útlum kostní resorpce. Bisfosfonátová osteonekróza čelistí vzniká v podstatě jen v souvislosti s léčbou aminobisfosfonáty, které jsou výrazně silnějšími inhibitory kostní resorpce než bezdusíkaté preparáty, navíc s antiangiogenním efektem (inhibice vaskulárního endoteliálního růstového faktoru – VEGF) (1, 28). Dosud byly publikovány jen ojedinělé případy těchto lézí u pacientů užívajících bisfosfonáty bez obsahu dusíku (1). Denosumab je humánní monoklonální protilátka, která se s vysokou afinitou i specificitou váže na ligand RANKL, čímž zabraňuje interakci RANKL/RANK, a tak i diferenciaci nových a aktivaci zralých osteoklastů (26, 29). Bevacizumab je rekombinantní humanizovaná monoklonální protilátka, která se váže na VEGF, a tím inhibuje jeho vazbu na receptory na povrchu endoteliálních buněk (3, 26). Sunitinib je tyrozinkinázový inhibitor, přičemž z hlediska vzniku osteonekrózy čelistí má pravděpodobně význam inhibice receptorů pro VEGF a destičkový růstový faktor (PDGFR) a receptoru kolonie stimulujícího faktoru (CSF-1R) (6, 25, 26).
Na patogenezi osteonekrózy čelistí vzniklé jako nežádoucí účinek systémové farmakoterapie se mohou podílet tyto faktory:
- Přílišný útlum kostní remodelace. Vzhledem k tomu, že je aktivita osteoklastů těsně spjata s osteoblasty a naopak, dochází při inhibici kostní resorpce do určité míry také k porušení kostní apozice. Suprese kostní přestavby vede ke kumulaci mikropoškození vzniklých při zátěži (mastikaci), stejně jako k poruše hojení kostních ran (např. po extrakcích zubů), které jsou pak často „triggerem“ pro vznik těchto lézí (1, 8) (obr. 1, 2). Ovlivnění procesu kostní remodelace je u výše zmíněných léků způsobeno odlišnými mechanismy (přímým intracelulárním působením v osteoklastech, působením přes RANKL/RANK, VEGF, PDGFR, CSF-1R).
- Orální slizniční cytotoxicita. Tímto faktorem se dříve alespoň částečně vysvětlovalo, proč je nekrotická kost obnažena slizniční ranou do dutiny ústní. Nicméně orální slizniční cytotoxicita byla prokázána jen u aminobisfosfonátů (8, 30). Toxické působení těchto léků na epiteliální buňky ústní sliznice neprobíhá jen systémově (v závislosti na plazmatických koncentracích), ale především lokálně (stálým uvolňováním bisfosfonátů z kosti čelistí) (26). Určitý vliv na vznik těchto lézí může mít i mukozitida, která narušuje slizniční bariéru a je popsána jako nežádoucí účinek léčby sunitinibem (26).
- Infekce. Infekce orálními patogenními mikroorganismy se považuje za jeden z hlavních faktorů pro vznik a následnou progresi těchto lézí. V této souvislosti je diskutována hlavně úloha bakterií rodu Actinomyces, které jsou histologicky a někdy i kultivačně prokazovány ve většině případů osteonekróz čelistí (1, 26, 30). Není dosud vyjasněno, zda se jedná jen o kolonizaci aktinomycetami, které jsou běžnými saprofyty v dutině ústní, nebo zda jde o hlavní patogen (1, 26). Někteří autoři považují tyto léze dokonce za formu cervikofaciální aktinomykózy. Bylo také prokázáno, že kostní tkáň, která je pod vlivem bisfosfonátů, je mnohem vnímavější k bakteriální infekci, a to včetně aktinomycet (1, 26). Infekční teorii vzniku osteonekróz čelistí podporuje i fakt, že tyto léze často vznikají u pacientů s nízkou úrovní orálního zdraví, tzn. i s četnými odontogenními infekčními fokusy v čelistech (parodontitida, periodontitida aj.). Infekce způsobuje i změny pH ve smyslu acidifikace, což má za následek větší toxicitu aminobisfosfonátů i jejich zvýšené uvolňování z kosti (30). Dutina ústní je silně mikrobiálně kolonizovaným prostředím a při porušení slizniční bariéry mohou tyto mikroorganismy za spolupůsobení dalších faktorů pronikat do kosti. Bakteriální infekce se tak velmi pravděpodobně podílí i na progresi těchto lézí, kdy na jejich podkladě vzniká osteomyelitida (II. stadium – viz dále).
- Imunitní dysfunkce. Působením na monocyto-makrofágovou linii výše zmíněné léky narušují nejen funkci osteoklastů, ale i monocytů a makrofágů, což snižuje imunitní odpověď na bakteriální infekci (8, 26). Imunodeficience je navíc navozena i častou konkomitantní imunosupresivní medikací (chemoterapie, kortikosteroidy).
- Antiangiogenní efekt. Antiangiogenní vlastnosti jsou popsány jen u aminobisfosfonátů, bevacizumabu a sunitinibu. Tento faktor při vzniku osteonekróz čelistí pravděpodobně hraje jen minimální roli a v současné době je spíše zpochybňován (8, 26). U bevacizumabu je popsán jako nežádoucí účinek komplikované hojení chirurgických ran (31).
1. Výřez z ortopantomogramu pacienta s generalizovaným hormonálně refrakterním adenokarcinomem prostaty, který byl mimo jiné léčen zoledronátem po dobu 20 měsíců. Pacient nepodstoupil stomatologické vyšetření a ošetření před zahájením terapie bisfosfonáty v rámci primární prevence osteonekrózy čelistí. Je patrný retinovaný zub 48 (v dolní čelisti), který byl jako příčinný zub kolemčelistního zánětu indikován k chirurgické extrakci. Fig. 1. A part of the panoramic X-ray of the patient with metastatic hormone-refractory prostate adenocarcinoma, who received zoledronate during a period of 20 months, among other things. The patient did not undergo a dental examination and treatment prior to the start of bisphosphonate therapy as the primary prevention of osteonecrosis of the jaw. The image shows an impacted tooth 48 (in the mandible), which was indicated for the surgical extraction as the origin of odontogenic soft tissue infection. 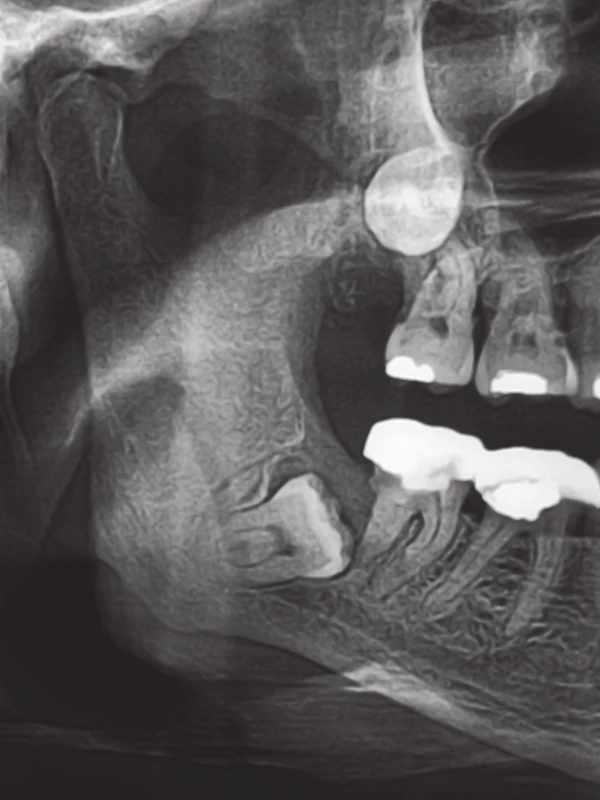
2. Výřez z ortopantomogramu pacienta z obrázku 1. Stav 3 měsíce po maximálně kost šetřící chirurgické extrakci zubu 48, která proběhla při dodržení všech preventivních opatření. Extrakční rána je radiologicky bez jakýchkoliv známek hojení, čemuž odpovídal i klinický nález. Posléze v této lokalizaci došlo k rozvoji osteonekrózy mandibuly. Fig. 2. A part of the panoramic X-ray of the patient in Figure 1. The state 3 months after the maximally bone-sparing surgical extraction of the tooth 48, which was performed in the line with preventive measures. The extraction wound is radiologically without any signs of healing, which corresponded with clinical fi ndings. The osteonecrosis of the mandible developed subsequently in this area. 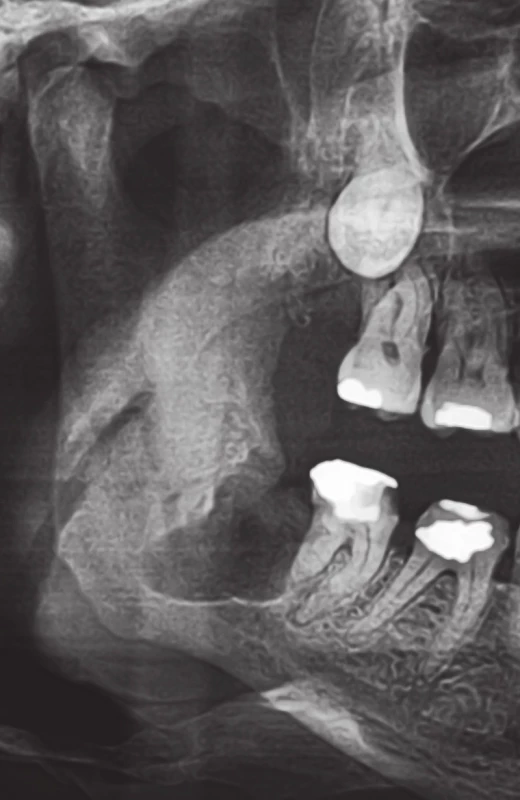
Mezi hlavní rizikové faktory vzniku bisfosfonátové osteonekrózy čelistí, které souvisejí s léčbou základního onemocnění, patří typ bisfosfonátu a jeho antiresorpční potenciál a celková dávka těchto léků navázaných na kostní tkáň v průběhu času (možno označit jako kumulativní dávka) (1). Ta je určena způsobem podání léku, dávkováním, délkou terapie a afinitou jednotlivých léků ke kosti, a tím i dobou perzistencí v této tkáni (poločas uvolňování z kosti se u některých bisfosfonátů odhaduje až na roky) (1). Na kostní tkáň se vyváže 50–70 % plazmatické koncentrace aminobisfosfonátu oproti 20–30 % u bezdusíkatých bisfosfonátů. Při perorálním podání se ze střeva vstřebá méně než 1 % podané látky oproti 1–3 % u bisfosfonátů bez obsahu dusíku (ovlivněno i časovým intervalem od příjmu potravy i typem přijímané stravy). Z výše uvedeného je zřejmé, že největší riziko vzniku osteonekrózy čelistí je v případě dlouhodobého intravenózního podávání kyseliny zoledronové v dávkování z onkologické indikace. Mezi další rizikové faktory pak patří diabetes mellitus, konkomitantní chemoterapie a/nebo cílená či imunosupresivní léčba (včetně kortikoidů) (8). Také u denosumabu se předpokládá na dávce závislé riziko vzniku osteonekrózy čelistí, takže pacienti s dávkováním z onkologické indikace mají pravděpodobně vyšší riziko vzniku těchto lézí než nemocní užívající tyto léky pro osteoporózu (29). Vzhledem k tomu, že efekt denosumabu na kostní remodelaci rychle odezní při vysazení tohoto léku (29), je toto riziko pravděpodobně poměrně reverzibilní.
Za hlavní lokální rizikové faktory jsou považovány chirurgický výkon v dutině ústní, trauma (včetně chronické traumatizace nevyhovující protézou), oblast anatomických struktur torus palatinus a mandibularis a linea mylohyoidea a zánětlivé dentální onemocnění (1, 8). Nejčastěji vznikají tyto léze po extrakcích zubů (až 70 %), mohou ovšem vznikat i spontánně bez identifikovatelné vyvolávající příčiny (1).
Téměř výhradní postižení čelistí u bisfosfonátové osteonekrózy bývá zdůvodňováno zvýšeným vychytáváním bisfosfonátů v těchto kostech v důsledku rychlejší kostní přestavby. Udává se, že remodelace alveolu je díky mastikaci a zatížení kosti přes dentici a periodontální vlákna až 10krát rychlejší než přestavba kostí dlouhých (zjištěno na zvířecích modelech) (32). Ve srovnání s ostatním skeletem jsou také čelisti vzhledem k anatomickým poměrům (přítomnost zubů, tenká slizniční bariéra) podstatně snáze infikovatelné mikroorganismy, pokud jsou pro to příhodné podmínky (např. právě lékově navozená porucha homeostázy a obranných mechanismů kosti), což na druhou stranu podporuje i infekční teorii vzniku těchto čelistních lézí.
KLINICKÉ PROJEVY
Osteonekróza čelistí vzniklá jako nežádoucí účinek systémové farmakoterapie má podobné klinické projevy bez ohledu na typ léku, při jehož podávání tato komplikace vznikla a který je její pravděpodobnou příčinou. Může postihovat bezzubé i ozubené části alveolárního výběžku jako léze solitární nebo vícečetná, s možným výskytem buď pouze v jedné, nebo i v obou čelistech současně. Dolní čelist je postižena přibližně 2krát častější než čelist horní (1, 8). Osteonekróza čelistí se projevuje jako žlutohnědá nebo šedá nevitální kost čelisti, která je obnažena slizniční ranou do dutiny ústní, vzácněji pak i kožní ranou navenek (obr. 3, 4). Velikost patrné léze většinou neodpovídá skutečnému rozsahu kostního postižení, které je ve většině případů extenzivnější (1, 33). Přítomnost obnažené nekrotické kosti čelistí může být a často také bývá doprovázena bolestí, příznaky z postižení nervových struktur, nejčastěji nervus alveolaris inferior a nervus infraorbitalis (parestezie, hypestezie až anestezie) a známkami zánětu tvrdých a měkkých tkání (otok, hnisavá exsudace z oblasti osteo-nekrózy či píštělí, intraorální a/nebo kožní píštěle obličeje a krku, reaktivní regionální lymfadenopatie, zánět hlubokých prostor hlavy a krku s jeho lokálními a celkovými projevy). Obličejová asymetrie může být způsobena nejen otokem měkkých tkání, ale i zduřením čelistí a periostální reakcí. Postupně může docházet k sekvestraci kosti, viklavosti a ztrátě zubů v postižené oblasti a u pokročilých stavů pak není výjimkou ani vznik patologické fraktury dolní čelisti, chronické oroantrální nebo oronazální komunikace a akutní či chronické maxilární rinosinusitidy se všemi jejími příznaky a komplikacemi. Na měkkých tkáních (nejčastěji jazyka a ústní spodiny) přilehlých k těmto lézím mohou být přítomné známky traumatizace ostrými okraji zející nekrotické kosti. U pacientů s konkomitantní cílenou či imunosupresivní léčbou byl zaznamenán závažnější průběh bisfosfonátové osteonekrózy čelistí i zkrácení doby od začátku užívání těchto léků do vzniku této komplikace (26). Osteonekróza čelistí může v pokročilých stadiích svými projevy významně ztěžovat až znemožňovat perorální příjem, což je problematické právě u onkologicky nemocných, a může i vést k nutnosti alternativních způsobů výživy. Od roku 2009, kdy bylo do stagingu těchto lézí doplněno 0. stadium (viz dále), se připouští i existence bisfosfonátové osteonekrózy čelistí, u níž je nekrotická kost kryta měkkými tkáněmi, a není tedy zevně exponována (7).
3. Osteonekróza horní čelisti (II. stadium) vzniklá po extrakci zubu u pacienta s generalizovaným dobře diferencovaným konvenčním renálním karcinomem s přechodem do vysoce maligního sarkomatoidního renálního karcinomu s rabdomyoblastickou diferenciací. Pacient byl mimo jiné dlouhodobě léčen bisfosfonáty (50 měsíců klodronát, 4 měsíce zoledronát, 2 měsíce pamidronát) v konkomitanci s biologickou léčbou (7 měsíců sorafenib). Fig. 3. Osteonecrosis of the maxilla (the 2nd stage) arised after tooth extraction in the patient with metastatic well- -diff erentiated conventional renal cell carcinoma with high-grade transformation into sarcomatoid renal cell carcinoma with rhabdomyoblastic diff erentiation. The patient received long term bisphosphonate therapy (clodronate for 50 months, zoledronate for 4 months, pamidronate for 2 months) and concomitant biological therapy (sorafenib for 7 months) among other things. 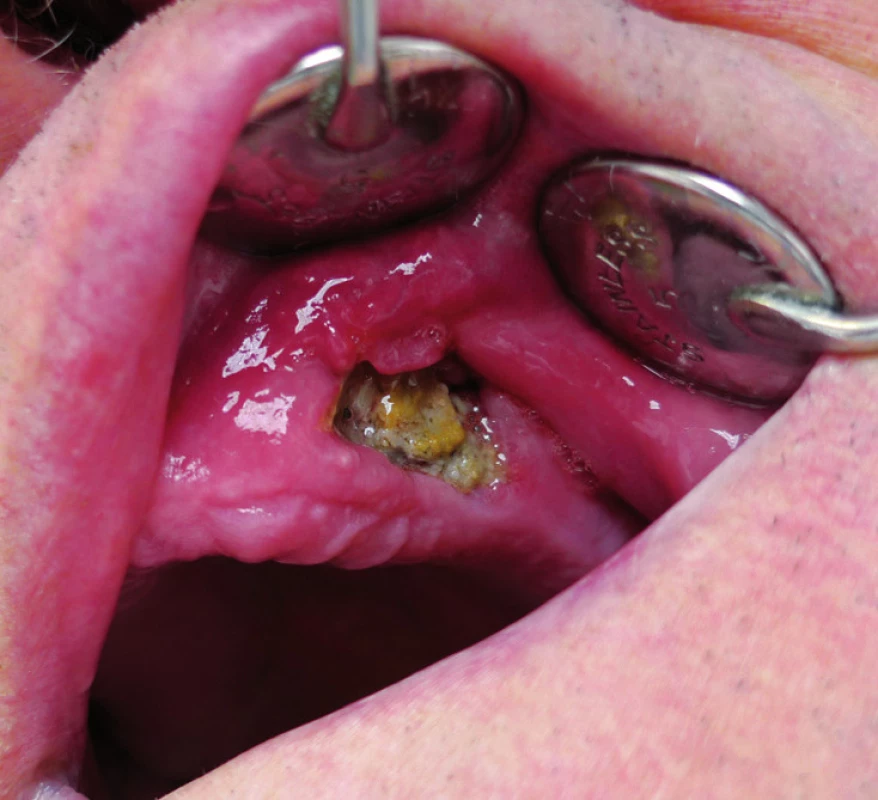
4. Rozsáhlá oboustranná osteonekróza horní čelisti s chronickými oroantrálními komunikacemi a oboustrannou chronickou maxilární rinosinusitidou (III. stadium) vzniklá po extrakcích zubů u pacienta s generalizovaným dobře diferencovaným konvenčním renálním karcinomem. Pacient byl mimo jiné léčen bisfosfonáty (2 měsíce zoledronát, 11 měsíců pamidronát) v konkomitanci s biologickou léčbou (12 měsíců sunitinib, 2 měsíce sorafenib). Fig. 4. Extensive bilateral osteonecrosis of the maxilla with chronic oroantral communications and bilateral chronic maxillary rhinosinusitis (the 3rd stage) arised after teeth extraction in patient with metastatic well–diff erentiated convent ional renal cell carcinoma. The patient received bisphosphonates (zolendronate for 2 months, pamidronate for 11 months) and concomitant biological therapy (sunitinib for 12 months, sorafenib for 2 months) among other things. 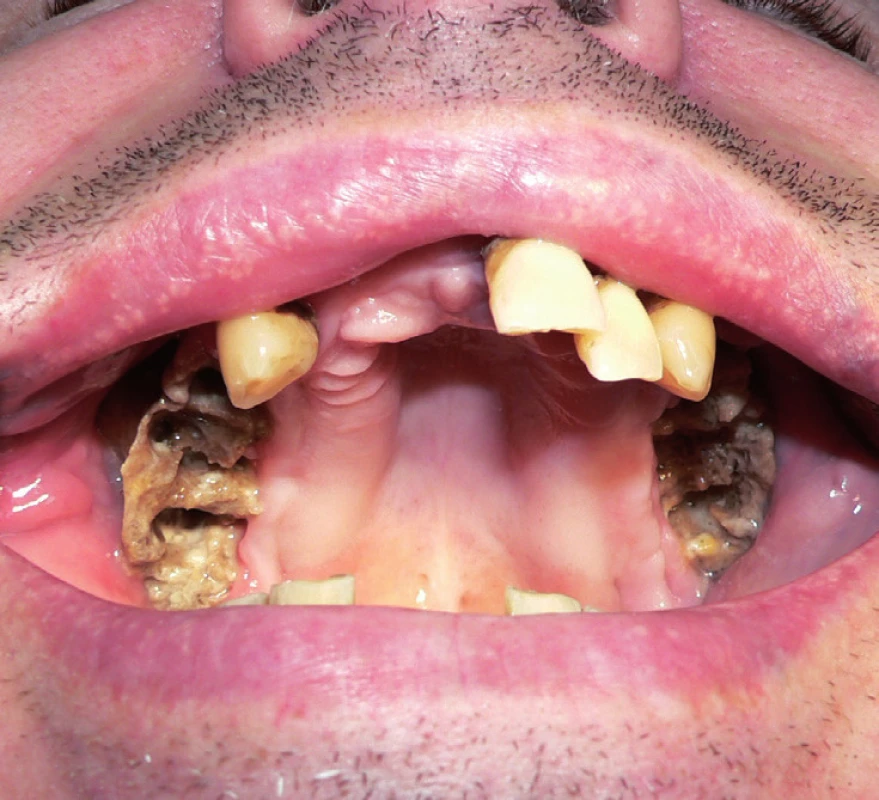
DIAGNOSTIKA A STAGING
Ke stanovení diagnózy lékově navozené osteo-nekrózy čelistí většinou postačují anamnestické údaje a klinické vyšetření. Vyšetření jednotlivými zobrazovacími metodami se ukazují jako nespecifická, neodlišující tyto léze od některých jiných patologií (např. spinaliom alveolárního výběžku čelisti s invazí do kosti) (33). Z hlediska zobrazovacích vyšetření je nutné mít na paměti, že kostní tkáň je schopna jen omezeně reagovat na patologické podněty, nehledě na jejich etiologii. Proto stejně jako u jiných patologických stavů i v případě osteonekrózy čelistí se v závislosti na stadiu léze setkáváme s osteolýzou, osteosklerózou a periostální nebo endostální reakcí spojenou s kostní apozicí. Hlavním významem zobrazovacích vyšetření je tak stanovení lokalizace a přesného rozsahu lézí (staging), diagnostika raných fází osteonekrózy nebo přidružených komplikací, do jisté míry i vyloučení jiných onemocnění čelistí a zhodnocení stavu čelistních kostí před chirurgickými výkony (33). Využívá se skiagrafie, cone-beam počítačová tomografie, počítačová tomografie a magnetická rezonance (obr. 5). Svůj význam mají i metody funkčního zobrazení s využitím radionuklidů – kostní scintigrafie, jednofotonová emisní výpočetní tomografie, pozitronová emisní tomografie a metody hybridní (nejčastěji PET/CT, SPECT/CT). Časné nebo malé léze většinou ani nejsou na skiagramu patrné. U urologických onkologických pacientů je v rámci stagingu či monitorace vývoje maligního onemocnění relativně často indikováno vyšetření celotělovou kostní scintigrafií, eventuálně celotělové PET/CT. Při těchto vyšetřeních je zobrazena i orofaciální oblast, kde se osteonekróza čelistí, projevuje v 60–90 % případů zvýšeným vychytáváním radiofarmaka (99mTc-MDP, 18F-FDG, 18F-NaF) již od počátku vzniku této komplikace (33) (obr. 6). Tím se liší od avaskulárních nekróz ostatních částí skeletu, které se v prvních týdnech jeví jako chladná ložiska (defekt akumulace) a teprve po jejich vaskularizaci, hojení a přestavbě dochází k difuzně zvýšenému vychytávání radiofarmaka, která přetrvává měsíce.
5. CT vyšetření, koronární řez, u pacienta z obrázku 4. Je dobře patrné úplné zastření obou maxilárních sinů při chronické maxilární rinosinusitidě a sekvestrace stěn čelistních dutin (zdroj: Klinika zobrazovacích metod LF UK a FN Plzeň, přednosta: doc. MUDr. Boris Kreuzberg, CSc.). Fig. 5. Coronal CT scan of the patient in Figure 4. The complete bilateral opacifi cation of maxillary sinus caused by chronic maxillary rhinosinusitis and the sequestration of the sinus walls is well evident (source: Department of Imaging Methods, University Hospital and Faculty of Medicine in Pilsen, Charles University in Prague, Head of Department: doc. MUDr. Boris Kreuzberg, CSc.). 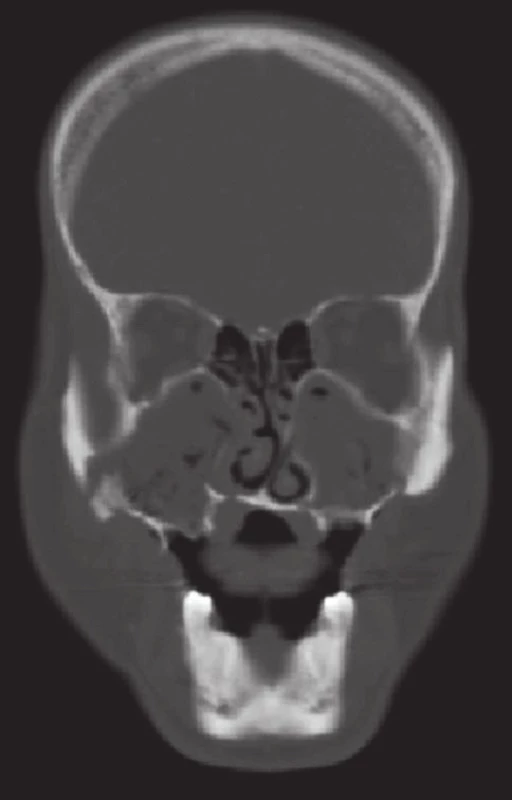
6. Zvýšené vychytávání radiofarmaka (<sup>18</sup>F-FDG) v oblasti osteonekrózy maxilly při PET/CT vyšetření u pacienta z obrázku 3 (zdroj: Klinika zobrazovacích metod LF UK a FN Plzeň, přednosta: doc. MUDr. Boris Kreuzberg, CSc.). Fig. 6. The increased uptake of the radiopharmaceutical (<sup>18</sup>F-FDG) in the area of maxillary osteonecrosis detected by PET/CT scans in patient demonstrated in Figure 3 (source: Department of Imaging Methods, University Hospital and Faculty of Medicine in Pilsen, Charles University in Prague, Head of Department: doc. MUDr. Boris Kreuzberg, CSc.). 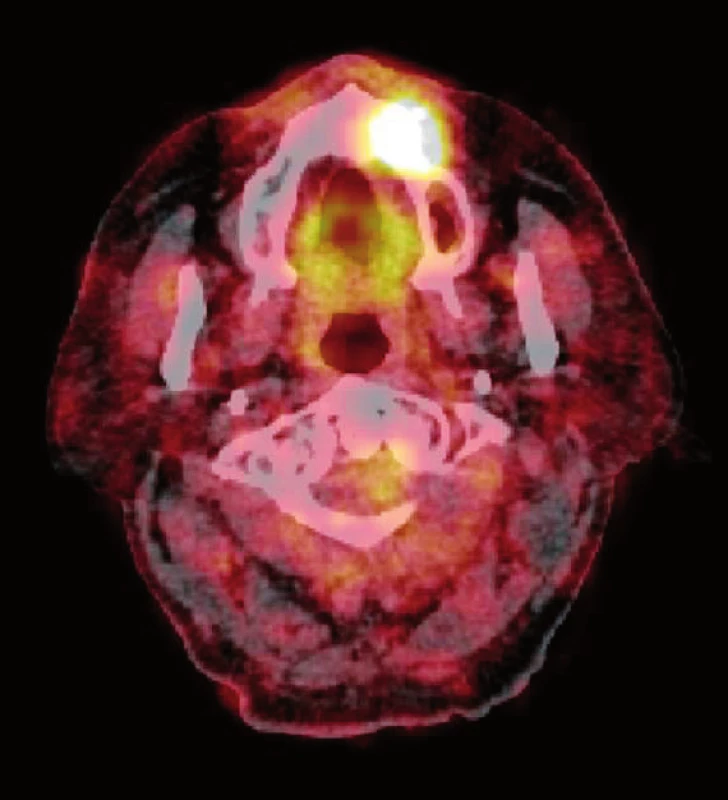
Kostní biopsie je doporučována pouze při podezření na maligní proces (primární nádor nebo metastatické postižení čelistí při základním onemocnění). Existuje totiž riziko zhoršení klinických příznaků osteonekrózy čelistí po invazivním výkonu. Navíc histologický nález je při osteonekróze čelistí nespecifický: nevitální kost bez osteoblastů a osteoklastů, přítomnost prázdných lakun bez osteocytů, zánětlivý infiltrát, častá přítomnost aktinomycet (až ve více než 90 % případů), even-tuálně hyfů a spór mykotických organismů (1). Staging byl vypracován v roce 2006 AAOMS pouze pro bisfosfonátovou osteonekrózu čelistí, nicméně lze použít i pro osteonekrózu čelistí vzniklou jako nežádoucí účinek jiné farmakoterapie. V roce 2009 pak bylo doplněno 0. stadium, které v podstatě nesplňuje úvodní definici pro tyto léze (7) (tab. 1). Nejčastějším klinickým projevem těchto osteonekróz čelistí je II. stadium (1).
1. Staging osteonekrózy čelistí vzniklé v souvislosti s léčbou bisfosfonáty dle American Association of Oral and Maxillofacial Surgeons 2009 Table 1. Staging of bisphosphonate – related osteonecrosis of the jaw according to American Association of Oral and Maxillofacial Surgeons 2009 
LÉČBA
Léčba bisfosfonátové osteonekrózy čelistí je obtížná, často zdlouhavá a neúspěšná, dosud bez jasného konsenzu mezi odbornou veřejností. Většina odborných společností včetně AAOMS doporučuje co nejkonzervativnější terapii s odkladem chirurgické léčby (tzn. resekčních výkonů na čelistech) až pro symptomatické léze 3. stadia. Cílem těchto doporučení je zachovat kvalitu života pacientů eliminací bolesti, léčbou zánětu měkkých a tvrdých tkání, zabráněním progrese stávajících lézí a vzniku lézí nových. Konzervativní terapie je však spíše léčbou paliativní, která vede k úplnému zhojení jen v malém procentu případů (18–23 %) (13, 34). Spočívá v podávání lokálních i celkových antimikrobiálních prostředků a analgetik, egalizaci ostrých kostních okrajů, sekvestrektomii ve stadiu uvolněného sekvestru, extrakci symptomatických zubů v nekrotické kosti a ve standardní léčbě (incize a drenáž) kolemčelistních zánětů v případě jejich vzniku. Principem chirurgické léčby je pak odstranění veškeré nekrotické kosti čelisti, která je substrátem převážně pro bakteriální infekci, s následným primárním uzavřením rány dobře vaskularizovanými měkkými tkáněmi se suturou nejlépe ve více vrstvách. V případě porušení kontinuity dolní čelisti (segmentální resekce) se doporučuje primární rekonstrukce pomocí osteosyntetického materiálu (7). Byly publikovány i případy úspěšné primární rekonstrukce mandibuly pomocí vaskularizovaných kompozitních volných tkáňových laloků (nejčastěji fibulárním osteomyokutánním) (1). V horní čelisti je pak možná i protetická rekonstrukce pomocí obturačních snímatelných protéz. Odůvodněním odkladu chirurgické léčby je obava z možné progrese lézí, neboť účinku bisfosfonátu je vystavena celá čelist a v resekčních okrajích, kde vzniká nová kostní rána, může opět dojít k problematickému hojení a vzniku osteonekrózy (7). V posledních několika letech však byly publikovány prospektivní studie potvrzující poměrně vysokou úspěšnost (60–100 %) chirurgické léčby i pro nižší stadia onemocnění a pro léze refrakterní na konzervativní terapii (35–38). V některých případech bylo nutné ke zhojení i více chirurgických výkonů, přičemž lepší výsledky byly zaznamenány u pacientů s osteoporózou užívajících perorální bisfosfonáty. Indikaci k radikálním chirurgickým výkonům je třeba vždy volit uvážlivě s ohledem na celkový zdravotní stav pacienta, stadium maligního onemocnění a předpokládanou dobu přežití.
Vzhledem k zatím spíše ojedinělému výskytu ostatních lékově navozených osteonekróz čelistí neexistují žádná doporučení pro jejich léčbu, všechny popsané léze byly léčeny podobně jako osteonekróza čelistí vzniklá v souvislosti s bisfosfonátovou terapií.
PREVENCE
Vzhledem k obtížné terapii bisfosfonátové osteonekrózy čelistí je primární prevence nejdůležitější strategií v přístupu k této komplikaci. Preventivními opatřeními je možné redukovat, nikoliv však zcela eliminovat riziko vzniku těchto lézí, což bylo prokázáno právě u onkologických pacientů (39). Všichni nemocní, u nichž je plánováno zahájení terapie bisfosfonáty, by měli být vyšetřeni zubním lékařem (klinické vyšetření včetně zhotovení ortopantomogramu). Principem primární prevence je vyloučení všech infekčních fokusů v čelistech a celková lege artis sanace chrupu (1). Radikalita ošetření je srovnatelná se sanací chrupu u pacientů před radioterapií v oblasti hlavy a krku (7), způsob ošetření by měl být znám všem zubním lékařům. Toto ošetření pak v době, kdy pacient již bisfosfonáty užívá, snižuje potřebu invazivních výkonů v dutině ústní, a při současné absenci zánětlivých ložisek v čelistních kostech tak i riziko vzniku osteonekrózy čelistí. Pokud jsou v rámci sanace chrupu nutné chirurgické výkony v dutině ústní (nejčastěji extrakce zubů), doporučuje se, pokud to lze, odložit zahájení plánované léčby intravenózními bisfosfonáty u onkologických pacientů o 2–3 týdny, nebo lépe až do prokazatelných známek kostního hojení na skiagramu (7). V průběhu bisfosfonátové léčby je pak samozřejmě zapotřebí další pravidelná zubní péče a dobrá úroveň ústní hygieny. U onkologických pacientů užívajících bisfosfonáty intravenózně je indikována co nejkonzervativnější terapie dentálních onemocnění s eliminací všech invazivních výkonů postihujících především čelistní kosti (extrakce zubu, periapikální, parodontální a jiná dentoalveolární chirurgie, implantologie) (1). V případech, kdy jsou tyto výkony nevyhnutelné, je lépe odeslat pacienty na specializované stomatochirurgické pracoviště.
Takto zavedená preventivní opatření je pak doporučováno dodržovat nejen u onkologických pacientů s terapií bisfosfonáty, ale i těch, kteří užívají jiné léky ovlivňující metabolismus kostí (bone modifying agents), především pak inhibitory funkce osteoklastů (doporučení American Society of Clinical Oncology) (40).
Dosud není k dispozici žádný vědecký důkaz o tom, že by přerušení léčby bisfosfonáty před chirurgickými výkony v dutině ústní snižovalo riziko vzniku osteonekrózy čelistí (1). V případě, že tyto léze jsou již přítomny, je dle AAOMS vysazení intravenózních bisfosfonátů z krátkodobého hlediska bez výraznějšího benefitu. Dlouhodobé přerušení léčby však může stabilizovat postižené oblasti, zmírnit klinické příznaky i snížit riziko postižení nových lokalit. Prioritní je však léčba maligního onemocnění, proto musí být vysazení bisfosfonátů důkladně zvažováno. Na základě současných znalostí ohledně působení denosumabu na kostní remodelaci se doporučuje zvažovat vysazení tohoto léku před plánovanými chirurgickými výkony v dutině ústní ke snížení rizika vzniku osteonekrózy čelistí (29). Přerušení léčby tímto lékem se zdá být vhodné i v případech již rozvinuté osteonekrózy čelistí, což může vést k lepšímu hojení těchto lézí (29). Jako prevence komplikace hojení chirurgických ran – nikoliv osteonekrózy čelistí – někteří autoři doporučují vysadit bevacizumab 6–8 týdnů před chirurgickým výkonem a opět zahájit terapii 4 týdny po výkonu (31).
ZÁVĚR
Jedním ze vzácných nežádoucích účinků antiresorptivní a/nebo cílené léčby ovlivňující kostní metabolismus je osteonekróza čelistí. Se zvýšeným užíváním těchto léků v klinické praxi se především zubní lékaři a stomatochirurgové setkávají s těmito lézemi stále častěji. U nemocných s pokročilými malignitami urogenitálního traktu je často indikována terapie, která je vysoce riziková právě pro vznik této komplikace, a tito pacienti se tak stávají jednou z nejvíce ohrožených skupin mezi onkologicky nemocnými. Osteonekróza čelistí vznikající jako nežádoucí účinek systémové farmakoterapie významně snižuje kvalitu života postižených pacientů. Dosud existuje velké množství nejasností především ohledně patofyziologie vzniku těchto lézí, vzhledem k jejich obtížné léčbě mají velký význam preventivní opatření. S vývojem nových léků lze do budoucna očekávat, že jakákoliv medikace, která ovlivňuje aktivitu osteoklastů, může zvyšovat riziko vzniku těchto lézí.
Došlo: 10. 1. 2013.
Přijato: 19. 2. 2013.
Kontaktní adresa
MUDr. Lukáš Hauer
Stomatologická klinika LF UK a FN
Alej Svobody 80, 304 60 Plzeň
e-mail: hauerl@fnplzen.cz
Podpořeno projektem Ministerstva zdravotnictví ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Střet zájmů: žádný.
Sources
1. Hauer L, Hrušák D, Hostička L, et al. Osteonekróza čelistí v souvislosti s celkovou léčbou bisfosfonáty – doporučení pro praxi. LKS 2011; 21(5): 94–105.
2. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61(9): 1115–1117.
3. Estilo CL, Fornier M, Farooki A, et al. Osteonecrosis of the jaw related to bevacizumab. J Clin Oncol 2008; 26(24): 4037–4038.
4. Taylor KH, Middlefell LS, Mizen KD. Osteonecrosis of the jaws induced by anti-RANK ligand therapy. Br J Oral Maxillofac Surg 2010; 48(3): 221–223.
5. Stopeck AT, Lipton A, Body JJ, et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol 2010; 28(35): 5132–5139.
6. Koch FP, Walter C, Hansen T, Jager E, Wagner W. Osteonecrosis of the jaw related to sunitinib. Oral Maxillofac Surg 2011; 15(1): 63–66.
7. Ruggiero SL, Dodson TB, Assael LA, et al. American Association of Oral and Maxillofacial Surgeons position paper on bisphosphonate-related osteonecrosis of the jaws – 2009 update. J Oral Maxillofac Surg 2009; 67(5 Suppl): 2–12.
8. Yamashita J, McCauley LK. Antiresorptives and osteonecrosis of the jaw. J Evid Based Dent Pract. 2012; 12(3 Suppl): 233–247.
9. Tennis P, Rothman KJ, Bohn RL, et al. Incidence of osteonecrosis of the jaw among users of bisphosphonates with selected cancers or osteoporosis. Pharmacoepidemiol Drug Saf 2012; 21(8): 810–817.
10. Christodoulou C, Pervena A, Klouvas G, et al. Combination of bisphosphonates and antiangiogenic factors induces osteonecrosis of the jaw more frequently than bisphosphonates alone. Oncology 2009; 76(3): 209–211.
11. Aragon-Ching JB, Ning YM, Chen CC, et al. Higher incidence of Osteonecrosis of the Jaw (ONJ) in patients with metastatic castration resistant prostate cancer treated with anti–angiogenic agents. Cancer Invest 2009; 27(2): 221–226.
12. Filleul O, Crompot E, Saussez S. Bisphosphonate-induced osteonecrosis of the jaw: a review of 2,400 patient cases. J Cancer Res Clin Oncol 2010; 136(8): 1117–1124.
13. Hoff AO, Toth BB, Altundag K, et al. Frequency and risk factors associated with osteonecrosis of the jaw in cancer patients treated with intravenous bisphosphonates. J Bone Miner Res 2008; 23(6): 826–836.
14. Jadu F, Lee L, Pharoah M, Reece D, Wang L. A retrospective study assessing the incidence, risk factors and comorbidities of pamidronate-related necrosis of the jaws in multiple myeloma patients. Ann Oncol 2007; 18(12): 2015–2019.
15. Durie BG, Katz M, Crowley J. Osteonecrosis of the jaw and bisphosphonates. N Engl J Med 2005; 353(1): 99–102.
16. Dimopoulos MA, Kastritis E, Anagnostopoulos A, et al. Osteonecrosis of the jaw in pa-tients with multiple myeloma treated with bisphosphonates: evidence of increased risk after treatment with zoledronic acid. Haematologica 2006; 91(7): 968–971.
17. Bamias A, Kastritis E, Bamia C, et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates: incidence and risk factors. J Clin Oncol 2005; 23(34): 8580–8587.
18. Zervas K, Verrou E, Teleioudis Z, et al. Incidence, risk factors and management of osteonecrosis of the jaw in patients with multiple myeloma: a single-centre experience in 303 patients. Br J Haematol 2006; 134(6): 620–623.
19. Fehm T, Beck V, Banys M, et al. Bisphosphonate-induced osteonecrosis of the jaw (ONJ): Incidence and risk factors in patients with breast cancer and gynecological malignancies. Gynecol Oncol 2009; 112(3): 605–609.
20. Sanna G, Preda L, Bruschini R, et al. Bisphosphonates and jaw osteonecrosis in patients with advanced breast cancer. Ann Oncol 2006; 17(10): 1512–1516.
21. Lo JC, O’Ryan FS, Gordon NP, et al. Prevalence of osteonecrosis of the jaw in patients with oral bisphosphonate exposure. J Oral Maxillofac Surg 2010; 68(2): 243–253.
22. Otto S, Abu-Id MH, Fedele S, et al. Osteoporosis and bisphosphonates-related osteonecrosis of the jaw: not just a sporadic coincidence – a multi-centre study. J Craniomaxillofac Surg 2011; 39(4): 272–277.
23. Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377(9768): 813–822.
24. Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol. 2011; 29(9): 1125–1132.
25. Fleissig Y, Regev E, Lehman H. Sunitinib related osteonecrosis of jaw: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; 113(3): e1–3.
26. Troeltzsch M, Woodlock T, Kriegelstein S, et al. Physiology and pharmacology of nonbisphosphonate drugs implicated in osteonecrosis of the jaw. J Can Dent Assoc 2012; 78: c85.
27. Dişel U, Beşen AA, Özyılkan Ö, Er E, Canpolat T. A case report of bevacizumab-related osteo-necrosis of the jaw: old problem, new culprit. Oral Oncol 2012; 48(2): e2–3.
28. Guarneri V, Miles D, Robert N, et al. Bevacizumab and osteonecrosis of the jaw: incidence and association with bisphosphonate therapy in three large prospective trials in advanced breast cancer. Breast Cancer Res Treat 2010; 122(1): 181–188.
29. Epstein MS, Ephros HD, Epstein JB. Review of current literature and implications of RANKL inhibitors for oral health care providers. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; http://dx.doi.org/10.1016/j.oooo.2012.01.046.
30. Otto S, Schreyer C, Hafner S, et al. Bisphosphonate-related osteonecrosis of the jaws – characteristics, risk factors, clinical features, localization and impact on oncological treatment. J Craniomaxillofac Surg 2012; 40(4): 303–309.
31. Gordon CR, Rojavin Y, Patel M, et al. A review on bevacizumab and surgical wound healing: an important warning to all surgeons. Ann Plast Surg 2009; 62(6): 707–709.
32. Sawatari Y, Marx RE. Bisphosphonates and bisphosphonate induced osteonecrosis. Oral Maxillofac Surg Clin North Am 2007; 19(4): 487–498.
33. Hauer L., Baxa J., Hrušák D., Hostička L., Andrle P. Využití zobrazovacích vyšetřovacích metod při diagnostice osteonekrózy čelistí vzniklé v souvislosti s léčbou bisfosfonáty. Prakt zub Lék 2012; 60(1): 4–13.
34. Lazarovici TS, Yahalom R, Taicher S, et al. Bisphosphonate related osteonecrosis of the jaws: a single-center study of 101 patients. J Oral Maxillofac Surg 2009; 67(4): 850–855.
35. Holzinger D, Seemann R, Klug C, et al. Long-term success of surgery in bisphosphonate-related osteonecrosis of the jaws (BRONJs). Oral Oncol 2013; 49(1): 66–70.
36. Stockmann P, Vairaktaris E, Wehrhan F, et al. Osteotomy and primary wound closure in bisphosphonate–associated osteonecrosis of the jaw: a prospective clinical study with 12 months follow-up. Support Care Cancer 2010; 18(4): 449–460.
37. Carlson ER, Basile JD. The role of surgical resection in the management of bisphosphonate-related osteonecrosis of the jaws. J Oral Maxillofac Surg 2009; 67(5 Suppl): 85–95.
38. Williamson RA. Surgical management of bisphosphonate induced osteonecrosis of the jaws. Int J Oral Maxillofac Surg 2010; 39(3): 251–255.
39. Ripamonti CI, Maniezzo M, Campa T, et al. Decreased occurrence of osteonecrosis of the jaw after implementation of dental preventive measures in solid tumour patients with bone metastases treated with bisphosphonates. The experience of the National Cancer Institute of Milan. Ann Oncol 2009; 20(1): 137–145.
40. Van Poznak CH, Temin S, Yee GC, et al. American Society of Clinical Oncology executive summary of the clinical practice guideline update on the role of bone-modifying agents in metastatic breast cancer. J Clin Oncol 2011; 29(9): 1221–1227.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2013 Issue 2-
All articles in this issue
- Using photodynamic diagnosis and narrow band imaging for diagnosing and treating non-muscle-invasive bladder cancer
- Osteonecrosis of the jaw as an adverse effect of therapy in urological cancer patients
- Lower urinary tract obstruction caused by benign prostatic hyperplasia in patients with end stage renal disease
- Comparison of long term outcomes after ileal and gastric bladder augmentation
- Evaluation of pathology results after radical prostatectomy for prostate cancer despite „normal“ values of PSA from the viewpoint of a urologist
- A case report of hydronephrosis affecting a large segment of a horseshoe kidney
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A case report of hydronephrosis affecting a large segment of a horseshoe kidney
- Osteonecrosis of the jaw as an adverse effect of therapy in urological cancer patients
- Lower urinary tract obstruction caused by benign prostatic hyperplasia in patients with end stage renal disease
- Evaluation of pathology results after radical prostatectomy for prostate cancer despite „normal“ values of PSA from the viewpoint of a urologist
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

