-
Medical journals
- Career
Srovnání dlouhodobých výsledků u pacientů po augmentaci močového měchýře ileálním a gastrickým segmentem
Authors: Radim Skalka 1,2; Radim Kočvara 1; Zdeněk Dítě 1; Jan Dvořáček 1; Tomáš Hanuš 1
Authors‘ workplace: Urologická klinika 1. LF UK a VFN, Praha 1; Urologické oddělení FN, Ostrava 2
Published in: Ces Urol 2013; 17(2): 109-117
Category: Original article
Overview
Cíl:
Srovnání dlouhodobých výsledků pacientů po gastrocystoplastice a ileocystoplastice a stanovení rizika vzniku malignit na základě podrobné rešerše literatury.Materiál a metoda:
V období únor 1990 až září 2006 bylo na Urologické klinice VFN v Praze provedeno 37 augmentací močového měchýře u 35 pacientů. Srovnáváme dlouhodobé výsledky a celkovou morbiditu 17 pacientů po ileocystoplastice (ICPL) a 15 pacientů po gastrocystoplastice (GCPL). Dva pacienty po kompozitní ileogastrocystoplastice nehodnotíme. Průměrný věk v době operace u pacientů po ICPL byl 12,5 let (5,8–19,2) a základní diagnózou byl neurogenní močový měchýř a komplex exstrofie/epispadie. U pacientů po GCPL byl průměrný věk v době operace 12,9 let (0,8–28,1) a základní diagnózou byl neurogenní močový měchýř a komplex exstrofie/epispadie. Retrospektivně jsme zhodnotili předoperační i pooperační nálezy (anamnézu, laboratorní, zobrazovací a urodynamická vyšetření) pacientů se zaměřením na komplikace a dlouhodobé funkční výsledky provedených augmentací.Výsledky:
U pacientů po ICPL je průměrná doba sledování 15,2 let; cystometrická kapacita močového měchýře vzrostla v průměru ze 122 na 401 ml a maximální plnící intravezikální tlak poklesl z 59,4 na 30cm H2O; plné kontinence moči dosáhlo 64,7 % pacientů. U pacientů po GCPL je průměrná doba sledování 16,3 let; cystometrická kapacita vzrostla v průměru ze 121 ml na 327 ml a intravezikální tlak poklesl ze 65,4 na 33,7 cm H2O; plné kontinence moči dosáhlo 60 % pacientů. Febrilní uroinfekce se vyskytly u 11,7 % pacientů po ICPL a u 20 % po GCPL, cystolitiáza vznikla u 11,7 % pacientů po ICPL, hematuria – dysuria syndrom se projevil u 20 % pacientů po GCPL, při jeho léčbě jsme udělali originální dobrou zkušenost s použitím kalium citrátu. U jednoho pacienta v každém souboru bylo nutné provést reaugmentaci jiným segmentem GIT a jeden pacient po GCPL zemřel na progresi CHRI. U žádného pacienta jsme nezaznamenali vznik maligního nádoru v augmentovaném měchýři.Závěr:
Dlouhodobé výsledky u pacientů po ICPL i GCPL jsou srovnatelné. Bylo dosaženo uspokojivých funkčních výsledků, ale za cenu vysoké morbidity, která je mírně vyšší u pacientů po GCPL. Pacienti vyžadují pravidelné a dlouhodobé sledování za účelem ochrany renálních funkcí a udržení kontinence moči. Vzhledem k riziku vzniku maligních nádorů v augmentovaném měchýři je nutné provádět roční cystoskopické kontroly se zahájením 10 let po augmentaci, což musí zajistit urolog, který tyto pacienty v dospělosti přebírá do péče.Klíčová slova:
gastrocystoplastika, ileocystoplastika, komplex exstrofie/epispadie, nádory močového měchýře, neurogenní měchýř.ÚVOD
Augmentace močového měchýře – augmentační cystoplastika – je indikována u pacientů s malokapacitním vysokotlakým močovým měchýřem, po vyčerpání konzervativních či méně invazivních léčebných metod. Cílem je ochrana renálních funkcí a dosažení močové kontinence u pacientů s neurogenní a non-neurogenní dysfunkcí močového měchýře či se závažnými vrozenými vadami močových cest (1). K augmentaci jsou nejčastěji využívány různé segmenty gastrointestinálního traktu (GIT) s dobrými funkčními výsledky, ale i s významnými komplikacemi, které se liší podle použitého segmentu (2). Použití ilea je spojeno s výskytem hyperchloremické acidózy, zvýšenou produkcí hlenu, tvorbou konkrementů v močovém měchýři, četnějšími symptomatickými uroinfekcemi a spontánní perforací měchýře (3). Při použití žaludku se vyskytuje hypochloremická hypokalemická alkalóza a hematuria – dysuria syndrom (4). Výskyt pozdních malignit je popisován při použití střevního i gastrického segmentu (5). Selhání augmentace je popisováno při použití jakéhokoliv segmentu u 5–42 % pacientů (2). Žaludek začal být k augmentaci močového měchýře používán od konce padesátých let 20. století, nejprve experimentálně u zvířat (6), později u dospělých i dětských pacientů (7). Výhodou jeho použití je sekrece kyselých substancí žaludeční sliznicí a kvalita jeho stěny, usnadňující provádění reimplantace močovodů a implantaci Mitrofanoffova stomatu. Indikací k jeho použití byla renální insuficience s metabolickou acidózou a syndrom krátkého střeva u pacientů s kloakální exstrofií (8). Pro výskyt komplikací, zejména hematuria – dysuria syndromu, a vzhledem k posléze popisovaným malignitám, není dnes jeho použití metodou první volby (9) a častěji je k augmentacím využíváno ileum. V naší práci hodnotíme celkovou morbiditu a dlouhodobé funkční výsledky pacientů po augmentaci močového měchýře pomocí ilea a žaludku a současně přikládáme podrobný přehled literatury se zaměřením na výskyt nádorů.
METODA
Retrospektivně jsme zhodnotili nálezy u 35 pacientů, kteří podstoupili 37 augmentací močového měchýře na Urologické klinice VFN v Praze od února 1990 do září 2006. U 17 pacientů byla provedena ileocystoplastika (ICPL), u 15 gastrocystoplastika (GCPL), u dvou kompozitní ileo-gastrocystoplastika a u tří kolocystoplastika. Předmětem této studie jsou pacienti po ileocystoplastice a gastrocystoplastice, které byly provedeny v letech 1990–2006 a 1993–1999:
- ICPL byla provedena u 17 pacientů ve věku 5,8–19,2 let (průměr 12,5 let), jedenáct chlapců a šest dívek, se základní diagnózou neurogenní močový měchýř u 16 a komplex exstrofie/epispadie u jednoho pacienta.
- GCPL byla provedena u 15 pacientů ve věku 0,8–28,1 let (průměr 12,9 let), deset chlapců a pět dívek, se základní diagnózou neurogenní močový měchýř u sedmi a komplex exstrofie/epispadie u osmi pacientů.
Cystoplastiku střevním segmentem jsme indikovali v prvním období 2/1990 až 2/1994. V dalším období 9/1993 až 2/1999 jsme dávali přednost gastrocystoplastice z důvodů menší tvorby hlenu, snazšímu způsobu reimplantace močovodů a apendikostomie do gastrického segmentu, menšímu riziku vzniku acidózy. V tomto druhém období také obecně poklesly indikace pro augmentace neurogenních měchýřů a začaly se více indikovat augmentace primárně rekonstruovaných exstrofických měchýřů. I přes dobré zkušenosti s léčbou hematuria dysuria syndromu jsme v dalším období indikovali pouze kompozitní gastroileocystoplastiky u pacientů v renální insuficienci.
Před operací byl u všech pacientů vyšetřen stav horních močových cest (USG, MCUG, IVU, scintigrafie), provedeno urodynamické vyšetření, v indikovaných případech cystoskopie, byly stanoveny sérové hladiny urey, kreatininu, iontů, hodnoty krevního obrazu, acidobazické rovnováhy, vyšetřena moč chemicky + sediment a kultivace moči. Současně s rekonstrukcí močového měchýře bylo nutné provést další výkony, které uvádíme v tabulce 1. Pooperačně jsme pacienty sledovali v intervalu 3–6 měsíců, anamnesticky jsme zjišťovali výskyt močových infekcí, změny zabarvení moči, bolesti, stav kontinence, četnost intermitentní katetrizace. Stav horních močových cest jsme sledovali sonograficky, při nálezu dilatace vývodného systému ledvin byla doplněna IVU s furosemidovým testem a při podezření na snížení renálních funkcí scintigrafie ledvin. Kontrolovali jsme parametry acidobazické rovnováhy, krevního obrazu, sérových hladin urey, kreatininu, iontů, moč (chemicky, sediment, kultivace), u gastrocystoplastik sérovou hodnotu gastrinu. Kontrolní (video) – urodynamické vyšetření bylo provedeno u všech pacientů v různém odstupu od operace a opakováno podle klinického průběhu, zejména při přetrvávání inkontinence. Pravidelné cystoskopické kontroly jsme začali provádět v ročních intervalech po 10 letech od augmentace, v indikovaných případech (hematurie, litiáza) také mimo tento interval. Ke statistickému srovnání parametrů funkčních výsledků v souboru ICPL a GCPL (maximální cystometrická kapacita, maximální intravezikální tlak) byl použit t-test.
Table 1. Počet výkonů provedených současně s augmentací močového měchýře v obou souborech Table 1. Additional surgical procedures at time of augmentation 
*počet reimplantovaných ureterů *number of reimplanted ureters VÝSLEDKY
Průměrná doba sledování pacientů po ICPL je 15,2 let (6,3–22,5) a po GCPL 16,3 let (13,7–19), jeden pacient z každého souboru byl ztracen v průběhu sledování. Předoperační ani pooperační hodnoty cystometrického vyšetření (kapacita, maximální plnící intravezikální tlak) se významně v obou souborech nelišily (tab. 2). V souboru ICPL dosáhlo plné kontinence jedenáct pacientů (64,7 %), zvýšila se maximální cystometrická kapacita ze 122 na 401 ml, což představuje nárůst o 228,6 %; současně se snížil maximální plnící intravezikální tlak o 49,5 % z 59,4 na 30 cm H2O. V souboru GCPL dosáhlo plné kontinence devět pacientů (60 %), další tři pacienti (20 %) jsou kontinentní přes den a noční úniky řeší zavedením katétru do appendikovezikostomie. Maximální průměrná cystometrická kapacita se zvýšila ze 121 na 327 ml, což představuje nárůst o 169,6 %. Maximální průměrný intravezikální tlak poklesl o 48,5 % ze 65,4 na 33,7 cm H2O. Za účelem zlepšení kontinence moči byly u pacientů v obou souborech dodatečně provedeny další výkony (tab. 3). Sérová hladina gastrinu byla u všech pacientů po GCPL v průběhu sledování v normě, vyjma jednorázového zvýšení u jednoho pacienta, v průměru 75,6 mIU/l (48–153,1).
Table 2. Funkční výsledky po augmentaci Table 2. Functional outcome after augmentation 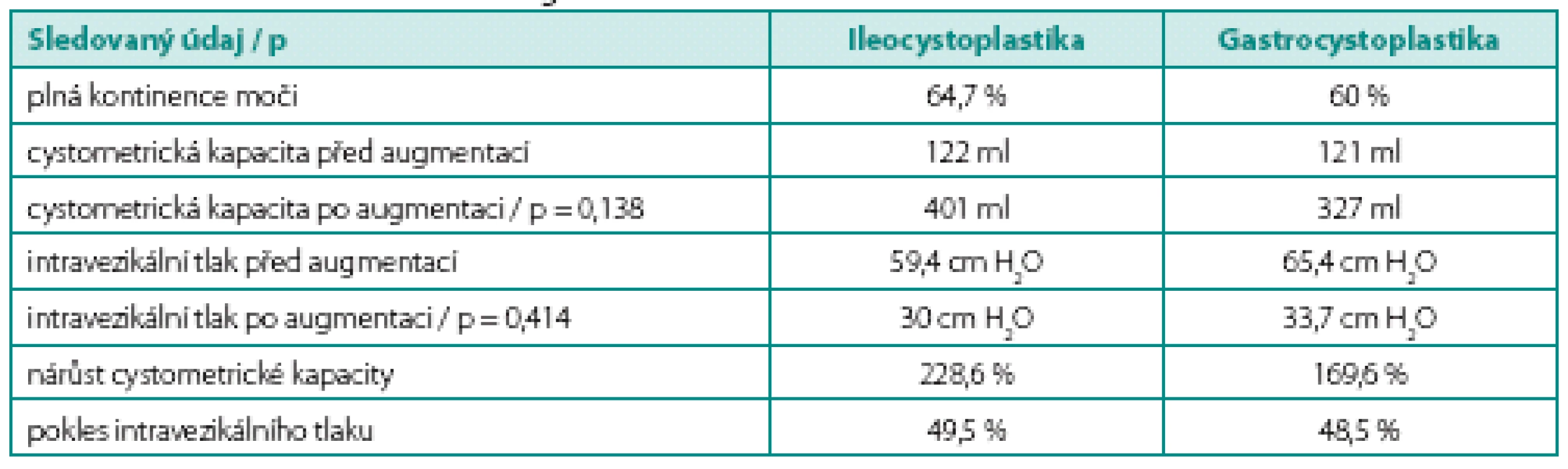
Table 3. Výkony provedené v dalším průběhu Table 3. Additional surgical procedures during follow-up 
Pooperační komplikace (tab. 4)
Table 4. Počet komplikujících příhod po augmentaci v obou souborech Table 4. Number of complicating events after augmentation 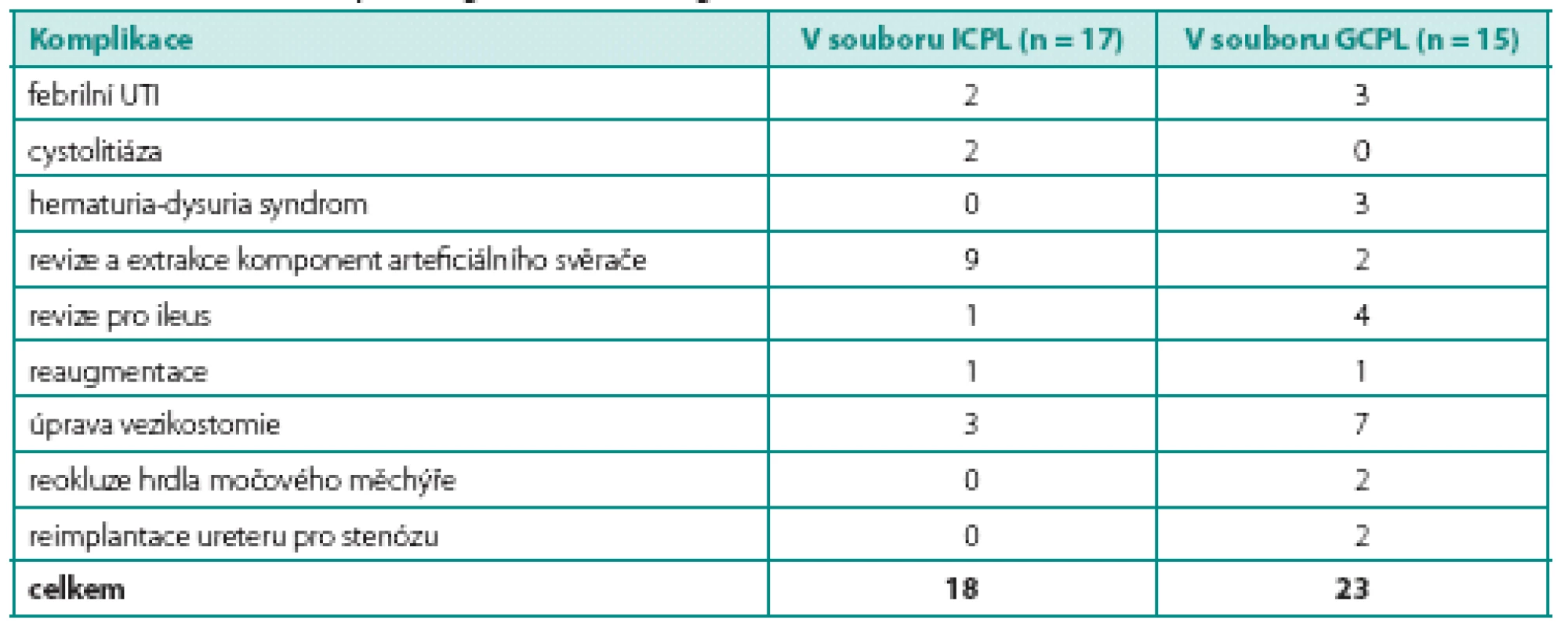
Mírné komplikace do stupně I a II podle Clavienovy stupnice se vyskytly u všech pacientů. Závažnější komplikace (Clavien III b) vznikly pouze u tří pacientů po GCPL. Jednalo se o revizi břicha pro ileus u dvou pacientů a úpravu apendikovezikostomie pro dehiscenci u jednoho pacienta.
Komplikace v průběhu dalšího sledování (tab. 4)
Rovněž jsme zaznamenali komplikace vyžadující chirurgické řešení. V souboru ICPL se jednalo o revizi břicha pro ileus (1), úpravu a exstirpaci apendikovezikostomie (3), revizi a exstirpaci komponent arteficiálního svěrače (9), cystolitotrypsi (1) a reaugmentaci (1). V souboru GCPL jsme provedli revizi břicha pro ileus u dalších dvou pacientů, úpravu apendikovezikostomie (7), reokluzi hrdla měchýře (2), exstirpaci komponent arteficiálního svěrače (2), reimplantaci ureteru pro stenózu ústí (2), reaugmentaci (1). V souboru ICPL se vyskytly febrilní infekce močových cest u dvou pacientů (11,7 %), cystolitiáza u dvou (11,7 %), u jednoho pacienta došlo k progresi chronické renální insuficience. V souboru GCPL se vyskytly febrilní infekce močových cest u tří pacientů (20 %), u dvou pacientů přetrvává vezikoureterální reflux nízkého stupně a u dvou došlo k progresi CHRI, z nichž jedna pacientka podstoupila transplantaci ledviny za 18 let od augmentace. Hematuria-dys-uria syndrom se projevil u tří pacientů (20 %), u všech pacientů byly potíže mírného stupně, dobře reagující na podání kalium citrátu per os v dávce 3 × 1 gram. V současné době jsou všichni tito pacienti asymptomatičtí a nevyžadují léčbu. Jeden pacient po GCPL zemřel 14 let po operaci. Jednalo se o pacienta s neurogenním měchýřem po operaci meningomyelokély, gastrocystoplastiku podstoupil v 10 letech. Pro přetrvávající vysoký intravezikální tlak a sekundární megaureter funkčně solitární ledviny byla o 3 roky později provedena reaugmentace pomocí sigmoideálního laloku, kterou bylo dosaženo uspokojivých funkčních výsledků (cystometrická kapacita, intravezikální tlak, kontinence). Pro rozpad sociálního zázemí u pacienta došlo ke ztrátě spolupráce, k progresi renální insuficience, na kterou pacient za ne zcela jasných okolností zemřel. V žádném ze souborů jsme nezaznamenali výskyt závažných metabolických komplikací ani výskyt tumorů v augmentovaném měchýři (tab. 4).
DISKUSE
Počet provedených augmentací u dětských pacientů se v současnosti snižuje. U neurogenního měchýře jsou důvodem méně invazivní metody léčby – aplikace botulinum toxinu do detruzoru (10) či intravezikální instilace anticholinergik u pacientů s nedostatečnou léčebnou odpovědí či nežádoucími účinky po jejich perorálním podání. U komplexu exstrofie/epispadie je pro dosažení potřebné kapacity měchýře důležitá včasná primární rekonstrukce buď po narození, či v raném kojeneckém věku (11). I přesto je potřeba následné augmentace u takto operovaných pacientů udávána v širokém rozmezí 0–70 % (12). U obou typů augmentací jsme dosáhli zvýšení kapacity močového měchýře a poklesu intravezikálního tlaku. Vyšší kapacita byla dosažena u pacientů po ileocystoplastice než po gastrocystoplastice, ale rozdíl není statisticky významný (p = 0,138). V publikovaných souborech je průměrná kapacita měchýře po GCPL udávána v rozmezí 275–490 ml (13–15). Provedením augmentace se sníží evakuační schopnost měchýře, kterou je nutné zajistit prováděním intermitentní katetrizace stomatem dle Mitrofanoffa nebo per urethram (16, 17). Se zvýšením kapacity a snížením intravezikálního tlaku souvisí i dosažení močové kontinence, která je v obou souborech srovnatelná, přesahující 60 %. V publikovaných souborech je udávána kontinence 78–100% po ICPL a 48–100% po GCPL (2). Zde je ale důležité rozlišit základní onemocnění, protože kontinentní mechanismus je u pacientů s neurogenním měchýřem a detruzoro-sfinkterickou dyssynergií zachován, na rozdíl od pacientů po operaci exstrofie měchýře. K posílení kontinentního mechanismu byly prováděny další výkony – plastika a okluze hrdla močového měchýře a implantace arteficiálního svěrače. V literatuře je popsáno použití arteficiálního svěrače u pacientů s augmentovaným měchýřem všemi segmenty GIT. Implantace sfinkteru je prováděna jak simultánně s augmentací, tak jako dvoudobá operace. Největším rizikem jsou infekční komplikace a eroze komponent sfinkteru. Miller a Mitchell v roce 1998 referovali v souboru 29 pacientů se simultánní implantací svěrače výskyt infekce v 6,9 % a odstranění sfinkteru u 27 % případů (18). Holmes v roce 2001 udává 43% výskyt infekce a eroze při simultánní implantaci svěrače a GCPL (19). Uzavírá, že faktory zvyšující riziko infekce a eroze, jsou předchozí operace na hrdle měchýře a operace ingvinální hernie. V našem souboru jsme implantovali svěrač simultánně s augmentací u jednoho pacienta v obou skupinách a u tří pacientů po ICPL v druhé době. Jednalo se o pacienty se základní diagnózou neurogenní močový měchýř. U čtyř pacientů došlo k infekčním komplikacím či erozi komponent svěrače, vyžadující jeho exstirpaci v průměru za 37 měsíců (14–99 měsíců) po implantaci. U jednoho pacienta po ICPL je ponechán malfunkční svěrač. Všichni tito pacienti jsou na režimu IK s inkontinencí mírného stupně vyžadující minimální potřebu absorpčních pomůcek (20).
Dalším problémem augmentací je výskyt infekcí močových cest a tvorba konkrementů v augmentovaném měchýři (7). Vzniku infekcí napomáhá chronické močové reziduum, přítomnost hlenu a katetrizace měchýře per vias naturales. Je potřeba odlišit symptomatickou febrilní uroinfekci od asymptomatické bakteriurie, kterou není potřeba léčit antibiotiky, profylaktické podávání antibiotik se však u některých pacientů osvědčilo (21). Výskyt febrilních uroinfekcí byl v obou našich souborech nízký. Vzniku cystolitiázy napomáhá produkce hlenu střevní sliznicí, která je v případě žaludeční sliznice minimální. Cystoli-tiázu jsme zaznamenali pouze u dvou pacientů po ileocystoplastice (11,7 %), což odpovídá publikovaným údajům s udávaným výskytem u 10–52 % pacientů (22, 23). Jednalo se o vícečetnou drobnou litiázu, která byla řešena endoskopicky. Přítomnost litiázy, chronická infekce a možnost traumatizace při katetrizaci, zvláště u pacientů s porušenou senzitivitou měchýře, mohou vést ke spontánní perforaci augmentovaného měchýře, jejíž incidence je udávána v 6–13 % případů s mortalitou 25 % (24, 25). K této komplikaci nedošlo u žádného pacienta v našem souboru. Za nejvýznamnější komplikaci gastrocystoplastik se obecně považuje hematuria-dysuria syndrom. Jedná se o soubor příznaků zahrnující spazmy močového měchýře, suprapubickou, penilní či peri-uretrální bolest, mikroskopickou nebo makroskopickou hematurii a dyzurii bez přítomnosti uroinfekce a také kožní exkoriace v genitální krajině (26). Častěji se vyskytuje u pacientů se zachovanou senzitivitou uretry, kteří nejsou zcela kontinentní, a také u pacientů s CHRI (27). Incidence se pohybuje mezi 9–70 %, etiologie není zcela jasná, roli může hrát zvýšená hladina gastrinu v séru (28) a infekce Helicobacter pylori (29). Léčba závisí na míře symptomů a je ve většině případů konzervativní, podáváním H2-blokátorů, omeprazolu, zvýšeným obratem tekutin či irrigací měchýře. Po podání bikarbonátu bylo pozorováno zvýšení hladiny gastrinu v séru (30). Pouze v případech úporných symptomů je indikována excize gastrického laloku. V našem souboru se syndrom projevil u tří pacientů (20 %), příznaky byly intermitentní, dobře reagující na podání kalium citrátu, který zvýší pH moči. Nárůst gastrinu jsme po jeho aplikaci nezaznamenali. Tuto léčbu, se kterou jsme se v písemnictví nesetkali, jsme úspěšně použili i u dalších dvou pacientů po augmentaci kompozitním lalokem ileogastrickým, u kterých se syndrom rovněž objevil.
Závažnou komplikací je výskyt pozdních malignit v augmentovaném měchýři, poprvé popsaný v roce 1971 (31). Dosud bylo popsáno více než 50 případů po enterocystoplastice s incidencí 1,2–3,8 % a s manifestací v průměru za 22 let (8–55 let) od augmentace (32); histologicky se jedná o adenokarcinomy.
V poslední době je popisován vznik malignit také po gastrocystoplastice, opět se jedná o adenokarcinomy, ale také o uroteliální karcinomy. Provedli jsme podrobnou rešerši článků popisujících gastrocystoplastiku v databázi PubMed, publikovaných v letech 1988–2012. Popsáno bylo více než 500 provedených gastrocystoplastik a celkem deset případů maligního nádoru s manifestací za 10 až 15 let po provedení gastrocystoplastiky. Zdá se, že se maligní nádory po gastrocystoplastice objevují dříve (37). Nádory se prezentují jak makroskopickou hematurií, tak nespecifickými příznaky nebo hydronefrózou, či se projeví již jako metastatické onemocnění s nejistou prognózou (33–39). Pacienty po augmentaci měchýře gastrointestinálním segmentem je proto nutné trvale a pravidelně sledovat. Vedle zobrazení horních močových cest sonograficky v minimálně ročních intervalech je doporučeno provádění cystoskopie 1krát ročně, se zahájením 10 let od augmentace (40). V našem souboru jsme v průběhu sledování, s průměrnou dobou 15, resp. 16 let v obou skupinách, tumor nezaznamenali u žádného pacienta.
ZÁVĚR
Oba srovnávané soubory pacientů po augmentaci močového měchýře mají obdobné předoperační charakteristiky, mimo zastoupení základních diagnóz. Dlouhodobé výsledky jsou srovnatelné. Jak po ileocystoplastice, tak po gastrocystoplastice bylo dosaženo uspokojivých funkčních výsledků, ale za cenu vysoké morbidity, zejména s nutností opakovaných chirurgických zákroků. Morbidita byla mírně vyšší u pacientů po GCPL. Obávaný hematuria-dysuria syndrom bylo možné dobře ovlivnit kalium citrátem. Dle našich znalostí nebyla tato léčba dosud publikována. Pacienti vyžadují aktivní způsob evakuace močového měchýře, často chronickou medikamentózní léčbu, trvalé kontroly funkce měchýře a stavu ledvinných funkcí, včetně acidobazické rovnováhy, na což musí dbát i urolog, který tyto pacienty po dosažení dospělosti přebírá do péče. Vzhledem k riziku vzniku pozdních malignit v augmentovaném měchýři je nutné provádět roční cystoskopické kontroly se zahájením za 10 let po augmentaci.
Použité zkratky
CHRI – chronická renální insuficience
IK – intermitentní katetrizace
IVU – intravenózní vylučovací urografie
MCUG – mikční cystouretrografie
USG – ultrasonografie
Došlo: 6. 3. 2013.
Přijato: 22. 4. 2013.
Kontaktní adresa
MUDr. Radim Skalka
Urologické oddělení FN
17. listopadu 1790, 708 00 Ostrava-Poruba
e-mail: rskalka@seznam.cz
Střet zájmů: žádný.
Sources
1. Metcalfe PD, Rink RC. Bladder augmentation: complications in the pediatric population. Curr Urol Rep 2007; 8(2): 152–156.
2. Biers SM, Venn SN, Greenwell TJ. The past, present and future of augmentation cystoplasty. BJU Int 2012; 109(9): 1280–1293.
3. Kispal Z, Balogh D, Erdei O, Kehl D, Juhasz Z, Vastyan AM, Farkas A, Pinter AB, Vajda P. Complications after bladder augmentation or substitution in children: a prospective study of 86 patients. BJU Int 2011; 108(2): 282–289.
4. Kurzrock EA, Baskin LS, Kogan BA. Gastrocystoplasty: long-term follow-up. J Urol 1998; 160(6 Pt 1): 2182–2186.
5. Husmann DA. Malignancy after gastrointestinal augmentation in childhood. Ther Adv Urol 2009; 1(1): 5–11.
6. Sinaiko E. Artificial bladder from segment of stomach and study of effect of urine on gastric secretion. Surg Gynecol Obstet 1956; 102(4): 433–438.
7. Adams MC, Mitchell ME, Rink RC. Gastrocystoplasty: an alternative solution to the problem of urological reconstruction in the severely compromised patient. J Urol 1988; 140(5): 1152–1156.
8. Kurzrock EA, Baskin LS, Kogan BA. Gastrocystoplasty: is there a consensus? World J Urol 1998; 16(4): 242–250.
9. Mingin GC, Stock JA, Hanna MK. Gastrocystoplasty: long-term complications in 22 patients. J Urol 1999; 162(3): 1122–1125.
10. Zerhau P, Husár M, Brichtová E, Mackerle Z, Šmakal O, Vrána J. Opakovaná intradetruzorová aplikace botulinumtoxinu A u dětí s hyperaktivitou detruzoru. Cesk Slov Neurol N 2011; 74/107(4): 471–474.
11. Zerhau P, Husár M. Současná strategie léčby neurogenního močového měchýře u pacientů s míšními dysrafismy. Rozhl Chir 2010; 89 : 306–309.
12. Woodhouse CR, North AC, Gearhart JP. Standing the test of time: long–term outcome of reconstruction of the exstrophy bladder. World J Urol 2006; 24(3): 244–249.
13. Dykes EH, Ransley PG. Gastrocystoplasty in children. Br J Urol 1992; 69(1): 91–95.
14. Gosalbez R Jr, Woodard JR, Broecker BH, Parrott TS, Massad C. The use of stomach in pediatric urinary reconstruction. J Urol 1993; 150(2): 438–440.
15. DeFoor W, Minevich E, Reeves D, Tackett L, Wacksman J, Sheldon C. Gastrocystoplasty: long-term followup. J Urol 2003; 170(4): 1647–1649.
16. Dvořáček J, Kočvara R. Appendix vermiformis a jeho využití v urologii. Rozhl Chir 1995; 74 : 176–179.
17. Hanuš T. Intermitentní katetrizace močového měchýře. Čas. Lék. čes. 1983; 122 : 1135–1137.
18. Miller EA, Mayo M, Kwan D, Mitchell M. Simultaneous augmentation cystoplasty and artificial urinary sphincter placement: infection rates and voiding mechanisms. J Urol 1998; 160(3): 750–752.
19. Holmes NM, Kogan BA, Baskin LS. Placement of artificial urinary sphincter in children and simultaneous gastrocystoplasty. J Urol 2001; 165(6): 2366–2368.
20. Hanuš T, Dvořáček J, Kočvara R. Umělý svěrač močové trubice u mužů. Rozhl Chir 1997; 76 : 17–21.
21. DeFoor W, Minevich E, McEnery P, Tackett L, Reeves D, Sheldon C. Lower urinary tract reconstruction is safe and effective in children with end stage renal disease. J Urol 2003; 170(4): 1497–1500.
22. Kaefer M, Hendren WH, Bauer SB, Goldenblatt P, Peters CA, Atala A, Retik AB. Reservoir calculi: a comparison of reservoirs constructed from stomach and other enteric segments. J Urol 1998; 160(6): 2187–2190.
23. DeFoor W, Minevich E, Reddy P, Sekhon D, Polsky E, Wacksman J, Sheldon C. Bladder calculi after augmentation cystoplasty: risk factors and prevention strategies. J Urol 2004; 172(5): 1964–1966.
24. DeFoor W, Tackett L, Minevich E, Wacksman J, Sheldon C. Risk factors for spontaneous bladder perforation after augmentation cystoplasty. Urology 2003; 62(4): 737–741.
25. Reinberg Y, Manivel JC, Froemming C, Gonzalez R. Perforation of the gastric segment of an augmented bladder secondary to peptic ulcer disease. J Urol 1992; 148(2): 369–371.
26. Nguyen DH, Bain MA, Salmonson KL, Ganesan GS, Burns MW, Mitchell ME. The syndrome of dysuria and hematuria in pediatric urinary reconstruction with stomach. J Urol 1993; 150(2): 707–709.
27. Chadwick Plaire J, Snodgrass WT, Grady RW, Mitchell ME. Long-term follow-up of the hematuria-dysuria syndrome. J Urol 2000; 164(3): 921–923.
28. Plawker MW, Rabinowitz SS, Etwaru DJ, Glassberg KI. Hypergastrinemia, dysuria-hematuria and metabolic alkalosis: complications associated with gastrocystoplasty. J Urol 1995; 154(2): 546–549.
29. Celayir S, Göksel S, Büyükünal SN. The relationship between Helicobacter pylori infection and acid–hematuria syndrome in pediatric patients with gastric augmentation-II. J Pediatr Surg 1999; 4(4): 532–535.
30. Kinahan TJ, Khoury AE, McLorie GA, Churchill BM. Omeprazole in post-gastrocystoplasty metabolic alkalosis and aciduria. J Urol 1992; 147(2): 435–437.
31. Smith P, Hardy GJ. Carcinoma occurring as a late complication of ileocystoplasty. Br J Urol 1971; 43(5): 576–579.
32. Vemulakonda VM, Lendvay TS, Shnorhavorian M, Joyner BD, Kaplan H, Mitchell ME, Grady RW. Metastatic adenocarcinoma after augmentation gastrocystoplasty. J Urol 2008; 179(3): 1094–1096.
33. Qiu H, Kordunskaya S, Yantiss RK. Transitional cell carcinoma arising in the gastric remnant following gastrocystoplasty: a case report and review of the literature. Int J Surg Pathol 2003; 11(2): 143–147.
34. Esquena Fernández S, Abascal JM, Tremps E, Morote J. Gastric cancer in augmentation gastrocystoplasty. Urol Int 2005; 74(4): 368–370.
35. Baydar DE, Allan RW, Castellan M, Labbie A, Epstein JI. Anaplastic signet ring cell carcinoma arising in gastrocystoplasty. Urology 2005; 65(6): 1226.
36. Balachandra B, Swanson PE, Upton MP, Yeh MM. Adenocarcinoma arising in a gastrocystoplasty. J Clin Pathol 2007; 60(1): 85–87.
37. Castellan M, Gosalbez R, Perez–Brayfield M, Healey P, McDonald R, Labbie A, Lendvay T. Tumor in bladder reservoir after gastrocystoplasty. J Urol 2007; 178(4): 1771–1774.
38. Zhang X, Gupta R, Nicastri AD. Bladder adenocarcinoma following gastrocystoplasty. J Pediatr Urol 2010; 6(5): 525–527.
39. Castellan M, Gosalbez R, Bar-Yosef Y, Labbie A. Complications after use of gastric segments for lower urinary tract reconstruction. J Urol 2012; 187(5): 1823–1827.
40. Dítě Z, Dvořáček J, Kočvara R, Kříž J. Srovnání funkcí močového měchýře augmentovaného ileálním, gastrickým, resp. sigmoideálním segmentem: 13. kongres Slovenskej a Českej urologickej spoločnosti. Vysoké Tatry, Štrbské pleso, 8.–10. 6. 2000. Urológia 2000; 6 : 36.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2013 Issue 2-
All articles in this issue
- Využití fotodynamické diagnostiky a úzkopásmového zobrazení v diagnostice a léčbě svalovinu neinfiltrujících nádorů močového měchýře
- Osteonekróza čelistí jako nežádoucí účinek léčby urologických onkologických pacientů
- Obstrukce dolních močových cest na podkladě benigní hyperplazie prostaty u pacientů v konečném stadiu renálního onemocnění
- Srovnání dlouhodobých výsledků u pacientů po augmentaci močového měchýře ileálním a gastrickým segmentem
- Zhodnocení patologických výsledků z pohledu urologa po radikální prostatektomii z důvodu karcinomu prostaty i při „normálních“ hodnotách PSA
- Hydronefróza segmentu podkovovité ledviny raritní velikosti a jeho chirurgické řešení
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hydronefróza segmentu podkovovité ledviny raritní velikosti a jeho chirurgické řešení
- Osteonekróza čelistí jako nežádoucí účinek léčby urologických onkologických pacientů
- Obstrukce dolních močových cest na podkladě benigní hyperplazie prostaty u pacientů v konečném stadiu renálního onemocnění
- Zhodnocení patologických výsledků z pohledu urologa po radikální prostatektomii z důvodu karcinomu prostaty i při „normálních“ hodnotách PSA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

