-
Medical journals
- Career
Selhání lokální léčby karcinomu prostaty
Authors: Milan Král; Vladimír Študent
Authors‘ workplace: Urologická klinika LF UP a FN, Olomouc
Published in: Ces Urol 2012; 16(2): 83-90
Category: Review article
Overview
Základní léčebné možnosti karcinomu prostaty zahrnují radikální prostatektomii a radioterapii. U řady pacientů je po ukončení léčby prokázáno rostoucí PSA jako známka perzistence onemocnění. Tato elevace PSA bývá často jediným průkazem recidivy karcinomu, která zpravidla předchází klinickou manifestaci o měsíce či roky. Úkolem klinika je pak na podkladě ukazatelů, jako je čas do biochemické recidivy, dynamika PSA, klinické a případně pooperační stadium onemocnění a grading určit, zda se jedná o lokální či vzdálenou recidivu onemocnění. Podle toho je následně vedena další léčebná strategie.
Klíčová slova:
karcinom prostaty, selhání léčby, salvage terapie, PSA.ÚVOD
Přes všechny současné pokroky v diagnostice karcinomu prostaty a zdokonalení léčebných možností dochází u poměrně vysokého procenta pacientů po radikální prostatektomii (RP) a radioterapii (RT) k nálezu postterapeuticky nenulového či progredujícího PSA. Toto biochemické selhání bývá často jedinou známkou přítomného maligního onemocnění (jde o tzv. PSA-only relaps). Úkolem klinika je pak na podkladě ukazatelů, jako je čas do biochemické recidivy, dynamika PSA, klinické a případně pooperační stádium onemocnění a grading určit, zda se jedná o lokální či vzdálenou recidivu onemocnění. Analýza dat sledující dobu do biochemického selhání v souboru 4561 pacientů po radikální prostatektomii poukázala na fakt, že k biochemické progresi došlo až u 31 % pacientů. U většiny z nich (cca 90 %) relaps choroby nastal během prvních 5 let po operaci. Příznivými parametry byly mj. PSA < 10 ng/ml (vs. > 20 ng/ml) a pooperační Gleasonovo skóre < 7 (vs. ≥ 7) (1). Z tohoto lze vyvodit, že toto období je z hlediska odhalení recidivy klíčové.
Přirozený průběh onemocnění nastínila skupina z Johns Hopkins na 1997 pacientech léčených v období 1982–1987 radikální prostatektomií. Z celkového souboru došlo k samotnému PSA relapsu u 315 pacientů, z nichž 304 bylo dále sledováno do vzniku klinických metastáz. Medián do vzniku metastáz od průkazu biochemické recidivy byl 8 roků a od průkazu metastáz k úmrtí dalších 5 let. Faktem je, že pacienti s nízce diferencovanými karcinomy, časnou biochemickou recidivou a krátkým PSA DT (doubling time) měli výrazně horší prognózu (2). Freedland et al. (3) hodnotil 10 a 15leté karcinom specifické přežití a na podkladě výsledků sestavil predikční tabulku (tab. 1). Účelem studie bylo posoudit parametry, které by lépe definovaly pacienty potenciálně profitující z další terapie při biochemickém selhání po prostatektomii.
Table 1. Desetileté a 15leté karcinom specifi cké přežití při biochemickém selhání pro radikální prostatektomii. Upraveno dle Freedlanda (3) Table 1. 10- and 15-year cancer specifi c survival in biochemical failure after radical prostatectomy. According to Freedland (3) 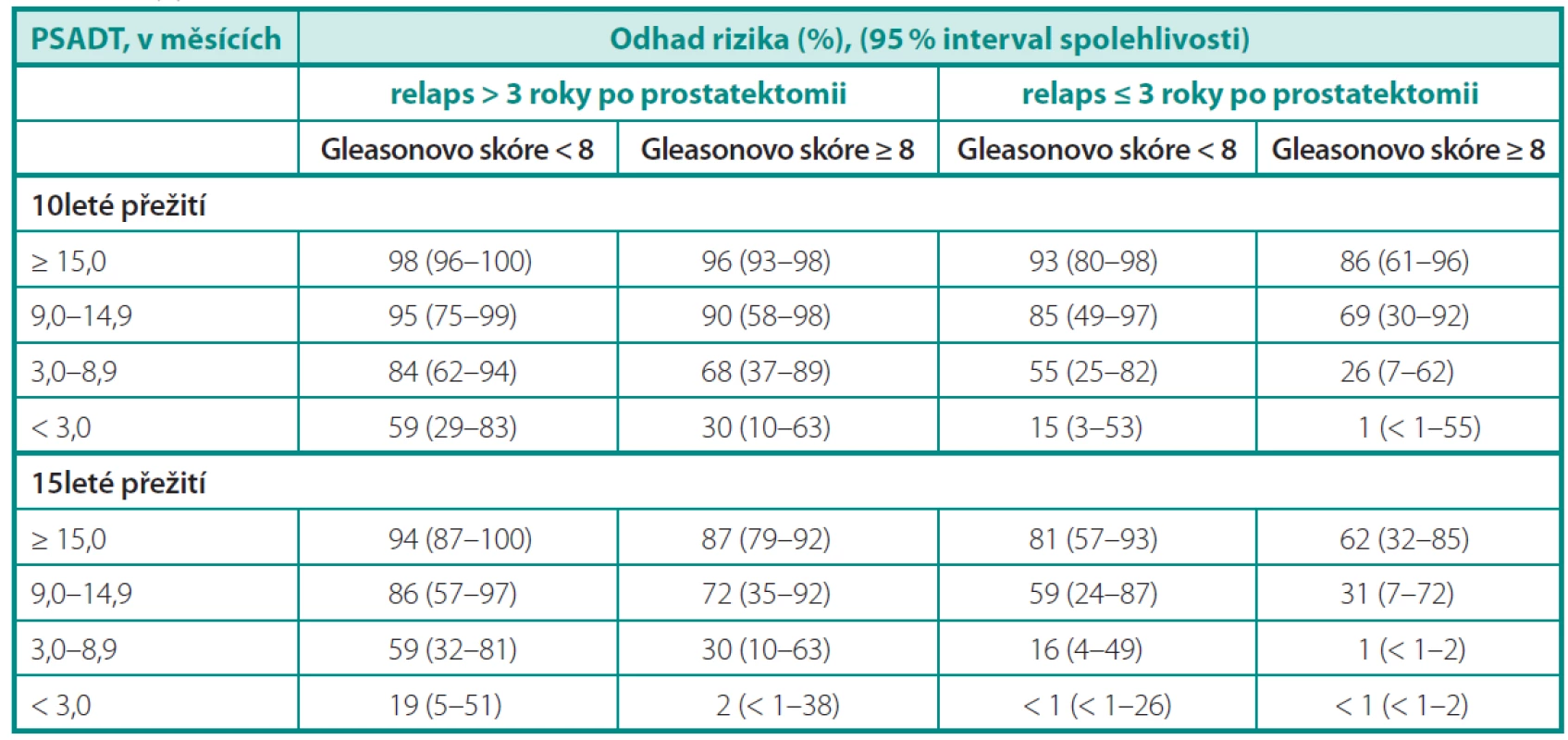
DIAGNOSTIKA LOKÁLNÍ VS. SYSTÉMOVÉ RECIDIVY
Biochemické vyšetření
Základem sledování pacientů léčených pro karcinom prostaty je stanovení PSA. Po RP je definována hodnota PSA svědčící pro biochemickou recidivu 2krát po sobě prokázané zvýšení PSA nad 0,2 ng/ml (4). Pravdou je, že názory na hladinu PSA odpovídající biochemické progresi se liší. Na jedné straně stojí např. retrospektivní práce Amlinga (5) poukazující na to, že jen cca 50 % pacientů s hodnotou PSA 0,2 ng/ml skutečně dále progreduje (49 % dále progredujících při PSA 0,2 ng/ml vs. 72 % při PSA 0,4 ng/ml). K obdobným závěrům dospěli Stephenson při retrospektivní analýze75 pacientů po RP progredujících do metastatického onemocnění (6). Na straně druhé pak stojí práce obhajující implementaci ultrasenzitivního PSA do klinické praxe s ohledem na možnost časnějšího odhalení biochemického selhání a lepší přežívání bez biochemické progrese (7–9). Panel expertů ASTRO (American Society for Therapeutic Radiology and Oncology) v roce 1996 definoval biochemické selhání po radioterapii jako 3krát po sobě prokázané navýšení PSA nad nadir (nejnižší dosažená hodnota PSA) bez ohledu na případnou kombinaci RT s hormonální léčbou (tzv. ASTRO definice). Nově byla tato hranice biochemického selhání v roce 2005 změněna na zvýšení o více než 2 ng/ml nad nadir (tzv. Phoenix definice). Tyto úpravy vycházejí ze sledování dalšího biochemického a klinického vývoje choroby, neboť řada pacientů selhávajících dle kritérií ASTRO v konečném důsledku nedospěla k nutnosti další fáze léčby nebo tato byla zahájena až s delším odstupem. Pro určení prognózy pacienta s progredujícím PSA má význam nejen jeho absolutní hodnota, ale také dynamické proměnné – čas do relapsu, PSA DT a PSAV. Doba od ukončení primární léčby do průkazu biochemické recidivy kratší než 2 roky je suspektní pro systémovou recidivu (vs. > 3 roky pro lokální recidivu). PSA velocita nižší než 0,75 ng/ml/rok bývá u lokální recidivy, zatímco PSAV vyšší než 0,75 ng/ml/rok bývá přítomna ve více než 56 % u pacientů se systémovou recidivou. PSA DT kratší než 4–6měsíců s vysokou pravděpodobností svědčí pro systémovou progresi, naopak PSA DT > 12 měsíců naznačuje spíše recidivu lokální (4).
Klinická a paraklinická vyšetření
Jako základní při posuzování případné lokální recidivy je bráno digitální rektální vyšetření. Toto má však pooperačně a zejména po radiační léčbě dosti nízkou výtěžnost (je minimálně efektivní při nulových či nízkých hodnotách PSA). Přínosná může být transrektální ultrasonografie (TRUS) ± biopsie (prostatické fossy, vezikouretrální anastomózy, patologické rezistence v lůžku). Zatímco je záchytnost v biopsii po RP při podezření na lokální recidivu při negativním digitálním rektálním vyšetření a TRUS jen cca 54%, pozitivní průkaz karcinomu však může dosahovat až 80 % při palpační rezistenci či hypoechogenním ložisku patrném při TRUS (4). Po RT karcinomu prostaty však může být biopsie prostaty indikovaná i v případě podezření na přítomnost viabilního karcinomu – v této souvislosti je však nutné zmínit, že biopsie má smysl jen v případě, že zvažujeme salvage lokální léčbu a jsou vyloučeny vzdálené metastázy. Samotná indikace biopsie prostaty po zevní RT či brachyterapii by neměla být dříve než 18 měsíců od ukončení léčby. Důvodem je, že až 30 % z pozitivních biopsií po RT provedených 12 měsíců po RT se změní během 24–30 měsíců při rebiopsii v negativní (10). Z dalších běžně dostupných vyšetřovacích modalit, které se uplatňují při detekci lymfadenopatie či postižení skeletu, jmenujme CT pánve a scintigrafi i skeletu. Magnetická rezonance skeletu, celotělová MR či MR-spektroskopie jsou metody sice velmi perspektivní a s vysokou výpovědní hodnotou, ale stále hůře dostupné a finančně náročné. Do popředí se dostává PET/CT při použití 11C-cholinu. Ačkoliv je nutné zohledňovat akumulaci tohoto radiofarmaka v zánětlivých intraprostatických lézích (po RT), přináší však slibné výsledky v korelaci s PSA, PSAV a PSA DT při biochemické recidivě (11). Detekce recidivy pomocí průkazu prostatického specifického membránového antigenu (PSMA) při imunoscintigrafi i za použití 111In-caprobamat pendetidu je další z možných, ale obtížně dostupných vyšetření. Stejně tak zatím spíše na pole experimentální patří magnetická rezonance s podáním mikročásteček oxidů železa (tzv. USPIO – ultra small superparamagnetic particles of iron oxide) – tato však ve srovnání s klasickou MRI dosahuje výrazně lepších výsledků (senzitivita 90 % vs. 35 %) (12, 13).
LÉČBA PO SELHÁNÍ RADIKÁLNÍ PROSTATEKTOMIE
Léčebné strategie zahrnují salvage RT (sRT, prostatické lůžko s/bez zaměření pánevních uzlin, s/bez hormonální léčby), samotnou androgen deprivační terapii a sledování. Faktory predikující odpověď na radioterapii jsou pozitivní okraje v histologii po prostatektomii, časné zahájení RT při nízkém PSA a delší interval od operace do průkazu biochemické recidivy. Naopak staging > pT2 s případným postižením uzlin, krátký PSA DT, Gleasonovo skóre ≥ 8 a přetrvávající elevace PSA po ukončení sRT jsou nepříznivé nezávislé parametry. Klíčovou roli v indikaci RT po prostatektomii hraje timing – adjuvantní vs. salvage RT. Např. D’Amico srovnával pooperačně high-risk pacienty (pT3, R1, Gleasonovo skóre8–10) s nulovým PSA, u nichž došlo k biochemickému relapsu. Subanalýzou dle PSA DT (kratší či delší než 10 měsíců) zjistil, že riziko úmrtí na jakoukoliv příčinu nebylo signifikantně odlišné u adjuvantní RT a salvage RT u pacientů s dlouhým PSA DT, ale naopak shledal významný rozdíl při krátkém PSA DT (14). Krom této D’Amicovy studie máme v současné době k dispozici tři další rozsáhlé randomizované studie zabývající se adjuvantní radioterapií. Studie EORTG 22911 zahrnovala 1005 pacientů s pooperačním stadiem pT2 R1a pT3. Pacienti byli rozděleni do větve k adjuvantní RT a k observaci, přičemž pacienti z observačního ramene byli indikováni k salvage RT jen v případě detekovatelné lokální recidivy (nikoliv při pouhém PSA relapsu). Při pětileté střední době sledování bylo prokázáno statisticky signifikantně lepší přežití bez biochemické i klinické progrese v adjuvantním rameni, ale za cenu vysokého počtu nadbytečně léčených pacientů. Gastrointestinální i genitourinární toxicita byla pochopitelně vyšší při adjuvantně indikované RT (15). Další studií při délce sledování 10,6 roků byla studie Southwest Oncology Group (SWOG) 8794 v provedení National Cancer Institute, Canada. Obdobně jako studie EORTC 22911 byla zaměřena na pacienty indikované po prostatektomii k adjuvantní RT prostatického lůžka či sledování (n = 425, pT3), a stejně tak potvrdila lepší biochemickou kontrolu, navíc pak přežití bez průkazu metastáz a lepší celkové přežití, ovšem za předpokladu life expectancy více než 10 let (16). Subanalýza SWOG8794 zaměřená na přežití bez vzniku metastáz s ohledem na PSA zjistila, že ve skupinách PSA< 0,2 ng/ml, 0,2–1 ng/ml a > 1 ng/ml bylo nejlepších výsledků dosaženo u pacientů, kteří podstoupili RT při nižší hladině PSA. Proto jev současné době doporučována salvage RT při PSA < 0,5 ng/ml. Ve třetí studii (ARO 96-02) s nejkratší dobou sledování bylo randomizováno 307 pacientů stádia pT3 do větve s adjuvantní RT a sledováním (17). Zde je nutné podotknout, že inkluzní kritéria pooperačního PSA všech tří studií byla odlišná a pouze ve studii ARO 96-02 bylo PSA < 0,1 ng/ml (v případě studie EORTC 22911 mělo 11 % pacientů PSA > 0,2 ng/ml a v případě SWOG8794 to bylo dokonce 34 % pacientů, tzn., že se jednalo o pacienty indikované k salvage RT). Obecně panuje shoda ve věci radiační dávky – tato je dle doporučení ASTRO 64–66 Gy. Důvodem je fakt, že při aplikaci záření o pouhých 60 Gy byla detekována lokální recidiva po adjuvantní radioterapii v 9 % případů (18). Otázkou zůstává, zda má být radioterapie cílena jen na lůžko po prostatektomii či na široké pole (lůžko + pánevní uzliny). Toto téma bylo předmětem studie RTOG 9413 a GETUG-01, které nepotvrdily benefit v přežívání pacientů po ozáření širokým polem, ačkoliv obě studie jsou založeny na datech od pacientů léčených radioterapií s kurativním záměrem (tedy nikoliv adjuvantní či salvage) (19, 20). Pooperační radioterapii pacienti zpravidla dobře tolerují a počet komplikací stupně 3 gastrointestinální a genitourinární toxicity bývá nízký (21). Zatímco léčba středně a vysoce rizikových karcinomů radioterapií ve spojení s hormonální léčbou je zcela standardní (22), neexistuje v současné době jednoznačná odpověď na to, zda je pooperačně přínosem samotná RT (adjuvantní/salvage) či její kombinace s hormonální léčbou. Randomizovaná, dvojitě zaslepená studie fáze III RTOG 96-01 posuzovala pacien typT3 N0 či pT2 N0 s pozitivními chirurgickými okraji s pooperačně nenulovým či relabujícím PSA v rameni salvage RT (64,8 Gy) + 24 měsíců podávaným bicalutamidem (150 mg/den) vs. salvage RT + placebo. Ačkoliv pacienti v rameni s kombinovanou léčbou vykazovali lepší přežití bez biochemické progrese i přežití bez metastáz, rozdíl v celkovém přežití nedosáhl statistické významnosti (23). Odpovědět na otázky načasování pooperační RT a délky trvání hormonální ablační léčby si dala za úkol jedna z nejvýznamnějších prací na toto téma, studie RADICALS (Radiotherapy and Androgen Deprivationin Combination after Local Surgery). Jde o multicentrickou randomizovanou studii sponzorovanou Medical Research Councila National Cancer Institute of Canada. Nábor pacientů do této multicentrické studie byl zahájen v říjnu 2007 a předpokládá se účast až 4000 pacientů. Pacienti s nízkým rizikem relapsu (pT2, GS 6, negativní chirurgické okraje, předoperační PSA < 10 ng/ml) budou pouze sledováni a RT bude u nich podána v časném „salvage režimu“. Pacienti s pooperačně se trvale přítomným PSA > 0,2 ng/ml by měli podstoupit okamžitou RT. Všichni ostatní pacienti s pooperačním PSA < 0,2 ng/ml, ale s rizikovými faktory (pT3, pozitivní okraje, GS > 6,PSA > 10 ng/ml či jejich kombinace) by byli randomizováni v průběhu 3 měsíců od RP do ramene k adjuvantní či časné salvage RT. Před zahájením vlastní radioterapie by proběhla další fáze randomizace a to do ramene bez hormonální léčby, s 6 měsíční a 2letou hormonální léčbou. Podrobnosti designu studie viz (24, 25). Výsledky by měly být z hlediska indikace, formy a načasování následné terapie klíčové.
LÉČBA PO SELHÁNÍ RADIOTERAPIE
Biochemické selhání po RT s/bez hormonální terapií je definováno dle kritérií Phoenix (viz výše). K poklesu PSA po RT dochází postupně a dosažení nadiru může nastat i po 18 měsících či později. Ačkoliv absolutní hodnota poklesu nemusí korelovat s rizikem případného relapsu onemocnění, rychlost poklesu a hodnota nadiru jsou významnými prediktory léčebných výsledků (26, 27). V souvislosti s biochemickým selháním je nutné odlišit tzv. bounce fenomén. Tento přechodný vzestup PSA může nastat u 10 –20 % pacientů léčených RT (externí či brachyterapií) s mediánem12–18 měsíců po ukončení léčby zářením (28,29). K biochemickému selhání po RT dochází u 20–50 % pacientů. Při pouhém vzestupu PSA je nutné posoudit, zda se jedná o vzestup při lokální recidivě/perzistence karcinomu po RT či jde o vzestup při vzdálených metastázách. Další zohledňovaná kritéria jsou věk pacienta, komorbidity a jeho biologický stav. Lze očekávat, že pacienti s klinickými parametry stadia > cT2c, vstupním PSA > 20 a bioptickým Gleasonovým skóre ≥ 8 jsou ve výrazně vyšším riziku vzdálených metastáz, a tudíž s největší pravděpodobností nebudou profitovat ze samotné lokální salvage terapie. Neméně důležitým faktorem je čas od ukončení léčby do biochemické recidivy, krátký PSA DT a absolutní hodnota PSA, při níž se indikuje salvage terapie (30). Zvažuje-li se tato další léčba, je nutné posoudit riziko konkrétního pacienta – v případě lokalizovaného onemocnění, s GS 3+3a dlouhým PSA DT je možností odložená léčba, a to až v případě výraznější progrese. Naopak pacienti vysoce rizikoví zasluhují léčbu časnou. Systémovou léčbu zahrnují různé formy hormonální ablace. Z lokálních léčebných možností se pak nabízejí salvage RP, kryoterapiea brachyradio terapie při předcházející zevní RT. Randomizované studie srovnávající tyto tři možnosti však zatím chybí.
Salvage RP
Dříve byla salvage RP považována za velmi náročný zákrok pro pacienta i operatéra s vysokým rizikem peri - a pooperačních komplikací (krvácení, vznik striktur anastomózy a rektouretrálnífi stuly). Dnes však s rozvojem chirurgických možností, důslednou selekcí kandidátů k výkonu a nižším stupněm postradiační fibrózy při přesnějších fokusacích záření jsou k dispozici velmi dobré výsledky jak funkční, tak onkologické. Na jedné straně je důvodem nižší radiační toxicita primární radikální radioterapie (31), na druhé straně to je preciznější chirurgický zákrok. Způsoby provedení zahrnují jak otevřenou RP (většina publikovaných prací), tak nově RP laparoskopickou i robotickou. Je tak dosaženo lepší lokální i systémové kontroly (10leté karcinom specifické přežití bylo 70–75 % a celkové přežití 60–66 %) (32). Prediktory pooperačně lokalizovaného onemocnění v definitivním preparátu (tj. pT2) zahrnují opět bioptické GS < 7, < 50 % pozitivních válečků v biopsii, PSA DT > 12 M a primárně použitá low-dose brachyterapie (33). Inkluzními kritérii pro salvage RP jsou reálně informování a dobře motivovaní pacienti v dobrém celkovém stavu, s life expectancy > 10 let, o stagingu < cT2, s bioptickým GS < 7 a předoperačním PSA < 10 ng/ml. U těchto pacientů je i doporučována rebiopsie prostaty k potvrzení lokální perzistence viabilního karcinomu. Vzhledem k tomu, že regresní změny v buňkách karcinomu prostaty probíhají delší dobu, je vhodné s indikací salvage RP vyčkat alespoň 18 měsíců (10). Nález viabilních nádorových buněk v časněji indikované biopsii nemusí totiž nutně korelovat s klinickou progresí. Svědčí o tom výsledky pacientů po RT pro karcinom prostaty indikovaných k cystoprostatektomii z různých důvodů s mediánem operace 60 měsíců po ukončené RT. Ačkoli 89 % pacientů bylo dle kritérií Phoenix bez biochemické recidivy, u 50 % z nich byl v definitivním preparátu prokázán reziduální karcinom prostaty, z čehož vyplývá nízká reprodukovatelnost absolutní hodnoty PSA (34). Z prognostického hlediska hraje po salvage RP klíčovou roli patologický staging, grading a pozitivita okrajů.
Kryoterapie
Zatímco prvotní výsledky salvage kryoterapie byly dosti skeptické (vysoká míra inkontinence, perineální bolest a erektilní dysfunkce), se zdokonalením techniky došlo i k významnému poklesu incidence těchto komplikací. Podle výsledků multicentrické studie srovnávající data 279 pacientů zahrnutých v databázi Cryo On-line Data Registry (COLD) vyplynulo, že 5leté přežití bez biochemické progrese dle kritérií Phoenix činí 54 % (35). Definicí selhání salvage kryoterapie je několik – kritéria ASTRO či Phoenix nebo průkaz karcinomu po ukončení léčby. Pozitivní nález v histologii po biopsii prostaty po salvage kryoterapii byl shledán až ve 37 % pacientů (36). Z multivariantní analýzy dat od téměř 800 pacientů vyplynulo, že prediktory biochemického selhání po kryoterapii jsou obdobně jako u RT vstupní PSA, staging a grading. Ačkoliv je salvage RP u pacientů s lokální recidivou po RT metodou volby, soudí se, že pacienti se vstupním stagingem ≥ cT3 či s tímto stadiem v době rekurence po RT by mohli profitovat ze salvage kryoterapie. Srovnání výsledků salvage léčby dvou center v USA (Mayo Clinic, 42 pacientů léčených salvage RP, a M. D. Anderson Cancer Center, 56 pacientů léčených kryoterapií) prokázalo sice lepší 5leté přežití bez biochemické recidivy – 66 % vs. 42 %, při mediánu sledování 8 let se však neprokázal rozdíl v přežití specifickém pro karcinom (37).
Salvage brachyterapie
Salvage brachyterapie je jednou z dalších možností při selhání zevní RT. Nedostatečná klinická aplikovatelnost vychází z malých klinických souborů, které ani dle recentních prací nepřesahují 50 pacientů, a retrospektivního designu studií. Na jedné straně vykazuje brachyterapie dobrou lokální kontrolu (zejména při nižším vstupním PSA a GS), na straně druhé však vyšší radiotoxicitu genitourinární a gastrointestinální (38). Způsob provedení ve většině studií zahrnuje low-dose rate techniky (LDR, 103Pd, 125I), možné jsou však i techniky high-dose rate (HDR). Soubor s nejdelším sledováním (medián 86 měsíců) zahrnoval 37 pacientů léčených LDR, přičemž 10leté přežití bez biochemické progrese a karcinom specifické přežívání byly 54 % a 96 % (39).
Salvage HIFU
Jde zatím o experimentální metodu, ačkoliv předběžné výsledky jsou slibné (z 167 pacientů bylo dosaženo u 73 % lokální kontroly při 5leté celkovém přežití 84 %. Stejně jako v případě salvage RP měli horší prognózu pacienti ve vyšší rizikové skupině dle D’Amico, s vyšším PSA před zahájením HIFU a ti, kteří absolvovali hormonální léčbu (40). Mezi komplikace salvage HIFU patří především inkontinence moči, méně pak vznik rektouretrálnífi stuly.
Sledování – watchful waiting (WW)
Pacienti, u nichž dochází k biochemické progresi jen pozvolna a s delším časovým odstupem po primární radikální léčbě, nemusí ihned nastupovat druhou linii lokální léčby či léčbu hormonální. Vycházíme jednak z přirozeného průběhu onemocnění při progresi onemocnění (2), jednak z komparativní studie posuzující hormonální léčbu a sledování. Srovnání podskupiny pacientů s PSA DT delším než 12 měsíců neprokázalo benefit časné androgen deprivační terapie (ADT); 5leté přežití bez metastáz činilo 88 % s hormonální léčbou oproti 92 % při WW (41). Ve shodě s tímto naopak pacienti s PSA DT < 6 měsíců profitovali z časné hormonální léčby (42).
SYSTÉMOVÁ LÉČBA PO SELHÁNÍ LOKÁLNÍ TERAPIE
Roli androgen-deprivační terapie (ADT) při selhání lokální terapie posuzuje řady studií – jednak formu (kastrace vs. antiandrogen, kontinuální vs. intermitentní, monoterapie vs. maximální androgenní blokáda), jednak čas zahájení léčby (adjuvantně pooperačně – např. u pN+ stadií, časně při PSA relapsu či až při průkazu metastatického onemocnění).
Samotná ADT je možností léčby u pacientů, kteří nejsou kandidáti salvage lokální terapie. Důvodem může být krátká očekávaná doba dožití s ohledem na celkový stav či předpokládané významné riziko systémového selhání. Systémovou progresi lze s vysokou pravděpodobností odhadnout při čase do PSA relapsu kratším než 1 rok, PSA DT 4–6 měsíců, Gleasonově skóre 8–10 a stadiu pT3b, pN1. Retrospektivní analýza z Mayo Clinic sice prokázala mírné zlepšení karcinom specifického přežití a přežití bez progrese u high-risk pacientů po prostatektomii s adjuvantní hormonální léčbou, celkové přežití se signifikantně nelišilo a samotní autoři doporučují multimodální přístup k léčbě (43).
ZÁVĚR
Úkolem klinika je na podkladě klinicko-patologických parametrů odhalit, zda je pacient s biochemickým relapsem po primární prostatektomii či radioterapii ohrožen lokální či systémovou recidívou. S touto znalostí by pak měl určit, jaký další postup je pro daného muže optimální s ohledem na rizikové faktory, biologický stav a osobní preference. Vzhledem k tomu, že adjuvantní či salvage terapie bývá svízelná, přináší s sebou různé formy a stupně nežádoucích účinků a její výsledky nejsou vždy ideální, je potřeba multimodálního přístupu a aktivní spolupráce pacienta, urologa, patologa a radioterapeuta.
Došlo: 2. 2. 2012.
Přijato: 30. 3. 2012.
Kontaktní adresa
MUDr. Milan Král, Ph.D.
Urologická klinika LF UP a FN
I. P. Pavlova 6, 775 20 Olomouc
e-mail: kral.milan@seznam.cz
Sources
1. Caire AA, Sun L, Ode O, et al. Delayed prostate-specifi c antigen recurrence after radical prostatectomy: how to identify and what are their clinical outcomes? Urology 2009; 74(3): 643 – 647.
2. Pound CR, Partin AW, Eisenberger MA, et al. Natural history of progression after PSA elevation following radical prostatectomy. JAMA 1999; 281(17): 1591–1597.
3. Freedland SJ, Humphreys EB, Mangold LA, et al. Risk of prostate cancer-specifi c mortality following biochemical recurrence after radical prostatectomy. JAMA 2005; 294(4): 433–439.
4. Guidelines EAU, Prostate cancer, v. 2-2011 (http: //www.uroweb.org/gls/pdf/08_Prostate_Cancer%20September%2022nd%202011.pdf)
5. Amling CL, Bergstralh EJ, Blute ML, Slezak JM, Zincke H. Defi ning prostate specifi c antigen progression after radical prostatectomy: what is the most appropriate cut point? J Urol 2001; 65(4): 1146–1151.
6. Stephenson AJ, Kattan MW, Eastham JA, et al. Defi ning biochemical recurrence of prostate cancer after radical prostatectomy: a proposal for a standardized defi nition. J Clin Oncol 2006; 24(24): 3973–3978.
7. Veselý Š, Jarolím L, Babjuk M, Kaliská V, Schmidt M. Poměr PSA NADIR a času do PSA NADIR stanoveného ultrasenzitivním testem jako významný prediktor selháni radikální prostatektomie (abstrakt). Ces Urol 2010; 14(4): 247.
8. Jarolím L, Veselý Š, Babjuk M, Schmidt M, Dušek P, Minárik I, Malinová B. Hodnota PSA před salvage radioterapií nižší než 0,2 ng/ml má větší šanci na úspěch léčby než hodnoty vyšší (abstrakt). Ces Urol 2011; 15(Suppl 2): 61.
9. Eisenberg ML, Davies BJ, Cooperberg MR, Cowan JE, Carroll PR. Prognostic implications of an undetectable ultrasensitive prostate-specifi c antigen level after radical prostatectomy. Eur Urol 2010; 57(4): 622–629.
10. Nguyen PL, D’Amico, Lee AK, Suh WW. Patient selection, cancer control, and complications after salvage local therapy for postradiation prostate-specifi c antigen failure: a systematic review of the literature. Cancer 2007; 110(7): 1417–1428.
11. Castellucci P, Fuccio C, Rubello D, et al. Is there a role for ¹¹C-choline PET/CT in the early detection of metastatic disease in surgically treated prostate cancer patients with a mild PSA increase <1.5 ng/ml? Eur J Nucl Med Mol Imaging 2011; 38(1): 55–63.
12. Th oeny HC, Triantafyllou M, Studer UE, et al. Combined ultrasmall superparamagnetic particles of iron oxide-enhanced and diff usion-weighted magnetic resonance imaging reliably detect pelvic lymph node metastases in normal-sized nodes of bladder and prostate cancer patients. Eur Urol 2009; 55(4): 761–769.
13. Harisinghani MG, Barentsz J, Hahn PF, et al. Noninvasive detection of clinically occult lymphnode metastases in prostate cancer. N Engl J Med 2003; 348(25): 2491–2499.
14. D’Amico AV, Chen MH, Sun L, et al. Adjuvant versus salvage radiation therapy for prostate cancer and the risk of death. BJU Int 2010; 106(11): 1618.
15. Bolla M, van Poppel H, Collette L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 2005; 366 : 572–578.
16. Thompson IM Jr, Tangen CM, Paradelo J, et al. Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 2006; 296(19): 2329–2335.
17. Wiegel T, Bottke D, Steiner U, et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specifi c antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009; 27(18): 2924–2930.
18. Swanson GP, Hussey MA, Tangen CM, et al. Predominant treatment failure in postprostatectomy patients is local: analysis of patterns of treatment failure in SWOG 8794. J Clin Oncol 2007; 25(16): 2225–2229.
19. Lawton CA, DeSilvio M, Roach M, et al. An update of the phase III trial comparing whole pelvic to prostate only radiotherapy and neoadjuvant to adjuvant total androgen suppression: updated analysis of RTOG 94-13, with emphasis on unnexpected hormone/radiation interactions. Int J Radiat Oncol Biol Phys 2007; 69 : 646.
20. Pommier, P, Chabaud, S, Lagrange, JL, et al. Is there a role for pelvic irradiation in localized prostate adenocarcinoma? Preliminary results of GETUG-01. J Clin Oncol 2007; 25 : 5366. 21. Peterson JL, Buskirk SJ, Heckman MG, et al. Late toxicity after postprostatectomy salvage radiation therapy. Radiother Oncol 2009; 93 : 203.
22. Dvořáček J. Hormonální léčba karcinomu prostaty, její nová role a česká specialita. Ces Urol 2008; 12(3): 165–172.
23. Shipley, WU, Hunt, D, Lukka, HR, et al. Initial report of RTOG 9601, a phase III trial in prostate cancer: Eff ect of anti-androgen therapy (AAT) with bicalutamide during and after radiation therapy (RT) on freedom from progression and incidence of metastatic disease in patients following radical prostatectomy (RP) with pT2-3,N0 disease and elevated PSA levels. J Clin Oncol 2011; 29(Suppl 7); abstract 1.
24. Parker C, Sydes MR, Catton C, et al. Radiotherapy and androgen deprivation in combination after local surgery (RADICALS): a new Medical Research Council/National Cancer Institute of Canada phase III trial of adjuvant treatment after radical prostatectomy. BJU Int 2007; 99(6): 1376–1379.
25. http: //clinicaltrials.gov/ct2/show/study/NCT00541047
26. Ray ME, Th ames HD, Levy LB, et al. PSA nadir predicts biochemical and distant failures after external beam radiotherapy for prostate cancer: a multi-institutional analysis. Int J Radiat Oncol Biol Phys 2006; 64(4): 1140–1150.
27. Crook JM, Choan E, Perry GA, Robertson S, Esche BA. Serum prostate-specifi c antigen profile following radiotherapy for prostate cancer: implications for patterns of failure and definition of cure. Urology 1998; 51(4): 566–572.
28. Satoh T, Ishiyama H, Matsumoto K, et al. Prostate-specifi c antigen ‚bounce‘ after permanent 125I-implant brachytherapy in Japanese men: a multi-institutional pooled analysis. BJU Int 2009; 103(8): 1064–1068.
29. Bachand F, Martin AG, Beaulieu L, Harel F, Vigneault E. An eight-year experience of HDR brachytherapy boost for localized prostate cancer: biopsy and PSA outcome. Int J Radiat Oncol Biol Phys 2009; 73(3): 679–684.
30. Zelefsky MJ, Ben-Porat L, Scher HI, et al. PSA state after defi nitive external-beam radiotherapy for prostate cancer. J Clin Oncol 2005; 23 : 826.
31. Odrážka K, Doležel M, Vaňásek J, Vaculíková M, Zouhar M5, Šefrová J, PaluskaP, Vošmik M, Kohlová T, Kolářová I, Broďák M, Navrátil P, Prošvic P,Hoff mann P, Hafuda A. Chronická urinární toxicita a 3D-CRT a IMRT karcinomu prostaty. Ces Urol 2010; 14(3): 156–163.
32. Stephenson AJ, Scardino PT, Bianco FJ, et al. Morbidity and functional outcomes of salvage radical prostatectomy for locally recurrent prostate cancer after radiation therapy. J Urol 2004; 172(6 Pt 1): 2239–2243.
33. Heidenreich A, Richter S, Th üer D, et al. Prognostic parameters, complications, and oncologic and functional outcome of salvage radical prostatectomy for locally recurrent prostate cancer after 1st-century radiotherapy. Eur Urol 2010; 57(3): 437–443.
34. Kaplan DJ, Crispen PL, Greenberg RE, et al. Residual prostate cancer after radiotherapy: a study of radical cystoprostatectomy specimens. Urology 2008; 72(3): 654–658.
35. Pisters LL, Rewcastle JC, Donnelly BJ, et al. Salvage prostate cryoablation: initial results from the Crho on-line data registry. J Urol 2008; 180(2): 559–563.
36. Finley DS, Belldegrun AS. Salvage cryotherapy for radiation-recurrent prostate cancer: outcomes and complications. Curr Urol Rep 2011; 12(3): 209–215.
37. Pisters LL, Leibovici D, Blute M, et al. Locally recurrent prostate cancer after initial radiation therapy: a comparison of salvage radical prostatectomy versus cryotherapy. J Urol 2009; 182(2): 517–525; discussion 525–527.
38. Moman MR, van der Poel HG, Battermann JJ, et al. Treatment outcome and toxicity after salvage 125I implantation for prostate cancer recurrences after primary 125I implantation and external beam radiotherapy. Brachytherapy 2010; 9(2): 119–125.
39. Burri RJ, Stone NN, Unger P, et al. Long-term outcome and toxicity of salvage brachytherapy for local failure after initial radiotherapy for prostate. Int J Radiat Oncol Biol 2010; 77(5): 1338–1344.
40. Murat FJ, Poissonnier L, Rabilloud M, et al. Mid-term results demonstrate salvage high-intensity focused ultrasound (HIFU) as an eff ective and acceptably morbid salvage treatment option for locally radiorecurrent prostate cancer. Eur Urol 2009; 55(3): 640–647.
41. Pinover WH, Horwitz EM, Hanlon AL, et al. Validation of a treatment policy for patients with prostate specifi c antigen failure after three-dimensional conformal prostate radiation therapy. Cancer 2003; 97(4): 1127–1133.
42. Klayton TL, Ruth K, Buyyounouski MK, et al. PSA Doubling Time Predicts for the Development of Distant Metastases for Patients Who Fail 3DCRT Or IMRT Using the Phoenix Definition. Pract Radiat Oncol. 2011; 1(4): 235–242.
43. Siddiqui SA, Boorjian SA, Blute ML, et al. Impact of adjuvant androgen deprivation therapy after radical prostatectomy on the survival of patients with pathological T3b prostate cancer. BJU Int 2011; 107(3): 383–388.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2012 Issue 2-
All articles in this issue
- Selhání lokální léčby karcinomu prostaty
- Časná salvage radioterapie po radikální prostatektomii indikovaná u pacientů s rostoucí hladinou PSA v hodnotách nižších, než je konvenční hranice biochemické recidivy 0,2 ng/ml
- Možnosti endoskopického řešení dlouhodobě ponechaných inkrustovaných ureterálních stentů
- Karcinom rete testis
- Intestinální metaplazie sliznice močového měchýře a Peutz Jeghersův syndrom
- Bilaterální karcinom ledviny řešený jednodobou operací, nefrektomií a resekcí ledviny
- Krvácení do skrota jako první příznak metastazování karcinomu prostaty do nadvarlete
- Lymfadenektomie sentinelové uzliny epidermoidního karcinomu penisu
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Časná salvage radioterapie po radikální prostatektomii indikovaná u pacientů s rostoucí hladinou PSA v hodnotách nižších, než je konvenční hranice biochemické recidivy 0,2 ng/ml
- Možnosti endoskopického řešení dlouhodobě ponechaných inkrustovaných ureterálních stentů
- Intestinální metaplazie sliznice močového měchýře a Peutz Jeghersův syndrom
- Selhání lokální léčby karcinomu prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

