-
Medical journals
- Career
Výsledky léčby retroperitoneálních sarkomů a jejich hlavní rizika
Authors: Balík Michal 1; Zoul Zdeněk 2; Petera Jiří 2; Pacovský Jaroslav 1; Broďák Miloš 1
Authors‘ workplace: Urologická klinika Fakultní nemocnice Hradec Králové 1; Klinika onkologie a radioterapie Fakultní nemocnice Hradec Králové 2
Published in: Ces Urol 2011; 15(2): 113-119
Category: Original article
Overview
Cíl:
Retroperitoneální sarkom (RPS) představuje vzácný maligní nádor s vysokým rizikem recidiv a letálního průběhu onemocnění. Cílem studie je zhodnocení výsledků léčby měkkotkáňových retroperitoneálních sarkomů.Materiál a metoda:
Retrospektivně byla zhodnocena skupina 43 pacientů s RPS. Adjuvantní irradiace a chemoterapie byly podány všem pacientům s pozitivními chirurgickými okraji (PSM – positive surgical margin) a „high-grade“ onemocněním. Zhodnotili jsme vliv PSM a „high-grade“ onemocnění na riziko recidiv a na přežití pacientů. Medián sledování byl 60 (26–128) měsíců. Medián věku pacienta byl 61 (35–75) let. U dvanácti ze čtrnácti pacientů s „high-grade“ onemocněním a u všech pacientů s PSM došlo k recidivě onemocnění. Jednomu pacientovi s „low-grade“ onemocněním byla prokázána recidiva v podobě vzdálených metastáz.Výsledky:
Celkové přežití bylo 84 % a přežití bez známek onemocnění 69 %. Celkové přežití vztažené ke gradingu onemocnění bylo 57 % u „high - -grade“ a 96 % u „low-grade“ léze.Závěr:
Agresivní kompletní resekce je jedinou efektivní metodou léčby.Klíčová slova:
retroperitoneální sarkom, chemoterapie, radioterapie, high-grade léze, low-grade léze.Úvod
Retroperitoneální sarkomy (RPS) patří do skupiny měkko-tkáňových sarkomů (STS – soft tissue sarcomas) a reprezentují heterogenní skupinu vzácných maligních solidních tumorů. STS představují méně než 1 % všech zhoubných onemocnění, které se z 10–15 % vyskytují v retroperitoneu (1–6). V České republice byla incidence RPS v roce 2007 1,1 na 100 000 obyvatel, mortalita 0,76/100 tisíc obyvatel, s maximem výskytu mezi 60–80 lety věku pacienta (7). Nejčastější histologické subtypy jsou liposarkom, leiomyosarkom, maligní histiocytom a fibrosarkom (1). Doposud je známo více než 50 různých histologických subtypů (8). Nejvíce se STS vyskytují mezi 5. až 6. dekádou života (9). Biologické chování těchto nádorů je nahodilé a jejich relativní vzácnost způsobuje malé zkušenosti s jejich léčbou. Nejefektivnější léčbou je chirurgická kompletní resekce nádoru. Radioterapie je limitována lokalizací nádoru v retroperitoneu. Současná chemoterapie má velice omezenou účinnost. RPS často dosahují velkých rozměrů a nezřídka si jejich kompletní odstranění vyžádá i resekci okolních orgánů. Hlavním rizikovým faktorem rekurence jsou pozitivní chirurgické okraje a dediferencovaný tumor (5, 10, 11). Hlavním cílem naší studie bylo zhodnocení chirurgické léčby RPS. Druhým pak analýza přítomnosti PSM a „high - -grade“ lézí na rekurenci onemocnění a přežití.
Metoda
V období mezi lednem 2000 a prosincem 2008 bylo na našem pracovišti postupně léčeno 43 pacientů pro primární RPS. CT vyšetření bylo hlavní diagnostickou metodou před chirurgickým řešením. MRI, kolonoskopie či cystoskopie byly doplněny pouze ve výjimečných případech při podezření na postižení přilehlých orgánů. Operační zákroky byly prováděny v celkové anestezii s antibiotickou profylaxí. Otevřená operace byla provedena u 42 pacientů, laparoskopická u jednoho. Hlavním cílem operace bylo kompletní odstranění nádorové masy. Byl preferován agresivní přístup, který se v některých případech vyžádal odstranění přilehlých orgánů (ledviny, střeva, sleziny, a podobně). Žádný z pacientů nepodstoupil radioterapii před operací. Velikost tumoru byla měřena pooperačně z odstraněné tkáně. Všechny vzorky byly vyšetřeny patologem v souladu s klasifikačním systémem WHO pro STS (11–13). Histologický obraz byl rozdělen do dvou skupin „low-grade“ a „high-grade“. Jako „low-grade“ tumor byly hodnoceny léze Grade 1, jako „high-grade“ pak léze Grade 2 a 3 ze třístupňové klasifikace (13–15). Jako pozitivní chirurgický okraj (PSM) byl hodnocen vzorek s vitální nádorovou tkání vzdálenou od nesekční plochy méně než 1 cm.
Pacienti s PSM nebo high-grade lézí postoupili adjuvantní kombinovanou chemoradioterapii. Dávka záření byla stanovena na 50 Gy pomocí IMRT (intensity modulated radiation therapy – radioterapie s modulovanou intenzitou paprsků). Chemoterapeutický režim se sestával z podávání doxorubicinu, ifosfamidu, dacarbazinu a mesny (Doxorubicin 50 až 60 mg/m2 i.v. bolus D1 + Ifosfamid 5 g/m2 i.v. v kontinuální 24hodinové infuzi D1 + Mesna 40 0mg/m2 i.v. bolus á 4 hodiny v průběhu aplikace Ifosfamidu a ještě 12 hodin poté + další cyklus den 21–28). Všichni pacienti byli pravidelně sledováni pro vysoké riziko recidiv onemocnění. Lokální recidiva byla indikací k sekundární chirurgické resekci. Další postup byl stanoven individuálně dle celkového stavu pacienta. Pacienti s opakovanou recidivou nebo metastatickým postižením podstoupili záchrannou chemoterapii.
Zhodnotili jsme chirurgické komplikace a výsledky léčby se zaměřením na lokální recidivu, celkové přežití a interval bez známek onemocnění.
Výsledky
Medián sledování byl 60 (26–128) měsíců. Medián věku pacientů byl 61 (35–75) let a medián velikosti tumoru byl 16 (7–45) cm. Základní demografické a onkologické charakteristiky sledovaného souboru jsou shrnuty v tabulce 1. Nebyl zaznamenán ani jeden případ úmrtí v souvislosti s výkonem. Hlavní komplikací bylo krvácení. Medián krevních ztrát během výkonu byl 500 ml. Sedmnácti pacientům byly podány krevní transfuze a medián množství podaných transfuzí byl 900 ml.
Table 1. Hlavní charakteristiky pacientů a onemocnění Table 1. Main patient and disease characteristics 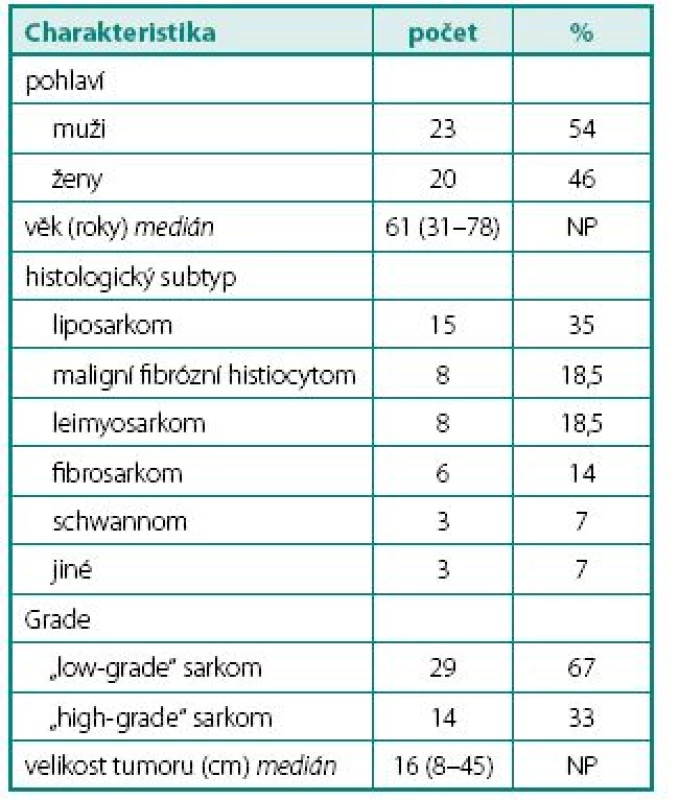
Charakteristiky sledování a výsledků léčby jsou shrnuty v tabulce 2.
Table 2. Charakteristiky léčby Table 2. Management characteristic 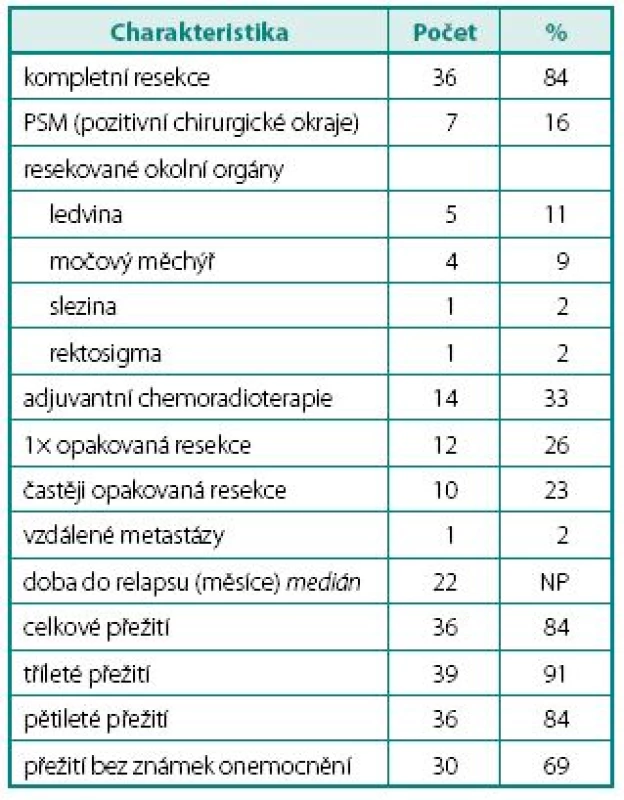
Recidiva onemocnění byla zaznamenána ve 13 (30 %) případech. Lokálně u 12 (28 %) pacientů, u jednoho (2 %) primárně metastaticky. Dvanáct pacientů s recidivou mělo „high - grade“ sarkom, z nich sedm mělo PSM. U jednoho pacienta s „low-grade“ leiomyosarkomem byla diagnostikována primárně metastatická recidiva onemocnění 28 měsíců po primárním chirurgickém zákroku. Tomuto pacientovi byla podána záchranná chemoterapie, pacient zemřel 11 měsíců od zjištění metastatického postižení.
Metodou volby u lokální recidivy bylo její chirurgické odstranění u všech 12 pacientů. Druhá resekce vedla k dlouhodobé remisi u dvou pacientů (17 %). Čtyři pacienti (33 %) podstoupili několik operačních zákroků lokální recidivy (tři pacienti 3 resekce a jeden 4). Recidiva vedla ke smrti u šesti pacientů z dvanácti (50 %). Pěti ze šesti pacientů byla podána záchranná chemoterapie (doxorubicin + ifosfamid + mesna).
Sedmi pacientům s PSM byla po primární chirurgické resekci podána adjuvantní chemoradioterapie. Všech sedm mělo lokální recidivu onemocnění a medián doby do vzniku recidivy byl 22 měsíců. Z celkových sedmi pacientů s PSM byli dva (29 %) v dlouhodobé remisi po druhé resekci. Dva pacienti (29 %) podstoupili několik resekcí, které vedly k remisi onemocnění. Třem pacientům (42 %) byly diagnostikovány opakovaně recidivy onemocnění a nakonec i vzdálené metastázy, které vedly ke smrti pacienta. Všichni pacienti s PSM měli „high-grade“ RPS.
Dvanácti ze 14 (86 %) pacientům s „high - -grade“ RPS byla diagnostikována lokální recidiva onemocnění. Dva (14 %) pacienti byli v dlouhodobé remisi po opakované resekci, čtyři (29 %) po opakovaných resekcích. Šest pacientů (43 %) zemřelo na „high-grade“ RPS přes opakované resekce a pouze 2 (14 %) mělo dlouhodobou remisi po primární chirurgické resekci následované adjuvantní chemoradioterapií.
Celkové pětileté přežití bylo 84% a nádorově specifické pětileté přežití 86%. Jeden pa-cient zemřel na bronchopneumonii 14 měsíců po primární resekci. Celkové přežití u „high - -grade“ RPS bylo 57%, u low-grade 96%. Přežití bez známek onemocnění bylo u „highgrade“ 14% a u „low-grade“ 96%. Všem pacientům s PSM byla následně diagnostikována lokální recidiva onemocnění, pěti pacientům (12 %) byla diagnostikována lokální recidiva bez PSM. Hlavními rizikovými faktory lokální recidivy onemocnění byly PSM a „high-grade“ tumor. Naproti tomu nebyla shledána žádná souvislost s velikostí tumoru, histologickým podtypem či pohlavím pacienta.
Diskuse
Retroperitoneální sarkomy jsou vzácné mezenchymální solidní nádory. Nízká incidence vede k limitovaným zkušenostem s léčbou zejména u „high-risk“ sarkomů. Typické pro RPS jsou minimální klinické symptomy v počátku onemocnění a rozsáhlý tumor při chirurgické resekci. Pro prognózu onemocnění je důležitá především kompletní chirurgická resekce (bez pozitivních chirurgických okrajů), histologický grading onemocnění, případně i délka klinické manifestace (2). Inkompletní resekce (PSM) nebo „high-grade“ tumory mají signifikantně horší prognózu onemocnění (5, 10, 11, 16–20). Podle našich údajů všechny tumory s PSM lokálně recidivovaly i přes adjuvantní chemoradioterapii. Tato zjištění jsou v souladu se závěry práce Gholamiho et al., který prokázal, že adjuvantní chemo-radioterapie nemá vliv na celkové přežití ani na přežití bez známek onemocnění (2). Podobně „high-grade“ RPS jsou spojeny se špatnou prognózou. Většina našich „high-grade“ RPS lokálně recidivovala (86 %) a jejich celkové přežití bylo 67%. Celkové přežití „low-grade“ RPS v našem souboru bylo 96%. Tato data jasně dokazují, že vysoký grading je vysoce negativním rizikovým faktorem. Právě „high-grade“ RPS měly velice špatnou prognózu i přes kombinovanou onkologickou léčbu. Někteří autoři popisují horší přežití u větších tumorů, starších pacientů a u mužů (3, 9, 19, 21). Tyto závěry jsme v naší retrospektivní studii nepotvrdili. Je možné tvrdit, že u velkých „low-grade“ tumorů lze kompletní resekcí (bez PSM) dosáhnout dlouhodobé remise. Naproti tomu je však nutné „low-grade“ nádory sledovat. Canter et al. prezentovali 9% mortalitu u „low-grade“ STS. Nejčastější (58 %) příčinou úmrtí byla fatální lokální recidiva (22). Jeden pacient v našem souboru zemřel v souvislosti s metastatickým onemocněním.
Nejefektivnější léčbou retroperitoneálních sarkomů je kompletní chirurgické odstranění nádoru bez ohledu na velikost nádorové hmoty. Obří RPS často zasahuje do okolních orgánů v retroperitoneu a břišní dutině. Je doporučen agresivní přístup v podobě resekce okolních orgánů včetně dolní duté žíly (23–25). García Franco et al. popsal 18% pětileté přežití po úspěšné resekci solitární plicní metastázy (26). Jeden pacient v našem souboru trpěl mnohočetným metastatickým postižením, které vylučovalo úspěšnou kompletní chirurgickou resekci všech ložisek.
Lewis et al. prezentoval výsledky léčby 500 pacientů, kteří podstoupili resekci retroperitoneálního sarkomu. Kompletní resekce byla provedena v 83 % případů. Medián přežití u pacientů po kompletní resekci byl 103 měsíců, u pacientů po inkompletní resekci 18 měsíců. Krátká doba přežití u pacientů po inkompletní resekci odpovídá době přežití u pacientů bez chirurgické léčby. Autoři učinili závěr, že parciální resekce RPS je indikována pouze v případech se závažnými klinickými projevy onemocnění. Medián přežití po druhé resekci byl 60 měsíců oproti 20 měsícům přežití pacientů bez druhé resekce po lokální recidivu. Recidivy byly úspěšně resekovány u 57 % pacientů s prv-ní recidivou. Toto číslo strmě klesá s narůstajícím počtem recidiv (20 % u druhé, 10 % u třetí recidivy). Signifikantně horší prognózu mají high-grade tumory a liposarkomy (27).
Stoeckle et al. prezentoval skupinu 145 pacientů s RPS bez vzdálených metastáz, ale pouze 94 pacientů (65 %) podstoupilo kompletní resekci. Pětileté celkové přežití bylo 49%. Autoři doporučovali pooperační adjuvantní radioterapii, která signifikantně zvyšovala pravděpodobnost lokální kontroly onemocnění. Naproti tomu Grade 3 v histologickém nálezu snižoval pravděpodobnost lokální kontroly onemocnění (28). Gholami et al. prezentoval vlastní zkušenosti s chirurgickou léčbou RPS. Autoři kladli důraz na kompletní resekci – dávali přednost radikální resekci tumoru v případě nutnosti i s okolními orgány před enukleací tumoru. Kompletní resekce byla dosažena v 93 % případů. Pětileté přežití bylo 46% a lokální recidiva byla hlavním problémem přes dosažení kompletní resekce primárního ložiska. Autoři doporučují bedlivé sledování s cílem včasné detekce lokální recidivy k její časné resekci (2).
Lokální recidivy jsou hlavním rizikem léčby retroperitoneálních sarkomů. Ve snaze o redukci četnosti lokálních recidiv byla doporučována adjuvantní radioterapie. Problém radioterapie spočívá v jejích nežádoucích účincích a toxicitě plynoucí z blízkosti tenkého střeva. Radioterapie může být podle autorů zahájena neoadjuvantně, konkomitantně s operačním zákrokem i adjuvantně či v kombinaci. Některé studie ukázaly alespoň částečný efekt na redukci četnosti lokálních recidiv, ale žádný efekt na tumor specifické přežití (21). Catton et al. dokumentoval, že adjuvantní RT po kompletní resekci pouze oddálila lokální recidivu (16). Podle dalších retrospektivních studií nemá adjuvantní či intraoperační RT vliv na lokální kontrolu onemocnění či přežití (2, 17, 18). Optimální role a načasování zahájení RT musí být ještě potvrzena v budoucích randomizovaných studiích.
Chemoterapie má limitovaný efekt léčby RPS. Ve starších studiích byl popsán určitý efekt režimu doxorubicinu v kombinaci s ifosfamidem (29). Tato léčba vykazovala velké množství nežádoucích účinků, zejména kvůli doxorubicinu. Ke snížení jeho toxicity byla použita PEGylace (kovalentní vazbou navázané molekuly polyethylenglykolu na molekulu doxorubicinu). Tato modifikace doxorubicinu vykazuje stejnou protinádorovou aktivitu a byla testována na léčbě pokročilých STS (30, 31). Jako slibnou molekulou v léčbě metastatického se ukazuje trabectetin – původně testovaný na ovariální karcinom. Tato molekula byla testována na metastatických či primárně inoperabilních STS po selhání standardního schématu s doxorubicinem a ifosfamidem (32, 33).
Závěr
Limity této studie spatřujeme v retrospektivitě a omezeném počtu pacientů. Naše výsledky jsou v souladu s výsledky obdobných studií a podtrhují nutnost zlepšení efektivity léčby high-risk tumorů. Nová efektivnější neoadjuvantní či adjuvantní schémata chemoterapie či radioterapie by mohly být vhodným řešením. Jsou očekávány výsledky nových klinických studií.
Na závěr je třeba podtrhnout, že „high - risk“ tumory a PSM v histologickém preparátu jsou spojeny s horší prognózou. Agresivní resekce (nezřídka včetně en bloc resekcí okolních orgánů) může snižovat riziko PSM. Tento přístup také snižuje riziko lokální recidivy onemocnění. Optimální léčba „high-grade“ tumorů pro tuto chvíli není stanovena. Efekt současné chemoterapie i radioterapie je kontroverzní. V případě lokální recidivy je opakovaná resekce jedinou efektivní metodou léčby. „Low-grade“ tumory mají relativně dobrou prognózu, přesto je však nutná pravidelná dispenzarizace.
Došlo: 30. 11. 2010.
Přijato: 18. 3. 2011.
Kontaktní adresa
MUDr. Michal Balík
Urologická klinika FN HK
Sokolská 581,
500 05 Hradec Králové
e-mail: balikmic@ fnhk.cz
Sources
1. Wibmer C, Leithner A, Zielonke N, Sperl M, Winghager R. Increasing incidence rates of soft tissue sarcomas? A population-based epidemiologic study and literature review. Ann Oncol 2010; 21 : 106–1111.
2. Gholami S, Jacobs CD, Kapp DS, Parast LM, Norton JA. The value of surgery for retroperitoneal sarcoma. Sarcoma 2009; doi:10.1155/2009/605840.
3. Qiao MZ, Li CL. Analysis of prognostic factors associated with primary retroperitoneal sarcoma Bull Cancer. 2007; 94 : 5–7.
4. Toro JR, Travis LB, Wu HJ, Zhu K, Fletcher CD, et al. Incidence patterns of soft tissue sarcomas, regardless of primary site, in the surveillance, epidemiology and end results program, 1978–2001: Annalysis of 26,758 cases. Int J Cancer 2006; 119 : 2922–2930.
5. Pirayesh A, Chee Y, Helliwell TR, Hershman MJ, Leinster SJ, et al. The management of retroperitoneal soft tissue sarcoma: a single institution experience with a review of the literature. Eur J Surg Oncol 2001; 27 : 491–497.
6. Zahm SH, Fraumeni JF. The epidemiology of soft tissue sarcoma. Semin Oncol 1997; 24 : 504–514.
7. www.svod.cz
8. Lahat G, Dhuka AR, Lahat S, Lazar AJ, Lewis VO, et al. Complete soft tissue sarcoma resection is a viable treatment option for select elderly patients. Ann Surg Oncol 2009; 16 : 2579–2586.
9. Lahat G, Tuvin D, Wei C, Anaya DA, Bekele BN, et al. New perspectives for staging and prognosis in soft tissue sarcoma. Ann Surg Oncol 2008; 15 : 2739–2748.
10. Chiappa A, Zbar AP, Biffi R, Bertani E, Biella F, et al. Effect of resection and outcome in patients with retroperitoneal sarcoma. ANZ J Surg 2006; 76 : 462–466
11. Hajdu SI, Shiu MH, Brennan MF. The role of the pathologist in the management of soft tissue sarcomas. World J Surg 1988; 12 : 326–331.
12. Enzinger FM, Lattes R, Torloni H. Histological typing of soft tissue tumors. Geneva: World Health Organization 1969.
13. Leyvraz S, Costa J. Histological diagnosis and grading of soft–tissue sarcomas. Semin Surg Oncol 1988; 4 : 3–6.
14. Hajdu SI. Soft tissue sarcomas. Cancer 2007; 109 : 1697–1704.
15. Mendenhall WM, Zlotecki RA, Hochwald SN, Hemming AW, Grobmyer SR, et al. Retroperitoneal soft tissue sarcoma. Cancer 2005; 104 : 669–675.
16. Catton CN, O‘Sullivan B, Kotwall C, Cummings B, Hao Y, et al. Outcome and prognosis in retroperitoneal soft tissue sarcoma. Int J Radiat Oncol Biol Phys 1994; 29 : 1005–1010.
17. Ballo MT, Zagars GK, Pollock RE, Benjamin RS, Feig BW, et al. Retroperitoneal soft tissue sarcoma: an analysis of radiation and surgical treatment. Int J Radiat Oncol Phys 2007; 67 : 158–163.
18. Youssef E, Fontanesi J, Mott M, Kraut M, Lucas D, et al. Long-term outcome of combined modality therapy in retroperitoneal and deep-trunk soft-tissue sarcoma: analysis of prognostic factors. Int J Radiat Oncol Biol Phys 2002; 54 : 514–519.
19. Gadgeel SM, Harlan LC, Zeruto CA, Osswald M, Schwartz AG. Patterns of care in a population - based sample of soft tissue sarcoma patients in the United States. Cancer 2009; 115 : 2744–2754.
20. Anaya DA, Lev DC, Pollock RE. The role of surgical margin status in retroperitoneal sarcoma. J Surg Oncol 2008; 98 : 607–610.
21. Gutierrez JC, Perez EA, Moffat FL, Livingstone AS, Franceschi D, et al. Outcomes for soft – tissue sarcoma in 8249 cases from a large state cancer registry. Ann Surg 2007; 245 : 952–958.
22. Canter RJ, Qin LX, Ferrone CR, MakiRG, Singer S, et al. Why do patients with low-grade soft tissue sarcoma die? Ann Surg Oncol 2008; 15 : 3550–3560.
23. Sartori A, Vigna S, Dal Pozzo A, Balduino M, Sartori CA. Leiomyosarcoma of the inferior vena cava: a case report and review of the literature. Chir Ital 2009; 61 : 503–505.
24. Alexander A, Rehders A, Raffel A, Poremba C, Knoefel WT, et al. Leiomyosarcoma of the inferior vena cava: radical surgery and vascular reconstruction. World J Surg Oncol 2009; 7 : 56.
25. Tameo MN, Calligaro KD, Antin L, Dougherty MJ. Primary leiomyosarcoma of the inferior vena cava: Reports of infrarenal and suprahepatic caval involvement. J Vasc Surg 2010; 51 : 221–224.
26. García Franco CE, Algarra SM, Ezcurra AT, Guillén-Grima F, San-Julián M, et al. Longterm results after resection for soft tissue sarcoma pulmonary metastases. Interact Cardiovasc Thorac Surg 2009; 9 : 223–226.
27. Lewis JJ, Leung D, Woodruff JM, Brennan MF. Retroperitoneal soft-tissue sarcoma: analysis of 500 patients treated and followed at a single institution. Ann Surg 1998; 228 : 355–365.
28. Stoeckle E, Coindre JM, Bonvalot S, Kantor G, Terrier P, et al. French Federation of Cancer Centers Sarcoma Group. Prognostic factors in retroperitoneal sarcoma: a multivariate analysis of a series of 165 patients of the French Cancer Center Federation Sarcoma Group. Cancer 2001; 92 : 359–368.
29. Mendenhall WM, Indelicato DJ, Scarborough MT, Zlotecki RA, Gibbs CP, et al. The management of adult soft tissue sarcomas. Am J Clin Oncol 2009; 32 : 436–442.
30. Judson I, Radford JA, Harris M, Blay JY, Van Hoesel Q, et al. Randomised phase II trial of pegylated liposomal doxorubicin (DOXIL/CAELYX) versus doxorubicin in the treatment of advanced or metastatic soft tissue sarcoma: a study by the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer 2001; 37 : 870–877.
31. Poveda A, López-Pousa A, Martín J, Del Muro JG, Bernabé R, et al. Phase II Clinical Trial With Pegylated Liposomal Doxorubicin (CAELYX(R)/Doxil(R)) and Quality of Life Evaluation (EORTC QLQ–C30) in Adult Patients With Advanced Soft Tissue Sarcomas: A study of the Spanish Group for Research in Sarcomas (GEIS). Sarcoma 2005; 9 : 127–132.
32. Demetri GD, Chawla SP, von Mehren M, Ritch P, Baker LH, et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. J Clin Oncol 2009; 27 : 4188–4196.
33. Le Cesne A, Domont J, Cloffi A. Role of trabectedin as a new chemotherapy option in advanced pretreated soft tissue sarcoma. Drug Today 2008; 45 : 403–421.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 2-
All articles in this issue
- Neurální kontrola dolních močových cest
- Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
- Role laparoskopie v urologii
- Nehmatné varle u dítěte: začít diagnostickou laparoskopií nebo otevřenou revizí třísla?
- Léčba neurogenní hyperaktivity detruzoru botulinumtoxinem A – první zkušenosti se subslizniční aplikací
- Výsledky léčby retroperitoneálních sarkomů a jejich hlavní rizika
- Sarkomatoidný karcinóm močového mechúra s heterológnou osteosarkomatóznou diferenciáciou
- Extrakce kalcifikované spirály z močového měchýře s použitím Holmiového laseru
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Neurální kontrola dolních močových cest
- Nehmatné varle u dítěte: začít diagnostickou laparoskopií nebo otevřenou revizí třísla?
- Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

