-
Medical journals
- Career
Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
: Lubomír Hyršl 1; Jan Závada 2; Zuzana Závadová 2; Ivan Kawaciuk 3; Štěpán Veselý 3; Petr Škapa 4
: Urologické oddělení ON Kladno 1; Ústav organické chemie a biochemie AV ČR, Praha 2; Urologická klinika 2. LF UK a FNM, Praha 3; Klinika patologie a molekulární medicíny 2. LF UK a FNM, Praha 4
: Ces Urol 2011; 15(2): 85-92
: Original article
Cíl:
Cílem práce bylo prokázat přítomnost solubilní formy CA IX proteinu (s-CA IX) v kultivačním médiu nádorových buněk in vitro a v tělních tekutinách in vivo u CA IX protein pozitivních nádorů. Následně přizpůsobit současné diagnostické metody ke stanovení s-CA IX a pokusit se zjistit jeho možný význam jako markeru u adenokarcinomu ledviny (RCC) a uroteliálních karcinomů (TCC).Materiál a metoda:
Do studie jsme zahrnuli dvě skupiny: 1. nemocní s RCC, 2. nemocní s TTC vývodných močových cest. V první skupině bylo testováno 31 pacientů s RCC a 61 kontrol, ve druhé 32 pacientů s endoskopickým podezřením na TCC a 16 kontrol. K průkazu CA IX antigenu ve vzorcích nádorů jsme použili imunohistochemické barvení pomocí monoklonální protilátky M75. V extraktech z nádorů a v tělních tekutinách jsme přítomnost CA IX stanovovali metodou „Western blot“ nebo ELISA.Výsledky:
V 1. skupině jsme v séru přítomnost s-CA IX zjistili pouze v podskupině s prokázaným RCC. Z 31 vzorků jich bylo 13 (41,9 %) pozitivních. V moči v podskupině s RCC byl s-CA IX protein prokázán u 19 (70 %) z 27 vzorků. V kontrolní skupině byly všechny vzorky s-CA IX negativní Ve 2. skupině byl TCC histologicky prokázán u 23 nemocných. Pozitivní nález s-CA IX v moči byl u 16 z nich (69,6 %). Negativní nález s-CA IX byl u 7 (30,4 %) nemocných. U žádného z TCC pozitivních pacientů jsme v séru s-CA IX antigen neprokázali.Závěr:
Naše práce prokázala uvolňování CA IX do tělních tekutin u nemocných s RCC a TCC a možnost jeho detekce. Western blot v kombinaci s použitím zvýšené chemiluminiscence je specifickou a vysoce citlivou metodou pro laboratorní hodnocení, avšak je to technika pracná a časově náročná. Současné výsledky ukazují, že by se dalo uvažovat o vyvinutí vhodné kvantitativní metody pro stanovení s-CA IX, jež by umožnila zpracování větších souborů nemocných ke zhodnocení klinického významu jeho exprese u nemocných s RCC a TCC.Klíčová slova:
adenokarcinom ledviny, karbonická anhydráza IX, uroteliální nádory vývodných močových cest.Úvod
Karbonická anhydráza IX (CA IX), dříve nazývaná MN nebo MN/CA9 protein, je povrchový buněčný protein, který se normálně vyskytuje pouze ve sliznici žaludku a žlučovodů (1). Malá množství CA IX lze prokázat ve sliznici střeva, a to v oblasti krypt, kde jsou buňky s vysokou proliferační kapacitou (2). Směrem distálním od žaludku jeho množství ubývá. Minimální hladiny lze dále zjistit v epiteliích pankreatického duktu mužských pohlavních orgánů a v epiteliálních buňkách vystýlajících tělní dutiny (3–5). Jeho přítomnost byla zjištěna ve vysokém procentu (téměř 100 %) u některých typů lidských karcinomů, jako je karcinom hrdla děložního, karcinom jícnu a adenokarcinom ledviny (2–7). V nižším procentu případů (40–60 %) byl stanoven i u karcinomů hlavy, krku, plic, prsu a kolorektálního karcinomu. Vždy se jedná o ektopickou expresi, kdy antigen je přítomen v nádorech vycházejících z CA IX negativních tkání. Nevyskytuje se ve tkáni zdravé ledviny, u nenádorových onemocnění ledviny ani u benigních nádorů, chromofobní varianty karcinomu ledviny a adenokarcinomu z jasných buněk extrarenálního původu (8–15). Protein CA IX tvoří homodimery spojené disulfidovými vazbami mezi rezidui cystinu. Každá jednotka (monomer) sestává z pěti domén: signálního peptidu, proteoglykanové domény, anhydrázové domény, transmembránové kotvy a intracytoplazmatického ocasu (obr. 1). Tvoří jej 459 aminokyselin.
1. Struktura CA IX proteinu Fig. 1. CA IX protein structure 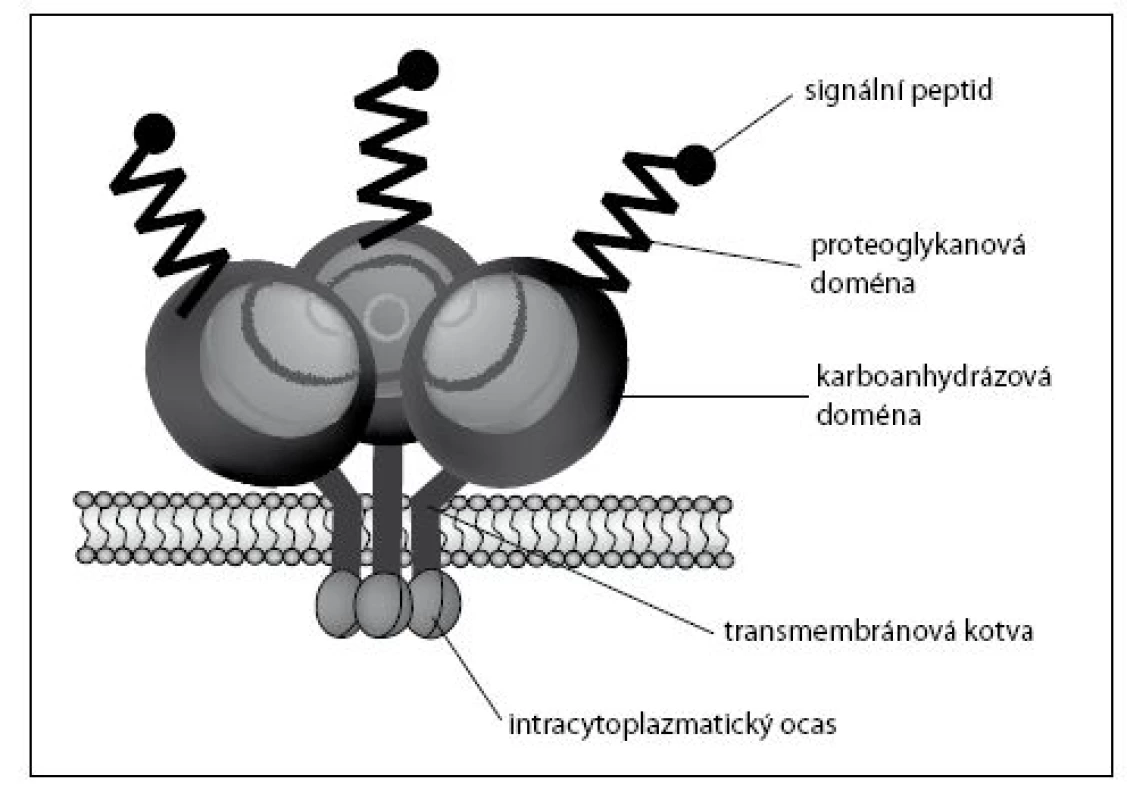
V normální žaludeční sliznici CA IX slouží jako diferenciační antigen (16). Předpokládá se, že anhydrázová část pracuje jako regulátor pH a účastní se na transmembránovém transportu iontů. Nižší extracelulární pH podporuje invazivní růst nádorových buněk, zvýšená koncentrace Ca iontů v cytoplazmě aktivuje buněčné tyrosin-specifické proteinkinázy. Proteoglykanová doména CA IX funguje jako adhezivní molekula, která se účastní diferenciace sliznice zažívacího traktu, avšak při ektopické expresi může vést k přenosu falešných signálů. To zřejmě hraje důležitou úlohu i v karcinogenezi. Jeho 100% ektopická exprese u tří lidských karcinomů a nižší, ale významná i u některých dalších podporuje tuto domněnku. Jednou z dalších možných rolí je inhibice apoptózy v nádorové buňce (17). CA IX protein lze prokázat imunohistochemickým barvením v histologickém preparátu na buněčné membráně. Pomocí reverzní transkripční polymerázové řetězové reakce (RT-PCR) v krevním vzorku lze zjistit mRNA kódující CA IX protein v uvolněných cirkulujících buňkách. Specificita vyšetření byla 100%, senzitivita metody je obrovská – stačí k odhalení jediné nádorové buňky v 1 ml krve, avšak záchytnost je nízká, pouze 25–49 %. Nevýhodou této metody je, že stanovuje CA9-mRNA v nádorových buňkách při jejich diseminaci (18). Tím lze i vysvětlit nízkou záchytnost. V naší studii jsme se zaměřili na možnost stanovení tohoto proteinu, který se uvolňuje z tumorózních buněk, v krvi a moči.
Materiál a metoda
Ve studii probíhající v letech 2004–2008 byly vytvořeny dvě skupiny pacientů: 1. nemocní s adenokarcinomem ledviny, 2. nemocní s uroteliálními tumory močového měchýře nebo kalichopánvičkového systému. V první skupině bylo testováno 31 pacientů s adenokarcinomem ledviny (RCC), 15 pacientů s nonRCC tumory, čtyři pacienti s nenádorovým urologickým onemocněním a 42 zdravých sloužilo jako kontrolní skupina. Do druhé skupiny bylo zařazeno 32 pacientů s endoskopickým podezřením na uroteliální nádor močového měchýře (TCC), v jednom případě ledvinné pánvičky a 16 kontrol. Do dalšího hodnocení jsme zařadili pouze nemocné s mikroskopicky prokázaným karcinomem vycházejícím z urotelu. K průkazu CA IX antigenu ve vzorcích nádorů nemocných po operaci jsme použili imunohistochemické barvení pomocí specifické monoklonální protilátky M75. Tato protilátka specificky reaguje s antigenem CA IX nativním i v parafinových bločcích s preparáty fixovanými formaldehydem. V nádorových tkáních CA IX dosahuje koncentrace okolo 1 mg/g proteinu.
Pro extrakty z buněk nebo pro média z buněčných kultur požíváme metodu ELISA, která vyžaduje kombinaci dvou protilátek (V10 pro zachycení antigenu a M75, značenou biotinem nebo peroxidázou) (19, 20). Metoda spolehlivě funguje s tekutinami obsahujícími nanogramy antigenu na ml a více (hodí se např. pro běžné nádorové markery jako PSA, CEA aj.). V materiálech s méně než 1 ng/mg ELISA sice funguje, avšak její výsledky jsou zatíženy nespecifickými reakcemi s jinými složkami biologických tekutin. Koncentrace CA IX v krvi a moči pacientů dosahuje však pouhých několika pg/ml. K těmto účelům jsme použili mimořádně citlivou a současně specifickou techniku, která je však značně pracná. V prvním stupni koncentrujeme antigen z 1 ml séra nebo z 10 ml moče. Ve druhém stupni rozdělíme molekuly bílkovin podle velikosti gelovou elektroforézou a přeneseme je na vhodnou membránu. Třetím stupněm je zviditelnění antigenu na membráně pomocí protilátky M75 konjugované s peroxidázou. Po přidání vhodného substrátu s použitím techniky ECL (potencovaná chemiluminiscence) antigen začne světélkovat, což zachytíme na citlivý film. Každou membránu s navázanými proteiny vyvoláváme napřed v roztoku monoklonální protilátky M75 konjugované s peroxidázou, která označí antigen CA IX. Následuje lázeň obsahující luminol, H2O2 a kyselinu kumarovou. Peroxidáza navázaná na protilátku katalyzuje oxidaci luminolu peroxidem vodíku, čímž vznikají záblesky světla. Ty se exponují na citlivý film. Pro každý blot užíváme nejméně dvě expozice: 5 minut pro materiály od pacientů s vyšší hladinou antigenu a 30 minut pro materiály od zdravých individuí. Ty pokládáme za „negativní“, ač obsahují také CA IX, ale jen 0,2–5 pg/ml. Každý blot obsahuje také standardní koncentrace CA IX jako kalibraci. V tomto případě to byla CA IX vyrobená metodami genového inženýrství, purifikovaná afinitní chromatografií a koncentrace zásobního preparátu byla stanovena chemicky.
Pro potvrzení hypotézy, že s-CA IX v séru pochází opravdu z adenokarcinomu ledviny, jsme stanovili koncentraci s-CA IX u nemocných s RCC před a 5. den po operačním výkonu.
Tato studie byla schválena etickou komisí Fakultní nemocnice v Motole.
Výsledky
V rámci 1. skupiny, týkající se adenokarcinomu ledviny, byly vyšetřovány vzorky od 50 nemocných. Soubor byl dále rozdělen na podskupinu nemocných s histologicky prokázaným adenokarcinomem ledviny (n = 31). Nemocní s histologicky odlišným nádorem než adenokarcinomu (n = 15) byli zařazeni spolu s nemocnými s nenádorovými onemocněními (n = 4) do podskupiny kontrolní. Jako další kontroly jsme ještě zařadili séra, získaná od zdravých dárců krve (n = 42).
Z tkáně zdravé ledviny, angiomyolipomu a šesti preparátů adenokarcinomu ledviny získané po nefrektomii jsme odebrali vzorky k přípravě extraktu, ve kterém jsme stanovili přítomnost a koncentraci CA IX proteinu. Na „Western blotu“ se CA IX protein zobrazuje jako dvojitý proužek o molekulové hmotnosti 58 a 54 kDa (obr. 2). Ve všech šesti extraktech z RCC nádorové tkáně byl přítomen CA IX protein ve vysoké koncentraci 0,5–2 mg/g celkového proteinu. V extraktu tkáně zdravé ledviny a angiomyolipomu CA IX nebyl přítomen. Část vitální tkáně nádoru jsme také kultivovali in vitro a v těchto krátkodobých tkáňových kulturách jsme poté prokázali uvolňování extracelulární části CA IX proteinu do kultivačního média jako solubilní formy CA IX proteinu (s-CA IX). Solubilní CA IX je kratší o transmembránovou a intracytoplazsignální matickou část a má molekulovou hmotnost 54 a 50 kDa. Koncentrace s-CA IX v růstovém médiu z nádorových explantátů se pohybuje v rozmezí 20–50 ng/ml.
2. Western Blot, stanovení CA IX v kultivačním médiu nebo buněčném extraktu RCC a kontrolních tkání Fig. 2. Western blot analysis of CA IX in culture media or in extracts from cells, tumours and control tissues 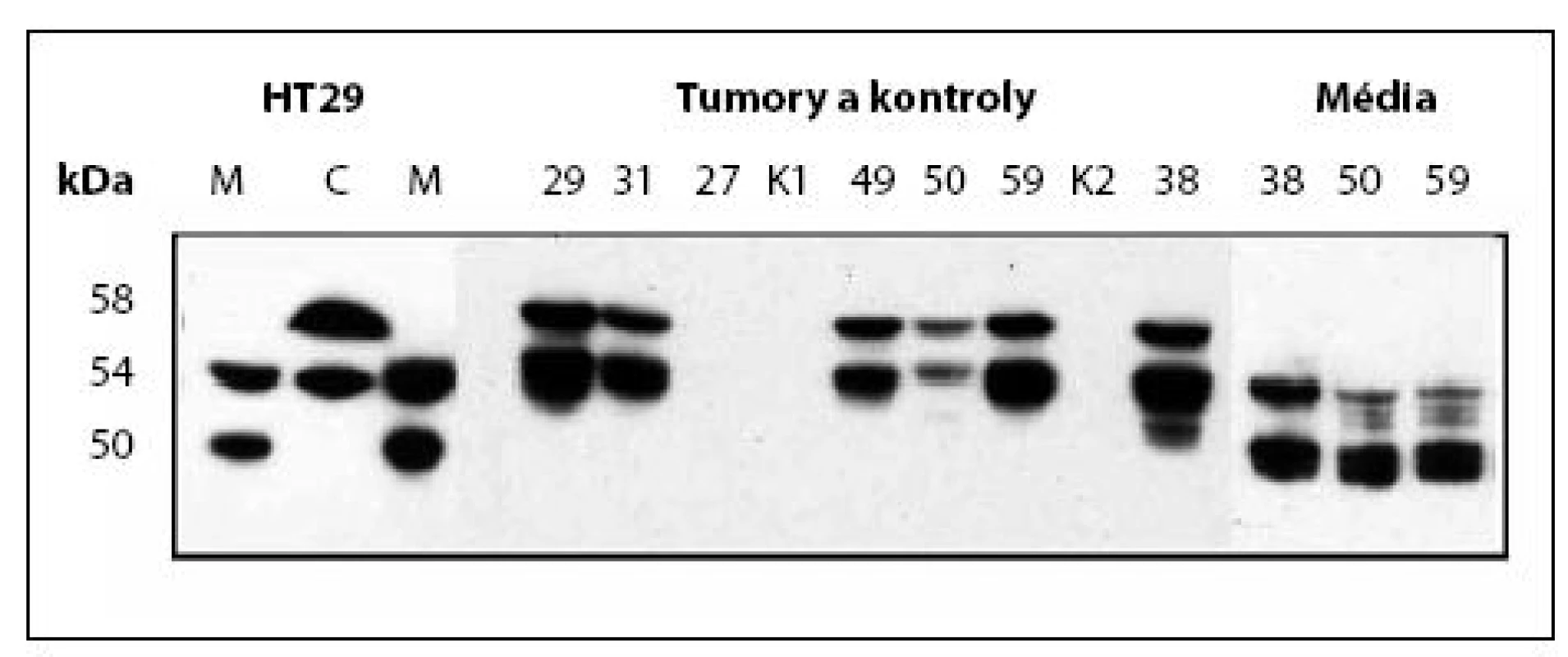
HT29: M – médium, C – buněčný extrakt. K1, K2 – kontroly, č. 27 – angiomyolipom, ostatní RCC HT29: M – medium, C – cell extract. K1, K2 – control kidneys; No. 27 – angiolipoma; all other lanes – RCC V séru pozitivní s-CA IX protein jsme zjistili pouze v podskupině s histologicky prokázaným adenokarcinomem ledviny. Z 31 vzorků jich bylo 13 (41,9 %) pozitivních. Ve druhé podskupině non-RCC tumorů a jiných nenádorových urologických onemocněních byly všechny vzorky na s-CA IX protein negativní.
V moči je vyšetření usnadněno tím, že od pacientů můžeme získat větší odběry než v případě krve a dále tím, že moč obsahuje mnohem méně bílkovin než sérum. Vysoký obsah bílkovin v koncentrovaném preparátu znemožňuje analýzu s-CA IX. V podskupině s přítomným RCC byl s-CA IX protein prokázán v moči u 19 (70 %) z 27 vzorků. V kontrolní skupině, zahrnující 30 vzorků (25 zdravých kontrol, 3 non-RCC tumory, 2 jiné urologické onemocnění), byly všechny vzorky s-CA IX negativní.
U pěti nemocných s RCC jsme stanovili koncentraci s-CA IX před a 5. den po operačním výkonu (obr. 3). Ve třech případech je vidět významný pokles hladiny s-CA IX po výkonu, u jednoho nemocného pouze mírný (druhý vzorek odebrán z technických důvodů již první den po operaci). U jednoho nemocného (pacient 68) je naopak pozorovatelná vyšší hladina s-CA IX. Zde byla provedena pouze operační revize a pro operačně neřešitelný nález nádor nebyl odstraněn. To dokazuje, že zdrojem s-CA IX jsou buňky RCC. V tabulce 1 jsou uvedeny přehledně údaje koncentrace CA IX proteinu v jednotlivých biologických materiálech, jak jsme je stanovili během naší práce.Výsledky v buněčných extraktech a kultivačním médiu byly stanoveny metodou ELISA. V séru a v moči, pro nízkou koncentraci s-CA IX, bylo nutné použít densitometrické hodnocení filmů exponovaných „Western bloty“ a porovnání se standardními koncentracemi s-CA IX.
3. s-CA IX v séru nemocných před a po nefrektomii Fig. 3. s-CA IX in the serum of RCC patients before and after nephrectomy 
1. Hodnoty CA IX v různých biologických materiálech Table 1. Concentration of CA IX in biological materials 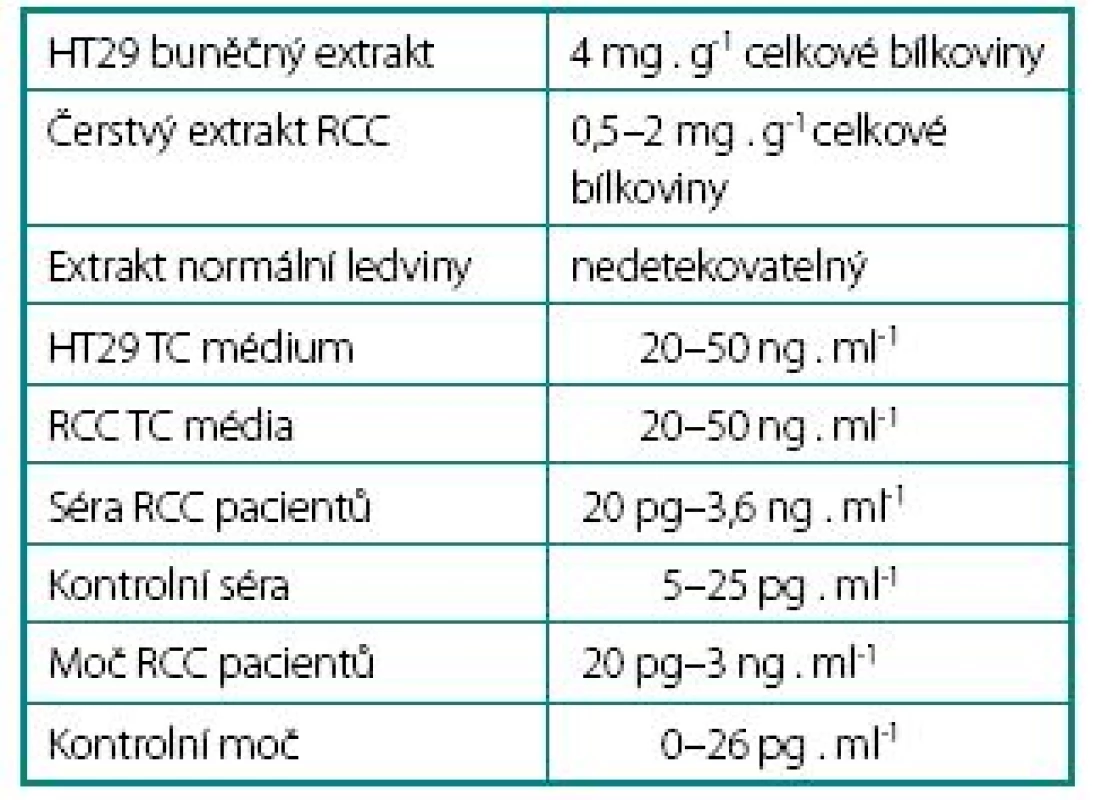
HT29 – buněčná linie kolorektálního karcinomu 2. Porovnání výsledků mikroskopického vyšetření (barvení hematoxylinem-eosinem), imunohistochemického vyšetření CA IX (IHC) a Western blot (WB) Table 2. An overview of the results obtained by histology (hematoxylin-eosin staining), CAIX antigen detection by immunohistochemistry (IHC) and Western blotting (WB) 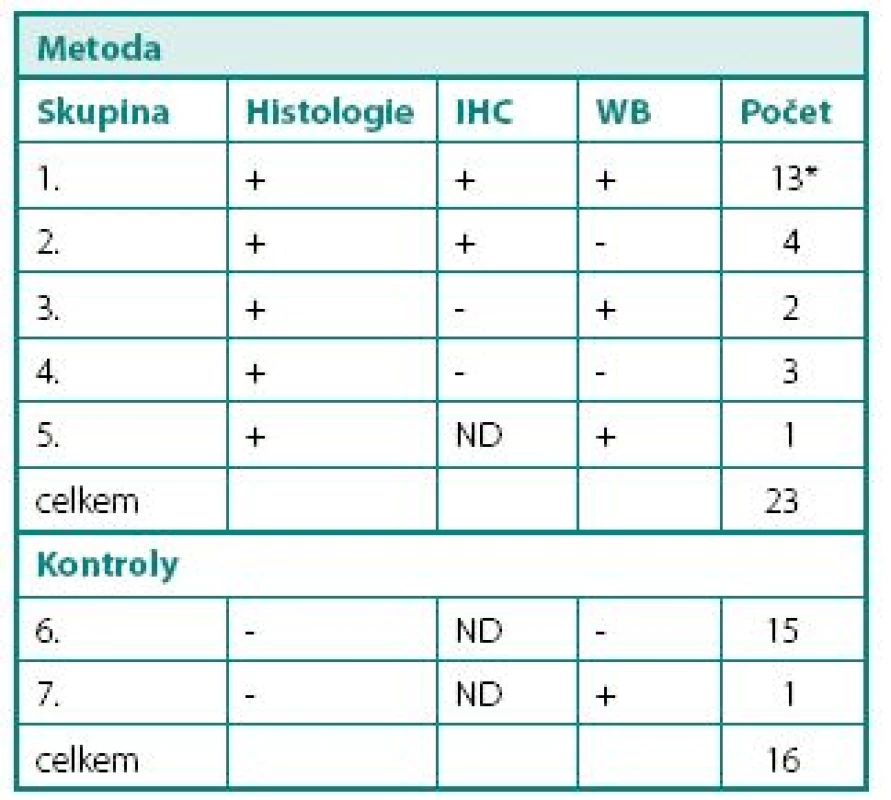
* 12 - TCC a 1 - SCC ND – neprovedeno Ve druhé skupině nemocných s uroteliálními tumory dolních a horních močových cest bylo hodnoceno 32 nemocných s podezřením nebo prokázaným uroteliálním tumorem. U sedmi byla provedena radikální cystektomie, u jednoho nefroureterektomie a u ostatních transuretrální resekce tumoru močového M C M 29 31 27 K1 49 50 59 K2 38 38 50 59 HT29 Tumory a kontroly Média kDa 58 54 50 B A B A B A B A B A s-CA IX (pg) 200 100 50 36 68 104 117 121 kDa 54 50 Obr. 2. Western Blot, stanovení CA IX v kultivačním médiu nebo buněčném extraktu RCC a kontrolních tkání HT29: M – médium, C – buněčný extrakt. K1, K2 – kontroly, č. 27 – angiomyolipom, ostatní RCC Fig. 2. Western blot analysis of CA IX in culture media or in extracts from cells, tumours and control tissues HT29: M – medium, C – cell extract. K1, K2 – control kidneys; No. 27 – angiolipoma; all other lanes – RCC Obr. 3. s-CA IX v séru nemocných před a po nefrektomii Fig. 3. s-CA IX in the serum of RCC patients before and after nephrectomy měchýře. Karcinom vycházející z urotelu byl histologicky prokázán u 23 (71,9 %) nemocných, u jednoho z nich se jednalo o karcinom spinocelulární. V této skupině byla s-CA IX pozitivní u 16 (69,6 %) nemocných a koncentrace s-CA IX proteinu v moči ve většině případů pohybovaly mezi 5–40 pg/ml. Negativní nález s-CA IX byl u 7 (30,4 %) pacientů (tab. 2). Imunohistochemické barvení prokázalo CA IX protein zejména v povrchových vrstvách nádoru u 13 nemocných. Nekrózu jsme nalezli pouze u tří TCC a jednoho SCC. Jeden z těchto TCC nádorů s nekrózou byl kompletně CA IX negativní, ostatní byly středně až výrazně pozitivní. Ani v jednom případě jsme nepozorovali vyšší intenzitu barvení v perinekrotické oblasti. Senzitivitu jsme v naší skupině spočetli na 69,6% a pozitivní prediktivní hodnotu 69,6%. Specificita a negativní prediktivní hodnota byly pouze 22,2%. Sérové koncentrace s-CA IX byly u všech těchto nemocných negativní.
Diskuse
Zdá se, že CA IX protein hraje důležitou úlohu v patogeneze mnoha karcinomů u lidí. K jeho expresi na membráně nádorových buněk dochází v důsledku hypoxie (inaktivace VHL genu a „upregulace“ dalších proteinů jako HIF, VEGF atd.). Tento membránový protein lze poměrně snadno zviditelnit na povrchu nádorových buněk v preparátu pomocí IHC barvení specifickou monoklonální protilátkou M75. V literatuře je uváděna přítomnost CA IX téměř u 100 % adenokarcinomů ledviny (8, 9). Jak jsme prokázali v naší práci, dochází zřejmě vlivem proteáz k odštěpování extracelulární části molekuly do kultivačního média a tkáňových tekutin. Proto je tato solubilní forma menší (54/50 kDa) než molekula transmembránového CA IX proteinu (58/54 kDa). Tato velikost odpovídá proteoglykanové a anhydrázové doméně (21). Solubilní CA IX v krvi je značně nestálá a zřejmě se různými mechanismy rychle eliminuje. Jedním z nich je vylučování s-CA IX v nezměněné formě močí. Koncentrace s-CA IX proteinu u RCC pacientů v moči přibližně odpovídají koncentracím v krvi (viz tab. 1). Vyšší pozitivitu s-CA IX proteinu u RCC pacientů v moči (70 %) proti séru (40 %) lze vysvětlit použitím většího objemu moče ke koncentraci s-CA IX než séra (10 ml vs. 1 ml). V dalších experimentech jsme se soustředili na uroteliální karcinomy močového měchýře a vývodných močových cest. Výhodou pro stanovování s-CA IX proteinu u těchto nádorů je, že jsou přímo omývány močí a že nejvíce nádorových buněk, exprimujících CA IX protein, je lokalizovaných na povrchu nádoru. Pravděpodobnost ztráty s-CA IX je tím minimální a jsme jej schopni detekovat v moči i u malých nádorů (22). Předpokládá se, že exprese CA IX v nádorových buňkách je důsledkem fokální hypoxie, která indukuje ektopickou syntézu CA IX (23–26). To jsme v naší práci nepotvrdili. Při IHC se CA IX protein často barvil difuzně v povrchových vrstvách nádorových papilárních struktur. To lze vysvětlit jednak nízkou tenzí kyslíku v oblasti relativně vzdálené od vaskulárního zásobení ve stromatu nádoru a dále také v moči. Kompletní IHC negativita jednoho TTC s fokální nekrózou může být důsledkem jiné biologické povahy nádoru s neschopností exprese CA IX.
Z výsledků lze předpokládat, že u nemocných s RCC s-CA IX cirkuluje v krvi, protože je buněčný adhezivní protein (27, 28) vázán v tkáních, které exprimují předpokládaný CA IX specifický receptor. Navázaný CA IX protein je poté v buňkách a následně rozložen. Menší část je vyloučena do moči. U nemocných, kde jsme stanovili vysoké koncentrace s-CA IX, lze předpokládat, že většina receptorů byla obsazena s-CA IX proteinem a nově tvořený zůstával volně v krvi a byl i ve vysoké koncentraci vylučován močí. Naopak u TCC je s-CA IX téměř výhradně uvolňován do moči. Jeho průniku do krve brání bazální membrána oddělující nádorové buňky od cév. To vysvětluje nepřítomnost s-CA IX v krvi.
Limitem naší práce je dostupnost vhodných metod ke stanovení s-CA IX v tělních tekutinách. Problémem je, že koncentrace s-CA IX jsou velmi nízké (1000× nižší než například koncentrace prostatického specifického antigenu v séru) a za hranicí citlivosti běžně dostupné metody ELISA. Jako dostatečně citlivá se ukázala metoda Western blotting (gelová imunoelektroforéza), kvantifikovaná pomocí densitometrického hodnocení filmů exponovaných Western bloty. Nevýhodou této metody je, že je pouze semikvantitativní a při nestandardním provedení zatížena značnou chybou ve výsledcích. Dále se jedná o metodu velmi pracnou a časově náročnou, nevhodnou pro zpracování většího množství vzorků. Její výsledky je nutné hodnotit opatrně a nelze stanovit jasně definovanou hodnotu mezi normální a zvýšenou hladinou s-CA IX.
Závěr
Naše práce prokázala uvolňování CA IX proteinu do tkáňových tekutin u nemocných s RCC a TCC a možnost jeho detekce. „Western blot“ je specifickou a dostatečně citlivou metodou pro laboratorní hodnocení. Bohužel pro zpracování většího souboru nemocných nebo klinickou praxi je pro svou pracnost a časovou náročnost nevhodná. Nevýhodou je také to, že je pouze semikvantitativní a výsledky nejsou vhodné pro statistické zpracování. Podaří-li se vyvinout jinou, současně vysoce citlivou, specifickou a rychlou metodu pro stanovení CA IX v krvi a moči, bude možné rozhodnout, zda je tento antigen vhodným markerem pro sledování stavu pacientů s RCC a TCC.
Došlo: 1. 11. 2010.
Přijato: 6. 12. 2010.
Kontaktní adresa
MUDr. Lubomír Hyršl
Urologické oddělení ON
Vančurova 1548, Úvod Karbonická anhydráza IX (CA IX), dříve nazývaná MN nebo MN/CA9 protein, je povrchový buněčný protein, který se normálně vyskytuje pouze ve sliznici žaludku a žlučovodů (1). Malá množství CA IX lze prokázat ve sliznici střeva, a to v oblasti krypt, kde jsou buňky
272 59 Kladno
e-mail: lhyrsl@volny.cz
Výzkum byl podpořen firmou Bayer Diagnostics, USA, grantem č. 301/99/0356 GA ČR a grantem č. 2/3055/23 VEGA.
Sources
1. Pastorekova S, Parkkila S, Parkkila AK, et al. Carbonic anhydrase IX, MN/CA IX: Analysis of stomach complementary DNA sequence and expression in human and rat alimentary tracts. Gastroenterology 1997; 112 : 398–408.
2. Saarnio J, Parkkila S, Parkkila AK, et al. Immunochemistry of carbonic anhydrase isozyme IX (MN/CA IX) in human gut reveals polarized expression in the epithelial cells with the highest proliferative capacity. J Histochem Cytochem 1998a; 46 : 497–504.
3. Kivela AJ, Parkkila S, Saarnio J, et al. Expression of transmembrane carbonic anhydrase isoenzymes IX and XII in normal human pancreas and pancreatic tumours. Histochem Cell Biol 2000; 114 : 197–204.
4. Karhumaa P, Kaunisto K, Parkkila S, et al. Expression of the transmembrane carbonic anhydrases, CA IX and CA XII, in the human male excurrent ducts. Mol Hum Reprod 2001; 7 : 611–616.
5. Ivanov S, Liao SY, Ivanova A, et al. Expression of hypoxia-inducible cell-surface transmembrane carbonic anhydrases in human cancer. Am J Pathol 2001; 158 : 905–919.
6. Liao SY, Brewer C, Zavada J, et al. Identification of MN antigen as a diagnostic biomarker of cervical intraepithelial sqamous and glandular neoplasia and cervical carcinomas. Am J Pathol 1994; 145 : 598–609.
7. Liao SY, Stanbridge EJ. Expression of MN/CA9 protein in Papanicolaou smears containing atypical glandular cells of undetermined significance is a diagnostic biomarker of cervical dysplasia and neoplasia. Cancer 2000; 88(5): 1108–1121.
8. Liao SY, Aurelio ON, Jan K, Zavada J, Stanbridge EJ. Identification of the MN/CA9 protein as a reliable diagnostic biomarker of clear cell carcinoma of the kidney. Cancer Res 1997; 57 : 2827–2831.
9. Oosterwijk E, Ruiter DJ, Hoedemaeker PJ, et al. Monoclonal antibody G250 recognizes a determinant present in renal-cell carcinoma and absent from normal kidney. Int J Cancer 1986; 38 : 489–494.
10. Oosterwijk E, Debruyne FM. Radiolabeled monoclonal antibody G250 in renal-cell carcinoma. World J Urol 1995; 13 : 186–190.
11. Uemura H, Kitagawa H, Hirao Y, et al. Expression of tumor-associated antigen MN/G250 in urologic carcinoma: Potential therapeutic target. J Urol 1997; 157(Suppl): 377.
12. McKiernan JM, Buttyan R, Bander NH, et al. Expression of the tumor-associated gene MN: A potential biomarker for human renal cell carcinoma. Cancer Res 1997; 57 : 2362–2365.
13. Turner JR, Odze RD, Crum CP, Resnick MB. MN antigen expression in normal, preneoplastic, and neoplastic esophagus: A clinicopathological study of a new cancerassociated biomarker. Hum Pathol 1997; 28 : 740–744.
14. Vermylen P, Roufosse C, Burny A, et al. Carbonic anhydrase IX antigen differentiates between preneoplastic lesions in non-small-cell lung carcinoma. Eur Respir J 1999; 14 : 806–811.
15. Bartosova M, Parkkila S, Pohlodek K, et al. Expression of carbonic anhydrase IX in breast is associated with malignant tissues and is related to overexpression of cerbB2. J Pathol 2002; 197 : 314–321.
16. Ortova-Gut M, Parkkila S, Vernerova Z, et al. Gastric hypeplasia in mice with targeted disruption of the carbonic anhydrase gene Car9. Gastroenteloogy 2002; 123 : 1889–1903.
17. Zavada J, Zavadova Z, Pastorek J, et al. Human tumour-associated cell adhesion protein MN/ CA IX: identification of M75 epitope and of the region mediating cell adhesion. Brit J Cancer 2000; 82 : 808–1813.
18. de la Taille A, Katz A, Cao Y, et al. Blood-based RT-PCR assays of MN/CA9 or PSMA: Clinical application in renal cancer patients. Urology 2000; 56 : 393–398.
19. Zatovicova M, Tarabkova K, Svastova E, et al. Monoclonal antibodies generated in CA IXdeficient mice recognize different domains of tumor-associated hypoxia induced carbonic anhydrase IX. J Immunol Methods 2003; 282 : 117–134.
20. Pastorekova S, Zavadilova Z, Kostal M, et al. A novel quasi-viral agent, MaTu, is a two-component system. Virology 1992; 187 : 620–626.
21. Opavský R, Pastoreková S, Zelník V, et al. Human MN/CA9 gene, a novel member of the carbonic anhydrase family: structure and exon to protein domain relationships. Genomics 1996; 33 : 480–487.
22. Turner KJ, Crew JP, Wykoff CC, et al. The hypoxiainducible genes VEGF and CA9 are differentially regulated in superficial vs invasive bladder cancer. Brit J Cancer 2002; 86 : 1276–1282.
23. Pastorekova S, Zavada J. Carbonic anhydrase (CA IX) as a potential target for cancer therapy. Review article. Cancer Ther 2004; 2 : 245–262.
24. Pastorekova S, Parkkila S, Zavada J. Tumor associated carbonic anhydrases and their clinical significance. Adv Clin Chem 2006; 42 : 167–216.
25. Loncaster JA, Harris AL, Davidson SE, et al. Carbonic anhydrase (CA IX) expression, a potential new intrinsic marker of hypoxia: Correlations with tumor oxygen measurements and prognosis in locally advanced carcinoma of the cervix. Cancer Res 2001; 61 : 6394–6399.
26. Harris AL. Hypoxia – a key regulatory factor in tumour growth. Nature Reviews Cancer 2002; 2 : 38–47.
27. Zavada J, Zavadova Z, Pastorek J, et al. Human tumour-associated cell adhesion protein MN/ CA IX: Identification of M75 epitope and of the region mediating cell adhesion. Brit J Cancer 2000; 82 : 808–1813.
28. Zavadova Z, Zavada J. Carbonic anhydrase IX (CA IX) mediates tumor cell interactions with microenvironment. Oncol Reports 2005; 13 : 977–982.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 2-
All articles in this issue
- Neural control of the lower urinary tract
- Lichen sclerosus – commonly overlooked urological diagnosis with serious complications
- Carbonic anhydrase IX (CA IX) expression in renal cell carcinoma and transitional cell carcinoma of urinary tract
- Role of laparoscopy in urology
- Impalpable testis, what first: diagnostic laparoscopy or inguinal exploration?
- Treatment of neurogenic detrusor overactivity using botulinumtoxin A – initial experiences with submucosal route of application
- Treatment outcomes of the retroperitoneal sarcomas and main risk factors
- Sarcomatoid carcinoma of the urinary bladder with heterologous osteosarcomatous differentiation
- Calcified metal tacker removal from the bladder using Holmium laser
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lichen sclerosus – commonly overlooked urological diagnosis with serious complications
- Neural control of the lower urinary tract
- Impalpable testis, what first: diagnostic laparoscopy or inguinal exploration?
- Carbonic anhydrase IX (CA IX) expression in renal cell carcinoma and transitional cell carcinoma of urinary tract
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

