-
Medical journals
- Career
Moderní metody zevní radioterapie v léčbě karcinomu prostaty
Authors: Karel Odrážka- 1 3; Martin Doležel 1,3; Jaroslav Vaňásek 1
Authors‘ workplace: Oddělení radiační onkologie, Multiscan s. r. o., Pardubická krajská nemocnice a. s. Pardubice 1; 1. a 3. lékařská fakulta, Univerzita Karlova v Praze 2; Katedra radiační onkologie IPVZ, Praha 3
Published in: Ces Urol 2010; 14(2): 81-91
Category: Review article
Overview
V posledních 20 letech prodělala zevní radioterapie karcinomu prostaty dramatický vývoj – objevily se zcela nové ozařovací metody a zlepšily se výsledky léčby. Plánování radioterapie s využitím počítačové tomografie a kalkulace rozložení dávky v prostoru nastartovaly rozvoj konformních technik radioterapie (trojrozměrná konformní radioterapie 3D-CRT, radioterapie s modulovanou intenzitou IMRT). Další pokrok v technologii zobrazování a koncentrace na přesné zaměření svazku záření zahájily etapu radioterapie řízené obrazem (IGRT), která posouvá konformní techniky na vyšší úroveň kvality a bezpečnosti. Pokročilé formy radioterapie jsou spojeny s lepší distribucí dávky oproti technikám konvenčním, což se projevuje významným šetřením zdravých tkání. Radiační onkologie plně využila výhod konformních metod k eskalaci dávky záření na oblast prostaty. Randomizované studie přinesly nezvratné důkazy o tom, že suprakonvenční dávky záření zvyšují pravděpodobnost kontroly nádoru.
Klíčová slova:
karcinom prostaty, zevní radioterapie, konformní techniky, řízení obrazem.Úvod
Zevní radioterapie je vedle radikální prostatektomie a intersticiální brachyterapie jednou ze základních metod léčby lokalizovaného karcinomu prostaty. Již v roce 1911 použil Pasteau intersticiální rádium k léčbě karcinomu prostaty a kurativní potenciál radioterapie byl doložen ve čtyřicátých letech 20. století (Barringer). Zevní radioterapie zaujala své postavení v léčbě karcinomu prostaty v 50.–70. letech minulého století díky zavádění megavoltážních přístrojů (kobaltový ozařovač, lineární urychlovač) do klinické praxe (Ray a Bagshaw, Stanfordská univerzita) (1). Megavoltážní ozařovače dokázaly dopravit vysokou dávku záření do hluboko uložených nádorů při přijatelném zatížení zdravých tkání. Radioterapie se tak transformovala z metody převážně paliativní v metodu s významným kurativním potenciálem.
U karcinomu prostaty je prokázána závislost mezi aplikovanou dávkou záření a pravděpodobností lokální kontroly. Hanks et al. (2) popsali u lokálně pokročilého onemocnění pravděpodobnost výskytu lokální recidivy 5 let po ozáření 37 % při dávce nižší než 60 Gy, 36 % při dávce 60–64,9 Gy, 29 % při dávce 65 až 69,9 Gy a konečně 19 % při dávce 70 Gy anebo vyšší. Limitem pro konvenční radioterapii je dávka přibližně 70 Gy; při jejím překročení neúměrně narůstá riziko závažné toxicity okolních orgánů (rektum, močový měchýř).
Trojrozměrná konformní radioterapie (3d-CRT )
Charakteristika
Trojrozměrná konformní radioterapie (threedimensional conformal radiation therapy 3D-CRT) je ozařovací technika, při které hranice cílového objemu odpovídají trojrozměrnému zobrazení objemu tumoru. Konformní radioterapie je spojena se zavedením počítačové tomografie (computed tomography CT) do klinické praxe v sedmdesátých letech 20. století a s vývojem algoritmů pro prostorovou kalkulaci dávky. Lékaři na Michiganské univerzitě (Lichter, Sandler, Ten-Haken) začali v roce 1987 jako první používat konformní radioterapii u pacientů s lokalizovaným karcinomem prostaty (3).
Plánování radioterapie na základě CT umožňuje konturovat cílový objem a rizikové orgány na jednotlivých axiálních řezech s následnou trojrozměrnou rekonstrukcí. Plánovací CT se provádí u pacienta v poloze, v jaké bude ozařován, včetně imobilizačních pomůcek. Při radioterapii prostaty se obvykle používá imobilizace dolních končetin, která omezuje pohyby pánve. CT řezy jsou přeneseny do plánovacího systému, je provedena objemová rekonstrukce a konturování cílového objemu a rizikových orgánů. Podle doporučení International Commission on Radiation Units and Measurements (ICRU) definujeme v radiační onkologii tři cílové objemy, které berou v úvahu mikroskopické šíření nádoru, pohyb orgánů a nepřesnost nastavení (obr. 1). Ke konturování prostaty je výhodné používat MRI, protože na T2 vážených skenech je její definice přesnější než na CT (především apex, báze a oblast nervově-cévních svazků). Plánovací systém umožňuje provést fúzi MRI s CT, kam se zakreslené kontury automaticky přenesou. Prostata se obvykle ozařuje technikou 3–6 koplanárních polí s klínovými filtry. Plánovací systém dokáže zobrazit cílový objem z pohledu svazku záření (beam‘s eye view BEV). Tvar jednotlivých svazků záření je upraven tak, aby kopíroval hranice cílového objemu v příslušné BEV projekci (obr. 2). Tvarování svazku fotonů lze provádět pomocí stínících bloků, ale dnes dáváme přednost vícelistovému kolimátoru (multileaf collimator MLC) (obr. 3). Ten sestává z desítek párových wolframových lamel, jejichž pohyb je ovládán motoricky. Prostorová kalkulace dávky probíhá v 3D plánovacím systému. Algoritmy pro výpočet dávkové distribuce zohledňují proměnlivou absorpci záření v závislosti na denzitě tkání (informace o denzitě tkání poskytuje plánovací CT). Výslednou distribuci dávky hodnotíme v CT řezech a zároveň pomocí dávkově-objemových histogramů (dose-volume histogram – DVH) (obr. 4). Na DVH lze odečíst, jakou dávku obdrží libovolně velká část (v % nebo absolutně v cm3) cílového objemu a rizikových orgánů. Ozařování probíhá na lineárním urychlovači s využitím fotonů o energii 6–18 MV (obr. 5).
Image 1. Cílové objemy v radioterapii Fig. 1 Target volumes for radiation therapy 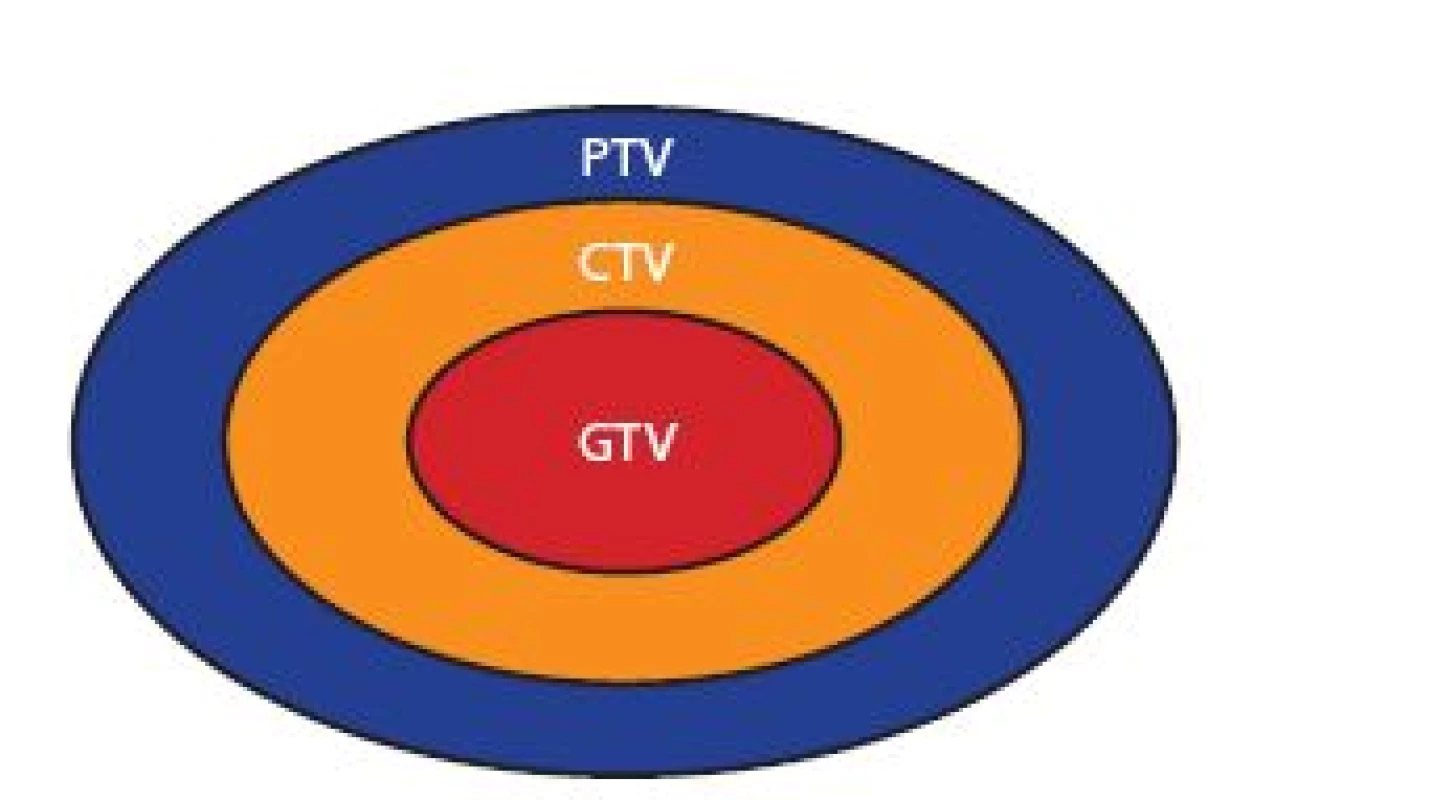
GTV – objem nádoru (gross tumor volume) – zobrazitelný makroskopický nádor; CTV – klinický cílový objem (clinical target volume) – lem kolem GTV zahrnující oblast subklinického mikroskopického šíření nádoru; PTV – plánovací cílový objem (planning target volume) – lem kolem CTV zahrnující nepřesnost způsobenou fyziologickými pohyby orgánů a nastavením pacienta při ozařování GTV gross tumor volume – viewable macroscopic tumor; CTV clinical target volume – margin around GTV covering area of subclinical microscopic tumor spread; PTV planning target volume – margin around CTV covering errors due to physiological organ movement and setup inaccuracy Image 2. Cílový objem a rizikové orgány v BEV projekci Fig. 2 Target volume and organs at risk in the BEV projection 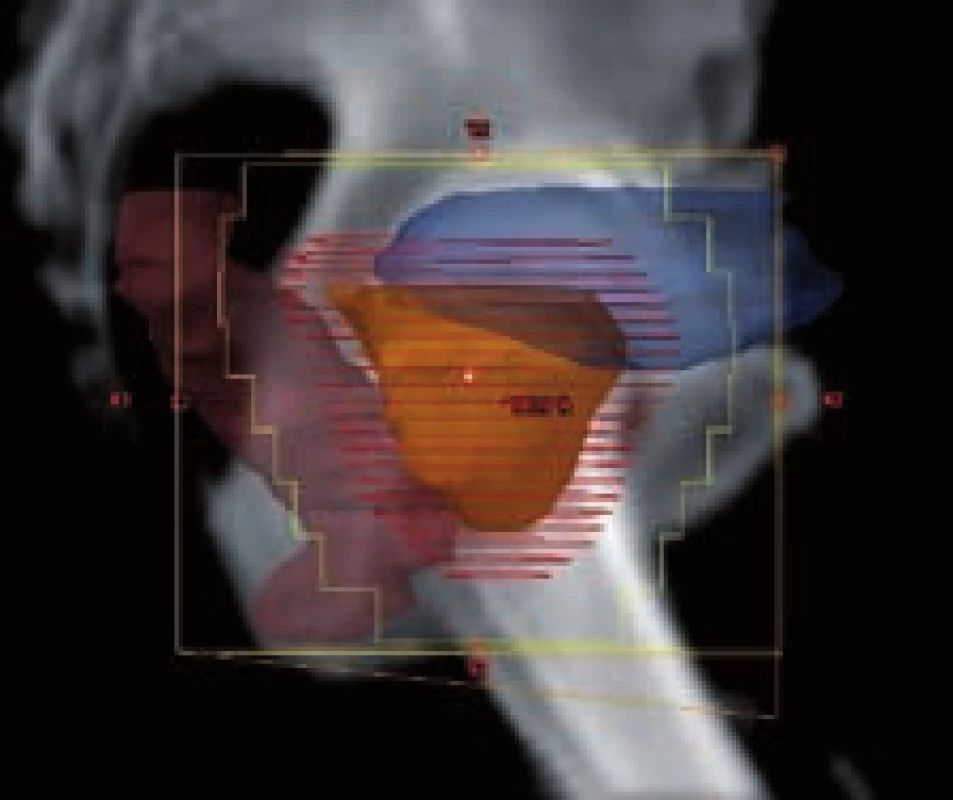
BEV – projekce svazku záření (beam’s eye view) BEV – beam’s eye view Image 3. Vícelistový kolimátor (multileaf collimator – MLC) Fig. 3 Multileaf collimator (MLC) 
Image 4. Dávkově-objemový histogram (dose-volume histogram – DVH) Fig. 4 Dose-volume histogram (DVH) 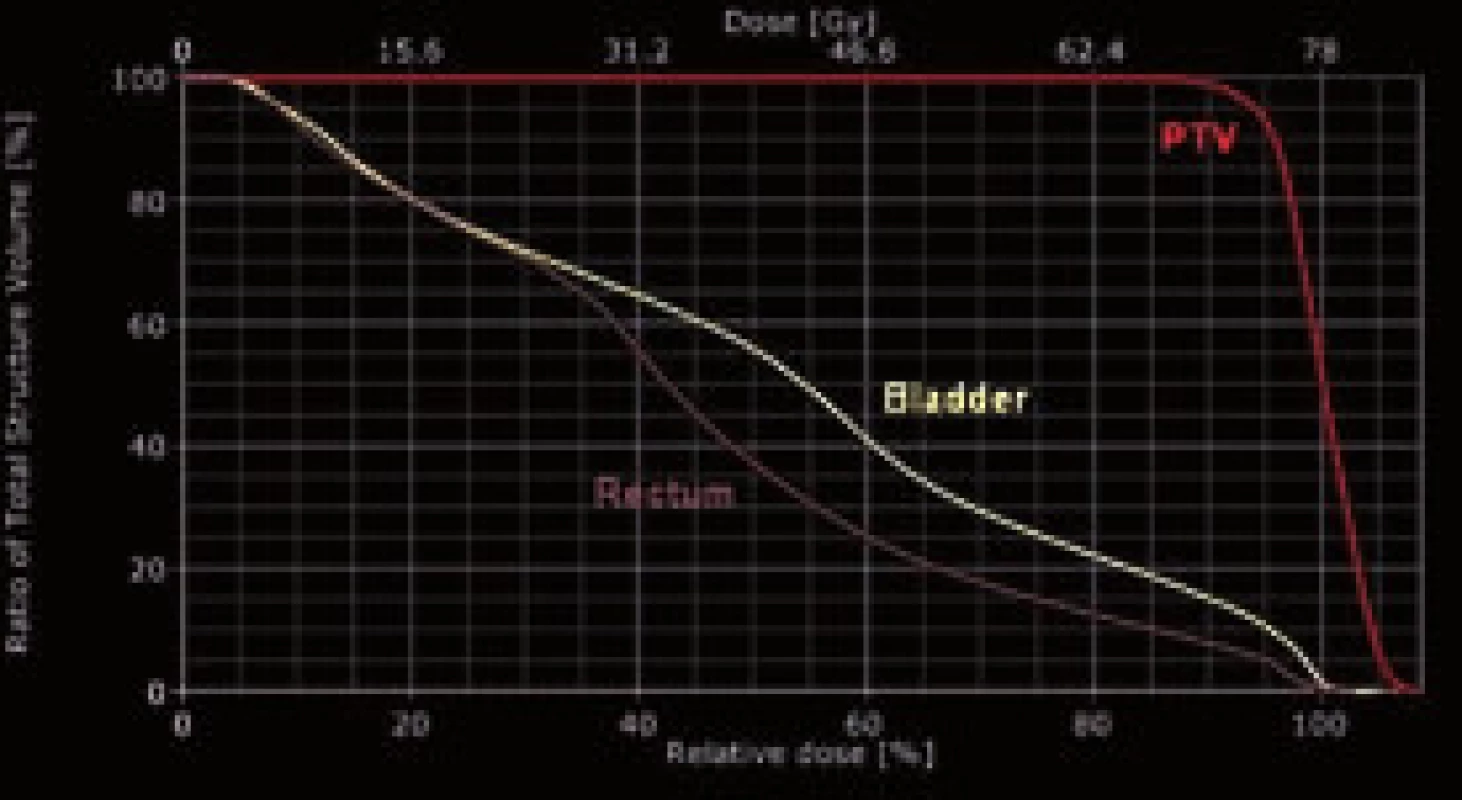
PTV – plánovací cílový objem (planning target volume) PTV – planning target volume Image 5. Lineární urychlovač Fig. 5 Linear accelerator 
Výhody
Oproti konvenční radioterapii přináší 3D - -CRT lepší dávkovou distribuci, která odpovídá tvaru cílového objemu v prostoru. V důsledku toho je zajištěno adekvátní ozáření definovaného nádorového ložiska a současně je redukována dávka na okolní zdravé tkáně.
Radioterapie s modulovanou intenzitou (imrt)
Charakteristika
Radioterapie s modulovanou intenzitou (intensity - modulated radiation therapy – IMRT) je pokročilou formou konformní radioterapie. Na rozdíl od 3D-CRT využívá IMRT nejenom tvarování svazku záření, ale navíc zde dochází k modulaci průtoku záření napříč svazkem. Metoda IMRT je spojena s novým způsobem plánování radioterapie, tzv. inverzním plánováním, které navrhl Brahme v roce 1988 (4). Lékaři z Memorial Sloan-Kettering Cancer Center v New Yorku (Ling, Burman, Chui) jako první referovali v roce 1996 o použití IMRT u karcinomu prostaty (5).
Modulaci intenzity lze demonstrovat tak, že si průřez svazkem záření představíme jako šachovnici, přičemž jednotlivá pole odpovídají tužkovým svazkům, jejichž intenzita není uniformní (obr. 6). Existuje řada způsobů jak ovlivnit intenzitu svazku záření. Současné IMRT systémy využívají především vícelistového kolimátoru. Dynamický vícelistový kolimátor (DMLC) funguje tak, že během ozařování se napříč svazkem pohybuje několik desítek párů lamel (technika sliding-window). Pohyb jednotlivých lamel v každém páru je navzájem nezávislý a rychlost pohybu je proměnlivá a programovatelná. Tak je možné jednotlivé segmenty svazku ozařovat různě dlouhou dobu. Mimoto se v průběhu ozařování může měnit dávkový příkon lineárního urychlovače, což má význam v místech velkého gradientu dávky.
Image 6. Modulace intenzity Fig. 6 Intensity modulation 
Průřez svazkem záření (pole 180°) – jednotlivé barevné izodozové křivky vymezují čtvercové oblasti odpovídající tužkovým svazků se stejnou intenzitou Cross section of the radiation beam (field 180°) – particular colour isodose lines enclose square areas corresponding to pencil beams with identical intensity Plánování 3D-CRT, jak bylo popsáno v předchozí kapitole, představuje u karcinomu prostaty proces do značné míry standardizovaný (uspořádání ozařovacích polí, energie svazku). Možnosti optimalizace ozařovacího plánu jsou omezené a jsou limitovány především topografií orgánů pánve u konkrétního pacienta. Proces optimalizace je intuitivní a významně se v něm uplatňuje zkušenost lékaře a fyzika. Požadavky na rozložení dávky v cílovém objemu a rizikových orgánech nelze zadat předem, můžeme je hodnotit a částečně ovlivnit až v závěru procesu plánování. Naproti tomu inverzní plánování, využívané pro IMRT, vychází z diametrálně odlišné koncepce. V úvodu plánování zadáváme požadavky na rozložení dávky v oblasti prostaty, rekta a močového měchýře. Můžeme definovat maximální i minimální dávky a rovněž dávky v určitém procentu objemu. Navíc lze ke každému z dávkových parametrů přiřadit číselný faktor důležitosti. Plánovací systém potom provede výpočet rozložení dávky. Postupuje v opakujících se krocích, kdy mění intenzitu jednotlivých svazků záření tak, aby se ve všech bodech příslušného objemu dávka vypočítaná co nejvíce blížila dávce požadované. Posouzení ozařovacího plánu se provádí na CT řezech a pomocí DVH jako u 3D-CRT. Možnosti optimalizace plánu jsou oproti konvenčnímu plánování nesrovnatelně větší, ovšem proces je méně intuitivní a zkušenost lékaře/fyzika hraje opět významnou roli.
Výhody
Díky ovlivnění intenzity svazku dosahuje IMRT ještě lepšího rozložení dávky v prostoru, než je tomu u 3D-CRT. Rozdíl mezi oběma metodami je patrný především u nádorových objemů konkávního tvaru, kdy je rizikový zdravý orgán uložen v konkavitě cílového objemu. Právě prostata představuje orgán, jehož tvar bývá dorzálně konkávní (sulkus, semenné váčky) a do prostoru této konkavity zasahuje rektum. IMRT dokáže nabídnout takovou dávkovou distribuci, kdy oblast vysoké dávky doslova kopíruje tvar cílového objemu včetně konkavit a šetří tak rektum (obr. 7).
Image 7. Izodozový plán – radioterapie s modulovanou intenzitou (IMRT) Fig. 7 Isodose plan – intensity-modulated radiation therapy (IMRT) 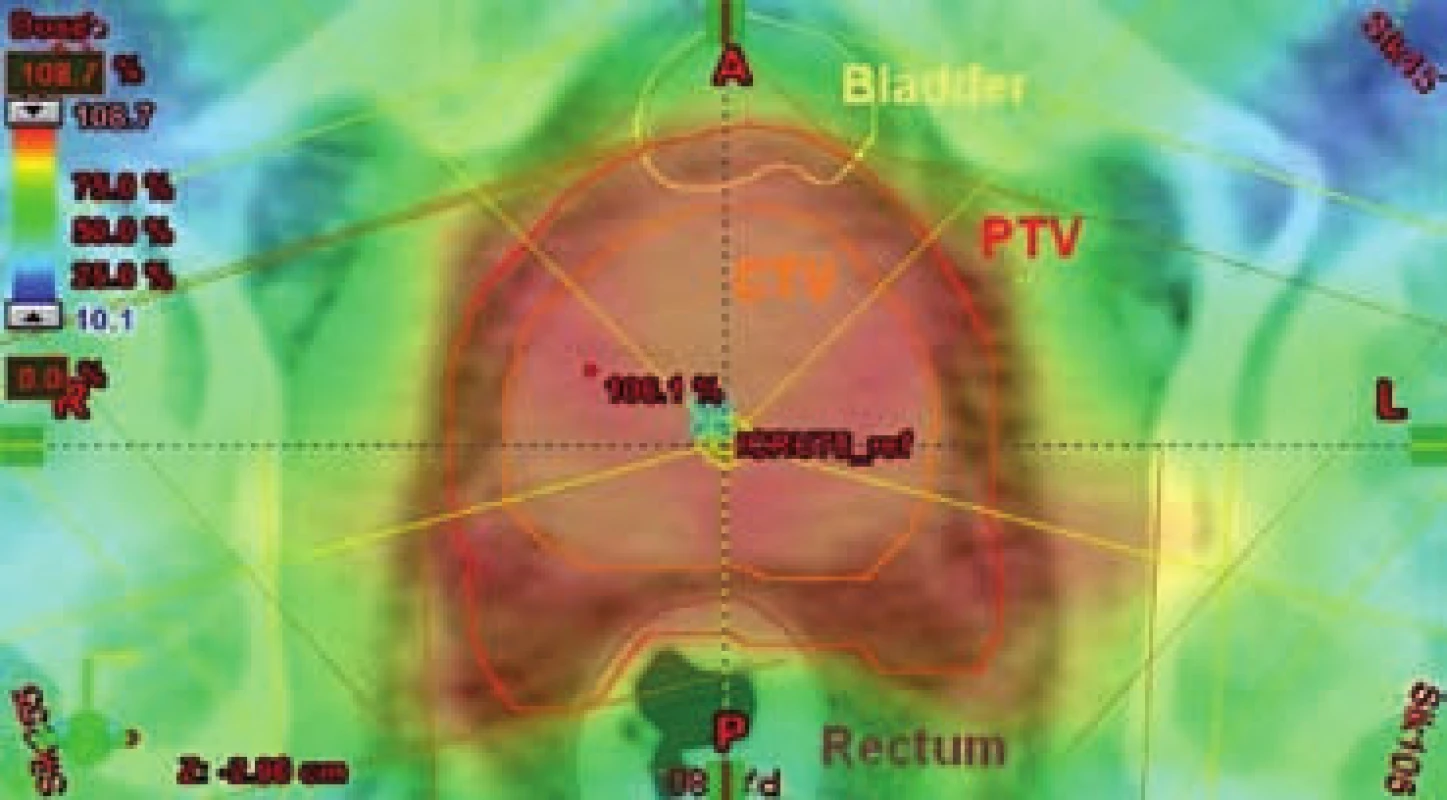
CTV – klinický cílový objem (clinical target volume); PTV – plánovací cílový objem (planning target volume) CTV – clinical target volume; PTV – planning target volume Radioterapie řízená obrazem (igrt)
Charakteristika
Radioterapie řízená obrazem (image-guided radiation therapy – IGRT) je v obecném slova smyslu jakákoliv ozařovací technika využívající ověřování pozice pacienta před a/nebo během ozařování. IGRT v současném pojetí znamená systematickou verifikaci pozice pacienta před a/nebo během každé frakce radioterapie spojenou s korekcí nepřesnosti nastavení. Historie kontroly polohy pacienta a stanovení nepřesnosti nastavení začíná v osmdesátých letech 20. století, kdy Verhey et al. testovali různé imobilizační pomůcky, prováděli RTG snímky před a po ozáření a měřili odchylky, které nastaly během ozáření (6). Ověřování pozice pacienta v moderním pojetí, pomocí portálových snímků s korekcí nepřesnosti nastavení, se objevuje poprvé v devedesátých letech (7). V současnosti je k dispozici celá řada IGRT metod – podrobněji se zmiňujeme o těch, které jsou v klinické praxi u karcinomu prostaty využívány nejvíce.
Portálové snímkování (electronic portal imaging device – EPID) pracuje s křemíkovým detektorem fixovaným na gantry urychlovače. Po nastavení pacienta se zhotoví snímky ze dvou úhlů, např. 0° (AP) a 90° (LAT), aby bylo možné provést rekonstrukci pozice v prostoru. Potom se aktuální obraz na portálových snímcích porovná s obrazem referenčním z plánovacího systému. Referenční obraz představuje tzv. digitálně rekonstruovaný rentgenový snímek (digitally reconstructed radiograph – DRR), který je v plánovacím systému generován z CT řezů. Porovnání aktuálního a referenčního obrazu může být automatické či manuální a rozdíl v pozici je číselně vyjádřen v osách antero-posteriorní (AP), kraniokaudální (SI) a latero-laterální (RL). Zjištěná odchylka pozice pacienta je korigována automatickým posunem ozařovacího stolu v příslušných osách (AP posun vertikální nahoru/ dolů, SI posun horizontální k hlavě/k nohám, RL posun horizontální doprava/doleva). Portálové snímkování umožňuje porovnávat skelet a implantované markery (zrna Au).
Zařízení pro kilovoltážní (kV) zobrazení tvoří dvě výsuvná protilehlá ramena na gantry urychlovače (obr. 8). Jedno rameno nese diagnostickou rentgenku a druhé detektor s amorfním křemíkem. Funkce je obdobná jako u portálového zobrazení, ale kvalita snímků je vyšší a lze ji přirovnat ke snímkům diagnostickým. Zobrazení kV umožňuje porovnávat skelet a implantované markery (obr. 9).
Image 8. Lineární urychlovač se zobrazovacím systémem – radioterapie řízená obrazem (IGRT) Fig. 8 Linear accelerator equipped with imaging device – image-guided radiation therapy (IGRT) 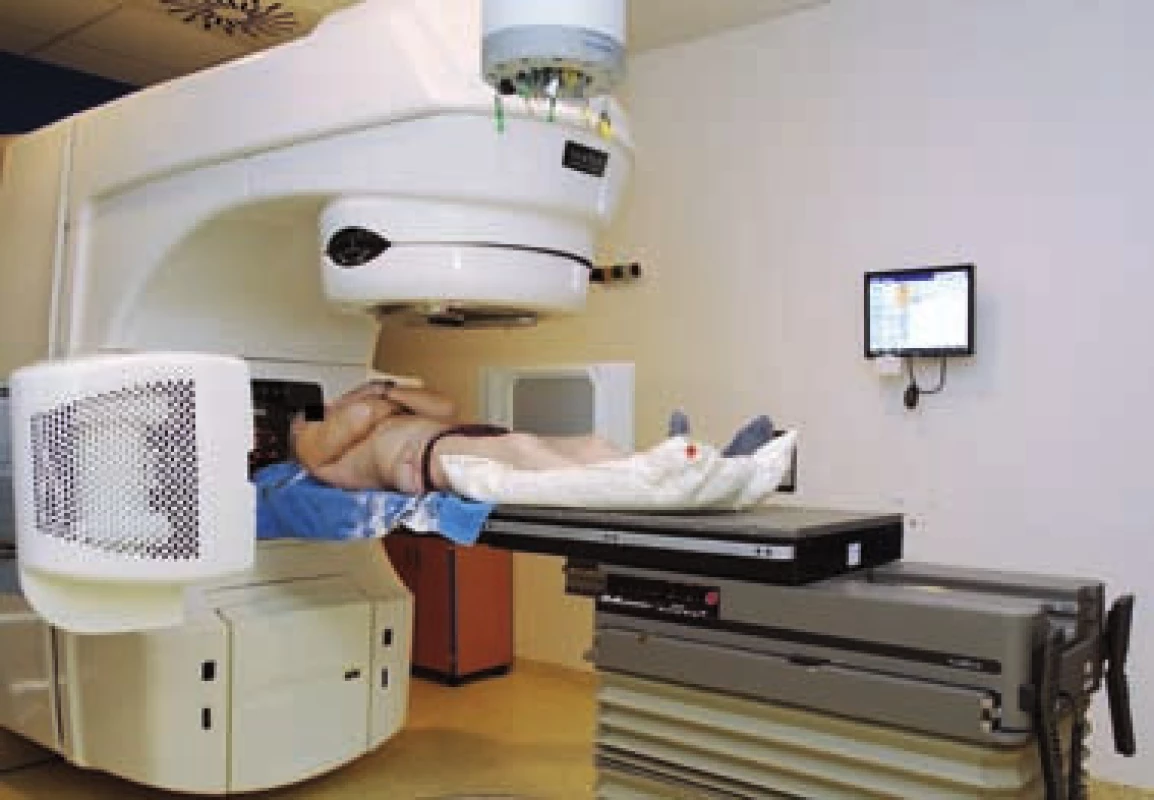
Image 9. kV zobrazení v AP projekci – radioterapie řízená obrazem (IGRT) Fig. 9 kV imaging in AP projection – image-guided radiation therapy (IGRT) 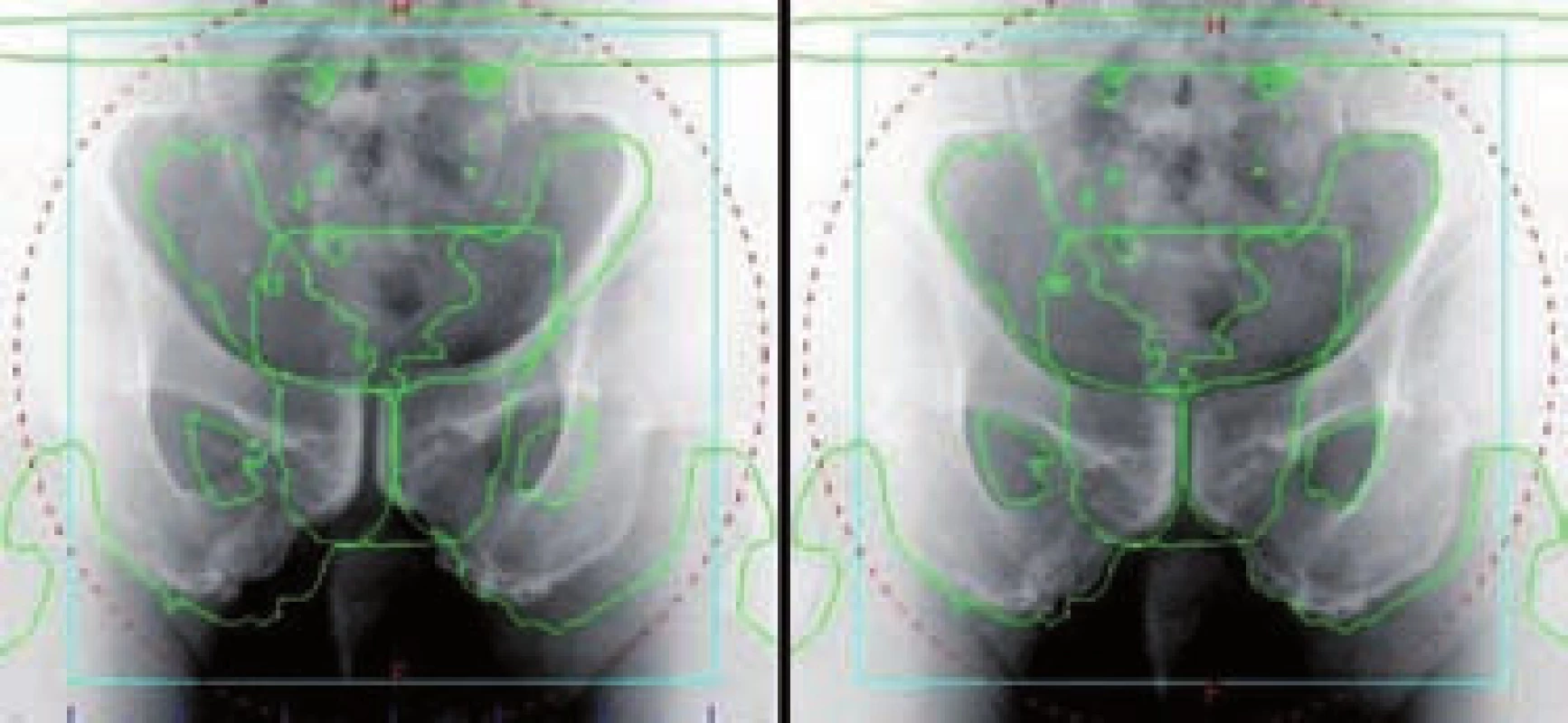
kV obraz odpovídá aktuální pozici pacienta, zelené linie odpovídají referenční pozici skeletu pánve; vlevo – pozice před korekcí, vpravo – pozice po korekci kV image corresponds to current patient position, green lines correspond to reference position of pelvic skeleton; left – position before correction, right – position after correction Kilovoltážní CT kuželovitým svazkem, kV cone-beam CT (kV CBCT) vychází ze stejného technického zařízení jako kilovoltážní zobrazení. Během rotace gantry probíhá sériové snímkování v pravidelných intervalech (např. jeden snímek na jeden stupeň rotace). Proces akvizice snímků trvá řádově desítky sekund a na závěr je z několika stovek získaných projekcí rekonstruován CT obraz. Kvalita obrazu CBCT je nižší než u diagnostického CT, nicméně dostatečně vysoká pro bezpečnou identifikaci orgánů. Výhodou CBCT oproti kV zobrazení je vizualizace měkkých tkání – prostaty, rekta, močového měchýře. Při porovnávání aktuálních CBCT řezů s referenčními CT řezy provádíme manuální registraci prostaty na prostatu (obr. 10). Korekce nepřesnosti nastavení se opět uskutečňuje automatickým posunem stolu.
Image 10. kV cone-beam CT (CBCT) – radioterapie řízená obrazem (IGRT) Fig. 10 kV cone-beam CT (CBCT) – image-guided radiation therapy (IGRT) 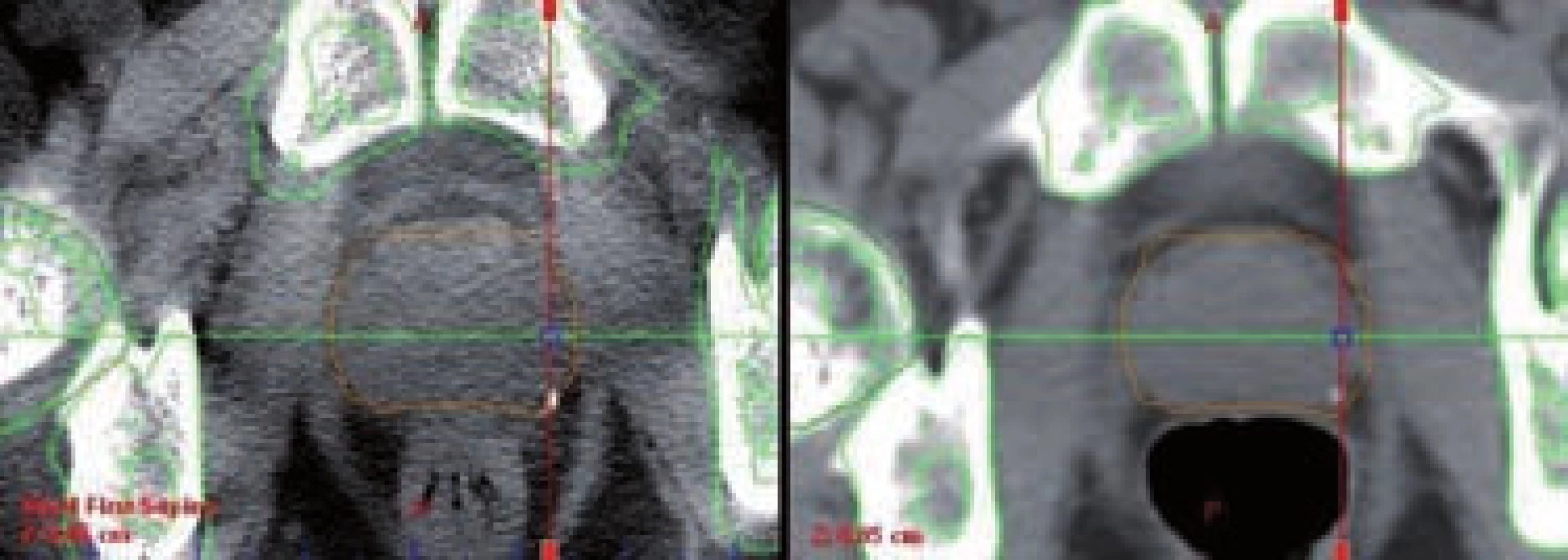
vlevo – CBCT obraz po korekci pozice prostaty, vpravo – referenční obraz z plánovacího CT (patrný je posun prostaty vlivem náplně rekta – roztažené rektum na plánovacím CT posouvá prostatu ventrálně, zatímco při prázdném rektu na CBCT je prostata více dorzálně, a tudíž pozice skeletu na CBCT neodpovídá zeleným referenčním konturám) left – CBCT image after correction of prostate position, right – reference image from planning CT (note the prostate shift due to rectal filling – expanded rectum on planning CT moves prostate ventrally while collapsed rectum enables prostate to be located more dorsally, consequently skeleton position on CBCT does not correspond to green reference contours) Kromě výše popsaných metod se můžeme méně často setkat i s dalšími formami IGRT karcinomu prostaty – UZ zobrazení (B-mode acquisition and targeting – BAT), megavoltážní cone-beam CT (MV CBCT), mikročipy s radiofrekvenční komunikací.
Výhody
IGRT není sama o sobě novou ozařovací technikou, ale metodou ke zvýšení kvality stávajících moderních technik radioterapie, tj. 3D-CRT a IMRT. IGRT zvyšuje spolehlivost a bezpečnost léčby a zajišťuje její kvalitu na vyšší úrovni – to je primární přínos metody. Sekundární přínos IGRT spočívá v tom, že pokud ozařujeme přesněji, můžeme redukovat bezpečnostní lem kolem prostaty – lem mezi klinickým a plánovacím cílovým objemem. Velikost tohoto lemu je obvykle 10 mm ve všech osách; směrem dorzálním může být menší (8–10 mm) kvůli šetření rekta. V závislosti na použité formě IGRT lze lem redukovat přibližně na 4–10 mm. Menší lem nelze doporučit, neboť současné metody IGRT neumožňují korigovat intrafrakční pohyb prostaty a mimoto je třeba zohlednit méně významné zdroje nepřesností v procesu plánování a provedení radioterapie. V důsledku redukce bezpečnostního lemu je ozařován menší cílový objem a dochází k šetření rekta a močového měchýře.
Výsledky 3D-CRT , IMRT a IGRT
Redukce toxicity
Pokročilé techniky radioterapie (3D-CRT, IMRT) vykazují ve srovnání s konvenční radioterapií nižší riziko chronické toxicity. Nejlépe tuto skutečnost dokládají dlouhodobé výsledky studií s eskalací dávky, které přinesly důkazy o tom, že aplikace suprakonvenčních dávek v rozmezí 75–80 Gy je provázena přijatelnou toxicitou. Michalski et al. analyzovali dlouhodobé výsledky studie Radiation Therapy Oncology Group (RTOG) 9406, která zahrnovala 1055 pacientů léčených 3D-CRT pro karcinom prostaty (8). Pacienti do studie vstupovali na postupně se zvyšujících úrovních dávky záření v rozmezí 68,4–79,2 Gy (1,8 Gy na frakci), respektive 74 Gy a 78 Gy (2 Gy na frakci). Kumulativní incidence gastrointestinální (GI) a genitourinární (GU) toxicity 2. a vyššího stupně byla pro všechny pacienty 7–26 %, resp. 18–29 %. Zelefski et al. prezentovali výsledky 3D-CRT a IMRT u 1571 pacientů s karcinomem prostaty s mediánem sledování 10 let (9). Incidence závažné chronické GI a GU toxicity 3. stupně byla 1 %, resp. 3 %. Autoři současně prokázali významně nižší riziko chronické GI toxicity při použití IMRT ve srovnání s 3D-CRT. Příznivý profil toxicity moderních metod radioterapie dokumentují výsledky randomizovaných studií s eskalací dávky (tab. 1).
Table 1. Randomizované studie s eskalací dávky Table 1 Randomized trials with dose escalation 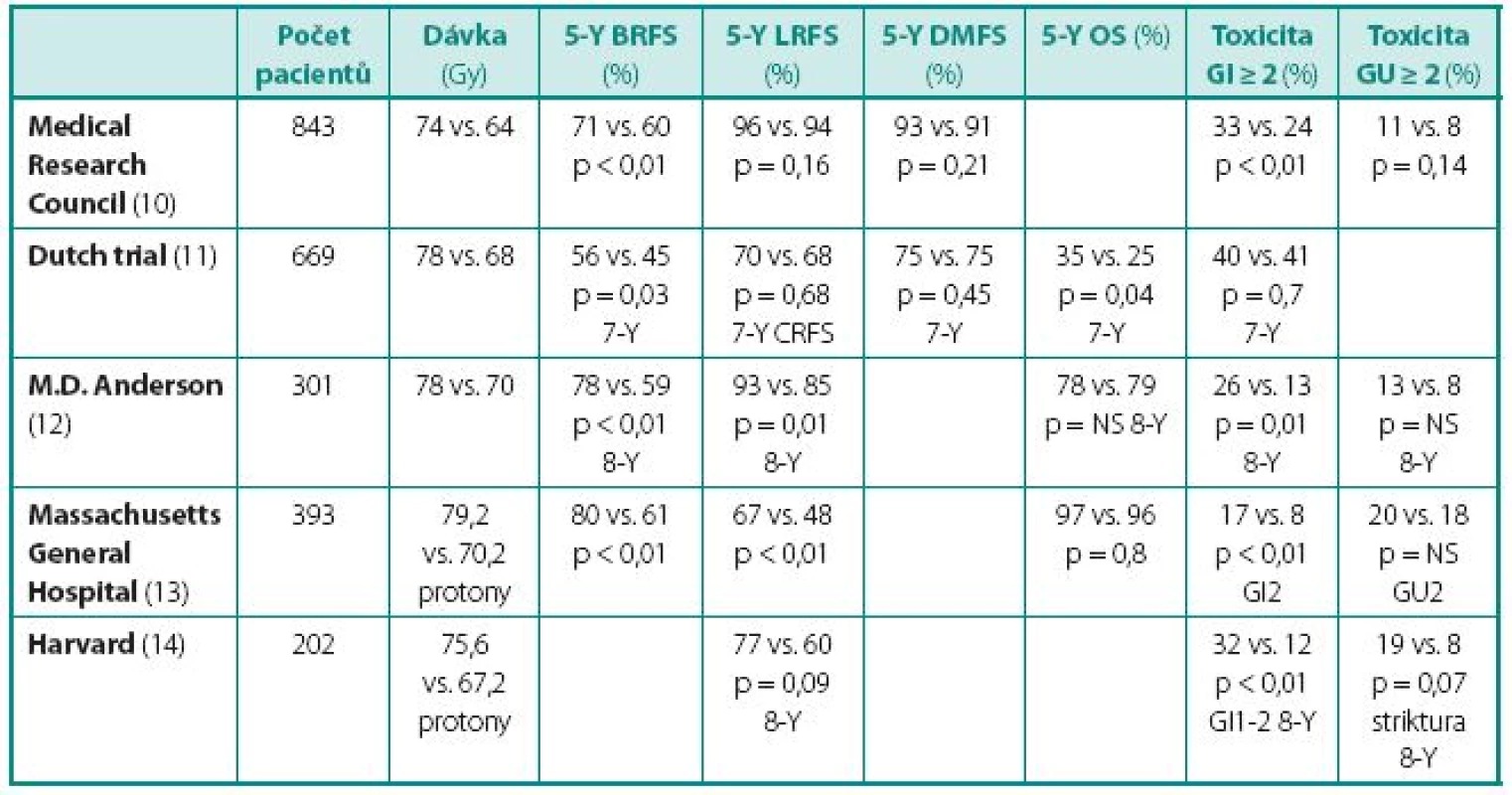
BRFS – přežití bez biochemického relapsu; LRFS – přežití bez lokální recidivy; DMFS – přežití bez distančních metastáz; CRFS – přežití bez klinického relapsu; GI – gastrointestinální; GU – genitourinární; OS – celkové přežití BRFS – biochemical relapse-free survival; LRFS – local relapse-free survival; DMFS – distant metastases-free survival; CRFS – clinical relapse-free survival; GI – gastrointestinal; GU – genitourinary; OS – overall survival Potenciál IGRT v další redukci morbidity je nesporný, předběžná data o akutní toxicitě jsou povzbuzující, ovšem dlouhodobé výsledky nejsou zatím k dispozici.
Eskalace dávky záření
Existují přesvědčivé důkazy o tom, že eskalace dávky záření zlepšuje výsledky léčby lokalizovaného karcinomu prostaty. Rozsáhlá retrospektivní analýza z Memorial Sloan-Kettering Cancer Center ukázala, že vyšší dávky záření významně snížily riziko PSA relapsu a riziko rozvoje distančních metastáz (15). Signifikantní vliv eskalace dávky na přežití bez biochemického relapsu a na lokální kontrolu prokázalo několik randomizovaných studií (tab. 1). Benefit vyšší dávky záření je patrný u všech kategorií rizika, nicméně nejvíce je vyznačen u pacientů se středním a vysokým rizikem. Eskalace dávky je natolik efektivní, že v posledních letech pevně zakotvila v mezinárodních doporučeních pro léčbu karcinomu prostaty (tab. 2).
Table 2. Indikace zevní radioterapie v kurativní léčbě karcinomu prostaty Table 2 Indications of external-beam radiation therapy in curative treatment of prostate cancer 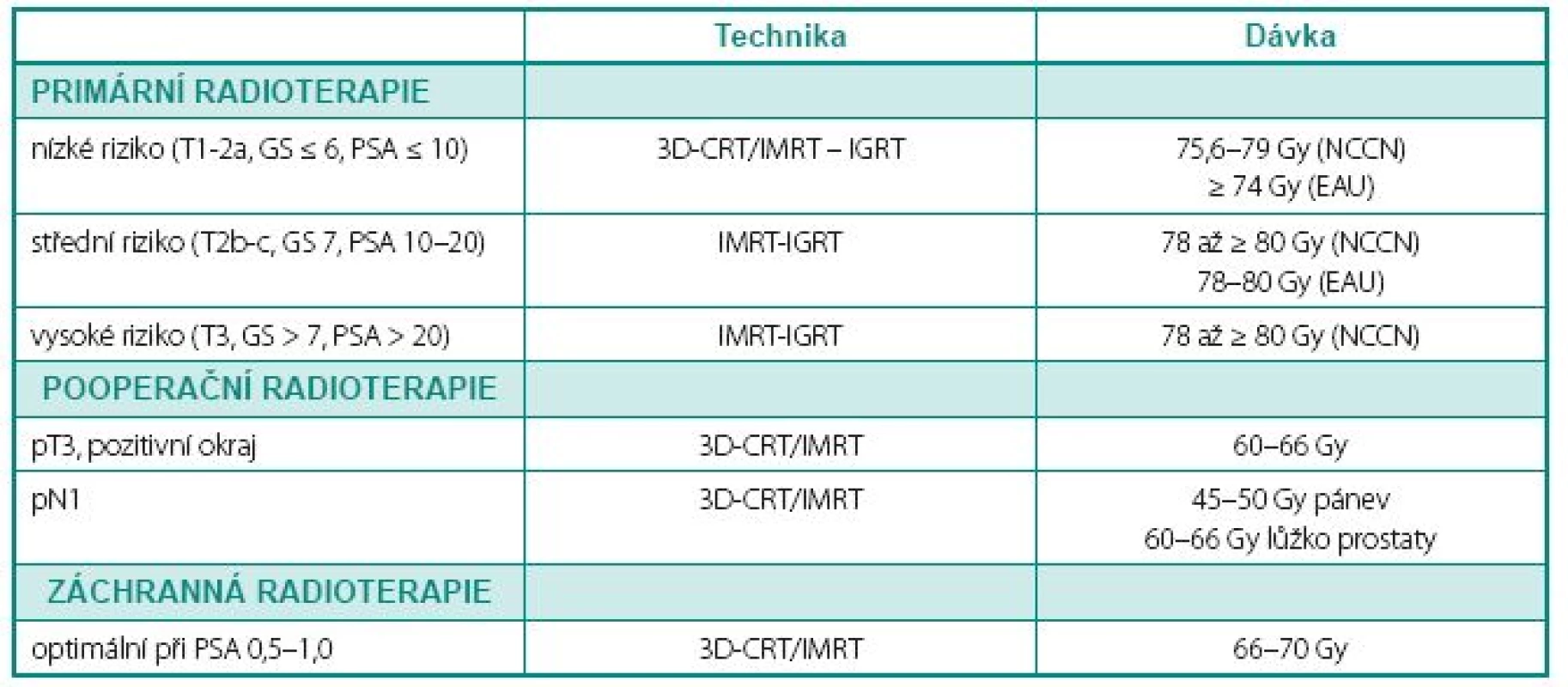
Adaptováno podle doporučení EAU European Association of Urology (www.uroweb.org) – verze březen 2009, NCCN National Comprehensive Cancer Network (www.nccn.org) – verze 1/2010 a NCI National Cancer Institute (www.nci.nih.gov) – verze 11/2009. Denní korekce pozice pacienta (IGRT ) je doporučena při aplikaci dávky ≥ 75 Gy. 3D-CRT – trojrozměrná konformní radioterapie; IMRT – radioterapie s modulovanou intenzitou; IGRT – radioterapie řízená obrazem Adapted according to recommendations of EAU European Association of Urology (www.uroweb.org) – version March 2009, NCCN National Comprehensive Cancer Network (www.nccn.org) – version 1/2010 and NCI National Cancer Institute (www. nci.nih.gov) – version 11/2009 Daily correction of patient’s position (IGRT ) is recommended for doses ≥ 75 Gy. 3D-CRT – three-dimensional conformal radiation therapy; IMRT – intensity-modulated radiation therapy; IGRT – image-guided radiation therapy Další perspektivní technologie a metody
Nové technologie
Významný pokrok přinášejí do plánování radioterapie moderní zobrazovací metody. Při konturování prostaty standardně využíváme výhod MRI zobrazení (viz kapitola 3D-CRT). Jako perspektivní pro definování intraprostatické léze se jeví MR spektroskopie, MR s dynamickým kontrastem nebo difuzně vážená MR, kde bylo referováno o senzitivitě a specificitě vyšší než 80% (16). Pozitronová emisní tomografie (PET) s 18F-fluorodeoxyglukózou není u karcinomu prostaty optimální metodou pro detekci primárního tumoru. Zdá se, že PET využívající jiných izotopů (např. 18F-fluorocholin nebo 11C-cholin) přinese lepší výsledky.
IMRT lze provádět nejenom ze statických polí, ale rovněž ve formě pohybové terapie.
Tomoterapie reprezentuje metodu, při níž urychlovač rotuje kolem pacienta a k modulaci štěrbinovitého svazku pomocí MLC dochází za pohybu v pravidelných intervalech (např. každých 5° rotace) (17). Helikální tomoterapie (Hi-Art, TomoTherapy) kombinuje rotaci gantry s plynulým podélným posunem stolu. Moderní přístroje pro tomoterapii integrují v jednom gantry lineární urychlovač a megavoltážní CT pro zobrazení a korekci pozice pacienta před ozářením.
Volumetrická rotační IMRT (volumetric intensity-modulated arc therapy, volumetric-modulated arc therapy; RapidArc, Varian; VMAT, Elekta) je technika, kde průtok fotonů ovlivňují tři proměnlivé faktory – pohyb lamel MLC, rychlost rotace gantry a dávkový příkon urychlovače. Předností metody je krátký ozařovací čas při srovnatelné/lepší dávkové distribuci v porovnání se statickými IMRT technikami.
Robotická radioterapie/radiochirurgie (CyberKnife, Accuray) využívá kombinace malého lineárního urychlovače 6 MV a robotického manipulátoru. Díky tomu není pozice svazku prostorově omezená. Ozařování úzkým svazkem probíhá z mnoha (desítky až stovky) směrů a jednotlivé „pulzy“ trvají relativně krátkou dobu (sekundy až desítky sekund). Zařízení je doplněno kV zobrazovacím systémem, který ověřuje správnost zaměření při každé změně pozice urychlovače a nastavení automaticky koriguje podle shody skeletu či implantovaných markerů.
Protonová terapie (Proteus Nano, IBA) se v posledních letech dostává do popředí zájmu. Důvodem jsou optimální fyzikální charakteristiky protonů. Při průchodu hmotou deponují protony většinu energie až na konci své dráhy, kde vytvářejí tzv. Braggův peak. Za tímto maximem dochází k prudkému poklesu dávky, což přináší významné šetření zdravých tkání za nádorovým ložiskem. Aktivní skenování umožňuje omezit oblast vysoké dávky přesně na tumor. Protonová terapie je navíc spojena s nízkou integrální dávkou, a proto je očekávané riziko sekundárních malignit nižší než u fotonové terapie. Protonová terapie s modulovanou intenzitou (intensity-modulated proton therapy – IMPT) nabízí stejné pokrytí cílového objemu a nižší zatížení zdravých tkání v porovnání s fotonovou IMRT technikou (18).
Nové metody
Nové zobrazovací metody a IGRT přispěly k rozvoji adaptivní radioterapie, kterou charakterizuje změna ozařovacího plánu v průběhu léčby (19). Plánování radioterapie se tak transformuje z procesu statického v proces dynamický. Offline adaptivní radioterapie spočívá v tom, že v první fázi léčby – během úvodních frakcí radioterapie – jsou zaznamenávány informace o nepřesnosti nastavení, popřípadě o objemu a pozici cílového objemu a rizikových orgánů. Následně je vypracován nový ozařovací plán pro druhou fázi léčby, který je přizpůsoben topografii a mobilitě aktuálního pacienta. Tento plán může například korigovat systematickou komponentu chyby nastavení, zohlednit náhodnou komponentu chyby nastavení či zohlednit průměrnou pozici a objem rizikových orgánů. Online adaptivní strategie představuje tvorbu nového ozařovacího plánu na základě aktuálních volumetrických dat pro každou frakci radioterapie.
Pokud dokážeme v prostatě spolehlivě zobrazit primární tumor, můžeme uvažovat o navýšení dávky záření cíleně na intraprostatickou lézi. Pomocí IMRT lze velmi dobře modelovat dávkovou distribuci a toho lze využít pro tzv. simultánní integrovaný boost (SIB). Metoda spočívá v tom, že celou prostatu ozáříme určitou dávkou (např. 78 Gy) a současně na intraprostatickou lézi aplikujeme dávku vyšší (např. 82 Gy) (20).
Radiobiologické modely naznačují, že karcinom prostaty vykazuje vyšší citlivost na vyšší dávku na frakci. Proto by hypofrakcionace – aplikace dávky na frakci vyšší než 2 Gy při nižší celkové nominální dávce – mohla mít lepší efekt než konvenční frakcionace (1,8–2 Gy na frakci). Problémem je, že vyšší dávka na frakci znamená pro zdravé tkáně vyšší riziko chronické toxicity. V klinické praxi je proto třeba vyčkat dlouhodobých výsledků randomizovaných studií.
Závěr
Moderní metody zevní radioterapie představují účinnou a bezpečnou modalitu léčby lokalizovaného karcinomu prostaty. Onkologická pracoviště by měla plně využívat IGRT technologii a periodicky hodnotit vlastní výsledky. Úzká a kontinuální spolupráce onkologů s urology je nutností.
Došlo: 17. 1. 2010.
Přijato: 28. 1. 2010
Kontaktní adresa
doc. MUDr. Karel Odrážka, Ph.D.
Oddělení radiační onkologie Multiscan & Pardubická krajská nemocnice
Kyjevská 44,
532 03 Pardubice
e-mail: odrazka@seznam.cz
Sources
1. Ray GR, Cassady JR, Bagshaw MA. Definitive radiation therapy of carcinoma of the prostate. A report on 15 years experience. Radiology 1973; 106 : 407–418.
2. Hanks GE, Martz KL, Diamond JJ. The effect of dose on local control of prostate cancer. Int J Radiat Oncol Biol Phys 1988; 15 : 1299–1305.
3. Sandler HM. 3-D conformal radiotherapy for prostate cancer. The University of Michigan Experience. In: Meyer JL, Purdy JA. (eds.) 3-D conformal radiotherapy. A new era in the irradiation of cancer. Basel: S. Karger 1996; 238–243.
4. Brahme A. Optimization of stationary and moving beam radiation therapy techniques. Radiother Oncol 1988; 12 : 129–140.
5. Ling CC, Burman C, Chui CS, et al. Conformal radiation treatment of prostate cancer using inversely-planned intensity-modulated photon beams produced with dynamic multileaf collimation. Int J Radiat Oncol Biol Phys 1996; 35 : 721–730.
6. Verhey LJ, Goitein M, McNulty P, Munzenrider JE, Suit HD. Precise positioning of patients for radiation therapy. Int J Radiat Oncol Biol Phys 1982; 8 : 289–294.
7. De Neve W, Van den Heuvel F, De Beukeleer M, et al. Routine clinical on-line portal imaging followed by immediate field adjustment using a tele-controlled patient couch. Radiother Oncol 1992; 24 : 45–54.
8. Michalski JM, Bae K, Roach M et al. Long-term toxicity following 3D conformal radiation therapy for prostate cancer from the RTOG 9406 phase I/II dose escalation study. Int J Radiat Oncol Biol Phys 2010; 76 : 14–22.
9. Zelefski MJ, Levin EJ, Hunt M, et al. Incidence of late rectal and urinary toxicities after three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70 : 1124–1129.
10. Dearnaley DP, Sydes MR, Graham JD, et al. Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007; 8 : 475–487.
11. Al-Mamgani A, van Putten WL, Heemsbergen WD, et al. Update of Dutch multicenter dose-escalation trial of radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72 : 980–988.
12. Kuban DA, Tucker SL, Dong L, et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70 : 67–74.
13. Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA 2005; 294 : 1233–1239.
14. Shipley WU, Verhey LJ, Munzenrider JE, et al. Advanced prostate cancer: the results of a randomized comparative trial of high dose irradiation boosting with conformal protons compared with conventional dose irradiation using photons alone. Int J Radiat Oncol Biol Phys 1995; 32 : 3–12.
15. Zelefski MJ, Yamada Y, Fuks Z, et al. Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases-free survival outcomes. Int J Radiat Oncol Biol Phys 2008; 71 : 1028–1033.
16. de la Rosette JJ, Mouraviev V, Polascik TJ. Focal targeted therapy will be a future treatment modality for early stage prostate cancer. Eur Urol Suppl 2009; 8 : 424–432.
17. Mackie TR, Holmes T, Swerdloff S, et al. Tomotherapy: a new concept for the delivery of dynamic conformal radiotherapy. Med Phys 1993; 20 : 1709–1719.
18. Weber DC, Wang H, Cozzi L, et al. RapidArc, intensity modulated photon and proton techniques for recurrent prostate cancer in previously irradiated patients: a treatment planning comparison study. Radiat Oncol 2009; 4 : 34.
19. Yan D, Wong J, Vicini F, et al. Adaptive modification of treatment planning to minimize the deleterious effects of treatment setup errors. Int J Radiat Oncol Biol Phys 1997; 38 : 197–206.
20. Fonteyne V, Villeirs G, Speleers B, et al. Intensity-modulated radiotherapy as primary therapy for prostate cancer: report on acute toxicity after dose escalation with simultaneous integrated boost to intraprostatic lesion. Int J Radiat Oncol Biol Phys 2008; 72 : 799–807.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2010 Issue 2-
All articles in this issue
- Fyzikální základy extrakorporální litotrypse
- Moderní metody zevní radioterapie v léčbě karcinomu prostaty
- Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
- Význam stanovení survivinu v moči pro neinvazivní diagnostiku uroteliálních karcinomů močového měchýře
- Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti
- Méně časté příčiny dysurie u žen
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Méně časté příčiny dysurie u žen
- Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti
- Moderní metody zevní radioterapie v léčbě karcinomu prostaty
- Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

