-
Medical journals
- Career
Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
Authors: Vlčková Eva; Mitrová Katarína
Authors‘ workplace: Pediatrická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole
Published in: Čes-slov Pediat 2023; 78 (3): 182-186.
Category: Review
doi: https://doi.org/10.55095/CSPediatrie2023/025Overview
Primární sklerozující cholangitida (PSC) je chronické progresivní onemocnění žlučových cest. Mezi primární sklerozující cholangitidou dospělých a juvenilní formou existuje řada rozdílů. V dětském věku vídáme tuto diagnózu nejčastěji ve spojitosti se zánětlivým střevním onemocněním (IBD). Fenotyp IBD se u pacientů s PSC-IBD liší od těch bez souběžné diagnózy PSC. Obvykle bývá charakterizován mírnějším průběhem a nálezem pankolitidy, rectal sparingu a backwash ileitidy. U těchto pacientů může být častěji přítomná endoskopická aktivita IBD navzdory chybějícím symptomům. Průběh PSC spojené s Crohnovou nemocí je zpravidla méně závažný než u PSC spojené s ulcerózní kolitidou (PSC-UC). Na rozdíl od pacientů s izolovanou formou UC bývají pacienti s PSC-UC častěji léčeni monoterapií aminosalicyláty. Navíc bylo u pacientů s PSC-UC popsáno nižší riziko provedení kolektomie a potřeby kortikosteroidů, thiopurinů nebo biologické terapie než u klasické formy UC. Recentní práce naznačují, že žádná z aktuálně používaných léčebných modalit nedokáže zastavit progresi PSC, přičemž značná část pacientů dospěje do stadia jaterního selhání vyžadujícího transplantaci jater.
Klíčová slova:
terapie – zánětlivá střevní onemocnění – detský vek – primární sklerozující cholangitida
ÚVOD
Primární sklerozující cholangitida (PSC) je vzácné chronické progresivní onemocnění extra - a/nebo intrahepatálních žlučovodů. Bývá diagnostikována na základě typického biochemického nálezu cholestázy a nálezu dilatací a/nebo striktur žlučových cest na cholangiogramu, které jsou typické pro onemocnění velkých žlučovodů, tzv. large-duct disease (87 %). Onemocnění malých žlučovodů neboli small-duct disease, diagnostikované na základě histologického nálezu při jaterní biopsii, bývá méně časté (13 %) a mívá obvykle mírnější průběh.(1) Tento typ se častěji objevuje u dětí (13–36 %) než u dospělých (5 %),(2) a proto je považován za brzké stadium SC.(1) Je spojován s lepší prognózou než large-duct SC a má menší riziko rozvoje cholangiokarcinomu. Incidence PSC se pohybuje kolem 0,2–1,5 na 100 000 dětí.(1,2) Toto číslo ale může být podhodnoceno vzhledem k mírným nebo i zcela chybějícím příznakům v brzkém stadiu onemocnění. Přestože se závažnost PSC může lišit napříč spektrem, její přirozený průběh vede nakonec k progresivní fibróze vyúsťující do jaterní cirhózy až jaterního selhání.
Sklerozující cholangitida v dětském věku se svým průběhem i některými symptomy odlišuje od onemocnění dospělých jedinců. Primární sklerozující cholangitida (PSC, neznámá etiologie onemocnění), běžná v dospělé populaci, je naopak v dětském věku poměrně vzácná, mnohem častěji se můžeme setkat s variantou, u které je přítomná pozitivita autoprotilátek. V takovém případě pak mluvíme o autoimunitní sklerozující cholangitidě (ASC). U dětských pacientů dochází na rozdíl od dospělé populace častěji k překryvu histologického a biochemického nálezu autoimunitní hepatitidy (AIH) a SC.(2,3)
EPIDEMIOLOGIE A PRŮBĚH NEMOCI
Etiologie sklerozující cholangitidy (SC) je komplexní a multifaktoriální. Na jejím vzniku se mohou podílet faktory genetické i environmentální. Přestože přesný mechanismus vzniku nebyl dosud zcela objasněn, byla ve spojitosti s rozvojem PSC popsána řada abnormalit na ose střevo–játra, včetně defektů v imunoregulaci, v metabolismu žlučových kyselin, mikrobiomu nebo střevní permeability. Podle současné definice Evropské společnosti pro dětskou gastroenterologii, hepatologii a výživu (ESPGHAN) lze termín „primární“ SC použít pouze u těch dětských pacientů, u kterých se vyskytuje sklerozující cholangitida zcela idiopatické etiologie, jelikož toto označení odkazuje právě na neznalost etiologie a patogeneze.(3) V některých případech se může SC pojit i s jinými onemocněními, podle čehož pak můžeme rozlišovat několik podtypů. V dětském věku vídáme tuto diagnózu nejčastěji ve spojitosti se zánětlivým střevním onemocněním (IBD). Současná prevalence IBD u pacientů s PSC se pohybuje kolem 70 %, což potvrdila i data z dosud největšího publikovaného souboru dětských pacientů s PSC.(4) V rámci tzv. Pediatric PSC Consortium, tj. mezinárodního multicentrického registru pacientů s PSC, mělo až 76 % pacientů konkomitantní IBD, přičemž převládala diagnóza ulcerózní kolitidy (UC), a to v 83 %.(4) Naproti tomu prevalence PSC u pacientů s IBD byla kolem 2,2 %. Zdá se, že v případě screeningově prováděné MRCP (magnetická rezonance žlučových cest) u pacientů s IBD by mohlo být toto číslo i vyšší (8–14 %).(5) Data týkající se přirozeného průběhu nemoci vycházející z menších studií naznačují, že zhruba 20 % dětí s PSC dospěje k transplantaci jater do 5–7 let od diagnózy.(1) Podle dat z Pediatric PSC Consortium bylo pětileté přežití s nativními játry 88 % (desetileté 70 %), přičemž u poloviny pacientů z registru došlo minimálně k jedné nežádoucí příhodě ve smyslu komplikace stran portální hypertenze nebo biliární komplikace, transplantaci jater, rozvoji cholangiokarcinomu nebo smrti v důsledku jaterního onemocnění.(4) Pětiletá pravděpodobnost rekurence PSC po transplantaci jater bývá kolem 23 %.(6)
PSC-IBD – FREKVENTOVANÁ FORMA PRIMÁRNÍ SKLEROZUJÍCÍ CHOLANGITIDY V DĚTSKÉM VĚKU
Jak již bylo zmíněno, forma PSC asociovaná s IBD bývá označována jako PSC-IBD. Jedná se o velice frekventovanou formu SC u dětí. IBD může předcházet diagnózu jaterního onemocnění o mnoho let, stejně tak ale může být diagnostikováno ve stejnou dobu nebo také až po transplantaci (Tx) jater. Při výskytu PSC spolu s ulcerózní kolitidou (v 75 % případů) mluvíme o PSC-UC. Genetický overlap mezi PSC a IBD je překvapivě malý, pouze u 5 % z přibližně 200 IBD kandidátních genů byla prokázána spojitost s PSC.(7)
KLINICKÝ OBRAZ
Fenotyp IBD
Rozsah zánětlivého postižení střeva u PSC-UC může být odlišný od klasické UC. Typickým obrazem bývá nález pankolitidy s obráceným gradientem postižení jako u izolované UC. Byla popsána predilekce intenzivnějšího zánětu v pravém kolon, dále nález typické backwash ileitidy nebo chybějící postižení rekta – tzv. rectal sparing.(1,8,9) V případě Crohnovy nemoci asociované s PSC (PSC-CD) se nejčastěji jedná o obraz crohnovské kolitidy, ev. v kombinaci s postižením terminálního ilea. Izolované postižení terminálního ilea je v tomto případě raritní, stejně tak i strikturující nebo penetrující komplikace.(1) Obecně má onemocnění IBD v případě pacientů s PSC-IBD mírnější průběh než u těch s izolovanou formou IBD. Navzdory mírnější aktivitě však u dětských pacientů s PSC-IBD chybějící klinické symptomy neodráží spolehlivě míru slizničního hojení. Zdá se, že hladina fekálního kalprotektinu pod 100 μg/g vypovídá o slizničním hojení lépe než indexy aktivity (např. PUCAI) založené na hodnocení klinických symptomů.(10) Závažnost střevního zánětu navíc nemusí korelovat se závažností jaterního postižení. U dospělých pacientů s PSC-IBD byl zaznamenán nižší počet kolektomií i s IBD spojených hospitalizací.(11) U dětí jsou data zatím rozporuplná.( 12) I když se udává, že riziko vzniku kolorektálního karcinomu (CRC) je u pacientů s PSC-UC 3–4× vyšší než u pacientů bez PSC, je výskyt CRC u dětí mladších 12 let velice vzácný.(13,17) Zatím nejsou k dispozici jednoznačná data stran surveillance, nicméně u náctiletých a u pacientů s déle trvajícím onemocněním by bylo provedení screeningové kolonoskopie pravděpodobně namístě. Vyšší riziko CRC u pacientů s PSC-UC bohužel přetrvává i po Tx jater.(14)
Fenotyp PSC
Při hodnocení fenotypu PSC nebyl pozorován významný rozdíl mezi pacienty s PSC a PSC-IBD, i když několik odlišností bylo přece jenom zaznamenáno. Jestli se přirozený průběh PSC mění vlivem IBD, není zcela jasné. Recentní práce naznačují, že provedení kolektomie je spojeno se sníženým rizikem rekurence PSC po transplantaci jater, což by zpochybňovalo dosavadní hypotézu, že se obě onemocnění vyvíjejí nezávisle na sobě.(14) Otázkou také zůstává, nakolik může časně stanovená diagnóza ovlivnit další průběh nemoci. Naprostá většina pacientů bývá stran symptomů PSC dlouhou dobu zcela bezpříznaková. Teprve v případě pokročilého nálezu se mohou objevit symptomy obdobné těm při autoimunitní hepatitidě, jako jsou ikterus, únava, nauzea, zvracení, bolest břicha, úbytek hmotnosti, tmavá moč, světlá acholická stolice, bolest hlavy, zpomalení růstu, teploty, pruritus nebo nedostatek vitaminů rozpustných v tucích. Při fyzikálním vyšetření může být patrná splenomegalie, hepatomegalie nebo ikterus. Při velmi pokročilém onemocnění jater může být prvním projevem krvácení z jícnových varixů při portální hypertenzi či obecně krvácivé projevy při koagulopatii nebo ascites.(1,9,15)
DIAGNOSTIKA
Diagnóza sklerozující cholangitidy je stanovena na základě charakteristického nálezu dilatace a/nebo striktur na žlučových cestách na MRCP(1,5) (obr. 1, obr. 2). MRCP lze eventuálně nahradit ERCP (endoskopická retrográdní cholangiopankreatikografie), která má sice významnou radiační zátěž a zvyšuje riziko vzniku pankreatitidy, na druhou stranu ji ale lze výhodně využít zejména v případě předpokládaného terapeutického výkonu u onemocnění s prokázanými dominantními strikturami. Nezastupitelnou roli pak hraje ERCP při screeningu cholangiokarcinomu u rizikových pacientů (provedení tzv. brush cytologie).(6,16) V případě negativního nálezu na MRCP a při přetrvávajícím podezření na SC je nutno provést diagnostickou jaterní biopsii, která může zároveň pomoci odlišit podtyp SC (small-duct SC nebo overlap syndrom). Jen na základě laboratorního sérologického a histologického nálezu nelze rozlišit AIH a SC, proto hraje MRCP v diagnostice SC nenahraditelnou roli.(2) Z důvodu častého překryvu těchto dvou onemocnění je důležité provést screening autoimunitní složky SC (autoprotilátky – ANA, ASMA, LKM, LC-1, IgG), v případě pozitivity je pak nutné doplnit jaterní biopsii. K vyloučení konkomitantního IBD je potřeba vyšetřit fekální kalprotektin i u zcela bezpříznakového jedince, ev. doplnit laboratorní imunologické vyšetření autoprotilátek (ASCA, ANCA).
Image 1. Pokročilý nález na MRCP – hydrops žlučníku, splenomegalie, mnohočetné striktury a dilatace na žlučových cestách 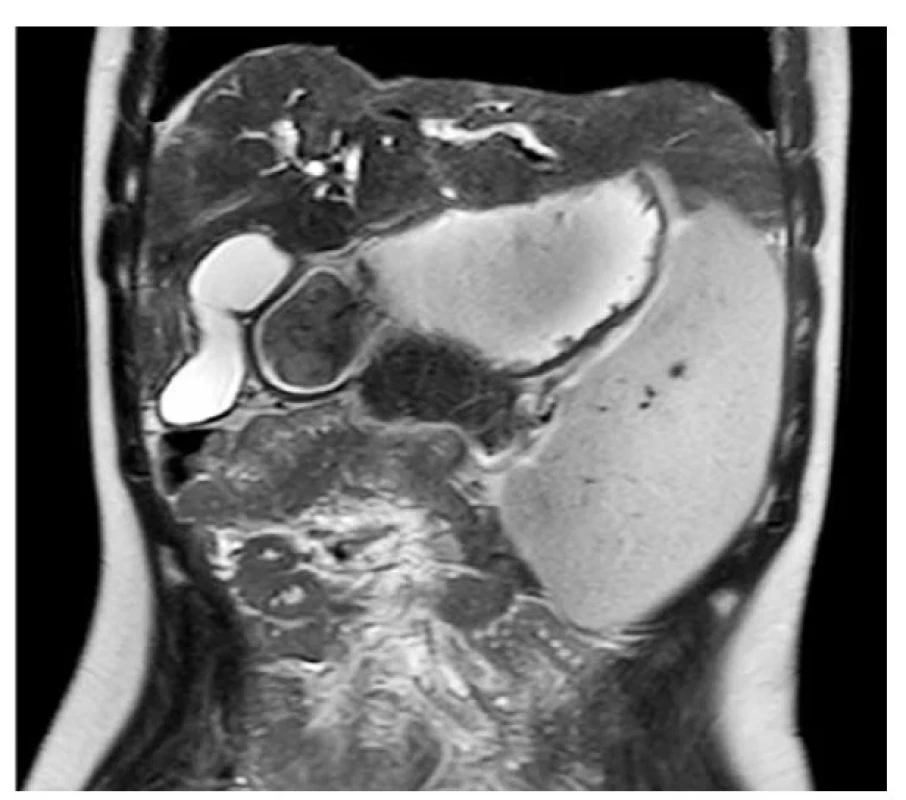
Image 2. 3D rekonstrukce žlučových cest a žlučníku u stejného pacienta 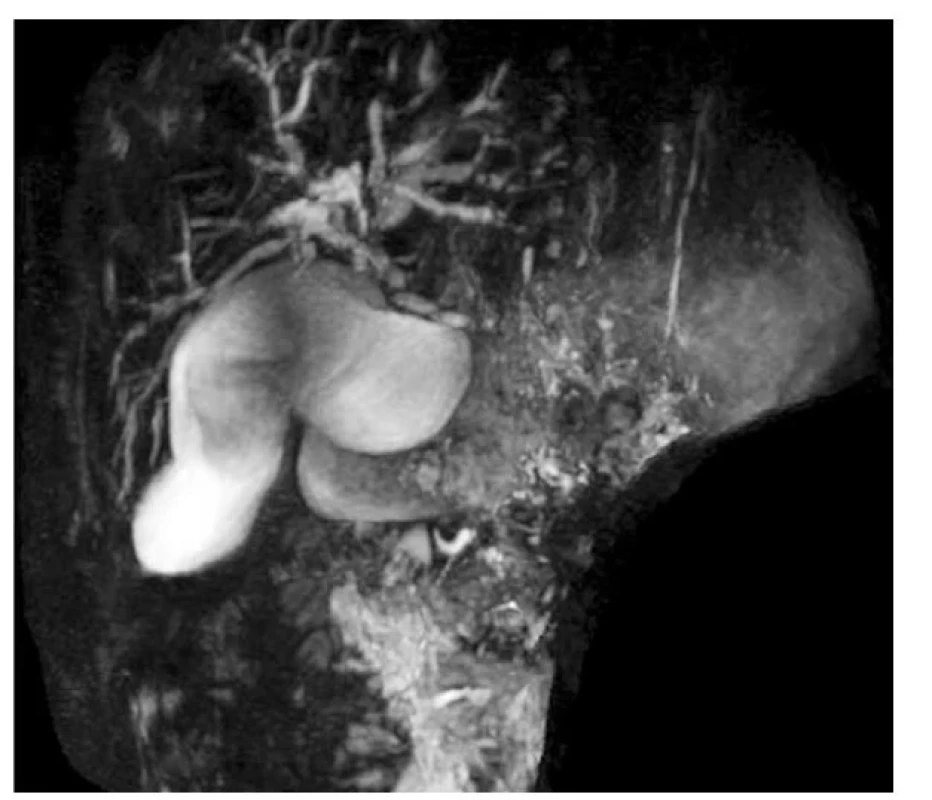
TERAPIE
Výsledky dosavadních studií a metaanalýz naznačují, že žádná z aktuálně používaných léčebných modalit nedokáže zastavit progresi nemoci.(1,2,14) Terapie PSC má tudíž často pouze podpůrný efekt, a to zejména u izolované PSC. Onemocnění žlučových cest u velké části pacientů s PSC progreduje navzdory jakékoliv terapii.(1,4,6)
Farmakologická léčba
U PSC-IBD v dětském věku se léčba odvíjí od medikace konkomitantního IBD. Podle recentních prací pediatričtí pacienti s PSC-IBD vyžadují méně často použití steroidů, thiopurinů nebo biologické léčby, než je tomu u pacientů bez PSC, což by poukazovalo na mírnější průběh IBD v této skupině pacientů.(10) U pacientů s PSC-UC bylo častěji pozorováno použití monoterapie 5-aminosalicylátů (5-ASA) než u izolované formy IBD.(9,10,16)
Kortikosteroidy mohou být použity i v indukční terapii PSC-IBD v případě významné aktivity UC. Nejčastěji je používán prednison, v dávce 1 mg/kg s maximem 40 mg/den s postupným taperingem.(17)
Nejčastěji používaným imunosupresivem v udržovací léčbě IBD, a tudíž i PSC-IBD, je azathioprin (AZA), i když jeho použití v případě PSC-IBD nezlepšuje prognózu PSC, a navíc je potřeba opatrnosti vzhledem k jeho možné hepatotoxicitě a myelotoxicitě.
Biologickou léčbu lze využít s cílem potlačení zánětlivé aktivity IBD, nicméně její vliv na PSC nebyl signifikantní a nedokázal zastavit progresi nemoci. Hodně diskutovaným tématem je i samotný výběr biologika. Ani použití vedolizumabu, který má selektivní účinek na gastrointestinální trakt a může vést k navození remise IBD i u pacientů s PSC-IBD, nevede ke zlepšení hodnot jaterních enzymů, pouze u minima pacientů dochází k poklesu GGT za 9–12 měsíců od nasazení léčby.(18)
V posledních letech je předmětem řady diskusí užívání kyseliny ursodeoxycholové (UDCA), která bývala donedávna jedinou léčbou využívanou v terapii primární SC. V dospělé populaci se od užívání UDCA ustupuje (vysoké dávky byly navíc spojené s významnými nežádoucími účinky), zatímco u dětí jsou názory na její použití kontroverzní. Účinek UDCA spočívá v inhibici intestinální absorpce hepatotoxických žlučových kyselin, může mít protizánětlivé nebo i imunomodulační účinky. Dávka 15 mg/kg hmotnosti denně může vést u dětí ke zlepšení laboratorních parametrů i cholestázy. Nicméně efekt léčby UDCA je stále sporný.(17,19) Podle posledních prací část pediatrických pacientů, která na terapii UDCA do jednoho roku od stanovení diagnózy odpoví poklesem hodnot GGT do normy, dosahovala z dlouhodobého hlediska lepších výsledků. U pacientů, kteří ale na léčbu UDCA neodpovědí, by měla být terapie vysazena, jelikož pro ně nepřináší žádný klinický benefit a nezlepšuje prognózu onemocnění.(19,20)
Vankomycin je baktericidní antibiotikum působící na grampozitivní bakterie. Je špatně vstřebatelné v gastrointestinálním traktu, a proto je využíváno k ovlivnění střevního mikrobiomu. V recentních studiích došlo k normalizaci transamináz a sedimentace u pacientů léčených perorálně podávaným vankomycinem v dávce 50 mg/kg/den, přičemž délka léčby byla variabilní.(2,20,21) Nicméně data týkající se jeho paušálního použití jsou zatím limitovaná.
Nefarmakologická léčba
V případě dominantních striktur lze i u pediatrických pacientů s PSC využít ERCP. Balonková dilatace dominantních striktur může zpomalit progresi nemoci a vést ke zlepšení laboratorních parametrů. Podle recentních prací nebyl prokázán signifikantní rozdíl mezi efektem balonkové dilatace a krátkodobým stentováním.(22)
Transplantace jater pak představuje jediné a definitivní řešení pro pokročilá a finální stadia nemoci, včetně pacientů s dekompenzovanou cirhózou, cholangiokarcinomem, úporným pruritem nereagujícím na terapii nebo také v případě chronické cholangitidy. Přibližně 2 % indikací k transplantaci jater u dětí jsou z důvodu SC. Nicméně je potřeba mít na paměti, že rekurence onemocnění po transplantaci jater může být 20–25 %.(6)
KOMPLIKACE
Riziko vzniku rozvoje komplikací spojených s portální hypertenzí se pohybuje kolem 38 %, u biliárních komplikací (nutnost intervence) to bývá přibližně 25 % za 10 let probíhajícího onemocnění. Tři čtvrtiny těchto pacientů podstoupí následně transplantaci jater.(4) Raritní, ale nezanedbatelnou komplikací u SC je vznik cholangiokarcinomu (CCA). V současnosti však neexistuje doporučený postup screeningu CCA u dětí. Lze doporučit pravidelné provádění ultrazvuku jater a detekce sérové hladiny cancer antigen 19-9 (CA 19-9) u pacientů nad 18 let, u pacientů s biliárními strikturami vyžadujícími intervenci začínáme jednou ročně již u starších 15 let.(15,17) K hodnocení dlouhodobé prognózy lze využít tzv. SCOPE index (tab. 1). Vyšší hodnoty APRI indexu (index AST k trombocytům), GGT a celkového bilirubinu v době diagnózy byly asociovány s horší dlouhodobou prognózou.(4)
Pacienti s podtypem PSC-IBD, zejména PSC-UC, vykazovali obecně pomalejší progresi onemocnění (s ohledem na menší riziko kolektomie i počet hospitalizací).(1,4,11) U pacientů s IBD, u kterých nedošlo k dosažení remise, bylo popsáno vyšší riziko relapsu PSC po jaterní transplantaci, proto je doporučeno zvážit (u pacientů s aktivním zánětlivým postižením kolon) provedení kolektomie ještě před plánovanou transplantací.(1,3,9)
Table 1. SCOPE index (Sclerosing Cholangitis Outcomes In Pediatrics) 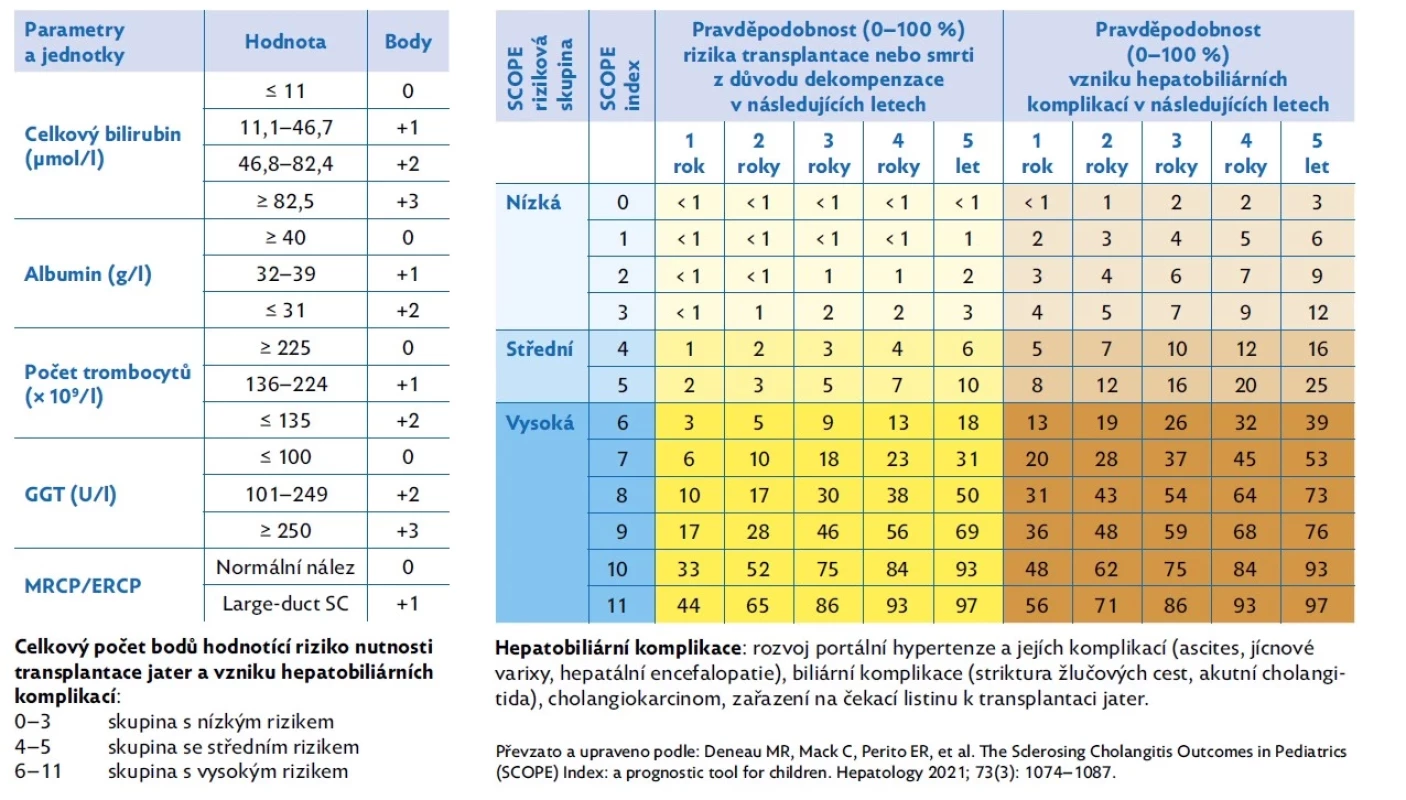
ZÁVĚR
Sklerozující cholangitida je v posledních letech vzhledem k narůstající incidenci předmětem intenzivního výzkumu. Je již zřejmé, že podobně jako u dospělých i fenotyp dětských pacientů s PSC-IBD vykazuje některé specifické znaky. Typický bývá nález pankolitidy s predilekčně závažnějším postižením pravého tračníku, chybějící postižení rekta nebo tzv. backwash ileitida. Častý bývá také nález aktivity střevního zánětu navzdory chybějícím klinickým symptomům, což vybízí k pečlivé monitoraci IBD i při absenci klinických potíží. I když recentní práce stále poukazují na komplexnost a závažnost tohoto onemocnění, terapeutické možnosti, které by dokázaly významným způsobem ovlivnit progresi nemoci, jsou velmi limitované. Stále nezodpovězenou otázkou zůstává, nakolik může potlačení zánětu ve střevě (optimalizací terapie IBD nebo provedením kolektomie časně po diagnóze PSC) změnit přirozený průběh PSC.
Korespondenční adresa:
MUDr. Eva Vlčková
Pediatrická klinika 2. lékařské fakulty Univerzity Karlovy
a Fakultní nemocnice v Motole
V Úvalu 84, 155 00 Praha 5
Sources
1. Ricciuto A, Kamath BM, Griffiths AM. The IBD and PSC phenotypes of PSC-IBD. Curr Gastroenterol Rep 2018; 20(4): 16.
2. Kerkar N, Chan A. Autoimmune hepatitis, sclerosing cholangitis, and autoimmune sclerosing cholangitis or overlap syndrome. Clin Liver Dis 2018; 22(4): 689–702.
3. Mieli-Vergani G, Vergani D, Baumann U, et al. Diagnosis and management of pediatric autoimmune liver disease: ESPGHAN Hepatology Committee Position Statement 2018; 66(2): 345–360.
4. Deneau MR, El-Matary W, Valentino PL, et al. The natural history of primary sclerosing cholangitis in 781 children. Hepatology 2017; 66(2): 518–527.
5. Lunder AK, Hov JR, Borthne A, et al. Prevalence of sclerosing cholangitis detected by magnetic resonance cholangiography in patients with long-term inflammatory bowel disease. Gastroenterology 2016; 151(4): 660–669.
6. Laborda TJ, Jensen MK, Kavan M, et al. Treatment of primary sclerosing cholangitis in children. World J Hepatol 2019; 11(1): 19–36.
7. Ji S, Juran BD, Mucha S, et al. Genome-wide association study of primary sclerosing cholangitis identifies new risk loci and quantifies the genetic relationship with inflammatory bowel disease. Nat Genet 2017; 49(2): 269–273.
8. Loftus EV. PSC-IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91–96.
9. Bajer L, Kamenář D, Sticová E, et al. Idiopatický střevní zánět u pacientů s primární sklerozující cholangitidou – samostatný fenotyp IBD. Gastroent Hepatol 2014; 68(1): 24–35.
10. Ricciuto A, Hansen BE, Ngo B, et al. Primary sclerosing cholangitis in children with inflammatory bowel diseases is associated with milder clinical activity but more frequent subclinical inflammation and growth impairment. Clin Gastroenterol Hepatol 2020; 18(7): 1509–1517.
11. Sokol H, Cosnes J, Chazouilleres O, Beaugerie L, et al. Disease activity and cancer risk in inflammatory bowel disease associated with primary sclerosing cholangitis. World J Gastroenterol 2008; 14(22): 3497–3503.
12. Bramuzzo M, Martelossi S, Torre G, et al. Clinical features and risk factors of autoimmune liver involvement in pediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2016; 63(2): 259–264.
13. Zheng H, Jiang X. Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease. Eur J Gastroenterol Hepatol 2016; 28(4): 383–390.
14. Lindström L, Jørgensen KK, Boberg KM, et al. Risk factors and prognosis for recurrent primary sclerosing cholangitis after liver transplantation: a Nordic Multicentre Study. Scandinavian J Gastroenterol 2018; 53(3): 297–304.
15. Nevoral J, et al. Praktická pediatrická gastroenterologie, hepatologie a výživa. Praha: Mladá fronta 2013.
16. Bajer L, Wohl P, Drastich P. PSC-IBD: specifický fenotyp idiopatického střevního zánětu asociovaný s primární sklerózující cholangitidou. Vnitř Lék 2018; 64(6): 659–664.
17. Turner D, Ruemmele FM, Orlanski-Meyer E, et al. Management of paediatric ulcerative colitis. Part 1: Ambulatory care-an evidence-based guideline from European Crohn’s and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition. JPGN 2018; 67(2):257–291.
18. Laborda TJ, Ricciuto A, Aumar M, et al. Vedolizumab therapy in children with primary sclerosing cholangitis: Data from the Pediatric Primary Sclerosing Cholangitis Consortium. JPGN 2020; 71(4): 459–464.
19. Deneau MR, Perito E, Ricciuto A, et al. Ursodeoxycholic acid therapy in pediatric primary sclerosing cholangitis: predictors of gamma glutamyltransferase normalization and favorable clinical course. J Pediatr 2019; 209 : 92–96.
20. Deneau MR, Mack C, Mogul D, et al. Oral vancomycin, ursodeoxycholic acid, or no therapy for pediatric primary sclerosing cholangitis: a matched analysis. Hepatology 2021; 73(3): 1061–1073.
21. Di Giorgio A, Tulone A, Nicastro E, et al. Use of oral vancomycin in children with autoimmune liver disease: A single centre experience. World J Hepatol 2021; 13(12): 2113–2127.
22. Ponsioen CY, Arnelo U, Berquist A, et al. No superiority of stents vs balloon dilatation for dominant strictures in patients with primary sclerosing cholangitis. Gastroenterology 2018; 155(3): 752–759.Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2023 Issue 3-
All articles in this issue
- Antonín Hudeček: Starý Kolín
- Co jsme psali
- Editorial
- O nositelích Nobelovy ceny Coriových, ale nejen o nich
- Po stopách manželů Coriových
- Dědičné poruchy metabolismu sacharidů, glykogenu, glykosaminoglykanů a glykosylace proteinů
- Pozdní diagnóza mukopolysacharidózy I. typu u dívky s kontrakturami rukou
- Hepatocelulární karcinom u kojence s tyrosinemií typ 1
- Je LATCH skórovací systém spolehlivým prediktorem délky kojení?
- Částečné kojení při propuštění novorozence z porodnice nepredikuje insuficientní kojení v prvních šesti měsících
- Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
- Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
- Profesorka MUDr. Lidka Lisá – devadesátiletá
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dědičné poruchy metabolismu sacharidů, glykogenu, glykosaminoglykanů a glykosylace proteinů
- Sklerozující cholangitida u pacientů se zánětlivým střevním onemocněním
- Pozdní diagnóza mukopolysacharidózy I. typu u dívky s kontrakturami rukou
- Analoga GLP-1 v léčbě obezity u adolescentů. První praktické zkušenosti s podáváním liraglutidu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

