-
Medical journals
- Career
Epidemiologie a klinický průběh syndromu multisystémové zánětlivé odpovědi spojeného s infekcí SARS-CoV-2 u dětí a mladistvých (PIMS-TS) v České republice
Authors: David Jan 1; Stará Veronika 1; Hradský Ondřej 1; Pešková Šárka 1; Toni Ledjona 1; Šedivý Vojtěch 1; Šibíková Michaela 1,2,3; Malcová Hana 4; Tučková Jana 5; Slabá Kateřina 5; Jabandžiev Petr 5,6; Šašek Lumír 7; Huml Michal 7; Žídková Iveta 8; Pavlíček Jan 8; Palátová Alžběta 9; Klásková Eva 9; Bánszka Karina 10; Terifajová Eva 10; Vyhnánek Radim 11; Bloomfield Markéta 11,12; Fingerhutová Šárka 13; Doležalová Pavla 13; Procházková Lucie 14; Chramostová Gabriela 15; Grätz Roman 16; Chalupský Martin 17; Weberová Chvílová Magdalena 18; Radvanová Jana 19; Ryba Luděk 20; Vlachý Pavel 21; Žáček Martin 22; Fencl Filip 1; Lebl Jan 1
Authors‘ workplace: Pediatrická klinika, 2. lékařská fakulta Univerzity Karlovy a FN v Motole, Praha 1; Ordinace PLDD, Smečno 2; Oddělení dětského urgentního příjmu a lékařské služby první pomoci, FN v Motole, Praha 3; Oddělení revmatologie dětí a dospělých, FN v Motole, Praha 4; Pediatrická klinika, Masarykova univerzita a FN Brno, Brno 5; Central European Institute of Technology, Masarykova univerzita, Brno 6; Dětská klinika, Lékařská fakulta Univerzity Karlovy a FN Plzeň, Plzeň 7; Klinika dětského lékařství, Lékařská fakulta Ostravské univerzity a FN Ostrava, Ostrava 8; Dětská klinika, Lékařská fakulta Univerzity Palackého a FN Olomouc, Olomouc 9; Dětská klinika, Lékařská fakulta Univerzity Karlovy a FN Hradec Králové, Hradec Králové 10; Pediatrická klinika, 1. lékařská fakulta Univerzity Karlovy a Fakultní Thomayerova nemocnice, Praha 11; Ústav imunologie, 2. lékařská fakulta Univerzity Karlovy a FN v Motole, Praha 12; Klinika pediatrie a dědičných poruch metabolismu, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha 13; Dětské oddělení, Krajská nemocnice T. Bati, Zlín 14; Dětské oddělení, Oblastní nemocnice Kolín, Kolín 15; Pediatrické oddělení, FN Na Bulovce, Praha 16; Dětské oddělení, Nemocnice Nové Město na Moravě, Nové Město na Moravě 17; Dětské oddělení, Nemocnice Havlíčkův Brod, Havlíčkův Brod 18; Dětské a novorozenecké oddělení, Nemocnice Třebíč, Třebíč 19; Dětské oddělení, Orlickoústecká nemocnice, Ústí nad Orlicí 20; Pediatrické oddělení, Nemocnice Jihlava, Jihlava 21; Dětské oddělení, Nemocnice České Budějovice, České Budějovice 22
Published in: Čes-slov Pediat 2022; 77 (6): 333-339.
Category: Original Papers
doi: https://doi.org/10.55095/CSPediatrie2022/059Overview
Cíl: Cílem studie bylo analyzovat epidemiologii a klinický průběh syndromu multisystémové zánětlivé odpovědi spojeného s infekcí SARS-CoV-2 u dětí a mladistvých (paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2, PIMS-TS) v České republice (ČR).
Metody: Do retrospektivně-prospektivní observační celonárodní studie byli zařazeni pacienti s PIMS-TS dle diagnostických kritérií Světové zdravotnické organizace, kteří byli hospitalizováni v ČR v období od 1. 11. 2020 do 31. 5. 2021. Anonymizovaná data těchto pacientů (demografické a klinické údaje) byla získána z lékařských zpráv. Některá data z výše uvedeného sledovaného období byla následně porovnána s výsledky menšího souboru pacientů z další pandemické vlny. Druhá fáze observační celonárodní studie navazovala v období od 1. 6. 2021 do 31. 3. 2022, které bylo charakterizováno převažujícími variantami viru delta a následně omikron.
Výsledky: Od 1. 11. 2020 do 31. 5. 2021 bylo na území ČR diagnostikováno 207 pacientů s PIMS-TS. V pediatrické populaci (0–19 let) byla incidence 1 : 10 100 obecné populace, resp. 1 : 1127 ve skupině pozitivně testovaných jedinců. Při následné ambulantní kontrole měli všichni pacienti normální srdeční funkci, pouze u dvou (1,2 %) přetrvávala dilatace koronární tepny. V období 1. 6. 2021 až 31. 3. 2022 byl PIMS-TS diagnostikován u dalších 222 dětí. Zatímco při převažující variantě delta byl výskyt PIMS-TS vysoký, ve fázi převažující varianty omikron poklesl ve vztahu k počtu pozitivně testovaných na čtvrtinu. Celkově tedy onemocnělo 429 dětí, nebyly zjištěny žádné případy úmrtí.
Závěry: Nízký výskyt závažných průběhů nemoci a nulovou mortalitu u PIMS-TS lze vysvětlit edukací pediatrů v celé ČR a sjednocením diagnostických a terapeutických postupů s časným podáním kombinované imunosupresivní terapie.
Klíčová slova:
incidence – COVID-19 – PIMS-TS – MIS-C
Úvod
Krátce po první závažné vlně nového koronavirového onemocnění (covid-19) v italském Bergamu na konci zimy 2020 bylo na tamní dětskou kliniku přijato deset dětí v závažném stavu, s příznaky podobnými Kawasakiho nemoci.(1) Jejich průměrný věk byl v porovnání s Kawasakiho nemocí vyšší – 7,5 roku, a překvapivě vysoký podíl pacientů měl srdeční dysfunkci.(1) Na počátku května 2020 se uskutečnila telekonference specialistů Great Ormond Street Hospital z Londýna a Hôpital Universitaire Robert-Debré z Paříže, během které byla definována nová pediatrická nemoc – syndrom multisystémové zánětlivé odpovědi asociovaný s infekcí SARS-CoV-2 u dětí a mladistvých (paediatric inflammatory multisystem syndrome temporally associated with severe acute respiratory syndrome coronavirus 2, PIMS-TS), ve Spojených státech nazvaná multisystémový zánětlivý syndrom (multisystem inflammatory syndrome in children, MIS-C), jako závažný opožděný klinický projev infekce virem SARS-CoV-2 u dětí a dospívajících.(2)
I když první ojedinělý případ v České republice (ČR) popsal již Klocperk se spolupracovníky na jaře 2020,(3) skutečným problémem se u nás PIMS-TS stal až ve druhé vlně covidu - 19 na přelomu října a listopadu téhož roku. Z pověření výboru České pediatrické společnosti byly připraveny doporučené postupy(4) a formou videokonference 18. 12. 2020 s nimi byli seznámeni lékaři dětských oddělení. Současně byla zahájena informační kampaň zaměřená na odbornou i laickou veřejnost s cílem včas rozpoznat tento závažný stav.
PIMS-TS je závažné akutní onemocnění dětí a dospívajících, které se rozvíjí obvykle za dva až šest týdnů po prodělání infekce SARS-CoV-2. Jeho podstatou je dysregulace imunitní odpovědi organismu na SARS-CoV-2 a vznik těžké multisystémové zánětlivé reakce. Klinicky nejzávažnější je postižení kardiovaskulárního aparátu. Při nepříznivém průběhu může dojít až k obrazu multiorgánového selhání. Etiologie je multifaktoriální. Svoji roli v patogenezi sehrávají T-lymfocyty i protilátky. Důvody vzniku autoreaktivních protilátek a imunokomplexů mohou být mnohé, nejen mikrobní mimikry. Zvažována je i genetická predispozice jedinců vedoucí k eskalované imunitní odpovědi doprovázené vznikem cytokinové bouře.(5)
Cílem této studie bylo analyzovat epidemiologické a klinické charakteristiky pacientů s diagnostikovaným PIMS-TS v ČR.
Metody
První část souboru je tvořena pacienty s PIMS-TS dle diagnostických kritérií Světové zdravotnické organizace(6) zařazených do retrospektivně-prospektivní observační celonárodní studie, kteří byli hospitalizováni v českých, moravských a slezských nemocnicích v období od 1. 11. 2020 do 31. 5. 2021. Anonymizovaná data těchto pacientů (demografické a klinické údaje, výsledky laboratorních testů, zobrazovací a echokardiografické nálezy a léčebné postupy) byla získána z lékařských zpráv. Oslovením všech pediatrických oddělení v ČR bylo zajištěno zachycení všech pacientů s PIMS-TS. Studie byla schválena Etickou komisí Fakultní nemocnice v Motole (číslo 705/21). Vzhledem k jejímu charakteru nebyl vyžadován informovaný souhlas pacientů nebo jejich zákonných zástupců. Výsledky popisující tuto část pacientů již byly publikovány v European Journal of Pediatrics.(7)
Některá data z výše uvedeného sledovaného období byla následně porovnána s výsledky menšího souboru pacientů z další pandemické vlny, a to konkrétně z období 1. 10. 2021 až 15. 1. 2022. Jednalo se o děti a mladistvé, kteří byli s diagnózou PIMS-TS hospitalizováni na Pediatrické klinice Fakultní nemocnice v Motole.
Druhá fáze observační celonárodní studie následovala od 1. 6. 2021 do 31. 3. 2022 se srovnatelným systémem sběru dat ze všech dětských lůžkových oddělení na území ČR. Toto období bylo charakterizováno převažujícími virovými variantami delta a následně omikron.
U všech pacientů v obou fázích studie byla laboratorně prokázána expozice SARS-CoV-2 nebo kontakt s pozitivní osobou v předcházejících dvou měsících. U každého pacienta byl při příjmu k hospitalizaci proveden stěr z nosohltanu k vyšetření SARS-CoV-2 polymerázovou řetězovou reakcí (PCR) a sérologické vyšetření na přítomnost protilátek třídy IgG proti SARS-CoV-2. Kardiologické vyšetření zahrnovalo elektrokardiografii a echokardiografii (vstupně a s odstupem jednoho až šesti měsíců). Dilatace koronárních arterií byla definována její šíří se z-skóre 2,0–2,5, aneuryzma pak jako z-skóre 2,5 a více. Srdeční dysfunkce byla definována sníženou ejekční frakcí levé komory (< 55 %). Rezistence k intravenózní imunoglobulinové léčbě byla stanovena přetrvávající horečkou nebo elevací zánětlivých parametrů déle než 36 hodin po první dávce imunoglobulinů.
Pro účely popisu kohorty byli pacienti rozděleni do čtyř fenotypových skupin podle převažující počáteční symptomatologie – gastrointestinální typ (bolest břicha, průjem, zvracení), Kawasaki-like typ (exantém, konjunktivitida, slizniční změny, lymfadenopatie), kardiovaskulární typ (hypotenze, edém, oligurie/ anurie, prodloužený kapilární návrat) a neurologický typ (bolest hlavy, meningismus, křeče, porucha vědomí).
Výsledky
Do první části celonárodní studie bylo zařazeno 207 pacientů s diagnostikovaným PIMS-TS v ČR ve sledovaném období 2020–2021. V pediatrické populaci (ve věku 0–19 let) byla incidence PIMS-TS 1 : 10 100, resp. 1 : 1127 ve skupině všech pozitivně testovaných jedinců. Medián věku při manifestaci onemocnění byl osm let (rozmezí 0,4–18) s převahou mužského pohlaví (132; 63,8 %). Většina jedinců (196; 94,7 %) patřila ke kavkazskému etniku. Demografické, klinické a laboratorní nálezy vč. léčby u sledovaných pacientů jsou shrnuty v tabulce 1 a graficky v obrázku 1 (upraveno dle(8)). Medián trvání příznaků před zahájením léčby byl pět dní (rozmezí 3–20). Většina pacientů byla doposud zdravá, 42 jedinců (20,3 %) mělo přidružené komorbidity. Nejčastěji se jednalo o alergická (7,7 %) a kardiovaskulární (2,9 %) onemocnění.
Table 1. Demografické parametry, klinické a laboratorní nálezy a léčba u sledované celonárodní kohorty 207 dětí z období listopad 2020 až květen 2021 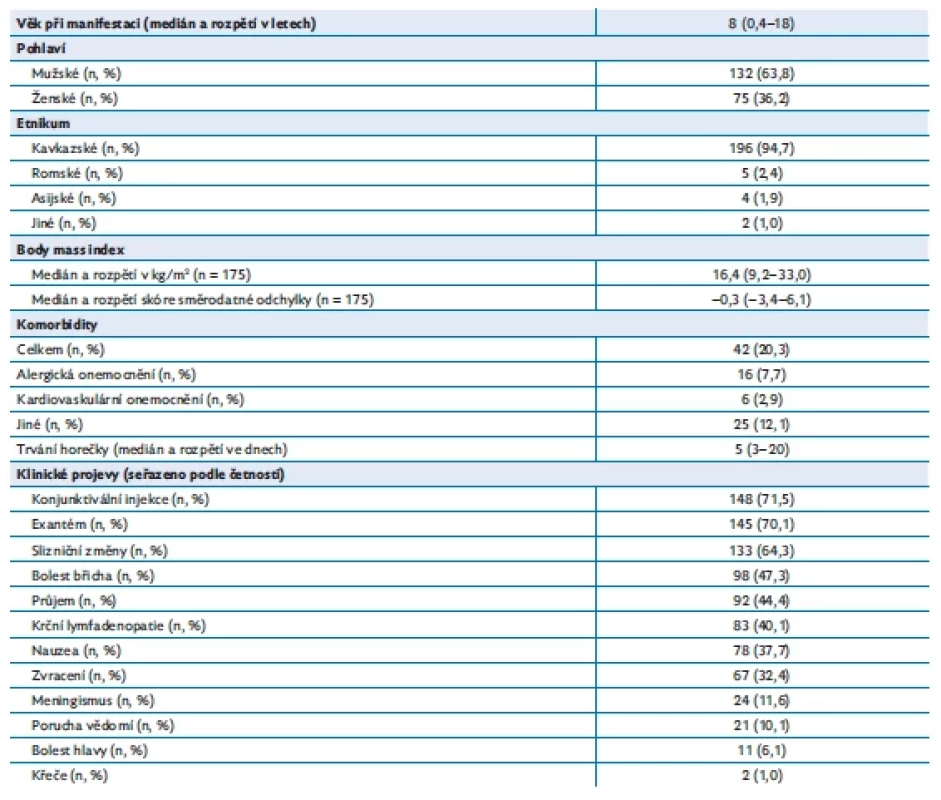
Image 1. Vybrané demografické a klinické nálezy u celonárodní sledované kohorty, upraveno volně dle(8) 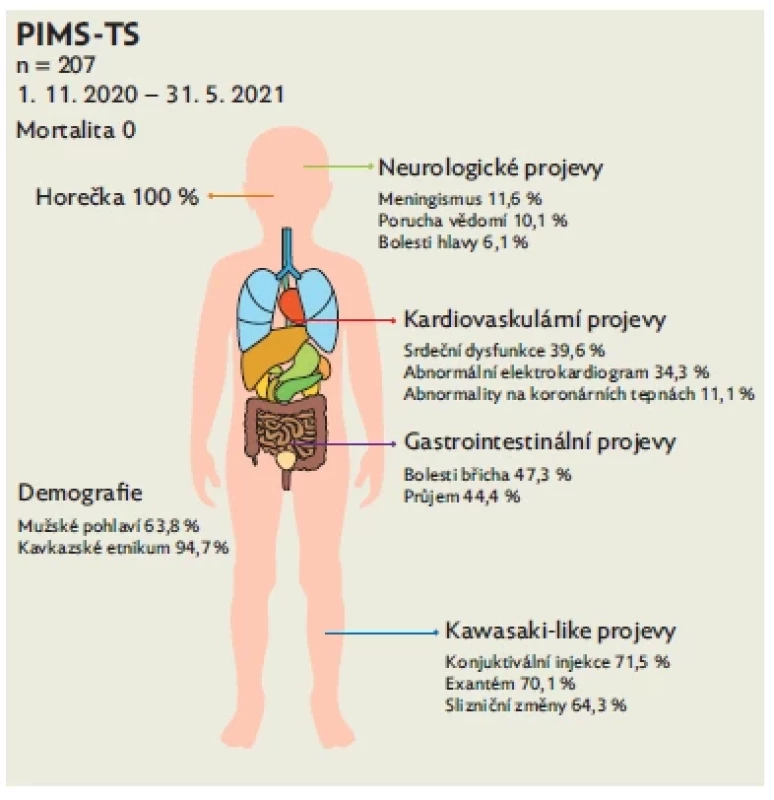
Všichni pacienti měli na počátku onemocnění zvýšené zánětlivé parametry (C-reaktivní protein, prokalcitonin, sedimentaci erytrocytů a/nebo feritin). U 187 (90,3 %) z nich byla při přijetí potvrzena pozitivita SARS-CoV-2 IgG protilátek. Pouze 41 (19,8 %) pacientů bylo však v době diagnózy SARS - -CoV-2 PCR pozitivních.
Gastrointestinální příznaky (bolest břicha, průjem, zvracení nebo nauzea) byly přítomny u 174 (84,1 %) pacientů. Mezi další často popisované symptomy patřila konjunktivální injekce (n = 148; 71,5 %), exantém (n = 145; 70,1 %) a slizniční léze (n = 133; 64,3 %).
U 71 (34,3 %) z 207 pacientů byly zjištěny elektrokardiografické (EKG) patologické nálezy jako abnormální repolarizace (n = 42), atrioventrikulární (AV) blokáda (n = 11) nebo prodloužený QT interval (n = 2). Dle echokardiografického vyšetření mělo 82 (39,6 %) jedinců sníženou funkci myokardu a 51 (24,6 %) vyžadovalo oběhovou podporu. Použití mimotělní membránové oxygenace nebylo hlášeno.
Neurologické postižení při přijetí mělo 61 (29,5 %) jedinců. Častěji hlášenými příznaky byly meningismus (n = 24), porucha vědomí (n = 21), bolest hlavy (n = 11) nebo křeče (n = 2). Lumbální punkce provedená u šesti dětí byla v pěti případech negativní, jedenkrát byla v likvoru potvrzena pleocytóza. Tři (1,5 %) pacienti podstoupili zobrazení hlavy (výpočetní tomografií nebo magnetickou rezonancí), které odhalilo extrapontinní myelinolýzu, oboustranné kortikálně-subkortikální hyperintenzity, mozkový edém, změny při syndromu reverzibilní encefalopatie (posterior reversible encephalopathy syndrome, PRES), arteriální trombózu nebo mozkovou ischemii. U dvou pacientů byly v době přijetí k hospitalizaci prokázány tromby v levé srdeční komoře s následnou embolizací do mozku. Rozdělení pacientů dle převažujícího fenotypu shrnuje tabulka 2.
Table 2. Rozdělení pacientů dle fenotypu u sledované celonárodní kohorty 207 dětí z období listopad 2020 až květen 2021 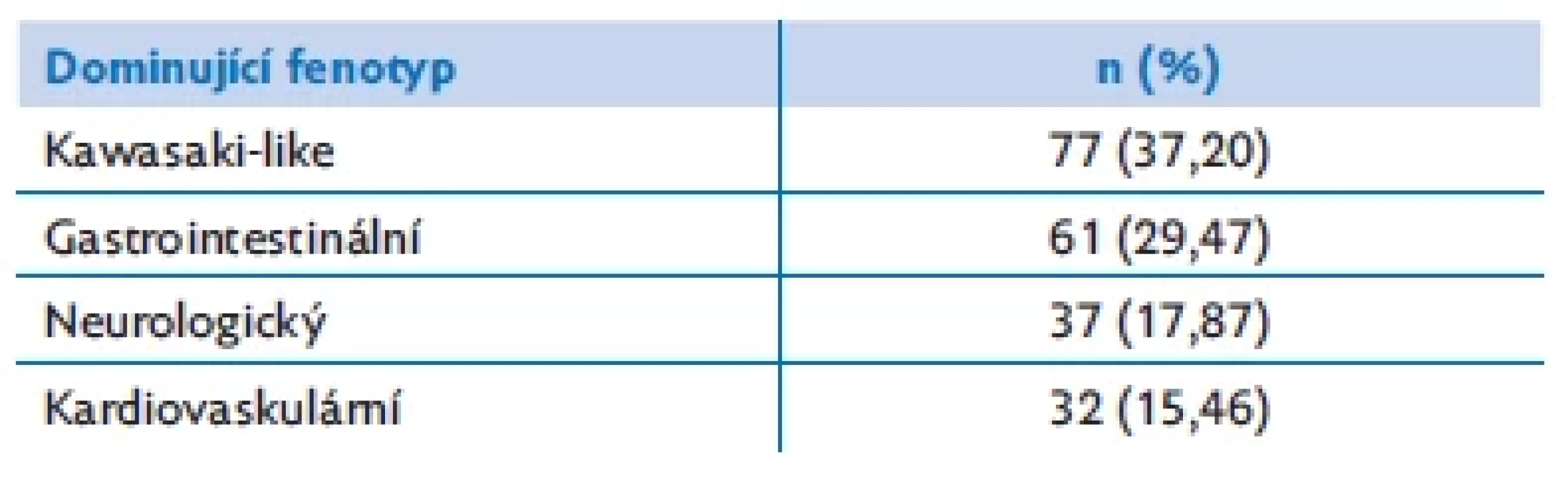
Většině pacientů (n = 190; 91,8 %) byly podány intravenózní imunoglobuliny. Opakované podání kvůli rezistenci na úvodní léčbu bylo nutné v sedmnácti případech (8,2 %). Systémové kortikosteroidy byly podány 172 pacientům (83,1 %). U šesti pacientů (2,9 %) bylo přistoupeno k biologické léčbě antagonistou receptoru pro interleukin 1 (anakinra). V naší kohortě nebylo zaznamenáno žádné úmrtí. Během následného sledování (à 1–6 měsíců) se srdeční funkce u všech pacientů (n = 161) znormalizovala, pouze u dvou jedinců (1,2 %) přetrvával reziduální nález (dilatace levé koronární arterie).
Kohortu cílenou k ověření validity těchto závěrů tvořilo 30 dětí s PIMS-TS hospitalizovaných na Pediatrické klinice Fakultní nemocnice v Motole v následném období. Medián věku při manifestaci onemocnění byl deset let (rozmezí 1–15) s převahou mužského pohlaví (20; 66,7 %). Většina jedinců (26; 86,7 %) patřila ke kavkazskému etniku. Medián trvání příznaků před zahájením léčby byl čtyři dny (rozmezí 3–9). Osm pacientů (26,7 %) rozvinulo srdeční dysfunkci.
Ve druhé fázi celonárodní observační studie mezi červnem 2021 a březnem 2022 byl PIMS-TS diagnostikován u dalších 222 dětí. Zatímco při převažující variantě delta byl výskyt PIMS-TS vysoký, ve fázi převažující varianty omikron poklesl ve vztahu k počtu pozitivně testovaných na čtvrtinu. Tato zjištění jsme publikovali v časopisu Journal of Pediatrics and Child Health.(9) Celkově tedy v ČR onemocnělo stavem označovaným jako PIMS-TS 429 dětí v období od listopadu 2020 do března 2022. Nebyly zjištěny žádné případy úmrtí a vzhledem k metodice sběru dat je nanejvýš pravděpodobné, že k žádnému úmrtí skutečně nedošlo (obr. 2).
Image 2. Průběh pandemie covidu-19 v České republice a celonárodní observační studie PIMS-TS. Údaje o průběhu pandemie dle ÚZIS. 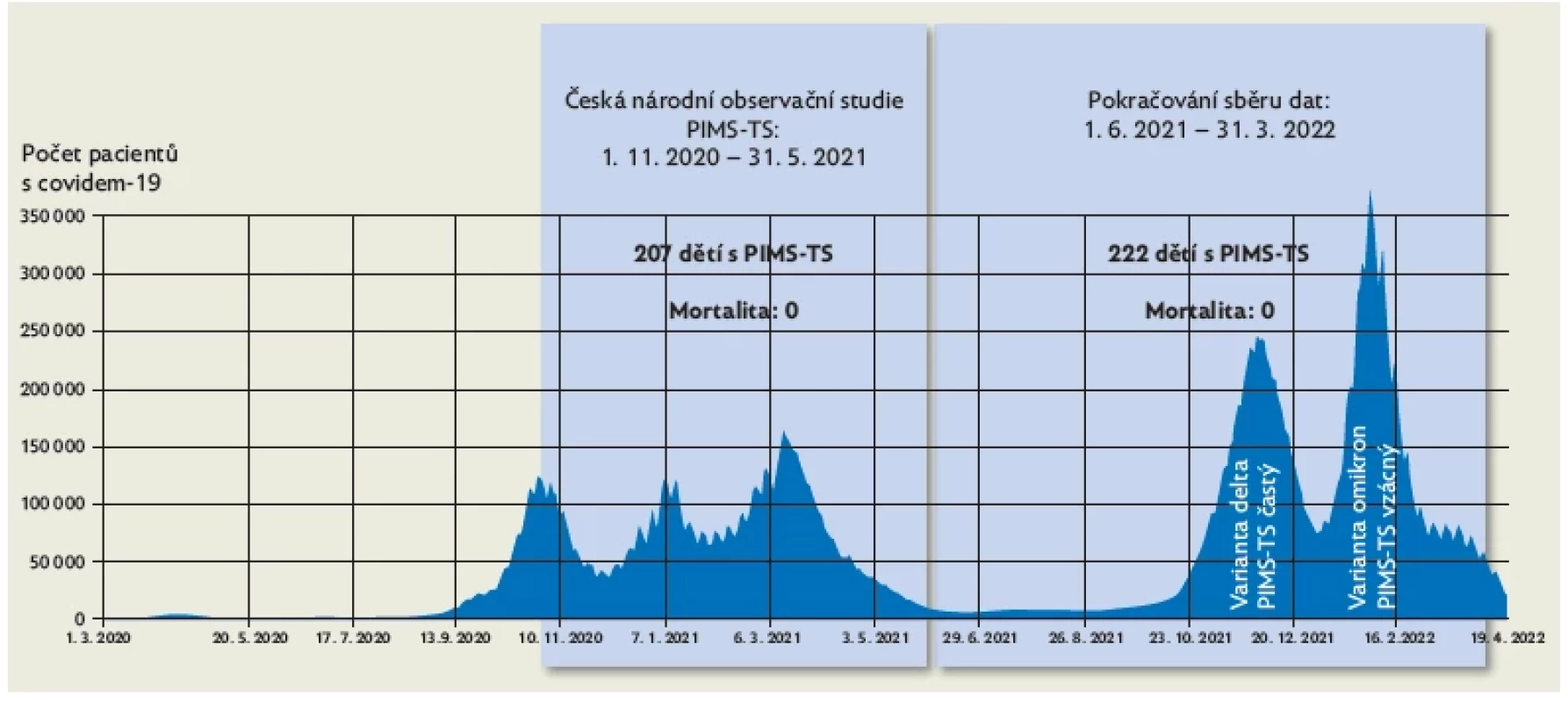
Diskuse
V předkládané studii je popsána celonárodní kohorta pacientů s PIMS-TS. Detailně jsou zpracována data 207 dětí a dospívajících z první části sběru dat mezi listopadem 2020 a květnem 2021. Některé demografické a klinické charakteristiky byly podobné dříve publikovaným zahraničním studiím. Jednalo se především o střední věk manifestace (osm let), délku trvání horečky (pět dní), převahu mužského pohlaví (64 %) nebo přítomnost gastrointestinálních příznaků (84 %) v úvodu onemocnění.(5,8) Námi popisovaná incidence PIMS-TS počítaná na počty pozitivních testů (1 : 1127) bude zřejmě vyšší než „skutečná“ incidence, vztažená na všechny nakažené jedince, jejichž celkové počty nejsou reálně známy.
Kardiovaskulární postižení patří mezi nejčastější a nejzávažnější příčiny morbidity pacientů s PIMS-TS. V naší kohortě se určitý stupeň dysfunkce levé komory vyskytl u téměř 40 % pacientů, přičemž v zahraničních publikacích bývá v závislosti na definici a vstupních kritériích jednotlivých studií nejčastěji uváděna dysfunkce levé komory u 50–60 % pacientů.(10) Postižení koronárních arterií bylo v námi popisovaném souboru přítomno u 11 % jedinců, což odpovídá zahraničním údajům (8–24 %).(10)
Poruchy rytmu a jiné EKG změny jsou u pacientů s PIMS - -TS časté. Častěji jsou převodními poruchami ohroženi pacienti s komorovou dysfunkcí.(11) V naší kohortě byly změny na EKG popisovány u 34 % pacientů. Nejčastěji se jednalo o nespecifické změny repolarizační fáze (n = 42), u deseti pacientů byl popsán AV blok prvního stupně a u jednoho pacienta AV blok druhého stupně. U žádného z nich však nebyly tyto změny zjištěny během následného sledování v odstupu jednoho až šesti měsíců.
Většina pacientů (90 %) měla při přijetí pozitivní sérologii ve třídě IgG SARS-CoV-2. Tento fakt se ukazuje jako důležitý prediktivní diagnostický parametr, který pomůže odlišit PIMS-TS od akutního průběhu covidu-19 nebo Kawasakiho nemoci.(12) Právě Kawasakiho nemoc často způsobuje diferenciálně diagnostické problémy. Další pomocný parametr představuje počet krevních destiček. V recentně publikované studii byl u pacientů s PIMS-TS popsán významně nižší počet krevních destiček (188 × 109/l) v porovnání s pacienty s Kawasakiho nemocí (383 × 109/l).(13) Podobně i v naší studii byl medián počtu trombocytů 172 × 109/l (rozmezí 40–831). PIMS-TS se také objevuje v porovnání s Kawasakiho nemocí (šest měsíců – pět let) ve vyšším věku.(14) Vysvětlením může být přetrvávající aktivita brzlíku u mladších dětí, která brání závažným a invazivním formám infekce SARS-CoV-2, a tím i rozvoji PIMS-TS.(15) Na rozdíl od Kawasakiho nemoci je u PIMS-TS také častěji přítomna dysfunkce levé komory, která je u pacientů s Kawasakiho nemocí bez postižení koronárních arterií vzácná.(7,10)
Třetina pacientů naší kohorty měla neurologické příznaky, podobně jako v jiných, dříve publikovaných studiích (15 – 40 %).(16–19) K rozvoji neurologické symptomatologie může při PIMS-TS vést alterace jak periferního, tak i centrálního nervového systému. Nejčastěji se jedná o bolest hlavy, meningismus, zmatenost, křeče, poruchu vědomí, dysartrii nebo dysfagii, cerebrální ataxii, svalovou slabost, hyporeflexii nebo elektroencefalografické změny (pomalá aktivita). Při vyšetření mozkomíšního moku bývá likvor obvykle negativní.( 16) Poškození centrálního nervového systému může u infekce SARS-CoV-2 být přímé nebo nepřímé. U PIMS-TS se spíše uplatňuje nepřímý mechanismus. Zvažuje se poškození při imunitně zprostředkovaném zánětu (tzv. cytokinové bouři), která je spojena s vysokou produkcí prozánětlivých cytokinů (IL-1β, IL-2, IL-6, IL-7, IL-8, IL-10, IL-17, INF-γ, TNF-α). Tyto působky vedou k endoteliálnímu poškození a sekundární alteraci neuronů. Nepřímým mechanismem je hyperkoagulační stav asociovaný s PIMS-TS. V krajních situacích může tento stav vést k mozkové arteriální trombóze s následnou mozkovou ischemií.(16–19) Nutno připomenout, že porucha vědomí může být i projevem těžké srdeční dysfunkce při nízkém srdečním výdeji a následné hypoperfuzi mozku. V naší kohortě jsme také popsali prvního dětského pacienta s PRES rozvinutým jako komplikace PIMS-TS.(20)
Covid-19 je spojován s trombotickými komplikacemi, ale embolické příhody jsou v pediatrické populaci – na rozdíl od dospělých – vzácné. Pacienti s PIMS-TS mají nejvyšší incidenci (6,5 %) trombotických komplikací ve skupině dětí starších dvanácti let, oproti akutnímu průběhu covidu-19 (2,1 %) nebo asymptomatické infekci SARS-CoV-2 (0,7 %).(21) V naší studii byl medián koncentrace D-dimerů 2 263 μg/l (rozmezí 185 – 35 000). Navzdory tomu byla trombóza (tromby v levé srdeční komoře) potvrzena pouze u dvou pacientů (1 %), konkrétně u sedmnáctiletého chlapce a osmileté dívky.
U PIMS-TS se popisuje rozvoj akutního poškození ledvin až ve 41 % případů.(22) V naší studii byl medián koncentrace kreatininu 43 μmol/l (rozmezí 16–300), oligo - či anurie se přechodně rozvinula v 56 případech (27 %).
Dle publikovaného systematického přehledu je u PIMS - -TS (n = 953) popsáno celkem osmnáct úmrtí (1,9 %).(8) V námi sledovaném období nebyl v ČR, na rozdíl od jiných zemí, hlášen žádný fatální případ. Domníváme se, že je to způsobeno spíše dobře fungujícím systémem pediatrické péče než méně závažným klinickým průběhem PIMS-TS. Situaci zřejmě dopomohla i možnost čerpat ze zahraničních zkušeností, kde se s PIMS-TS a nutností jeho léčby setkali dříve, než se objevil u nás. Podobně i reziduální srdeční nález byl přítomen pouze u dvou pacientů (1,2 %). Ve srovnání s dříve publikovanými daty je to významně nižší počet (7,3 %).(8) S výjimkou jednoho pacienta s neurologickým deficitem není známa žádná jiná reziduální morbidita. Většina (83 %) pacientů dostávala duální léčbu intravenózními imunoglobuliny a systémovými kortikosteroidy. Tato kombinace může být spojena s lepším průběhem, a může tak přispívat k nízké nemocnosti a úmrtnosti v naší kohortě.(23)
Poděkování
Všem českým, moravským i slezským pediatrům patří poděkování a uznání za osobní podíl při zvládnutí pandemie covidu-19 u dětí, a zejména za včasnou diagnostiku dětí s PIMS-TS.
Korespondenční adresa:
MUDr. Jan David, Ph.D.
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
jan.david@centrum.cz
Sources
1. Cattalini M, Della Paolera S, Zunica F, et al. Defining Kawasaki disease and pediatric inflammatory multisystem syndrome-temporally associated to SARS-CoV-2 infection during SARS-CoV-2 epidemic in Italy: results from a national, multicenter survey. Pediatr Rheumatol Online J 2021; 19(1): 29.
2. Harwood R, Allin B, Jones CE, et al. A national consensus management pathway for paediatric inflammatory multisystem syndrome temporally associated with COVID-19 (PIMS-TS): results of a national Delphi process. Lancet Child Adolesc Health 2021; 5 (2): 133–41.
3. Klocperk A, Parackova Z, Dissou J, et al. Case report: Systemic inflammatory response and fast recovery in a pediatric patient with COVID-19. Front Immunol 2020; 11 : 1665.
4. Fencl F, Sibikova M, David J, et al. Syndrom multisystémové zánětlivé odpovědi asociovaný s COVID-19 u dětí. Doporučený postup ČPS ČLS JEP. Ces - -slov Pediat 2021; 76(1): 4–9.
5. Feldstein L. Characteristics and outcomes of US children and adolescents with multisystem inflammatory syndrome in children (MIS-C) compared with severe acute COVID-19. JAMA 2021; 325(11): 1074–87.
6. World Health Organization. Multisystem inflammatory syndrome in children and adolescents with COVID-19. Dostupné na: https://www.who.int/ publications/i/item/multisystem-inflammatory-syndrome-in children-and - -adolescents-with-covid-19
7. David J, Stará V, Hradský O, et al. Nationwide observational study of paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (PIMS-TS) in the Czech Republic. Eur J Pediatr 2022; 181 : 3663–72.
8. Hoste L, Van Paemel R, Haerynck F. Multisystem inflammatory syndrome in children related to COVID-19: a systematic review. Eur J Pediatr 2021; 180 : 2019–34.
9. David J, Hradsky O, Jabandziev P, et al. Impact of SARS-CoV-2 variants on the incidence of paediatric inflammatory multisystem syndrome (PIMS-TS). J Paediatr Child Health 2022; 58 : 1901–3.
10. Alsaied T, Tremoulet AH, Burns JC, et al. Review of cardiac involvement in multisystem inflammatory syndrome in children. Circulation 2021; 143 : 78–88.
11. Dionne A, Mah DY , Son MBF, et al. Atrioventricular block in children with multisystem inflammatory syndrome. Pediatrics 2020; 146: e2020009704.
12. Rostad CA, Chahroudi A, Mantus G, et al. Quantitative SARS-CoV-2 serology in children with multisystem inflammatory syndrome (MIS-C). Pediatrics 2020; 146: e2020018242.
13. Yeo WS, Ng QX. Distinguishing between typical Kawasaki disease and multisystem inflammatory syndrome in children (MIS-C) associated with SARS - -CoV-2. Med Hypotheses 2020; 144 : 110263.
14. Toubiana J, Poirault C, Corsia A, et al. Kawasaki-like multisystem inflammatory syndrome in children during the covid-19 pandemic in Paris, France: prospective observational study. BMJ 2020; 369: m2094.
15. Güneş H, Dinçer S, Acıpayam C, et al. What chances do children have against COVID-19? Is the answer hidden within the thymus? Eur J Pediatr 2021; 180 : 983–6.
16. Chen TH. Neurological involvement associated with COVID-19 infection in children. J Neurol Sci 2020; 418 : 117096.
17. Aghagoli G, Gallo Marin B, Katchur NJ, et al. Neurological involvement in COVID-19 and Potential mechanisms: a review. Neurocrit Care 2021; 34 : 1062–71.
18. Abdel-Mannan O, Eyre M, Löbel U, et al. Neurologic and radiographic findings associated with COVID-19 infection in children. JAMA Neurol 2020; 77 : 1440–45.
19. Lad SS, Kait SP, Suryawanshi PB, et al. Neurological manifestations in pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (PIMS-TS). Indian J Pediatr 2021; 88 : 294–5.
20. David J, Toni L, Fencl F, et al. Posterior reversible encephalopathy syndrome – a rare complication of COVID-19 MIS-C. Klin Padiatr 2022. doi: 10.1055/a-1690-7583
21. Whitworth HB, Sartain SE, Kumar R, et al. Rate of thrombosis in children and adolescents hospitalized with COVID-19 or MIS-C. Blood 2021; 5: blood. 2020010218.
22. Deep A, Upadhyay G, du Pré P, et al. Acute kidney injury in pediatric inflammatory multisystem syndrome temporally associated with severe acute respiratory syndrome coronavirus-2 pandemic: experience from PICUs across United Kingdom. Crit Care Med 2020; 48 : 1809–18.
23. Ouldali N, Toubiana J, Antona D, et al. Association of intravenous immunoglobulins plus methylprednisolone vs immunoglobulins alone with course of fever in multisystem inflammatory syndrome in children. JAMA 2021; 325 : 855–64.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 6-
All articles in this issue
- Bohumil Kubišta: Cirkus
- Co jsme psali
- Editorial
- Století Ervína Adama a příběh eradikace poliomyelitidy
- Poliomyelitis and eradication problems
- Epidemiological and clinical characteristics of paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (PIMS-TS) in the Czech Republic
- Clostridioides difficile infection in children hospitalised in Motol University Hospital
- Treatment of sleep disordered breathing with non-invasive positive pressure ventilation (NIV) – our experience
- Different perspective of the consequences of CAN syndrome
- Nomophobia in pediatric population
- Supracondylar fractures of humerus in children – overview
- Morbidity of children under 2 years of age in the districts with different degrees of air pollution
- Inborn errors of amino acid, organic acid metabolism and disorders of the urea cycle
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inborn errors of amino acid, organic acid metabolism and disorders of the urea cycle
- Supracondylar fractures of humerus in children – overview
- Epidemiological and clinical characteristics of paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (PIMS-TS) in the Czech Republic
- Treatment of sleep disordered breathing with non-invasive positive pressure ventilation (NIV) – our experience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


