-
Medical journals
- Career
Dlouhodobé dopady předčasného porodu na respirační systém u dětí
Authors: J. Tuková; P. Koťátko
Authors‘ workplace: Klinika pediatrie a dědičných poruch metabolismu 1. LF UK a VFN, Praha
Published in: Čes-slov Pediat 2020; 75 (7): 393-400.
Category:
Overview
Předčasný porod je asociován se zvýšenou respirační morbiditou a mortalitou. Závažnost trvalých strukturálních a funkčních změn obvykle narůstá nepřímo úměrně gestačnímu věku a porodní váhové kategorii. Chronické plicní postižení z nezralosti se rozvíjí především u dětí z těžké (porod ve 28. až 31. gestačním týdnu) a extrémní prematurity (porod před ukončeným 28. týdnem) a jeho rozvoj nemusí být podmíněn stanovením diagnózy bronchopulmonální dysplazie.
Přestože pokroky moderní medicíny v oblasti dechové podpory i farmakoterapie zmírňují dopady předčasného porodu na křehký vyvíjející se respirační systém, zároveň vedou k celkovému nárůstu počtu dětí s těžce nevyzrálým respiračním systémem. Celkový počet dětí se závažným CLDI se tak nemění. Nezralost i řada dalších přídatných faktorů mohou vést k trvalému postižení respiračního systému, jehož klinická manifestace se v průběhu dětského věku spíše zmírňuje, do dospělosti však přetrvává funkční i strukturální abnormita s nejistou prognózou.
Klíčová slova:
prematurita – bronchopulmonální dysplazie – chronické plicní postižení z nezralosti – vývoj plic – funkční plicní vyšetření
ÚVOD
V současnosti se celosvětově narodí kolem 11 % novorozenců před ukončeným 37. týdnem gestace [1]. Riziko závažných respiračních následků předčasného porodu stoupá nepřímo úměrně s klesajícím gestačním věkem při porodu a váhovou kategorií plodu [2]. V praxi je diagnóza bronchopulmonální dysplazie (BPD) stanovena přibližně u 45 % dětí z extrémní nezralosti [3] (u téměř 80 % dětí narozených ve 23. gestačním týdnu vs. u 20 % dětí narozených ve 28. gestačním týdnu [4]). Nicméně bez ohledu na závažnost nezralosti či naplnění kritérií diagnózy BPD mají děti narozené předčasně vyšší riziko respiračních obtíží [5].
TERMINOLOGIE
Nezralost respiračního systému se obvykle projeví záhy po porodu rozvojem syndromu dechové tísně (respiratory distress syndrome, RDS). Klinické projevy zvýšeného dechového úsilí převážně odrážejí nedostatečnou produkci surfaktantu, kdy přetrvává vysoké povrchové napětí v alveolu významně zvyšující tuhost plíce a riziko atelektatických změn. V případě těžké a především extrémní nezralosti je v následných dnech a týdnech nutná přístrojová dechová podpora, neboť je k ventilaci nucena plíce, ve které se teprve začíná tvořit nezralá tenkostěnná bariéra mezi vzduchem a krví.
Řadu let je věnováno veliké úsilí snaze vytipovat na konci novorozeneckého období děti, u nichž došlo k rozvoji závažných strukturálních a funkčních změn s vysokým rizikem celoživotního onemocnění. Pro takto perinatálně hodnocený stav bývá rezervován termín bronchopulmonální dysplazie (BPD), jehož definice se neustále vyvíjí [6]. Pro dlouhodobé plicní onemocnění spojené s klinickými příznaky, které nastává u dětí z nezralosti bez ohledu na stanovení diagnózy BPD, je používán termín chronické plicní postižení z nezralosti (chronic lung disease of immaturity, syn. chronic lung disease of infancy, CLDI).
DIAGNÓZA BRONCHOPULMONÁLNÍ DYSPLAZIE
V roce 1967 Northway původně označil jako BPD těžké fibroproliferativní onemocnění plic u dětí narozených ve 31., resp. 34. gestačním týdnu, které byly vystaveny náročným ventilačním režimům i vysokým inhalačním koncentracím kyslíku (tzv. „old“ BPD, obr. 1, 2) [7]. Nové medicínské poznatky v oblasti přístrojové ventilační techniky i farmakoterapie (antenatální steroidy, surfaktant) však umožnily přežití dětem i z extrémní nezralosti a zásadně proměnily obraz BPD. Současná podoba BPD (tzv. „new“ BPD, obr. 3, 4) odpovídá komplexnímu narušení vývoje těžce nezralých struktur dýchacích cest, plicního parenchymu i kapilárního řečiště [8]. Diagnóza BPD se v klinické praxi zatím stále opírá o nároky na dechovou podporu a kyslíkovou terapii v arbitrárně stanoveném termínu [9, 10]. Toto hodnocení však často zkreslují dočasné i dlouhodobější komorbidity.
Image 1. Skiagram hrudníku 3měsíčního chlapce narozeného ve 24. gestačním týdnu, nález těžkých fibroproliferativních a emfyzematózních změn připomíná obraz „old“ BPD (archiv Radiodiagnostické kliniky 1. LF UK a VFN).
Fig. 1. Chest X-ray of a 3-month-old boy born in the 24th gestational week, the finding of severe fibroproliferative and emphysematous changes resembles the image of „old“ BPD (archive of the Department of Radiology, First Faculty of Medicine, Charles University and General University Hospital in Prague).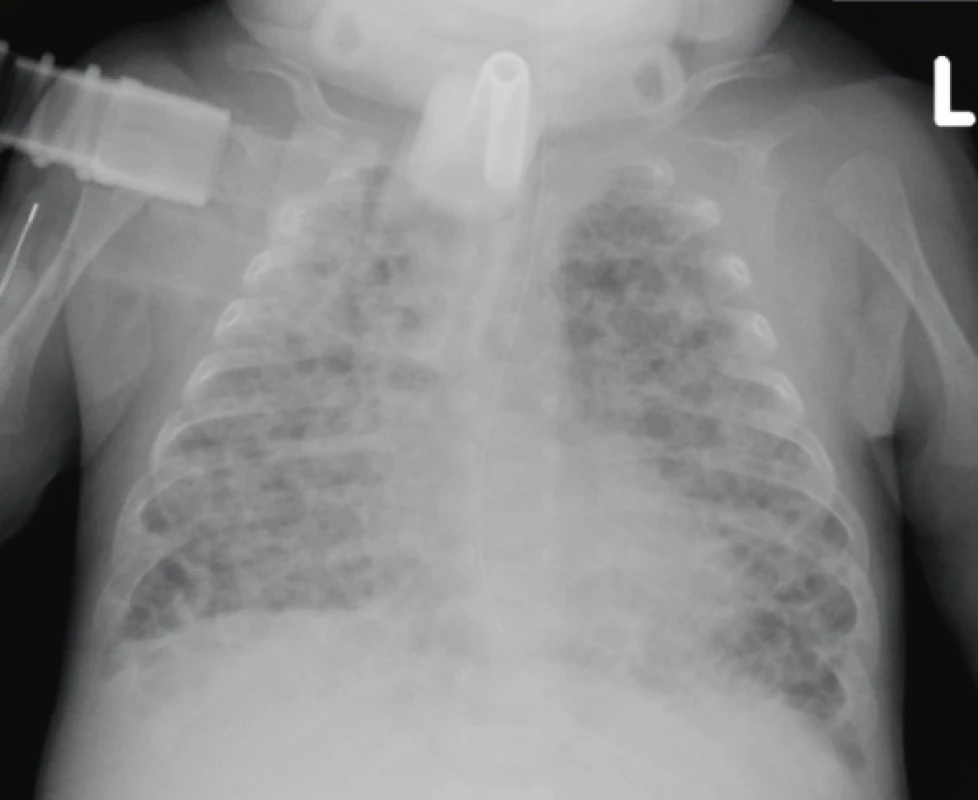
Image 2. Počítačová tomografie plic u stejného chlapce s těžkými bulózními a emfyzematózními změnami při fibroproliferativní přestavbě plíce připomíná obraz „old“ BPD (archiv Radiodiagnostické kliniky 1. LF UK a VFN).
Fig. 2. Chest computed tomography scan in the same boy with severe bullous and emphysematous changes as a consequence of fibroproliferative lung remodelling resembles the image of „old“ BPD (archive of the Department of Radiology, First Faculty of Medicine, Charles University and General University Hospital in Prague).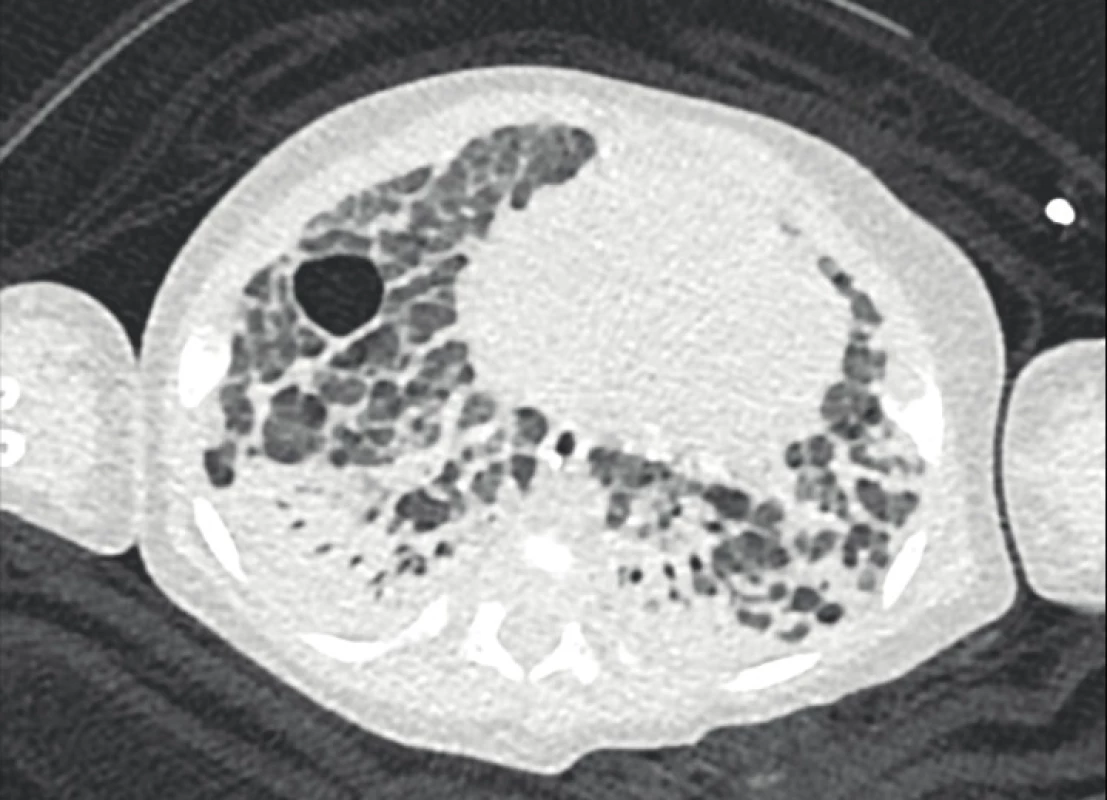
Image 3. Na skiagramu hrudníku u dívky narozené ve 27. gestačním týdnu s mírnou formou BPD je patrná povšechně snížená vzdušnost obou plic odpovídající nálezu „new“ BPD (archiv Radiodiagnostické kliniky 1. LF UK a VFN).
Fig. 3. The chest X-ray of a girl born in the 27th gestational week with a mild form of BPD shows a generally reduced airiness of both lungs corresponding to the finding of „new“ BPD (archive of the Department of Radiology, First Faculty of Medicine, Charles University and General University Hospital in Prague).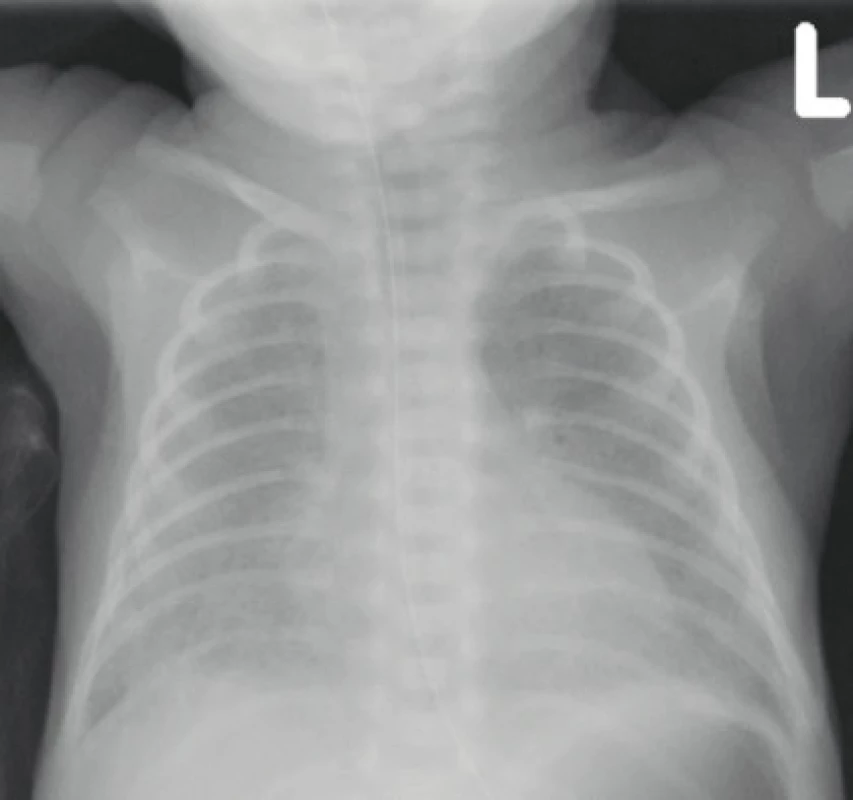
Image 4. Na skiagramu hrudníku u dívky narozené ve 24. gestačním týdnu s těžkou formou BPD a nutností přechodné domácí oxygenoterapie je ve 4 týdnech věku patrná hyperinflace obou plic a nehomogenní stíny a skvrnité konsolidace ve všech plicních polích. I přes postižení odpovídající spíše nové formě BPD jsou zjevná i ložiska svědčící pro zánětlivé a jizevnaté změny (archiv Radiodiagnostické kliniky 1. LF UK a VFN).
Fig. 4. The chest X-ray of a 4-weeks-old girl born in the 24th gestational week with severe BPD and the need for transient home oxygen therapy, the hyperinflation of both lungs and inhomogeneous shadows and spotted consolidation in all lung fields are obvious. Despite the changes corresponding to a new form of BPD, foci of obvious inflammatory and scarring changes are also evident (archive of the Department of Radiology, First Faculty of Medicine, Charles University and General University Hospital in Prague).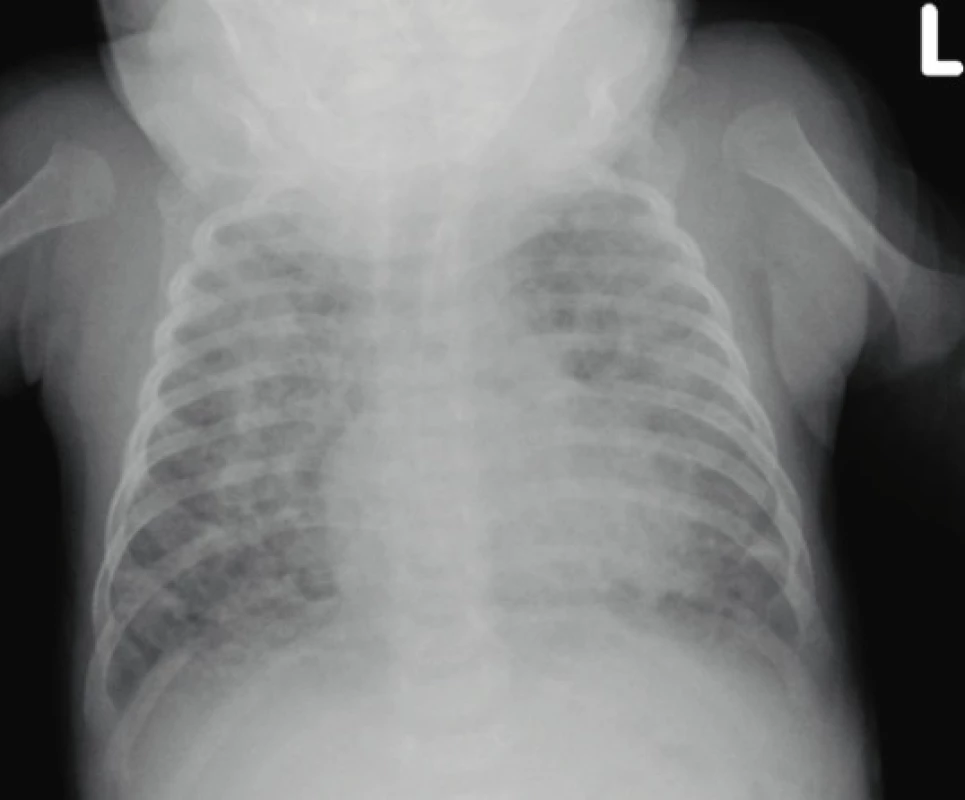
Mezi časté přídatné faktory ovlivňující přesnost stanovení diagnózy BPD patří postižení centrálního nervového systému (intrakraniální krvácení, infekce, porucha likvorového systému), malacie dýchacích cest, postintubační stenóza, pneumonie, plicní apoplexie, pneumotorax či klinicky významná plicní hypertenze. V současnosti pokračuje intenzivní výzkum ve snaze nalézt definici, která by se více blížila patofyziologické podstatě onemocnění a věrněji predikovala rozvoj CLDI [11].
PATOGENEZE
V případě extrémní nezralosti se novorozenec rodí na konci kanalikulárního období plicního vývoje, kdy se začínají tvořit první generace respiračních bronchiolů a první terminální tenkostěnné váčky. Surfaktant se poprvé objevuje činností pneumocytů typu II kolem 24. gestačního týdne, jeho významnější množství je však produkováno až po 28. gestačním týdnu. In utero je další buněčné dělení a vývoj plíce stimulován v prostředí s nižším parciálním tlakem kyslíku jemnými fetálními dechovými pohyby i cirkulací intrapulmonální tekutiny vytvářející mírně pozitivní tlak. Okamžikem předčasného porodu jsou nezralé struktury dýchacích cest, epitelií i kapilár náhle vystaveny nefyziologicky vysokým a nestabilním koncentracím kyslíku (21 % ve vzduchu versus 4 % in utero), prudké změně mechaniky dýchání s možným rozvojem závažného traumatu (barotrauma, volumotrauma, atelektotrauma, biotrauma) i zánětlivým změnám [12]. Biochemicky nezralá plíce, jíž chybí efektivní antioxidační a antiproteázová aktivita, čelí oxidačnímu stresu, infekčním komplikacím, i široké škále xenobiotik. Rozvíjí se výrazná zánětlivá odpověď na tkáňové poškození, která může být dále potencována rozvojem sepse. Na plicním postižení se podílí i abnormální reparace a hojení tkáně.
Plicní postižení se často nerozvíjí až v okamžiku porodu, ale řada antenatálních příčin abnormálního plicního vývoje je asociována s rizikem předčasného porodu a dále prohlubuje vývojové postižení plíce. Patří sem vrozená vnímavost ke strukturálním změnám, malnutrice matky a plodu (plicní postižení u dětí s fetální růstovou retardací), infekce plodových obalů či vliv chemických látek včetně kouření cigaret, užívání léků a drog. Celoživotní následky nezralosti na respirační trakt dále významně ovlivní i další postnatální vývoj respiračního systému v prvních letech života. Novorozenec narozený v termínu má vytvořeno okolo 10 až 15 % z konečného počtu alveolů. V prvních 2 až 4 letech dochází k dalšímu zásadnímu nárůstu počtu alveolů na konečných 300 až 600 milionů.
Komplikované respirační infekce v prvních letech věku, často probíhající pod obrazem bronchiolitid či broncho-pneumonií, mohou závažně zasáhnout období intenzivní plicní alveolarizace a prohloubit dopady nezralosti na respirační zdraví. Na vysoké frekvenci respiračních infekcí se v prvních letech věku podílí porucha imunitních funkcí spojená s abnormním vývojem imunitního systému (nefyziologická antigenní stimulace, chybějící přenos protilátek intrauterinně ve 3. trimestru, odlišný mikrobiom apod.). Závažný průběh respiračních infekcí s vysokým rizikem rozvoje respirační insuficience souvisí ale především s vlastním strukturálním postižením plic a dýchacích cest a s tím související sníženou dechovou rezervou.
PATOFYZIOLOGIE
Závažným zásahem do vývoje plicní tkáně často dochází k narušení struktury a funkce plicního parenchymu, k postižení dýchacích cest i k abnormálnímu vývoji kapilárního plicního řečiště. Typický histologický obraz plicní tkáně dítěte se současnou podobou BPD („new“ BPD) odpovídá především nižšímu zastoupení alveolů, které jsou dilatované a méně septované, provázených redukovanou plicní kapilární sítí. V souladu s tímto nálezem počítačová tomografie hrudníku zobrazí nerovnoměrné postižení plic se zastoupením ložisek fibrózy, emfyzematických i atelektatických oblastí (obr. 5). Dochází ke změně plicní poddajnosti, zvýšení mrtvého prostoru i prohloubení ventilačně-perfuzního nepoměru s možným nárůstem zkratové cirkulace. Vyšetření plicní difuze odhalí u řady dětí poruchu funkce alveolokapilární membrány, na čemž se podílí i jednodušší kapilární síť provázená odlišnou cévní reaktivitou.
Image 5. Počítačová tomografie hrudníku s vysokým rozlišením u 11letého chlapce narozeného ve 28. gestačním týdnu s BPD. Nález lineárních opacit subpleurálně, okrsky air-trappingu ve všech plicních lalocích, které se na výdechových skenech dále zvýrazňují, bulózní tenkostěnné dutiny zcela bez plicní architektury (archiv Radiodiagnostické kliniky 1. LF UK a VFN).
Fig. 5. Chest high-resolution computed tomography of an 11-year-old boy born in the 28th gestational week with BPD. Finding of subpleural linear opacities, areas of air-trapping in all lung lobes, which are further highlighted on expiratory scans, bullous thin-walled cavities completely without lung architecture (archive of the Department of Radiology, First Faculty of Medicine, Charles University and General University Hospital in Prague).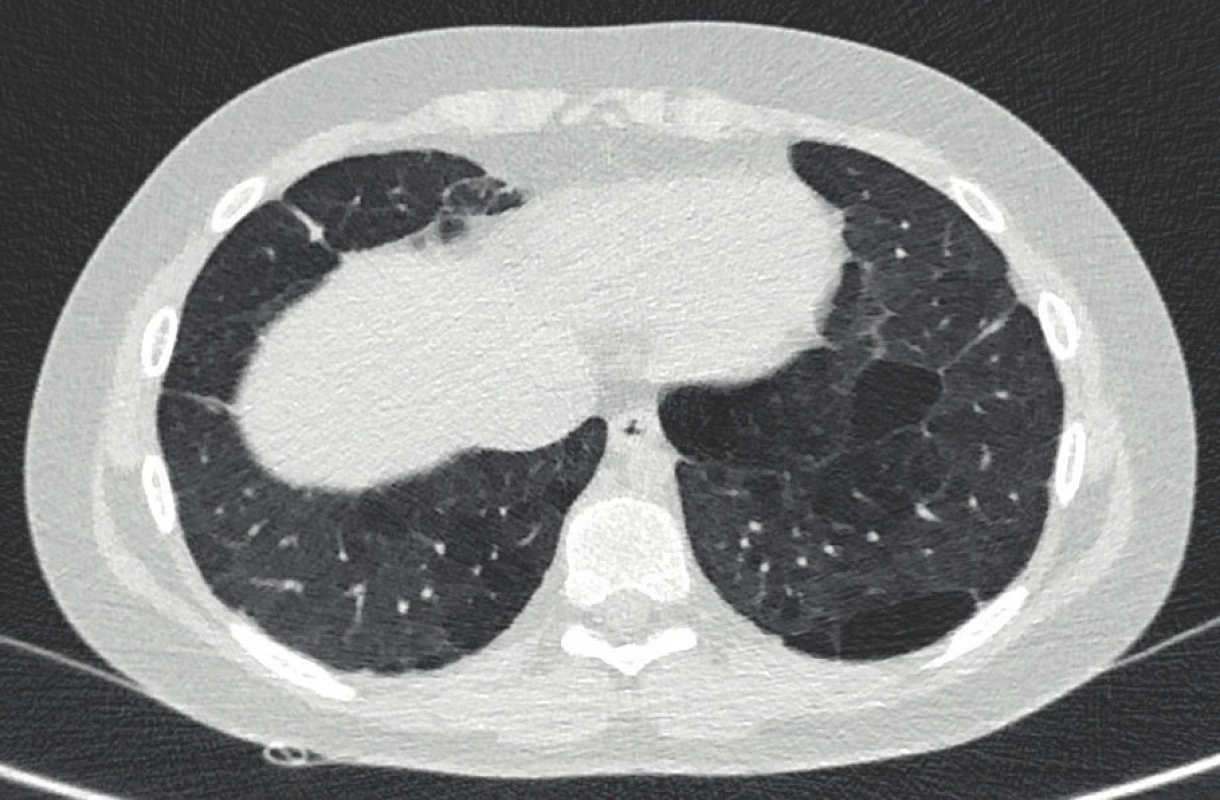
U závažnějších stavů se rozvíjí plicní hypertenze, jejíž tíži i dynamiku je třeba pečlivě monitorovat a léčit. Neméně funkčně významné je i postižení dýchacích cest. Abnormní vývoj plicní tkáně vede k nižšímu zastoupení elastických vláken v plicním parenchymu. Tato vlákna za běžných podmínek pomáhají stabilizovat průsvit distálních bronchů a bronchiolů, které již neobsahují chrupavčitou výztuž. Dýchací cesty bez této opory snáze podléhají předčasnému kolapsu se zadržením vzduchu uvnitř plíce. Stav ještě umocňuje hypoplazie dýchacích cest a hyperplazie buněk hladké svaloviny ve stěně průdušek, jež se podílí na často pozorované parciálně reverzibilní bronchiální obstrukci.
KLINICKÉ OBTÍŽE
V prvních měsících věku se plicní postižení obvykle manifestuje klidovou tachydyspnoí. U části dětí nemusí být v klidu ventilační problém zjevný a projeví se až při zátěži, kterou v tomto věku představuje pláč, příjem stravy, respirační infekce a věku příslušná pohybová aktivita či fyzioterapie. Zpočátku se tak dyspnoe prohloubí při pití jeho přerušováním, příjmem nižší dávky mléka. Příjem stravy i pláč může být provázen cyanózou či kašlem. Zvýšené dechové úsilí vynikne zprvu v poloze na bříšku, později při vyšší fyzické aktivitě. Poslechově nemusí být v útlém věku slyšitelné spastické fenomény, dechový diskomfort se projeví paradoxním dýcháním, zatahováním mezižebří, podžebří i jugula a tachypnoí. V prvních dvou letech jsou děti z extrémní a těžké nezralosti výrazně náchylné k virovým infekcím dolních dýchacích cest, asi 50 % dětí s BPD je z této příčiny v prvním roce hospitalizováno. Souvisejícím nálezem u dítěte se zvýšenou dechovou prací může být neprospívání, zvýšená dráždivost či zpomalení vertikalizace.
V prvních dvou letech mají děti narozené z těžké a extrémní nezralosti významně vyšší frekvenci vážněji probíhajících respiračních infekcí. U dětí s diagnózou BPD obvykle riziko rehospitalizací, chronického kašle, pískotů a četnosti podávání inhalační terapie ještě dále stoupá [13]. Přestože se závažnost obtíží s růstem spíše zmírňuje, přetrvává strukturální abnormita podle počítačové tomografie do dospělosti. Navíc vykazují děti narozené předčasně i ve starším školním věku častěji příznaky spojené s bronchiální hyperreaktivitou, mají sníženou toleranci zátěže, zvýšenou spotřebu inhalačních léků a často jsou sledovány pod diagnózou průduškové astma. Přibližně polovina z těchto dětí má nález bronchiální obstrukce na spirometrii (obr. 6) [14].
Image 6. Spirometrická křivka metodou průtok-objem v klidu (modrá křivka) a po krátké zátěži (červená křivka) u stejného chlapce jako v případě CT nálezu na obr. 5, plánovaný 8minutový zátěžový test během byl předčasně ukončen pro rozvíjející se dušnost. 
Na počítačové tomografii hrudníku mohou být patrná emfyzematózní ložiska, subpleurální a lineární opacity a známky air-trappingu na výdechových skenech (obr. 5). Do dospělosti obvykle přetrvávají i nižší parametry plicní difuze a snížená tolerance zátěže dle spiroergometrie [15].
MANAGEMENT A TERAPIE
U malého procenta dětí s BPD přetrvává porucha oxygenace i po dosažení původního termínu porodu a tyto děti jsou předávány k ambulantnímu sledování se zajištěním dlouhodobé domácí oxygenoterapie. Používaným zdrojem bývá rezervoár kapalného kyslíku přiváděný dítěti formou nosních brýlí s možností regulace průtoku od 0,05 do 2 litrů/min), na transport jsou rodiče vybaveni přenosným zásobníkem tekutého kyslíku. Potřeba oxygenoterapie se obvykle během prvního roku snižuje a domácí oxygenoterapie bývá následně v druhém či třetím roce ukončována.
Děti narozené předčasně, které splní indikační kritéria, podstoupí opakovaně dle schématu pasivní imunizaci proti respiračnímu syncytiálnímu viru [16].
Obecně se doporučuje v časném období omezit expozici dítěte kolektivním zařízením a místům s vysokou koncentrací osob. Nejbližšímu okolí dítěte je třeba doporučit sezónní očkování proti influenze, v případě delšího odstupu zvážení přeočkování proti pertusi. Očkování proti influenze lze podávat v případě dobrého klinického stavu dětem nad 6 měsíců věku. Lze jednoznačně doporučit i vakcínu proti pneumokokům. Osoby pečující o dítě je třeba důrazně poučit o nutnosti prevence expozice kouření, otevřeným topeništím a dalším inhalačním škodlivinám.
Aktuálně chybí větší studie zabývající se následnou péčí o děti s CLDI po propuštění z porodnice. Letos vydala Evropská respirační společnost dlouho očekávané doporučené postupy zaměřené na management dětí s bronchopulmonální dysplazií [17]. Tato publikace konstatuje zásadní nedostatek prací týkajících se sledování a terapie dětí s CLDI. Navrhovaná doporučení jsou předkládaná především jako expertní názory, jejich opora ve vědeckém výzkumu je slabá. Publikace doporučuje dlouhodobé sledování plicních funkcí u dětí s BPD, vyšetření pomocí zobrazovacích metod s užitím ionizujícího záření má být naopak vyhrazeno pouze pro osoby se závažnými symptomy. Rutinní preskripce inhalační terapie není vhodná. Inhalační bronchodilatační léky mohou být přínosem u osob s výraznějšími klinickými příznaky, zvláště v případě průkazu reverzibility bronchiální obstrukce pomocí plicního funkčního vyšetření (obr. 7). Preskripci inhalačních či systémových kortikosteroidů lze zahájit u symptomatických osob pouze formou terapeutického testu, s časným zhodnocením efektu. Koncentrace oxidu dusnatého ve vydechovaném vzduchu (FeNO) svědčící pro eozinofilní zánět je u dětí s CLDI obvykle nízká. Toto měření představuje užitečný nástroj k odhalení možného rozvoje alergického průduškového astmatu [18], které se objeví asi u 10 % dětí, populaci předčasně narozených nevyjímaje. Práce dále navrhuje u těchto osob i udržování optimální saturace krve kyslíkem při kyslíkové terapii mezi 90 a 95 %.
Image 7. Průkaz parciální bronchiální reverzibility pomocí spirometrie průtok-objem u 15letého chlapce z těžké nezralosti: A) standardizovaný bronchodilatační test – 4 vstřiky ipratropia á 20 μg, B) standardizovaný bronchodilatační test – 4 vstřiky salbutamolu á 100 μg). 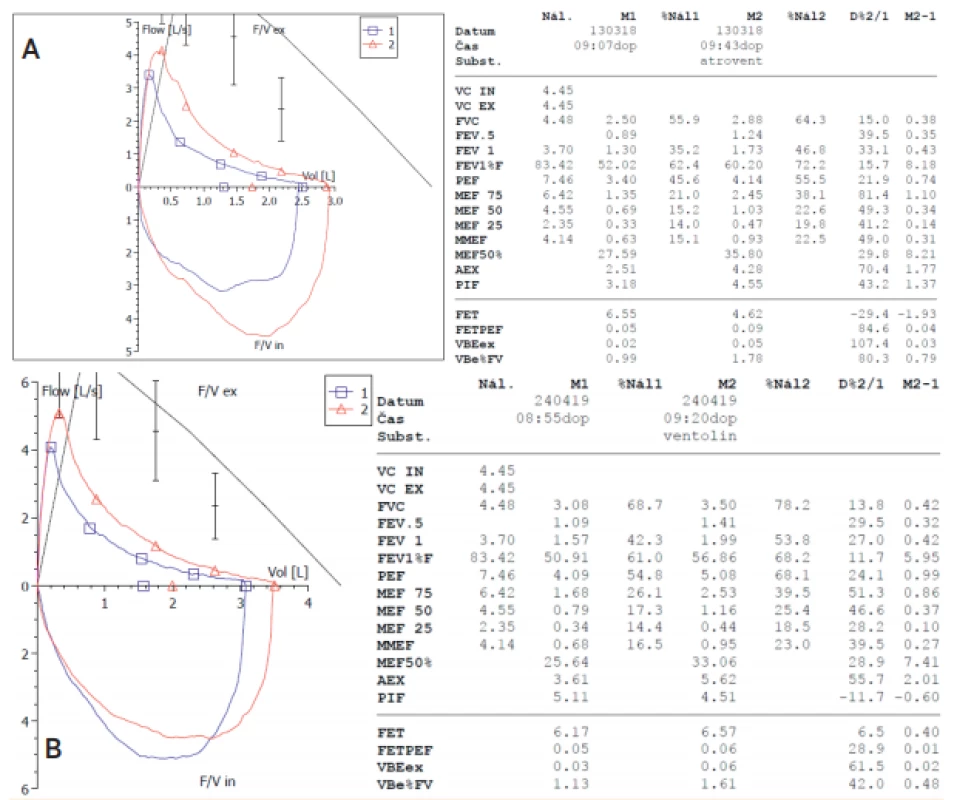
Na základě našich zkušeností a vzhledem k současné absenci studií doporučujeme posuzovat každé dítě zcela individuálně. Na základě zhodnocení klinického nálezu, dechových obtíží, tolerance fyzické zátěže, průběhu respiračních infekcí a opakovaného testování plicních funkcí zvažujeme případně inhalační terapii. Posoudit je však třeba i možný podíl dalších komorbidit na klinickém stavu, mimo jiné riziko rozvoje plicní hypertenze či přítomnost jiného kardiovaskulárního onemocnění, riziko aspirace provázející poruchu polykání při neurologickém postižení či paréze hlasivky, gastroezofageální reflux, syndrom spánkové apnoe a další. Pro rozhodování o léčbě jsou zásadní testy reverzibility případné bronchiální obstrukce s použitím účinných látek ze skupiny inhalačních beta-2-agonistů a parasympatolytik (obr. 7). Velmi cenné jsou i výsledky zátěžového spirometrického testu. Případné léky nasazujeme vždy formou terapeutického testu. Aktivně je třeba pátrat po rizikových faktorech rozvoje průduškového astmatu. Kombinace postižení respiračního systému nezralostí s rozvojem bronchiálního astmatu obvykle vede k závažnějším klinickým příznakům a včasné odhalení astmatické složky může zásadně zmírnit klinické obtíže a včasnou léčbou zabránit dalším ireverzibilním změnám plicních funkcí (obr. 8). Zjišťujeme přítomnost alergie či astmatu u jednostupňových příbuzných, monitorujeme alergické projevy u dítěte (alergická rhinitis, konjunktivitis, atopický ekzém, reakce na potraviny a další). Do screeningu alergického onemocnění patří i laboratorní vyšetření k ozřejmění případné atopie či eozinofilie, ev. senzibilizace na alergeny a případně i prick testy na nejčastější alergeny.
Image 8. Klidová spirometrie metodou průtok-objem u 7letého chlapce narozeného z extrémní nezralosti před nasazením léčby ukazující těžkou bronchiální obstrukci (modrá křivka), jasně pozitivní bronchodilatační test se 4 vstřiky salbutamolu s téměř plnou reverzibilitou (červená křivka), kontrolní vyšetření za 6 měsíců od nasazení inhalační kombinované terapie (inhalační kortikosteroidy + dlouhodobě působící bronchodilatancia) svědčí pro velmi významný terapeutický efekt s ústupem obstrukce dýchacích cest, přetrvává jen obstruktivní tvar spirometrické křivky (zelená křivka). Vzhledem k téměř plné reverzibilitě obstrukce a rozvoji alergických obtíží je u chlapce zvažována kombinace CLDI s alergickým průduškovým astmatem. 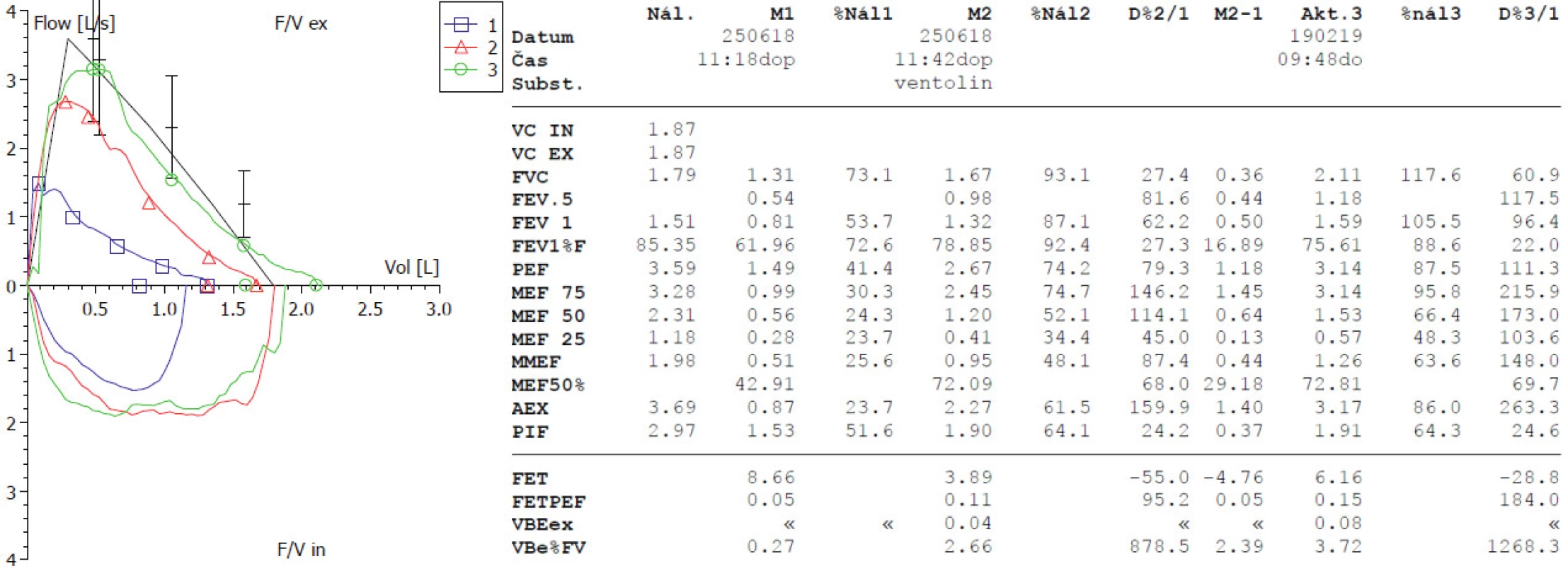
V případě chronických respiračních obtíží a průkazu reverzibilní obstrukce lze zvážit terapeutický test s dlouhodobě působícími bronchodilatačními léky. V případě akutních stavů u dětí s bronchiální hyperreaktivitou obvykle podáváme rychle působící bronchodilatační léky v podobném schématu jako u asthma bronchiale a léky vždy titrujeme podle klinické odpovědi. Argumentem pro dlouhodobé podávání inhalačních kortikosteroidů by neměla být samotná přítomnost astmatu podobných příznaků. Efekt těchto léků lze předpokládat především při kombinaci nezralosti s rozvojem průduškového astmatu (obr. 8). U vybraných dětí lze terapii inhalačními kortikosteroidy opět provést formou terapeutického testu a pokračovat v terapii pouze při objektivizaci jejich efektu.
VÝHLEDY DĚTÍ S CLDI DO DOSPĚLOSTI
Přibližně polovina dospělých osob s diagnózou BPD udává občasné známky obstrukce při dýchání (pískoty). Přibližně třetina z nich si stěžuje na noční dušnost a kašel. Kolem 40 % z těchto osob je sledováno s diagnózou průduškové astma a užívá antiastmatickou terapii [19].
Podle velkých prospektivních studií plicní funkce postupně narůstají a dosahují maximálních hodnot kolem 20. až 25. roku [20]. V případě narušení vývoje respiračního systému z různých příčin prenatálních či postnatálních dochází časně ke snížení parametrů plicních funkcí (dokumentováno např. na parametrech průchodnosti dýchacích cest), které sice v dalším období plynule stoupají, ale udržují se trvale pod pásmem normy (obr. 9). Přestože plicní funkce u zdravých jedinců po 25. roku zvolna klesají (např. FEV1 rychlostí přibližně o 20 ml za rok), vzhledem k dostatečné rezervě respiračního systému plíce nejsou při absenci respiračního onemocnění limitujícím orgánem přežití. V případě narušení plicního vývoje a snížení plicních funkcí chybí přirozená dechová rezerva a hrozí v průběhu stárnutí rozvoj plicních obtíží i vyšší riziko morbidity a mortality v důsledku respirační insuficience [21].
Image 9. Vývoj plicních funkcí v průběhu růstu a stárnutí. Na obrázku je znázorněna fyziologická křivka hodnot usilovně vydechnutého objemu během první sekundy v průběhu dětství a dospělosti (černá křivka). Maximum hodnot je dosaženo mezi 20. a 25. rokem věku a následně dochází k fyziologickému poklesu (plná černá křivka), tento pokles může být akcelerován vlivem xenobiotik či respiračního onemocnění (např. průduškové astma, chronická obstruktivní plicní nemoc – černá přerušovaná čára) V případě antenatálního či časného postnatálního inzultu dojde záhy ke snížení funkčních parametrů, jejichž nárůst zůstává i v dalším průběhu omezen (modrá plná křivka), v případě inzultu v prvních 2 až 4 letech může opět následovat celoživotní limitace (modrá přerušovaná čára v levé části obrázku). Zatím není jisté, zda přirozený pokles plicních funkcí u těchto osob má stejnou dynamiku jako u zdravých (modrá plná čára), či dojde k akceleraci poklesu (přerušovaná modrá čára). Upraveno dle Stocks et al., Lancet Resp Med 2016. 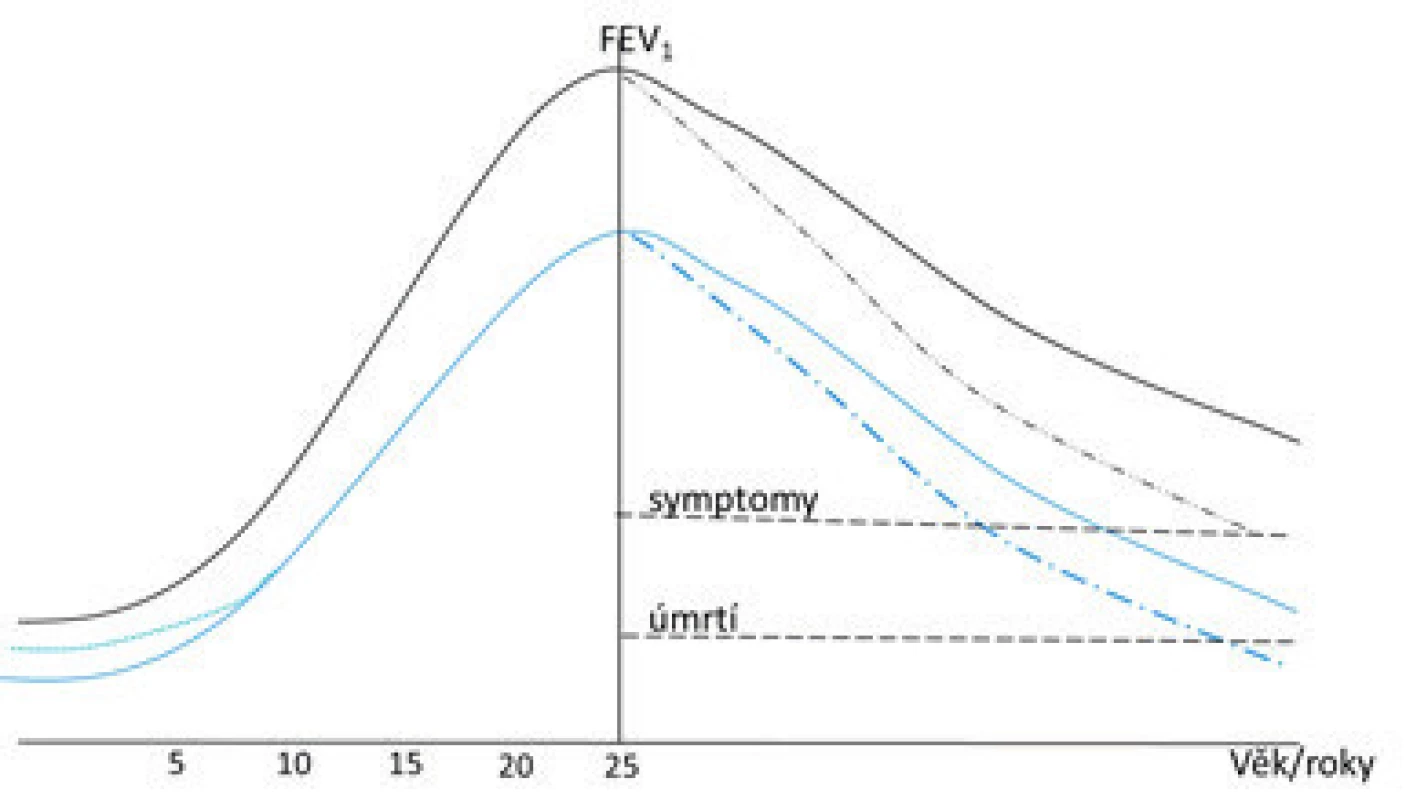
Zda u dětí s CLDI bude pokles plicních funkcí probíhat se stejnou dynamikou jako u zdravých, či zda bude akcelerován, není zatím podle studií jednoznačné [22]. Zdá se, že za určitých okolností může postnatální alveolarizace částečně zmírnit postižení plicního parenchymu [23], bronchiální obstrukce však obvykle přetrvává a s růstem může dojít i k jejímu prohloubení.
ZÁVĚR
Pokroky moderní medicíny umožnily přežití dětem z těžké či extrémní nezralosti a nejen pediatři tak musí čelit novým otázkám spojeným s péčí o jedince se závažně narušeným plicním vývojem. Zatímco v dětském věku se obvykle klinická symptomatologie během času zmírňuje, lze předpokládat nejistou dynamiku plicních funkcí v dospělém věku. Aktuálně se středního a vyššího věku dožívají jedinci se starou formou BPD, prognóza dospělých z extrémní a těžké nezralosti narozených v 90. letech 20. století a později je zatím nezodpovězenou otázkou.
MUDr. Jana Tuková, Ph.D.
Klinika pediatrie a dědičných poruch metabolismu
1. LF UK a VFN
Ke Karlovu 2
128 00 Praha 2
e-mail: jana.tukova@vfn.cz
Sources
1. Harrison MS, Goldenberg RL. Global burden of prematurity. Semin Fetal Neonatal Med 2016; 21 (2): 74–79.
2. Costeloe KL, et al. Short term outcomes after extreme preterm birth in England: comparison of two birth cohorts in 1995 and 2006 (the EPICure studies). BMJ 2012; 345: e7976.
3. Stoll BJ, et al. Trends in care practices, morbidity, and mortality of extremely preterm neonates, 1993–2012. JAMA 2015; 314 (10): 1039–1051.
4. Younge N, et al. Survival and neurodevelopmental outcomes among periviable infants. N Engl J Med 2017; 376 (7): 617–628.
5. Bolton CE, et al. Lung consequences in adults born prematurely. Thorax 2015; 70 (6): 574–580.
6. Day CL, Ryan RM. Bronchopulmonary dysplasia: new becomes old again! Pediatr Res 2017; 81 (1–2): 210–213.
7. Northway WH Jr, Rosan RC, Porter DY. Pulmonary disease following respirator therapy of hyaline-membrane disease. Bronchopulmonary dysplasia. N Engl J Med 1967; 276 (7): 357–368.
8. Jobe AJ. The new BPD: an arrest of lung development. Pediatr Res 1999; 46 (6): 641–643.
9. Higgins RD, et al. Bronchopulmonary Dysplasia: Executive Summary of a Workshop. J Pediatr 2018; 197 : 300–308.
10. Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med 2001; 163 (7): 1723–1729.
11. Stoecklin B, Simpson SJ, Pillow JJ. Bronchopulmonary dysplasia: Rationale for a pathophysiological rather than treatment based approach to diagnosis. Paediatr Respir Rev 2019; 32 : 91–97.
12. Kalikkot Thekkeveedu R, Guaman MC, Shivanna B. Bronchopulmonary dysplasia: A review of pathogenesis and pathophysiology. Respir Med 2017; 132 : 170–177.
13. Ehrenkranz RA, et al. Validation of the National Institutes of Health consensus definition of bronchopulmonary dysplasia. Pediatrics 2005; 116 (6): 1353–1360.
14. Fawke J, et al. Lung function and respiratory symptoms at 11 years in children born extremely preterm: the EPICure study. Am J Respir Crit Care Med 2010; 182 (2): 237–245.
15. Caskey S, et al. Structural and functional lung impairment in adult survivors of bronchopulmonary dysplasia. Ann Am Thorac Soc 2016; 13 (8): 1262–1270.
16. Straňák Z. Imunoprofylaxe závažných forem RSV infekce neovlivňuje očkování u dětí - nová indikační kritéria. Pediatr praxi 2015; 16 (4): 247–250.
17. Duijts L, et al. European Respiratory Society guideline on long-term management of children with bronchopulmonary dysplasia. Eur Respir J 2020; 55 (1).
18. Baraldi E, et al. Low exhaled nitric oxide in school-age children with bronchopulmonary dysplasia and airflow limitation. Am J Respir Crit Care Med 2005; 171 (1): 68–72.
19. Gough A, et al. Impaired lung function and health status in adult survivors of bronchopulmonary dysplasia. Eur Respir J 2014; 43 (3): 808–816.
20. Quanjer PH, et al. Multi-ethnic reference values for spirometry for the 3-95-yr age range: the global lung function 2012 equations. Eur Respir J 2012; 40 (6): 1324–1343.
21. Stocks J, Hislop A, Sonnappa S. Early lung development: lifelong effect on respiratory health and disease. Lancet Respir Med 2013; 1 (9): 728–742.
22. Urs R, et al. Persistent and progressive long-term lung disease in survivors of preterm birth. Paediatr Respir Rev 2018; 28 : 87–94.
23. Narayanan M, et al. Catch-up alveolarization in ex-preterm children: evidence from (3)He magnetic resonance. Am J Respir Crit Care Med 2013; 187 (10): 1104–1109.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 7-
All articles in this issue
- Dětská pneumologie v Česku a na Slovensku
- Dlouhodobé dopady předčasného porodu na respirační systém u dětí
- Kdy pomýšlet na řasinkové dysfunkce?
- Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
- C-reaktívny proteín vo vzťahu k fenotypom obštrukčného spánkového apnoe u detských pacientov
- Děti závislé na technické podpoře dýchání
- Transplantace kmenových buněk krvetvorby u dětí s Fanconiho anémií po selhání krvetvorby v České republice a na Slovensku (2005–2016)
- Úsmevné príhody z Martinskej nemocnice – obytná budova
- Vplyv chorioamnionitídy na morbiditu predčasne narodených novorodencov a možné terapeutické intervencie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kdy pomýšlet na řasinkové dysfunkce?
- Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
- Dlouhodobé dopady předčasného porodu na respirační systém u dětí
- Dětská pneumologie v Česku a na Slovensku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

