-
Medical journals
- Career
Stanovenie hladín sukcinylacetónu u časti zdravej detskej populácie na Slovensku
Authors: G. Addová; R. Górová; H. Jurdáková
Authors‘ workplace: Chemický ústav, Prírodovedecká fakulta, Univerzita Komenského, Bratislava, Slovensko
Published in: Čes-slov Pediat 2020; 75 (2): 91-96.
Category: Original Papers
Overview
Cieľ štúdie: Cieľom štúdie bolo získať fyziologický rozsah hladiny sukcinylacetónu ako markera pre tyrozinémiu typu I u časti detskej populácie na Slovensku.
Metódy: Na splnenie cieľa sa v práci aplikovala tandemová hmotnostná spektrometria s priamym nástrekom, na úpravu vzorky suchej kvapky krvi sa použil komerčný kit Chromsystems pre aminokyseliny a acylkarnitíny a sukcinylacetón s derivatizáciou.
Výsledky: Z nášho súboru vzoriek a zvoleného postupu vyplýva fyziologický rozsah hladiny SUAC stanovený v suchej kvapke krvi od 0,32 do 0,70 µmol/l, s priemernou hodnotou 0,50 µmol/l a mediánom 0,49 µmol/l.
Záver: Vzhľadom na výhodu súčasného stanovenia aminokyselín, acylkarnitínov a sukcinylacetónu z jednej vzorky suchej kvapky krvi je táto metóda vhodná pre rutinnú prax v laboratóriách zaoberajúcich sa dedičnými metabolickými chorobami pre veľmi dôležitý skorý záchyt tyrozinémie I.
Klíčová slova:
tyrozinémia – sukcinylacetón – skríning – suchá kvapka krvi – tandemová hmotnostná spektrometria
ÚVOD
Za účelom identifikácie dedičných porúch metabolizmu tyrozínu sa stanovuje hladina tyrozínu pomocou tandemovej hmotnostnej spektrometrie (MS/MS). V rámci tyrozinémií rozlišujeme viacero typov – I, II, III a dočasný fyziologický stav nazývaný prechodná neonatálna tyrozinémia [1].
Neonatálna tyrozinémia je najčastejšia tyrozinémia u novorodencov spôsobená oneskorením dozrievania enzýmu 4-hydroxyfenylpyruvátdioxygenázy (HPPD). To spôsobuje prechodné zvýšenie hladiny tyrozínu v krvi, ako aj 4-hydroxyfenyllaktátu a 4-hydroxyfenylpyruvátu v moči [2]. Na druhej strane, tyrozinémia typu III je spôsobená nedostatkom HPPD v dôsledku genetickej poruchy. Tyrozinémia typu II sa vyskytuje v dôsledku nedostatku cytoplazmatickej tyrozíntransaminázy, ktorá inhibuje prvý krok metabolizmu L-tyrozínu na 4-hydroxyfenylpyruvát (obr. 1). Vrodená nedostatočná aktivita enzýmu 4-fumarylacetoacetáthydrolázy (FAH) spôsobuje tyrozinémiu typu I (Tyr I), autozomálne recesívnu poruchu, nazývanú tiež hepatorenálna tyrozinémia (OMIM 276700). Nedostatok FAH v dráhe katabolizmu tyrozínu vedie k progresívnym ochoreniam pečene, neurologickým poruchám a hypofosfatickým rozvratom [3]. Tyrozinémia predstavuje významný zdravotný problém v regiónoch s vysokým výskytom choroby, ako je Kanada [4], India [5] a Tunisko [6]. Tyrozinémia typu I postihuje celosvetovo približne 1 zo 100 000 novorodencov, v regiónoch Quebec je však incidencia 1 : 16 000, v severovýchodnej podoblasti Quebecu Saguenay-Lac-St.Jean v období rokov 1982–1986 bola dokonca 1 : 1846 [7], v Nórsku 1 : 60 000 [8].
Image 1. Metabolizmus L-fenylalanínu a L-tyrozínu s vyznačenými patofyziologickými dráhami. 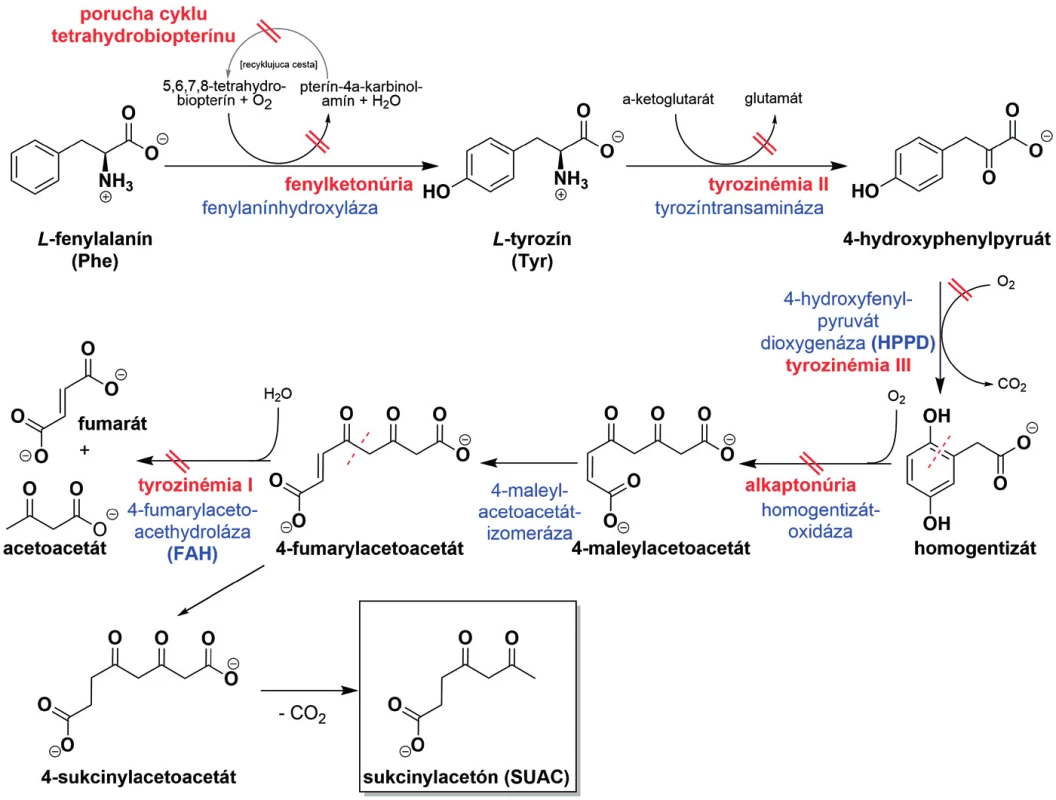
Tyrozinémie II a III vykazujú signifikantné zvýšenie L-tyrozínu v krvi, zatiaľ čo u tyrozinémie typu I sú normálne hladiny tyrozínu pozorované v takmer tridsiatich percentách [9] diagnostikovaných pacientov s Tyr I, ktoré kulminujú falošne negatívne výsledky. Naproti tomu, zníženie hraničných hodnôt L-tyrozínu podstatne zvyšuje falošne pozitívne výsledky a zvyšuje záťaž opakovanej analýzy. Skríning založený na analýze a kvantifikácii L-tyrozínu ako markera na detekciu Tyr I nie je preto ani špecifický, ani dostatočne citlivý [10].
Defekt v enzýme FAH má za následok hromadenie 4-fumarylacetoacetátu (obr. 1), 4-sukcinylacetoacetátu a sukcinylacetónu (SUAC), o ktorých sa predpokladá, že spôsobujú hepatorenálne poškodenie [11]. Prejavom akútnej formy Tyr I je akútne zlyhanie pečene, u subakútnej formy majú pacienti ochorenie pečene so závažnou hepatopatiou, hepatomegáliou a koagulopatiou, ktoré môžu viesť k cirhóze pečene alebo hepatocelulárnemu karcinómu. Tyr I sa vyznačuje dysfunkciou renálnych tubulov, jej symptómami sú tiež krivica, neprospievanie a svalová hypotónia. Chronická forma je charakteristická pomaly postupujúcim ochorením pečene a obličiek, možná je kardiomyopatia a bolesti dolných končatín pri neuropatii [12]. Nové metódy vyvinuté na diagnostiku Tyr I zahŕňajú stanovenie SUAC ako špecifického markera produkovaného metabolizmom nahromadeného 4-fumarylacetoacetátu v dôsledku nedostatku FAH [10, 13–17].
Väčšina toxického SUAC sa viaže na bielkoviny, ako je albumín a niektoré aminokyseliny (lyzín, alanín), zatiaľ čo približne 10 % zostáva neviazaných [18]. Predchádzajúce snahy o skríning Tyr I s využitím vzorky moču [19–22] boli časovo náročné a neboli použiteľné pri vysoko priepustnom skríningu novorodencov.
Zatiaľ čo L-tyrozín spolu s inými aminokyselinami sa v novorodeneckom skríningu bežne stanovuje vo vzorkách suchej kvapky krvi (SKK) pomocou MS/MS, zistenie hypertyrozinémie sa najčastejšie spája s bežnou a prechodnou tyrozinémiou novorodenca. Na zlepšenie špecifickosti NS pre Tyr I sa vyvinulo niekoľko testov na meranie SUAC v SKK. Počiatočné prístupy k jeho meraniu boli nepriame, a to stanovením aktivity dehydratázy kyseliny delta-aminolevulónovej, ktorá sa inhibuje pôsobením SUAC. Rutinné merania dehydratázovej aktivity na kyseline delta-aminolevulónovej kolorimetrickou metódou [7] sa prvýkrát implementovali v programe NS v Quebecu. Schulze a kol. ďalej zlepšili analýzu pomocou spektrofotometrie, ktorá umožnila kvantitatívne merania a objektívnejšiu interpretáciu výsledkov [23]. Allard a kol. v programe NS [24] vyvinuli analýzu na báze MS/MS na priame meranie SUAC. Pretože extrakcia SUAC z SKK vyžaduje kyslé roztoky, súčasná extrakcia SUAC, aminokyselín a acylkarnitínov metanolom nie je možná. Allard preto použil SKK po extrakcii aminokyselín a acylkarnitínov na extrakciu a derivatizáciu SUAC pomocou hydrazínu s následnou analýzou pomocou MS/MS. Nevýhodou tohto prístupu je potreba dodatočného vybavenia a personálu potrebného na meranie SUAC v každej SKK. Z tohto dôvodu táto metóda nebola nikdy začlenená v skríningových laboratóriách ako primárny skríningový test. Avšak od polovice roka 2008 v rámci NS programu v Novom Anglicku (USA) túto metódu modifikovali a použili tak, že spojili viacero vzoriek dokopy a stanovovali SUAC v spojených extraktoch. Následne sa jednotlivo analyzovali len tie vzorky, ktoré boli obsiahnuté v spojenom extrakte so zvýšenou hodnotou SUAC [25]. Magera a kol. [26] stanovovali izoxazolpropionát, ako derivát SUAC v dvojstupňovom postupe, kedy sa SUAC stanovoval len vo vzorkách s koncentráciami L-tyrozínu nad zníženou hraničnou hodnotou. Tento prístup sa však považoval za nedostatočne citlivý vzhľadom na významné prekrytie koncentrácií tyrozínu u pacientov s Tyr I a normálnej populácie [27].
Jedna z metód súčasného stanovenia SUAC, aminokyselín a acylkarnitínov je navrhnutá tak, že sa najprv extrahujú aminokyseliny a acylkarnitíny, ktoré sa následne derivatizujú na butylestery. V ďalšom kroku sa extrahuje SUAC zo zostávajúcej SKK po pôsobení hydrazínu a následne sa adukt hydrazínu a SUAC derivatizuje na butylester. Derivatizované vzorky sa potom spoja a aminokyseliny, acylkarnitíny a SUAC sa stanovujú spoločne pomocou MS/MS v rámci jednej analýzy. Koncentrácia SUAC sa stanoví porovnaním s izotopicky značeným SUAC (13C5-SUAC) ako vnútorným štandardom [9, 14, 28]. Priemerná koncentrácia SUAC v 13 521 kontrolných vzorkách bola 1,25 μmol/l, 99,5% percentil koncentrácie SUAC bol 2,65 μmol/l, rozsah koncentrácie SUAC u pacientov s tyrozinémiou I bol 13–81 μmol/l [9]. Marca a kol. [28] uvádzajú hraničnú hodnotu SUAC v SKK <2,4 µmol/l. Al-Dirbashi a kol. [29] uverejnili prácu, v ktorej sa SUAC extrahoval z terčíka SKK a derivatizoval danzylhydrazínom. Derivátový extrakt sa analyzoval pomocou UPLC-MS/MS. Hraničná hodnota SUAC v SKK u zdravých detí bola 0,63 µmol/l (n = 151). Vo vzorkách SKK od pacientov so stanovenou Tyr I (n = 11) bola koncentrácia sukcinylacetónu 6,4 až 30,8 µmol/l. V práci Sander a kol. [30] sa uvádza hraničná hodnota pre SUAC <10 μmol/l.
V roku 1992 bola navrhnutá liečba herbicídom 2-(2-nitro-4-trifluórmetylbenzoyl)-1,3-cyklohexándiónom (NTBC), pretože je účinným inhibítorom HPPD, ktorá je enzýmom v dráhe degradácie tyrozínu pred reakciou s FAH [31]. Tento farmakologický zásah zabraňuje tvorbe 4-maleyl - a 4-fumarylacetoacetátu, ako aj súvisiacich derivátov, o ktorých je známe, že spôsobujú patológie pozorované v Tyr I [32]. Spolu s diétou so zníženým obsahom L-fenylalanínu a L-tyrozínu [33] sa perorálne podávanie NTBC stalo základnou liečbou pre pacientov s Tyr I. NTBC je komerčne dostupný ako Orfadin® (nitizinón) od roku 2002. Larochelle a kol. [34] opisujú výsledok pacientov s Tyr I narodených v rokoch 1984 až 2004 v Quebecu. Dokázalo sa, že perorálne podávanie NTBC je nielen lepšie ako samotná diétna liečba a bezpečnejšie ako transplantácia orgánov, ale je obzvlášť účinné, keď sa s liečbou začne počas prvého mesiaca života [34, 35].
METÓDY
Príprava vzoriek
K dispozícii sme mali 840 vzoriek suchej kvapky krvi, z toho 720 zdravých novorodencov a 120 vzoriek zdravých detí vo veku od 2 mesiacov do 10 rokov. Vzorky SKK sme získali z Novorodeneckej kliniky Univerzitnej nemocnice v Martine a Oddelenia klinickej biochémie Národného ústavu detských chorôb v Bratislave.
Príprava vzorky je založená na účinnej extrakcii analytov z odberového papiera a následnej derivatizácii analytov na butylestery pomocou komerčného kitu Chromsystems@ pre aminokyseliny a acylkarnitíny a sukcinylacetón s derivatizáciou. Aby sa zabezpečila reprodukovateľná kvantifikácia analytov, pre kalibráciu a meranie sa využívajú stabilné, izotopovo značené interné štandardy. Pre SUAC sa použil 13C značený štandard SUAC.
Z odobratej vzorky suchej kvapky krvi sa vystrihne terčík s priemerom 3 mm a vloží sa do jamky v 96-jamkovej doštičke. Pridá sa 200 µl roztoku zmesi interných štandardov aminokyselín a acylkarnitínov v extrakčnom činidle a nasleduje miešanie doštičky, ktorá je prikrytá vzduchotesnou fóliou po dobu 20 min pri laboratórnej teplote a otáčkach 650 rpm. Po odstránení fólie sa supernatant odoberie, prenesie do novej jamky a ďalej sa spracováva na stanovenie aminokyselín a acylkarnitínov. K zostávajúcemu terčíku sa pridá 150 µl interného štandardu sukcinylacetónu v extrakčnom činidle s obsahom hydrazínu. Sukcinylacetón s hydrazínom tvorí aromatický pyrazolový derivát sukcinylacetónu (obr. 2), čím sa umožní jeho extrakcia.
Image 2. Schéma derivatizácie sukcinylacetónu (SUAC) reakciou s hydrazínom. 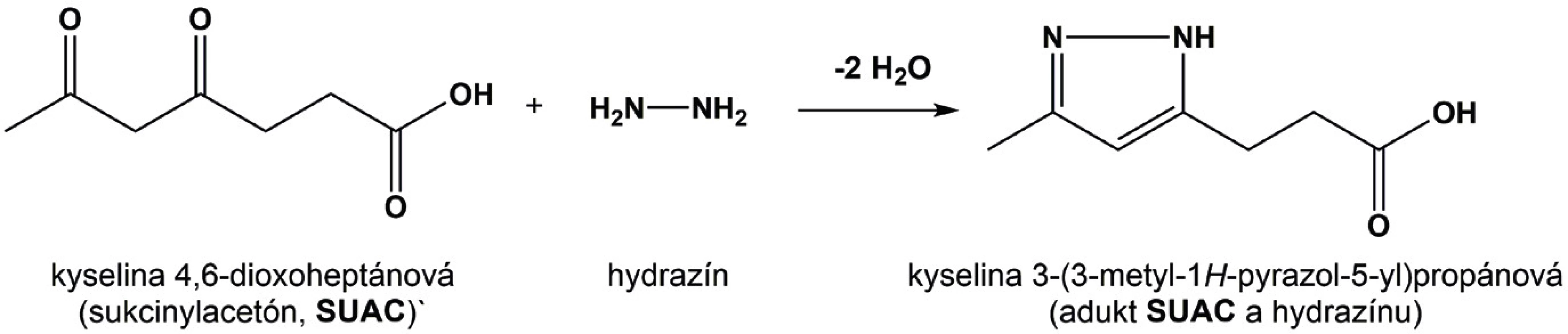
Prikrytá doštička sa mieša pri otáčkach 600 rpm po dobu 30 min pri 60 °C, následne sa odkryje, supernatant sa prenesie do novej jamky a nechá sa pod prúdom vzduchu pri miešaní odpariť do sucha pri teplote 60 °C. Pridá sa 60 µl derivatizačného činidla (HCL v butanole), doštička sa opäť prikryje fóliou a nasleduje derivatizácia po dobu 15 min pri 60 °C a 650 rpm (obr. 3).
Image 3. Schéma esterifikácie hydrazónového derivátu sukcinylacetónu. 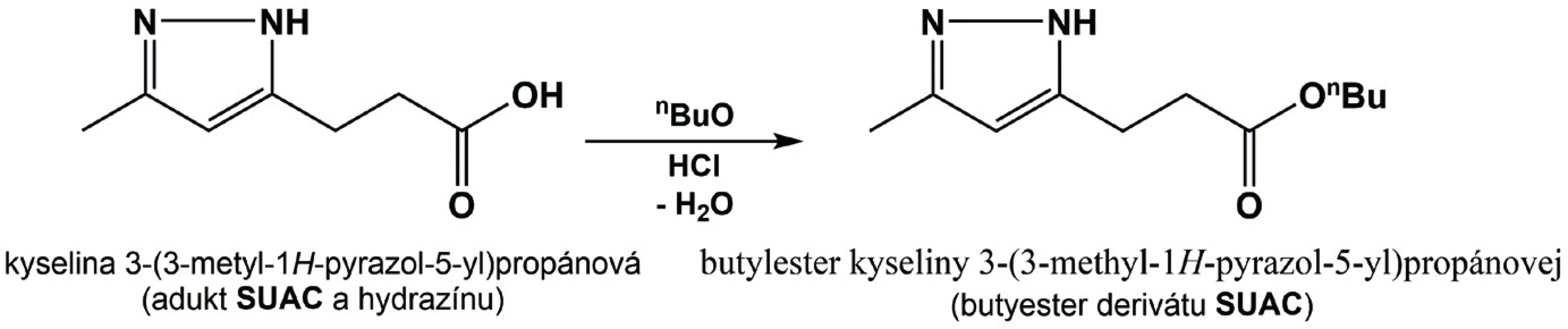
Po derivatizácii sa fólia odstráni, derivatizačné činidlo sa nechá odpariť pod prúdom vzduchu do sucha pri otáčkach 650 rpm a teplote 60 °C. Nakoniec sa pridá 100 µl rekonštitučného činidla, pretrepe sa pri laboratórnej teplote po dobu cca 2 minúty a tento roztok sa dávkuje do systému FIA-MS/MS.
FIA-MS/MS
Desať µl vzorky sa dávkuje použitím autosamplera (Finnigan Surveyor Autosampler Plus) do hmotnostného spektrometra s trojitým kvadrupólom TSQ Quantum QC (Thermo Fisher Scientific Inc.) použitím HPLC pumpy Finnigan Surveyor MS Plus. Ako iónový zdroj sa použil elektrosprej (ESI) pracujúci v pozitívnom móde. Nastavenia ESI ionizátora boli nasledovné: napätie 3500 V, tlak dusíka ako sušiaceho plynu 20, pomocného plynu 7 a čistiaceho plynu 1 i.u. (prístrojová jednotka); teplota kapiláry iónového transferu do MS bola 325 °C.
Merania MS/MS sa uskutočnili v SRM (selective reaction monitoring) móde s nasledujúcimi m/z prechodmi pre SUAC m/z 211→137 a pre izotopovo značený štandard m/z 216→142. Ako kolízny plyn sa použil argón s tlakom 0,6 mTorr a hodnotou kolíznej energie 14 V.
VÝSLEDKY
Kvantifikácia sa uskutočnila porovnaním plôch píkov pre analyt a zodpovedajúci 13C izotopovo značený vnútorný štandard. Správnosť merania sa overila použitím kontrolnej kvapky krvi so známou hladinou SUAC, ktorá sa použila aj na výpočet korekčného faktora pre každú várku vzoriek.
Výťažnosť SUAC bola cca 50%, rovnako ako uvádza výrobca používaného kitu. V rámci 4 mesiacov, kedy sa merania uskutočňovali každý týždeň, bola priemerná hodnota korekčného faktora 2,37 v rozsahu od 1,94 do 2,96 (medián 2,37).
Na štatistické vyhodnotenie sme dáta získané zo skupiny zdravých novorodencov a zdravých detí vo veku od 2 mesiacov do 10 rokov porovnali pomocou analýzy dvoch nezávislých výberov (QC Expert, p = 0,05). Výsledkom testu zhody rozptylov, testu zhody priemerov a testu dobrej zhody rozdelenia je zhoda vo všetkých testovaných parametroch na hladine významnosti 0,05 (tab. 1).
Table 1. Porovnanie hladín SUAC v skupine 720 zdravých novorodencov a 120 zdravých detí vo veku od 2 mesiacov do 10 rokov pomocou dvoch nezávislých výberov (QC Expert, P = 0,05). 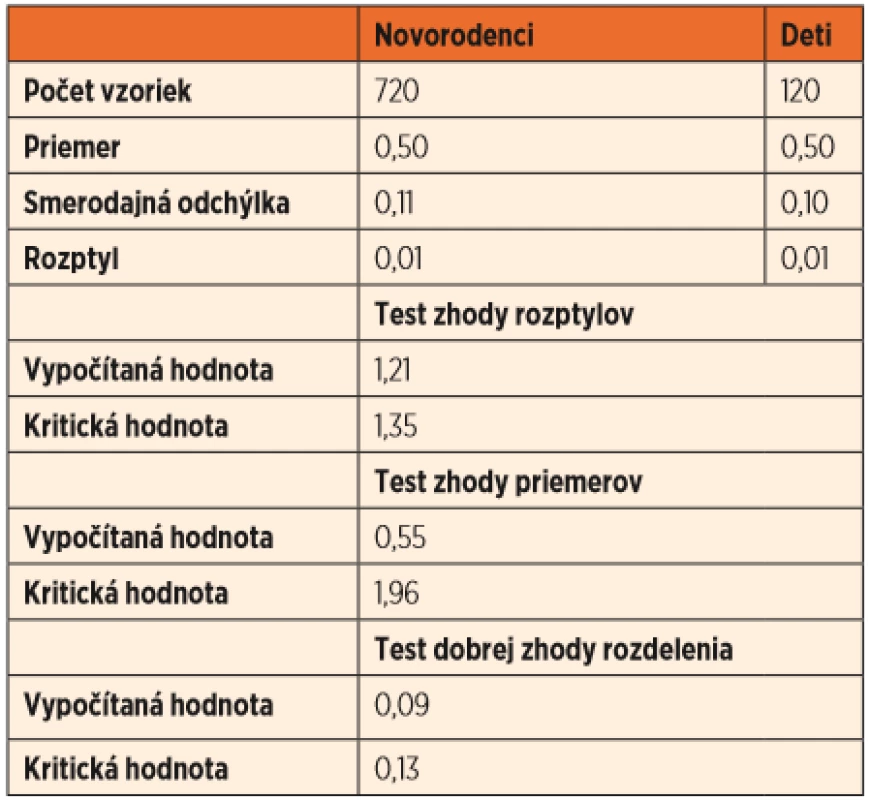
Opakovateľnosť sa hodnotila pri opakovaní merania hladín SUAC u zdravých jedincov v rámci dvoch týždňov pri dvoch koncentračných hladinách, medziľahlá presnosť merania sa hodnotila v štyroch nezávislých meraniach pri dvoch koncentračných hladinách. Hodnoty nepresiahli 3 % a sú uvedené v tabuľkách 2 a 3.
Table 2. Opakovateľnosť merania. 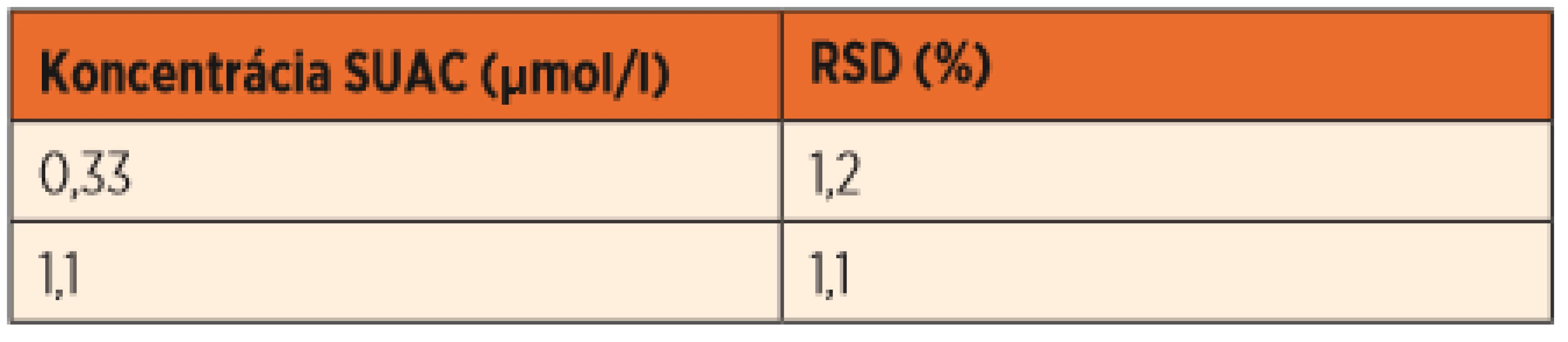
Table 3. Medziľahlá presnosť merania. 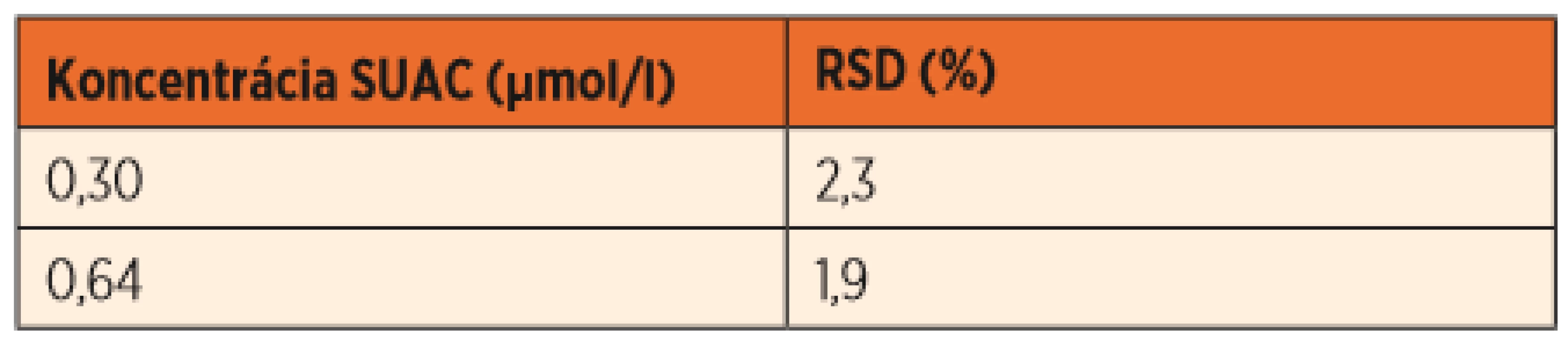
Obrázok 4 zobrazuje jednotlivé hodnoty sukcinylacetónu (SUAC) vo vzorkách suchej kvapky krvi namerané nami použitou metódou. Po štatistickom vyhodnotení 95. percentil určuje hornú hladinu fyziologickej hodnoty a 5. percentil určuje dolnú hladinu fyziologickej hodnoty. Z nášho súboru vzoriek a zvoleného postupu vyplýva fyziologický rozsah hladiny SUAC stanovený v suchej kvapke krvi od 0,32 do 0,70 µmol/l, s priemernou hodnotou 0,50 µmol/L a mediánom 0,49 µmol/l.
Image 4. Koncentrácie SUAC zistené vo vzorke suchej kvapky krvi nami použitou metódou. Hodnoty sú nasledovné: 95. percentil (0,70 μmol/l), priemer (0,50 μmol/l), medián (0,49 μmol/l) a 5. percentil (0,32 μmol/l). 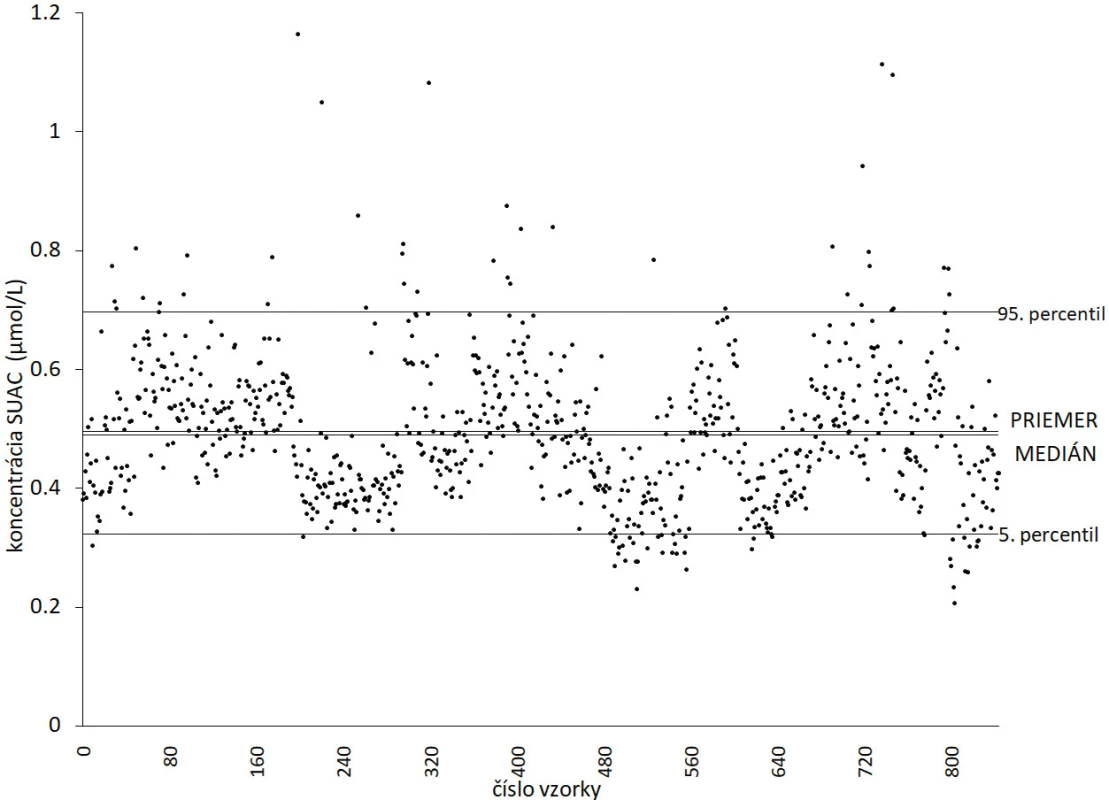
DISKUSIA
Rozptyl korekčného faktora, ktorý sa vypočítaval pri príprave vzorky, v rozsahu od 1,94 do 2,96, je veľký. Dôvodom je výťažnosť. Najväčší vplyv na výťažnosť SUAC má teplota pri extrakcii, rozsah vysušenia, resp. presušenia extraktu a teplota pri derivatizácii.
Pri teplote extrakcie a derivatizácie nižšej ako 60 °C dochádza k nekvantitatívnej extrakcii a derivatizácii, pri teplote 85 °C je uvádzaný rozklad SUAC. Pri sušení prvého supernatantu z kroku extrakcie je potrebné dbať na dodržanie vhodného času sušenia, t.j. do stavu, kedy je jamka suchá, presušenie vedie k rozkladu žiaduceho produktu. Pri kroku derivatizácie je optimálny čas 15 minút, pri predlžovaní tohto času sa výťažnosť už ďalej nezvyšuje. Viackroková príprava vzorky, vrátane dvoch krokov sušenia a derivatizácie vyžaduje, aby sa všetky vzorky v rámci jednej mikrotitračnej doštičky spracovali súčasne pri rovnakých podmienkach a je nutná súčasná analýza referenčnej suchej kvapky krvi so známou hodnotou koncentrácie SUAC.
Hodnota SUAC získaná nami použitou metódou zo suchej kvapky krvi 0,70 µmol/l, ktorú považujeme za hraničnú hodnotu, je porovnateľná s publikovanou hodnotou 0,63 µmol/l [29] a značne nižšia ako publikované hodnoty <2 μmol/L [24], <2,4 μmol/L [28], <5 μmol/L [26] a <10 μmol/L [31]. Nami stanovený fyziologický rozsah je nižší ako publikovaný 0,5–3,0 µmol/l [9] a vyšší ako publikovaný 0–0,30 µmol/l [36]. Rozdielnosť v týchto hodnotách vyplýva z rozdielností použitých metodík, preto pre správnu interpretáciu výsledkov analýz je pre každé laboratórium podmienkou určenie vlastného rozsahu fyziologických hodnôt a hraničnej hodnoty pre SUAC.
ZÁVER
Pri súčasnej ročnej pôrodnosti na Slovensku je výskyt tyrozinémie typu I približne 1 prípad za 2 až 3 roky. V súčasnosti je základom liečby detí s tyrozinémiou typu I liek Orfadin® a súčasne veľmi prísna nízkobielkovinová diéta, ktorá znižuje príjem aminokyseliny L-tyrozínu v strave, doplnená preparátom esenciálnych aminokyselín bez fenylalanínu a tyrozínu. Aminokyselinové zmesi zabezpečujú, že nutričné požiadavky pre všetky ďalšie aminokyseliny sú splnené a podporujú tak rast a vývoj. Tyrozinémia typu II a III sú ešte vzácnejšie a ich príznaky sú miernejšie.
Táto práca sa zamerala na stanovenie hladiny sukcinylacetónu v suchej kvapke krvi u zdravej novorodeneckej a detskej populácie na Slovensku. V našom laboratóriu sme na vzorke 840 zdravých jedincov určili fyziologický rozsah sukcinylacetónu (SUAC) v suchej kvapke krvi od 0,32 do 0,70 µmol/l, s priemernou hodnotou 0,50 µmol/l a mediánom 0,49 µmol/l. Zvolená metóda spracovania suchej kvapky krvi je viackroková a vyžaduje, aby sa všetky vzorky v rámci jednej mikrotitračnej doštičky spracovali pri rovnakých podmienkach. Vzhľadom na citlivosť na zmenu podmienok predúpravy je tiež pre spoľahlivú interpretáciu výsledkov nevyhnutná súčasná analýza referenčnej suchej kvapky krvi so známou hodnotou koncentrácie SUAC.
Pre výhodu súčasného stanovenia aminokyselín, acylkarnitínov a sukcinylacetónu z jednej vzorky suchej kvapky krvi vzhľadom k tomu, že v súčasnosti nie je zavedený na Slovensku skríning hepatorenálnej tyrozinémie a súčasne je veľmi dôležitý včasný záchyt tyrozinémie I a nasadenie terapie, by sa táto metóda mala dostať do rutinnej praxe v laboratóriách zaoberajúcich sa dedičnými metabolickými chorobami.
Poďakovanie
Tento článok vznikol vďaka podpore v rámci OP Výskum a vývoj pre dopytovo-orientovaný projekt: Univerzitný vedecký park Univerzity Komenského v Bratislave, ITMS 26240220086 spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja a projekt: Vybudovanie kompetenčného centra pre výskum a vývoj v oblasti molekulárnej medicíny, ITMS 26240220071.
Došlo: 9. 7. 2019
Přijato: 20. 11. 2019
RNDr. Gabriela Addová, PhD.
Chemický ústav
Prírodovedecká fakulta Univerzity Komenského
Ilkovičova 6
842 15 Bratislava
Slovenská republika
e-mail: gabriela.addova@uniba.sk
Sources
1. Mitchell GA, Grompe M, Lambert MR, et al. Hypertyrosinemia. In: Scriver CR, et al. The Metabolic and Molecular Bases of Inherited Disease. 8th ed. New York: McGraw-Hill, 2001 : 1777–1805.
2. Holme E, Lindstedt S. Diagnosis and management of tyrosinemia type I. Curr Opin Pediatr 1995; 7 (6):726–732.
3. Dashti AS, Hamzavi SS. Tyrosinemia presenting with multiple hepatic lesions and splenomegaly. J Clin Gastroenterol 2019; 53 (1): 76–77.
4. Giguère Y, Berthier MT. Newborn screening for hereditary tyrosinemia type I in Québec. Adv Exp Med Biol 2017; 959 : 139–146.
5. Verma IC. Burden of genetic disorders in India. Ind J Pediatr 2000; 67 (12): 893–898.
6. Nasrallah F, Souissi M, Feki M, et al. Tyrosinemia type I: prevalence and clinical and biochemical profile in Tunisia. J Inherit Metab Dis 2005; 28 (Suppl 1): 58.
7. De Braekeleer M, Larochelle J. Genetic epidemiology of hereditary tyrosinemia in Quebec and Saguenay-Lac-St-Jean. Am J Hum Genet 1990; 47 (2): 302–307.
8. Bliksrud YT, Brodtkorb E, Backe PH, et al. Hereditary tyrosinaemia type I in Norway: incidence and three novel small deletions in the fumarylacetoacetase gene. Scand J Clin Lab Invest 2012; 72 (5): 369–373.
9. Turgeon C, Magera MJ, Allard P, et al. Combined newborn screening for succinylacetone, amino acids, and acylcarnitine in dried blood spots. Clin Chem 2008; 54 (4): 657–664.
10. Dhillon KS, Bhandal AS, Aznar CP, et al. Improved tandem mass spectrometry (MS/MS) derivatized method for the detection of tyrosinemia type I, amino acids and acylcarnitine disorders using a single extraction process. Clin Chim Acta 2011; 412 (11–12): 873–879.
11. Lindblad B, Lindstedt S, Steen G. On the enzymatic defects in hereditary tyrosinemia. Proc Natl Acad Sci USA 1977; 74 (10): 4641–4645.
12. Vondráčková A, Tesařová M, Magner M, et al. Clinical, biochemical and molecular characteristics in 11 Czech children with tyrosinemia type I. Čas Lék čes 2010; 149 (9): 411–416.
13. Jakobs C, Dorland L, Wikkerink B, et al. Stable isotope dilution analysis of succinylacetone using electron capture negative ion mass fragmentography: an accurate approach to the pre - and neonatal diagnosis of hereditary tyrosinemia type I. Clin Chim Acta 1988; 17 (2–3): 1223–232.
14. Kvittingen EA, Holme E. Disorders of tyrosine metabolism. In: Fernandes JM, et al. Inborn Metabolic Diseases. 3rd ed. Heidelberg: Springer-Verlag, 2000 : 186–194.
15. Chace DH, Lim T, Hansen CR, et al. Improved MS/MS analysis of succinylacetone extracted from dried blood spots when combined with amino acids and acylcarnitine butyl esters. Clin Chem Acta 2009; 407 (1–2): 6–9.
16. Laberge C, Grenier A, Valet JP, et al. Fumarylacetoacetase measurement as a mass-screening procedure for hereditary tyrosinemia type I. Am J Hum Genet 1990; 47 (2): 325–328.
17. Hasanoglu A, Ozalp I. Transient tyrosinemia of the newborn. Turk J Pediatr 1978; 20 (3–4): 85–90.
18. Manabe S, Sassa S, Kappas A. Hereditary tyrosinemia: formation of succinylacetone – amino acid adducts. J Exp Med 1985; 162 (3): 1060–1074.
19. Al-Dirbashi OY, Rashed MS, Ten Brink HJ, et al. Determination of succinylacetone in dried blood spots and liquid urine as a dansylhydrazone by liquid chromatography tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 2006; 831 (1–2): 274–280.
20. Haagen AAM, Duran M. Absence of increased succinylacetone in the urine of a child with hereditary tyrosinemia type I. J Inherit Metab Dis 1987; 10 (Suppl 2): 323–325.
21. Rashed MS, Al-Ahaidib LY, Al-Dirbashi OY, et al. Tandem mass spectrometry assay of succinylacetone in urine for the diagnosis of hepatorenal tyrosinemia. Anal Biochem 2005; 339 (2): 310–317.
22. Chen H, Yu C. Urinary succinylacetone analysis by gas chromatography-mass spectrometry (GC-MS). In: Garg U. Clinical Applications of Mass Spectrometry in Biomolecular Analysis: Methods and Protocols. Heidelberg: Springer, 2016; 281–290.
23. Schulze A, Frommhold D, Hoffmann GF, et al. Spectrophotometric microassay for delta-aminolevulinate dehydratase in dried-blood spots as confirmation for hereditary tyrosinemia type I. Clin Chem 2001; 47 (8): 1424–1429.
24. Allard P, Grenier A, Korson MS, et al. Newborn screening for hepatorenal tyrosinemia by tandem mass spectrometry: analysis of succinylacetone extracted from dried blood spots. Clin Biochem 2004; 37 (11): 1010–1015.
25. Zytkovicz TH, Sahai I, Rush A, et al. Newborn screening for hepatorenal tyrosinemia-I by tandem mass spectrometry using pooled samples: a four-year summary by the New England newborn screening program. Clin Biochem 2013; 46 (7–8): 681–684.
26. Magera MJ, Gunawardena ND, Hahn SH, et al. Quantitative determination of succinylacetone in dried blood spots for newborn screening of tyrosinemia type I. Mol Genet Metab 2006; 88 (1): 16–21.
27. Laboratory Quality Improvement of Newborn Screening. http://www.clir-r4s.org/, Accessed July 7, 2014.
28. La Marca G, Malvagia S, Pasquini E, et al. The inclusion of succinylacetone as marker for tyrosinemia type I in expanded newborn screening programs. Rapid Commun Mass Spectrom 2008; 22 (6): 812–818.
29. Al-Dirbashi OY, Rashed MS, Jacob M, et al. Improved method to determine succinylacetone in dried blood spots for diagnosis of tyrosinemia type 1 using UPLC-MS/MS. Biomed Chrom 2008; 22 (11): 1181–1185.
30. Sander J, Janzen N, Peter M, et al. Newborn screening for hepatorenal tyrosinemia: tandem mass spectrometric quantification of succinylacetone. Clin Chem 2006; 52 (3): 482–487.
31. Lindstedt S, Holme E, Lock EA, et al. Treatment of hereditary tyrosinaemia type I by inhibition of 4-hydroxyphenylpyruvate dioxygenase. Lancet 1992; 340 (8823): 813–817.
32. Lock EA, Ellis MK, Gaskin P, et al. From toxicological problem to therapeutic use: the discovery of the mode of action of 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC), its toxicology and development as a drug. J Inherit Metab Dis 1998; 21 (5): 498–506.
33. Floriánková M, Bláhová Š, Pencová M, et al. Nutritional therapy in patients with inherited metabolic disorders. Čes-slov Pediat 2018; 73 (6): 395–407.
34. Larochelle J, Alvarez F, Bussieres JF, et al. Effect of nitisinone (NTBC) treatment on the clinical course of hepatorenal tyrosinemia in Quebec. Mol Genet Metab 2012; 107 (1–2): 49–54.
35. Sundberg J, Wibrand F, Lund AM, et al. Simultaneous quantification of succinylacetone and nitisinone for therapeutic drug monitoring in the treatment of Tyrosinemia type 1. J Chromatogr B Analyt Technol Biomed Life Sci 2018; 1072 : 259–266.
36. Johnson DW, Gerace R, Ranieri E, et al. Analysis of succinylacetone, as a Girard T derivative, in urine and dried bloodspots by flow injection electrospray ionization tandem mass spectrometry. Rapid Commun Mass Spectrom 2007; 21 (1): 59–63.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 2-
All articles in this issue
- Editorial: Když si děti hrají, někdy z toho problém mají
- Cizí tělesa v polykacích cestách u dětí
- Pevné exogénne cudzie telesá v dolných dýchacích cestách u detí
- Aspirovaná cizí tělesa u dětí – kazuistiky
- Hračka – bezpečný předmět na dětských odděleních?
- Stravovací a pohybové zvyklosti v rodině – ověření reliability dotazníku
- Léčba trombotických příhod u novorozenců a kojenců
- Stanovenie hladín sukcinylacetónu u časti zdravej detskej populácie na Slovensku
- Opakovaná spontánní remise atypického hemolyticko-uremického syndromu vyvolaného chřipkou – kazuistika
- Hyponatriémia – vzácna komplikácia nefrotického syndrómu
- Úspěšná sklerotizace cyst štítné žlázy alkoholem pod ultrasonografickou kontrolou u adolescentů
- Moje úsmevné spomienky na Olomouc
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cizí tělesa v polykacích cestách u dětí
- Úspěšná sklerotizace cyst štítné žlázy alkoholem pod ultrasonografickou kontrolou u adolescentů
- Léčba trombotických příhod u novorozenců a kojenců
- Aspirovaná cizí tělesa u dětí – kazuistiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

