-
Medical journals
- Career
Falešná pozitivita v novorozeneckém screeningu deficitu 21-hydroxylázy
Authors: J. David; M. Hedelová; F. Votava
Authors‘ workplace: Klinika dětí a dorostu, Fakultní nemocnice Královské Vinohrady a 3. lékařská fakulta Univerzity Karlovy, Praha
Published in: Čes-slov Pediat 2019; 74 (6): 354-358.
Category: Original Papers
Overview
Cíl: Deficit 21-hydroxylázy je v České republice ze všech osmnácti screenovaných nemocí zatížen nejvyšší frekvencí falešné pozitivity („False Positivity Rate“ – FPR). Cílem této práce bylo zjistit rozdíl FPR při hodnocení screeningových hodnot 17-hydroxyprogesteronu (17OHP) dle „cut-off“ vztažených k porodní hmotnosti (PH) a vůči gestačnímu věku novorozence.
Metody: Analýza zahrnovala 129 175 novorozenců z období 1. 1. 2015 až 31. 12. 2017, u kterých byla dostupná data o PH i gestačním věku. 17OHP byl stanoven v suchých kapkách krve (SKK) na novorozenecké screeningové kartičce fluorescenční imunoanalytickou metodou AutoDELFIA® PerkinElmer, firmy Wallac Oy, Finsko. Pozitivní nález (tj. koncentrace 17OHP nad „cut-off“ hodnotou) spustil další vyšetřovací proces. Ve většině případů se jednalo o vyžádání opakovaného odběru SKK. Pokud nedošlo k poklesu 17OHP pod „cut-off“, nebo při extrémně zvýšené koncentraci (tj. jednoznačné pozitivitě) 17OHP už v prvním pravidelném odběru SKK byl proband urgentně přijat na dětské oddělení k neodkladné konfirmaci diagnózy a neodkladnému zahájení léčby. Rozdíl FPR mezi 17OHP vůči PH a gestačnímu věku byl vyhodnocen pomocí statistické metody Adjusted Wald Interval for a Difference of Proportions with Matched Pairs (software R program).
Výsledky: Ve sledované kohortě mělo celkem 393 novorozenců falešně pozitivní hodnotu 17OHP nad stávajícími „cut-off“ vztaženými k PH. Při použití „cut-off“ hodnot dle gestačního věku počet novorozenců s falešně pozitivní hodnotou 17OHP klesl na 295 při zachování stejné schopnosti detekce pacientů. Rozdíl FPR mezi oběma skupinami byl statisticky signifikantní.
Závěry: Hodnocení 17OHP vůči gestačnímu věku signifikantně sníží FPR a tím i zátěž zdravé části novorozenecké populace.
Klíčová slova:
kongenitální adrenální hyperplazie – deficit 21-hydroxylázy – porodní hmotnost – gestační věk – 17-hydroxyprogesteron – falešná pozitivita
ÚVOD
Kongenitální adrenální hyperplazie (CAH) je autosomálně recesivně dědičná porucha steroidogeneze v kůře nadledvin. Nejčastějším typem (cca 95 % případů) je deficit 21-hydroxylázy. Klinické projevy a závažnost CAH závisí na zbytkové aktivitě deficitního enzymu a tím nejvíce na typu mutace v CYP21A2 genu (tab. 1) [1, 2]. Enzym 21-hydroxyláza se účastní biosyntézy kortizolu a aldo-steronu, konvertuje 17-hydroxyprogesteron (17OHP) na 11-deoxykortizol a progesteron na 11-deoxykortikosteron. Frekvence výskytu v České republice (ČR) je cca 1 : 12 000 [3].
Table 1. Dělení pacientů s deficitem 21-hydroxylázy podle fenotypové formy onemocnění, odpovídající zbytkové aktivitě 21-hydroxylázy (enzym P450c21) a patologii v genu pro P450c21 (CYP21A2), je použito aktuální genetické označení mutací platné od roku 2018 [1, 2]. ![Dělení pacientů s deficitem 21-hydroxylázy podle fenotypové formy onemocnění, odpovídající zbytkové aktivitě 21-hydroxylázy
(enzym P450c21) a patologii v genu pro P450c21 (CYP21A2), je použito aktuální genetické označení mutací platné od roku 2018 [1, 2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a3c421254c376c4387527648049353fe.png)
Pravidelný celoplošný novorozenecký laboratorní screening (NLS) CAH, resp. deficitu 21 hydroxylázy, byl v ČR zahájen 7. února, resp. 1. listopadu (Praha, resp. Brno) 2006. Do 31. 12. 2017 bylo pomocí NLS detekováno 108 pacientů. Cílem NLS je včasným záchytem a včasnou léčbou zabránit rozvoji život ohrožující solné krize u nejtěžších forem onemocnění, resp. vzniku předčasné pseudopuberty s deficitem dospělé výšky u lehčích forem. NLS detekuje deficit 21-hydroxylázy pomocí zvýšených hladin 17OHP v suchých krevních kapkách (SKK) odebíraných novorozencům mezi 48. až 72. hodinou života. Dodržení tohoto intervalu je významné a nutné vzhledem k fyziologicky vyšším hodnotám 17OHP v prvních dnech života novorozence, což je dáno vyšší aktivitou enzymatického aparátu fetální kůry nadledvin [4]. Definice správných postupů v preanalytické, analytické a postanalytické části k zajištění NLS jsou shrnuty v Metodickém návodu Věstníku Ministerstva zdravotnictví ČR z roku 2016 [5].
Hlavní rizika NLS představují falešně negativní (senzitivita) a falešně pozitivní (specificita) nálezy. Jejich výskyt nelze zcela eliminovat a je spjat s každou laboratorní metodou. Ideální screeningový test vykazuje dostatečnou senzitivitu i specificitu. Jsou to však spojené nádoby, jejichž hladiny při hodnocení biomarkerů jdou proti sobě. 17OHP je měřen imunofluorescenční metodou, s relativně vysokou frekvencí falešné pozitivity („False Positivity Rate“ – FPR) a tím nižší pozitivní prediktivní hodnotou (PPV) [6]. Deficit 21-hydroxylázy je v ČR ze všech osmnácti screenovaných nemocí zatížen nejvyšší FPR [3]. FPR představuje stigmatizaci zdravých novorozenců, zátěž pro jejich rodiny a vyšší nákladovost celého screeningového programu [7]. Cílem této studie bylo srovnat FPR při hodnocení screeningových hodnot 17OHP dle „cut-off“ vztažených k porodní hmotnosti (PH) a gestačnímu věku.
METODY
V období 1. 1. 2015 až 31. 12. 2017 bylo v regionu Čechy vyšetřeno celkem 215 291 novorozenců, což odpovídá cca 2/3 všech narozených dětí v ČR v tomto období [8, 9]. U všech proběhl pravidelný odběr NLS mezi 48. a 72. ho-dinou života, tj. mezi druhým a třetím dnem života, pokud se datum narození považuje za den nultý. Data o PH a gestačním věku byla získána ze screeningových kartiček, které byly zasílány běžnou poštou do centrální screeningové laboratoře pro danou oblast v Praze. 17OHP byl stanoven v SKK fluorescenční imunoanalytickou metodou (AutoDELFIA® Perkin-Elmer, firmy Wallac, OY, Finsko).
Pozitivní nález (tj. koncentrace 17OHP nad „cut-off“ hodnotou) spustil další vyšetřovací proces. Ve většině případů se jednalo o vyžádání opakovaného odběru SKK. Pokud nedošlo k poklesu 17OHP pod „cut-off“ nebo při extrémně zvýšené koncentraci 17OHP již v prvním pravidelném odběru SKK, byl proband urgentně přijat na dětské oddělení k neodkladné konfirmaci diagnózy a neodkladnému zahájení léčby.
Konfirmační diagnostika deficitu 21-hydroxylázy spočívala ve stanovení 17OHP ze žilní krve a průkazu patogenních mutací v genu CYP21A2, event. v případech diferenciálně diagnostických nejasností též ve stanovení dalších steroidů a provedení ACTH (adrenokortikotropní hormon) stimulačního testu.
Analyzovaná kohorta zahrnovala 129 175 dětí, u kterých byla dostupná data o PH i gestačním věku (60,0 % ze všech screenovaných dětí ve sledovaném období). Rozdíl FPR mezi 17OHP vůči PH a gestačnímu věku byl vyhodnocen pomocí statistické metody Adjusted Wald Interval for a Difference of Proportions with Matched Pairs (software R program). Screeningové „cut-off“ hodnoty 17OHP v korelaci s PH, délkou gestace a vě-kem novorozence při odběru jsou shrnuty v tabulce 2 [10].
Table 2. Použité screeningové hodnoty 17-hydroxyprogesteronu: „cut-off“ hodnoty (nmol/l) ve vztahu k porodní hmotnosti, délce gestace a věku při odběru (upraveno dle [10]). ![Použité screeningové hodnoty 17-hydroxyprogesteronu: „cut-off“ hodnoty (nmol/l) ve vztahu k porodní hmotnosti, délce gestace a věku
při odběru (upraveno dle [10]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/05e08ea95821972ab4b7b85d875066b5.png)
VÝSLEDKY
V celé vyšetřené skupině 215 291 novorozenců bylo konfirmováno osmnáct pacientů s deficitem 21-hydroxylázy (medián 17OHP v prvním pravidelném odběru SKK 287 nmol/l, rozpětí 31,2–1630 nmol/l). Žádný z detekovaných pacientů neměl screeningovou koncentraci 17OHP pod „cut-off“ hodnotou vztaženou vůči gestačnímu věku. Nejnižší koncentraci 31,2 nmol/l odpovídal hodnotě „cut-off“ vztažené ke gestačnímu věku 20,0 nmol/l. Celkem u 755 novorozenců byl nález falešně pozitivní (vztaženo k PH), což odpovídalo FPR 0,35 %, resp. u 510 novorozenců s PH <2500 g (FPR 2,95 %) a u 245 novorozenců s PH ≥2500 g (FPR 0,12 %).
V analyzované kohortě 129 175 dětí mělo celkem 393 novorozenců falešně pozitivní hodnotu 17OHP nad stávajícími hodnotami „cut-off“ vztaženými k PH (medián 39,0 nmol/l, rozpětí 20,1–1080 nmol/l). V této skupině nebylo podezření na deficit 21-hydroxylázy následným vyšetřením prokázáno: jednak poklesem 17OHP pod „cut-off“ v opakovaném odběru SKK (380 případů, 260 novorozenců s PH <2500 g, 120 novorozenců s PH ≥2500 g), nebo negativním endokrinologickým vyšetřením z venózní krve (třináct případů, sedm novorozenců s PH <2500 g, šest novorozenců s PH ≥2500 g).
Při použití „cut-off“ hodnot vztažených ke gestačnímu věku klesl počet novorozenců s falešně pozitivní hodnotou 17OHP na 295 při zachování stejné schopnosti detekce pacientů (tab. 3). Statistické vyhodnocení významnosti rozdílu FPR v jednotlivých letech (PH versus gestační věk) ukazuje tabulka 4. V analyzované kohortě ve sledovaném období vedlo použití „cut-off“ hodnot 17OHP vztažených na gestační věk k signifikantnímu snížení FPR na 0,23 % oproti původním 0,30 % (při použití „cut-off“ hodnot dle PH). Senzitivita zůstala zachována.
Table 3. Přehled výsledků analyzované kohorty novorozenců s pozitivním nálezem (tj. koncentrace 17-hydroxyprogesteronu nad „cut-off“) v pravidelném odběru novorozeneckého screeningu deficitu 21-hydroxylázy v období 2015–2017. 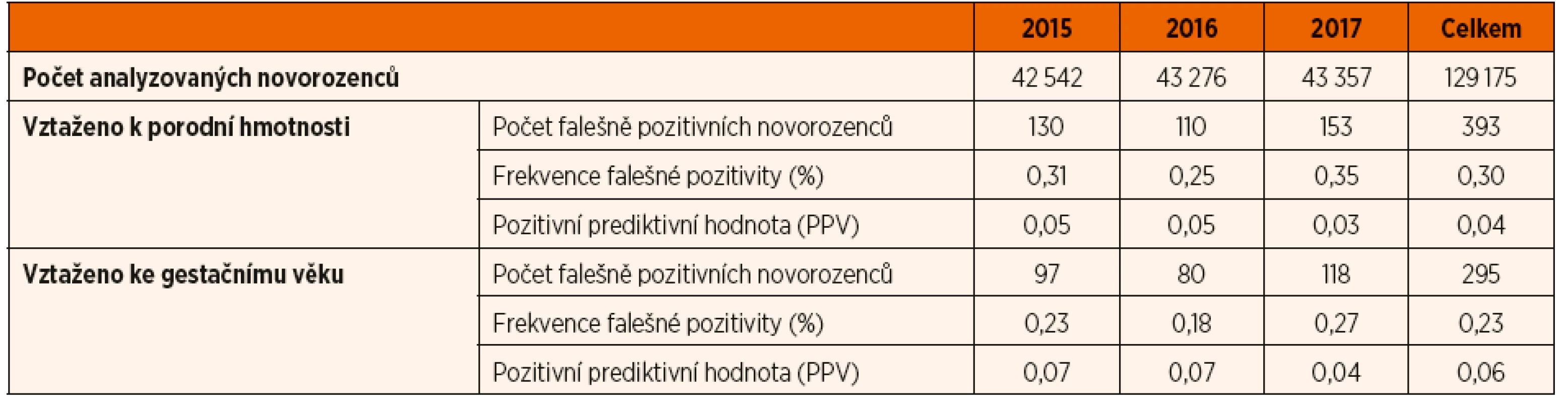
Table 4. Statické vyhodnocení významnosti rozdílu frekvencí falešné pozitivity v jednotlivých letech (porodní hmotnost versus gestační věk). Metoda Adjusted Wald Interval for a Difference of Proportions with Matched Pairs, odhadovaný parametr testovací statistiky leží v 95% intervalu spolehlivosti, který nepokrývá nulu. 
DISKUSE
NLS deficitu 21-hydroxylázy v ČR i v zahraničí vykazuje vysokou efektivitu [11–14]. Interpretace screeningových hodnot 17OHP je komplikovaná, závislá na postnatálním věku při odběru, gestačním věku, PH novorozence a jeho aktuální klinické situaci (stimulaci ACTH osy, např. hypoxií, septickým stavem či intrakraniálním krvácením) [15]. Gestační věk a PH nepřímo úměrně korelují s hodnotou 17OHP [16] a FPR [17]. PH lze považovat za parametr objektivnější a spolehlivější. Gestační věk se pouze odhaduje, avšak studie prokazují, že délka gestace lépe koreluje s hodnotami 17OHP [18].
Výsledky této studie prokázaly statisticky významný pokles FPR při hodnocení 17OHP podle gestačního věku novorozence. Potvrzují tak již dříve publikovaná data, která však byla provedena na menším vzorku dětí [19, 20]. Na druhé straně je nutné uvést, že použití korelace koncentrací 17OHP vůči gestačnímu věku sice významně snižuje FPR, ale nejefektivnějším nástrojem pro její další snížení je použití druhostupňových analýz přímo v originálních SKK, kde byla zjištěna koncentrace 17OHP nad „cut-off“ hodnotou. V tomto ohledu je v současné době nejefektivnější stanovení profilu dalších steroidů pomocí tandemové hmotnostní spektrometrie spojené s kapalinovou chromatografií – tzv. LC-MS/MS [1, 21]. Tento postup je v ČR připravován.
Falešná pozitivita v NLS obecně představuje významnou zátěž pro zdravou část populace, zejména na psychický stav rodičů zdravých novorozenců vystavených navazujícímu vyšetřovacímu postupu. Rodiče jsou po určitou dobu vystaveni informaci, že jejich dítě může trpět závažným onemocněním. I když je dalšími vyšetřeními toto podezření vyvráceno, stres či obavy mohou u některých rodičů přetrvávat [7]. Falešně pozitivní nálezy přináší též ekonomický aspekt, vyžadují opakovaná vyšetření a tím tak zvyšují náklady celého screeningového programu.
Za zmínku stojí též falešná negativita v NLS deficitu 21-hydroxylázy. Falešně negativní nálezy se mohou objevit z důvodů technické či logistické chyby při odběru, nejčastější příčinou jsou však klinicky mírné formy nemoci. Z celého období fungování NLS deficitu 21-hydroxylázy v ČR (2006–2017) je nám známo šest pacientů (dva s klasickou formou a čtyři s neklasickou formou) s hodnotou 17OHP pod „cut-off“ (tab. 5). U jednoho pacienta se však jednalo o „nepravou“ falešnou negativitu, protože před odběrem SKK byl léčen kortikoidy, u zbývajících pacientů šlo o skutečnou „biologickou“ falešnou negativitu. Z výše uvedeného vyplývá, že negativní screeningový výsledek obecně (nejen u deficitu 21-hydroxylázy) nevylučuje danou nemoc z diferenciálně diagnostické rozvahy, zpravidla se však jedná o klinicky mírnější formy.
Table 5. Přehled pacientů s deficitem 21-hydroxylázy, které novorozenecký screening v období 2006–2017 nedetekoval (známé falešně negativní nálezy). 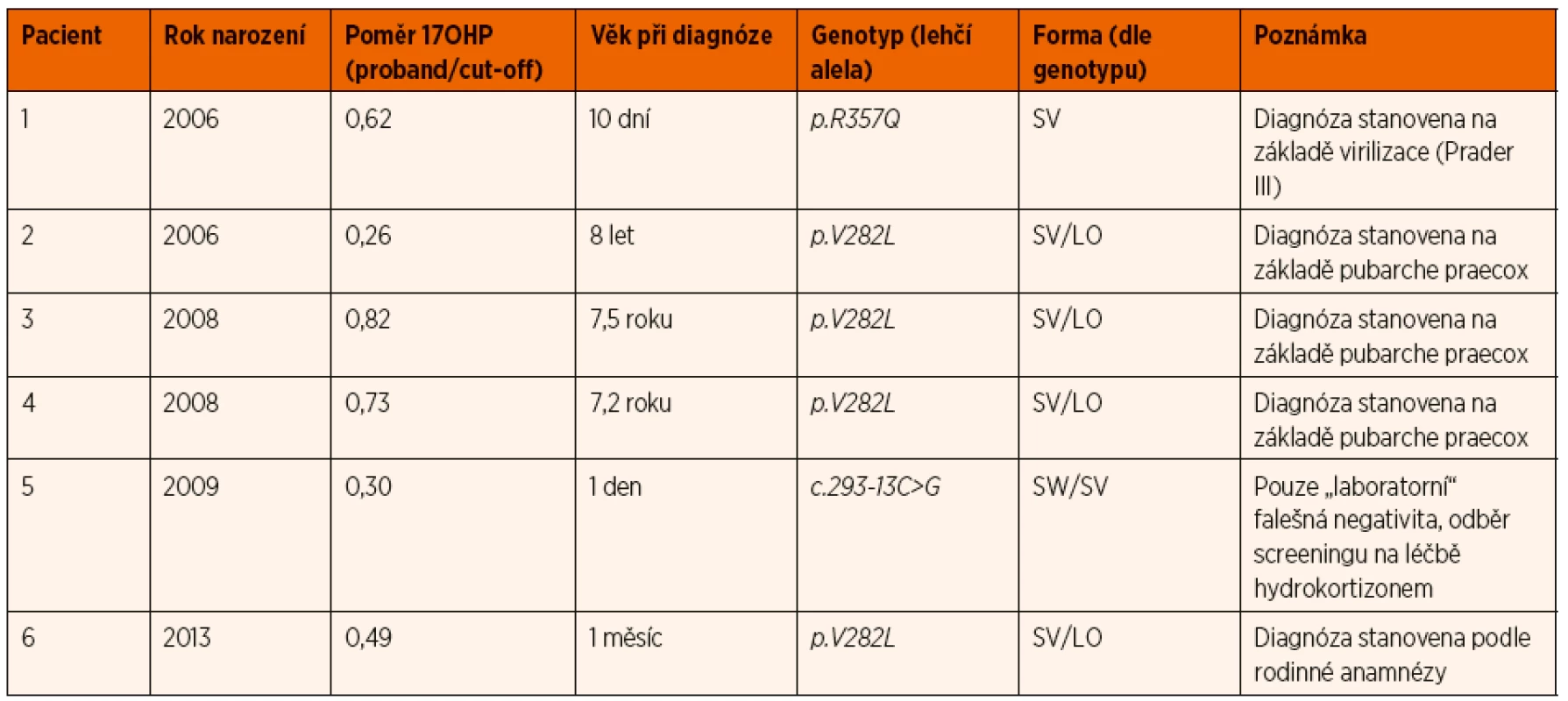
Zkratky: 17OHP – 17-hydroxyprogesteron, SV – klasická prostá virilizující forma, SV/LO – neklasická pozdní forma, SW/SV – klasická přechodná forma ZÁVĚR
Hodnocení screeningových hladin 17-hydroxyprogesteronu vůči gestačnímu věku významně sníží frekvenci falešné pozitivity při zachování stejné detekční schopnosti systému novorozeneckého laboratorního screeningu v České republice, a tím sníží negativní dopad a stigmatizaci zdravé části populace novorozenců a jejich rodin.
Došlo: 9. 11. 2018
Přijato: 20. 1. 2019
MUDr. Jan David, Ph.D.
Klinika dětí a dorostu 3. LF UK
Fakultní nemocnice Královské Vinohrady
Šrobárova 1150/50
100 34 Praha
e-mail: jan.david@centrum.cz
Sources
1. Speiser PW, Azziz R, Baskin LS, et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2010; 95 (9): 4133–4160.
2. Dunnen JT, Dalgleish R, Maglott DR, et al. HGVS Recommendations for the description of sequence variants: 2018 Update. Hum Mutat 2018; 37 : 564–569.
3. David J, Vinohradská H, Dejmek P, et al. Epidemiologické hodnocení výsledků novorozeneckého screeningu kongenitální adrenální hyperplazie v České republice. XII. Český pediatrický sjezd s mezinárodní účastí, Hradec Králové, 15. –17. 9. 2016. Abstrakt in: Čes-slov Pediat 2016; 71 (Suppl1): 42–43.
4. Van der Kamp HJ, Wit JM. Neonatal screening for congenital adrenal hyperplasia. Eur J Endocrinol 2004; 151 (Suppl 3): U71–75.
5. Metodický návod k zajištění novorozeneckého laboratorního screeningu a následná péče. Praha: Ministerstvo zdravotnictví ČR, 2016; 11 : 1–6.
6. Minutti CZ, Lacey JM, Magera MJ, et al. Steroid profiling by tandem mass spectrometry improves the positive predictive value of newborn screening for congenital adrenal hyperplasia. J Clin Endocrinol Metab 2004; 89 (8): 3687–3693.
7. Frankova V, Votava F, Kožich V. Etické aspekty rozšiřování novorozeneckého screeningu dědičných metabolických poruch. Čes-slov Pediat 2014; 69 : 87–94.
8. ÚZIS. Rodička a novorozenec. Praha: ÚZIS. http://www.uzis.cz/en/category/tematicke-rady/newborns.
9. ČSÚ. Obyvatelstvo. https://www.czso.cz/csu/czso/population.
10. Blankenstein O, Stopsack M, Fingerhut R, et al. The ISNS 17OHP initiative: Establishing of 17OHP cut-off levels by international collaboration. The 6th European Regional Meeting in Neonatal Screening, Praha, 26.–28. 4. 2009. Čes-slov Pediat 2009; 64 (4): 192–193.
11. Votava F, Kozich V, Chrastina P, et al. Performance metrics of 5 years of newborn screening in the Czech Republic. Int J Neonatal Screen 2016; 2 : 69–70.
12. Tsuji A, Konishi K, Hasegawa S, et al. Newborn screening for congenital adrenal hyperplasia in Tokyo, Japan from 1989 to 2013: a retrospective population-based study. BMC Pediatr 2015; 15 : 209.
13. Heather NL, Seneviratne SN, Webster D, et al. Newborn screening for congenital adrenal hyperplasia in New Zealand, 1994–2013. J Clin Endocrinol Metab 2015; 100 (3): 1002–1008.
14. Steigert M, Schoenle EJ, Biason-Lauber A, et al. High reliability of neonatal screening for congenital adrenal hyperplasia in Switzerland. J Clin Endocrinol Metab 2002; 87 (9): 4106–4110.
15. Anandi VS, Shaila B. Evaluation of factors associated with elevated newborn 17-hydroxyprogesterone levels. J Pediatr Endocrinol Metab 2017; 30 (6): 677–681.
16. Gruñeiro-Papendieck L, Prieto L, Chiesa A, et al. Neonatal screening program for congenital adrenal hyperplasia: adjustments to the recall protocol. Horm Res 2001; 55 (6): 271–277.
17. Slaughter JL, Meinzen-Derr J, Rose SR, et al. The effects of gestational age and birth weight on false-positive newborn-screening rates. Pediatrics 2010; 126 (5): 910–916.
18. Van der Kamp HJ, Oudshoorn CG, Elvers BH, et al. Cutoff levels of 17-alpha-hydroxyprogesterone in neonatal screening for congenital adrenal hyperplasia should be based on gestational age rather than on birth weight. J Clin Endocrinol Metab 2005; 90 (7): 3904–3907.
19. Torresani T, Grüters A, Scherz R, et al. Improving the efficacy of newborn screening for congenital adrenal hyperplasia by adjusting the cut-off level of 17α-hydroxyprogesterone to gestational age. Screening 1994; 3 (2): 77–84.
20. Cavarzere P, Camilot M, Teofoli F, et al. Neonatal screening for congenital adrenal hyperplasia in North-Eastern Italy: a report three years into the program. Horm Res 2005; 63 (4): 180–186.
21. Fiet J, Le Bouc Y, Guéchot J, et al. A Liquid chromatography/Tandem Mass Spectometry Profile of 16 serum steroids, including 21-deoxycortisol and 21-deoxycorticosterone, for management of congenital adrenal hyperplasia. J Endocr Soc 2017; 1 (3): 186–201.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2019 Issue 6-
All articles in this issue
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě I – Epidemiologie a chirurgické výsledky
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě II – Vývoj řeči
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě III – ORL výsledky
- Jaké jsou možnosti podpory kojení po časné plastice rozštěpu rtu v porodnici se statutem Baby-Friendly Hospital?
- Falešná pozitivita v novorozeneckém screeningu deficitu 21-hydroxylázy
- Vplyv etnicity a miery integrácie/segregácie rómskeho etnika na antropometrické parametre u ich novorodencov, narodených v oblasti severovýchodu Slovenska
- Problematika časné diagnostiky neuroinfekcí
- 14. česko-slovenský kongres dětské anestezie, intenzivní péče a urgentní medicíny Praha, 8.–9. listopad 2019
- Protilátkami zprostředkovaná rejekce u dětských pacientů po transplantaci ledviny
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Problematika časné diagnostiky neuroinfekcí
- Funkční výsledky pacientů s rozštěpem patra v letech 1993–2006 na Moravě I – Epidemiologie a chirurgické výsledky
- Falešná pozitivita v novorozeneckém screeningu deficitu 21-hydroxylázy
- Protilátkami zprostředkovaná rejekce u dětských pacientů po transplantaci ledviny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

