-
Medical journals
- Career
Etiopatogeneze dětské obezity
: I. Aldhoon Hainerová 1; H. Zamrazilová 2
: Klinika dětí a dorostu 3. LF UK a FN Královské Vinohrady, Praha 1; Endokrinologický ústav, Praha 2
: Čes-slov Pediat 2019; 74 (2): 70-76.
:
Obezita, jako multifaktoriální onemocnění, je dána interakcí genetických, metabolických, sociálně-ekonomických a environmentálních faktorů a je charakterizována nadměrnou akumulací tukové tkáně. Tělesná hmotnost je významně ovlivněna genetickými faktory. Udává se, že genetické faktory ovlivňují hodnotu indexu tělesné hmotnosti ze 60–80 %. Existují ryze geneticky podmíněné formy obezity, ať už se jedná o mendelovsky děděné syndromy, či o monogenní formy obezity. V obou případech se většinou jedná o těžké formy obezity začínající v časném dětském věku. U syndromů se v mnoha případech současně vyskytují jak vrozená vývojová postižení řady orgánů, tak různý stupeň mentální retardace. Naproti tomu monogenní formy obezity nemají bohatý fenotypický projev.
Endokrinopatie vedoucí k nárůstu tělesné hmotnosti představují pouze zlomek všech případů obezity v dětském věku. Mělo by se na ně pomýšlet zejména tehdy, pokud u jedince dojde ke zpomalení růstového tempa. Nápadně rychlý nárůst tělesné hmotnosti se spolu s hyperfagií a dalšími znaky souvisejícími s postižením centrálního nervového systému vyskytuje u hypotalamických forem obezit. Řada chronicky užívaných léků vyvolává nadměrnou akumulaci tukové tkáně, ať už stimulací centra hladu, či podporou adipogeneze. Rovněž prenatální faktory, včetně tělesné hmotnosti a výživy matky, intrauterinní programování a epigenetické faktory ovlivňují tělesnou hmotnost potomka v pozdějším věku. Známý je vliv rizikového chování spojeného s pozitivní energetickou bilancí, např. neadekvátní stravovací zvyky, absence pravidelné pohybové aktivity a nadměrný sedentarismus. Kauzálních faktorů obezity je známo více než osmdesát.
Tento přehledový článek má za cíl čtenáře jednak seznámit se známými etiopatogenetickými faktory obezity a jednak prezentovat i ty poněkud méně tradiční. Jednotlivé rizikové faktory nejenže interagují mezi sebou, ale dochází i k interakci s individuální genetickou predispozicí. Jak na poli výzkumném, tak i v běžné klinické praxi by odborník zabývající se problematikou obezity měl u každého obézního jedince cíleně pátrat po možných rizikových faktorech souvisejících s nárůstem tělesné hmotnosti.
Klíčová slova:
genetika – dětská obezita – etiopatogeneze – rizikové faktory obezity – adenovirus
ÚVOD
Na zvýšení výskytu obezity v posledních několika dekádách se bezesporu podílí environmentální faktory. Na druhou stranu je obezita považována za onemocnění, jehož vznik je významně podmíněn genetickými faktory [1]. Na základě dostupných studií lze usuzovat, že 60–80 % pozorované variability tělesné hmotnosti u lidí je dáno dědičnými faktory [2]. Studie jak monozygotních dvojčat, tak adoptovaných dětí ukázaly vyšší korelaci indexu tělesné hmotnosti (BMI) s biologickými než s adoptivními rodiči [3, 4]. Z toho též vyplývá skutečnost, že obezita jednoho či obou rodičů je význačným rizikovým faktorem pro rozvoj obezity potomka. V neposlední řadě existují důkazy, které potvrdily interakci rizikových alel řady genů obezity s prostředím [5]. V následujícím textu budou diskutovány kauzální i rizikové faktory vedoucí k nárůstu tělesné hmotnosti u lidí.
GENETIKA OBEZITY
Syndromy asociované s nadměrnou tělesnou hmotností
Dosud bylo identifkováno 79 syndromů asociovaných s obezitou [6]. Většina z nich se kromě obezity prezentuje dalšími fenotypickými znaky, zejména pak vrozenými orgánovými vadami, mentální retardací či neurokognitivními poruchami. Necelá čtvrtina syndromů byla geneticky objasněna. Je možné, že někteří jedinci, kteří nevykazují klinické známky syndromu spojeného s obezitou, jsou nositeli méně závažné mutace jednoho či více genů, které jsou známy ve spojitosti se syndromologickou obezitou.
Nejčastější ze syndromů je syndrom Pradera a Williho (též označovaného jako syndrom Pradera Labharta Williho), pro který je typická výrazná hypotonie po narození, neprospívání v prvních měsících života, následně od 1. roku hyperfagie s výrazným nárůstem tělesné hmotnosti. Jedinci s tímto syndromem vykazují různý stupeň mentální retardace, mají menší ruce a chodidla a dosahují nižší tělesné výšky. Pro další z častěji se vyskytujících syndromů – Bardetův-Biedlův syndrom (též označovaného jako Laurencův-Moonův-Bardetův-Biedlův syndrom) – je kromě obezity typická polydaktylie, retinitis pigmentosa, vrozené vady ledvin, hypogonadismus a poruchy chování. Tabulka 1 uvádí přehled některých ze syndromů spojených s obezitou. Existuje řada dosud nepojmenovaných klinických jednotek, u kterých je známá jak dědičnost, tak i místo genové mutace [6].
1. Vybrané syndromy spojené s obezitou. 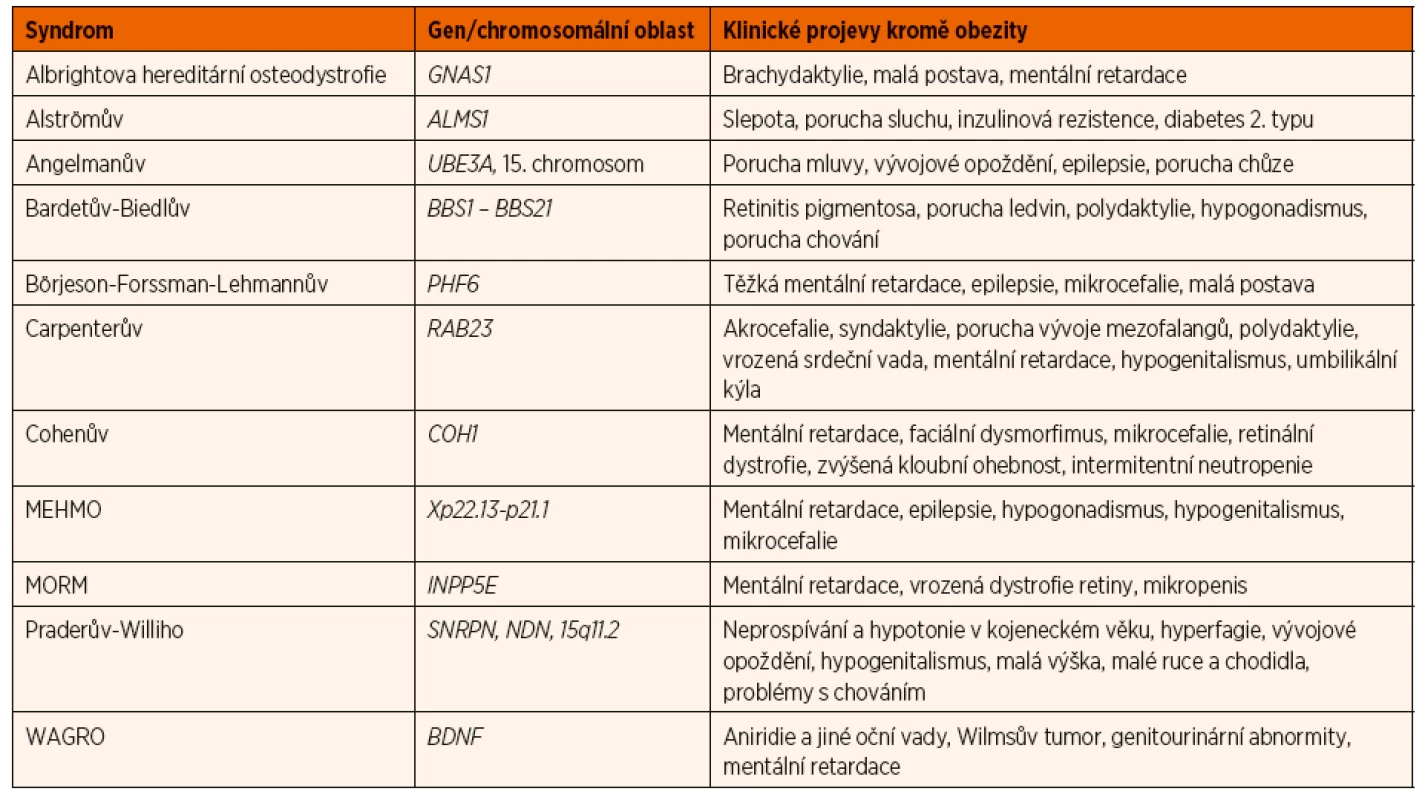
MORM syndrom (Mental retardation, truncal Obesity, Retinal dystrophy, and Micropenis); MEHMO syndrom (Mental retardation, Epilepsy, Hypogonadism/hypogenitalism, Microcephaly, and Obesity); WAGRO syndrom (Wilms tumor, Aniridia, Genitourinary anomalies, mental Retardation, and Obesity) Leptinová signalizační dráha
Až 4 % všech případů časně vzniklé těžké obezity mohou být vysvětlena vzácnými mutacemi genů zasahujícími do leptinové signalizační dráhy [7, 8]. Jedná se o mutace genů pro leptin, leptinový receptor, proopiomelanokortin a enzym prohormon konvertázu 1, který štěpí proopiomelanokortin. Poruchy způsobené inaktivací genů, které ovlivňují správné fungování leptinového receptoru, jako například Src homology 2 B adapter protein 1 (SH2B1), vedou k obezitě a neurokognitivním poruchám [9]. Bylo zjištěno, že některé ciliopatie, jako je například Bardetův-Biedlův syndrom, narušují leptinovou signalizační dráhu [10]. Homozygotní a heterozygotní inaktivační mutace genu pro melanokortinový receptor 4. typu (MC4R) vyvolává obezitu a hyperfagii v dětství [11]. Patří mezi nejčastější mutace způsobující tzv. monogenně podmíněnou obezitu. Studie téměř 300 českých dětí s obezitou vzniklou před 10. rokem života zjistila, že 2,4 % těchto dětí jsou nositeli mutace MC4R [12]. Vzácné mutace genu melanocortin receptor accessory protein 2 (MRAP2), který kóduje protein důležitý pro funkci MC4R, jsou též asociovány s obezitou u dětí [13]. Některé studie potvrdily roli polymorfismů melanokortinového receptoru 3. typu v regulaci tělesné hmotnosti, zejména pak u afroamerických dětí [14]. Mozkový neurotrofický faktor (brain derived neurotrophic factor, BDNF) nejspíše ovlivňuje leptinovou dráhu níže od MC4R. Haploinsuficience BDNF způsobuje časně vzniklou obezitu a neurokognitivní poruchy [15]. Zároveň heterozygotní inaktivační mutace genu kódující BDNF vede k obezitě, křečím a vývojovému opoždění [16]. Lze předpokládat, že postupně budou identifikovány další mutace genů způsobující obezitu zásahem do leptinové signalizace.
Běžné genové varianty ovlivňující energetickou bilanci
Dosud bylo identifikováno více než 300 genových lokusů, které se podílejí na regulaci tělesné hmotnosti u lidí či zvířecích modelů [17]. Minimálně u 32 z nich byl prokázán jejich význam v celogenomových studiích [18]. Některé extrémně vzácné genové varianty přímo ovlivňují funkci genu a chování jedince bez přispění obezitogenního prostředí. Většina z popsaných jednotlivých genových variant ovlivňuje tělesnou hmotnost menší měrou, ale přispívá ke genetické predispozici a k nárůstu tělesné hmotnosti, zvláště pak v interakci s obezitogenním prostředím. Geny mají vliv jak na energetický příjem, pocit sytosti, preferenci pokrmů a energetický výdej, tak na změnu tělesné hmotnosti, resp. množství tělesného tuku jako odpověď na pozitivní nebo negativní energetickou bilanci [19, 20].
Jednonukleotidové polymorfismy (single nucleotide polymorphisms, SNP) a varianty v počtu opakování určitých segmentů řady genů a chromosomálních oblastí jsou asociovány s tělesnou hmotností a tělesným složením. Mechanismus účinku není často objasněn. Nejkonzistentnější výsledky vztahu SNP a tělesné hmotnosti byly popsány u genu kódující fat mass and obesity associated protein (FTO) [21]. Rovněž naše studie 1443 adolescentů potvrdila souvislost rs9939609 FTO s nadváhou a obezitou [22]. Následně na rozšířeném souboru 1953 adolescentů se nám podařilo potvrdit asociaci této rizikové alely FTO s vyšším BMI [23].
Bylo zjištěno, že messengerová jednovláknová nukleová kyselina FTO je exprimována v oblastech mozku, které jsou důležité pro regulaci energetické balance a podílejí se na systému odměňování v mozku, tzv. reward system [24]. Některé studie u dětí prokázaly, že jedinci s minoritní alelou FTO mají vyšší kalorický příjem, snížený pocit sytosti a častěji se u nich vyskytuje ztráta kontroly nad konzumací potravy [25]. Ve studii Dušátkové s kol. byla riziková varianta rs9939609 FTO asociována s nižším příjmem vápníku [23]. Nicméně není stále jasné, zda výše zmíněné asociace a projevy souvisejí přímo s proteinem kódovaný FTO či s jinými geny, které ovlivňují oblast FTO [26].
PREKONCEPČNÍ, MATERNÁLNÍ A INTRAUTERINNÍ FAKTORY
Kromě genetické predispozice je zřejmé, že intrauterinní prostředí má významný vliv na riziko rozvoje obezity i metabolických komplikací v pozdějším věku jedince [27]. Některé z rizikových faktorů ovlivňujících aktuální vznik a rozvoj obezity potomka mohly ovšem působit intrauterinně již v minulosti, např. před dvěma generacemi [28]. Většinou se jedná o epigenetické změny (např. o metylaci). Je tedy možné, že nárůst obezity, který zaznamenáváme nyní, může být částečně způsoben změnami vnějšího prostředí již v minulých generacích. Vyšší věk matky při porodu je jeden z rizikových faktorů rozvoje obezity u potomka. Souvislost je částečně vysvětlena biologií odpřahujících proteinů (uncoupling protein). Uvádí se urychlená ztráta odpřahujícího proteinu 1 v hnědé tukové tkáni krátce po narození, což způsobí pozdější nadměrný nárůst bílé tukové tkáně [29]. Celosvětově došlo k nárůstu věku matek při porodu, což podle výpočtu může mít za následek až 7% nárůst rizika obezity [30].
Jak nadměrná tělesná hmotnost matky před těhotenstvím, tak i nadměrný nárůst tělesné hmotnosti během těhotenství vedou k nadměrné porodní hmotnosti potomka a následnému rozvoji metabolických komplikací, včetně porušenému glukózovému metabolismu [31]. S rozvojem obezity a kardiometabolických komplikací v průběhu života jedince jsou též spojovány intrauterinní růstová retardace, nízká porodní hmotnost, rychlý nárůst tělesné hmotnosti (tzv. catch-up) v kojeneckém věku a časný adipozity rebound [32]. Takzvaná Barkerova teorie původu zdraví a nemoci ukázala, že intrauterinní prostředí a fetální období může mít zásadní vliv na zdraví v pozdějším věku jedince.
ENDOKRINOPATIE SOUVISEJÍCÍ S NÁRŮSTEM TĚLESNÉ HMOTNOSTI
Pouze u 2–3 % dětí, které jsou odeslány k vyšetření pro nadměrnou tělesnou hmotnost, je příčinou obezity některé z onemocnění endokrinního systému. Hypotyreóza může vést k nárůstu BMI o 1–2 jednotky, což představuje většinou několik málo kilogramů [5]. Vzhledem k tomu, že se děti s hypotyreózou prezentují růstovou stagnací či snížením růstové rychlosti, BMI může být vysoké, aniž by tělesná hmotnost převyšovala 97. percentil k danému věku a pohlaví. Ke sníženému lineárnímu růstu a nárůstu tělesné hmotnosti vede nedostatečná sekrece růstového hormonu. Deficit růstového hormonu je spojován s nadměrným množstvím tělesného tuku, zejména v abdominální oblasti, a zároveň s úbytkem netukové složky. Cushingův syndrom zapříčiňuje rozvoj centrální obezity, i když u dětí může být přítomný celkový nárůst tělesné hmotnosti a též výrazně snížená růstová rychlost [33]. Inzulinomy jsou u dětí velmi vzácné. Zvýšená produkce inzulinu vede k hypoglykémiím, které vyvolávají zvýšený hlad, dochází k nadměrnému příjmu potravy a následně může dojít k rozvoji obezity [34].
STRUKTURÁLNÍ ZMĚNY HYPOTALAMU ASOCIOVANÉ S NÁRŮSTEM TĚLESNÉ HMOTNOSTI
Hypotalamická obezita se může rozvinout v rámci vrozených malformací, poranění či nádorů hypotalamu. Ztráta faktoru single-minded homolog 1 (Sim1), který je zodpovědný za vývoj hypotalamu, vede k obezitě u lidí [35]. U poloviny případů dětí chirurgicky léčených pro kraniofaryngeom dochází k rozvoji obezity [36].
FARMAKA
Řada dlouhodobě užívaných léků (glukokortikoidy, antipsychotika, antidepresiva, antikonvulziva, antidiabetika, antihypertenziva, antihistaminika, kontraceptiva a chemoterapeutika) může vést k nárůstu tělesné hmotnosti buď prostřednictvím navýšení chuti k jídlu, či podporou rozvoje tukové tkáně [37]. Mnohé z těchto léků působí na receptory ovlivňující regulaci tělesné hmotnosti či stimulují adipogenezi. Podíl užívání farmak na prevalenci obezity je třeba zohlednit s ohledem na nárůst preskripce jak antipsychotik, tak i antidiabetik, antikonvulziv a antihypertenziv posledních desetiletích [38].
FAKTORY VNĚJŠÍHO PROSTŘEDÍ PODÍLEJÍCÍ SE NA NÁRŮSTU TĚLESNÉ HMOTNOSTI
Z několika studií vyplývá snížení počtu hodin trávených chůzí či jízdou na kole. Naopak se zvyšuje cestování dopravními prostředky a přibývá počet hodin strávených pasivní činností (pasivní odpočívání, sledování televize, čas trávený u počítače a dalších elektronických zařízení, technologií, automatizace a robotizace pracovního procesu apod.). Nevhodné složení stravy, nadměrná konzumace sladkých nápojů, nedostatečná konzumace mléka, nedostatečná pohybová aktivita, nadměrné trávení času pasivními činnostmi (tzv. screen time) a doprava autem do školy byly asociovány s nadváhou a obezitou u dětí [39, 40]. Například ze studie britských dětí vyplynulo, že sledování televize po dobu více jak 8 hodin týdně u dětí ve věku 3 let bylo identifikováno jako rizikový faktor rozvoje obezity ve věku 7 let [41].
Nicméně je třeba zmínit, že řada odborníků nesdílí názor, že epidemie obezity je dána jenom konzumací nezdravých potravin v důsledku marketingových praktik (zvětšení porcí v restauracích, instalace prodejních automatů ve školách, větší dostupnost zařízení rychlého občerstvení a sladkých nápojů apod.) a snížením pohybové aktivity. Podle některých autorů neexistují jasně podložená data, která by roli výše uvedených faktorů v rámci jak asociačních, tak intervenčních studií jasně prokázala [38]. Proto výzkum etiopatogeneze obezity neopomíjí další možné faktory, z nichž některé zmiňujeme níže.
Infekce lidským adenovirem 36
Lidský adenovirus 36 (Adv36) vedl k navýšení tělesné hmotnosti u infikovaných kuřat, krys a opic [42]. Většina studií u lidí prokázala, že jedinci s pozitivními protilátkami proti lidskému Adv36 mají vyšší výskyt obezity a tělesnou hmotnost [43, 44]. Studie 1179 českých adolescentů potvrdila souvislost protilátek proti Adv36 s obezitou a nadváhou. Ukázalo se, že pozitivita protilátek proti Adv36 významně asociovala se zvýšenou tělesnou hmotností a BMI [45]. Role infekce v patogenezi obezity se potvrzuje i ve studiích zabývajících se střevní mikroflórou a mikrobiomem během posledních několika let.
Nedostatek spánku
Negativní závislost mezi počtem hodin spánku a BMI byla potvrzena v průřezových a longitudinálních studiíchu dospělých i dětí [46, 47]. Chronický nedostatek spánku souvisí se zvýšeným pocitem hladu a chuti k jídlu, sníženou sekrecí leptinu a tyreotropního hormonu a dále se zvýšenou koncentrací ghrelinu [48]. Je známo, že za posledních několik desetiletí se doba spánku u dospělých i dětí významně snížila [38].
Endokrinní disruptory a polutanty vnějšího prostředí
Některé vyráběné chemické látky, jakými jsou například bisfenol A, či polutanty vnějšího prostředí mohou ovlivnit hormonální regulaci organismu. Endokrinní disruptory působí antiandrogenně, či inhibují aromatázy a ovlivňují koncentraci estrogenů v těle [49]. Množství endokrinních disruptorů se za poslední roky v potravinách navýšilo, jak například ukázaly studie sledující koncentraci některých látek v mateřském mléce [50].
Ovlivňování teploty
Termoneutrální zóna je okolní teplota, při které se nezvyšuje energetický výdej. Naopak pokud teplota je nad/pod touto zónou, dochází k navýšení energetického výdeje, ke snížení energetických zásob, včetně tukových. V současné době se lidé pohybují častěji v termoneutrální zóně než v minulosti používáním klimatizace či topení.
Zanechání kouření
Klinické i epidemiologické studie ukázaly, že kuřáci mají nižší tělesnou hmotnost oproti nekuřákům. Zároveň zanechání kouření je často spojeno s nárůstem tělesné hmotnosti. Nikotin má jednak termogenní účinek a jednak potlačuje chuť k jídlu. Potlačení chuti k jídlu se ještě zvýrazňuje při konzumaci kofeinu [51]. Statistiky ukazují, že například v USA se podíl kuřáků významně snížil při současném nárůstu prevalence obezity [52].
Socioekonomické faktory a demografické změny
Sociokulturní a ekonomické faktory hrají důležitou roli v nárůstu výskytu obezity [53]. Vliv prostředí na jedince začíná prostřednictvím samotné rodiny a postupně se rozšiřuje na vrstevníky, okolí bydliště a školy (obr. 1). Nezanedbatelnou roli hrají národní a kulturní zvyklosti. Například prostředí okolí bydliště může výrazně ovlivnit stupeň pohybové aktivity (přítomnost/absence hřišť, parků a cyklostezek, otázka bezpečnosti).
1. Vlivy bezprostředního okolí a vnějšího prostředí na tělesnou hmotnost dítěte. 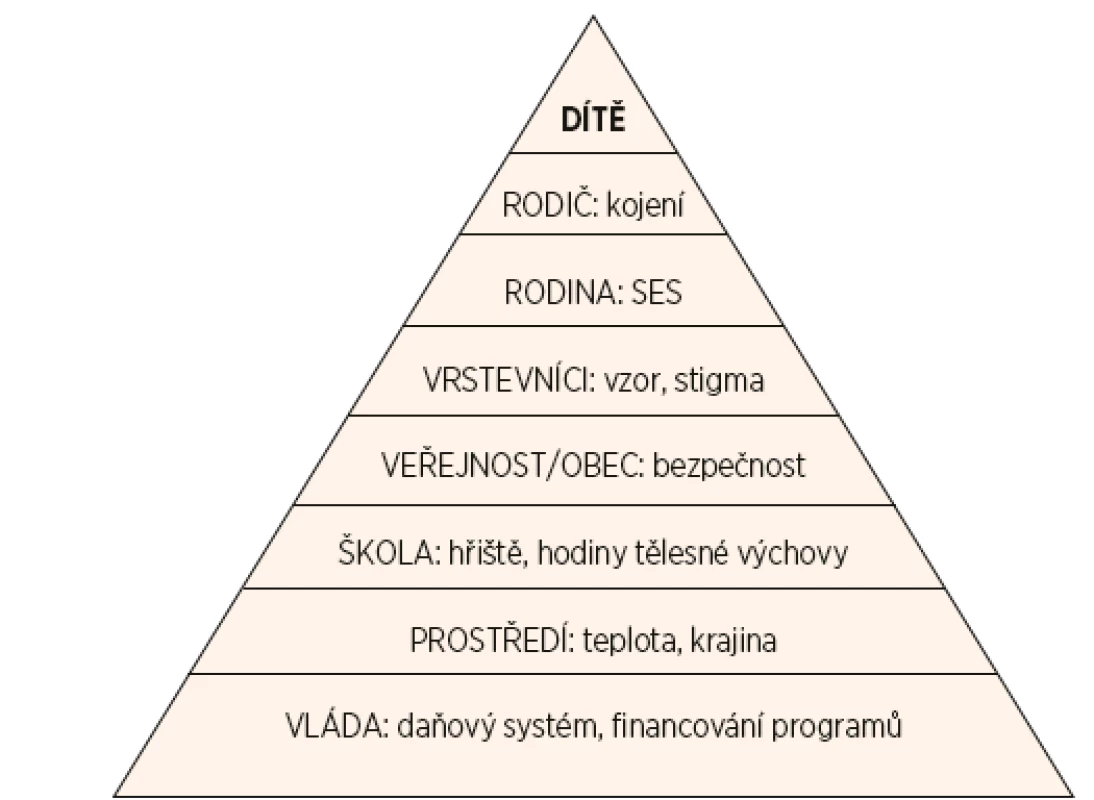
SES – socioekonomický status Na často citovaném příkladu Pima Indiánů žijících v rezervaci v Arizoně je ukázán zásadní vliv prostředí a jeho interakce s genovou predispozicí. Tito Indiáni mají významně vyšší výskyt obezity a diabetu než jejich geneticky příbuzní jedinci žijící v izolované vesnici v Mexiku [54]. Dospívající Asiati či Hispánci narození ve Spojených státech amerických (USA) mají vyšší výskyt obezity než generace, která se do USA přistěhovala [55].
Výrazně vyšší výskyt obezity u některých etnik je znám. Afroameričani a Hispánci jsou častěji obézní oproti kavkazské rase. V USA došlo k populačnímu nárůstu právě u ras s vyšším výskytem obezity. Jak zmiňuje Keith, i tyto demografické změny v populaci mohou přispívat k celkovému navýšení prevalence obezity v USA [38].
Vliv prostředí začíná rodiči a dále se rozšiřuje na vrstevníky, sousedství, školy a pak na politiku ve vztahu k zdravému životnímu stylu populace (upraveno podle Yanovski [5], obr. 1).
Další možné faktory
Mezi další faktory se řadí nárůst deprese u dětí, práce na směny, nekojení, menší příjem vápníku a mléčných výrobků apod. [56–59]. V naší studii z roku 2015 byl prokázán významně nižší příjem vápníku u jedinců s nadměrnou hmotností oproti štíhlým vrstevníkům [23].
Je nezbytné si uvědomit, že vliv jednoho rizikového faktoru na tělesnou hmotnost může být relativně malý, avšak spolupůsobení více faktorů může mít výraznější vliv na tělesnou hmotnost. Pro výsledný vliv je pak zásadní interakce s genetickou vnímavostí a predispozicí jedince [60].
ZÁVĚR
Dětská obezita je multifaktoriální onemocnění ovlivněné genetickými, psychosociálními a epigenetickými faktory společně v interakci s vlivy vnějšího prostředí. I když je celosvětový nárůst výskytu obezity často dáván do souvislosti se změnami prostředí s následkem zvýšené konzumace potravy o vysokém energetickém obsahu a sedavého způsobu života, a rovněž je známá zásadní role genetické predispozice v regulaci energetické bilance a tělesní hmotnosti, byla identifikována řada dalších etiopatogenetických faktorů obezity, které je třeba zohlednit.
U každého obézního jedince je žádoucí provést rozbor možných rizikových faktorů rozvoje obezity. Některé z rizikových faktorů lze zároveň využít v preventivních a intervenčních opatřeních jak na celospolečenské úrovni, tak i individuálně.
Podpořeno granty Progres Q36 a AZV 17-31670A.
MUDr. Irena Aldhoon Hainerová, Ph.D.
Klinika dětí a dorostu 3. LF UK
a FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: ihainer@hotmail.com
Sources
- Hainer V, Bendlová B, Hainerová I, et al. Úloha genetických faktorů v patogenezi a léčbě obezity. DMEV 2006; Suppl 1 : 56–64.
- Segal NL, Feng R, McGuire SA, et al. Genetic and environmental contributions to body mass index: comparative analysis of monozygotic twins, dizygotic twins and same-age unrelated siblings. Int J Obes (Lond) 2009; 33 : 37–41.
- Skytthe A, Kyvik K, Holm NV, et al. The Danish Twin Registry: 127 birth cohorts of twins. Twin Res 2002; 5 : 352–357.
- Stunkard AJ, Sorensen TI, Hanis C, et al. An adoption study of human obesity. N Engl J Med 1986; 314 : 193–198.
- Yanovski JA. Pediatric obesity. An introduction. Appetite 2015; 93 : 3–12.
- Kaur Y, de Souza RJ, Gibson WT, et al. A systematic review of genetic syndromes with obesity. Obes Rev 2017; 18 (6): 603–634.
- Hainerová I. Vznik obezity na základě mutací genů ovlivňující energetickou bilanci. Čas Lék Čes 2007; 146 : 240–245.
- Hainerová I, Lebl J. Monogenní formy obezity. DMEV 2004; 4 : 188–193.
- Doche ME, Bochukova EG, Su HW, et al. Human SH2B1 mutations are associated with maladaptive behaviors and obesity. J Clin Invest 2012; 122 : 4732–4736.
- Feuillan PP, Ng D, Han JC, et al. Patients with Bardet-Biedl syndrome have hyperleptinemia suggestive of leptin resistance. J Clin Endocrinol Metab 2011; 96: E528–E535.
- Farooqi IS, Keogh JM, Yeo GS, et al. Clinical spectrum of obesity and mutations in the melanocortin 4 receptor gene. N Engl J Med 2003; 348 : 1085–1095.
- Hainerová I, Larsen LH, Holst B, et al. Melanocortin 4 receptor mutations in obese Czech children: studies of prevalence, phenotype development, weight reduction response, and functional analysis. J Clin Endocrinol Metab 2007; 92 (9): 3689–3696.
- Asai M, Ramachandrappa S, Joachim M, et al. Loss of function of the melanocortin 2 receptor accessory protein 2 is associated with mammalian obesity. Science 2013; 341 : 275–278.
- Savastano DM, Tanofsky-Kraff M, Han JC, et al. Energy intake and energy expenditure among children with polymorphisms of the melanocortin-3 receptor. Am J Clin Nutr 2009; 90 : 912–920.
- Han JC, Thurm A, Golden Williams C, et al. Association of brain-derived neurotrophic factor (BDNF) haploinsufficiency with lower adaptive behaviour and reduced cognitive functioning in WAGR/11p13 deletion syndrome. Cortex 2013; 49 : 2700–2710.
- Yeo GS, Connie Hung CC, Rochford J, et al. A de novo mutation affecting human TrkB associated with severe obesity and developmental delay. Nat Neurosci 2004; 7 : 1187–1189.
- Rankinen T, Zuberi A, Chagnon YC, et al. The human obesity gene map. The 2005 update. Obesity 2006; 14 : 529–644.
- Speliotes EK, Willer CJ, Berndt SI, et al. Association analyses of 249,796 individuals reveal 18 new loci associated with body mass index. Nat Genet 2010; 42 : 937–948.
- Bouchard C, Tremblay A, Despres JP, et al. The response to long-term overfeeding in identical twins. N Engl J Med 1990; 322 : 1477–1482.
- Hainer V, Stunkard AJ, Kunesova M, et al. Intrapair resemblance in very low calorie diet-induced weight loss in female obese identical twins. Int J Obes Relat Metab Disord 2000; 24 : 1051–1057.
- Hunt SC, Stone S, Xin Y, et al. Association of the FTO gene with BMI. Obesity 2008; 16 : 902–904.
- Dušátková L, Zamrazilová H, Sedláčková B, et al. Association of obesity susceptibility gene variants with metabolic syndrome and related traits in 1,443 Czech adolescents. Folia Biol (Praha) 2013; 59 (3): 123–133.
- Dušátková L, Zamrazilová H, Aldhoon-Hainerová I, et al. A common variant near BDNF is associated with dietary calcium intake in adolescents. Nutr Res 2015; 35 (9): 766–773.
- Fredriksson R, Hagglund M, Olszewski PK, et al. The obesity gene, FTO, is of ancient origin, up-regulated during food deprivation and expressed in neurons of feeding-related nuclei of the brain. Endocrinol 2008; 149 : 2062–2071.
- Tanofsky-Kraff M, Han JC, Anandalingam K, et al. The FTO gene rs9939609 obesity-risk allele and loss of control over eating. Am J Clin Nutr 2009; 90 : 1483–1488.
- Smemo S, Tena JJ, Kim KH, et al. Obesity-associated variants within FTO form long-range functional connections with IRX3. Nature 2014; 507 : 371–375.
- Ludwig DS, Currie J. The association between pregnancy weight gain and birthweight. A within-family comparison. Lancet 2010; 376 : 984–990.
- Finch CE, Loehlin JC. Environmental influences that may precede fertilization: a first examination of the prezygotic hypothesis from maternal age influences on twins. Behav Genet 1998; 28 : 101–106.
- Symonds ME, Pearce S, Bispham J, et al. Timing of nutrient restriction and programming of fetal adipose tissue development. Proc Nutr Soc 2004; 63 : 397–403.
- Patterson ML, Stern S, Crawford PB, et al. Sociodemographic factors and obesity in preadolescent black and white girls: NHLBI’s Growth and Health Study. J Natl Med Assoc 1997; 89 : 594–600.
- Yu Z, Han S, Zhu J, et al. Pre-pregnancy body mass index in relation to infant birth weight and offspring overweight/obesity. A systematic review and meta-analysis. PLoS One 2013; 8: e61627.
- Barker DJ. The origins of the developmental origins theory. J Int Med 2007; 261 : 412–417.
- Greening JE, Storr HL, McKenzie SA, et al. Linear growth and body mass index in pediatric patients with Cushing’s disease or simple obesity. J Endocrinol Invest 2006; 29 : 885–887.
- Bonfig W, Kann P, Rothmund M, et al. Recurrent hypoglycemic seizures and obesity: delayed diagnosis of an insulinoma in a 15 year-old boy – final diagnostic localization with endosonography. J Pediatr Endocrinol Metab 2007; 20 : 1035–1038.
- Hung CC, Luan J, Sims M, et al. Studies of the SIM1 gene in relation to human obesity and obesity-related traits. Int J Obes Obesity 2007; 31 (3): 429–434.
- Srinivasan S, Ogle GD, Garnett SP, et al. Features of the metabolic syndrome after childhood craniopharyngioma. J Clin Endocrinol Metab 2004; 89 : 81–86.
- Maayan L, Correll CU. Weight gain and metabolic risks associated with antipsychotic medications in children and adolescents. J Child Adolesc Psychopharmacol 2011; 21 : 517–535.
- Keith SW, Redden DT, Katzmarzyk PT, et al. Putative contributors to the secular increase in obesity: exploring the roads less traveled. Int J Obes (Lond) 2006; 30 (11): 1585–1194.
- Gubbels JS, van Assema P, Kremers SP. Physical activity, sedentary behavior, and dietary patterns among children. Curr Nutr Rep 2013; 2 : 105–112.
- Ottevaere C, Huybrechts I, Benser J, et al. Clustering patterns of physical activity, sedentary and dietary behavior among European adolescents: The HELENA study. BMC Publ Health 2011; 11 : 328–338.
- Reilly JJ, Armstrong J, Dorosty AR, et al. Early life risk factors for obesity in childhood: cohort study. BMJ 2005; 330 (7504): 1357.
- Dhurandhar NV, Kulkarni P, Ajinkya SM, et al. Effect of adenovirus infection on adiposity in chicken. Vet Microbiol 1992; 31 : 101–107.
- Hainer V, Hainerová IA, Zamrazilová H. Role of infection in the pathogenesis of obesity. Cas Lek Cesk 2012; 151 (12): 563–567.
- Hainer V, Zamrazilová H, Kunešová M, et al. Obesity and infection: reciprocal causality. Physiol Res 2015; 64 (Suppl 2): S105–S119.
- Aldhoon-Hainerová I, Zamrazilová H, Atkinson RL, et al. Clinical and laboratory characteristics of 1179 Czech adolescents evaluated for antibodies to human adenovirus 36. Int J Obes (Lond) 2014; 38 (2): 285–291.
- von Kries R, Toschke AM, Wurmser H, et al. Reduced risk for overweight and obesity in 5 - and 6-years-old children by duration of sleep – a cross-sectional study. Int J Obes Relat Metab Disord 2002; 26 : 710–716.
- Gangwisch JE, Malaspina D, Boden-Albala B, et al. Inadequate sleep as a risk factor for obesity: analysis of the NHANES I. Sleep 2005; 28 : 1289–1296.
- Spiegel K, Tasali E, Penev P, et al. Brief communication: sleep curtailment in healthy young men is associated with decreased leptin levels, elevated ghrelin levels, and increased hunger and appetite. Ann Intern Med 2004; 141 : 846–850.
- Pelletier C, Imbeault P, Tremblay A. Energy balance and pollution by organochlorines and polychlorinated biphenyls. Obes Rev 2003; 4 : 17–24.
- Noren K, Meironyte D. Certain organochlorine and organobromine contaminants in Swedish human milk in perspective of past 20–30 years. Chemosphere 2000; 40 : 1111–1123.
- Jessen AB, Buemann B, Toubro S, et al. The appetite-suppressant effect of nicotine is enhanced by caffeine. Diab Obes Metab 2005; 7 : 327–333.
- Centers for Disease Control and Prevention. Cigarette smoking among adults – United States, 2002. Morb Mortal Wkly Rep 2004; 53 : 427–431.
- Hawkins SS, Cole TJ, Law C. An ecological systems approach to examining risk factors for early childhood overweight. Findings from the UK Millennium Cohort Study. J Epidemiol Comm Health 2009; 63 : 147–155.
- Ravussin E, Valencia ME, Esparza J, et al. Effects of a traditional lifestyle on obesity in Pima Indians. Diabetes Care 1994; 17 : 1067–1074.
- Popkin BM, Udry JR. Adolescent obesity increases significantly in second and third generation U.S. immigrants. The National Longitudinal Study of Adolescent Health. J Nutr 1998; 128 : 701–706.
- Pine DS, Goldstein RB, Wolk S, et al. The association between childhood depression and adulthood body mass index. Pediatrics 2001; 107 : 1049–1056.
- Di Lorenzo L, De Pergola G, Zocchetti C, et al. Effect of shift work on body mass index: results of a study performed in 319 glucose-tolerant men working in a Southern Italian industry. Int J Obes Relat Metab Disord 2003; 27 : 1353–1358.
- Arenz S, Ruckerl R, Koletzko B, et al. Breast-feeding and childhood obesity – a systematic review. Int J Obes Relat Metab Disord 2004; 28 : 1247–1256.
- Zemel MB, Thompson W, Milstead A, et al. Calcium and dairy acceleration of weight and fat loss during energy restriction in obese adults. Obes Res 2004; 12 : 582–590.
- Friedman JM. A war on obesity, not the obese. Science 2003; 299 (5608): 856–858.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2019 Issue 2-
All articles in this issue
- Etiopathogenesis of childhood obesity
- Prevalence of overweight and obesity in seven year old children in the Czech Republic, relation to adipose tissue distribution
- Overweight and obesity among children aged 7–8: Results of the WHO project in Slovakia
- The effect of nutrition on the development of obesity in different periods of childhood
- Metabolic syndrome in childhood
- Obesity and hypertension in children
- Physical activities in the prevention and therapy of childhood obesity
- Secular changes in body composition, fat distribution and physical activity in Czech children
- Our experience and psychotherapy of children’s obesity
- Step by step or how to deal with obese child (Manual from our children's clinic for therapy obesity)
- Editorial: Obezita u dětí
- Obezita v dětském věku – historie a současnost
- MEZIOBOROVÉ STANOVISKO K POOPERAČNÍ PÉČI U DOSPĚLÝCH A DĚTSKÝCH PACIENTŮ PO TONZILOTOMII NEBO TONZILEKTOMII
- Ocenění České pediatrické společnosti
- 38. PRACOVNÍ DNY DĚTSKÉ NEFROLOGIE 23.–24. červen 2017 Hotel Růže, Český Krumlov
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Overweight and obesity among children aged 7–8: Results of the WHO project in Slovakia
- Etiopathogenesis of childhood obesity
- Obesity and hypertension in children
- Obezita v dětském věku – historie a současnost
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

