-
Medical journals
- Career
Rotaviry a další původci gastroenteritid u pacientů hospitalizovaných na Klinice dětských infekčních nemocí Fakultní nemocnice Brno v letech 2015 a 2016
Authors: M. Malá 1; M. Trnková 1; V. Musil 1; A. Ševčíková 2; L. Krbková 1
Authors‘ workplace: Klinika dětských infekčních nemocí LF MU a FN Brno 1; Oddělení klinické mikrobiologie, FN Brno 2
Published in: Čes-slov Pediat 2017; 72 (7): 396-403.
Category:
Overview
Cíl studie:
Analyzovat etiologii střevních patogenů u dětí přijatých na Kliniku dětských infekčních nemocí Fakultní nemocnice Brno v letech 2015–2016 se zaměřením na rotavirové gastroenteritidy (RVGE).Metody:
Retrospektivní studie hodnotí dětské pacienty ve věku 0–18 let s příznaky gastroenteritidy hospitalizované od 1. 1. 2015 do 31. 12. 2016. Všem pacientům byl odebrán výtěr z rekta na kultivaci obligátních střevních patogenů, v určitých případech také vzorek stolice na identifikaci virových antigenů a na průkaz Clostridium difficile.Výsledky:
Pacientů s gastroenteritidou bylo hospitalizováno 1083 v roce 2015 a 988 v roce 2016. Virovou infekci jsme prokázali u 36,0 % a 29,0 % pacientů v letech 2015 a 2016. RVGE bylo 28,2 %, resp. 18,2 %. Adenovirových gastroenteritid jsme zaznamenali 3,2 %, resp. 5,0 %. Norovirových gastroenteritid bylo 4,6 %, resp. 5,8 %. Bakteriální infekci jsme prokázali u 14,6 % pacientů v obou letech, z nichž nejvíce bylo salmonelóz (9,3 %; 8,3 %), méně kampylobakterióz (4,2 %; 5,2 %), klostridiových kolitid (0,9 %; 0,7 %) a nejméně yersinióz (0,0 %; 0,4 %). Nikdo nebyl hospitalizován s infekcí způsobenou Shigella spp. Etiologie zůstala neobjasněna v 49,7 %, resp. 56,6 % případů. Maximum případů virových onemocnění se vyskytlo u dětí do 5 let (83,3 %; 82,5 %), konkrétně ve skupině 13–36 měsíců (44,6 %; 47,6 %). U pacientů s RVGE bylo nejvíce případů u dětí do 5 let (82,3 %; 80,6 %) a ve skupině 13–36 měsíců (41,0 %; 42,8 %). Maximum případů bakteriálních onemocnění bylo u dětí nad 5 let (54,4 %, 46,5 %). Nejvíce RVGE jsme zaregistrovali v dubnu 2015 a v březnu a dubnu 2016.Závěr:
Pacienti s RVGE tvoří i v dnešní době dostupného očkování nezanedbatelnou část pacientů hospitalizovaných pro gastroenteritidu (23,4 %).Klíčová slova:
akutní gastroenteritida, rotavirus, rotavirová gastroenteritida, dětiÚVOD
Střevní infekce spolu s infekcemi respiračními patří mezi nejčastější onemocnění dětského věku. Původci střevních infekcí u dětí jsou jak bakteriální (převládají infekce vyvolané Campylobacter spp, Salmonella spp, mnohem méně jsou zastoupené infekce způsobené Yersinia enterocolitica, Shigella spp, specifickými kmeny Escherichia coli a také klostridiové kolitidy způsobené Clostridium difficile aj.), tak virové (způsobené rotaviry, adenoviry, noroviry, koronaviry, astroviry aj.). Ostatní příčiny (protozoární, parazitární nebo importované nákazy) bývají u dětí vzácné [1].
Rotaviry, neobalené RNA viry velikosti 65 až 70 nm z čeledi Reoviridae, jsou jedním z hlavních původců gastroenteritidy s celosvětově vysokou morbiditou. Jsou charakterizovány podstatnou genetickou diverzitou. Je popsáno osm skupin rotavirů označovaných písmenem A–H. Čtyři skupiny způsobují infekci u lidí (skupiny A, B, C a H). Humánní infekce jsou až v 90 % způsobeny rotaviry skupiny A (RVA) [2]. Podobně jako u viru chřipky je k popisu sérotypů používán duální klasifikační systém založený na dvou povrchových strukturálních proteinech viru, glykoprotein VP7 determinuje typ G a proteáza-senzitivní protein VP4 typ P [3]. Dosud bylo u RVA popsáno 27 G a 37 P genotypů, podle současných poznatků jen 12 G a 15 P typů způsobuje infekci u lidí. Antigenní struktura virů se mění antigenním shiftem a mechanismem rekombinace humánních kmenů s nehumánními kmeny [4, 5].
Přenos virionů se uskutečňuje primárně fekálně-orální cestou včetně přenosu přes kontaminovaný povrch prostředí. Přenos vzdušnou cestou byl sice opakovaně zvažován, ale respirační patogenita viru prokázána nebyla [4]. K vyvolání příznaků při primoinfekci stačí pouze několik jednotek virionů.
Rotaviry primárně napadají zralé epiteliální buňky vrcholků klků tenkého střeva, kde se replikují a způsobí lýzu enterocytů. Narušení normální trávicí a absorpční funkce tenkého střeva vede k malabsorpci, osmotickému průjmu a excesivní ztrátě elektrolytů, sekreční komponenta průjmu spolu se zvýšenou motilitou střeva dále zhoršuje onemocnění [6]. Virus je prokazatelný ve stolici již přibližně 5 dní před klinickými projevy onemocnění, nejvyšší koncentrace virionů ve stolici dosahuje v prvních 4 dnech klinických potíží a snižuje se po 7 dnech [7].
Rotavirová gastroenteritida (RVGE) je onemocnění s variabilním klinickým obrazem, který se může rozvinout po inkubační době trvající 1–3 dny. Infekce je lokalizovaná zejména na tenké střevo, symptomy jsou nespecifické (bolest břicha, zvracení, průjem, horečka) a trvají několik dní. Patogeneze a s tím spojená závažnost infekce je závislá na faktorech viru i hostitele, zejména na věku. Nejzávažnější onemocnění se vyskytuje u dětí ve věku od 3 do 35 měsíců, u kterých již významně poklesly hodnoty transplacentárně přenesených mateřských protilátek [4, 8]. Imunitní odpověď se vyvíjí s každou infekcí, proto následné infekce bývají méně závažné. Žádná cílená antivirová terapie není v současné době k dispozici. Symptomatická léčba se opírá o náhradu tekutin a ztrát iontů, která může být v rozvojových zemích ekonomicky nebo geograficky nedostupná a tím staví vakcinaci do popředí zájmu.
V České republice jsou v současné době dostupné dvě perorální vakcíny proti rotavirům, Rotarix® (GlaxoSmithKline Biologicals S.A., Rixensart, Belgie) a RotaTeq® (Merck Sharp and Dohme, B.V. Haarlem, Nizozemsko). Rotarix® je vakcína obsahující jeden atenuovaný humánní kmen RIX4414 s prokázanou účinností proti gastroenteritidě způsobené nejběžnějšími rotavirovými genotypy G1P[8],G2P[4], G3P[8] a G9P[8] a vzácným rotavirovým genotypům G8P[4] a G12P[6]. Aplikační schéma se skládá ze dvou dávek.
RotaTeq® je vakcína obsahující živé rotavirové humánně-bovinní reasortanty typu G1–G4 a P1A[8]. Účinnost byla prokázána proti gastroenteritidě způsobené rotavirovými genotypy G1P[8], G2P[4], G3P[8], G4P[8] a G9P[8]. Aplikační schéma je třídávkové. Rotavirová vakcína v ČR není součástí povinného očkovacího kalendáře.
V této práci předkládáme výsledky zahrnující etiologii střevních patogenů u dětí ve věku 0–18 let hospitalizovaných na Klinice dětských infekčních nemocí (KDIN) Fakultní nemocnice Brno (FN Brno) v letech 2015–2016, zaměřujeme se zejména na rotavirové gastroenteritidy (RVGE).
MATERIÁL A METODY
Pacienti a materiál
Představujeme retrospektivní shrnutí pediatrických pacientů hospitalizovaných za dvouleté období, od 1. 1. 2015 do 31. 12. 2016, na KDIN FN Brno s příznaky gastroenteritidy. Zařízení provozuje ambulantní a lůžkovou část zahrnující jednotku intenzivní péče a 2 standardní oddělení (s celkovým počtem 50 lůžek) pro dětské pacienty do dovršení 19. roku věku s různým spektrem diagnóz. Pro účely této studie byl vybrán soubor hospitalizovaných pacientů (<19 let) s klinickými příznaky gastritidy a/nebo enterokolitidy. Jednotlivé podskupiny byly rozděleny podle věku. Všem pacientům byl odebrán výtěr z rekta na kultivaci obligátních střevních patogenů, v určitých případech vzorek stolice na identifikaci virových antigenů a na průkaz Clostridium difficile.
V případě indikovaného odběru na C. difficile je klostridiová kolitida (C. difficile infection, CDI) definována přítomností průjmovitých stolic nebo změnou charakteru stolice (přítomností klinických symptomů) a pozitivního výsledku stolice na toxin/toxigenní kmen s vyloučením jiného střevního patogenu a přihlédnutím k přítomnosti rizikových faktorů: hematologické a solidní malignity, hematologické poruchy, stavy imunosuprese, orgánové transplantace, nespecifické střevní záněty nebo další gastrointestinální poruchy včetně poruchy motility, předchozí antibiotická a cytotoxická expozice do 12 týdnů od odebrání stolice.
Sběr dat
Shromáždili jsme data pacientů zahrnující věk, pohlaví, výsledek mikrobiologického testování stolice na střevní patogeny a datum testování. Informace byly získávány ze zdravotních záznamů databáze FN Brno. Byla eliminována duplicitní a jinak zmnožená data z jedné hospitalizace. Nevyhledávali jsme pacienty trpící duální nebo vícečetnou infekcí, proto ve výsledcích tato data nefigurují. Klinické projevy nebyly hodnoceny, pouze v případě C. difficile jsme uvedli výsledky po zohlednění klinických dat (vzhledem k významnému nosičství toxigenních kmenů C. difficile v dané věkové populaci a patogennímu potenciálu bakterie).
Detekce, identifikace střevních patogenů
Rektální výtěr na obligátní střevní patogeny byl proveden pomocí sterilního transportního tamponu a uchováván do transportu v pokojové teplotě. Vzorek stolice na viry a C. difficile byl po odběru uchováván při teplotě 4 °C a transportován ve sterilním kontejneru do 24 hodin k dalšímu zpracování. Vzorky byly zpracovány v akreditované laboratoři Oddělení klinické mikrobiologie (OKM) FN Brno. Kultivace bakterií probíhala na zavedených kultivačních půdách a podrobněji byly bakterie určeny pomocí hmotnostní spektrofotometrie (MALDI, matrix assisted laser desorption/ionisation). Identifikace virů ve stolici byla prováděna metodou rychlé chromatografické imunoeseje IMMUNOQUICK NoRotAdeno.
Diagnóza klostridiové kolitidy je založena na dvoustupňovém algoritmu. Každý fekální vzorek byl testován imunochromatografickou metodou na přítomnost antigenu glutamátdehydrogenázy (GDH) a toxinu A, B (TECHLAB C. DIFF QUICK CHEK COMPLETE). Vzorky stolice, které se ukázaly jako GDH-negativní a toxin A/B-negativní, byly hodnoceny jako negativní. Stolice, které byly GDH-pozitivní, ale toxin A/B-negativní, byly konfirmovány metodou polymerázové řetězové reakce (polymerase chain reaction, PCR) na přítomnost genu pro toxin B, binární toxin a deleci tcdC v nukleotidu 117 (GeneXpert Clostridium difficile Cepheid). GDH-pozitivní/PCR pozitivní vzorky byly interpretovány jako pozitivní (toxin produkující kmeny). Při diagnostice CDI byl následován národní doporučený postup pro CDI [9].
VÝSLEDKY
V letech 2015–2016 bylo na KDIN FN Brno hospitalizováno celkem 2071 dětí s příznaky gastroenteritidy ve věku 0–18 let, 1083 v roce 2015, resp. 988 v roce 2016 (o 8,8 % méně).
Virovou infekci jsme prokázali u 36,0 % pacientů (390/1083) v roce 2015, resp. 29,0 % (286/988) v roce 2016. Nejvýznamnější skupinou byly rotavirové gastroenteritidy. Ze všech gastroenteritid bylo prokázaných RVGE 28,2 % (305/1083) v roce 2015, resp. 18,2 % (180/988) v roce 2016. Z virových gastroenteritid tvořily RVGE naprostou většinu, 78,2 % (305/390) v roce 2015 a 62,9 % (180/286) v roce 2016. Ostatních virových infekcí vyžadujících hospitalizaci bylo mnohem méně. Adenovirových gastroenteritid jsme v roce 2015 zaznamenali pouze 3,2 % (35/1083) ze všech případů gastroenteritid, resp. 9,0 % (35/390) z virových gastroenteritid, v roce 2016 obdobně 5,0 % (49/988) ze všech gastroenteritid, resp. 17,1 % (49/286) z virových gastroenteritid. Norovirových gastroenteritid bylo v roce 2015 4,6 % (50/1083) ze všech případů gastroenteritid, resp. 12,8 % (50/390) z virových gastroenteritid, v roce 2016 tvořily 5,8 % ze všech gastroenteritid (57/988), resp. 19,9 % (57/286) z virových gastroenteritid.
Bakteriální infekci jsme prokázali u 14,6 % pacientů (158/1083) v roce 2015 a rovněž u 14,6 % (144/988) v roce 2016. V roce 2015 jsme největší počet pacientů (9,3 %; 101/1083) hospitalizovali pro salmonelózu. Kampylobakterióz bylo 4,2 % (46/1083), klostridiových kolitid 0,9 % (10/1083) a pouze jeden případ yersiniózy. Obdobně v roce 2016 nejvíce pacientů bylo se salmonelózou (8,3 %; 82/988), sestupně následovaly případy kampylobakterióz (5,2 %, 51/988), klostridiových kolitid (0,7 %; 7/988) a yersinióz (0,4 %; 4/988). Ve sledovaných letech jsme nepřijali žádného pacienta se střevní infekcí způsobenou Shigella spp. U velkého počtu pacientů zůstala etiologie neobjasněna (49,7 %, 538/1083 v roce 2015; 56,6 %, 558/988 v roce 2016). Poměrné zastoupení etiologických agens zobrazují grafy 1 a 2, jednotlivé rody a druhy bakteriálních agens představuje tabulka 1.
Graph 1. Etiologie gastroenteritid u pacientů hospitalizovaných na Klinice dětských infekčních nemocí FN Brno v roce 2015. Uvedena jsou jednotlivá etiologická agens, počet případů a procentuální zastoupení. *Zahrnuti pacienti s klostridiovou kolitidou (<em>Clostridium difficile</em> infection, CDI) podle definice uvedené v části Materiál a metody 
Graph 2. Etiologie gastroenteritid u pacientů hospitalizovaných na Klinice dětských infekčních nemocí FN Brno v roce 2016. Uvedena jsou jednotlivá etiologická agens, počet případů a procentuální zastoupení. *Zahrnuti pacienti s klostridiovou kolitidou (<em>Clostridium difficile</em> infection, CDI) podle definice uvedené v části Materiál a metody. 
Table 1. Etiologie bakteriálních gastroenteritid. 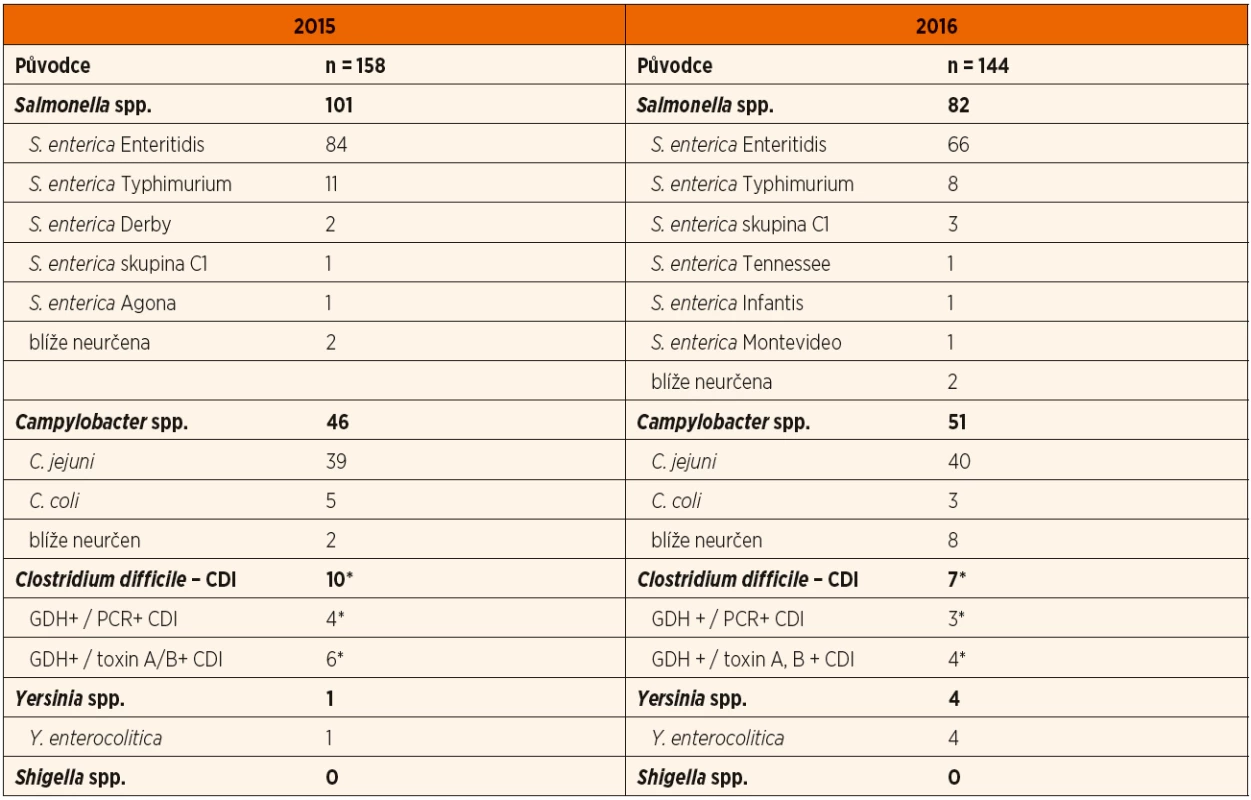
n = počet případů CDI = Clostridium difficile infection, klostridiová kolitida GDH = glutamátdehydrogenáza PCR = polymerase chain reaction, polymerázová řetězová reakce *Zahrnuti pacienti s klostridiovou kolitidou podle definice uvedené v části Materiál a metody. Poměr chlapců a dívek hospitalizovaných pro rotavirózu byl v roce 2015 vyrovnaný (1,0; 152 chlapců, 153 dívek), v roce 2016 převažovali chlapci (1,4; 103 chlapců, 72 dívek). U adenovirových infekcí byl poměr chlapci//dívky v roce 2015 0,9 (17 chlapců, 18 dívek) a 1,0 (25 chlap-ců, 24 dívek) v roce 2016. U norovirových infekcí byl tento poměr ve prospěch chlapců v roce 2015 – 1,4 (29 chlapců, 21 dívek) a vyrovnaný v roce 2016 (1,0; 28 chlapců,29 dívek).
Maximum případů virových onemocnění se oba roky vyskytlo u dětí ve věkové skupině od narození do 5 let (v roce 2015 83,3 %, 325/390; v roce 2016 82,5 %, 236/286). Přesněji nejvíce nemocných bylo ve věkové skupině 13–36 měsíců, a to 44,6 % (174/390) v roce 2015 a 47,6 % (136/286) v roce 2016. Na druhém místě byli nemocní ve věkové skupině 37–60 měsíců (44,6 %, 89/390 v roce 2015; 19,2 %, 55/286 v roce 2016) a teprve poté děti starší 5 let (16,7 %, 65/390 v roce 2015; 17,5 %, 50/286 v roce 2016) a děti do 12 měsíců věku (15,9 %, 62/390 v roce 2015; 15,7 % 45/286 v roce 2016). Toto věkové rozdělení jsme pozorovali u všech tří druhů hodnocených virů.
U pacientů s RVGE bylo skupinou do 5 let věku zastoupeno 82,3 % případů (251/305) v roce 2015 a 80,6 % (145/180) v roce 2016. Z toho ve věku 0–12 měsíců se jednalo pouze o 18,4 % případů (56/305) v roce 2015 a 17,8 % (32/180) v roce 2016. Nejpočetnější skupinu tvořila skupina ve věku 13–36 měsíců, kde jsme zaznamenali celých 41,0 % případů (125/305) v roce 2015 a 42,8 % (77/180) v roce 2016. Ve věku 37–60 měsíců jsme napočítali 23,0 % případů (70/305) v roce 2015 a 20,0 % (36/180) v roce 2016. Ve věku nad 5 let tvořily počty případů 17,6 % (54/305) v roce 2015 a 19,4 % (35/180) v roce 2016. Jednotlivé věkové skupiny a jejich zastoupení během roku ukazuje graf 3.
Graph 3. Věkové rozložení pacientů s RVGE v jednotlivých měsících let 2015–2016. 
Nejpočetnější věkovou skupinou i u ostatních virových infekcí byly děti ve věku 13–36 měsíců. U adenovirových infekcí se jednalo o 45,7 % pacientů (16/35) v roce 2015 a 55,1 % (27/49) v roce 2016, analogicky u norovirových infekcí o 66,0 % pacientů (33/50) v roce 2015 a 56,1 % (32/57) v roce 2016.
Rozdílné výsledky vidíme u pacientů hospitalizovaných pro bakteriální střevní infekce. Nejvíce zastoupenou věkovou skupinou byli pacienti nad 5 let věku (54,4 %, 86/158 v roce 2015; 46,5 %, 67/144 v roce 2016). Pacienti ve věku 0–12 měsíců tvořili pouze 7,0 % případů (11/158) v roce 2015 a 6,3 % (9/144) v roce 2016. Ve věku 13–36 měsíců jsme zaznamenali 27,8 % případů (44/148) v roce 2015 a 30,6 % (44/144) v roce 2016. Ve věku 37–60 měsíců bylo 10,8 % případů (17/158) v roce 2015 a 16,7 % (24/144) v roce 2016.
Největší výskyt všech gastroenteritid jsme zaznamenali v jarních a letních měsících roku (graf 4). Nejvíce prokázaných bakteriálních enterokolitid bylo v roce 2015 v srpnu (20/158) a v roce 2016 v září (19/144). Nejvíce virových gastroenteritid bylo v roce 2015 v dubnu (67/390) a v roce 2016 v březnu (44/286). Nejvíce RVGE jsme zaregistrovali v jarních měsících, s maximem v dubnu 2015 a v březnu a dubnu 2016, ostatní virové gastroenteritidy sezónní výskyt nejeví (graf 5).
Graph 4. Etiologie gastroenteritid v jednotlivých měsících roku 2015–2016 vzhledem ke všem případům gastroenteritid v uvedených letech. 
Graph 5. Sezónní výskyt rotavirových gastroenteritid (RVGE) v letech 2015–2016. 
Klinické parametry, laboratorní výsledky a léčbu naše studie nezahrnuje, budou součástí pozdějších prací.
DISKUSE
Rotaviry jsou jedním z hlavních původců gastroenteritid s celosvětově vysokou morbiditou. Podle odhadů Světové zdravotnické organizace způsobují rotaviry 30–50 % všech průjmových onemocnění u dětí do 5 let [2]. Z našeho souboru byla z celkového počtu 2071 dětí přijatých s gastroenteritidou za 2 roky rotavirová etiologie prokázána u 485 pacientů (23,4 %). Do 5 let věku jsou rotavirům vystaveny téměř všechny děti na celém světě a u více než 25 % z nich se rozvine symptomatické onemocnění [10]. Incidence onemocnění mezi rozvinutými a rozvojovými zeměmi se neliší, vyšší hygienický standard nesnižuje přenosnost viru. Odlišnost mezi rozvojovými a rozvinutými zeměmi je v mortalitě. Hlavní devastující dopad na skupinu dětí má tato infekce právě v rozvojových zemích, odhaduje se 450–600 tisíc úmrtí dětí do 5 let za rok [11] zejména v Africe a Asii. V rozvinutých zemích děti na RVGE umírají pouze výjimečně [12], konkrétní odhad pro celou Evropu činí asi 6550 úmrtí dětí do 5 let za rok [13]. Ve sledovaném souboru za 2 roky 2015–2016 nezemřelo na RVGE žádné dítě.
Uvádí se, že rotaviry jsou nejčastější příčinou hospitalizace pro gastroenteritidu u dětí do 5 let (30–70 %), v závislosti na ročním období [4]. K vzestupu celkového počtu hospitalizací docházelo v obou letech v březnu a dubnu, vždy se na tom významně podílely právě RVGE (graf 4). Celosvětově infekce více postihuje chlapce [14]. Tomuto údaji odpovídá pouze převaha chlapců v roce 2016 (poměr chlapci/dívky 1,4), v roce 2015 byl poměr obou pohlaví vyrovnaný.
Podle informací hlášených do systému EPIDAT Státního zdravotního ústavu bylo v České republice v roce 2015 zaznamenáno 62 919 případů infekčního průjmového onemocnění a 56 342 v roce 2016. Virové infekce hlášené v roce 2015 tvořily 29,5 % všech gastroenteritid a 16,8 % v roce 2016. Ve srovnání s celorepublikovými počty hlášených virových průjmů byla v našem souboru pacientů virová etiologie prokázána častěji, a to 36,0 % v roce 2015 a 29,0 % v roce 2016. Jedním z důvodů vyššího podílu virové etiologie průjmů může být cílený odběr stolice na virová agens u všech pacientů přijatých s gastroenteritidou.
V České republice diagnostika rotavirových infekcí začala nesměle na konci 70. let 20. století, více dostupnou se stala až v 90. letech 20. století. Od této doby se stále zlepšuje senzitivita diagnostických metod [15], narůstá počet laboratoří nabízejících diagnostiku, zvyšuje se množství provedených testů a tím i počet hlášených infekcí [14], přesto záchyt těchto případů představuje jen zlomek skutečnosti. Hlavním důvodem falešně nízké incidence je fakt, že jen malá část pacientů vyhledá lékařskou péči a jen části těchto pacientů je provedeno vyšetření stolice na viry, které zdravotnickému zařízení zvyšuje náklady, nicméně nepřispívá ke změně léčebného postupu. Také všechny rozpoznané infekce nemusí být hlášeny. Ze spektra možných etiologických agens virových průjmů se prokazovaly v daném souboru jen rotaviry (23,4 %), noroviry (5,2 %) a adenoviry (4,1 %). Velikou skupinu představovaly gastroenteritidy, u nichž etiologie nebyla prokázána (52,9 %). Prevalence onemocnění je podhodnocena celosvětově, jen malá část onemocnění způsobená rotaviry je klasifikována jako RVGE [4].
Výskyt rotavirových gastroenteritid je charakterizován sezónností u všech věkových skupin. V mírném klimatu má infekce vrchol v zimních měsících, v Evropě je popisován vrchol nemoci v lednu ve Španělsku a šíří se severněji s vrcholem v následujících měsících [4]. Sezónnost je méně vyznačena blíže k rovníku, kde se infekce více vyskytuje během sušších a chladnějších měsíců [4]. V České republice je dlouhodobě nejvyšší výskyt RVGE v zimních a jarních měsících od ledna do května s vrcholem počtu případů v březnu [14, 16], v hodnoceném souboru byly největší počty pacientů v březnu a dubnu (grafy 4 a 5).
Jako preventabilní infekce představuje RVGE významnou ekonomickou zátěž pro zdravotnický systém. Odhaduje se, že rotaviry jsou celosvětově zodpovědné za více než 130–140 milionů průjmových onemocnění, 2 miliony hospitalizací dětí do 5 let [13], z toho v Evropě kolem 146 tisíc (38 tisíc – 1 milion), které tvoří přes 50 % všech hospitalizací [3, 17]. Průměrná cena léčby za hospitalizační případ v České republice se pohybuje kolem 476 eur [13], tj. kolem 12,5 tisíc Kč, roční výdaje za všechny hospitalizace pro RVGE se odhadují na 2,1 milionů eur [13], tj. kolem 55 milionů Kč. Hospitalizace 485 pacientů s RVGE za uvedené dva roky odpovídá asi 6,1 milionům Kč.
Použití vakcín proti rotavirům ve světě bylo zahájeno v roce 2006, v České republice v roce 2007. Před zavedením plošného očkování i po něm zůstávají nejběžněji se vyskytujícími sérotypy rotavirů typy G1 až G4, G9 a G12 zodpovědné za 80–95 % případů průjmu u dětí [2, 4]. G1 sérotyp je přítomen zejména v Severní Americe, Austrálii a Evropě, kde před zavedením očkování způsoboval až 70 % infekcí [4, 18, 19]. V postvakcinační éře došlo ke snížení prevalence a (i dočasným) změnám v geografické distribuci u určitých kmenů [2]. Vakcinace efektivně snižuje počty hospitalizací [20, 21]. V současnosti jsou vakcíny registrovány ve více než 100 zemích světa [18].
ZÁVĚR
RVGE stále zůstává v rozvinutých zemích zátěží pro zdravotnický systém. Pacienti hospitalizovaní pro RVGE tvoří i v dnešní době dostupného očkování podstatnou část pacientů přijatých pro průjmové onemocnění na naši kliniku, tj. 23,4 % všech dětí hospitalizovaných pro gastroenteritidu.
MUDr. Miriam Malá
Klinika dětských infekčních nemocí
Lékařská fakulta Masarykovy univerzity
Fakultní nemocnice Brno
Černopolní 22a
613 00 Brno
e-mail: mala.miriam@fnbrno.cz
Sources
1. Krbková L, Mikolášek P, Musil V. Terapie průjmových onemocnění dětí (aneb co se změnilo v průběhu 70 let). Čes-slov Pediat 2016; 71 (3): 150–155.
2. Esona MD, Gautam R. Rotavirus. Clin Lab Med 2015; 35 (2): 363–391.
3. O’Ryan M. The ever-changing landscape of rotavirus serotypes. Pediatr Infect Dis J 2009; 28 (3 Suppl): S60–62.
4. Bernstein DI. Rotavirus overview. Pediatr Infect Dis J 2009; 28 (3 Suppl): S50–53.
5. Moutelíková R, Prodělalová J. Možnosti zoonotického přenosu rotavirových infekcí. Epidemiol Mikrobiol Imunol 2015; 64 (2): 66–71.
6. Hyser JM, Estes MK. Rotavirus vaccines and pathogenesis: 2008. Curr Opin Gastroenterol 2009; 25 (1): 36–43.
7. Vesikari T, Sarkkinen HK, Mäki M. Quantitative aspects of rotavirus excretion in childhood diarrhoea. Acta Paediatr Scand 1981; 70 (5): 717–721.
8. Ray PG, Kelkar SD, Walimbe AM, et al. Rotavirus immunoglobulin levels among Indian mothers of two socio-economic groups and occurrence of rotavirus infections among their infants up to six months. J Med Virol 2007; 79 (3): 341–349.
9. Beneš J, Husa P, Nyč O, et al. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile. Klin Mikrobiol Inf Lék 2014; 20 (2): 56–66.
10. Parashar UD, Hummelman EG, Bresee JS, et al. Global illness and deaths caused by rotavirus disease in children. Emerg Infect Dis 2003; 9 (5): 565–572.
11. Tate JE, Burton AH, Boschi-Pinto C, et al. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis 2012; 12 (2): 136–141.
12. Soriano-Gabarró M, Mrukowicz J, Vesikari T, et al. Burden of rotavirus disease in European Union countries. Pediatr Infect Dis J 2006; 25 (1 Suppl): S7–11.
13. Tichopád A, Müllerová J, Jackowska T, et al. Cost burden of severe community-acquired rotavirus gastroenteritis requiring hospitalization in the Czech Republic, Slovakia, Poland, and Hungary: A retrospective patient chart review. Value Health Reg Issues 2016; 10 : 53–60.
14. Pazdiora P, Beneš Č. Rotavirus gastroenteritis in the Czech Republic before the start of vaccination. Epidemiol Mikrobiol Imunol 2013; 62 (4):131–137.
15. Fajfr M, Stěpánová V, Plíšková L, et al. Viral gastroenteritis in Eastern Bohemia Region of the Czech Republic. Epidemiol Mikrobiol Imunol 2014; 63 (2): 88–91.
16. Mészner Z, Anca I, André F, et al. Rotavirus vaccination in central Europe. J Pediatr Gastroenterol Nutr 2013; 56 (6): 586–596.
17. Forster J, Guarino A, Parez N, et al. Hospital-based surveillance to estimate the burden of rotavirus gastroenteritis among European children younger than 5 years of age. Pediatrics 2009; 123 (3): e393-400.
18. Dóró R, László B, Martella V, et al. Review of global rotavirus strain prevalence data from six years post vaccine licensure surveillance: is there evidence of strain selection from vaccine pressure? Infect Genet Evol 2014; 28 : 446–461.
19. Diez-Domingo J, Baldo J-M, Patrzalek M, et al. Primary care-based surveillance to estimate the burden of rotavirus gastroenteritis among children aged less than 5 years in six European countries. Eur J Pediatr 2011; 170 (2): 213–222.
20. Karafillakis E, Hassounah S, Atchison C. Effectiveness and impact of rotavirus vaccines in Europe, 2006-2014. Vaccine 2015; 33 (18): 2097–2107.
21. Hungerford D, Smith K, Tucker A, et al. Population effectiveness of the pentavalent and monovalent rotavirus vaccines: a systematic review and meta-analysis of observational studies. BMC Infect Dis 2017; 17 (1): 569.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 7-
All articles in this issue
- Epidemie hepatitidy A u dětí hospitalizovaných na Klinice dětských infekčních nemocí FN Brno od března 2016 do března 2017
- Rotaviry a další původci gastroenteritid u pacientů hospitalizovaných na Klinice dětských infekčních nemocí Fakultní nemocnice Brno v letech 2015 a 2016
- Syphilis congenita recens – kazuistika
- Studie negativních zážitků z dětství (ACE) v České republice
- Longitudinální sledování změn somatických parametrů dětí v období dospívání
- Atypická cysta ductus thyreoglossus s tracheální píštělí
- Prevalence podváhy, nadváhy a obezity u 7–9letých venkovských dětí v průběhu ekonomické transformace v Polsku. 40 let pozorování: případová kontrolní studie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Atypická cysta ductus thyreoglossus s tracheální píštělí
- Studie negativních zážitků z dětství (ACE) v České republice
- Syphilis congenita recens – kazuistika
- Rotaviry a další původci gastroenteritid u pacientů hospitalizovaných na Klinice dětských infekčních nemocí Fakultní nemocnice Brno v letech 2015 a 2016
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

