-
Medical journals
- Career
Nezvyčajná príčina hyperkalciémie u pacientky s primárne kortikorezistentným nefrotickým syndrómom – kazuistika
Authors: Ľ. Kováčiková ml.; Ľ. Tichá; M. Chocholová; Ľ. Podracká
Authors‘ workplace: Detská klinika Lekárskej fakulty Univerzity Komenského a Detskej fakultnej nemocnice s poliklinikou, Bratislava
Published in: Čes-slov Pediat 2017; 72 (1): 39-44.
Category: Case Report
Overview
Porucha homeostázy kalcia je u pacientov s nefrotickým syndrómom pomerne častým javom. Typickým nálezom je hypokalciémia, ktorá je zvyčajne dôsledkom závažnej hypoalbuminémie (pseudohypokalciémie). K hypokalciémii prispievajú aj močové straty vitamín D viažucich proteínov a následná hypovitaminóza D, ktorá znižuje absorpciu kalcia v čreve.
V kazuistike prezentujeme nezvyčajnú príčinu hyperkalciémie u 12-ročného dievčaťa s primárne kortikorezistentným nefrotickým syndrómom na podklade fokálnej segmentálnej glomerulosklerózy. Pacientka bola liečená kortikosteroidmi a početnými imunosupresívami 2. línie bez dosiahnutia kompletnej remisie. Prekvapivým nálezom bola hyperkalciémia pri rozvinutých laboratórnych známkach nefrotického syndrómu, ktorá pretrvávala aj po vysadení substitučnej liečby vitamínom D a vápnikom pre glukokortikoidmi indukovanú osteoporózu. Na základe ultrasonografického vyšetrenia prištítnych teliesok a pozitrónovej emisnej tomografie bolo vyslovené podozrenie na adenóm prištítneho telieska, diagnózu potvrdilo histologické vyšetrenie po exstirpácii adenómu.Kľúčové slová :
nefrotický syndróm, hyperkalciémia, adenóm prištítneho telieskaÚVOD
Nefrotický syndróm (NS) je najčastejšie ochorenie glomerulov v detskom veku [1]. Charakterizuje ho proteinúria viac ako 1 g/m2/deň, alebo pomer proteínov a kreatinínu v moči vyšší ako 300 mg/mmol, opuch, hypoalbuminémia (menej ako 25 g/l) a hyperlipidémia [2]. Poruchy homeostázy kalcia sú pri NS časté, pričom typickým nálezom je hypokalciémia, ktorá je zvyčajne dôsledkom závažnej hypoalbuminémie (pseudohypokalciémia). K hypokalciémii prispievajú aj močové straty proteínov viažucich vitamín D s následnou hypovitaminózou D, ktorá znižuje absorpciu kalcia v čreve, a tiež aj dlhodobá liečba kortikosteroidmi [3–5].
V kazuistike prezentujeme zriedkavý prípad dieťaťa s kortikorezistentným NS na podklade fokálnej segmentálnej glomerulosklerózy (FSGS) asociovaný s hyperkalciémiou extrarenálneho pôvodu.
KAZUISTIKA
Dvanásťročná pacientka rómskeho etnika, ktorá je sledovaná od 3 rokov života pre primárne kortikorezistentný NS bola prijatá na hospitalizáciu pre opakovaný nález hyperkalciémie. V rodinnej anamnéze je údaj o hematúrii u matky a jej sestier. Výskyt poruchy sluchu v širokom príbuzenstve negovali. Rodičia sú zdraví, konsanguinita bola vylúčená, súrodencov nemá.
Dieťa je z prvej rizikovej gravidity kvôli poruche prietokov na kardiotokografii. Pôrod bol v 40. gestačnom týždni, spontánny, záhlavím, s Apgarovej skóre 9/9, pôrodná hmotnosť 3550 g a dĺžka 55 cm. U pacientky sa v 3 rokoch života prvýkrát manifestoval nefrotický syndróm, ktorý bol primárne rezistentný na liečbu kortikosteroidmi. Histologické vyšetrenie renálneho tkaniva preukázalo obraz FSGS. Mutácie NPHS2 génu a WT1 génu boli vylúčené. Pre základné ochorenie pacientka dlhodobo užívala kortikosteroidy a viaceré imunosupresíva 2. línie (cyklofosfamid, cyklosporín A, mykofenolát mofetil), ktoré však neviedli ku kompletnej remisii. V močovom náleze pretrvávala mikroskopická hematúria a proteinúria do 2 g/d. Tlak krvi bol udržiavaný pod 90. percentilom dvojkombináciou antihypertenzív.
V klinike dominovalo mierne presiaknutie v okolí členkov, cushingoidný habitus a nižší telesný rast (pod 3.percentil). V laboratórnom obraze sa potvrdila hyperkalciémia s hodnotou celkového kalcia 3,08 mmol/l a ionizovaného kalcia 1,63 mmol/l pri hypoproteinémii 57,2 g/l a hypoalbuminémii 31,0 g/l. Aktuálny klírens endogénneho kreatinínu bol 96 ml/min/1,73 m2. V terapii užívala 10 mg prednizón obdeň a takrolimus 3 mg/deň. Substitúciu vitamínom D podávanú v rámci prevencie glukokortikoidmi indukovanej osteoporózy sme ukončili. Napriek tomu pretrvávala hyperkalciémia 3,22 mmol/l a elevácia parathormónu 156,5 pg/ml (norma: 15–65 pg/l). Ultrasonografickým vyšetrením prištítnych teliesok sa pod ľavým lalokom štítnej žľazy znázornil hypoechogénny oválny útvar charakteru lymfatickej uzliny s hilárnym typom vaskularizácie (obr. 1).
Image 1. Ultrasonografické vyšetrenie prištítnych teliesok. Fig. 1. Ultrasonography of parathyroid glands. A. Hypoechoic oval mass 5.1 x 4.5 mm of size under the left lobe of thyroid gland; appearance typical for lymph node. B. Color-doppler shows central hilar vascularization. 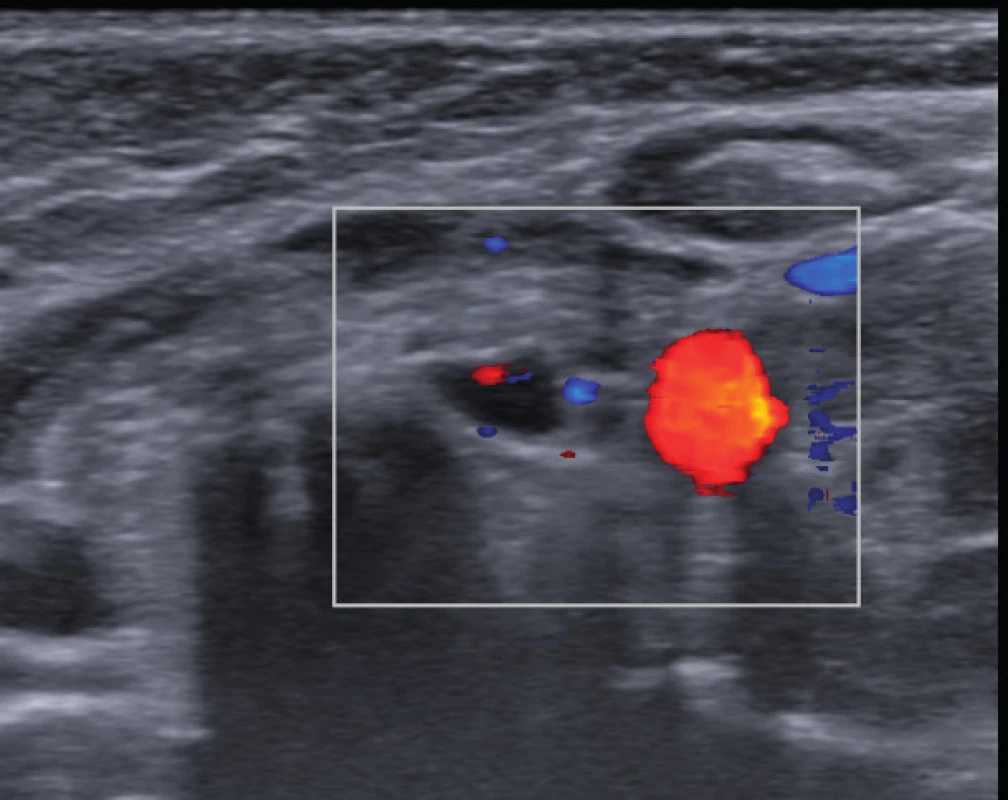
A. Pod ľavým lalokom štítnej žľazy hypoechogénny oválny útvar veľkosti 5,1 x 4,5 mm charakteru lymfatickej uzliny. B. Farebný doppler ukazuje hilárny typ vaskularizácie. A. Hypoechoic oval mass 5.1 x 4.5 mm of size under the left lobe of thyroid gland; appearance typical for lymph node. B. Color-doppler shows central hilar vascularization. Pre podozrenie na adenóm ľavého dolného prištítneho telieska sme realizovali pozitrónovú emisnú tomografiu, ktorá preukázala charakteristický obraz svedčiaci pre adenóm (obr. 2) a v ďalšom kroku sme indikovali extirpáciu. Po predoperačnej príprave a dôslednej 24-hodinovej rehydratácii bol pacientke chirurgicky odstránený tumor mäkkej konzistencie, sivohnedej farby a veľkosti 1,5x1x1 cm (obr. 4). Histologicky sa potvrdil adenóm prištítneho telieska. Hodnota parathormónu z peroperačného odberu vzorky krvi po bezprostrednom odstránení tumoru bola 97,75 pg/ml. Na druhý pooperačný deň prišlo k promptnému poklesu vápnika v sére s nutnosťou substitúcie kalcia a aj vitamínu D. Tri mesiace po odstránení adenómu je klinický stav pacientky stabilizovaný a kalciémia sa udržuje v referenčnom rozpätí.
Image 2. Pozitrónová emisná tomografia. Fig. 2. Positron emission tomography. 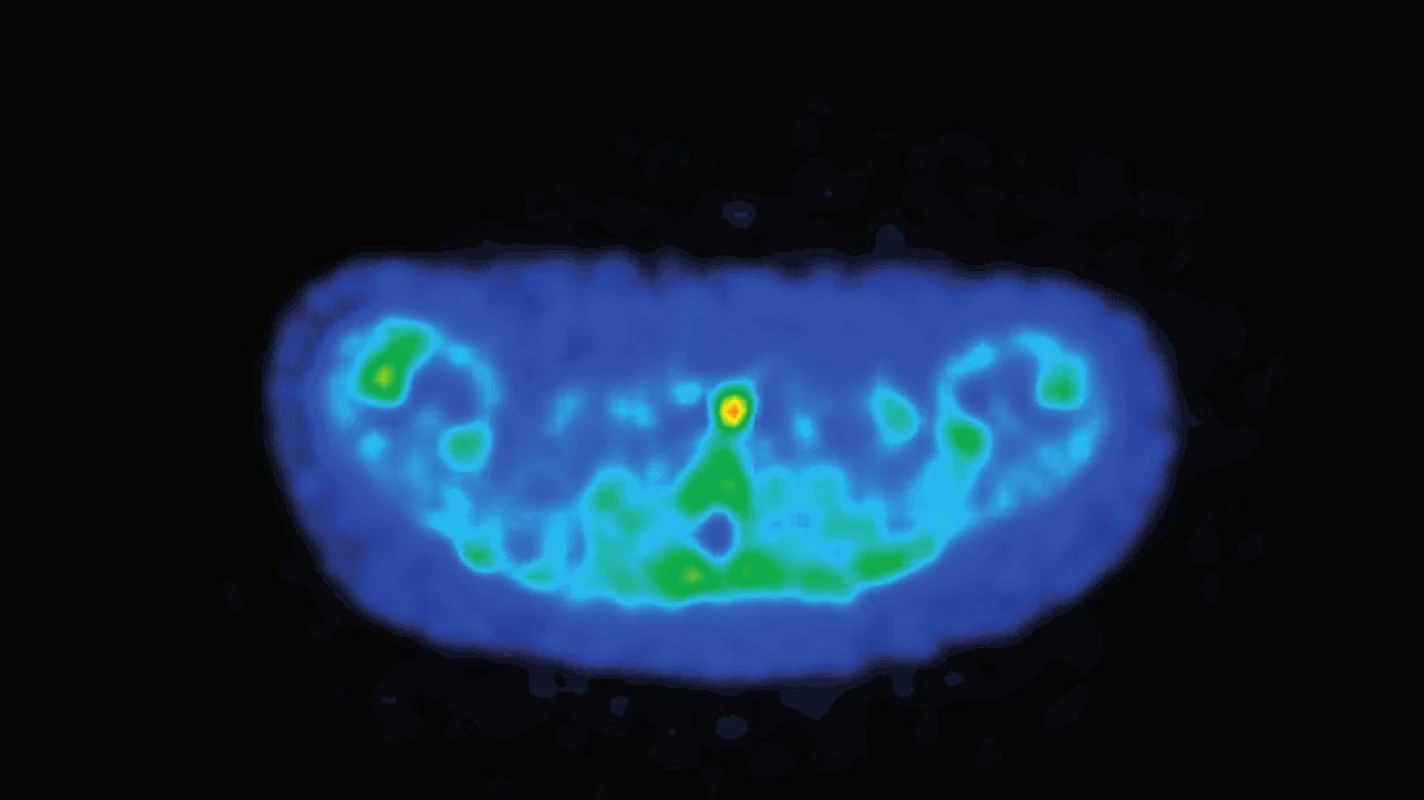
Image 3. A. Extirpácia adenómu. B. Extirpovaný adenóm ľavého dolného prištítneho telieska. Fig. 4. A. Exstirpation of adenoma. B. Adenoma of left inferior parathyroid gland after exstirpation. 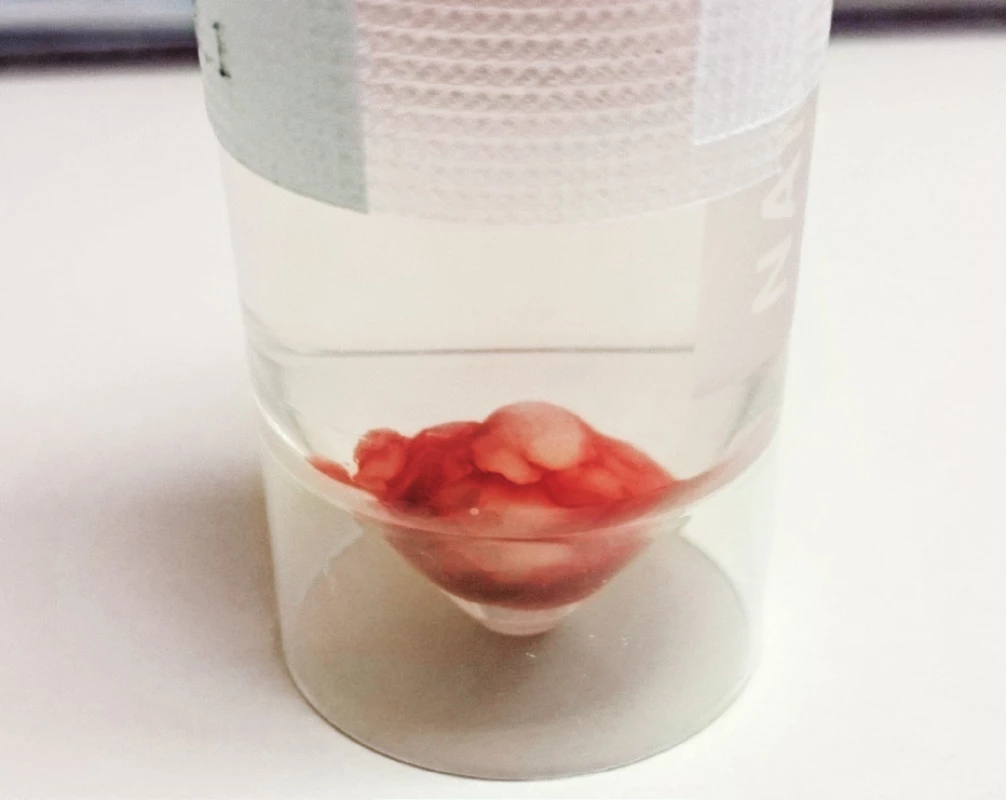
DISKUSIA
Za normokalciémiu sa považuje koncentrácia kalcia v krvi 2,25–2,75 mmol/l. Z toho je 40 % kalcia viazaného na albumín, resp. globulíny, 15 % tvorí komplex s citrátom, sulfátom, fosfátom a bikarbonátom a zvyšných 45 % sérového kalcia pripadá na ionizované kalcium, ktoré je fyziologicky dôležité. Patologické odchýlky koncentrácií celkového vápnika súbežne sprevádzajú aj zmeny ionizovaného kalcia. Výnimku tvoria stavy ako sú poruchy acidobázickej rovnováhy, hypoalbuminémia a chronické obličkové ochorenie.
Organizmus má snahu o udržanie konštantného súčinu kalcia a fosforu v sére. Dôležitú úlohu v regulácii metabolizmu kalcia zohráva parathormón (PTH), ktorý pôsobí 3 hlavnými mechanizmami:
- Ovplyvňuje vstrebávanie vápnika z čreva. Zvýšené vstrebávanie vápnika a fosfátov z čreva zabezpečuje PTH nepriamo stimuláciou tvorby metabolicky aktívneho vitamínu D 3 (1,25-dihydroxycholekalciferolu) v obličkách.
- Ovplyvňuje metabolizmus kostí. Zvyšuje činnosť osteoklastov a vyvoláva demineralizáciu kostného tkaniva, čo má za následok zvýšené vyplavovanie ionizovaného kalcia a fosfátov z kostí do krvi.
- Ovplyvňuje činnosť obličiek, kde zvyšuje spätnú tubulárnu resorpciu vápnika z primárneho moču do krvi, čím klesá vylučovanie vápnika močom. PTH súčasne zvyšuje renálnu exkréciu fosfátov potlačením ich spätnej tubulárnej resorpcie (obr. 3) [6].
Image 4. Regulácia metabolizmu kalcia. Fig. 3. Regulation of calcium metabolism. 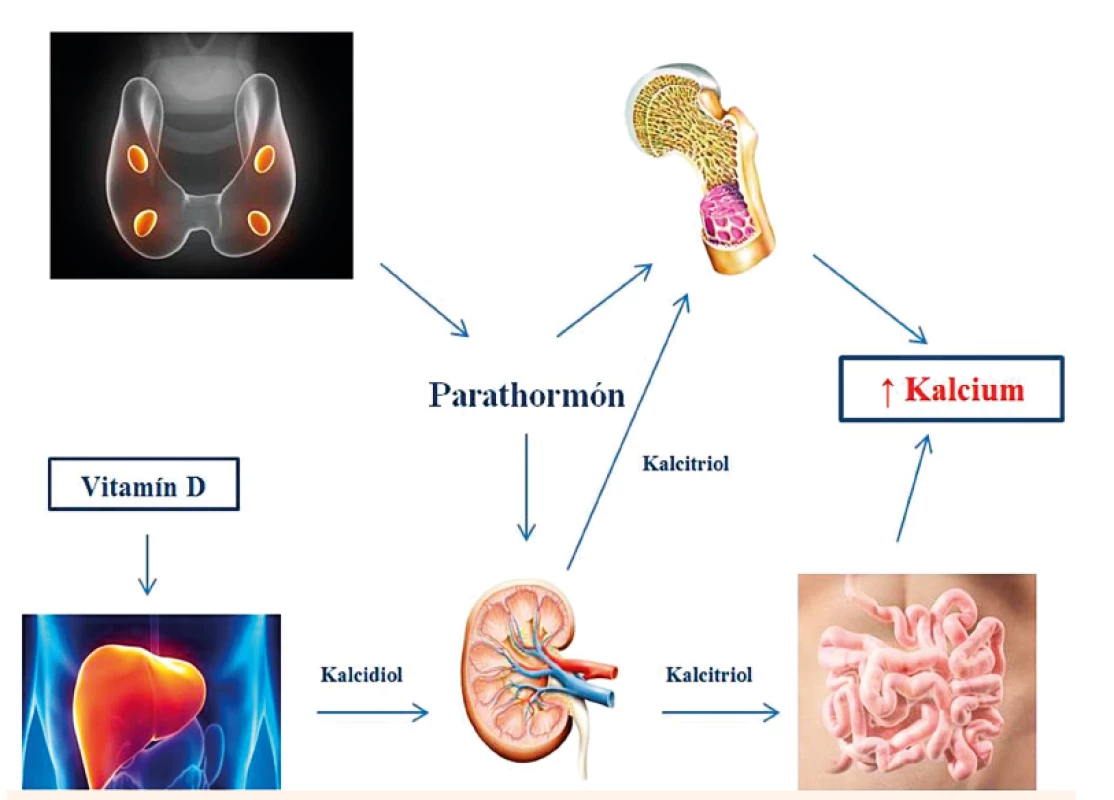
(Upravené podľa Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling. Physiol Rev 2001; 81 (1): 239–297) (Modified from Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling. Physiol Rev 2001; 81 (1): 239–297) U pacientov s NS je častým javom hypokalciémia, ktorá je zvyčajne dôsledkom závažnej hypoalbuminémie (pseudohypokalciémia) [5]. Hyperkalciémia sa pri NS so zachovanými renálnymi funkciami vyskytuje raritne. K vzostupu sérového kalcia môže dôjsť, ak NS progreduje do renálneho zlyhania a vyvinie sa sekundárna hyperparatyreóza ako odpoveď na hyperfosfatémiu a iniciálnu hypokalciémiu. V pokročilej urémii vzniká hyperkalciémia často pri adynamickej kostnej chorobe z nadmernej substitúcie vitamínom D a z podávania fosfátových viazačov s vysokým obsahom vápnika.
Hyperkalciémia je definovaná koncentráciou vápnika v krvi viac ako 2,75 mmol/l. Príčiny hyperkalciémie sú rôzne. Patrí k nim primárna alebo sekundárna hyperparatyreóza, malignity, intoxikácia vitamínom D, chronické granulomatózne ochorenia, niektoré lieky, endokrinné ochorenia, imobilizácia, parenterálna výživa či Milk-alkali syndróm (tab. 1) [7, 8]. U našej pacientky bola hyperkalciémia asociovaná s hypoalbuminémiou a hypoproteinémiou pri normálnych renálnych funkciách. Vzhľadom k tomu, že dievčatko užívalo vitamín D, hyperkalciémia sa najprv považovala za dôsledok tejto substitučnej liečby. Keďže sérové kalcium sa neupravilo ani po vysadení substitúcie, pátrali sme po extrarenálnej príčine hyperkalciémie. Ultrasonografické vyšetrenie a pozitrónová emisná tomografia spolu so zvýšeným parathormónom poukazovali na adenóm prištítnych teliesok, ktorý sa potvrdil histologicky.
Table 1. Príčiny hyperkalciémie. 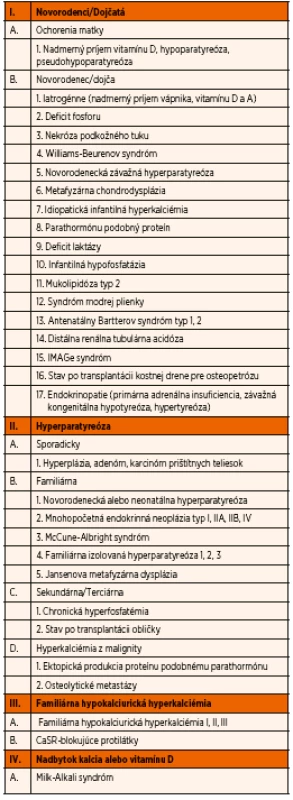

Modifikované podľa Kliegman RM, Stanton BF, St Geme JW, Schor NF (eds.). Nelson Textbook of Pediatrics, ed. 20, Elsevier, Inc., 2016, p. 2696. Solitárny benígny adenóm je najčastejšou (90 %) príčinou primárnej hyperparatyreózy. Mnohopočetné adenómy sa vyskytujú zriedkavo (2–4 %), pričom postihnutie všetkých štyroch prištítnych teliesok je približne u 10 % pacientov, karcinóm je extrémne zriedkavý (<1 %) [9–11]. Pacienti s postihnutím viacerých teliesok majú zvyčajne germinatívne mutácie asociované s genetickými syndrómami, ako sú MEN typ 1, MEN typ 2 a familiárna hyperparatyreóza. V dostupnej literatúre sme nenašli opísaný prípad hyperparatyreózy u detí s nefrotickým syndrómom, ako to bolo u našej pacientky.
Biochemické nálezy primárnej hyperparatyreózy u detí sú podobné ako u dospelých. Pacienti majú hyperkalciúriu, hyperkalciémiu, hypofosfatémiu a buď neprimerane normálne, alebo zvýšené koncentrácie PTH, ktoré nezodpovedajú hodnote hyperkalciémie. U detí a adolescentov je rozsah patologických hodnôt výraznejši než u dospelých, čo odpovedá tomu, že hyperparatyreoizmus je u nich závažnejší.
Na rozdiel od dospelých má väčšina detských pacientov (85 %) klinické príznaky, ku ktorým patria obličkové kamene, polyúria, bolesť brucha, porucha metabolizmu kostí (fraktúry, znížená denzita kostného minerálu), kognitívne a psychiatrické poruchy [10–13]. U našej pacientky chýbali charakteristické klinické prejavy a hyperkalciémia bola „náhodným“ nálezom pri pravidelnej nefrologickej kontrole. Na primárnu hyperparatyreózu poukazovala elevácia parathormónu a perzistujúca hyperkalciémia. Pre dôkaz adenómu sú kľúčové zobrazovacie vyšetrenia, a to ultrasonografia a pozitrónová emisná počítačová tomografia [14, 15]. Liečba je chirurgická, extirpácia adenómu [11, 14, 16].
V predoperačnom manažmente sa odporúča dôkladná rehydratácia za účelom zníženia sérovej koncentrácie vápnika. Peroperačne sa odoberá krv na vyšetrenie parathormónu. Pokles koncentrácie parathormónu ne-priamo svedčí pre adenóm prištítneho telieska. Definitívna diagnóza sa stanoví histologickým vyšetrením extirpovaného tumoru.
Vo včasnom pooperačnom období sa môže vyskytnúť syndróm hladných kostí „hungry bone syndrome” (u 50 % pacientov) a akútna hypokalciémia (u 50 % pacientov). V longitudinálnych klinických sledovaniach sa zistili variabilné sérové hodnoty kalcia, u 2 % chorých sa vyskytovala hypokalciémia a u 3 % pacientov hyperkalciémia [11, 17]. U našej pacientky bol skorý pooperačný priebeh bez komplikácií, koncentrácia parathormónu 97,75 pg/ml, sérové kalcium z hodnoty 2,81 mmol/l (ionizované kalcium 1,46 mmol/l) postupne pokleslo na 2,15 mmol/l. Pre predpokladaný útlm ostávajúcich prištítnych teliesok sme pacientku substituovali vápnikom a po saturovaní koncentrácií aj vitamínom D.
ZÁVER
Poruchy homeostázy kalcia u detí s NS sú časté, pričom typickým nálezom je „pseudo“hypokalciémia. Ak sa hyperkalciémia zistí u pacienta s normálnymi obličkovými funkciami, treba pátrať po extrarenálnych príčinách.
Došlo: 6. 9. 2016
Přijato: 31. 10. 2016
Adresa pre korešpondenciu:
Prof. MUDr. Ľudmila Podracká, CSc.
Detská klinika LFUK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: ludmila.podracka@dfnsp.sk
Sources
1. Kovács L, Podracká Ľ. Proteinúria u detí. Pediatr prax 2012; 13 (1): 11–13.
2. Malina M, Janda J, Seeman T. Geneticky podmíněné formy nefrotického syndrómu u dětí. Čes-slov Pediat 2009; 64 (2): 77–82.
3. Kubejová K, Podracká Ľ. Kortikoidmi indukovaná osteoporóza u detí – patogenéza a diagnostika. Pediatr prax 2013; 14 (2): 57–60.
4. Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling. Physiol Rev 2001; 81 (1): 239–297.
5. Esmaeeili M, Azarfar A, Hoseinalizadeh S. Calcium and vitamin D metabolism in pediatric nephrotic syndrome; an update on the existing literature. Int J Pediatr 2015; 3 (Suppl 1, 2–1): 103–109.
6. Peacock M. Calcium metabolism in health and disease. Clin J Am Soc Nephrol 2010; 5 (Suppl 1): S23–30.
7. Shane E. Etiology of hypercalcemia. UpToDate, 2015.
8. Doyle DA. Hyperparathyroidism. In: Kliegman RM, Stanton BF, St Geme JW, Schor NF (eds). Nelson Textbook of Pediatrics, ed. 20. Milwaukee: Elsevier, Inc., 2016 : 2694–2697.
9. Marcocci C, Cetani F. Clinical practice. Primary hyperparathyroidism. N Engl J Med 2011; 365 (22): 2389–2397.
10. Kollars J, Zarroug A, van Heerden J, et al. Primary hyperparathyroidism in pediatric patients. Pediatrics 2005; 115 (4): 974–980.
11. Roizen J, Levine MA. Primary hyperparathyroidism in children and adolescents. J Chin Med Assoc 2012; 75 (9): 425–434.
12. Li CC, Yang C, Wang S, et al. A 10-year retrospective study of primary hyperparathyroidism in children. Exp Clin Endocrinol Diabetes 2012; 120 (4): 229–233.
13. Venail F, Nicollas R, Morin D, et al. Solitary parathyroid adenoma: a rare cause of primary hyperparathyroidism in children. Laryngoscope 2007; 117 (5): 946–949.
14. Alagaratnam S, Kurzawinski TR. Aetiology, diagnosis and surgical treatment of primary hyperparathyroidism in children: New trends. Horm Res Paediatr 2015; 83 (6): 365–375.
15. Hnízdil L, Procházková I, Jedlička V, et al. Adenom příštítného tělíska. Onkologie 2013; 7 (5): 252–255.
16. Durkin ET, Nichol PF, Lund DP, et al. What is the optimal treatment for children with primary hyperparathyroidism? J Pediatr Surg 2010; 45 (6): 1142–1146.
17. Witteveen JE, van Thiel S, Romijn JA, et al. Hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. Eur J Endocrinol 2013; 168 (3): R45–53.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 1-
All articles in this issue
- Diagnostický a terapeutický postup u detských pacientov s prvou nekomplikovanou infekciou horných močových ciest
- Recidivující infekce močových cest – přínos diagnostiky a léčby dysfunkční mikce
- Včasná antibiotická terapia a riziko renálneho jazvenia u detí s prvou nekomplikovanou infekciou močových ciest
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Nezvyčajná príčina hyperkalciémie u pacientky s primárne kortikorezistentným nefrotickým syndrómom – kazuistika
- Kvalita spánku detí a adolescentov s diabetes mellitus 1. typu
- Funkcia štítnej žľazy u obéznych detí
- Recidivující krvácení do trávicího ústrojí
- General Movements – vyšetření nezralého nervového systému
- Získaná kardiovaskulární onemocnění u Turnerova syndromu
- Febrilní křeče: doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi. Adaptovaný doporučený postup American Academy of Pediatrics
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Recidivující krvácení do trávicího ústrojí
- General Movements – vyšetření nezralého nervového systému
- Febrilní křeče: doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi. Adaptovaný doporučený postup American Academy of Pediatrics
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



