-
Medical journals
- Career
Segmentální dilatace střeva – prezentace souboru novorozenců se segmentální dilatací tenkého střeva a přehled literatury
: K. Hanousková 1; A. Matějková 2; M. Navratilova 1; T. Matějek 1; J. Koudelka 3; P. Rejtar 4; Z. Kokštein 1; J. Malý 1
: Dětská klinika LF UK a FN, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Fingerlandův ústav patologie LF UK a FN, Hradec Králové přednosta prof. MUDr. A. Ryška, Ph. D. 2; Oddělení dětské chirurgie a traumatologie FN, Hradec Králové primář MUDr. J. Koudelka, CSc. 3; Radiologická klinika LF UK a FN, Hradec Králové přednosta prof. MUDr. A. Krajina, CSc. 4
: Čes-slov Pediat 2015; 70 (3): 135-145.
: Original Papers
Úvod:
Segmentální dilatace střeva (segmental dilatation of the intestine – SDI) je vzácně popisovaným onemocněním, které je charakterizováno abnormálním rozšířením jednoho či více segmentů střeva s normálním průměrem i průchodností střevního lumen orálním i aborálním směrem projevujícím se funkční obstrukcí střeva. Postižena může být kterákoliv část tenkého či tlustého střeva, nejčastěji ileum. Resekce postiženého úseku je v naprosté většině případů kurativní. Při mikroskopickém vyšetření bývá nejčastěji popisován normální histologický obraz stěny střevní včetně gangliových buněk, event. změny svalové vrstvy ve smyslu ztenčení či hypertrofie.Cíl:
Cílem práce je zhodnocení vlastního souboru pacientů s SDI, přehled dostupné literatury a vznesení otázek týkajících se klasifikace tohoto onemocnění.Metoda:
Retrospektivní analýza souboru pacientů léčených v letech 1998–2012 na Dětské klinice LF UK a FN Hradec Králové. Informace o pacientech byly získány ze zdravotnické dokumentace.Výsledky:
SDI byla diagnostikována u 22 pacientů. Ve všech případech se jednalo o nedonošené novorozence; 19 (86 %) novorozenců s porodní hmotností pod 1500 g, z nichž 15 (68 % z celého souboru) vážilo méně než 1000 g. Medián porodní hmotnosti pacientů byl 815 g (680–2720 g), medián gestačního věku 26 týdnů (24–35 týdnů). Byla zaznamenána mírná převaha chlapců (13 : 9; tj. 1,4 : 1). Klinické příznaky se objevily mezi 1.–14. dnem života (v průměru 5. den). Převážně se jednalo o vzedmutí břicha, rýsující se střevní kličky a intoleranci stravy. U 21 (95 %) pacientů byla postižena oblast ilea, z toho dvakrát byla současně dilatována ještě část jejuna; v jednom případě (5 %) bylo postiženo pouze jejunum. U všech 21 (95 %) operovaných pacientů byla provedena resekce dilatovaného úseku s následnou primární anastomózou či vyvedením stomie. Při histologickém vyšetření byl u 11 (50 %) pacientů popsán defekt svalové vrstvy střevní stěny v oblasti dilatace. Prognóza pacientů byla ovlivněna především celkovým stavem a onemocněními spojenými s prematuritou. Incidence SDI v uvedeném období ve spádové oblasti východočeského regionu činila 1,4 případů na 10 000 živě narozených dětí.Závěr:
SDI je pravděpodobně nesourodou nozologickou jednotkou, do které jsou zahrnovány sobě podobné stavy několika různých etiologií. Z analýzy souboru usuzujeme na možné prolínání diagnóz SDI a segmentální defekt/absence svalové vrstvy střevní stěny.Klíčová slova:
segmentální dilatace střeva, novorozenec, tenké střevo, svalová vrstva střevní stěny, defekt střevní svalové vrstvyÚVOD
Segmentální dilatace střeva (segmental dilatation of the intestine – SDI) je podle literatury vzácným onemocněním, které je charakterizováno dilatací jednoho či více segmentů střeva s normální velikostí i průchodností střevního lumen orálním i aborálním směrem. Postižena může být kterákoliv část tenkého či tlustého střeva, nejčastěji ileum. Dilatovaný úsek střeva vede k funkční poruše průchodnosti. Resekce postiženého úseku je v naprosté většině případů kurativní. Poměrně častý je výskyt přidružené vrozené vady či abnormality; nejčastěji malrotace, omfalokély a Meckelova divertiklu. Při histologickém vyšetření nacházíme normální, ztenčelou nebo hypertrofickou svalovou vrstvu stěny střevní, ve většině případů s normální inervací střeva včetně přítomnosti gangliových buněk. Někdy bývá zjištěna přítomnost heterotopní tkáně. Etiologie a patogeneze SDI jsou i přes řadu publikovaných teorií stále nejasné.
MATERIÁL A METODA
Jedná se o retrospektivní analýzu pacientů léčených v letech 1998–2012 na Dětské klinice LF UK a FN Hradec Králové. Informace o pacientech byly získány ze zdravotnické dokumentace. Pacienti byli vyhledáni revizí záznamů operačních knih Oddělení dětské chirurgie a traumatologie FN HK nezávisle na sobě dvěma autory (KH, MN) a porovnáním nálezů s prospektivně vedenými databázemi dalších dvou autorů (ZK, JM). Rentgenová dokumentace byla získána z databáze Radiologické kliniky FN HK, peroperační fotografie z osobní fotodokumentace jednoho z autorů (JK). Diagnóza SDI byla v uvedeném období stanovena u 22 pacientů na podkladě klinických příznaků, odpovídajícího rentgenového obrazu (nativní rentgenový snímek, irrigoskopie) a peroperačního nálezu. Histologické preparáty z resekovaných částí střeva byly vyšetřeny po základním barvení hematoxylinem a eosinem (HE); všechny histologické nálezy byly revidovány jedním z autorů (AM).
VÝSLEDKY
Všichni pacienti v souboru (tab. 1) byli nedonošení novorozenci; v 19 (86 %) případech se jednalo o novorozence s porodní hmotností <1500 g, z nichž 15 (68 % z celého souboru) vážilo <1000 g. Medián porodní hmotnosti byl 815 g (680–2720 g), medián gestačního věku 26 týdnů (24–35 týdnů). Byla zaznamenána mírná predominance chlapců (M : F ratio – 13 : 9, tj. 1,4 : 1).
1. Pacienti, u kterých byla na Dětské klinice LF UK a FN Hradec Králové v letech 1998–2012 stanovena diagnóza segmentální dilatace střeva (SDI). 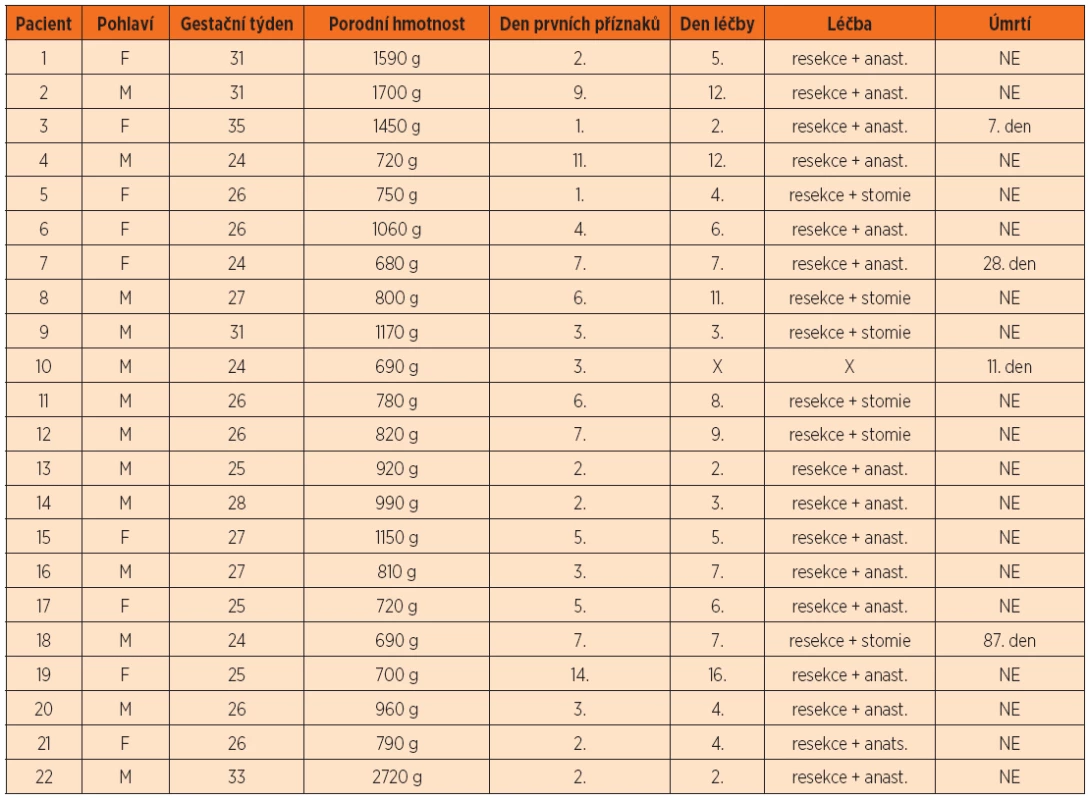
anast. – primární anastomóza end-to-end (Pacient č. 10 neoperován pro nepříznivou prognózu při intraventrikulárním krvácení IV. stupně.) Celková incidence SDI v naší spádové oblasti východočeského regionu (Královéhradecký kraj, Pardubický kraj, část kraje Vysočina a část Libereckého kraje) činila v daném období 15 let (1998–2012) 1,4 případů na 10 000 živě narozených dětí.
K rozvoji klinických příznaků došlo mezi 1.–14. dnem života (průměrně 5. den). Hlavními klinickými projevy byly známky ileu (vzedmutí břicha, rýsující se střevní kličky, intolerance stravy).
Na nativních rentgenových snímcích byly ve 20 (91 %) případech popsány dilatované kličky tenkého střeva (obr. 1) a při následné irrigografii normální či úzký nepoužívaný tračník normálního uložení a ev. dilatovaná klička ilea (obr. 2), bez průkazu mechanické překážky aborálně. Ve 4 (18 %) případech bylo zobrazeno pneumoperitoneum při následně potvrzené perforaci střevní stěny. U jednoho pacienta došlo k perforaci střeva aborálně od SDI v průběhu irrigografie. U 11 (50 %) pacientů vedlo rentgenové vyšetření k vyslovení podezření na diagnózu SDI, ve zbývajících případech byla diagnóza SDI stanovena až při operační revizi indikované pro ileus.
Obr. 1. Nativní rentgenový snímek pacientky s SDI – dilatované kličky střevní. Fig. 1. Abdominal native X-ray of the patient with SDI – dilatated bowel loops. 
Obr. 2. Irrigografické vyšetření téže pacientky – zobrazení dilatovaného úseku ilea. Fig. 2. Large bowel enema in the same patient – imaging of the dilatated part of the ileum. 
U 21 (95 %) pacientů byla v průměru 6. den života (2.–16. den) provedena operační revize dutiny břišní. U všech operovaných pacientů byla provedena resekce dilatovaného úseku střeva. Anastomóza end-to-end následovala ve 14 (64 %) případech, u 6 (27 %) dětí byla z důvodu celkově závažného stavu vyvedena enterostomie. U jedné (5 %) pacientky se současnou střevní perforací byla v místě po resekci SDI provedena primární anastomóza a v místě perforace vyvedena jejunostomie. Jeden (5 %) pacient nebyl operován z důvodu špatné prognózy při intraventrikulárním krvácení IV. stupně.
Při operaci byla v 19 (86 %) případech nalezena segmentální dilatace v oblasti ilea, u 2 (9 %) pacientů v oblasti jejuna i ilea (1x dilatace jejuno-ileálního přechodu, 1x jedna dilatace v oblasti jejuna a jedna v oblasti ilea), v 1 (5 %) případě byla dilatována část jejuna. Nalezené dilatace byly vřetenovitého (obr. 3) či kulovitého tvaru, délky 1–20 cm (průměrně 6 cm) a šířky 1–4 cm (průměrně 1,7 cm). Oproti průměru orálně resp. aborálně uložených střevních kliček byl dilatovaný úsek přibližně 2–3x resp. 3–4x širší. V 5 (23 %) případech bylo přítomno více dilatovaných segmentů (graf 1). U 6 (27 %) pacientů byly současně nalezeny 1–3 perforace střevní stěny; čtyři perforace byly popsány v oblasti SDI, tři na orálněji uložených kličkách a jedna perforace v oblasti céka, vzniklá pravděpodobně v průběhu irrigografického vyšetření.
Obr. 3. Resekát střeva se segmentální dilatací. Fig. 3. Resected bowel with segmental dilatation. 
1. Soubor pacientů – počet dilatovaných úseků. 
U všech operovaných pacientů byla resekce dilatovaného úseku z hlediska SDI kurativní. U jednoho pacienta došlo 6 dní po operaci pro SDI ke spontánní perforaci střeva nad stomií; u dalšího se 15 dní po operaci rozvinula nekrotizující enterokolitida s následnou perforací střeva v oblasti colon sigmoideum. Čtyři (18 %) pacienti zemřeli v důsledku komplikací asociovaných s těžkou nezralostí (odstup od operace pro SDI byl 5, 21 a 80 dní; jeden pacient nebyl operován).
Histologicky byly vyšetřeny střevní resekáty od všech operovaných pacientů i preparáty z pitvy neoperovaného pacienta. Histologické preparáty z resekovaných částí střeva byly vyšetřeny po základním barvení hematoxylinem a eosinem (HE). Co se týče svalové vrstvy stěny střevní (tab. 2), pouze u 3 (14 %) pacientů byl v místě dilatace střeva popsán normální nález. U 16 pacientů (73 %) byla popsána defektní nesouvislá vnitřní vrstva svaloviny – u 11 (50 %) z těchto vzorků ji tvořily izolované „bochánky/ostrůvky“ jinak normálně vypadajících svalových buněk (tyto případy byly patologem hodnoceny jako suspektní primární dysgeneze/ageneze svalové vrstvy střevní stěny – obr. 4, 5), zevní vrstva svaloviny byla v těchto případech obvykle velmi tenká, tvořená drobnými svalovými buňkami nebo místy chyběla úplně; u dalších 5 (23 %) případů byly obě svalové vrstvy extrémně tenké, tvořené místy pouze několika protáhlými buňkami, nebo chyběly úplně (tyto nálezy svědčí svým charakterem spíše pro sekundární změny při dilataci střeva, nicméně zcela jednoznačně se nelze k primární či sekundární etiologii přiklonit). U 6 (27 %) vzorků (včetně 3 vzorků zařazených do skupiny dysgeneze/ageneze svaloviny) byl popis značně limitován výraznými zánětlivými změnami či hemoragickou infarzací stěny, které se blížily obrazu nekrotizující enterokolitidy. Nervové pleteně submukózního plexu nebyly v základním barvení HE spolehlivě hodnotitelné; pleteně myenterického plexu byly ve 12 (55 %) případech normálního vzhledu, u 8 (36 %) vzorků byly plexy patrné pouze v části obvodu střeva (v místech, kde byla svalová vrstva střevní stěny defektní, pozorovány nebyly) a ve 2 (9 %) případech nebylo možné nervové pleteně vůbec hodnotit. Gangliové buňky byly v naprosté většině případů přítomny; hodnocení jejich přesného počtu či vzhledu však nebylo vzhledem k nízké spolehlivosti detekce v základním barvení HE možné. Cajalovy buňky rovněž nebyly v základním barvení hodnotitelné. V žádném vzorku nebyla popsána přítomnost heterotopní tkáně.
2. Soubor pacientů – histologický popis svalové vrstvy střevní stěny v místě dilatace. 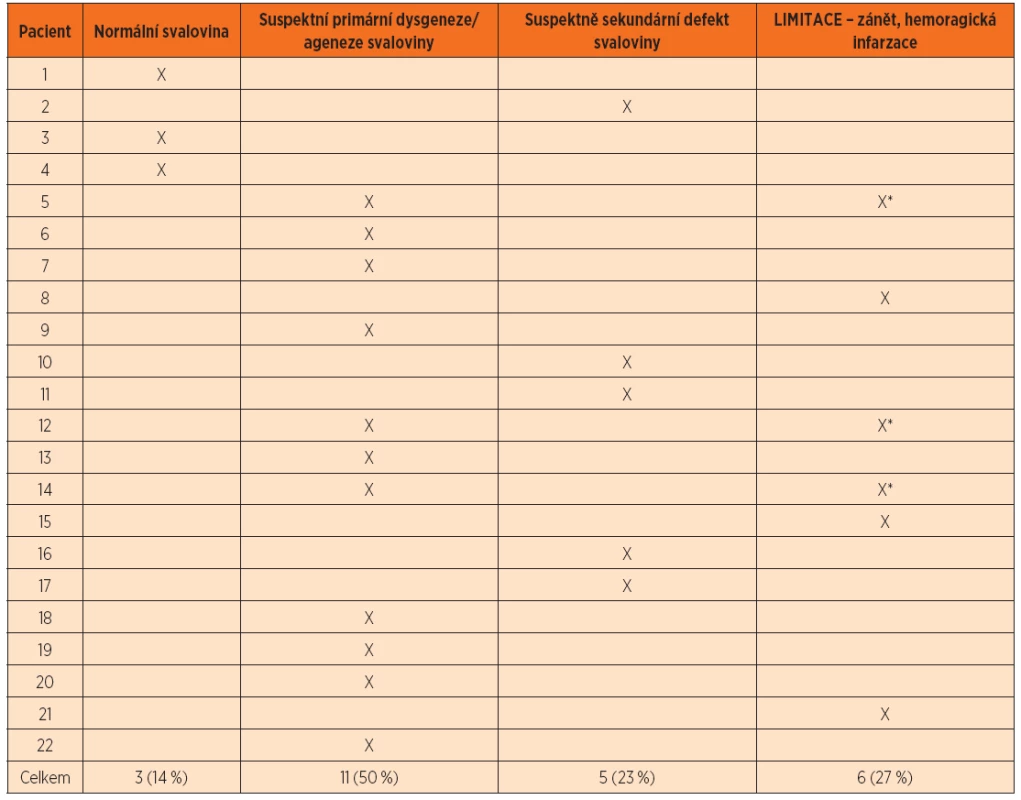
* u 3 (14 %) pacientů byly současně zastiženy změny svalové vrstvy ve smyslu ageneze/dysgeneze svaloviny a změny charakteristické pro nekrotizující enterokolitidu Obr. 4. Část stěny tenkého střeva se zcela chybějící lamina muscularis propria; ve stěně patrný edém a hyperémie (barveno hematoxylinem a eosinem; zvětšeno 200x). Fig. 4. Microscopic image of the small bowel wall with complete absence of muscularis propria layer, edema and hyperemia (hematoxyline-eosine staining, magnification 200). 
Obr. 5. Stěna tenkého střeva s patrným defektem vnitřní svalové vrstvy (VV), zachován pouze ostrůvek svaloviny; zevní svalová vrstva (ZV) ztenčená; sliznice (S) a podslizniční vazivo (SM) výrazně prokrvácené s edémem (barveno hematoxylinem a eosinem; zvětšeno 100x). Fig. 5. Microscopic image of the small bowel wall with defect of the inner muscular layer (VV), attenuation of the outer muscular layer (ZV), mucosa (S) and submucosal connective tissue (SM) with considerable hemorrhage and edema (hematoxyline-eosine staining, magnification 100). 
U žádného z našich pacientů nebyly zastiženy přidružené vrozené anomálie gastrointestinálního traktu. U jedné pacientky byla současně přítomna meningomyelokéla sakrální oblasti, u dalšího pacienta kongenitální hydrocefalus, jedenkrát byla zjištěna hypospádie a dvakrát aortopulmonální kolaterála (v jednom případě současně s defektem septa síní a perzistující tepennou dučejí).
DISKUSE
1. Segmentální dilatace střeva – přehled literatury
Diagnóza SDI byla poprvé použita v roce 1959 Swensonem a Rathauserem [1] u tří pacientů s dilatací střeva v oblasti colon; obdobné případy lze však najít i v dříve publikovaných pracích (Bill AH, et al. 1957 – citováno De Lorimierem 1971 [2]). První případ segmentální dilatace tenkého střeva publikovali v roce 1962 Sjolin a Thorén [3]. V nám dostupné anglicky psané literatuře bylo dosud popsáno 153 případů segmentální dilatace střeva, přičemž nejčastěji se jednalo o dilataci v oblasti ilea (58 %) a colon (27 %); vzácněji též jejuna (8 %), duodena (4 %), céka a rekta. Někteří autoři uvádějí rovněž možnost výskytu SDI v oblasti Meckelova divertiklu [4, 5, 6]. Počet publikovaných případů segmentálních dilatací jednotlivých částí střeva je přehledně shrnut v tabulce 3; i zde je patrná mírná predominance mužského pohlaví.
3. Přehled pacientů se segmentální dilatací střeva z dostupné literatury. 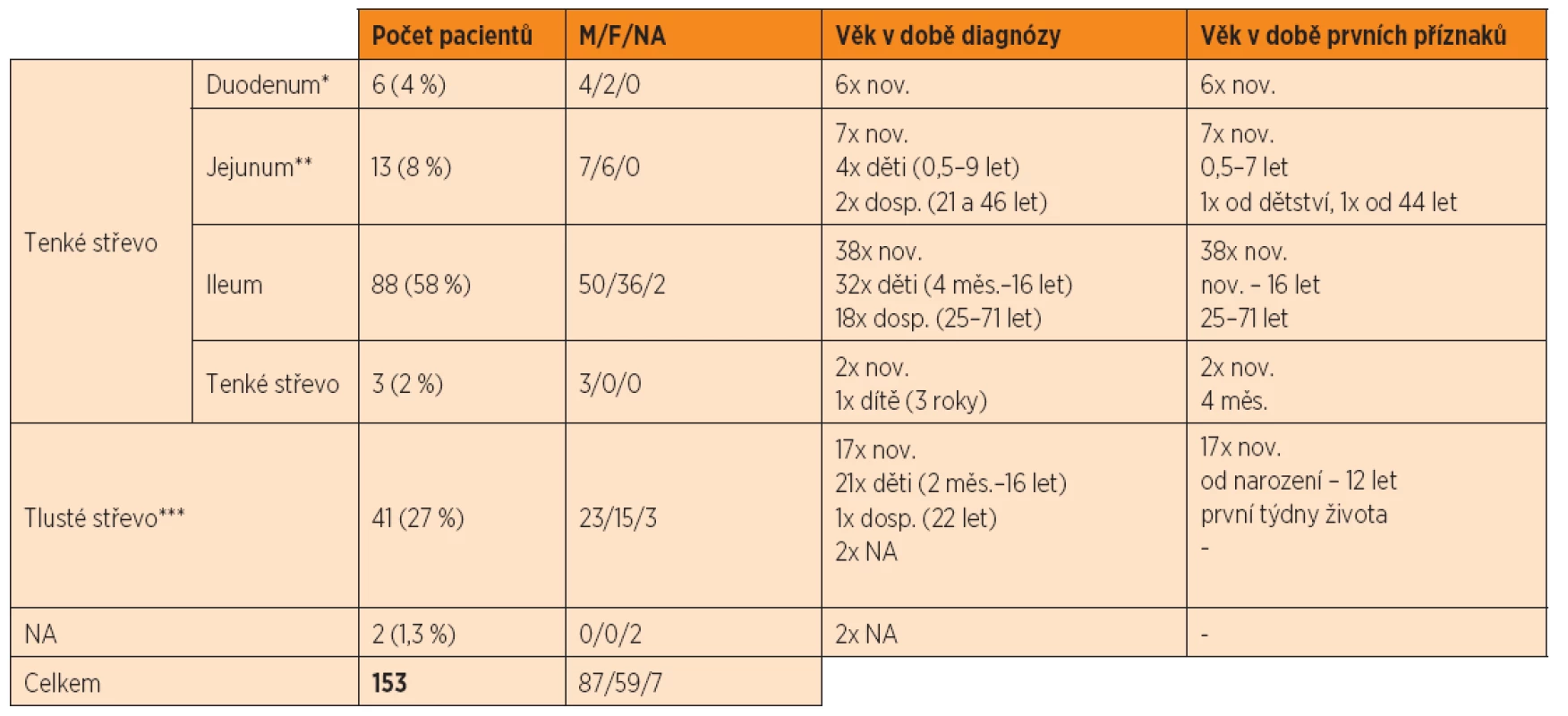
M – male/mužské pohlaví, F – female/ženské pohlaví, nov. – novorozenecký věk, dosp. – dospělost, NA – not available/nedostupná informace *1x současně dilatace jejuna, **1x současně dilatace duodena, ***převážně postižení colon; 3x současně dilatace céka, 7x současně dilatace rekta Co se týče názvu diagnózy, nacházíme v literatuře značné diskrepance. Nejčastěji používaným názvem je segmentální dilatace střeva (segmental dilatation of the intestine – SDI; segmental intestinal dilatation – SID), event. kongenitální segmentální dilatace (congenital segmental dilatation – CSD). Dále se lze setkat s názvy dysgeneze ilea [7, 8], segmentální megaileum [9], idiopatická lokalizovaná dilatace ilea (ILDI) [10, 11, 12], obrovský Meckelův divertikl [13], segmentální dilatace colon (segmental dilatation of the colon – SDC) [14, 15], ektázie colon [16] či pseudo-Hirschsprungova choroba (použito v roce 1965 při hledání vhodného názvu diagnózy) [17].
Dodnes se nejčastěji citují diagnostická kritéria uvedená v tabulce 4, která s odvoláním na práci Swensona a Rathausera (1959) [1] navrhli v roce 1978 Claret et al. (v anglicky psané literatuře prvně citována Rovirou v roce 1989 [18], dále citována například těmito autory [5, 19–29]). Klinické a patologické znaky segmentální dilatace colon sepsali v roce 1973 Brawner a Shafer [30] – viz tabulka 5.
4. Nejčastěji citovaná diagnostická kritéria SDI, která s odvoláním na práci Swensona a Rathausera (1959) [1] navrhli v roce 1978 Claret et al. (v anglicky psané literatuře prvně citována Rovirou v roce 1989 [18]). ![Nejčastěji citovaná diagnostická kritéria SDI, která s odvoláním na práci Swensona a Rathausera (1959) [1] navrhli v roce 1978 Claret et al. (v anglicky psané literatuře prvně citována Rovirou v roce 1989 [18]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/42a08c64440fa874f86d483a1a9f520c.png)
5. Klinické a patologické znaky segmentální dilatace colon podle Brawnera a Shafera (1973) [30]. ![Klinické a patologické znaky segmentální dilatace colon podle Brawnera a Shafera (1973) [30].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/37fa7af302e82a88aebf4ee3ad486693.png)
Klinicky způsobuje dilatovaný úsek funkční obstrukci střeva. Při postižení tenkého střeva se první příznaky nejčastěji objevují již časně v novorozeneckém věku; dominují známky akutní střevní obstrukce, jako jsou vzedmutí břicha a zvracení. Méně často se při SDI v oblasti tenkého střeva setkáme s obtížemi chronického charakteru (intermitentní bolesti břicha, anémie [3, 7–9, 11, 12, 31–34], neprospívání [8, 35], hypalbuminémie [31, 36]). Při postižení tlustého střeva je diagnóza častěji stanovena až u dětí starších jednoho měsíce. Příznaky jsou spíše chronické (chronická zácpa, distenze břicha), často však také trvající již od narození. Vzhledem k charakteru obtíží je v naprosté většině případů pomýšleno na Hirschsprungovu chorobu.
Před operací je definitivní stanovení diagnózy z důvodu nespecifičnosti klinických projevů a nálezů na nativních rentgenových snímcích poměrně obtížné. Pro SDI svědčí spojení výše jmenovaných symptomů a přítomnost lokalizované nápadně dilatované střevní kličky/kliček na nativním rentgenovém snímku. Při irrigografii bývá při SDI v oblasti tenkého střeva zobrazeno zcela normální či nepoužívané úzké tlusté střevo a event. dilatovaný úsek distálního tenkého střeva; při postižení colon je obvykle zřetelně zobrazen dilatovaný úsek, v obou případech bez průkazu organické překážky aborálně. Ve 12 (8 %) publikovaných případech byl nález intraabdominální cystické léze s následnou diagnózou SDI popsán již při prenatálním ultrazvukovém vyšetření [4, 19, 27, 28, 37–43]. Jako vzácněji použitou diagnostickou metodu lze jmenovat postnatální ultrazvukové vyšetření [10, 37, 44–47]. K literárně dokumentovanému použití CT břicha [10, 11, 26, 31, 40] se váže celá řada výhrad a především v novorozeneckém a kojeneckém období nemá jeho použití žádné opodstatnění (záření, rozlišovací schopnost, nutnost podání kontrastní látky atd.).
Po rentgenovém vyšetření, ať už diagnostickém či nikoliv, je obvykle indikována laparotomie s peroperačním potvrzením diagnózy, respektive objasněním příčiny obtíží. SDI bývá také náhodným nálezem při laparotomii z jiných důvodů, nejčastěji pro přidružené vrozené vady trávicího traktu. Je otázkou, zda je segmentální dilatace v těchto případech asymptomatická, či zda se příznaky nestačily před operací projevit.
Diferenciálně diagnosticky je nutno pomýšlet na častější příčiny střevní obstrukce, jako jsou atrézie a stenóza střeva, malrotace, mekoniový ileus, uskřinutá kýla, invaginace a další. V případě postižení tlustého střeva je nejčastěji pomýšleno na Hirschsprungovu chorobu, která má obdobné klinické příznaky. Diagnostickými vodítky jsou normální peristaltika a roztažitelnost tlustého střeva při kontrastním rentgenovém vyšetření, relaxace vnitřního sfinkteru při rektálním manometrickém vyšetření a přítomnost gangliových buněk při histologickém vyšetření vzorku z rektální biopsie [48]. Z dalších diferenciálně diagnostických možností u SDI v oblasti tlustého střeva jmenujme střevní duplikatury či divertikly, idiopatické megacolon, poruchy vyprazdňování při neuromuskulárních onemocněních a u hypotyreózy. K odlišení SDI od střevních divertiklů (včetně Meckelova divertiklu) lze podle Kima [11] a Javorse [12] použít pravidlo axiální symetrické orientace SDI. Další autoři jsou toho názoru, že v případě obrovského Meckelova divertiklu vakovitého tvaru se jedná o segmentální dilataci v oblasti Meckelova divertiklu [4, 5, 6]. U prenatálně diagnostikovaných případů SDI lze při ultrazvukovém zobrazení intraabdominální cystické léze pomýšlet na kongenitální volvulus, atrézii či významnou stenózu GIT a cystický útvar jiného původu (mezenteriální cysta, cysta choledochu, střevní duplikatura atd.).
Peroperačním nálezem bývá sféricky či tubulárně dilatovaný segment či více [49, 50] segmentů střeva, přičemž rozsah dilatace se různí – od krátkého segmentu až po celé střevo (colon) [51]. Léčbu SDI představuje resekce dilatovaného úseku a primární anastomóza end-to-end. Byly však popsány i případy opakované laparotomie pro perforaci v jiných oblastech střeva s abnormální stěnou střevní [50]. V případě závažného stavu pacienta bývá volena vícestupňová operace s dočasným vyvedením enterostomie. Postižení duodena segmentální dilatací většinou zahrnuje i Vaterskou papilu a je nutné provedení speciálních záchovných zákroků k zajištění drenáže žluči [38]. Segmentální dilatace duodena byla opakovaně popsána ve spojitosti s kongenitální alveolární kapilární dysplazií (ACD/MPV) a Inoue [38] navrhuje odložení operace minimálně o pár dní k snížení rizika rozvoje perzistující plicní hypertenze, což se vzhledem ke 100% smrtnosti ACD/MPV jeví jako bezpředmětné. Při dilataci střeva v oblasti rektosigmoidea byly též použity tzv. průvlekové operace (například modifikovaná Duhamelova „pull-through“ operace [52]). Ponechání segmentální dilatace in situ vede podle některých autorů k nutnosti další chirurgické intervence [53, 54]. Bylo však popsáno pět případů, kdy po stanovení diagnózy SDI následovala pouze observace bez nutnosti operační léčby [10, 12, 32]; správnost stanovené diagnózy je v těchto případech diskutabilní.
Při histologickém vyšetření resekované dilatace bývá obvykle popisována střevní stěna bez významnějších abnormalit. Svalová vrstva stěny střevní byla nejčastěji označena jako normální (37 %); dále pak hypertrofická (12 %) či ztenčelá (11 %). U 36 % publikovaných případů nám není informace o tloušťce svalové vrstvy známá. Podle některých autorů [55, 56, 57] je hypertrofie charakteristicky viditelná u starších pacientů a chybí u novorozenců a může tak být pouze funkční adaptací sekundárně k chronické distenzi a nikoliv součástí samotné vrozené malformace. Dva autoři [5, 6] popsali každý jeden případ segmentální dilatace jejuna s histologickými známkami svalové myopatie v oblasti dilatace (vakuolární degenerace svalových vláken). Nervové plexy stěny střevní jsou ve většině případů v normě včetně počtu a morfologie gangliových buněk, nicméně nacházíme literární odkazy popisující případy SDI s prokázanými abnormitami nervových pletení [4, 44, 49]. Cajalovy intersticiální buňky (ICC), jimž je přisuzována funkce pacemakeru střevní peristaltiky, byly vyšetřeny ve třech případech; dvě práce [4, 22] prezentovaly nález nižšího počtu ICC; Cheng [6] oproti tomu publikoval případ SDI s normálním nálezem ICC. V některých pracích byly rovněž popisovány určité abnormity cév – tortuozita cév v místě dilatace [1, 58], angiodysplazie [18] a další. Heterotopní tkáň byla v oblasti dilatace popsána celkem u 16 (10 %) pacientů [7, 12, 19, 25, 26, 33, 46, 53, 59–64]. Nejčastěji se jednalo o žaludeční sliznici (12x); dále pak pankreatickou tkáň, sliznici jícnu, chrupavku, příčně pruhované svaly, plicní tkáň. U 22 (14 %) pacientů byl v místě segmentální dilatace nalezen vřed [3, 7–9, 11, 12, 21, 31–36, 65, 66], jehož výskyt byl pouze ve 23 % případů spojen s přítomností heterotopní žaludeční sliznice.
U 74 (48 %) publikovaných případů SDI byla přítomna přidružená vrozená vada či anomálie [3, 7–9, 13–16, 19, 23, 27, 28, 34, 38, 39, 44–46, 49, 51, 53–55, 57, 59, 60, 62–64, 66–85]. Nejčastěji se jednalo o malrotaci (u 20 pacientů – 13 %), omfalokélu (u 15 pacientů – 10 %) a Meckelův divertikl (u 12 pacientů – 8 %); dále pak o atrézie střev a jícnu, anální anomálie, anomálie obratlů a žeber, extrofii močového měchýře, malformace genitálu, malformace pankreatu, rozštěpy rtu a patra, vrozené srdeční vady, malformaci plic, meningoencefalokélu s hydrocefalem, chromozomální vady a další.
Vzhledem k tomu, že většina případů segmentální dilatace střeva byla diagnostikována v novorozeneckém období (70 pacientů – 46 %) a ve 12 (8 %) případech dokonce zobrazena již prenatálně, a vzhledem k velkému procentu přidružených vrozených vad lze předpokládat, že se jedná o anomálii vrozenou. Je však sporné, zda je tomu tak i u případů diagnostikovaných v pozdějším věku.
Publikovaných teorií o příčině vzniku segmentální dilatace střeva je celá řada – přehledně jsou dokumentovány v tabulce 6.
6. Dosud publikované teorie vzniku SDI. 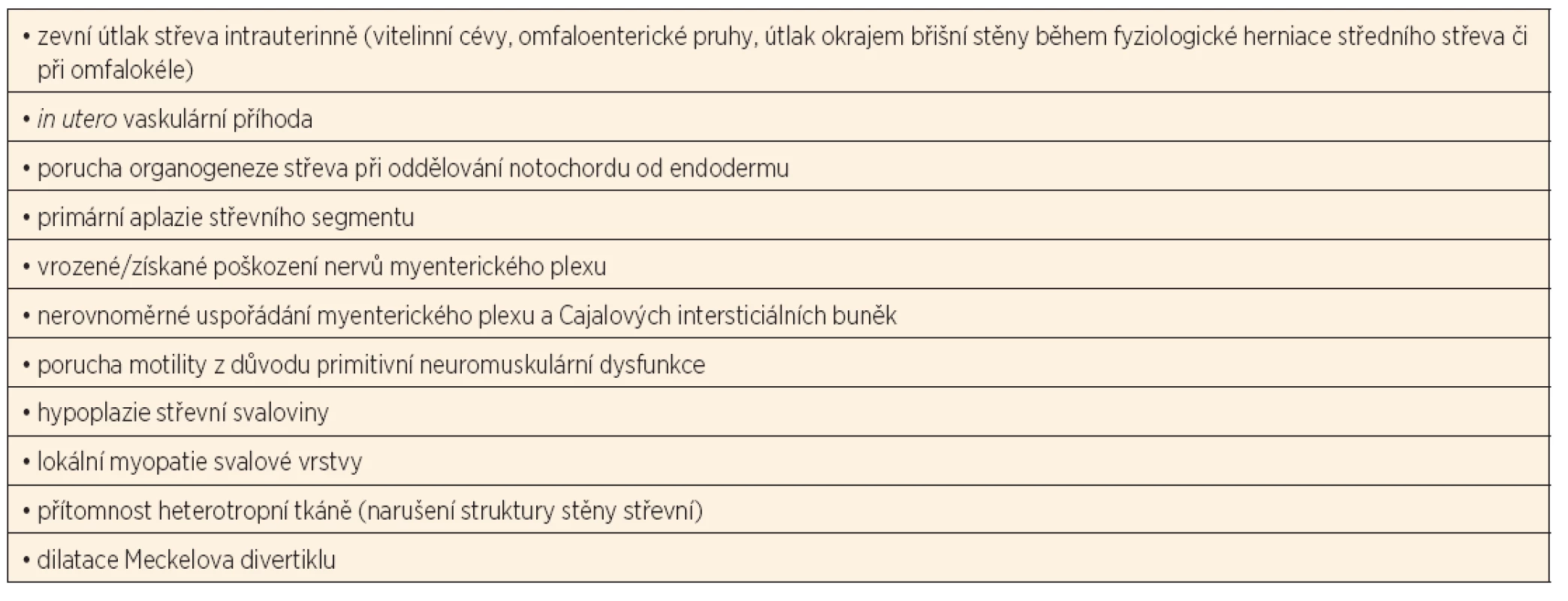
Jak již někteří autoři dříve zvažovali [4, 60], je možné, že pod diagnózou SDI je skryto několik více či méně příbuzných onemocnění. Pro toto tvrzení mohou svědčit některé rozdíly, jakými jsou například různé lokalizace dilatací, rozdíly v histologických nálezech, různý věk pacientů v době klinické manifestace i rozdílné teorie vzniku.
2. Prezentovaný soubor pacientů a diagnóza SDI
Prezentovaný soubor pacientů se od dosud publikovaných prací o SDI liší v několika aspektech. Zaprvé byly dosud převážně publikovány jednotlivé kazuistiky; žádný soubor pacientů s touto diagnózou nebyl tak početný (max. 9 pacientů). Poměrně významnou odlišností je, že zatímco gestační věk všech našich pacientů byl 24.–35. týden, v literatuře se jen ve 12 (8 %) případech SDI jednalo o nedonošené novorozence – nejnižší gestační věk novorozence s touto anomálií byl 31 gestačních týdnů [86]. Prenatálně ale byla SDI zobrazena již v 17. gestačním týdnu [28].
Za příčinu těchto rozporů by se hypoteticky dalo považovat nesprávné diagnostické zařazení našich pacientů pod diagnózu SDI; dalším důvodem by mohl být malý počet publikovaných případů nedonošených dětí s SDI z důvodu nízké publikovanosti či publikovatelnosti nebo v důsledku jiného a nejspíše nepřesného diagnostického zařazení. Pro oprávněné použití diagnózy SDI u našich pacientů svědčí naplnění diagnostických kritérií pro SDI (jedinou nesrovnalostí u části našich pacientů byla popsaná diskontinuita myenterického plexu v místech, kde nebyla souvislá svalová vrstva střevní stěny).
Vzhledem k tomu, že u 11 (50 %) našich pacientů byl při histologickém vyšetření popsán defekt svalové vrstvy ve smyslu suspektní primární ageneze/dysgeneze svaloviny, bylo by pravděpodobně možné zařazení těchto případů rovněž pod diagnózu „segmentální defekt/absence svaloviny střeva“ [87–91]. Toto ještě vzácněji publikované onemocnění, které je histologicky definováno částečnou či kompletní absencí lamina muscularis propria střevní stěny, je popisováno především u nezralých novorozenců a klinicky se manifestuje především střevní perforací či dilatací střeva s funkční obstrukcí, což v domácím písemnictví publikovala Vítková [91]. Etiologie této jednotky je zatím rovněž nejasná.
U zbývající poloviny našich pacientů jsou teorie o etiologii dilatace pouze spekulativní. U 3 (14 %) pacientů byla svalová vrstva stěny střevní bez abnormit a u 5 (23 %) pacientů byly defekty svalové vrstvy spíše sekundárního charakteru v.s. po předchozí dilataci střevní stěny. V těchto případech se o defektu svaloviny jako primární příčině dilatace pravděpodobně uvažovat nedá. U 3 (14 %) zbývajících pacientů byl ve střevní stěně popsán nález připomínající nekrotizující enterokolitidu. Otázka, zda se předchozí ischemický či zánětlivý inzult (spolu)podílel na vzniku dilatace, zůstane nezodpovězena. U dalších 3 (14 %) pacientů s popsanou suspektní primární agenezí//dysgenezí svaloviny byl však současně také popsán nález připomínající obraz nekrotizující enterokolitidy; je tedy možné uvažovat o tom, že tyto změny (ve smyslu zánětu a hemoragické infarzace) jsou sekundárním následkem dilatace střeva či pouze souběžným postižením střeva se stejnou či odlišnou primární příčinou.
Ze současné analýzy souboru našich pacientů s SDI usuzujeme na značnou heterogenitu diagnózy SDI, pod kterou je vzhledem k šíři diagnostických kritérií zařazováno větší množství nozologických jednotek lišících se pravděpodobně v řadě aspektů, a dále na pravděpodobné prolínání diagnóz SDI a segmentální defekt/absence střevní svaloviny.
ZÁVĚR
Po prostudování dostupných informací o segmentálních dilatacích střeva v odborné literatuře a po rozboru souboru našich pacientů s touto diagnózou docházíme k názoru, že segmentální dilatace střeva je pravděpodobně spíše heterogenní skupinou onemocnění než jedinou úzce specifikovanou nozologickou jednotkou. Pro toto tvrzení mohou svědčit fakta, jako jsou různé lokalizace střevních dilatací, určité rozdíly v histologických nálezech, různý věk pacientů v době klinické manifestace i různé publikované teorie o etiopatogenezi. Z analýzy souboru našich pacientů s SDI můžeme předpokládat možné prolínání diagnóz SDI a segmentální defekt//absence střevní svaloviny. Čistě spekulativně je možné uvažovat o příbuznosti některých případů SDI a nekrotizující enterokolitidy.
Bylo by žádoucí vyvolat diskusi v odborných kruzích k porovnání zkušeností jednotlivých pracovišť a ucelení poznatků. Diskuse by mohla vést k vytvoření návrhu nutných diagnostických postupů, k posouzení (ne)dostatečnosti v současnosti používaných diagnostických kritérií a eventuálnímu dalšímu rozčlenění případů SDI do více nozologických jednotek.
U všech operovaných případů SDI by bylo vhodné, a pro lepší pochopení tohoto onemocnění přínosné, detailní histologické vyšetření včetně přesného popisu svalové vrstvy stěny střevní, inervace a eventuální provedení imunohistochemické detekce c-kit pozitivních Cajalových buněk, jejichž nižší počet byl již v literatuře jako možná příčina SDI popsán.
Práce podporována programem PRVOUK P37/12.
Došlo: 4. 8. 2014
Přijato: 20.2. 2015
MUDr. Jan Malý, Ph.D.
Dětská klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: malyj@lfhk.cuni.cz
Sources
1. Swenson O, Rathauser F. Segmental dilatation of the colon; a new entity. Am J Surg 1959; 97 : 734.
2. De Lorimier AA, Benzian SR, Gooding CA. Segmental dilatation of the colon. Am J Roentgenol 1971; 112 : 100.
3. Sjölin S, Thorén L. Segmental dilatation of the small intestine. Arch Dis Child 1962; 37 : 422–425.
4. Okada T, Sasaki F, Honda S, et al. Disorders of interstitial cells of Cajal in a neonate with segmental dilatation of the intestine. J Pediatr Surg 2010; 45: E11–E14.
5. Daher P, Ghanimeh J, Riachy E, et al. Congenital segmental dilatation of the small bowel (CSD). Eur J Pediatr Surg 2007; 17 (4): 289–291.
6. Cheng W, Lui VCH, Chen QM, et al. Enteric nervous systém, interstitial cells of Cajal, and smooth muscle vacuolization in segmental dilatation of jejunum. J Pediatr Surg 2001; 36 (5): 930–935.
7. Dillman JR, Neef HC, Ehrlich PF, et al. Ileal dysgenesis coexisting with multiple enteric duplication cysts in a child – MR enterography, CT, and Meckel scan appearances. Pediatr Radiol 2012; 42 (12): 1517–1522.
8. Orenstein SR, Magill HL, Whitington PF. Ileal dysgenesis presenting with anaemia and growh failure. Pediatr Radiol 1984; 14 : 59–61.
9. Leinster SJ, Hughes LE. Segmental mega-ileum presenting as anaemia. Br J Surg 1981; 68 (6): 417–419.
10. Yang DM, Kim HC, Jin W, et al. Imaging findings of idiopathic localized dilatation of the ileum. Br J Radiol 2008; 81: e48–e49.
11. Kim YS, Kim Y, Park DW, et al. Idiopathic localized dilatation of the ileum: CT findings. Abdom Imag 2002; 27 (1): 15–17.
12. Javors BR, et al. Idiopathic localized dilatation of the ileum in adults: Findings on barium studies. Am J Roentgenol 1995; 164 : 87–90.
13. Cross VF, Wendth AJ, Phelan JJ, et al. Giant Meckel´s diverticulum in premature infant. Am J Roentgenol 1970; 108 : 591–597.
14. Ragavan M, Arunkumar S, Balaji NS. Segmental dilatation of near total colon managed by colon preserving surgery. APSP J Case Rep 2012; 3 (3): 18.
15. Puri A, Choudhury SR, Yadav PS, et al. Congenital pouch colon and segmental dilatation of the colon: A report of two unusual cases. J Indian Assoc Pediatr Surg 2011; 16 (2): 61–63.
16. AlQahtani AR. Laparoscopic-assisted sigmoid resection for colonic ectasia in s neonate. J Pediatr Surg 2010; 45 : 1714–1716.
17. Ehrenpreis T. Pseudo Hirschsprung´s disease. Arch Dis Child 1965; 40 : 177.
18. Rovira J, Morales L, Parri FJ, et al. Segmental dilatation of the duodenum. J Pediatr Surg 1989; 24 (11): 1155–1157.
19. Paradiso FV, et al. Antenatal ultrasonographic features associated with segmental small bowel dilatation: An unusual neonatal condition mimicking congenital small bowel obstruction. Pediatr Neonatol 2013; 54 (5): 339–343.
20. Rathod KJ, Mohd Z, Kanojia R, Rao KLN. Segmental ileal dilatation: an unsuspected cause of neonatal intestinal obstruction. Trop Gastroenterol 2012; 33 (2): 143–146.
21. Uchida K, Otake K, Inoue M, et al. Unique capsule endoscopic appearance of segmental intestinal dilatation in a child. Pediatr Int 2012; 54 (5): 727–729.
22. Katsura S, Kudo T, Enoki T, et al. Congenital segmental dilatation of the duodenum: Report of a case. Surg Today 2011; 41 : 406–408.
23. Wei CH, Sheu JC. Concomitant segmental intestinal dilatation and omphalocele. Formosan Journal of Surgery 2011; 44 : 168–170.
24. Saha S, et al. Segmental ileal obstruction in neonates – a rare entity. J Pediatr Surg 2009; 44 : 1827–1830.
25. Shah AD, Kovanlikaya A, Beneck D, et al. Segmental dilatation of the ileum in a healthy adolescent. Pediatr Radiol 2009; 39 : 1350–1353.
26. Kobayashi T, Uchida N, Shiojima M, et al. Segmental dilatation of the ileum covered almost entirely by gastric mucosa: Report of a case. Surg Today 2007; 37 : 1102–1104.
27. Basaran UN, Sayin C, Oner N, et al. Segmental intestinal dilatation associated with omphalocele. Pediatr Int 2005; 47 (2): 227–229.
28. Cuming T, Asif M, Babu R, et al. Congenital segmental dilatation of the duodenum – differential diagnosis for an antenatally-diagnosed intra-abdominal cyst. Eur J Pediatr Surg 2001; 11 (2): 133–135.
29. Mir E, Yegane S, Karaca I, et al. Segmental dilatation of the jejunum. Acta Paediatr Jpn 1996; 38 : 69–71.
30. Brawner J, Shafer AD. Segmental dilatation of the colon. J Pediatr Surg 1973; 8 : 957.
31. Oberhelman AP, Herman TE, McAlister WH, et al. CT manifestations of ileal dysgenesis. Pediatr Radiol 2007; 37 : 209–212.
32. Usselman JA, Ghahremani GG, Bordin GM, et al. Idiopathic localized dilatation of the ileum in adults. Gastrointest Radiol 1981; 6 : 313–317.
33. Porreca A, Capobianco A, Terracciano C, et al. Segmental dilatation of the ileum presenting with acute intestinal bleeding. J Pediatr Surg 2002; 37 : 1506 – 1508.
34. Morewood DJ, Cunningham ME. Case report: segmental dilatation of the ileum presenting with anaemia. Clin Radiol 1985; 36 (3): 267–268.
35. Eradi B, Menon P, Rao KLN, et al. Segmental dilatation of ileum: an unusual cause of severe malnutrition. Pediatr Surg Int 2005; 21 : 405–406.
36. Elemen L, Inanc D, Oz F, et al. Segmental dilatation of the ileum accompanying hypoproteinemia. J Pediatr Surg 2008; 43: E15–E18.
37. Park JS, et al. Segmental dilatation of the ileum presenting as a cystic lesion on prenatal ultrasonography in one twin. Pediatr Int 2010; 52 : 337–338.
38. Inoue M, Uchida K, Otake K, et al. Congenital segmental dilatation of the duodenum: Report of a case. Pediatr Int 2010; 52: e184–e186.
39. Harjai MM, Katiyar A, Negi V, et al. Congenital segmental dilatation of jejunoileal region in a newborn: Unusual clinical and radiologic presentation. J Indian Assoc Pediatr Surg 2010; 15 : 96–97.
40. Waters KJ, Levine D, Lee EY, et al. Segmental dilatation of the ileum. J Ultrasound Med 2007; 26 : 1251–1256.
41. Manikoth P, Paul J, Zachariah N, et al. Congenital segmental dilatation of the small bowel. J Pediatr 2004; 145 : 415.
42. Hosie S, Lorenz C, Schaible T, et al. Segmental dilatation of the jejunum resembling prenatal volvulus. J Pediatr Surg 2001; 36 : 927–929.
43. Mboyo A, Aubert D, Massicot R, et al. Antenatal finding of intestinal obstruction caused by isolated segmental jejunal dilatation: A case report. J Pediatr Surg 1996; 31 : 1454–1456.
44. Mahadevaiah SA, Panjwani P, Kini U, et al. Segmental dilatation of sigmoid colon in a neonate: atypical presentation and histology. J Pediatr Surg 2011; 46 (3): e1–e4.
45. Mehmood MT, Shahzad F, Ashraf MS, et al. Congenital segmental dilatation of sigmoid colon, penile agenesis and umbilical cord hernia – a new association. Journal of the Dow University of Health Sciences 2009; 3 (1): 30–32.
46. Brown BR, Hennessey I, Lansdale N, et al. Pancreatic tissue in congenital segmental dilatation of intestine: case presentation and recommendation for treatment. J Pediatr Surg 2008; 43: E9–E11.
47. Fang SB, Lee HC, Sheu JC, et al. Segmental dilatation of the ileum as an unusual cause of gastrointestinal bleeding: report of one case. Acta Paediatr Taiwan 2000; 41 (2): 93–97.
48. Gopal SC, Gangopadhyay AN, Pandit SK. Segmental dilatation of the sigmoid colon. Pediatr Surg Int 1994; 3 : 212–213.
49. Morikawa N, Kuroda T, Honna T, et al. A novel association of duodenal atresia, malrotation, segmental dilatation of the colon and anorectal malformation. Pediatr Surg Int 2009; 25 : 1003–1005.
50. Kuint J, Avigad I, Husar M, et al. Segmental dilatation of the ileum: An uncommon cause of neonatal intestinal obstruction. J Pediatr Surg 1993; 28 (12): 1637–1639.
51. Sarin YK, Singh VP. Congenital segmental dilatation of colon. Indian Pediatr 1995; 32 (1): 116–118.
52. Al-Salem A. Congenital segmental dilatation of the rectosigmoid colon: A forgotten cause of constipation. Journal of Pediatric Surgical Specialties 2008; 2 (2): 20–22.
53. Ben Brahim M, Belghith M, Mekki M, et al. Segmental dilatation of the intestine. J Pediatr Surg 2006; 41 : 1130–1133.
54. Doody D, Nguyen LT. Congenital atresia of the colon combined with segmental dilatation of the ileum: a case report. J Pediatr Surg 1987; 22 (9): 804–805.
55. Kothari P, Gowrishankar, Rastogi A, et al. Congenital segmental dilatation of colon with colonic atresia. Indian J Gastroenterol 2005; 24 (3): 123–124.
56. Al-Salem AH, Grant C. Segmental dilatation of the colon: report of a case and review of the literature. Dis Colon Rectum 1990; 33 : 515–518.
57. Helikson MA, Schapiro MB, Garfinkel DJ, et al. Congenital segmental dilatation of the colon. J Pediatr Surg 1982; 17 : 201–202.
58. Takehara H, Nobuhiko K, Massao H. Congenital segmental dilatation of the colon: Report of a case and review of the literature. Pediatr Surg Int 1988; 4 : 66–68.
59. Aterman K, Abaci F. Heterotopic gastric and esophageal tissue in the colon. Am J Dis Child 1967; 113 : 552.
60. Irving IM, Lister J. Segmental dilatation of the ileum. J Pediatr Surg 1977; 12 (1): 103–112.
61. Senocak ME, Bulut M, Caglar M, et al. Congenital segmental dilatation of the colon with heterotopic esophageal mucosa. Turk J Pediatr 1987; 29 : 51–60.
62. Marsden HB, Gilchrist W. Pulmonary heteroplasia in the terminal ileum. J Pathol Bacteriol 1963; 86 : 532–534.
63. Brown A, Carty H. Segmental dilatation of the ileum. Br J Radiol 1984; 57 : 371–374.
64. Kusaba M, Nakajo T, Akiyama H, et al. Segmental dilatation of intestine. Report of six cases. Journal of Japanese Society of Pediatric Surgeons 1983; 19 : 127–134.
65. Morowitz MJ, Markowitz R, Kamath BM, et al. Dieulafoy´s lesion and segmental dilatation of the small bowel: An uncommon cause of gastrointestinal bleeding. J Pediatr Surg 2004; 39 (11): 1726–1728.
66. Simpson S, Hollinshead J, Katelaris PH. Idiopathic localized dilatation of the ileum. A rare cause of gastrointestinal haemorrhage in an adult. J Gastroenterol Hepatol 1998; 13 : 1234–1236.
67. Mirza B, Bux N. Multiple congenital segmental dilatations of colon: A case report. J Neonat Surg 2012; 1 (3): 40.
68. Sam CJ. Segmental ileal dilatation in a child. Trop Gastroenterol 2011; 32 (3): 221–223.
69. Thambidorai CR, Arief H, Noor Afidah MS. Ileal perforation in segmental intestinal dilatation associated with omphalocoele. Singapore Med J 2009; 50 (12): e412–e414.
70. Mahajan JK, Mohanan A, Rao KLN. Segmental dilatation of colon associated with anorectal malformation. J Indian Assoc Pediatr Surg 2007; 12 : 32–33.
71. Mathur P, Mogra N, Surana SS, et al. Congenital segmental dilatation of the colon with anorectal malformation. J Pediatr Surg 2004; 39 (8): E31.
72. Ojha S, Menon P, Rao KLN. Meckel‘s diverticulum with segmental dilatation of the ileum: radiographic diagnosis in a neonate. Pediatr Radiol 2004; 34 : 649–651.
73. Ratan SK, Kulshreshta R, Ratan J. Cystic duplication of the cecum with segmental dilatation of the ileum. Surg Today 2001; 31 : 72–75.
74. Chadha R, Gupta S, Tanwar US, et al. Congenital pouch colon associated with segmental dilatation of the colon. J Pediatr Surg 2001; 36 : 1593–1595.
75. Yadav K, Singh G, Budhiraja S. Congenital segmental dilatation of intestine. Indian J Pediatr 1996; 63 : 561–572.
76. Balik E, Taneli C, Yazici M, et al. Segmental dilatation of intestine: a case report and review of the literature. Eur J Pediatr Surg 1993; 3 (2): 118–120.
77. Narasimhan KL, Roychoudhuri S. Duplication of appendix with segmental dilatation of the colon and vesical exstrophy. Pediatr Surg Int 1993; 8 : 452.
78. Ngai RLC, Chan AKH, Lee JPK, et al. Segmental colonic dilatation in a neonate. J Pediatr Surg 1992; 27 (4): 506–508.
79. Ratcliffe J, Tait J, Lisle D, et al. Segmental dilatation of the small bowel: Report of three cases and literature review. Radiology 1989; 171 : 827–830.
80. Mizote H, Gu L, Sugiyama M, et al. Congenital segmental dilatation of the jejunum with malrotation. Kurume Med J 1988; 35 (3): 135–138.
81. Ziv Y, Lombroso R, Mor C, et al. Congenital segmental dilatation of small intestine with esophageal atresia and duodenal atresia in a premature infant. Z Kinderchir 1987; 42 : 317–318.
82. Venugopal S, Char JN. Segmental dilatation of the colon and the Stilling-Turk-Duane retraction syndrome. West Indian Med J 1985; 34 : 139–142.
83. Craft AW, Watson AJ, Scott JES. Giant Meckel´s diverticulum causing intestinal obstruction in the newborn. J Pediatr Surg 1976; 11 : 1037–1038.
84. Komi N, Kohyama Y. Congenital segmental dilatation of the jejunum. J Pediatr Surg 1974; 9 : 409.
85. Rossi R, Giocomino MA. Segmental dilatation of the jejunum. J Pediatr Surg 1973; 8 : 335.
86. Lee JE, Lee SW, Hwang JY. Segmental dilatation of the ileum: A report of two cases. Acta Radiol 2006; 47 : 525–528.
87. Oretti C, Bussani R, Janes A, et al. Multiple segmental absence of intestinal musculature presenting as spontaneous isolated perforation in an extremely low-birth-weight infant. J Pediatr Surg 2010; 45: E25–E27.
88. Stephens D, Arensman R, Pillai S, et al. Congenital absence of intestinal smooth muscle: a case report and review of the literature. J Pediatr Surg 2010; 44 : 2211–2215.
89. Kella N, Rathi PK. Segmental defect of intestinal musculature: A rare cause of intestinal obstruction in children. J Coll Physicians Surg Pak 2006; 16 (8): 551–552.
90. Huang SF, Vacanti J, Kozakewich H. Segmental defect of the intestinal musculature of a newborn: Evidence of acquired pathogenesis. J Pediatr Surg 1996; 31 (5): 721–725.
91. Vítková I. Perforace střeva při kongenitálním defektu svaloviny ilea u novorozence. Čes-slov Pediat 1985; 40 : 737–739.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 3-
All articles in this issue
- Primary imunodeficiency in the practice of pediatric pneumology
- Mild mental retardation in ambulance of general practitioner for child and adolescent – can you recognize it?
- Late manifestation of caudal regression syndrome in the extremely low birth weight infant
- Preparticipation examination in young athletes with focus on resting electrocardiogram
- Cervical lymphadenopathy from the perspective of an otolaryngologist
- Overview of current treatment of juvenile-onset recurrent respiratory papillomatosis
- Single photon emission tomography in detection of the lingual thyroid ectopy. Its use in newborn with the congenital hypothyroidism – case report
- Benefit of ultrasound imaging in diagnostics of acute appendicitis
- Segmental dilatation of the intestine – case series of newborns with segmental dilatation of the small intestine and a literature review
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cervical lymphadenopathy from the perspective of an otolaryngologist
- Mild mental retardation in ambulance of general practitioner for child and adolescent – can you recognize it?
- Segmental dilatation of the intestine – case series of newborns with segmental dilatation of the small intestine and a literature review
- Preparticipation examination in young athletes with focus on resting electrocardiogram
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

