-
Medical journals
- Career
Tranzitorní pseudohypoaldosteronismus – nefro-urologické „puzzle“
Authors: Z. Doležel 1; P. Jabandžiev 1; Z. Ráčilová 2; J. Štarha 1; D. Dostálková 1; P. Zerhau 3
Authors‘ workplace: Pediatrická klinika LF MU a FN Brnopřednosta prof. MUDr. Z. Doležel, CSc. 1; Klinika dětské radiologie LF MU a FN Brnopřednosta doc. MUDr. J. Skotáková, CSc. 2; Klinika dětské chirurgie, ortopedie a traumatologie LF MU a FN Brnopřednosta prof. MUDr. L. Plánka, Ph. D. 3
Published in: Čes-slov Pediat 2014; 69 (1): 3-11.
Category: Original Papers
Overview
V dětském věku se většina změn sérové koncentrace elektrolytů týká dysbalance sodíku a draslíku. Hyponatremie provázená hyperkalemií je nejčastěji asociována s chorobami nadledvin, může však vzniknout také při poruchách homeostázy tělesné vody a minerálů v průběhu onemocnění ledvin nebo zažívacího ústrojí. Pseudohypoaldosteronismus je syndromem renálních solných ztrát, které jsou současně provázeny hyponatremíí, hyperkalemií, metabolickou acidózou a zvýšenou sérovou koncentrací aldosteronu a reninu. Jednou z variant tohoto stavu je tranzitorní pseudohypoaldosteronismus typ I. K jeho rozvoji dochází nejčastěji u novorozenců nebo kojenců, a to v souvislosti s infekcí močových cest a/nebo obstrukčními uropatiemi.
Uveden je soubor 14 dětí (6 dívek, 8 chlapců, průměrný věk 5,6 měsíců) s tranzitorním pseudohypoaldosteronismem typ I, kde u 12 z nich byla vyvolávající příčinou anomálie močových cest provázená infekcí, u 2 dětí akutní pyelonefritida bez abnormit dutého systému ledvin. U všech dětí došlo během léčby infekce močových cest k plné úpravě pozměněných laboratorních hodnot, u 4 pacientů byla s přihlédnutím k charakteru obstrukční uropatie vedle léčby močové infekce nezbytná také invazivní urologická operace. U každého novorozence nebo kojence s laboratorními doklady syndromu solných ztrát je důležité provést základní biochemické vyšetření moči a vyšetření ledvin ultrazvukem. Jsou to důležitá pomocná vyšetření přispívající zejména k diagnostice, ale také k racionálnímu léčebnému postupu tranzitorního pseudohypoaldosteronismu typ 1.Klíčová slova:
tranzitorní pseudohypoaldosteronismus, infekce močových cest, obstrukční uropatieÚvod
Změny sérové koncentrace iontů je nezbytné vždy velmi obezřetně hodnotit, neboť mohou být dokladem onemocnění, které může dítě bezprostředně ohrožovat i na životě. Přitom u části dětských pacientů lze s přihlédnutím k anamnestickým údajům a klinickému nálezu některé z dyselektrolytémií očekávat relativně častěji, naopak u jiných dětí bývá taková laboratorní změna nálezem překvapivým. Abnormální hodnota minerálů v séru by však měla být vždy objasněna. V klinické praxi bývají nejčastější změny sérové koncentrace sodíku a draslíku. U novorozenců/kojenců laboratorně prokázaná hyponatremie provázená hyperkalemií a příp. známkami dehydratace by měla budit podezření zejména na onemocnění nadledvin nebo na chorobu spojenou s redistribucí tělesné vody a iontů při onemocnění ledvin nebo zažívacího traktu. Identická iontová dysbalance může však být asociována také se strukturálními vadami dutého systému ledvin, a to bez ohledu, zda je nebo není uropatie provázena infekcí močových cest (IMC). Hyponatremie s hyperkalemií jsou v těchto případech jedním z kritérií pro stav označovaný tranzitorní pseudohypoaldosteronismus typ I. Uvádíme vlastní zkušenosti s touto nozologickou jednotkou.
Soubor pacientů a metody
Retrospektivně jsme zhodnotili skupinu 14 dětí (6 dívek, 8 chlapců, průměrný věk 5,6 měsíců) hospitalizovaných v období leden 2006 – říjen 2013 s prokázanou hyponatremií provázenou hyperkalemií a u nichž byla současně přítomna infekce močových cest a/nebo nález obstrukční uropatie. Definice hyponatremie, resp. hyperkalemie vycházela z rozmezí normálních hodnot laboratoře pro příslušný věk. V tabulkách 1 a 2 je uvedena charakteristika analyzovaného souboru a vybrané údaje.
Table 1. Iniciální laboratorní hodnoty. 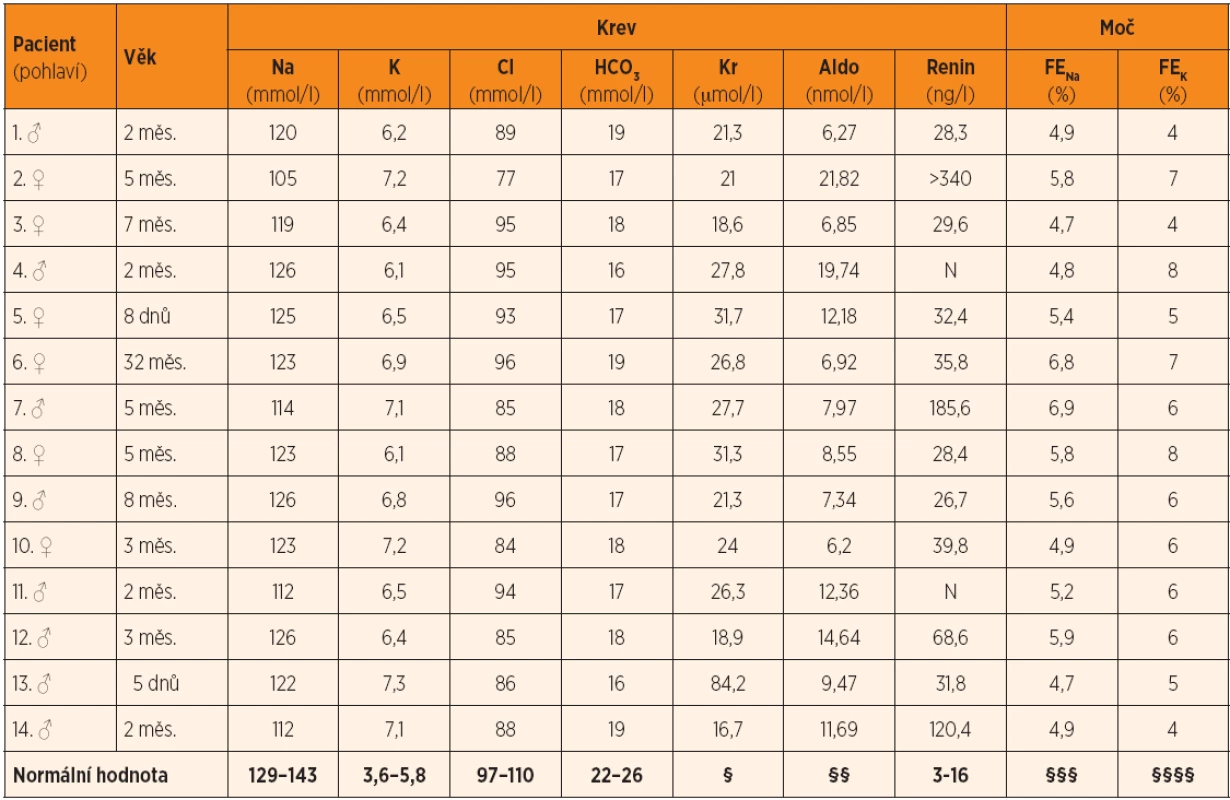
Na – sodík, K – draslík, Cl – chloridy, HCO3 – st. bikarbonát, Kr – kreatinin, Aldo – aldosteron, FENa – frakční exkrece sodíku, FEK – frakční exkrece draslíku, N – nestanoveno § – normální hodnota (μmol/l): novorozenec 27–77, 2.–12. měs. 14–34, 1.–3. r. 15–31 §§ – normální hodnota (nmol/l): novorozenec 0,832–5,27, 2. měs.–2. r. 0,055–3,051, 3.–16. r. 0,033–0,943 §§§ – FENa >2,5 dokládá zvýšení močového vylučování sodíku §§§§ – hodnota je závislá na příjmu stravou, většinou je v rozmezí 10–15 % Table 2. Vybrané charakteristiky souboru dětí. 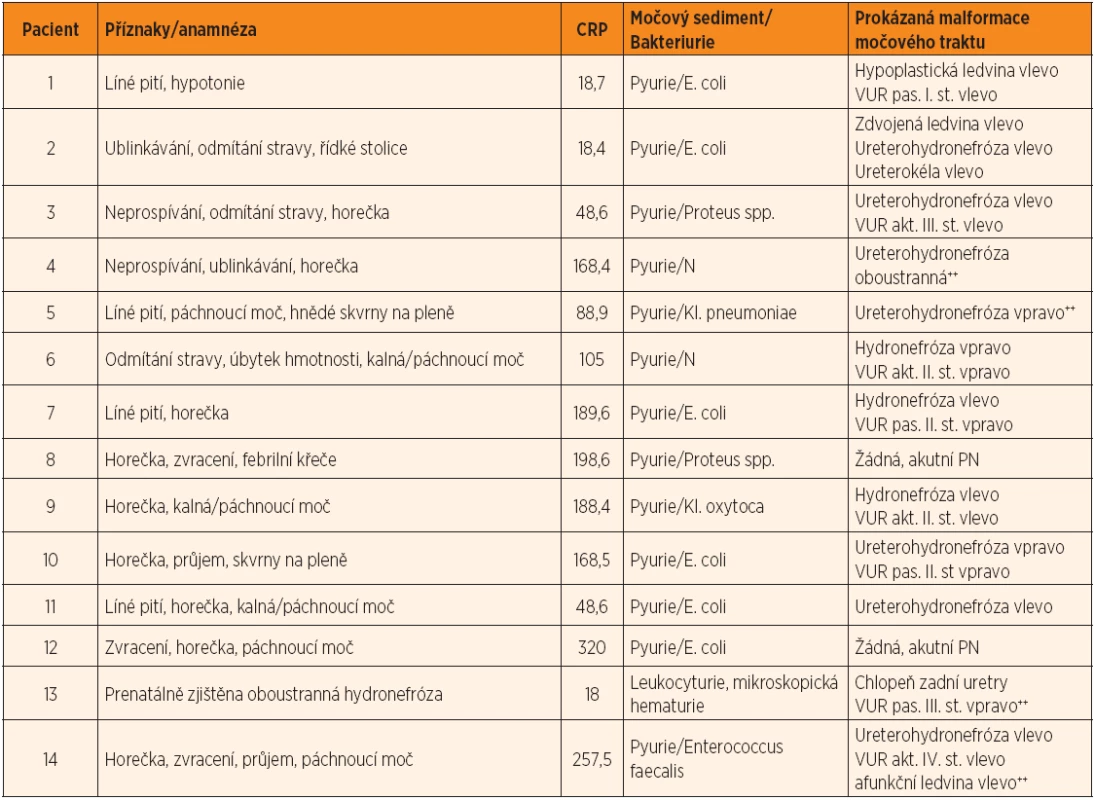
CRP – C-reaktivní protein (normální hodnota 0–5 mg/l), PN – pyelonefritida, VUR – vezikoureterální reflux, ++ – invazivní urologická intervence Všechny děti měly v den přijetí k hospitalizaci stanoveny sérové koncentrace iontů (Na, K, Cl, Ca, P, Mg), urey, kreatininu, CRP a hodnoty acidobazické rovnováhy; dále byla odebrána moč (chemické vyšetření a sediment). Vzhledem k tomu, že znalost výsledků uvedených laboratorních vyšetření byla rychlá, byl při průkazu hyponatremie s hyperkalemií odebrán s maximálním odstupem 2 hodin od odběru iniciálního další krevní vzorek na stanovení koncentrací aldosteronu (ALDO), reninu (RE) a kortizolu. U pacientů č. 5 a 13 jsme navíc odebrali krev ke stanovení hodnoty 17-OH progesteronu (17-OHP), neboť v době jejich přijetí k hospitalizaci nebyl přesvědčivě znám výsledek ze screeningu vrozených poruch metabolismu. Krevní odběry byly u dětí prováděny v poloze vleže. Sérové koncentrace iontů (SNa, K, Cl) byly stanovovány iont selektivní elektrodou, koncentrace Ca, P, Mg a urey fotometricky. Sérový kreatinin (SKr) byl stanoven Jaffého kinetickou reakcí, CRP imunoturbidimetrickou metodou. Ke stanovení ALDO, RE a 17-OHP byla využívána radioimunoanalýza, kortizol byl stanoven chemiluminiscenční imunoanalýzou. Při nálezu hyponatremie s hyperkalemií stanovila laboratoř ve zbytku iniciálního vzorku moči koncentrace sodíku (UNa), draslíku (UK) a kreatininu (UKr); frakční exkrece sodíku (FENa) a draslíku (FEK) byly kalkulovány podle vzorců: FENa = (UNa : SNa) x (SKr : UKr) x 100, FEK = (UK : SK) x (SKr : UKr) x 100.
K definici infekce močových cest jsme využívali jednak nálezů nepřímých (pozitivní průkaz nitritů při vyšetření moči testačním proužkem; pyurie {definována jako >10 leukocytů v zorném poli mikroskopu při zvětšení 350x při vyšetření cetrifugované moči}), jednak nálezu signifikantní bakteriurie (tj. ≥105 kolonií/ml moči). Moč na bakteriologické vyšetření byla u 11 dětí odebrána během spontánní mikce přímo na kultivační médium s respektováním doporučených zásad (tj. omytí genitálu, metoda středního proudu moči), u zbývajících 3 dětí byl vzorek moči získán s použitím adhesivního sáčku a pro vlastní transport k mikrobiologickému vyšetření bylo použito kultivační médium.
K zobrazení ledvin a jejich dutého systému byla využívána ultrasonografie (přístroj Sonoline Antares, fy Siemens; lineární sonda s frekvencí 10 MHz nebo konvexní sonda s frekvencí 2,5 MHz). Vzhledem k tomu, že úvodní vyšetření ultrazvukem (UZ) nebylo prováděno vždy stejným lékařem, byl získaný obrazový záznam u všech pacientů hodnocen jako tzv. druhé čtení jedním z autorů sdělení (Z.R.).
Získané hodnoty laboratorních vyšetření jsme zhodnotili pouze formou standardních statistických ukazatelů (tj. aritmetický průměr, medián, směrodatná odchylka, minimální a maximální hodnota).
Výsledky
U všech dětí (100 %) analyzovaného souboru byla v rámci iniciálního laboratorního vyšetření přítomna hyponatremie, hyperkalemie a zvýšená hodnota ALDO; plazmatická koncentrace RE byla zvýšená u 12 dětí (85 %), u dvou dětí nebyla úvodní hladina RE vyšetřena pro technické problémy. I přes toto částečné omezení tak všichni pacienti splňovali základní laboratorní charakteristiku pseudohypoaldosteronismu (PHA). Zvýšená hodnota FENa byla u všech dětí (100 %), hodnota FEK byla snížená. Vzhledem k tomu, že u 13 pacientů (93 %) nebyl současně zvýšen SKr, zvýšení FENa při současném snížení FEK jsme proto hodnotili jako údaje svědčící pro zvýšené močové ztráty sodíku a ne jako doklad akutního selhání ledvin. Zvýšení SKr bylo zaznamenáno pouze u pacienta č. 13 – u tohoto novorozence se domníváme, že vyšší SKr souvisela s adaptačními změnami v časném neonatálním období, neboť při kontrole ve 2. týdnu života mělo dítě SKr již v normálním rozmezí hodnot. U všech dětí (100 %) byla snížena hodnota sérové koncentrace bikarbonátů (HCO3) a bylo tak splněno další kritérium PHA. Přitom však hodnota pH krve u žádného z dětí nebyla nižší než 7,2 – u 12 dětí se hodnota pH pohybovala v rozmezí 7,25–7,30, u pacienta č. 4 bylo pH 7,22 a u pacienta č. 13 : 7,21. Sérová koncentrace 17-OHP u pacientů č. 5 a 13 byla normální, což vylučovalo vrozenou adrenální hyperplazii se solnou poruchou; u ostatních dětí souboru jsme ve vztahu k této endokrinopatii vycházeli z negativního záznamu výsledku novorozeneckého screeningu. Sérová koncentrace kortizolu byla u všech pacientů v normálním rozmezí hodnot.
U všech dětí (100 %) hodnoceného souboru byly doklady IMC; ve dvou případech (14 %) se jednalo o akutní pyelonefritidu při normálním UZ nálezu dutého systému ledvin, u 12 dětí (86 %) byla na UZ prokázána obstrukční uropatie, včetně doprovázející močové infekce. U čtyř pacientů (29 %) byla s přihlédnutím k charakteru obstrukce nutná invazivní urologická intervence. Abnormální nález při vyšetření moči (testační proužky, močový sediment) byl zaznamenán u všech pacientů. Kultivační vyšetření moči prokázalo u 6 dětí (43 %) nález E. coli, u 5 nemocných (36 %) byl izolován jiný patogen, ve 3 případech (21 %) nebylo vykultivováno žádné mikrobiální agens.
Na obrázcích 1 – 4 uvádíme některé z nálezů našich nemocných při UZ vyšetření ledvin.
Image 1. Ultrasonografie, pacient č. 2; silnější šipka ukazuje zvýšeně echogenní abnormální sediment v moči v močovém měchýři; slabší šipka ukazuje na podobný obsah v levém močovodu, který je rozšířen na 12,7 mm. Fig. 1. Ultrasound, patient No 2; note increased echogenicity of urine sediment in the bladder (thick arrow); similar urine sediment is in the lumen of dilated (diameter 12.7 mm) left ureter (thin arrow). 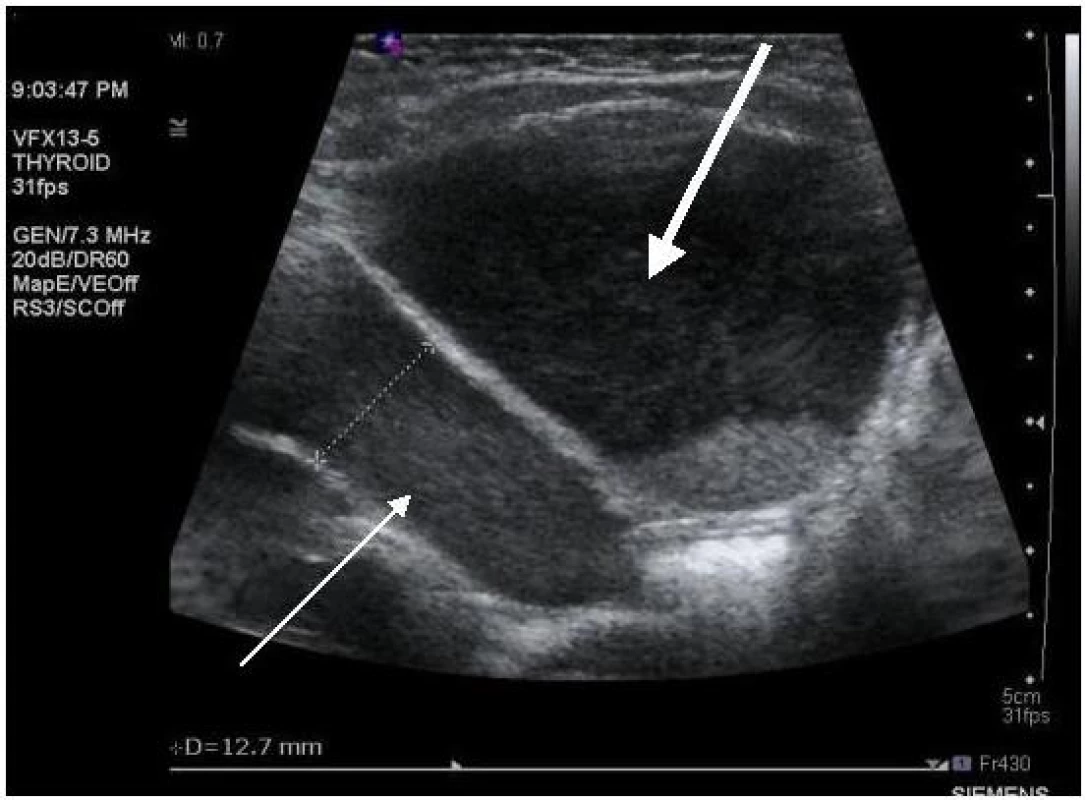
Image 2. Ultrasonografie, pacient č. 5; šipka ukazuje dilatovaný močovod s abnormální echogenitou jeho náplně. Fig. 2. Ultrasound, patient No 5; moderate dilation of the ureter with abnormal echogenicity in the lumen (arrow). 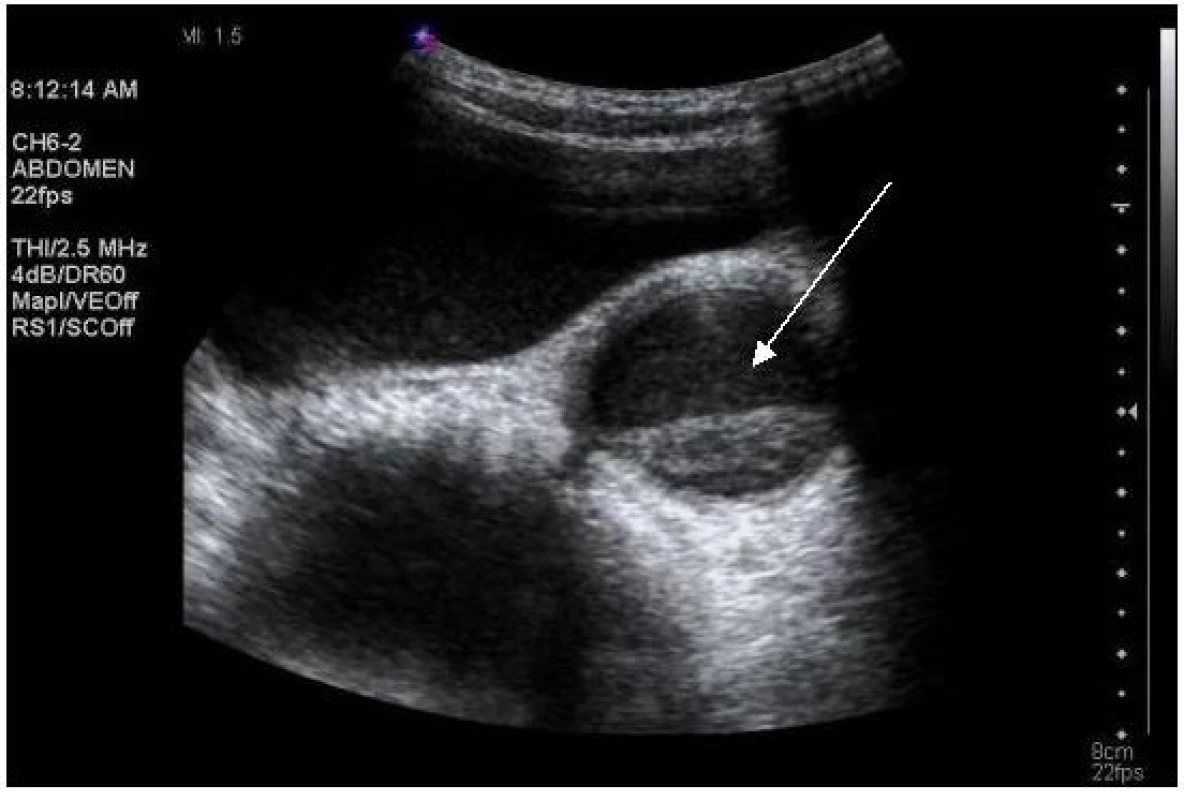
Image 3. Ultrasonografie, pacient č. 13; šipka ukazuje na zesílenou a trabekulizovanou stěnu močového měchýře, jeho obsah je čirý; juxtavezikálně zobrazený ureter má šířku 5 mm (tečkovaně). Fig. 3. Ultrasound, patient No 13; note thick and trabeculated bladder wall with content of clear urine (arrow); diameter of juxtavesical ureter is 5 mm (dotted line). 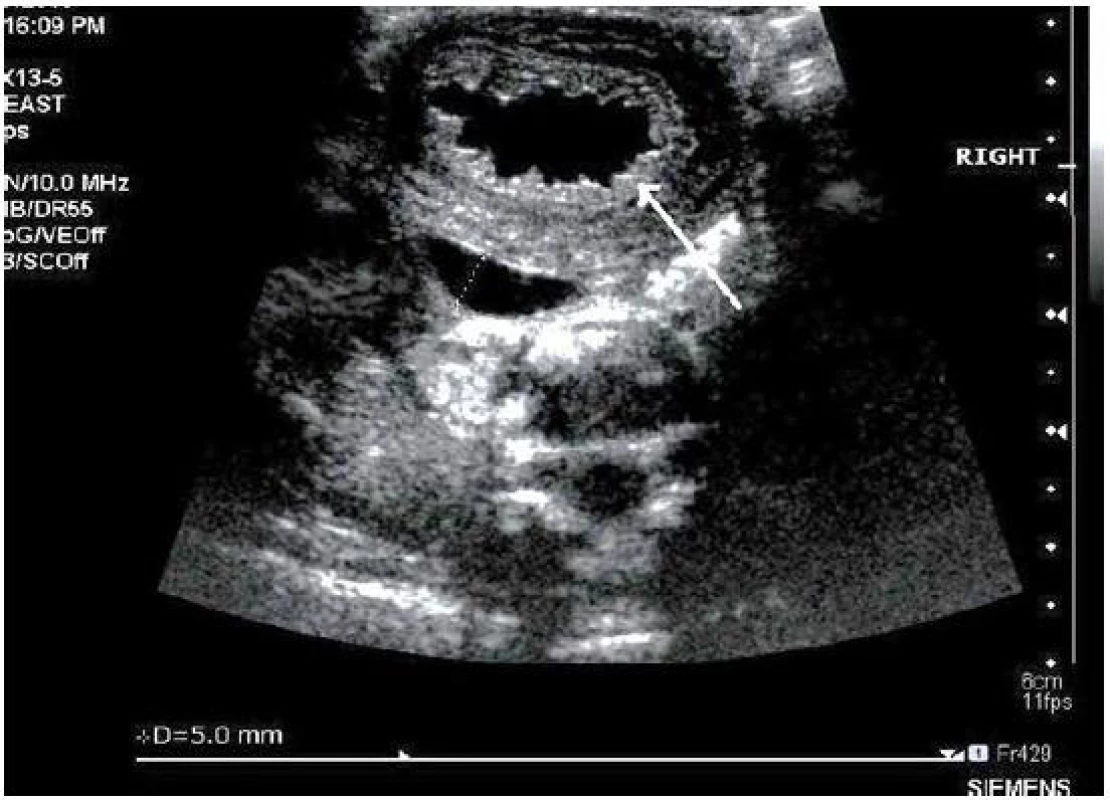
Image 4. Ultrasonografie, pacient č. 14; šipka ukazuje na výrazně dilatovaný levostranný močovod. Fig. 4. Ultrasound, patient No 14; gross dilation of the left ureter (arrow). 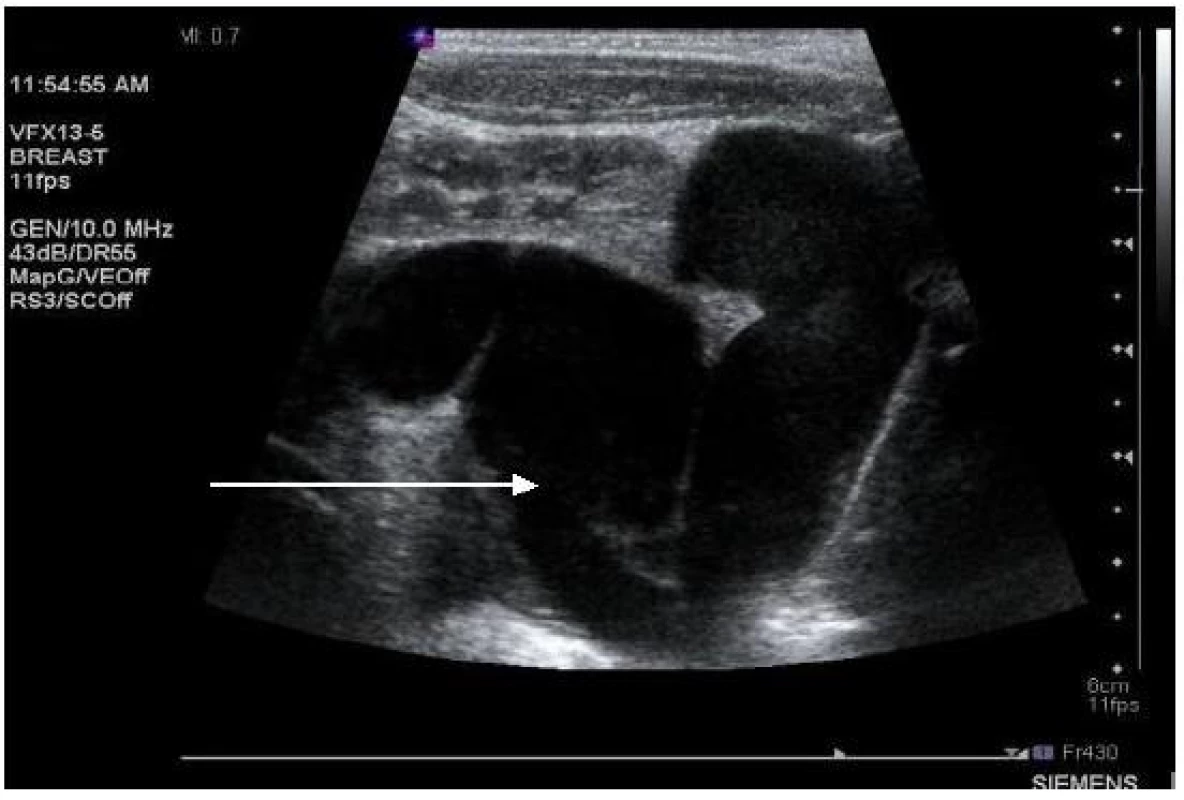
I přesto, že v tabulce 3 uvádíme základní statistické hodnoty vztahující se k výsledkům laboratorních vyšetření, domníváme se, že tyto hodnoty nemají přesvědčivý význam. A to proto, že každý pacient našeho souboru splňoval kritéria PHA a získané výsledky laboratorních analýz tak měly pouze deskriptivní význam.
Table 3. Statistické hodnoty. 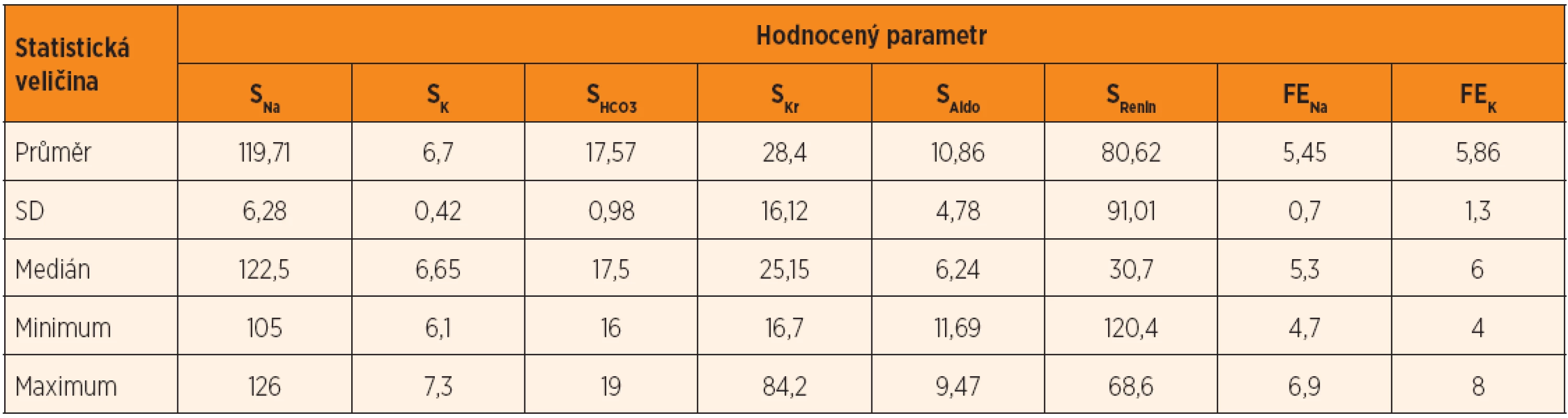
S – sérová koncentrace, Na – sodík, K – draslík, HCO3 – bikarbonát, Kr – kreatinin, Aldo – aldosteron, FENa – frakční exkrece sodíku, FEK – frakční exkrece draslíku Diskuse
Zejména u novorozenců v prvních týdnech života, méně často u mladších kojenců, je nejčastější příčinou hyponatremie s hyperkalemií vrozená adrenální hyperplazie (CAH). Vzhledem ke screeningu CAH by proto její závažná varianta provázená solnými ztrátami (tj. úplný deficit 21-hydroxylázy) měla být včas diagnostikována. Pokud tedy není příčinou uvedené dyselektrolytémie CAH se solnou poruchou, pak je nezbytné diferenciálně diagnosticky pomýšlet na některé vzácnější nozologické jednotky, které jsou podmíněny poruchou nadledvin. Jde zejména o vrozenou adrenální hypoplazii, izolovaný deficit aldosteronu nebo o pseudohypoaldosteronismus (PHA). PHA je poměrně heterogenní skupinou chorob, jejichž jednotícími laboratorními nálezy jsou: hyponatremie, hyperkalemie, metabolická acidóza, zvýšení ALDO a RE a vyšší solné ztráty močí. PHA je rozdělován na typ 1 (PHA1) a 2 (PHA2), stručná charakteristika ve vztahu k dědičnosti je uvedena v tabulce 4.
Table 4. Pseudohypoaldosteronismus – rozdělení. 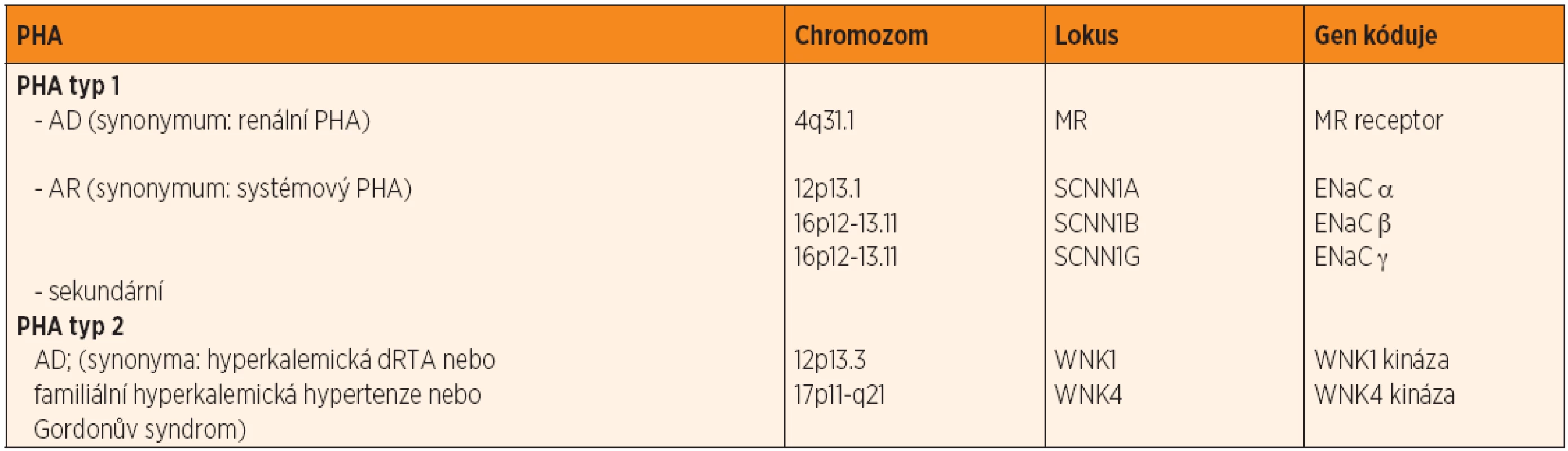
AD – autozomálně dominantní, AR – autozomálně recesivní, dRTA – distální renální tubulární acidóza, MR – mineralokortikoidní, ENaC – epiteliální sodíkový kanál (má podjednotky α, β, γ) Tranzitorní PHA1, promiskue označovaný také sekundární, je nejčastěji asociovaný s obstrukčními uropatiemi a/nebo s IMC, která postihuje horní partie močových cest (tj. akutní pyelonefritida). Publikovaná sdělení uvádějí, že většina dětí s tranzitorním PHA1 jsou novorozenci nebo kojenci, převažují jedinci mužského pohlaví [1, 2]. I přesto, že přesný patofyziologický mechanismus vzniku tranzitorního PHA1 není znám, předpokládá se, že k jeho rozvoji dochází na podkladě fyziologické nevyzrálosti buněk distálního tubulu ledvin, které jsou vůči aldosteronu rezistentní. Nevyzrálost se uplatňuje zejména v období prvních 3–4 měsíců života dítěte, poté za fyziologických okolností by měla již být přítomna normální tubulární senzitivita k aldosteronu. Vedle tohoto mechanismu však k necitlivosti na aldosteron s vysokou pravděpodobností přispívá také zvýšená tvorba cytokinů (např. interleukin 6, tumor necrosis factor-α, tromboxan A2, prostaglandiny), která byla prokázána jak u nemocných s obstrukčními uropatiemi, tak i u pacientů s bakteriální infekcí močových cest [3, 4]. Necitlivostí ledvinných tubulů k aldosteronu proto dochází ke zvýšení jeho sérové koncentrace. Při laboratorním průkazu hyponatremie s hyperkalemií je tedy klíčová pro další diagnostický postup právě znalost ALDO.
Ve většině biochemických laboratoří však stanovení ALDO není vyšetřením rychle – statim dosažitelným a výsledek bývá k dispozici až za více dnů. Přitom dysbalance sodíku a draslíku může být u sekundárního PHA1 ve vzácných případech i závažná, ojediněle je v této souvislosti uváděn rozvoj srdeční dysrytmie [5]. Proto než je známa aktuální hodnota ALDO, je racionální stanovit hodnoty UNa a UK, resp. vypočítat FENa a FEK; s výhodou lze k laboratorním analýzám těchto hodnot využít jednorázového vzorku moči. Typickým nálezem u nemocných s PHA je zvýšení UNa a FENa, hodnota FEK je snížená. V případě průkazu takových výsledků je tedy s respektováním údajů anamnestických, klinického nálezu a znalostí výsledků dalších vyšetření (CRP, krevní obraz s diferenciálním rozpočtem, moč chemicky a sediment) důležité nezapomenout provést UZ vyšetření ledvin, které může zobrazit obstrukční uropatii nebo zánětlivé změny parenchymu ledvin. Nekonstantně bývá uváděno, že podle možností je optimální v podmínkách klinické praxe posuzovat hodnoty UNa, UK, FENa a FEK alespoň ze dvou vzorků moči, neboť je známo, že u dětí ve stáří 0–12 měsíců se jednotlivé renální funkce postupně vyvíjejí a hodnocení pouze z jednoho vzorku moči může být zatíženo chybou. Toto dynamické posuzování/monitorování uvedených hodnot se však vztahuje spíše k diferenci mezi akutním selháním ledvin z příčin pre - nebo renálních [6, 7]. Dalším konstantním laboratorním nálezem u PHA je metabolická acidóza, resp. distální tubulární acidóza typ 4 provázená snížením sérové koncentrace HCO3, současné snížení pH krve přitom obvykle nebývá závažné (tj. <7,2). Tak tomu bylo i v našem souboru nemocných.
U starších dětí je rozvoj tranzitorního PHA1 asociovaného s uropatiemi nebo IMC vzácný; přesto je i v této věkové kategorii uváděno, že v průběhu akutní pyelonefritidy lze u některých nemocných prokázat laboratorní nálezy odpovídající PHA1. Sekundární PHA1 je popisován také u dětí s autoimunitními chorobami (systémový lupus erythematodes, idiopatická revmatoidní artritida), srpkovitou anemií, s akutní a chronickou rejekcí transplantované ledviny nebo v souvislosti s farmakoterapií (amilorid, triamteren, nesteroidní antiflogistika, cyklosporin A, takrolimus). Patogeneze rozvoje tranzitorní varianty PHA1 ve všech příkladech uvedených v předchozí větě je však velmi komplexní (uplatňuje se např. deficit mineralokortikoidů nebo rezistence vůči nim, dále také ovlivnění delikátních procesů renální tubulární resorpce a sekrece) a přesahuje rozsah tohoto sdělení [8, 9, 10].
V případě PHA1 vyvolaného obstukční uropatií je základem léčby zabezpečení dostatečného a volného odtoku moči – katetrizaci močového měchýře (cévkování, suprapubická epicystostomie) nebo punkční nefrostomii se tak u některých pacientů v počáteční fázi léčby nevyhneme. Podle charakteru uropatie a zhodnocení nálezu dětským urologem se následně zvolí vhodná operační korekce nebo léčba konzervativní. Ve skupině našich dětí byl nezbytný invazivní urologický výkon u 4 dětí.
Důsledná antimikrobiální léčba je metodou volby při léčbě PHA1 podmíněného IMC, optimální je cílené podávání antibiotika (ATB) podle bakteriologického nálezu v moči. Po odléčení akutní fáze IMC je možno pokračovat v zajišťovacím podávání vhodného ATB – rozhodnutí o dlouhodobější profylaxi IMC je individuální, vždy je nutno zvážit zejména rozsah a stupeň prokázané obstrukční uropatie. Dalším nezbytným opatřením v léčbě tranzitorního PHA1 je zabezpečení dostatečné hydratace nemocného (dítě mívá horečku, netoleruje perorální tekutiny, zvrací, může mít průjem) a příp. korekce hyponatremie a hyperkalemie. V iniciální fázi léčby je většinou nutný parenterální přívod tekutin – z infuzních roztoků je u nemocných, kde není SNa ≤ 125 mmol/l, postačující 0,9% roztok NaCl, neboť s úspěšnou léčbou IMC, resp. s odpovídající derivací moči, dochází u nemocných v krátkém čase (během několika dnů) k úpravě SNa i SK. Při výraznějším poklesu SNa je nutno do infuzí přidávat roztok NaCl; v některých případech bývá po přechodnou dobu po úpravě SNa nezbytná i perorální substituce NaCl. U pacientů s hyperkalemií ≥7,5 mmol/l je důležité dosáhnout jejího snížení vhodnou farmakoterapií. Ve většině případů sekundárního PHA1 nebývá nutné korigovat metabolickou acidózu, pokud není pokles pH <7,2 [11, 12, 13, 14, 15]. Podle vlastních zkušeností při léčbě dětí našeho souboru postačuje efekt léčebných opatření monitorovat podle opakovaného stanovování SNa, K, zvyšovat frekvenci vyšetření ALDO nebo RE je nadbytečné, alkalizaci roztokem NaHCO3 jsme nepoužili.
Recidiva sekundárního PHA1 je možná, nejčastěji opět v souvislosti s IMC. V naší skupině dětí jsme takový průběh pozorovali pouze u pacienta č. 10, u kterého došlo k další epizodě tranzitorního PHA1 za 4 měsíce po první, a to při akutní pyelonefritidě. Dítě původně nemělo zajišťovací chemoprofylaxi, k jejímu podávání jsme přistoupili až po druhé manifestaci sekundárního PHA1.
Závěr
Sdělením jsme chtěli upozornit na důsledné vyšetřování sérové koncentrace elektrolytů a racionální interpretaci jejich hodnot. Při průkazu hyponatremie s hyperkalemií je zejména u novorozenců/kojenců důležité nezapomenout na vyšetření moči (vyšetření chemické a močový sediment) a současně provést UZ vyšetření ledvin a jejich dutého systému. Jsou to základní a snadno dostupná vyšetření, která umožňují vyslovit podezření na sekundární PHA1. K přesvědčivému závěru, že se skutečně jedná o tuto variantu PHA, je možno využít další doplňující laboratorní vyšetření. Standardním postupem u dětí s obstrukční uropatií je zajištění koordinované péče dětským nefrologem a urologem.
Došlo: 29. 11. 2013
Přijato: 17. 1. 2014
Prof. MUDr. Zdeněk Doležel, CSc.
Pediatrická klinika LF MU a FN Brno
Černopolní 9
625 00 Brno
e-mail: zdoleze@fnbrno.cz
Sources
1. Dolezel Z, Starha J, Novotna D, et al. Secondary pseudohypoaldosteronism in an infant with pyelonephritis. Bratisl Lek Listy 2004; 105 (12): 435–437.
2. Torun-Bayran M, Soylu A, Kasap-Demir B, et al. Secondary pseudohypoladosteronism caused by urinary tract infection associated with urinary tract anomalies: case reports. Turk J Pediatr 2012; 54 : 67–70.
3. Kostakis ID, Cholidou KG, Perrea D. Syndromes of impaired ion handling in the distal nephron: pseudohypoaldosteronism and familial hyperkalemic hypertension. Hormones 2012; 11 (1): 31–53.
4. Bogdanovic R, Stajic N, Putnik J, et al. Transient type 1 pseudo-hypoaldosteronism: report on a eight-patient series and literature review. Pediatr Nephrol 2009; 24 : 2167–2175.
5. Thies K-C, Boos K, Müller-Deile K, et al. Ventricular flutter in a neonate – severe electrolyte imbalance caused by urinary tract infection in the presence of urinary tract malformation. J Emerg Med 2000; 18 (1): 47–50.
6. Fahimi D, Mohajeri S, Hajizadeh N, et al. Comparison between fractional excretions of urea and sodium in children with acute kidney injury. Pediatr Nephrol 2009; 24 (12): 2409–2412.
7. Gotfried J, Wiesen J, Raina R, et al. Finding the cause of acute kidney injury: which index of fractional excretion is better? Cleve Clin J Med 2012; 79 (2): 121–126.
8. Belot A, Ranchin B, Fichtner C, et al. Pseudohypoaldosteronism, report on a 10-patient series. Nephrol Dial Transplant 2008; 23 (5): 1636–1641.
9. Alper SL. Familial renal tubular acidosis. J Nephrol 2010; 23 (S16): 57–76.
10. Devuyst O, Konrad M, Jeunemaitre X, et al. Tubular disorders of electrolyte regulation. In: Avner ED, Harmon WE, Niaudet P, Yoshikawa N (eds). Pediatric Nephrology. 6th ed, vol 1. Heidelberg, Berlin: Springer-Verlag, 2009 : 929–977.
11. Grym J, Goldemund K. Základy rehydratační léčby v pediatrii. Olomouc: Solen, 2013 : 1–270..
12. Nandagopal R, Vaidyanathan P, Kaplowitz P. Transient pseudohypoaldosteronism due to urinary tract infection in infancy: a report of 4 cases. Int J Pediatr Endocrinol 2009; Article ID 195728, 4 s.
13. Štíchová L, Pajerek J. Neprospívání a recidivující hyponatremie u kojence. Pediatr Pro Prax 2013; 14(1): 42-44.
14. Sopfe J, Simmons JH. Failure to thrive, hyponatremia, and hyperkalemia in a neonate. Pediatr Ann 2013; 42 (5): 74–79.
15. Riepe FG. Pseudohypoaldosteronism. Endocr Dev 2013; 24 : 86–95.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2014 Issue 1-
All articles in this issue
- Tranzitorní pseudohypoaldosteronismus – nefro-urologické „puzzle“
- Adipsický diabetes insipidus u pacienta s dysgenézou corpus callosum
- Péče o předčasně narozené dítě: Kdy začíná a kdy končí?
- ICON – souhrn nejnovějších doporučení v managementu průduškového astmatu u dětí
- Kryptorchizmus – potreba včasnej diagnostiky a liečby
- Vědecké důkazy o prospěšnosti výživy mateřským mlékem
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kryptorchizmus – potreba včasnej diagnostiky a liečby
- Tranzitorní pseudohypoaldosteronismus – nefro-urologické „puzzle“
- Péče o předčasně narozené dítě: Kdy začíná a kdy končí?
- Adipsický diabetes insipidus u pacienta s dysgenézou corpus callosum
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

