-
Medical journals
- Career
Vývin črevného nervového systému a patogenéza Hirschsprungovej choroby
Authors: L. Zábojníková 1; V. Cingel 1; D. Murgaš 2; M. Fuňáková 1; T. Sláviková 3; I. Varga 3
Authors‘ workplace: Klinika detskej chirurgie DFNsP a LFUK, Bratislava prednosta doc. MUDr. J. Trnka, CSc. 1; Klinika detskej chirurgie, Univerzitná nemocnica Martin a JLF UK, Martin prednosta doc. MUDr. M. Dragula, CSc., mim. prof. 2; Ústav histológie a embryológie LFUK, Bratislava prednosta doc. MUDr. Š. Polák, CSc. 3
Published in: Čes-slov Pediat 2012; 67 (6): 402-409.
Category: Review
Overview
Hirschsprungova choroba je najčastejšia vrodená anomália motility čreva, spôsobená abnormálnym usporiadaním črevného nervového systému. Charakterizovaná je absenciou nervových ganglií (aganglionózou) prevážne v distálnej časti čreva na variabilne dlhom úseku. Črevo je schopné vykonávať peristaltické pohyby, a tak zabezpečiť pasáž črevného obsahu, len po úplnej kolonizácii progenitorovými bunkami nervového tkaniva počas embryonálneho vývinu. Črevný nervový systém zároveň monitoruje obsah lúmenu čreva, koordinuje proces delenia epitelových buniek, riadi transport vody a elektrolytov cez sliznicu a reguluje prietok krvi stenou čreva. Vývin črevného nervového systému je podmienený vycestovaním multipotentných buniek z neurálnej lišty do základu čreva. Bunky neurálnej lišty migrujú počas embryonálneho obdobia vývinu od základov zadného mozgu do celého čreva, následne proliferujú a diferencujú sa na širokú paletu nervových aj neurogliových buniek.
Cieľom práce je priniesť prehľad súčasných poznatkov o genéze tráviacej rúry so zameraním na vývin a funkciu črevného nervového systému vo vzťahu k Hirschsprungovej chorobe. Poukazujeme najmä na genetické príčiny, ktoré zohrávajú dôležitú úlohu v patogenéze tejto vrodenej anomálie.Kľúčové slová:
črevný nervový systém, Hirschsprungova choroba, bunky neurálnej lišty, primitívne črevo, črevná obštrukciaÚVOD
Tráviaca rúra je vysoko organizovaným, komplexným orgánom, ktorý zabezpečuje dôležité funkcie ako sú trávenie, vstrebávanie živín, endokrinné a imunitné funkcie. Pre správnu výslednú činnosť čreva je potrebná koordinovaná funkcia tzv. črevného nervového systému (ČNS, angl. enteric nervous system), ktorý sa nachádza v jeho stene. Bunky črevného nervového systému musia navyše spolupracovať s rôznymi ďalšími typmi buniek, akými sú Cajalove intersticiálne bunky, ktoré zabezpečujú pacemakerovú aktivitu („udavači kroku“ peristaltických pohybov) a hladké svalové bunky. Črevný nervový systém je časťou periférneho nervového systému. Monitoruje obsah lúmena čreva, zabezpečuje motilitu čreva, riadi transport vody a elektrolytov cez sliznicu a reguluje prietok krvi stenou čreva [1, 2]. Neuróny ČNS spolu s podpornou neurogliou sú organizované do ganglií, ktoré obsahujú rôzne podtypy neurónov (motorické neuróny, senzorické neuróny aj interneuróny).
Črevo pochádza zo všetkých troch zárodkových listov. Nervové tkanivo v stene čreva je pôvodom z neuroektodermy neurálnej lišty, kým epitelová výstelka čreva je pôvodom z endodermy, väzivo a svalovina embryonálne pochádzajú z mezodermy. Vývin črevného nervového systému je podmienený vycestovaním multipotentných buniek z neurálnej lišty do základu čreva. Bunky neurálnej lišty sú schopné migrovať z pôvodného miesta svojho vzniku (základ zadného mozgu) na relatívnu veľkú vzdialenosť (celá dĺžka čreva), proliferovať, kolonizovať a diferencovať sa v stene vyvíjajúceho čreva na bunky nervové a bunky neurogliové (obr. 1). Proces migrácie a diferenciácie buniek neurálnej lišty začína v priebehu 4. týždňa po oplodnení [3]. Výsledkom je vznik komplexnej súčasti periférneho nervového systému – črevného nervového systému.
Image 1. Schéma embrya počas 5. týždňa vývinu. Bunky neurálnej lišty po uzavretí neurálnej rúry (základ centrálneho nervového systému) migrujú do celého tela embrya. Vo vyvíjajúcom sa čreve dajú základ nervovým aj neurogliovým bunkám črevného nervového systému. Fig. 1. Schematic drawing of human embryo during 5th week of development. The neural crest cells after closure of the neural tube (future central nervous system) migrate to many specific locations in the body. In the wall of developing gut they differentiate into the neurons and supporting neuroglial cells of the future enteric nervous system. 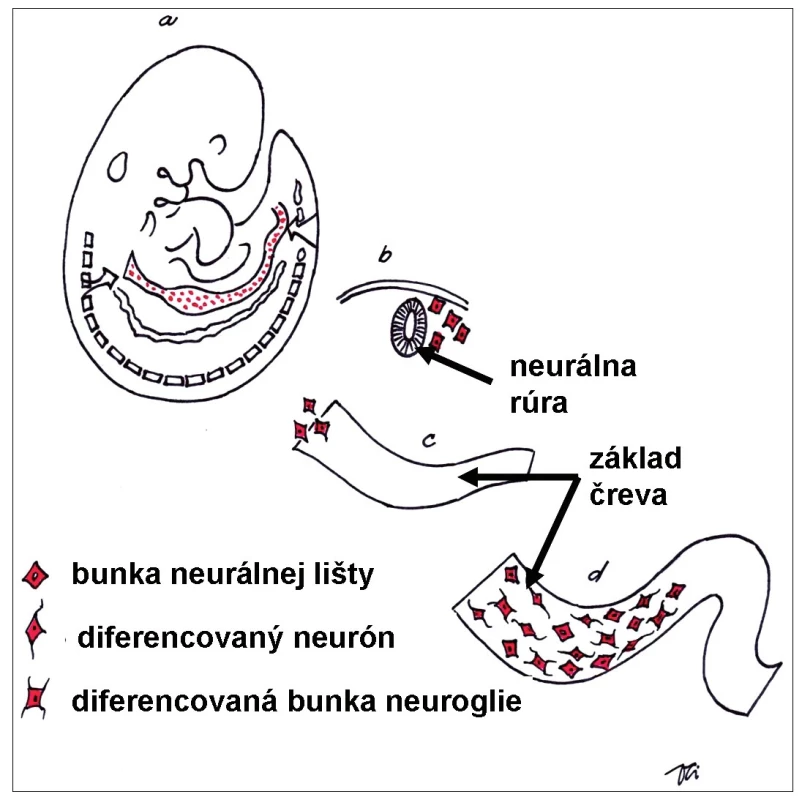
Ak počas embryonálneho vývinu dôjde k poruche migrácie a osídľovania čreva bunkami neurálnej lišty, prípadne sa naruší proces ich proliferácie a diferenciácie, vznikajú vrodené poruchy motility čreva (obr. 2). Hirschsprungova choroba (nazývaná aj tradičným, ale nesprávnym názvom megacolon congenitum) je najčastejšia vrodená anomália motility čreva. Charakterizovaná je absenciou nervových ganglií (aganglionózou) najčastejšie (až v 80 %) v distálnej časti čreva na variabilne dlhom úseku. Doteraz bolo identifikovaných viac ako 12 génov, ktorých mutácie môžu spôsobiť Hirschsprungovu chorobu (tab. 1). Súčasné výskumy však naznačujú spoluúčasť ďalších genetických aj environmentálnych faktorov [4]. Hirschsprungova choroba sa prejavuje väčšinou krátko po narodení príznak-mi distálnej obštrukcie čreva. Klinická manifestácia, chirurgické riešenie a prognóza je variabilná a závisí od dĺžky aganglionárneho úseku a kvality inervácie tráviacej rúry s prítomnými gangliovými bunkami. Pokiaľ sa nelieči adekvátne, mortalita môže dosahovať až 80 % [5].
Obr. 2a. Nervové gangliá v stene fyziologického čreva. Fig. 2a. Nervous ganglia in the wall of normal gut. 
Obr. 2b. Hypoganglionóza. Fig. 2b. Hypoganglionosis. 
Obr. 2c. Aganglionóza hrubého čreva. Fig. 2c. Aganglionosis of colon. 
Obr. 2d. Totálna aganglionóza čreva. Fig. 2d. Total aganglionosis of the gut. 
Table 1. Príklady génov zapojených do vývinu črevného nervového systému (podľa [1, 5, 13, 53]). ![Príklady génov zapojených do vývinu črevného nervového systému (podľa [1, 5, 13, 53]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6183876fc34105a84a0950570f25fee0.png)
Pravdepodobne najstarší opis Hirschsprungovej choroby pochádza od holandského profesora anatómie Fredericka Ruyscha z roku 1691. Prvý presnejší opis a samotný názov tejto nozologickej jednotky poskytol až dánsky pediater Harald Hirschsprung na konferencii Nemeckej spoločnosti pediatrov v Berlíne v roku 1886 (následne publikované v roku 1888) [6]. Exaktná patofyziológia Hirschsprungovej choroby bola objasnená v roku 1948, kedy Whitehouse a Kernohan [7] potvrdili, že chýbanie Auerbachovej nervovej spleti distálnej časti hrubého čreva alebo konečníka je príčinou funkčnej obštrukcie čreva. Nakoľko však súbor ich pacientov bol malý, až ďalšie roky výskumu potvrdili tieto závery. Prvé práce zaoberajúce sa novými možnosťami chirurgickej liečby založenými na experimentálnych základoch pochádzajú od Orvara Swensona z rokov 1948 a 1949 [6, 8, 9]. Snahou nášho príspevku je podať prehľad súčasných poznatkov o vývine tráviacej rúry so zameraním na vývin a funkciu črevného nervového systému vo vzťahu k Hirschsprungovej chorobe.
FUNKČNÁ MORFOLÓGIA ČREVNÉHO NERVOVÉHO SYSTÉMU
Autonómny nervový systém človeka možno rozdeliť na sympatikovú a parasympatikovú časť, niektorí autori samostatne vyčleňujú ČNS [1]. ČNS je systémom neurónov a podporných neurogliových buniek lokalizovaných v stene tráviacej rúry. Počet neurónov v stene čreva je porovnateľný s poč-tom neurónov miechy, aj preto je ČNS najväčšou súčasťou autonómneho nervového systému [10]. V rámci ČNS môžeme nájsť širokú paletu neuro-transmiterov, pričom väčšinu z nich možno dokázať aj v mozgu a mieche [1]. Podobne aj podporné neurogliové bunky lokalizované v stene čreva majú viac spoločných funkčných a morfologických vlastností s neurogliovými bunkami v centrálnom nervovom systéme, ako s neurogliovými bunkami sympatikových a parasympatikových ganglií [11]. ČNS má teda mnoho charakteristík, ktorými sa podobá centrálnemu nervovému systému.
Všeobecná stavba črevného nervového systému je rovnaká v pažeráku, žalúdku, tenkom aj hrubom čreve, a pozostáva z početných neurónov a ešte väčšieho počtu podporných neurogliových buniek, ktoré sú usporiadané do ganglií. Tie sú súčasťou dvoch veľkých nervových spletí lokalizovaných pozdĺž celej dĺžky tráviacej rúry: vnútorný Meissnerov plexus nervosus submucosus lokalizovaný v podsliznicovom väzive a vonkajší Auerbachov plexus nervosus myentericus lokalizovaný medzi cirkulárnou a longitudinálnou vrstvou vonkajšej svaloviny steny čreva [12, 13]. Vo všeobecnosti plexus submucosus zodpovedá za koordináciu činnosti sliznice, zatiaľ čo plexus myentericus reguluje svalovú aktivitu. Toto tvrdenie však neplatí univerzálne. Niektoré axóny neurónov podsliznicového väziva zasahujú až k vonkajšej svalovine a podobne neu-róny lokalizované vo svalovej vrstve majú axóny zasahujúce až do sliznice [14]. Morfológia a funkcia jednotlivých neurónov ČNS je rôznorodá, pričom väčšina z nich nie je priamo inervovaná z mozgu alebo miechy, pôsobia do značnej miery nezávisle. Furness [15] opisuje v stene čreva vyše 10 odlišných typov neurónov. Medzi ne patria motorické neuróny, interneuróny, senzorické neuróny aj neuróny ovplyvňujúce sekrečnú aktivitu žliazok a priesvit ciev. K podrobnému opisu jednotlivých podtypov neurónov pomáhajú metódy imunohistochémie. Tie ich identifikujú na základe markerov nervových buniek, neurotransmiterov a ďalších bio-logicky aktívnych látok (najčastejšie prítomnosť vazoaktívneho intestinálneho peptidu, cholín-acetyltransferázy, tyrozín-hydroxylázy, peptidu asocio-vaného s génom pre kalcitonín, somatostatínu, syntázy oxidu dusnatého a ďalších) [16].
Neuróny v stene čreva ovplyvňujú sekréciu elektrolytov cez výstelkový epitel [17], regulujú prietok krvi stenou čreva [2] a participujú pri ochrane pred patogénnymi mikroorganizmami. ČNS ovplyvňuje procesy spojené s proliferáciou buniek epitelu [18] ako aj vytváranie tesných spojení medzi epitelovými bunkami [19].
K správnemu fungovaniu motility čreva sú okrem ČNS a hladkej svaloviny potrebné aj Cajalove intersticiálne bunky, ktoré zabezpečujú tvorbu rytmických kontrakčných vĺn. Majú funkciu tzv. „pacemaker“-ov (udavačov kroku). Pomenované sú podľa španielskeho neurohistológa Ramon y Cajala (čítaj kachal), ktorý ich objavil v roku 1893. Sú mezodermového pôvodu, podobne ako hladká svalovina, s ktorou sú vo funkčnom prepojení. Nie sú teda neuroektodermového pôvodu ako bunky ČNS, aj keď sa to dlhú dobu predpokladalo [20]. Cajalove bunky lokalizované v okolí nervových ganglií v svalovej vrstve čreva zabezpečujú vznik pomalých peristaltických vĺn (majú inhibičnú, ako aj excitačnú funkciu), sú zapojené do procesov spojených s uvoľňovaním neurotransmiterov a šírenia elektrických impulzov [21].
Z pohľadu porúch motility tráviacej rúry sa predpokladá, že znížený počet alebo úplná neprítomnosť Cajalových intersticiálnych buniek sa môže spolupodieľať na vzniku hypertrofickej stenózy pyloru, intestinálnej neuronálnej dysplázie alebo achalázie vnútorného zvierača konečníka [22]. Pri Hirschsprungovej chorobe je prítomnosť, resp. neprítomnosť Cajalových intersticiálnych buniek v stene čreva otázna. Kým Betolli et al. [23] nezistili redukciu počtu Cajalových buniek u pacientov s Hirschsprungovou chorobou, Huizinga et al. [24] opisujú pri podobných stavoch chýbanie Cajalových buniek vo svalovej vrstve. V poslednej dobe výskumy naznačujú aj ďalší význam Cajalových buniek, nakoľko tie môžu byť základom pre gastrointestinálne stromálne tumory [25].
VÝVIN TRÁVIACEJ RÚRY
Embryonálnym podkladom tráviacej rúry je primitívne črevo, ktoré vzniká po včlenení dorzálnej časti žĺtkového vaku do tela embrya v priebehu 3. a 4. týždňa vývinu. Primitívne črevo siaha od faryngovej membrány (miesto budúcej hltanovej úžiny) po kloakovú membránu (hranicou je budúca linea pectinata análneho kanála) a je rozdelené na predné črevo, stredné črevo a zadné črevo. Zo zadného čreva vzniká distálna tretina colon transversum, colon descendens, colon sigmoideum, rectum a horná časť canalis analis, teda aj tie časti, ktoré sú najčastejšie postihnuté črevnou aganglionózou [26–28]. Primitívne črevo je počas vývinu zložené najprv len z dvoch vrstiev. Vnútorná epitelová výstelka je derivátom endodermy, vonkajšia vrstva (budúce väzivo a svalovina) je derivátom mezodermy. Postupne, ako sa z mezodermy diferencuje hladká svalovina a väzivo, stena primitívneho čreva hrubne. Epitelové bunky endodermového pôvodu sa počas 18. až 20. týždňa vývinu definitívne diferencujú na absorpčné enterocyty, hlien produkujúce pohárikové bunky, Panethove bunky produkujúce antimikrobiálne enzýmy (prítomné v tenkom čreve), enteroendokrinné bunky a nediferencované kmeňové bunky.
Všetky tieto bunkové populácie možno histologicky verifikovať v epitelovej výstelke čreva už ku koncu druhého trimestra, avšak mnohé z nich funkčne dozrievajú až ku koncu gravidity, prípadne až po začatí príjmu potravy po narodení [29–33].
NEURÁLNA LIŠTA A VÝVIN ČREVNÉHO NERVOVÉHO SYSTÉMU
Neurálna lišta (textus cristae neuralis, angl. neural crest) je dočasnou štruktúrou, ktorá sa u človeka vyskytuje len v embryonálnom vývine pri utváraní základu centrálneho nervového systému. Nachádza sa na rozhraní medzi neurálnou platničkou (základ mozgu a miechy) a zvyškom ektodermy (budúca pokožka). Pôvodne tesne vedľa seba usporiadané bunky neurálnej lišty s početnými medzi-bunkovými spojeniami sa uvoľňujú a získavajú schopnosť migrácie, ktorá je typická pre bunky mezodermového pôvodu. Je to unikátny embryologický proces (tzv. epitelovo-mezenchýmová transformácia), ktorý pripomína metastázovanie nádorov [34]. Bunky neurálnej lišty sú multipotentné, dokážu sa diferencovať na bunky s rôznou štruktúrou a funkciou. Po vycestovaní v ľudskom tele tvoria embryonálny základ periférneho a autonómneho nervového systému, väziva, chrupky, niektorých kostí a svalov hlavy a krku, pigmentových buniek, ale sú dôležité aj vo vývine oka a ucha, pri oddeľovaní veľkých ciev srdca, vo vývine drene nadobličky, zubov, týmusu, štítnej žľazy aj prištítnych teliesok [34–39]. Vývinové anomálie spôsobené narušením migrácie buniek neurálnej lišty, medzi ktoré patrí aj Hirschsprungova choroba, sa spoločne označujú ako neurocristopatie [40]. Z tohto prehľadu možno usúdiť, že neurálna lišta je embryonálnou štruktúrou, ktorá sa podieľa na normálnom vývine mnohých štruktúr ľudského tela. Dokonca sa objavujú odvážne úvahy o tom, že by neurálna lišta mala byť označovaná ako samostatný (v poradí štvrtý) zárodkový list [41].
Podrobnejšie štúdie poukázali, že budúce nervové bunky steny čreva pochádzajú z dvoch oblastí neurálnej lišty (obr. 3). Väčšina neurónov pochádza z kraniálnej časti, z oblasti základu rhombencefala. Tieto bunky migrujú pozdĺž celého primitívneho čreva až do distálnych častí základov hrubého čreva a konečníka. Niektoré neuróny distálneho čreva však pochádzajú aj z kaudálnej časti neurálnej lišty, z budúcej krížovej oblasti. Význam pôvodu neurónov ČNS z dvoch odlišných oblastí neurálnej lišty bude zrejme predmetom ďalších experimentálnych štúdií [42].
Image 2. Oblasti neurálnej lišty, z ktorých pochádzajú prekurzorové bunky črevného nervového systému (podrobnejší opis v texte). Fig. 3. Subdivisions of neural crest, from which the progenitor cells of the future enteric nervous system originate. 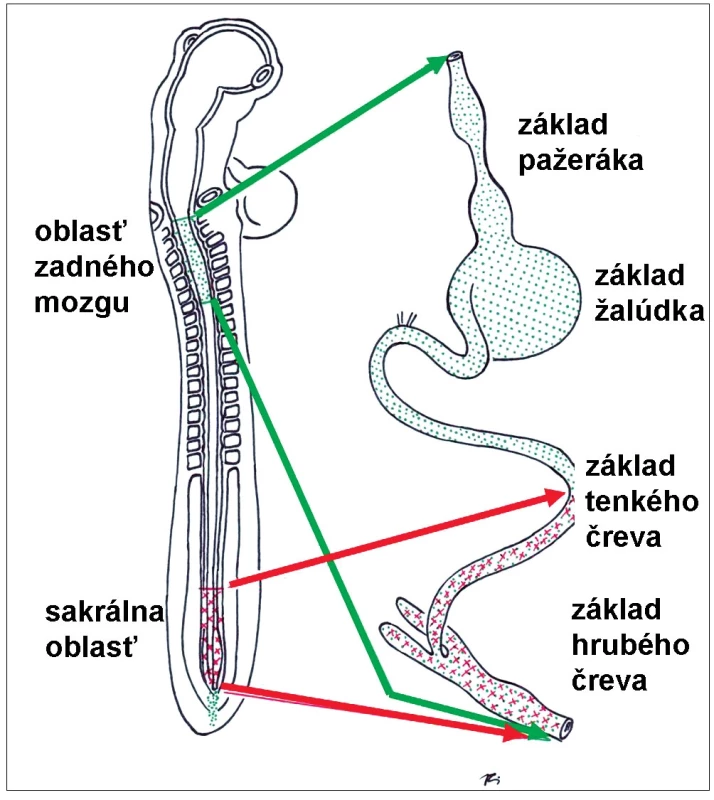
Bunky neurálnej lišty začínajú migrovať z oblasti budúceho rhombencefala približne 22. deň po oplodnení, pričom oblasť predného čreva do-siahnu už na 26. deň. Do oblasti zadného čreva prichádzajú približne na 38. deň a kolonizácia celého čreva je ukončená 43. deň vývinu embrya. Bunky neurálnej lišty zo sakrálnej oblasti začínajú migrovať na 27. deň a zadné črevo obsadia približne na 40. deň. Rýchlosť pohybu buniek neurálnej lišty sa odhaduje na 40 μm za hodinu. Budúce neuróny sa v stene vyvíjajúceho čreva intenzívne množia a v krátkom čase vytvárajú zhluky – základy budúcich ganglií [43].
ETIOPATOGENÉZA HIRSCHSPRUNGOVEJ CHOROBY
Črevo je schopné peristaltických pohybov len po úplnej kolonizácii progenitorovými bunkami nervového tkaniva. Hirschsprungova choroba vzniká dôsledkom poruchy buď prežívania, migrácie, množenia, alebo diferenciácie prekurzorových buniek črevného nervového systému pochádzajúcich z neurálnej lišty [44]. Aganglionóza postihuje najčastejšie rectum a colon sigmoideum, zriedkavejšie ostatné časti hrubého čreva prípadne ilea. Avšak môže postihovať aj celé črevo. Aganglionárny úsek nie je schopný tvorby a šírenia peristaltických vĺn a svalovina tohto úseku je kontrahovaná. Tento úsek čreva stráca svoju schopnosť relaxácie v dôsledku chýbania inhibičných neurónov, ktoré uvoľňujú oxid dusnatý (NO) a vazoaktívny intestinálny peptid (VIP), čím svalovina zostáva tonicky kontrahovaná. To vedie k funkčnej obštrukcii a nad postihnutým úsekom vzniká sekundárny megakolon, hypertrofia a dilatácia zdravého – ganglionárneho čreva [45]. Aj napriek abnormálnemu vzhľadu má táto dilatovaná časť normálne vyvinuté nervové gangliá. V kontrahovanej časti sa telá neurónov nenachádzajú, sú tu ale relatívne dobre vyvinuté nervové vlákna pochádzajúce z neurónov lokalizovaných mimo steny čreva [1]. Pri histologickej diagnostike aganglionózy čreva zohráva úlohu enzýmohistochémia. Pri nej sa v bioptickej vzorke dokazuje prítomnosť/neprítomnosť ganglií s telami neurónov a v inervačnej oblasti sakrálneho parasympatiku nachádzame po vykonaní acetylcholínesterázovej reakcii pozitívne hrubé, neusporiadané nervové vlákna. Pri nedostatočných skúsenostiach môže byť problémom odlíšenie úplného chýbania nervových ganglií pri Hirschsprungovej chorobe od hypoganglionózy pri niektorých iných poruchách motility čreva [46, 47].
Hirschsprungova choroba postihuje v priemere 1 z 5000 živonarodených detí, pričom pomer chlapcov k dievčatám je 3,9 : 1. Vo väčšine prípadov sa vyskytuje ako izolovaná forma (70 %). Môže byť však súčasťou viacerých syndrómov (Downov syndróm, Waardenburgov-Shahov syndróm, Goldbergov-Shprintzenov syndróm, MEN 2 a ďalšie) [13]. Toto ochorenie má významný genetický podklad, riziko vzniku Hirschsprungovej choroby medzi súrodencami je až 4 % v porovnaní s 0,02 % v celkovej populácii. Pravdepodobnosť vzniku sa zvyšuje úmerne s dĺžkou postihnutého úseku čreva [48]. V posledných rokoch výskumu sa dokázalo, že vrodená aganglionóza krátkeho aj dlhého segmentu môže byť spôsobená mutáciami niektorých génov, najčastejšie mutáciou proto-onkogénu pre tyrozín-kinázový receptor (RET) [49]. Produkt RET proto-onkogénu je transmembránovou receptorovou tyrozínkinázou, ktorá je za normálnych podmienok dôležitá najmä vo vývine autonómneho nervového systému, ale aj vo vývine obličiek a pri spermiogenéze. Mutácie RET proto-onkogénu zohrávajú úlohu nielen vo vývine črevného nervového systému, ale aj v patogenéze nádorových chorôb štítnej žľazy. Aj preto sa u pacientov s Hirschsprungovou chorobou zaviedol v Českej republike molekulovo-genetický skríning mutácií RET proto-onkogénu. Odhalenie zmien RET proto-onkogénu u týchto pacientov pomáha pri včasnom záchyte rizikových jedincov z pohľadu nádorov štítnej žľazy ešte v presymptomatickom štádiu [50–52].
V súčasnosti sú však známe aj mutácie iných génov, ktoré zodpovedajú za vznik Hirschsprungovej choroby (tab. 1). Produkty týchto génov sú zapojené do kaskády molekulových a bunkových dejov sprevádzajúcich vývin neurónov črevného nervového systému. Väčšina týchto génov kóduje transkripčné faktory (napr. SOX10 exprimovaný progenitorovými bunkami ČNS), signálne bielkoviny zapojené do procesov množenia a prežívania neurónov (napr. GDNF – neutrofický faktor odvodený od gliových buniek, NRTN – neurturín), prípadne rozličné enzýmy zapojené do signálnych dráh (napr. ECE1 – endotelín-konvertujúci enzým) [13, 53]. Tieto mutácie sa však dajú geneticky potvrdiť len približne v polovici prípadov aganglionóz čreva [54]. To naznačuje, že existujú doposiaľ nerozpoznané gény, ktorých mutácie spôsobujú Hirschsprungovu chorobu, dedičnosť polygénneho typu a sporadické prípady Hirschsprungovej choroby, ktoré nevznikajú na genetickom podklade.
Poznámka autorov:
Pojem „črevný nervový systém“, ktorý zahŕňa zhluky neurónov a podporných neurogliových buniek (gangliá) aj nervové vlákna v stene čreva, nie je v slovenskej písomnosti zaužívaný. V anglickej literatúre sa táto časť autonómneho nervového systému označuje ako „enteric nervous system“. V oficiálnej slovenskej anatomickej terminológii nachádzame len pojem „črevná spleť“ [55], v českej anatomickej terminológii pojem „střevní pleteň“ [56], ktoré sú prekladom latinského „plexus entericus“. Plexus entericus zahŕňa nervové spleti v podsliznicovom väzive (plexus submucosus), medzi cirkulárnou a longitudinálnou vrstvou svaloviny (plexus myentericus), aj nervovú spleť vo väzive serózy (plexus subserosus).
Došlo: 25. 4. 2012
Přijato: 3. 8. 2012
MUDr. Lenka Zábojníková
Klinika detskej chirurgie
DFNsP a LFUK
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: zabojnikova.lenka@gmail.com
Sources
1. Newgreen D, Young HM. Enteric nervous system: development and de-velopmental disturbances – part 1. Pediatr Dev Pathol 2002; 5 : 224–247.
2. Vanner S, Surprenant A. Neural reflexes controlling intestinal microcirculation. Am J Physiol 1996; 271: G223–G230.
3. Anderson RB, Newgreen DF, Young HM. Neural crest and the development of the enteric nervous system. Adv Exp Med Biol 2006; 589 : 181–196.
4. Barlow AJ, Dixon J, Dixon MJ, Trainor PA. Balancing neural crest cell intrinsic processes with those of the microenvironment in Tcof1 haploinsufficient mice enables complete enteric nervous system formation. Hum Mol Genet 2012; 21 : 1782–1793.
5. Kenny SE, Tam PK, Garcia-Barcelo M. Hirschsprung´s disease. Sem Pediatr Surg 2010; 19 : 194–200.
6. Skaba R. Historic milestones of Hirschsprung‘s disease (commemorating the 90th anniversary of Professor Harald Hirschsprung‘s death). J Pediatr Surg 2007; 42 : 249–251.
7. Whitehouse FR, Kernohan JW. The myenteric plexus in congenital megacolon; study of 11 cases. Arch Intern Med (Chic) 1948; 82 : 75–111.
8. Swenson O. Hirschsprung‘s disease – a complicated therapeutic problem: some thoughts and solutions based on data and personal experience over 56 years. J Pediatr Surg 2004; 39 : 1449–1453.
9. Swenson O. Early history of the therapy of Hirschsprung‘s disease: facts and personal observations over 50 years. J Pediatr Surg 1996; 31 : 1003–1008.
10. Gershon MD, Chalazonitis A, Rothman TP. From neural crest to bowel: development of the enteric nervous system. J Neurobiol 1993; 24 : 199–214.
11. Gershon MD, Rothman TP. Enteric glia. Glia 1991; 4 : 195–204.
12. Burns AJ, Pachnis V. Development of the enteric nervous system: bringing together cells, signals and genes. Neurogastroenterol Motil 2009; 21 : 100–102.
13. Heanue TA, Pachnis V. Enteric nervous system development and Hirschsprung‘s disease: advances in genetic and stem cell studies. Nat Rev Neurosci 2007; 8 : 466–479.
14. Schemann M, Neunlist M. The human enteric nervous system. Neurogastroenterol Motil 2004; 16 (Suppl 1): 55–59.
15. Furness JB. Types of neurons in the enteric nervous system. J Auton Nerv Syst 2000; 81 : 87–96.
16. Mongardi Fantaguzzi C, Thacker M, Chiocchetti R, Furness JB. Identification of neuron types in the submucosal ganglia of the mouse ileum. Cell Tissue Res 2009; 336 : 179–189.
17. Riegler M, Castagliuolo I, Wang C, et al. Neurotensin stimulates Cl(-) secretion in human colonic mucosa in vitro: role of adenosine. Gastroenterology 2000; 119 : 348–357.
18. Toumi F, Neunlist M, Cassagnau E, et al. Human submucosal neurones regulate intestinal epithelial cell proliferation: evidence from a novel co-culture model. Neurogastroenterol Motil 2003; 15 : 239–242.
19. Neunlist M, Toumi F, Oreschkova T, et al. Human ENS regulates the intestinal epithelial barrier permeability and a tight junction-associated protein ZO-1 via VIPergic pathways. Am J Physiol Gastrointest Liver Physiol 2003; 285: G1028–G1036.
20. Bettolli M, De Carli C, Jolin-Dahel K, et al. Colonic dysmotility in postsurgical patients with Hirschsprung‘s disease. Potential significance of abnormalities in the interstitial cells of Cajal and the enteric nervous system. J Pediatr Surg 2008; 43 : 1433–1438.
21. Fintl C, Pearson GT, Ricketts SW, et al. The development and distribution of the interstitial cells of Cajal in the intestine of the equine fetus and neonate. J Anat 2004; 205 : 35–44.
22. Rolle U, Piaseczna-Piotrowska A, Puri P. Interstitial cells of Cajal in the normal gut and in intestinal motility disorders of childhood. Pediatr Surg Int 2007; 23 : 1139–1152.
23. Bettolli M, De Carli C, Jolin-Dahel K, et al. Colonic dysmotility in postsurgical patients with Hirschsprung‘s disease. Potential significance of abnormalities in the interstitial cells of Cajal and the enteric nervous system. J Pediatr Surg 2008; 43 : 1433–1438.
24. Huizinga JD, Berezin I, Sircar K, et al. Development of interstitial cells of Cajal in a full-term infant without an enteric nervous system. Gastroenterology 2001; 120 : 561–567.
25. Kitamura Y. Gastrointestinal stromal tumors: past, present, and future. J Gastroenterol 2008; 43 : 499–508.
26. Dudek RW. High-yield Embryo-logy. 4th ed. Baltimore: Lippincott Williams & Wilkins 2010 : 1–158.
27. Carlson BM. Human Embryology and Developmental Biology. 4th ed. Philadelphia: Mosby Elsevier, 2009 : 1–544.
28. Sadler TW. Langman´s Medical Embryology. Baltimore: Lippincott Williams & Wilkins, 2010 : 1–385.
29. Roberts DJ. Molecular mechanisms of development of the gastrointestinal tract. Dev Dynam 2000; 219 : 109–120.
30. Zorn A, Wells JM. Vertebrate endoderm development and organ formation. Annu Rev Cell Dev Biol 2009; 25 : 221–251.
31. Wells J, Melton DA. Vertebrate endoderm development. Annu Rev Cell Dev Biol 1999; 15 : 393–410.
32. Pospisilova V, Terstianska G, Vranakova V. Contribution to early development of the small intestine in the human embryo. Folia Morphol 1977; 25 : 333–337.
33. Kylarová D, Vrchovecký J, Holinka M, Erdösová B. The occurrence of c-myc, p53 and Bcl-2 family proteins in the early phase of development of duodenal epithelium. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2004; 148 : 229–232.
34. Kang P, Svoboda KK. Epithelial-mesenchymal transformation during craniofacial development. J Dent Res 2005; 84 : 678–690.
35. Hutson MR, Kirby ML. Model systems for the study of heart development and disease. Cardiac neural crest cells and conotruncal malformations. Semin Cell Dev Biol 2007; 18 : 101–110.
36. Graham A. Development of the pharyngeal arches. Am J Med Gen 2003; 119 : 251–256.
37. Sakai D, Wakamatsu Y. Regulatory mechanisms for neural crest formation. Cells Tissues Organs 2005; 179 : 24–35.
38. Farlie PG, McKeown SJ, Newgreen DF. The neural crest: basic biology and clinical relationships in the craniofacial and enteric nervous systems. Birth Defects Res C Embryo Today 2004; 72 : 173–189.
39. Varga I, Pospíšilová V, Gmitterová K, et al. The phylogenesis and ontogenesis of the human pharyngeal region focused on the thymus, parathyroid, and thyroid glands. Neuroendocrinol Lett 2008; 29 : 837–845.
40. Bolande RP. Neurocristopathy: its growth and development in 20 years. Pediatr Pathol Lab Med 1997; 17 : 1–25.
41. Hall BK. The neural crest as a fourth germ layer and vertebrates as quadroblastic not triploblastic. Evol Dev 2000; 2 : 3–5.
42. Le Douarin NM, Teillet MA. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J Embryol Exp Morphol 1973; 30 : 31–48.
43. Newgreen D, Young HM. Enteric nervous system: development and developmental disturbances – part 2. Pediatr Dev Pathol 2002; 5 : 329–349.
44. Burns AJ, Thapar N. Advances in ontogeny of the enteric nervous system. Neurogastroenterol Motil 2006; 18 : 876–887.
45. Škába R, Rousková B, Šimsová M, Kalousová J, Pýcha K. Léčba Hirschsprungovy choroby na Klinice dětské chirurgie 2. LF UK a FN Motol v letech 1979–2004. Čas Lék čes 2004; 143 : 748–751.
46. Tomita R, Munakata K, Howard ER, Fujisaki S. Histological studies on Hirschsprung‘s disease and its allied disorders in childhood. Hepatogastroenterology 2004; 51 : 1042–1044.
47. Munakata K, Fukuzawa M, Nemoto N. Histologic criteria for the diagnosis of allied diseases of Hirschsprung‘s disease in adults. Eur J Pediatr Surg 2002; 12 : 186–191.
48. Badner JA, Sieber WK, Garver KL, Chakravarti A. A genetic study of Hirschsprung disease. Am J Hum Genet 1990; 46 : 568–580.
49. Seri M, Yin L, Barone V, et al. Frequency of RET mutations in long - and short-segment Hirschsprung disease. Hum Mutat 1997; 9 : 243–249.
50. Skába R, Dvoráková S, Václavíková E, et al. The risk of medullary thyroid carcinoma in patients with Hirschsprung‘s disease. Pediatr Surg Int 2006; 22 : 991–995.
51. Vaclavikova E, Kavalcova L, Skaba R, et al. Hirschsprung‘s disease and medullary thyroid carcinoma: 15-year experience with molecular genetic screening of the RET proto-oncogene. Pediatr Surg Int 2012; 28 : 123–128.
52. Bendlová B, Dvořáková Š, Václavíková E, et al. Nádory štítné žlázy a Hirschsprungova choroba: desetileté zkušenosti s molekulárně genetickou diagnostikou RET proto-onkogenu. Vnitř Lek 2006; 52 : 926–934.
53. Puri P, Shinkai T. Pathogenesis of Hirschsprung‘s disease and its variants: recent progress. Semin Pediatr Surg 2004; 13 : 18–24.
54. Parisi MA, Kapur RP. Genetics of Hirschsprung disease. Curr Opin Pediatr 2000; 12 : 610–617.
55. Holomáňová A, Brucknerová I. Anatomické názvy III. Latinsko-anglicko-slovenský slovník. Bratislava: Vydavateľstvo Elán, 2003 : 1–154.
56. Kachlík D, Čech P, Musil V, Báča V. České tělovědné názvosloví. Návrh české anatomické nomenklatury podle poslední revize mezinárodně platné latinské anatomické nomenklatury. Brno: Tribun EU s.r.o., 2010 : 1–170.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 6-
All articles in this issue
- Vyššie riziko terminálneho zlyhania obličiek u rómskych detí – dáta z pediatrického registra Slovenska
- Kvalita života a nemocnost dětí po operaci vrozené brániční kýly
- Kvalita života osob pečujících o dítě s dědičným metabolickým onemocněním
- Akutní diseminovaná encefalomyelitida
- Úskalí prenatální diagnostiky trizomie 20 a její mozaiky
- Diagnostika a terapie neurogenního měchýře u dětí
- Vývin črevného nervového systému a patogenéza Hirschsprungovej choroby
- Takzvaně problémový pacient
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kvalita života a nemocnost dětí po operaci vrozené brániční kýly
- Úskalí prenatální diagnostiky trizomie 20 a její mozaiky
- Akutní diseminovaná encefalomyelitida
- Diagnostika a terapie neurogenního měchýře u dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

