-
Medical journals
- Career
Variabilita klinické manifestace norovirové infekce u novorozence – od perakutní nekrotizující enterokolitidy po asymptomatický průběh
: J. Malý 1; J. Melek 1; P. Bréšková 1; K. Hanousková 1; V. Štěpánová 2; Lenka Ryšková 2; Z. Kokštein 1; J. Koudelka 3; R. Štichhauer 3; O. Pozler 1
: Dětská klinika LF UK a FN, Hradec Králové, přednosta prof. MUDr. M. Bayer, CSc. 1; Ústav klinické mikrobiologie LF UK a FN, Hradec Králové, přednosta doc. RNDr. V. Buchta, CSc. 2; Oddělení dětské chirurgie a traumatologie FN, Hradec Králové, primář MUDr. J. Koudelka, CSc. 3
: Čes-slov Pediat 2012; 67 (3): 178-186.
: Original Papers
Úvod:
Noroviry jsou nejčastějším původcem epidemií gastroenteritid celosvětově. Jde o vysoce nakažlivé neobalené RNA viry řazené do čeledi Caliciviridae šířící se fekálně-orální cestou a aerosolem. Klinická manifestace onemocnění u novorozenců je málo známá.Metoda:
Klinická observační studie na JIP pro novorozence perinatologického centra FN Hradec Králové. Diagnostika realizována antigenními testy na bázi imunochromatografie Immunocard Stat Norovirus (Meridian, Bioscience Europe, Milano, Itálie) a RIDAQUICK Norovirus test (R-Biopharm, AG, Darmstadt, Německo). Konfirmace výsledků byla provedena v Národní referenční laboratoři pro elektronovou mikroskopii virů Státního zdravotního ústavu v Praze. U všech vyšetřovaných pacientů byl současně proveden test na průkaz antigenu rotavirů a adenovirů ve stolici kazetovým imunochromatografickým testem Rota-Adeno-Card (Vidia, Certest, Španělsko). Kultivační vyšetření stolice bylo realizováno pomocí standardních mikrobiologických postupů. Nekrotizující enterokolitida (NEC) byla definována jako onemocnění ve stupni minimálně IIa podle Bellových kritérií modifikovaných Walshem a Kliegmanem.Výsledky:
Norovirový antigen byl prokázán ve vzorku stolice u 21 pacientů, u jednoho dalšího pacienta byla pozitivní elektronová mikroskopie při negativním antigenním testu. Konfirmace imunochromatografických testů elektronmikroskopicky byla realizována v 17 případech, shoda byla 75%. Medián věku při rozvoji klinických příznaků nebo první pozitivitě testu byl 17,5 dne s rozptylem 5–38 dní, medián gestačních týdnů (GT) a porodní hmotnosti byl 29 GT (24–38), resp. 1073 g (530–3260). Klinicky zcela asymptomatických bylo 6 pacientů. Nejčastějším symptomem onemocnění byla enteroragie u 9 (56 %) pacientů. Poklesy saturace a apnoe byly rovněž velmi časté – 8 (50 %), resp. 5 (31 %) pacientů; u 6 (38 %) pacientů vedly k nutnosti umělé plicní ventilace (UPV). Klinické a radiologické známky nekrotizující enterokolitidy byly shledány u 7 (44 %) pacientů.Závěr:
Symptomy norovirových infekcí u novorozenců jsou odlišné od symptomů dospělých a starších dětí. Mezi nejčastější patří distenze břicha, enteroragie, respirační nestabilita se zvýšením nároků na oxygenoterapii a apnoické pauzy, a to v různém časovém sledu. Nekrotizující enterokolitida vyžadující operační řešení není výjimečným vyústěním norovirové infekce. Diagnostika norovirové infekce je svízelná, autoři doporučují konfirmaci antigenních testů RT-PCR nebo elektronovou mikroskopií. Úplná kohortace pacientů i personálu a striktní dodržování hygienicko-protiepidemických opatření je podmínkou zvládnutí infekce na novorozeneckých JIP.Klíčová slova:
noroviry, novorozenec, nekrotizující enterokolitida, epidemie, JIPÚVOD
Noroviry jsou považovány za nejčastějšího původce epidemií gastroenteritid celosvětově, postihující děti i dospělé. Jde o vysoce nakažlivé neobalené RNA viry řazené do čeledi Caliciviridae šířící se fekálně-orální cestou a aerosolem. Typický klinický průběh u dětí i dospělých po krátké inkubační době zahrnuje explozivní zvracení a vodnatý průjem bez krve a hlenů [1]. Klinický průběh norovirových infekcí u novorozenců byl donedávna víceméně neznámý.
V květnu 2011 došlo na JIP pro novorozence Dětské kliniky FN Hradec Králové k rozvoji závažných abdominálních příznaků u několika dětí. V rámci diferenciální diagnostiky byla provedena i dostupná virologická vyšetření s pozitivním průkazem antigenu norovirů ve stolici. Cílem práce byla snaha o maximální možnou objektivizaci virové nákazy, dokumentaci průběhu infekcí a zjištění, jakými klinickými symptomy a s jakými následky se manifestuje norovirová infekce u novorozence v podmínkách JIP.
MATERIÁL A METODA
Klinické příznaky zahrnující distenzi břicha, zhoršení tolerance enterální výživy či enteroragii vedly v období od května 2011 do října 2011 mimo jiné k provedení vyšetření na průkaz antigenu norovirů ve stolici metodou imunochromatografie, testem Immunocard Stat Norovirus (Meridian, Bioscience Europe, Milano, Itálie). Na konci sledovaného období byla diagnostika norovirového antigenu rozšířena o další imunochromatografický test RIDAQUICK Norovirus test (R-Biopharm, AG, Darmstadt, Německo). Jedná se o rychle dostupné testy na bázi ELISA, s nejvyšší senzitivitou a specificitou v porovnání s dalšími rychlými antigenními testy (50–80% senzitivita a >85% specificita) [1, 2]. Vyšetření antigenu norovirů v tracheálním aspirátu (DCD) u pacientů s nejvýraznějšími dechovými obtížemi bylo provedeno nestandardní metodikou (testy jsou výrobci určeny pro vyšetření stolice). V rámci pátrání po možných zdrojích infekce byla při zjištění pozitivity antigenu u více než dvou pacientů na oddělení doplněna vyšetření antigenů i u asymptomatických pacientů.
U všech vyšetřovaných pacientů byl současně proveden test na průkaz antigenu rotavirů a adenovirů ve stolici kazetovým imunochromatografickým testem Rota-Adeno-Card (Vidia, Certest, Španělsko).
Konfirmace imunochromatografického testu na průkaz antigenu norovirů byla provedena v Národní referenční laboratoři pro elektronovou mikroskopii virů Státního zdravotního ústavu (SZÚ) v Praze. K vyšetření do SZÚ byly odeslány vzorky v sériích (květen, srpen, září, říjen), kromě jednoho případu se jednalo vždy o vzorky pozitivně testované na přítomnost antigenu norovirů. Rozlišení norovirů a sapovirů elektronmikroskopicky není možné, proto byl výsledek interpretován jako pozitivní při průkazů virů čeledi Caliciviridae (zahrnující rody Norovirus a Sapovirus).
Kultivační vyšetření stolice bylo realizováno pomocí standardních mikrobiologických postupů se zvláštním zaměřením na tyto patogeny: Salmonella sp., Shigella sp., Yersinia enterocolitica, enteropatogenní E. coli, Campylobacter sp., Clostridium difficile a Clostridium perfringens.
Od všech pacientů s pozitivním průkazem norovirů byla zaznamenána základní data, případné klinické obtíže, byla provedena standardní laboratorní vyšetření a u symptomatických pacientů byl zhotoven nativní rentgenový snímek břicha. Léčebný postup i případné komplikace byly rovněž sledovány a jsou předmětem dalšího sdělení.
Nekrotizující enterokolitida (NEC) byla definována jako onemocnění ve stupni minimálně IIa podle Bellových kritérií modifikovaných Walshem a Kliegmanem [3] s rentgenologickými známkami pneumatosis cystoides intestini (PCI), přítomnosti plynu ve větvích portální žíly (PVG) nebo obrazu fixované kličky, event. pneumoperitonea a patřičnými laboratorními odchylkami.
V průběhu října 2011 byl zastaven příjem nových pacientů na JIP po dobu 10 dní. Byla provedena maximální možná sanitace prostředí s kohortací pozitivně testovaných pacientů a pacientů „v kontaktu“ s následným obnovením příjmu na „čistou“ JIP.
VÝSLEDKY
Norovirový antigen byl prokázán ve vzorku stolice u jedenadvaceti pacientů hospitalizovaných na JIP pro novorozence Dětské kliniky FN Hradec Králové v období mezi květnem až říjnem 2011 (graf 1). U jednoho dalšího pacienta byla probíhající infekce diagnostikována elektronmikroskopicky při negativním výsledku antigenního testu. U šesti pozitivně testovaných dětí nebyly zjištěny žádné klinické obtíže – vyšetření bylo provedeno v rámci pátrání po zdrojích či rezervoárech nákazy na oddělení (tab. 1).
1. Výskyt norovirových infekcí v 5.–10. měsíci roku 2011 na JIP. V průběhu října 2011 došlo k uzavření příjmu na JIP. 
1. Rozdělení souboru na základě klinické symptomatologie. 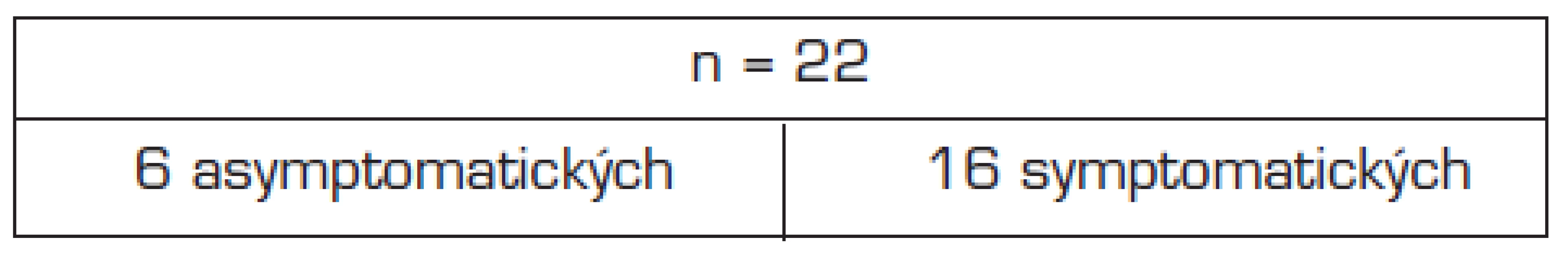
Shoda mezi průkazem antigenu a průkazem virů elektronmikroskopicky byla 75% – ze 17 odeslaných a vyšetřených materiálů jich 13 bylo označeno jako pozitivní nebo vysoce suspektní, přičemž 1 vzorek byl při testování antigenu označen jako negativní (tab. 2). Vyšetření přítomnosti antigenu rotavirů a adenovirů bylo ve všech případech negativní. Medián věku při rozvoji klinických příznaků nebo první pozitivitě testu byl 17,5 dne s rozptylem 5–38 dní, medián gestačních týdnů (GT) a porodní hmotnosti byl 29 GT (24–38), resp. 1073 g (530–3260).
2. Rozdělení souboru na základě provedené diagnostiky. 
Ag – imunochromatografické vyšetření antigenu +/- (pozitivní/negativní); eM – elektronová mikroskopie +/- (pozitivní/negativní) Klinicky zcela asymptomatických bylo 6 pacientů (tab. 3). Symptomatická infekce byla prokázána v 16 případech a klinická manifestace onemocnění byla poměrně rozmanitá (tab. 4). Nejčastějším příznakem byla enteroragie u 9 (56 %) pacientů, a to buď izolovaná nebo jako příznak provázející NEC. Poklesy saturace a apnoe byly rovněž velmi časté (50 %, resp. 31 %) a u 6 (38 %) pacientů vedly k nutnosti umělé plicní ventilace (UPV). U 3 (19 %) pacientů s vážnými respiračními problémy byl prokázán antigen norovirů v tracheálním aspirátu. Sepsis-like klinický obraz zahrnující poruchy prokrvení, apatii apod. byl zaznamenán u 5 (31 %) případů. Zvracení bylo symptomem méně častým a bylo zaznamenáno jen u 3 (19 %) pacientů. Klinické a radiologické známky nekrotizující enterokolitidy byly shledány u 7 (44 %) pacientů, u dalšího pacienta došlo k rozvoji nekrotizující enterokolitidy 2,5 týdne po prvním průkazu antigenu norovirů.
3. Asymptomatičtí pacienti – základní data. 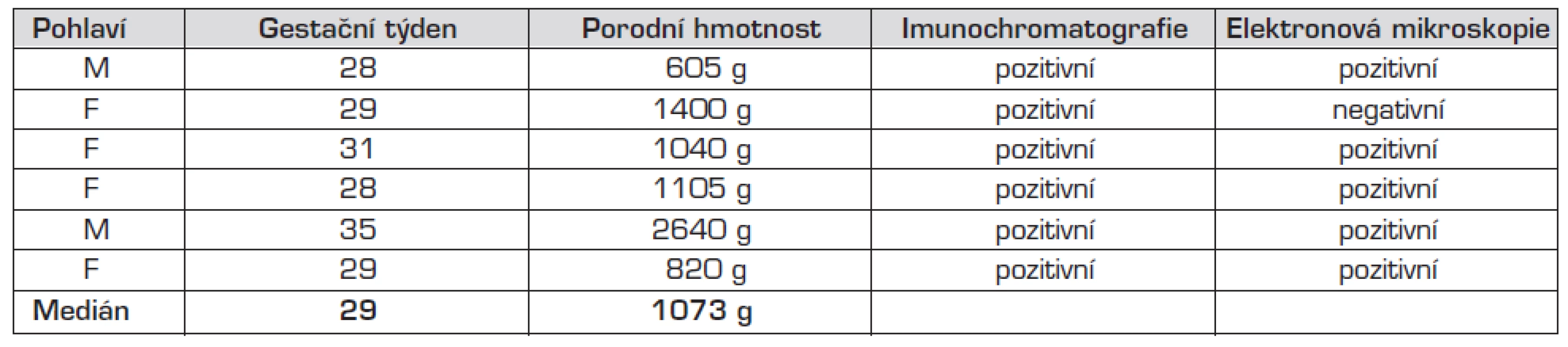
4. Zastoupení klinických příznaků u symptomatických pacientů s prokázanou norovirovou infekcí a porovnání s výsledky jiných prací [10, 12]. ![Zastoupení klinických příznaků u symptomatických pacientů s prokázanou norovirovou infekcí a porovnání s výsledky jiných prací [10, 12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/896cc8407ad99592d16938fff935864a.png)
Počet případů nekrotizující enterokolitidy vztažený k počtu příjmů na JIP je uveden v grafu 1.
Šest (75 % pacientů s NEC) z těchto pacientů bylo operováno pro progresi onemocnění přes maximální konzervativní péči (tab. 5). Dva pacienti po operaci zemřeli (mortalita NEC 25 %), v obou případech byl antigen norovirů prokázán i v tracheálním aspirátu. Kromě těchto pacientů byli z celého souboru operováni ještě další 2 pacienti – první (35. GT/1315 g) byl operován 10. den života s klinickým obrazem ileu a peroperačně prokázanými adhezemi jako pravděpodobného následku proběhlé prenatální střevní ischemie s možným podílem aktuálně probíhající norovirové střevní infekce; druhý pacient (původně 29. GT/1150 g) byl operovaný 69. den života pro mechanický ileus při pozánětlivé stenóze v oblasti ileocékálního přechodu. Šlo o dítě po proběhlé NEC IIa/IIb při prokázané norovirové infekci ve 3. týdnu života léčené konzervativně.
5. Pacienti operovaní pro NEC. 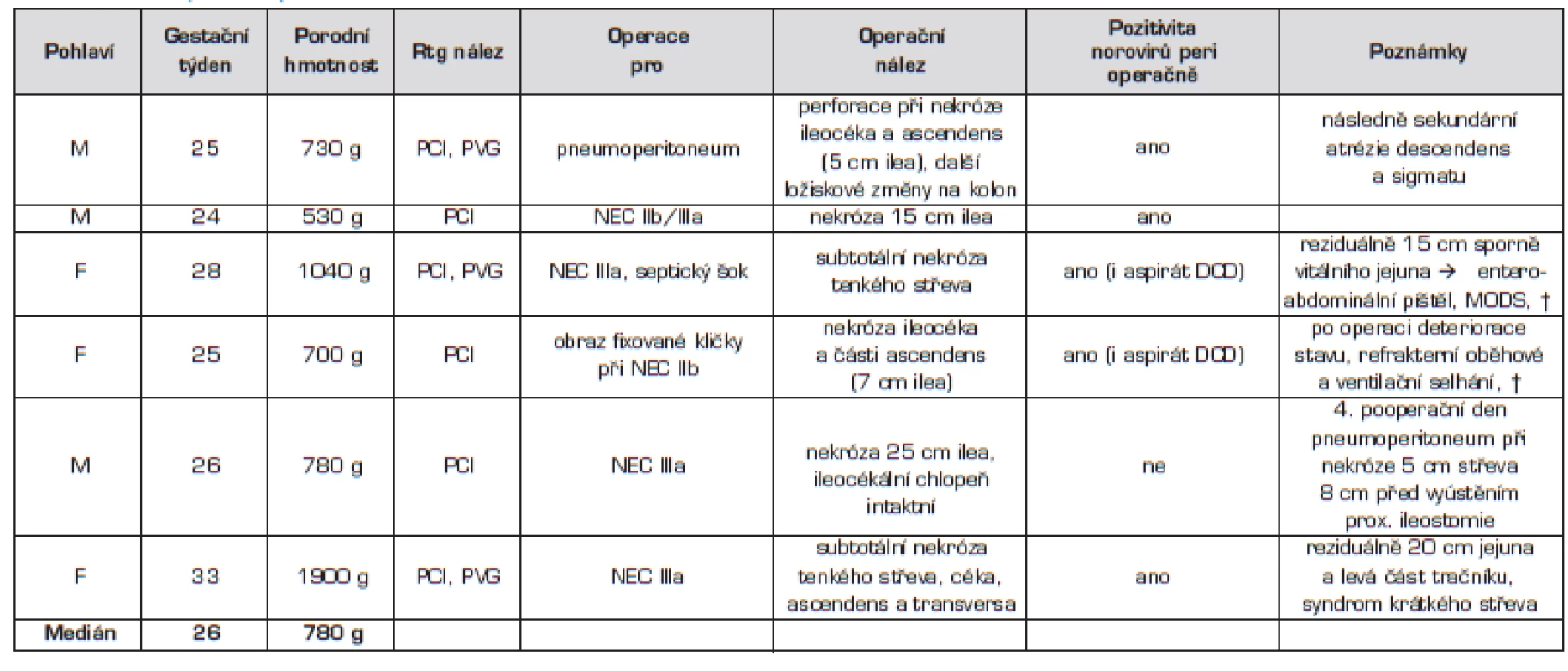
DISKUSE
A. – Noroviry
Gastroenteritidy patří mezi nejčastější onemocnění všech věkových skupin a podle WHO jsou každoročně příčinou úmrtí asi 1,8 milionu dětí mladších 5 let celosvětově [4]. Příčinou gastrointestinálních obtíží může být široké spektrum bakterií, parazitů a virů, přičemž posledně jmenované jsou nejméně často diagnostikované, byť zjevně nejčastější. Kultivační průkazy virů jsou nákladné a značně nespolehlivé a rutinní použití elektronové mikroskopie je nejen z epidemiologického hlediska velmi komplikované. Zavedením metod molekulární biologie, především reverzní transkriptázové polymerázové řetězové reakce (RT-PCR) do běžné klinické praxe a zpřístupněním testů na bázi průkazu virových antigenů metodami ELISA, se virová diagnostika stala dostupnější.
V roce 1968 na základní škole ve městě Norwalk v Ohiu propukla epidemie gastroenteritidy vyvolaná v té době neznámým agens, které o 4 roky později identifikoval pomocí imunoelektronové mikroskopie Kapikian [5]. V dalších letech bylo zjištěno, že tzv. Norwalk-like virus je „prototypem“, patřícím do velké rodiny neobalených RNA virů čeledi Caliciviridae a tento rod byl přejmenován na Norovirus. Elektronová mikroskopie byla dlouho považována za zlatý standard v diagnostice, nicméně především její senzitivita bývá deklarována jako nižší v porovnání s nejmodernější RT-PCR (36–58 % vs. 94–98 %) při obdobné specificitě (96–98 % vs. 92–100 %) [6]. Použitím reverzní transkriptázové PCR a genomického sekvenování bylo zjištěno, že noroviry jsou geneticky i antigenně různorodým rodem. V současnosti jsou děleny do 29 genetických typů spadajících do 5 genoskupin, přičemž pro humánní patologii je důležitá především skupina I (patogenní pro člověka) a skupina II (patogenní pro člověka a vepře). Konfirmace našich výsledků pomocí elektronové mikroskopie byla v dané době jediným možným přístupem, protože ani Národní referenční laboratoř pro virové nákazy ani žádná z univerzitních nemocnic v ČR neprováděla v dané době vyšetření polymerázovou řetězovou reakcí. I to bylo důvodem pro převzetí metodiky a zavedení RT - -PCR s možností typizace genoskupin I a II ve FN Hradec Králové (od prosince 2011). Sérologický průkaz proběhlé infekce je v současnosti pouze experimentální záležitostí.
Podle odhadů CDC (Center for Disease Control) jsou noroviry každoročně zodpovědné za 21 milionů případů gastroenteritid v USA [1]. Vrchol výskytu epidemií bývá v chladných měsících roku. Po krátké inkubační době (12–24 hodin) se objevují příznaky onemocnění, které bez léčby ustupují během 1 až 3 dnů, přestože závažnost jednotlivých příznaků může být značná. Typický klinický průběh u dospělých a starších dětí zahrnuje náhle vznikající nevolnost, zvracení, průjem bez příměsi krve a křeče v břiše. U některých pacientů se objevují chřipkové příznaky, bolesti svalů a asi u třetiny pacientů teploty, ustupující do 24 hodin. Úmrtí asociovaná s norovirovou infekcí byla popsána u epidemií v pečovatelských zařízeních [7].
U mladších dětí a kojenců je klinická manifestace onemocnění mírně odlišná. Nejčastějším klinickým symptomem je průjem; zvracení se objevuje méně často a obtíže mohou mít delší trvání (4–6 dní), podobně jako u velmi starých a hospitalizovaných pacientů. Ne zcela jednoznačně vysvětlenou jednotku představují tzv. benigní infantilní křeče asociované s virovou gastroenteritidou. U těchto pacientů (nejčastěji v průběhu druhého roku života) se po krátkém období afebrilní gastroenteritidy objevují obvykle generalizované tonicko-klonické nebo fokální sekundárně generalizované křeče poměrně refrakterní k běžným antikonvulzivům. Přes dramatický nástup má onemocnění obecně dobrou prognózu. Benigní infantilní křeče jsou asociovány s různými virovými agens vyvolávajícími gastroenteritidy, přičemž noroviry patří mezi nejčastěji diagnostikované (stolice, sérum). Problematiku benigních infantilních křečí asociovaných s virovou gastroenteritidou detailněji popisuje Melek se spoluautory v tomto čísle Čes.-slov. pediatrie [8].
Noroviry jsou po proběhlé infekci běžně detekovány ve stolici asi 4 týdny, přičemž k maximálnímu vylučování virů dochází 2–5 dní po proběhlé gastroenteritidě, kdy je pacient obvykle již zcela asymptomatický. Nálož 100 miliard kopií v 1 gramu stolice představuje při infekční dávce nižší než 10 virových partikulí pro zdravého dospělého gigantický potenciál k šíření nákazy. Velmi protrahované vylučování norovirů (>1 rok) provázené gastrointestinálními symptomy bylo popsáno u dětských onkologických pacientů [9].
B. – Noroviry v neonatologii
Norovirové infekce u novorozenců byly donedávna zcela neznámé. V roce 2008 publikovala Turcios-Ruiz RM et al. informaci o vzplanutí norovirové epidemie vedoucí k rozvoji nekrotizující enterokolitidy na novorozenecké jednotce intenzivní péče. V průběhu 14 dní onemocnělo 8 z 35 přijatých dětí (23 případů NEC/100 přijatých). Medián věku při výskytu NEC byl 21 dní (5–38), medián gestačního věku při narození byl 28 (24–33) týdnů a medián porodní hmotnosti 1073 g (763–2106). Oproti kontrolní skupině dětí (které byly ve stejné době přijaty a neonemocněly) se jednalo o děti signifikantně menší, lehčí a iniciálně nemocnější. Nejčastějším klinickým symptomem byla distenze a citlivost břicha provázená zvracením (75 %), polovina pacientů měla enteroragii a dokumentované apnoe. Dvě děti, u nichž došlo k rozvoji NEC, zemřely (mortalita 25 %). V 6 případech bylo možné vyšetření stolice elektronovou mikroskopií, které bylo ve všech případech pozitivní (viry čeledi Caliciviridae). Noroviry byly identifikovány pomocí RT-PCR ve 4 případech, další konfirmací byla southern-blot hybridizace s pozitivním výsledkem ve 3 případech. Zbývající 3 vzorky byly označeny jako nediagnostické a příliš malé [10].
Klinické symptomy zahrnující distenzi břicha a enteroragii byly rovněž nejčastěji popisovanými příznaky ve studii německých autorů (100 %, resp.50 %), u 7 (88 %) pacientů byl popisován průjem. Naproti tomu zvracení bylo symptomem méně častým (3 (38 %) pacienti) [11]. Zkušenost, kterou jsme potvrdili i v našem pozorování, zaznamenali Armbrust et al. – záchyt antigenu norovirů v tracheálním aspirátu u pacientů s nejvýraznějšími respiračními symptomy, a to opakovaně [12]. O výskytu norovirů v respiračním traktu můžeme pouze spekulovat – zda jde o přímé postižení epitelií dolních cest dýchacích nebo jde o kontaminaci při mikroaspiracích či zvracení. Nicméně i s ohledem na průkaz norovirů v séru a dokonce detekci norovirové RNA v likvoru u starších dětí [13] je možné, že virémie a celková infekce organismu není raritní situací. Spektrum klinických obtíží v našem souboru a porovnání se studiemi Armbrusta a Turcios-Ruiz s kolegy je dokumentována v tabulce 4.
Stuart se spolupracovníky popsala epidemii NEC u 15 dětí v průběhu 6 měsíců ve státě Victoria v Austrálii. V průběhu těchto měsíců byl zaznamenán vzestup incidence z 6 případů/1000 příjmů na JIP na 32 případů/1000 příjmů na JIP. Od 10 dětí bylo možné vyšetření vzorku stolice (zbývajících 5 dětí bylo přeloženo nebo zemřelo); ve 4 případech byla potvrzena RNA norovirů RT-PCR, konkrétně genotyp GII.3. Obdobně jako ve výše zmiňovaných studiích patřily mezi pacienty především těžce nezralé děti (medián gestačního věku a porodní hmotnosti činil 26 GT a 812 g). Chirurgické řešení nekrotizující enterokolitidy vyžadovalo 7 (47 %) pacientů, 3 (20 %) pacienti zemřeli. Překvapením bylo, že virová RNA byla diagnostikována i u 4 (9 %) dětí v kontrolní skupině (non-NEC), které neměly žádné abdominální příznaky. Dobře známý asymptomatický průběh norovirové infekce u některých dospělých (až 30 % případů) byl takto poprvé dokumentován u novorozenců [14]. Rovněž v našem souboru jsme zaznamenali skupinu 6 (27 %) asymptomatických pacientů (tab. 3); elektronová mikroskopie byla shodně s antigenním testem pozitivní u 4 (67 %) z nich. Zbývající jeden asymptomatický pacient byl diagnostikován elektronmikroskopicky při negativním antigenním testu, u posledního asymptomatického pacienta (antigenní test pozitivní) byla elektronová mikroskopie negativní.
Mortalita nekrotizující enterokolitidy v našem pozorování (25 %) je vyšší než dlouhodobé výsledky našeho pracoviště (16,2 % – nepublikovaná data), nicméně je plně srovnatelná s publikovanými soubory [10, 14]. Stejně tak naše data dokumentují nejzávažnější průběh u nejmenších pacientů (medián 780 g a 26. gestační týden).
Variabilita klinických projevů i jejich závažnost může být kromě celkového stavu pacienta před rozvojem infekce zásadním způsobem ovlivněna vnímavostí jednotlivce k norovirům a následnou imunitní odpovědí, (geno)typem vlastního kmene norovirů či případnou koinfekcí s dalšími střevními patogeny včetně virů. Mutace genu 1,2-fukosyltransferázy (FUT 2 gen) vede ke snížené expresi antigenů krevních skupin (AB0, Lewis, H) na povrchu enterocytů; tyto antigeny (HBGA – histo-blood group antigens) představují kandidátní receptory pro noroviry a mutací „postižení“ pacienti se stávají méně vnímaví k norovirům [15, 16]. Problematika vrozené rezistence k norovirům a imunitní odpovědi senzitivních pacientů již překračuje cíle naší práce.
Kromě širokého spektra klinických symptomů postupujících od minimální enteroragie přes „poklesy saturace četnější a hlubší než obvykle“ po perakutně probíhající nekrotizující enterokolitidu se musí neonatolog v případě norovirů vyrovnat se záludnostmi virové diagnostiky, která u novorozenců selhává ještě častěji, než je obvyklé. Köhler s kolegy popsali norovirový „pseudo-outbreak“ při použití ELISA antigenního testu (IDEIA Norovirus EIA, Oxoid, Wesel, Germany) na novorozenecké JIP se 100% negativitou výsledků při kontrolním testování RT-PCR a jasně dokumentovali potřebu konfirmačního testu, zvláště u asymptomatických pacientů [17]. Dalším problémem průkazu virové infekce u novorozence může být velikost a kvalita vzorku, která je z hlediska správné diagnostiky rozhodující, a to i při použití RT-PCR. Odběr vzorku stolice je jednoznačně vhodnější než anální výtěr, ideálně v akutní fázi onemocnění (tekutá nebo polotekutá stolice). Z epidemiologického a organizačního hlediska může být nebezpečné odkládat virologická vyšetření do obdržení negativních výsledků kultivačních bakteriálních či parazitárních onemocnění. V případě, že se jedná o vyšetření v pozdější fázi onemocnění, měla by být diagnostika vedena ve spolupráci s klinickým virologem či epidemiologem. Je velmi důležité si uvědomit, že i v případě negativního výsledku RT-PCR, ale v nápadných klinicko-epidemiologických souvislostech je nutné přistupovat k situaci velmi obezřetně. Ty již před 30 lety formuloval Kaplan se spolupracovníky. Patří mezi ně zvracení u více než poloviny postižených, inkubační doba 24–48 hodin, trvání onemocnění v průměru 12–60 hodin a absence bakteriálního patogenu při kultivaci stolice. Senzitivita při tomto přístupu dosahuje 99 % a specificita 68 % [18, 19]. V případě odložené diagnostiky mohou být vzorky stolice uchovávány až 3 týdny při teplotě 4 °C, v případě ještě delší prodlevy je pro zachování výtěžnosti diagnostických metod nutné zmražení (-20 °C nebo -70 °C). Průkaz RNA je při zachování těchto postupů možný přinejmenším 5 let od získání vzorku. Při plánovaném vyšetření elektronovou mikroskopií je naopak žádoucí předejít zmrznutí vzorku [1].
Jedním z největších problémů v případě norovirové infekce je šíření nákazy. Tabulka 6 dokumentuje důvody pro snadné šíření nákazy na novorozeneckých odděleních. Zastavení takovéto epidemie je podle našich i literárních zkušeností krajně obtížné [14, 20]. Prevence šíření infekce spočívá v identifikaci zdroje nákazy a cesty přenosu, dodržování striktních hygienických opatření při manipulaci s vodou, potravinami a biologickým materiálem a zabránění dalšího šíření nákazy interpersonálními kontakty či aerosolem. Pokud se nepodaří zdroj nákazy identifikovat, jsme postaveni před problém, který ještě dále akcentuje obtíže s diagnostikou a závažným klinickým průběhem. I v případě, že nemáme k dispozici přesný nástroj k diagnostice norovirů či výsledky vyšetření nejsou zcela přesvědčivé (pozitivita testů pouze u některých symptomatických pacientů), je podle Kaplana et al. nutné o norovirové epidemii uvažovat, a to včetně negativně testovaných symptomatických pacientů.
6. Důvody podporující šíření norovirů na novorozeneckých JIP. 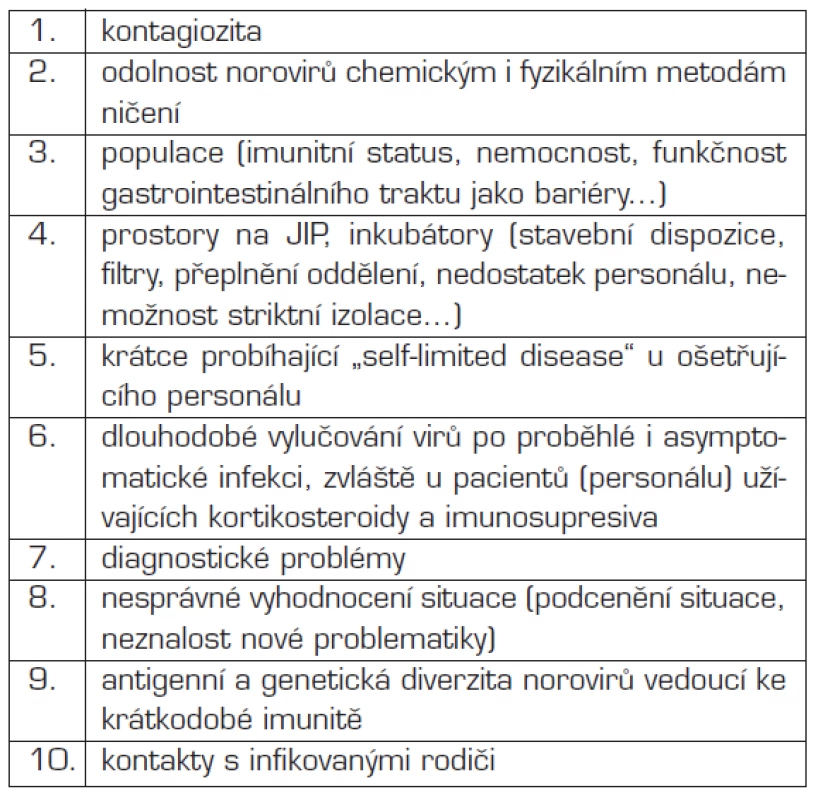
Základním předpokladem zabránění dalšího šíření nákazy je adekvátní hygiena rukou. Jako první je doporučováno mytí rukou běžným nebo antiseptickým mýdlem pod tekoucí vodou, což vede k významnému snížení množství virových partikulí. Dalším problémem je volba alkoholové dezinfekce. Žádná z dostupných alkoholových dezinfekcí nebyla testována na humánní noroviry. Po průkazu norovirové infekce na JIP navrhlo oddělení nemocniční hygieny změnu alkoholové dezinfekce na vysoce účinný přípravek proti obaleným i neobaleným virům – Sterillium Virugard, Bode Chemie, Hamburg, Německo) obsahující 95 g ethanolu ve 100 g roztoku. Tento přípravek je rovněž doporučován Institutem Roberta Kocha v Berlíně, nicméně v již citované práci nevedlo jeho použití k zastavení epidemie [12]. Inkubátory byly dezinfikovány přípravky Haxaquart plus 2% (Braun, Melsungen, Německo) a Dismozon pur 0,5% (Bode Chemie, Hamburg, Německo). Dalším z klíčových bodů v zastavení norovirové epidemie je chemická dezinfekce kontaminovaných ploch a podlah, a to použitím přípravků na chloridové bázi vždy čerstvě připravených v koncentracích až 5000 ppm [1]. Podlahy a hrubé povrchy byly v našem případě dezinfikovány přípravky Presept 2,5 g tbl. (Johnson & Johnson, Düsseldorf, Německo) v koncentraci 10 g/5 litrů vody a Incidin Rapid 0,5% (Ecolab, Düsseldorf, Německo).
Závěry studií sledujících efektivitu dezinfekčních přípravků rukou proti norovirům shrnuje aktuální doporučení CDC: 1. hygiena rukou mýdlem a tekoucí vodou v trvání minimálně 20 sekund vede nejefektivněji ke snížení kontaminace rukou noroviry a mytí rukou nemůže být nahrazeno žádným z dostupných dezinfekčních přípravků, 2. dezinfekční přípravky testované na kmenech norovirů patogenních pro myši a kočky jsou vhodné a efektivní jako doplněk hygieny mezi mytím rukou vodou a mýdlem [1].
Noroviry jsou dále odolné zmrazení a teplotám až do 60 °C. K šíření nákazy může tedy teoreticky přispívat i použití prostěradel a různých oblečků obvykle praných přímo na odděleních při teplotách zřídkakdy převyšujících 60 °C.
Nedílným krokem v zastavení šíření nákazy je kohortace pacientů, striktní rozdělení personálu při důsledném dodržování pravidel asepse a hygieny rukou, používání plášťů, ústenek a rukavic na jedno použití. Zastavení nákazy se v našem případě podařilo až po absolutní separaci infikovaných pacientů a pacientů v kontaktu uzavřením příjmu na JIP v trvání 10 dní. Vzhledem k nevyhovujícím stavebním podmínkám a nemožnosti adekvátní izolace s křížením provozů byli infikovaní pacienti přestěhováni na jiné patro Dětské kliniky (přesun a spojení jiných oddělení kliniky) s vyčleněním personálu a pobytem na tomto oddělení až do propuštění. Další významnou zkušeností byla velmi obtížná spolupráce s některými rodiči. Přestože byli opakovaně upozorňováni, že v případě jakýchkoliv symptomů onemocnění, především zvracení či průjmů, je jejich návštěva na JIP nežádoucí a bude odmítnuta, byli jsme svědky zapírání a disimulací, které nás v souhlase s oddělením nemocniční hygieny vedly k zákazu návštěv na oddělení s výjimkou zdravých kojících a odstříkávajících matek.
ZÁVĚRY
Symptomy norovirových infekcí u novorozenců jsou odlišné od symptomů dospělých a starších dětí. Mezi nejčastější příznaky patří distenze břicha, enteroragie, respirační nestabilita se zvýšením nároků na oxygenoterapii a apnoické pauzy, a to v různém časovém sledu. Nekrotizující enterokolitida vyžadující operační řešení se všemi důsledky není výjimečným vyústěním norovirové infekce. Diagnostika norovirové infekce je svízelná, autoři jednoznačně doporučují konfirmaci rychlých ELISA testů elektronovou mikroskopií nebo lépe RT-PCR nově dostupnou i v ČR (Ústav klinické biochemie a diagnostiky, FN Hradec Králové).
Zavedení těchto nových poznatků a diagnostických postupů do denní neonatologické praxe umožňuje časnou diagnostiku norovirů a zajištění adekvátních protiepidemických opatření, která mohou zabránit rozvoji onemocnění u dalších pacientů s dalekosáhlými medicínskými i společenskými důsledky. Ukončení šíření norovirové nákazy na novorozeneckých JIP je možné jen za cenu úplné kohortace pacientů i personálu a striktního dodržování všech výše diskutovaných bodů.
Poděkování
Poděkování patří RNDr. J. Schramlové, CSc., za elektronmikroskopickou diagnostiku a kolegům v ostatních perinatologických centrech za převzetí několika těhotných pacientek s hrozícím předčasným porodem do péče při uzavření JIP ve FN Hradec Králové.
Podpořeno programem PRVOUK P37/12.
Došlo: 24. 1. 2012
Přijato: 30. 3. 2012
MUDr. Jan Malý, Ph.D.
Dětská klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: malyj@lfhk.cuni.cz
Sources
1. Hall AJ, Vinjé J, Lopman B, et al. Updated norovirus outbreak management and disease prevention guidelines. MMWR Recomm Rep 2011; 60 (3): 1–9.
2. Kirby A, Gurgel RQ, Dove W, et al. An evaluation of the RIDASCREEN and IDEIA enzyme immunoassays and the RIDAQUICK immunochromatographic test for the detection of norovirus in faecal specimen. J Clin Virol 2010; 49 : 254–257.
3. Walsh MC, Kliegman RM. Necrotizing enterocolitis: treatment based on staging criteria. Pediatr Clin N Am 1986; 33 : 179–201.
4. Bryce J, Bosch-Pinto C, Sibuya K, Blafl RE. WHO estimates of the cause of death in children. Lancet 2005; 365 : 1147–1152.
5. Kapikian AZ, Wyatt RG, Dolin R, et al. Visualization by immune electron microscopy of the 27-nm particle associated with acute nonbacterial gastroenteritis. J Virol 1972; 10 (5): 1075–1081.
6. Castriciano S, Luinstra K, Petrich A, et al. Comparison of the RIDASCREEN norovirus enzyme immunoassay to IDEIA NLV GI/GII by testing stools also assayed by RT-PCR and electron microscopy. J Virol Methods 2007; 141 : 216–219.
7. Harris JP, Edmunds WJ, Pebody R, et al. Deaths from norovirus among elderly, England and Wales. Emerg Infect Dis 2008; 14 : 1546–1552.
8. Melek J, Malý J, Štefáčková Š, et al. Benigní infantilní křeče asociované s norovirovou gastroenteritidou. Čes-slov Pediat 2012; 67 (3): 186–190.
9. Simon A, Schildgen O, Eis-Hubinger M, et al. Norovirus outbreak in a paediatric oncology unit. Scand J Gastroenterol 2006; 41 (6): 693–699.
10. Turcios-Ruiz RM, Axelrod P, John KS, et al. Outbreak of necrotizing enterocolitis caused by norovirus in a neonatal intensive care unit. J Pediatr 2008; 153 : 339–344.
11. Bagci S, Eis-Hübinger AM, Yassin AF, et al. Clinical characteristics of viral intestinal infection in preterm and term neonates. Eur J Clin Microbiol Infect Dis 2010; 29 : 1079–1084.
12. Armbrust S, Kramer A, Olbertz D, et al. Norovirus infections in preterm infants: wide variety of clinical courses. BMC Research Notes 2009; 2 : 96–101.
13. Ito S, Takeshita S, Nezu A, et al. Norovirus-associated encephalopathy. Pediatr Infect Dis J 2006; 25 : 651–652.
14. Stuart RL, Tan K, Mahar JE, et al. An outbreak of necrotizing enterocolitis associated with norovirus genotype GII.3. Pediatr Infect Dis J 2010; 29 : 644–647.
15. Lindesmith L, Moe C, Marionneau S, et al. Human susceptibility and resistance to Norwalk virus infection. Nat Med 2003; 9 : 548–553.
16. Menon VK, George S, Ramani S, et al. Genogroup IIb norovirus infections and association with enteric symptoms in a neonatal nursery in Southern India. J Clin Microbiol 2010; 48 : 3212–3215.
17. Köhler H, Jüngert J, Korn K. Norovirus pseudo-outbreak in a neonatal intensive care unit. J Pediatr Gastroenterol Nutr 2008; 46 (4): 471–472.
18. Kaplan JE, Gary GW, Baron RC, et al. Epidemiology of Norwalk gastroenteritis and the role of Norwalk virus in outbreaks of acute nonbacterial gastroenteritis. Am J Publ Health 1982; 72 : 1329–1332.
19. Turcios RM, Widdowson MA, Sulka AC, et al. Reevaluation of epidemiological criteria for identifying outbreaks of acute gastroenteritis due to norovirus: United States, 1998–2000. Clin Infect Dis 2006; 42 : 964–969.
20. Sommer C, Mueller W, Resch B. Two nosocomial outbreaks in the neonatal intensive and intermediate care unit. Eur J Clin Microbiol Infect Dis 2009; 28 : 1133–1136.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 3-
All articles in this issue
- Incidence of dyslipidemia in a obese children population
- Pyruvate kinase deficiency in children
- Unusual manifestations of parvovirus B19 infection in children
- Determination of prealbumin and selenium in serum for monitoring the nutrition status of phenylketonuric and hyperphenylalaninemic patients
- Variability in clinical manifestation of noroviral infection in a newborn: from fulminant necrotizing enterocolitis to asymptomatic course
- Benign infantile seizures associated with noroviral gastroenteritis
- Reading about speech and language therapy – 1st Part
- Current use of beta adrenergic receptors blocking medication in paediatric heart failure
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Unusual manifestations of parvovirus B19 infection in children
- Pyruvate kinase deficiency in children
- Variability in clinical manifestation of noroviral infection in a newborn: from fulminant necrotizing enterocolitis to asymptomatic course
- Benign infantile seizures associated with noroviral gastroenteritis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

