-
Medical journals
- Career
Vyšetrovací postup u dieťaťa s proteinúriou
: Ľ. Podracká 1; L. Kovács 2
: I. Klinika detí a dorastu LF UPJŠ a DFN, Košice prednostka prof. MUDr. Ľ. Podracká, CSc. 1; 2. Detská klinika LFUK a DFNsP, Bratislava prednosta prof. MUDr. L. Kovács, DrSc., MPH 2
: Čes-slov Pediat 2008; 63 (6): 327-335.
: Postgraduate Education
Proteinúria je častý močový syndróm, s ktorým sa denne stretáva pediater v klinickej praxi. Proteinúria môže byť prechodná alebo trvalá, glomerulárna a/alebo tubulárna. Pri diferenciálnej diagnostike je dôležité najprv určiť veľkosť a typ proteinúrie a až potom indikovať cielené vyšetrenia, ktoré pomôžu zistiť vyvolávajúcu príčinu.
Hlavnou úlohou praktického pediatra a dorastového lekára je odlíšiť, či sa za proteinúriou skrýva ochorenie obličiek, ktoré si vyžaduje odborné nefrologické vyšetrenie. Včasné rozhodnutie je dôležité, lebo môže predísť a/alebo zabrániť trvalému poškodeniu obličiek.Kľúčové slová:
proteinúria, glomerulová proteinúria, tubulárna proteinúria, vyšetrovacie metódy, diferenciálno-diagnostický algoritmusÚvod
Proteinúria sa zvyčajne zistí náhodne pri rutinnom vyšetrení moču v pediatrických ambulanciách. Asymptomatická proteinúria je častejšia ako hematúria, vyskytuje sa u 4,2–6,3 % detskej populácie a až u 14 % adolescentov, toto percento je pri opätovnom vyšetrení moču nižšie [1, 2, 3]. Hlavnou úlohou, ktorej čelí praktický pediater a dorastový lekár, je odlíšiť, či sa za týmto nálezom „skrýva“ ochorenie obličiek, ktoré si vyžaduje odborné vyšetrenie u detského nefrológa. Včasné rozhodnutie je dôležité aj preto, lebo sa zistilo, že proteinúria je nezávislý faktor progresie nefropatie, ktorý zásadným spôsobom determinuje jej prognózu [4].
V nasledujúcom prehľade zhrnieme patofyziologické poznatky o proteinúrii a zameriame sa na praktický vyšetrovací postup u dieťaťa s nálezom bielkovín v moči.
Patofyziológia
Prestup bielkovín cez stenu glomerulovej kapiláry modifikujú viaceré faktory. Hlavnú úlohu v tomto procese však majú štruktúrové vlastnosti glomerulovej kapilárnej steny, ktorú tvorí: 1) fenestrovaný endotel, 2) glomerulová bazálna membrána (GBM) spolu s 3) glomerulovými epitelovými bunkami (podocytmi). Kým v minulosti sa za hlavný mechanizmus proteinúrie považovali abnormality samotnej GBM, v ostatnom období stále zreteľnejšie vystupuje do popredia i ďalší mechanizmus proteinúrie spojený s poškodením či narušením epiteliálnych buniek, tzv. podocytov [5].
Glomerulová kapilárna stena obmedzuje filtráciu molekúl podľa ich veľkosti a elektrického náboja. Zdraví jedinci denne prefiltrujú obličkami veľké množstvo bielkovín, najmä nízkomolekulové proteíny (lyzozým, beta-2-mikroglobulín, inzulín, rastový hormón atď.), ktoré sa následne kompletne spätne vstrebávajú v proximálnom tubule. Na rozdiel od toho, pre molekuly väčšie ako 40–50 kDa (teda zhruba veľkosti albumínu) je za normálnych okolností kapilárna stena nepriepustná. Hlavnou bariérou zabraňujúcej ich filtrácií je spojenie medzi výbežkami (pedicelmi) podocytov, ktoré sa označuje ako „štrbinová membrána“ (angl. „slit diaphragm“). V ostatných rokoch pribudli zásadné nové informácie o štruktúre a funkcii štrbinovej membrány ako aj o proteínoch, ktoré ju tvoria a chýbanie ktorých vedie k vzniku hereditárnych proteinurických syndrómov (obr. 1) [6].
1. Schéma štruktúry štrbinovej membrány a pedicel podocytov. Proteíny TRCP6, ACTN4, CD2AP a podocín sú kľúčovými „podpornými“ molekulami štrbinovej membrány tvorenej molekulami nefrínu oboch susediacich pedicel podocytov. Legenda: SM – štrbinová membrána, GBM – glomerulová bazálna membrána, TRPC6 – tranzientný kationový kanál receptorového potenciálu,ACTN4 – alfa aktinín 4, CD2AP – CD2 asociovaný proteín,WT1 –Wilmsov tumor proteín 1. Podľa: Johnstone DB, Holzman LB. Clinical impact of research on the podocyte slit diaphragm. Nat. Clin. Pract. Nephrol. 2006;2(5): 271–282. 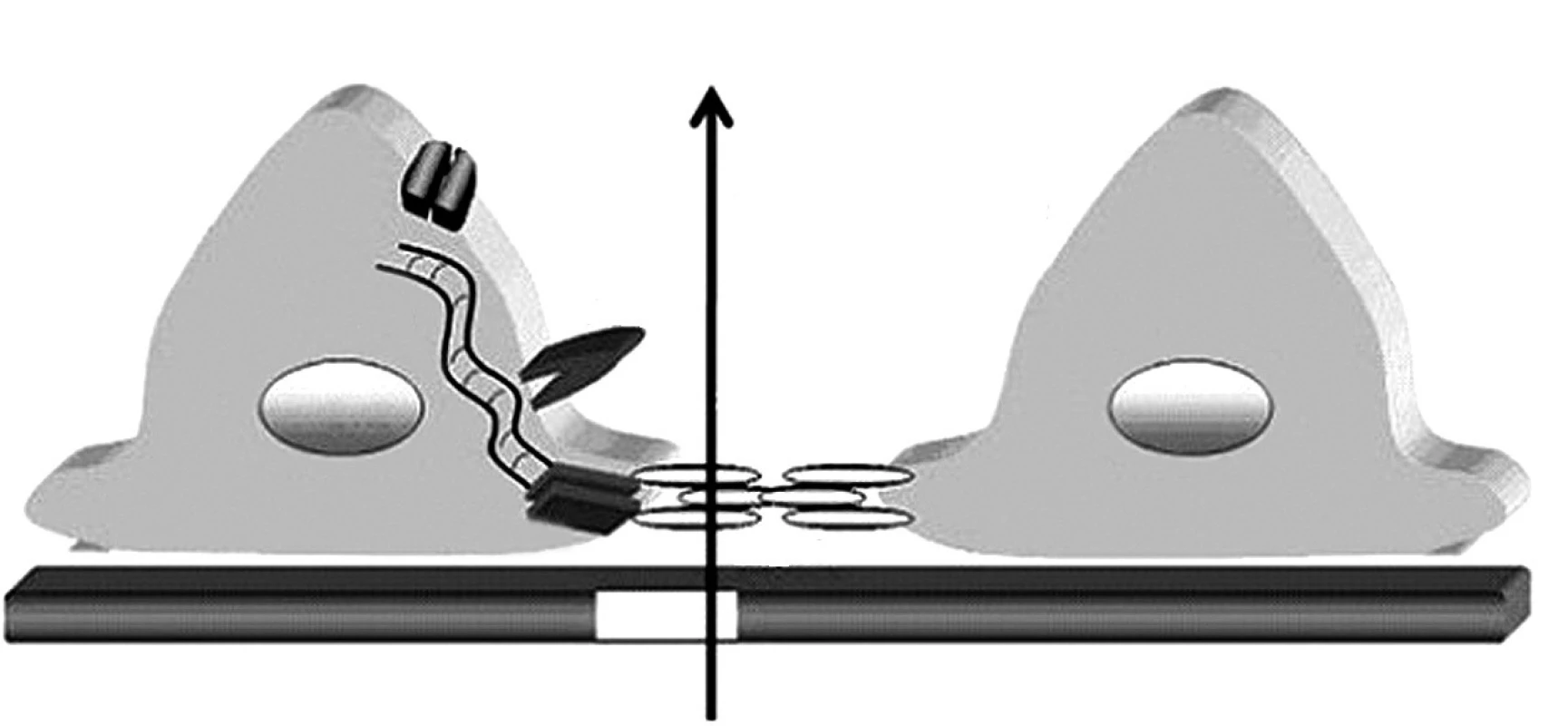
Je známe, že mutácia génu základného štrukturálneho proteínu štrbinovej membrány (nefrinu) je príčinou kongenitálneho nefrotického syndrómu (NS) fínskeho typu, kým mutácie iných podocytárnych proteínov (napr. podocinu a alfa-aktininu-4) majú za následok kongenitálnu fokálnu segmentálnu glomerulosklerózu (FSGS). Selektívnu priepustnosť kapilárnej steny ovplyvňuje aj získané poškodenie podocytov. V miestach, kde dochádza k splynutiu (fúzii) pedicel podocytov, je filtrácia znížená a v miestach, kde sú podocyty celkom oddelené od GBM, dochádza k masívnemu prieniku makromolekúl do priestoru Bowmanovho puzdra glomerulu.
Definícia
Malé množstvo bielkovín je prítomné aj v moči zdravých osôb. Za horný limit pre fyziologickú proteinúriu u detí aj dospelých sa všeobecne akceptuje množstvo 150 mg/deň/1,73 m2 [7]. Proteinúria sa považuje za patologickú, ak vylučovanie bielkovín močom prevyšuje u detí 150 mg/deň a u adolescentov 250 mg/deň (tab. 1).
1. Normálne hodnoty proteinúrie. 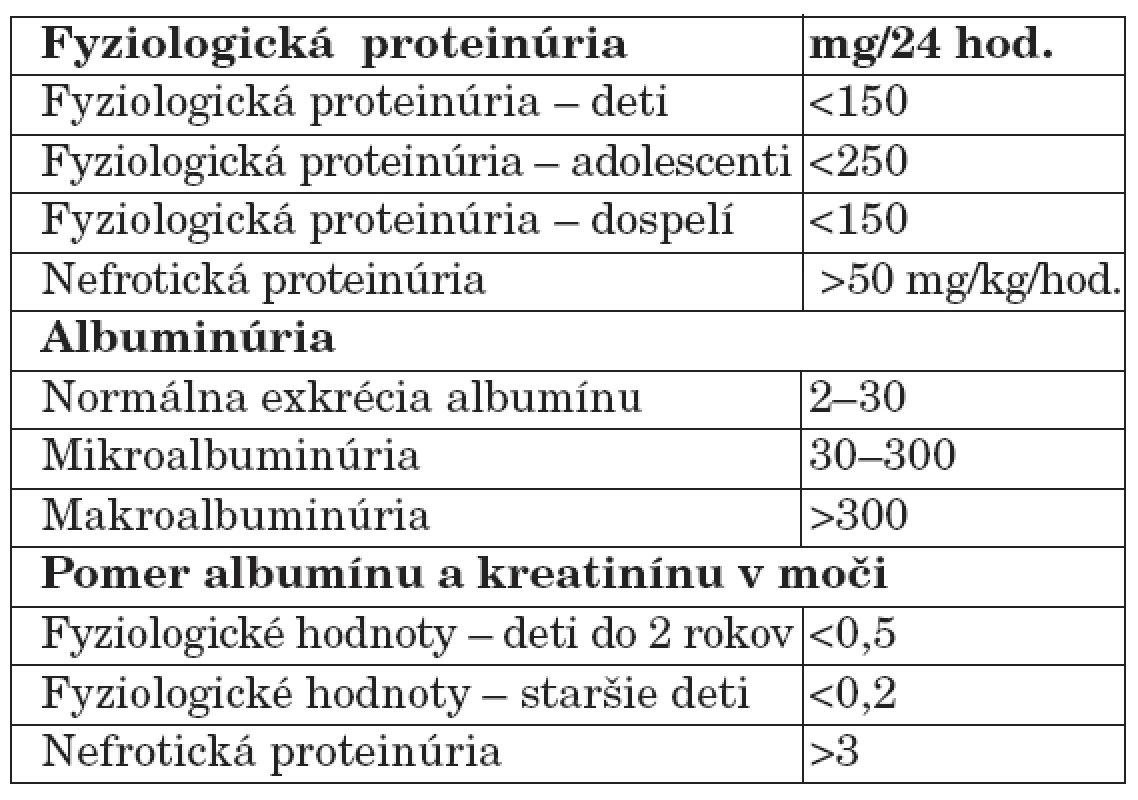
Analýzou moču zdravých ľudí sa zistilo, že najväčšiu frakciu jeho normálneho bielkovinového spektra tvorí okrem albumínu z plazmy tzv. Tammov-Horsfallov mukoproteín syntetizovaný v distálnom tubule a vylučovaný do moču u zdravých jedincov v množstve 25 až 75 mg/deň/ 1,73 m2. Nižšia sekrécia Tammovho-Horsfallovho proteínu poukazuje na poruchu tubulov a drene obličiek, normálna či zvýšená sekrécia svedčí pre intaktné tubuly [7].
Mikroalbuminúria je osobitným typom glomerulovej proteinúrie. Charakterizuje sa mierne zvýšenou močovou exkréciou albumínu v rozsahu, ktorý ešte nedosahuje hodnoty detegovateľné bežnými (papierikovými) diagnostickými metódami (25 až 200 mg/l, resp. 25 až 200 mg/deň/1,73 m2). Dnes sa mikroalbuminúria považuje za nezávislý prognostický faktor, ktorý spoľahlivo odráža renálnu dysfunkciu a je včasný marker diabetickej nefropatie a kardiovaskulárnych chorôb včítane hypertenzie spojených s renálnym poškodením [8]. V ostatnom čase viaceré porovnávacie štúdie poukazujú na skutočnosť, že mikroalbuminúria je senzitívnejší marker ako celková proteinúria, a to najmä preto, že dovoľuje vyselektovať skupinu rizikových pacientov už v incipientnom štádiu nefropatie. Tieto klinické výsledky sú natoľko presvedčivé, že boli hlavným podnetom k zavedeniu celoplošného skríningu mikroalbuminúrie v USA.
Enzýmúria je zvýšené vylučovanie špecifických enzýmov, ktoré pri tubulárnom poškodení prechádzajú vo zvýšenom množstve do moču. Vyšetrenie močových enzýmov nenaplnilo pôvodne očakávania a využíva sa len pri diferenciálnej diagnostike tubulointersticiálnych nefritíd. Z početných enzýmov má praktický význam iba stanovenie N-acetyl-beta-D-glukozaminidázy (NAG), ktoré pomôže vcelku spoľahlivo rozlíšiť akútne a chronické tubulointersticiálne nefritídy a osvedčilo sa aj pri monitorovaní dysfunkcie proximálneho tubulu. Pri akútnom poškodení tubulárnych buniek vylučovanie NAG močom stúpa (presahuje 20 U/gUcr), kým pri chronických tubulopatiach je močová koncentrácia NAG menej ako 20 U/gUcr [7].
Vyšetrovacie metódy
Vyšetrenie moču patrí k rutinnému pediatrickému skríningu a je súčasťou bežnej laboratórnej analýzy u každého chorého dieťaťa.
Ku skríningovým metódam patrí vyšetrenie testačnými papierikmi, resp. vyšetrenie na základe jednoduchých chemických reakcií (napr. Biuretova metóda, kyselina sulfosalicylová a ďalšie).
Papierikové metódy slúžia predovšetkým na rýchlu a orientačnú diagnostiku v ambulantných podmienkach, kde nie je dostupné biochemické laboratórium. Senzitivita papierikového testu je 90 % a špecificita 56 %. Papierik detekuje prítomnosť albumínu v moči, je však málo citlivý na ostatné bielkoviny (napr. nízkomolekulové proteíny, Bensova-Jonesova bielkovina, či gama globulíny). Vyšetrenie papierikom sa podľa farebnej škály interpretuje ako negatívne, resp. pozitívne (1+, 2+, 3+, 4+). Intenzita sfarbenia papierika je úmerná veľkosti proteinúrie, pričom 1+ sa rovná proteinúrii cca 300 mg/l; 2+ cca 1 g/l; resp. 3+ cca 3 g/l; resp. 4+ v rozmedzí 20–30 g/l [7]. Treba však podčiarknuť, že semikvantitatívne hodnotenie proteinúrie podľa intenzity sfarbenia papierika je len orientačné. Papierik dáva pozitívnu reakciu na bielkoviny vtedy, keď proteinúria presiahne 300 mg/deň (teda nedokáže zachytiť mikroalbuminúriu). Falošne pozitívne výsledky môžu byť pri veľkej hematúrii a pri zahustenom alebo alkalickom moči. Naopak, ak je moč hypoosmolárny, papierik sa nesfarbuje a dáva falošne negatívny výsledok [9]. Dôležité je zdôrazniť, že pozitívny nález bielkovín papierikom sa musí vždy overiť kvantitatívnym vyšetrením z 24-hodinového zberu moču.
Jednoduchý biochemický test s 20% kyselinou sulfosalicylovou je vhodný na monitorovanie proteinúrie v domácich podmienkach, napr. u detí s nefrotickým syndrómom. Po pridaní niekoľkých kvapiek 20% kyseliny sulfosalicylovej do moču sa pri patologickej proteinúrii vytvorí biela zrazenina. Táto metóda deteguje všetky proteíny nachádzajúce sa v moči. V prípade, že test je pozitívny a vyšetrenie papierikom negatívne, treba myslieť na iné močové bielkoviny ako albumín (napr. pri myelóme).
Definitívne, diagnostické určenie proteinúrie sa uskutočňuje na základe kvantitatívneho merania bielkovín v moči, resp. elektroforetickej analýzy močových bielkovín.
Kvantitatívne meranie bielkovín v 24-hodinovom moču sa považuje za zlatý štandard na určenie presného množstva vylučovaných proteínov.
Alternatívnou metódou nahrádzajúcou celodenný zber moču je výpočet indexu albumín (mg/dl)/kreatinín (mg/dl) z jednorázovej vzorky moču. Pre svoju jednoduchosť sa štandardne používa v rozvinutých krajinách a pre bežnú klinickú prax úplne postačuje. U zdravých detí do 2 rokov života je index albumín/kreatinín nižší ako 0,5, u starších detí nepresahuje hodnotu 0,2. Pri veľkej nefrotickej proteinúrii je pomer albumín/kreatinínový vyšší ako 3 [10].
Elektroforetické vyšetrenie moču slúži na jednoduché rozlíšenie glomerulovej a tubulárnej proteinúrie. Tubulárnu proteinúriu charakterizuje prítomnosť bielkovín v oblasti alfa a beta frakcie, kým pri glomerulovej proteinúrii tvorí hlavnú zložku močových proteínov albumín. Snahy biochemikov o zdokonalenie pôvodnej metódy vyústili do zavedenia novších techník využívajúcich elektroforézu na polyakrylamidovom géli (PAGE). Separácia na 10% PAGE umožňuje oddiferencovať jednotlivé typy proteinúrie a získať tak detailnejšiu analýzu špecifických tubulárnych proteínov, ktorých (ne)prítomnosť je nápomocným diagnostickým vodítkom pri chronických nefropatiach. Vhodnou alternatívou je SDS-PAGE technika, ktorá zdokonalením grafickej analýzy močových proteínov dokáže spoľahlivo odlíšiť glomerulovú (selektívnu aj neselektívnu), tubulárnu aj zmiešanú proteinúriu. Prehľadný grafický záznam s detailným vyhodnotením močových bielkovín podľa ich molekulovej hmotnosti pomôže lekárovi zacieliť diagnostický postup a rozhodnúť, či sú indikované ďalšie špeciálne vyšetrenia. Aj na základe vlastných skúsenosti môžeme uzavrieť, že SDS-PAGE metóda predstavuje rýchlu, efektívnu a finančne prístupnú diagnostiku proteinúrie, ktorá je vhodná na sledovanie dynamiky chorobného procesu a kontrolu úspešnosti liečby [11].
Vyšetrenie lyzozýmu v moči sa javí ako vhodná a nenáročná metóda na diagnostiku tubulárnej dysfunkcie. Lyzozým je bázický polypeptid enzymatickej povahy s molekulovou hmotnosťou 14 700 kDa, ktorý je prítomný v rôznych biologických tekutinách. Voľne sa filtruje cez stenu glomerulových kapilár a v proximálnom tubule sa takmer úplne resorbuje, preto sa v moči zdravých ľudí nachádza len v stopovom množstve. Za patologickú lyzozymúriu sa považujú hodnoty lyzozýmu nad 0,3 mg/l, chorí s fibrózou interstícia majú signifikantne vyššiu lyzozymúriu ako jedinci bez tubulointersticiálneho poškodenia (4 mg/l versus 0,3 mg/l) [12].
Príčiny proteinúrie
Najčastejšou príčinou proteinúrie sú choroby glomerulov, zriedkavejšie tubulopatie, prechodne ju môžu indukovať aj niektoré „nepatologické stavy“, ako je fyzická námaha, poloha tela či diéta (tab. 2). Asymptomatická proteinúria je pomerne častá a môže byť trvalá alebo prechodná. Prechodná tzv. „tranzientná“ proteinúria je benígny symptóm s dobrou prognózou. Ak je proteinúria trvalá a perzistuje, zvyčajne je vyvolaná zvýšenou glomerulovou permeabilitou, ktorá sprevádza závažné ochorenia ako napr. nefrotický syndróm, glomerulonefritídy (poinfekčná, membránová, lupusová, IgA nefropatia), či hereditárne nefropatie (Alportov syndróm, mezangiálna skleróza). Každé dieťa s pretrvávajúcou proteinúriou si preto vyžaduje dôkladne nefrologické vyšetrenie.
Prechodná proteinúria
Prechodná proteinúria nie je zapríčinená patologickým stavom a po odoznení vyvolávajúcej príčiny vždy ustupuje. Zvyčajne nepresiahne množstvo 1 g/deň a nikdy sa nezdružuje s edémami [13].
Febrilná proteinúria
Mechanizmus indukcie proteinúrie pri horúčke nie je známy. Zjavuje sa pri teplote nad 38,3 ˚C a s poklesom telesnej teploty sa stratí. Množstvo vylučovaných bielkovín pri febrilnej proteinúrii je klinicky nevýznamné a zvyčajne nepresahuje 2+.
Ponámahová proteinúria
Ponámahová proteinúria sa pozoruje pri nadmernom fyzickom výkone, maximálne dosahuje hodnotu 2+. Ak zmizne do 48 hodín, považuje sa za benígnu.
Ortostatická proteinúria
Ortostatická proteinúria je častý problém v pediatrickej praxi, v typických prípadoch sa zistí pri preventívnej prehliadke až u 5 % dospievajúcich [13]. Zvýšené vylučovanie bielkovín močom počas dňa sa vysvetľuje vertikalizáciou tela, nadmernou lordózou a poklesom obličiek vo vzpriamenej polohe.
Ide o izolovanú proteinúriu bez hematúrie, s normálnymi hodnotami obličkových funkcií aj C3 zložky komplementu v sére. U všetkých detí s asymptomatickou malou proteinúriou treba vždy najprv myslieť na ortostatickú proteinúriu a vykonať ortostatický test. Pri tomto teste pacient zbiera moč do osobitnej nádoby od 7. hodiny ráno do 23. hodiny večer a potom do inej zbernej nádoby počas noci od 23. hodiny večer do 7. hodiny ráno.
Pri ortostatickej proteinúrii sa zistí zvýšená kvantitatívna proteinúria len v dennej vzorke moču [14]. Keď je izolovaná proteinúria nižšia ako 1 g/deň, renálna biopsia nie je indikovaná, lebo sa dá očakávať, že histologicky nález bude normálny alebo nešpecifický [15]. Renálna biopsia je indikovaná iba v prípade, ak proteinúria perzistuje, je vyššia ako 1 g/deň a/alebo je prítomna aj hematúria, hypertenzia, nízka C3 zložka komplementu či porucha renálnych funkcií [13].
Z dlhodobého hľadiska má ortostatická proteinúria dobrú prognózu, nevedie do renálnej insuficiencie a u väčšiny pacientov v priebehu rokov úplne vymizne [16]. Vo všeobecnosti sa odporúča osoby s ortostatickou proteinúriou dispenzarizovať až do normalizácie moču a pravidelne sledovať, či sa nepridruží hematúria, hypertenzia, pokles renálnych funkcií, alebo či proteinúria nestúpne nad 1 g/deň [17].
Patologická (perzistujúca) proteinúria
Proteinúria je pre klinika veľmi cenným príznakom, lebo jej stupeň priamo odráža závažnosť priebehu viacerých ochorení [18]. Usudzuje sa, že včasná diagnostika proteinúrie môže odkryť plazivo prebiehajúcu obličkovú chorobu a umožní neodkladne započať adekvátnu liečbu [19].
Patologické zvýšené množstvo bielkovín v moči môže byť glomerulového a/alebo tubulárneho pôvodu.
Glomerulárna proteinúria
Glomerulárna proteinúria je včasný príznak glomerulopatie a zásadným spôsobom ovplyvňuje rýchlosť ich progresie. Dlhotrvajúca pasáž bielkovín cez glomerulovú kapiláru a mezangium poškodzuje renálne bunky a významne potencuje aktivitu kľúčových mediatórov udržujúcich lokálny imunitný zápal. Zvýšená nálož filtrovaných proteínov má toxický vplyv i na bunky proximálneho tubulu a okrem iného stimuluje v nich aj expresiu génov indukujúcich tvorbu rastových faktorov a vazoaktívnych (endotelín-1) a zápalových (MCP-1 monocytový chemoatrahujúci proteín) pôsobkov zúčastňujúcich sa na tubulointersticiálnom poškodení [20].
Odpad bielkovín sa môže pohybovať v rozmedzí od 1 až do 30 g/deň. Glomerulárna proteinúria môže byť selektívna (straty bielkovín s molekulovou hmotnosťou albumínu) a neselektívna (močové straty proteínov s vysokou molekulovou hmotnosťou, napr. IgG). Selektívna proteinúria sprevádza v typických prípadoch chorobu minimálnych zmien (MCD), závažné formy glomerulonefritíd sú spojené zvyčajne s neselektívnou proteinúriou. Určovanie selektivity proteinúrie má však iba malý diagnostický význam, lebo jednotlivé renálne choroby sa vzájomne často prekrývajú.
Najčastejšou príčinou glomerulárnej proteinúrie je zvýšenie permeability steny glomerulovej kapiláry podmienené imunologickým procesom. Mechanizmus masívnej proteinúrie má pri jednotlivých primárnych glomerulopatiach svoje charakteristické črty [21].
- V patogenéze NS na podklade MCD a FSGS (fokálna segmentálna glomeruloskleróza) sa predpokladá účasť doteraz neidentifikovaného cirkulujúceho permeabilného faktora produkovaného T lymfocytmi.
- Sporadické formy FSGS je možné rozdeliť na 3 typy: a) FSGS s mutáciami génu niektorých podocytových proteínov (podocinu, á-aktininu atď.), b) FSGS s nadprodukciou permeabilného faktora (faktorov) a c) FSGS s deficitom inhibítora permeabilných faktorov.
- Pri membránovej glomerulonefritíde (MGN), charakterizovanej primárne subepiteliálnym ukladaním imunitných depozitov sa predpokladá, že k poškodeniu podocytov dochádza v dôsledku lokálnej aktivácie komplementu s tvorbou membranolytického komplexu C5b–C9.
- Pri membranovoproliferatívnej glomerulonefritíde sú imunitné komplexy prítomné okrem mezangia aj medzi endoteliálnymi bunkami a GBM (subendoteliálne). Ukladanie cirkulujúcich imunitných komplexov spôsobuje lokálnu aktiváciu komplementu a tvorbu chemotaktických látok; následne zvýšená aktivácia adhezných molekul na endoteliálnych bunkách vedie cez infiltráciu glomerulu neutrofilmi a monocytmi (spojené s lokálnou tvorbou reaktívnych foriem kyslíka a proteáz) k poškodeniu GBM.
- U pacientov s lupusovou nefritídou (LN) sa možno stretnúť s histologickým obrazom MGN (typ V) i proliferatívnej GN (LN trieda III a IV). Pri proliferatívnej lupusovej nefritíde so subendoteliálnymi depozitmi sa predpokladá významná úloha väzby kationických nukleozómov na prevažne negatívne nabité štruktúry GBM.
- Pri Alportom syndróme, ktorý je najvýznamnejšou dedičnou glomerulopatiou, je postupný vývoj závažnej proteinúrie až nefrotického syndrómu najčastejšie viazaný na abnormálnu stavbu á5 reťazca kolagénu IV.
Tubulárna proteinúria
Pri poškodení tubulárnych buniek a interstícia viazne spätná reabsorpcia nízkomolekulových bielkovín a preto sa vylučujú vo zvýšenom množstve do moču (napr. alfa-1-mikroglobulín, beta-2-mikroglobulín, lyzozým, retinol viažúci proteín a ďalšie). Tubulárna proteinúria je zvyčajne nízka a vzácne presiahne 1 g/deň. Je typickým laboratórnym znakom svedčiacim pre získané a dedičné choroby tubulov, ku ktorému sa pri plne rozvinutom klinickom obraze pridružujú aj glykozúria, fosfatúria, straty bikarbonátov a aminoacidúria. Podľa typu vrodeného defektu vzniká kompletný alebo inkompletný syndróm DeToniho-Debrého-Fanconiho. Izolovaná tubulárna proteinúria bez iných sprievodných klinických a/alebo laboratórnych príznakov sa vyskytuje len vzácne. Zvyčajne nerobí diagnostické problémy, lebo základná renálna choroba sa manifestuje ešte pred proteinúriou.
Tubulárna proteinúria je citlivý marker, ktorý sa osvedčil aj pri detekcii získaných tubulárnych porúch podmienených autoimunitným procesom alebo endo/exogénnym nefrotoxínom.
Vyšetrovací postup u dieťaťa s perzistujúcou proteinúriou
Proteinúria je častý močový syndróm, s ktorým sa bežne stretáva pediater v svojej klinickej praxi. V diferenciálno-diagnostickom postupe je dôležité najprv zistiť veľkosť a charakter proteinúrie a tak indikovať cielené vyšetrenia na určenie vyvolávajúcej príčiny.
Asymptomatická proteinúria môže byť intermitentná alebo perzistujúca. Intermitentná proteinúria je benígna a trvá iba krátko, preto sa nevyžadujú žiadne ďalšie komplikované klinické vyšetrenia [9]. Perzistujúca proteinúria sa definuje ako proteinúria trvajúca aspoň 3 mesiace, ktorá sa zistí u dovtedy zdravého dieťaťa. Odpad bielkovín v moči nepresahuje 2 g/deň, hematúria, hypertenzia či opuchy nie sú prítomné.
Vyšetrovací diagnostický postup u dieťaťa s asymptomatickou proteinúriou odporúčaný konsenzom pediatrických nefrológov z roku 2000 uvádza obrázok 2 [22].
2. Vyšetrovací diagnostický postup u dieťaťa s asymptomatickou proteinúriou odporúčaný konsenzom pediatrických nefrológov z roku 2000 [22]. ![Vyšetrovací diagnostický postup u dieťaťa s asymptomatickou proteinúriou odporúčaný konsenzom
pediatrických nefrológov z roku 2000 [22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e51d57d434467c6664a3c5120e9fd4dc.jpg)
Prvým krokom je starostlivé klinické vyšetrenie. Začína sa dôkladnou anamnézou a podrobným fyzikálnym vyšetrením, ktoré sú cielené na prítomnosť chorobných príznakov spojených s proteinúriou, ako je výskyt opuchov, vysoký krvný tlak, hematúria, dyzúria, porucha sluchu a lieky. Zo širokej palety farmák môžu proteinúriu indukovať nesteroidné antiflogistika, penicilamín a v pediatrii zriedkavo používané preparáty zlata.
Vyšetrenie močového sedimentu je najdôležitejším krokom laboratórnych vyšetrení, lebo od jeho výsledku sa odvíja ďalší diferenciálno-diagnostický postup. Hematúria, výskyt valcov a lipidúria svedčia pre glomerulopatiu, ktorá si vyžaduje odborné nefrologické vyšetrenie.
Keď je močový sediment negatívny, treba s odstupom času zopakovať vyšetrenie papierikom. Ak sa bielkoviny pri kontrolnom vyšetrení už nezistia, najpravdepodobnejšie išlo o prechodnú proteinúriu. Ďalšie vyšetrenia sa už neindikujú a treba uistiť rodičov, že ich dieťa nemá chorobu obličiek. Ak proteinúria pretrváva, je indikované vyšetrenie renálnej funkcie a z 24-hodinového zberu moču sa stanoví aj kvantitatívna proteinúria.
Prognóza
Ortostatická proteinúria má dobrú prognózu, lebo nespeje do renálnej insuficiencie a u drvivej väčšiny pacientov v priebehu rokov úplne vymizne. Na druhej strane, prognóza detí s trvalou neortostatickou proteinúriou je neistá. Dokumentujú to výsledky retrospektívnej štúdie u 31 detí s proteinúriou trvajúcou viac ako 10 mesiacov. Zo 17 chorých, u ktorých bola vykonaná renálna biopsia, malo 11 detí patologický histologický nález vrátane obávanej fokálnej segmentálnej sklerózy. Počas 6-ročného sledovania vymizla proteinúria u 12 detí, ktoré neboli bioptované a u 4 chorých, ktorí mali normálny histologický nález [23].
V inej štúdii japonskí autori hodnotili výsledky biopsie u 53 detí s asymptomatickou proteinúriou. Signifikantné histologické zmeny sa zistili takmer u polovici z nich (25 chorých, 47 %), 15 detí malo fokálnu glomerulosklerózu. Prekvapivo, až 7 pacientov s patologickým histologickým nálezom dospelo do chronickej renálnej insuficiencie [24].
Vo všeobecnosti ale platí, že prognóza nefropatií s proteinúriou do 1 g/deň je priaznivejšia ako prognóza nefropatií s proteinúriou prevyšujúcou 1 g/deň.
Liečba proteinúrie
Liečba glomerulových chorôb presahuje rámec tejto publikácie. Pre úplnosť informácie však treba uviesť účinný antiproteinurický účinok inhibítorov ACE a blokátorov receptoru pre angiotenzín II (ARBs). Tieto lieky priamo chránia integritu GBM a redukujú proteinúriu znižením intraglomerulového tlaku, nezávisle od ich systémového antihypertenzívneho efektu. Priaznivý efekt ACE inhibítorov na spomalenie progresie proteinurických nefropatií do štádia obličkového zlyhania presvedčivo dokázali mnohé klinické štúdie a ACE inhibítory pre svoje komplexné účinky sa dnes radia k štandardným terapeutickým postupom aj v detskom veku [25, 26, 27, 28, 29].
Záver
Proteinúria je častý močový syndróm, s ktorým sa pediater denne stretáva vo svojej klinickej praxi. V diferenciálno-diagnostickom postupe je dôležité najprv určiť veľkosť a typ proteinúrie a až potom indikovať cielené vyšetrenia, ktoré pomôžu zistiť vyvolávajúcu príčinu.
Ďakujeme p. Libuši Herichovej za technickú prípravu článku.
Došlo: 29. 1. 2008
Přijato: 12. 3. 2008
Prof. MUDr. Ľudmila Podracká, CSc.
I. Klinika detí a dorastu LF UPJŠ a DFN
Tr. SNP 1
040 66 Košice
Slovenská republika
e-mail: podracka@lf.upjs.sk
Redakční poznámka: Kontrolní otázky k tomuto článku jsou uveřejněny na vložené příloze v tomto čísle.
Sources
1. Vehaskari VM, Rapola J. Isolated proteinuria: analysis of a school-age population. J. Pediatr. 1982;101 : 661–668.
2. Dodge WF, West EF, Smith EH, Bunce Harvey 3rd. Proteinuria and hematuria in school-age children: epidemiology and early natural history. J. Pediatr. 1976;88 : 327–347.
3. Yoshikawa N, Kitagawa K, Ohta K, Tanaka R, Nakamura H. Asymptomatic constant isolated proteinuria in children. J. Pediatr. 1991;119 : 375–379.
4. Burton C, Harris KPG. The role of proteinuria in the progression of chronic renal failure. Am. J. Kidney Dis. 1996;27 : 765–775.
5. Šašinka M. Proteinúria. In Dzúrik M, Šašinka M, Mydlík M, Kovács L. Nefrológia. Bratislava: Herba, 2004 : 87–96.
6. Johnstone DB, Holzman LB. Clinical impact of research on the podocyte slit diaphragm. Nat. Clin. Pract. Nephrol. 2006;2(5): 271–282.
7. Ehrich JHH, Miltenyi M. Proteinuria. In Cochat, P. ESPN Handbook. France, 2002 : 88–95.
8. Ritz E. Renal dysfunction as a novel risk factor: Microalbuminuria and cardiovascular risk. Kidney Int. 2005;67(Suppl 93): S25–S28.
9. Bergstein JM. A practical approach to proteinuria. Pediatr. Nephrol. 1999;13 : 697–700.
10. Houser M. Assessment of proteinuria using random urine samples. J. Pediatr. 1984;104(6): 845–848.
11. Dubayová K, Kušnír J, Podracká Ľ. Diagnostic monitoring of urine by means of synchronous fluorescence spectrum. J. Biochem. Biophys. Methods 2003;55(2): 111–119.
12. Podracká Ľ, Šašinka M, Kováčová A, Böör A, Filka J. Lyzozymúria – jednoduchá metóda na dôkaz tubulointersticiálneho poškodenia obličiek. Detský Lekár 1994;1(4): 149–150.
13. Gagnadoux MF. Evaluation of proteinuria in children. UpToDate 2005;3 : 2.
14. Rose BD, Fletcher SW. Proteinuria: The primary care approach. UpToDate 2007.
15. Trachtman H, Bergwerk A, Gauthier B. Isolated proteinuria in children. Natural history and indications for renal biopsy. Clin. Pediatr. 1994;33 : 468–472.
16. Springberg PD, Garrett LEJr, Thompson AL, Collins NF, Lordon RE, Robinson RR. Fixed and reproducible orthostatic proteinuria: results of a 20-year follow-up study. Ann. Intern. Med. 1982;97 : 516–519.
17. Voght BA, Avner ED. Conditions particulary associated with proteinuria. In Nelson Textbook of Pediatrics. 17th ed. Philadelphia: W. B. Saunders, 2004 : 1751–1753.
18. Ruggenenti P, Perna A, Mosconi L, Pisoni R, Remuzzin G. Urinary protein excretion rate is the best independent predictor of ESRF in non-diabetic proteinuric chronic nephropathies. Kidney Int. 1998;53 : 1209–1216.
19. Ihle BU, Whitworth JA, Shahinfar S, Cnaan A, Kincaid-Smith PS, Becker GJ. Angiotensin-converting enzyme inhibition in nondiabetic progressive renal insufficiency: a controlled double-blind trial. Am. J. Kidney Dis. 1996;27 : 489–495.
20. Zoja C, Donadelli R, Colleoni S, Figliuzzi M, Bonazzola S, Morigi M, Remuzzi G. Protein overload stimulates RANTES production by proximal tubular cells depending on NF-kB activation. Kidney Int. 1998;53 : 1608–1615.
21. Ryšavá R, Tesař V, Merta M. Nefrotický syndróm. Interní Medicína pro Praxi 2005;3 : 131–134.
22. Hogg RJ, Portman RJ, Milliner D, et al. Evaluation and management of proteinuria and nephrotic syndrome in children: Recommendations from a Pediatric Nephrology panel established at the National Kidney Foundation Conference on Proteinuria, Albuminuria, Risk, Assessment, Detection and Elimination (PARADE). Pediatrics 2000;105 : 1242.
23. Trachtman H, Bergwerk A, Gauthier B. Isolated proteinuria in children. Natural history and indications for renal biopsy. Clin. Pediatr. 1994;33 : 468–472.
24. Yoshikawa N, Kitagawa K, Ohta K, Tanaka R, Nakamura H. Asymptomatic constant isolated proteinuria in children. J. Pediatr. 1991;119 : 375–379.
25. Jafar TH, Stark PC, Schmid CH, et al. AIPRD Study Group. Progression of chronic kidney disease: The role of blood pressure control, proteinuria, and angiotensin-converting enzyme inhibition-A patient-level meta analysis. Ann. Intern. Med. 2003;139 : 244–252.
26. Barclay L. ACE inhibitors may slow progression of IgA renal disease. Am. Soc. Nephrol. 2007;18 : 1880–1888.
27. Šašinka M, Podracká Ľ, Boor A, Jurkovič I, Mitro A, Kovács L. Enalapril treatment of proteinuria in normotensive children. Bratisl. lek. Listy 1999;100(9): 476–480.
28. Bhattacharjee R, Filler G. Additive antiproteinuric effect of ACE inhibitor and losartan in IgA nephropathy. Pediat. Nephrol. 2002;17(4): 302–304.
29. Seeman T, Patzer L, John U, Dusek J, Vondrák K, Janda J, Misselwitz J. Blood pressure, renal function, and proteinuria in children with unilateral renal agenesis. Kidney Blood Press. Res. 2006;29(4): 210–215.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2008 Issue 6-
All articles in this issue
- Therapy of Inborn Spine Deformities
- Spinal Epidural Abscess in a Sixteen Years Old Boy Case report and review of literature
- Cough in Children with Diseases of Nasal Cavity and Paranasal Sinuses
- Intrauterine Growth Retardation and Fetal Origin of Diseases at the Adult Age
- Examination Procedure in the Child with Proteinuria
- History of the Care of Patients with Cystic Fibrosis in Slovakia
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Examination Procedure in the Child with Proteinuria
- Intrauterine Growth Retardation and Fetal Origin of Diseases at the Adult Age
- Therapy of Inborn Spine Deformities
- Spinal Epidural Abscess in a Sixteen Years Old Boy Case report and review of literature
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


