-
Medical journals
- Career
Novorozenecký screening v České republice a v Evropě
: F. Votava; K. Strnadová
: Klinika dětí a dorostu UK 3. LF a FN Královské Vinohrady, Praha přednosta doc. MUDr. F. Votava, PhD.
: Čes-slov Pediat 2008; 63 (2): 96-105.
Přehledový článek informuje čtenáře o aktualitách v novorozeneckém screeningu v České republice a evropských státech.
Klíčová slova:
novorozenecký screening, Česká republika, fenylketonurie, kongenitální hypotyreóza, kongenitální adrenální hyperplazie, cystická fibrózaÚvod
Novorozeneckým screeningem (NS) se rozumí aktivní a celoplošné (celostátní) vyhledávání chorob u novorozenců v jejich časném, preklinickém stadiu. Pod pojem NS lze zahrnout klinické vyšetření neonatologem či pediatrem při pátrání po vrozených vývojových vadách či vrozených infekcích, vyšetření ortopedem při vyhledávání vrozené dysplazie kyčlí, vyšetření oftalmologem při vyhledávání vrozené katarakty [1, 2], vyšetření sluchu při vyhledávání vrozené hluchoty [3] či ultrazvukové vyšetření ledvin k časnému záchytu vrozených vývojových vad urotraktu [4].
Předmětem sdělení je NS v užším smyslu, čímž se rozumí vyhledávání chorob na základě stanovení koncentrace specifické látky – analytu, resp. někdy i průkazu genové mutace v suché kapce krve odebírané na filtrační papírek všem novorozencům v dané populaci. Kapky krve se po zaschnutí odesílají běžnou poštou do příslušných laboratoří k analýze. Systém NS nespočívá pouze v laboratorní analýze, ale zahrnuje celou logistiku preanalytické části (způsob, časování odběrů, informace rodičům), analytické části (jaké analyty jakým způsobem a kde jsou měřeny) a postanalytické části (systém vyhodnocování a zpracování dat screeningu, návaznost na klinická pracoviště, dlouhodobé „follow-up“ pacientů a systému NS, skladování a využití vzorků). Smyslem článku je přiblížit čtenářům současný pohled na problematiku NS v ČR a Evropě.
V ČR je logistika NS dána „Metodickým opatřením MZ ČR“, které bylo naposledy aktualizováno v červenci 2003 [5]. Toto opatření je pro náš zdravotnický systém závazné, definuje „lege artis“ postup. S rozvojem NS podléhá opakovaným aktualizacím a není smyslem článku ho rozebírat či opisovat.
Z pohledu celoevropského je pro systémy NS v jednotlivých státech charakteristická značná roztříštěnost a nejednotnost ve všech částech logistiky systémů. Příčinou je, že se systémy NS vyvíjely na základě konkrétních historických, geografických, medicínských, ekonomických i politických podmínek daného státu a tyto vlivy i nadále rozhodují o fungování celého systému. Neexistuje jeden univerzální, nejlepší systém NS. Evropskou nejednotnost je možné dokumentovat růzností spektra screenovaných chorob v jednotlivých státech (tab. 1) nebo růzností počtu screeningových laboratoří. Dvacet dva státy ze 43 evropských má jednu centrální screeningovou laboratoř (např. Rakousko, Slovensko, Portugalsko, Švédsko), 7 států je pokryto 2–5 laboratořemi (např. ČR, Holandsko, Švýcarsko, Belgie) a 14 států má více laboratoří (např. Polsko 8, Německo 13, Francie a Itálie 22, extrémem je Finsko, kde neexistují centrální laboratoře, analýza se provádí prakticky v každé porodnici) [6, 7]. Je nasnadě, že ve státech s menším počtem laboratoří se nové (= drahé) technologie NS zavádí ekonomicky i organizačně snadněji. Logistika systému může být někdy překážkou zavedení nového NS, které je možné jen po sofistikované změně systému (příkladem může být absence centrálních laboratoří ve Finsku, která brání zavedení drahých technologií, či pozdní odběr vzorků ve Velké Británii, který znehodnocuje NS, u kterých o efektivitě rozhoduje včasnost výsledku). Společným jmenovatelem pro systémy NS v Evropě je používání metody suchých kapek krve a zahrnutí minimálně fenylketonurie a kongenitální hypotyreózy do spektra vyšetřovaných chorob. Dalším společným jmenovatelem je expanzivnost – snaha o zavádění nových novorozeneckých screeningů. Odborné mezinárodní zaštítění představuje ISNS (International Society of Neonatal Screening, www.isns-neoscreening.org), která pořádá celosvětové a regionální (kontinentální) kongresy. Šesté evropské setkání této organizace je plánováno na 26.–28. dubna 2009 v Praze. ISNS zveřejnila lexikon pojmů a termínů používaných v NS.
1. Přehled pravidelně prováděných celoplošných novorozeneckých screeningů v Evropě (celkem 43 států včetně Turecka, Skotsko a Wales počítány samostatně). 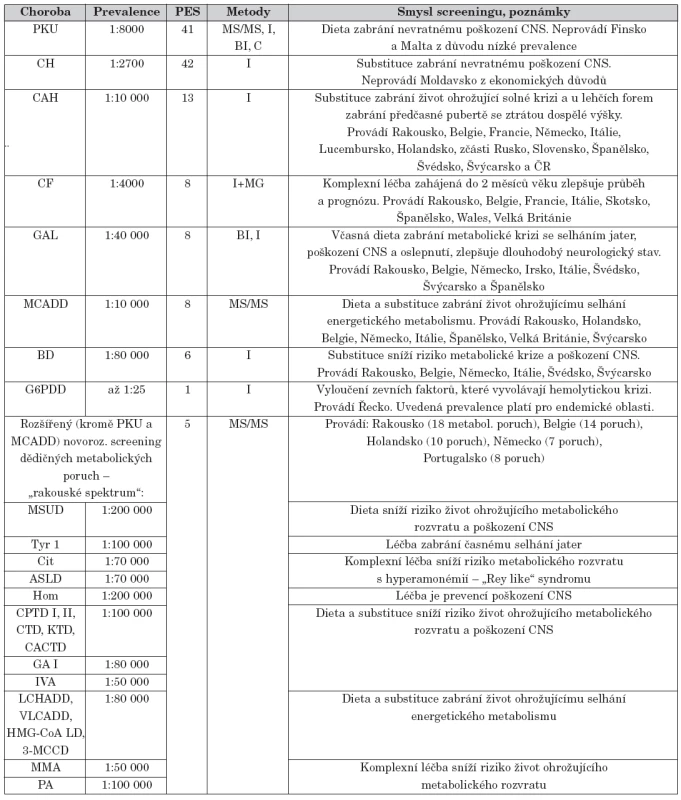
Vysvětlivky: PES = počet evropských států provádějících daný screening; PKU = fenylketonurie; CH = kongenitální hypotyreóza; CAH = kongenitální adrenální hyperplazie; CF = cystická fibróza; GAL = galaktosémie; MCADD = deficit dehydrogenázy „medium-chain acyl-CoA“; BD = deficit biotinidázy; G6PDD = deficit glukózo-6-fosfát dehydrogenázy; MSUD = nemoc javorového sirupu; Tyr I = tyrozinémie I. typu; Cit = citrulinémie; ASLD = deficit lyázy argininsukcinátu; Hom = homocystinurie; CPTD I, II = deficit karnitin palmitoyltransferázy I, II; CTD = deficit transportéru karnitinu; KTD = deficit ketothiolázy; CACTD = deficit karnitin-acylkarnitintranslokázy; GA I = glutarová acidurie I. typu; IVA = izovalerová acidurie; LCHADD = deficit dehydrogenázy „long-chain acylCoA“; VLCADD = deficit dehydrogenázy „very long-chain acylCoA“; HMG-CoA LD = deficit lyázy „3-hydroxy-3-methylglutaryl-CoA“; 3-MCCD = deficit karboxylázy „3-methylcrotonyl-CoA“; MMA = metylmalonová acidurie; PA = propionová acidurie; MS/MS = tandemová hmotnostní spektrometrie; I = imunoesej (fluoro-, enzymo- či radio-); BI = inhibice růstu bakterií; C = chromatografie; MG = molekulárně genetické vyšetření V tabulce 2 je přehled a vysvětlení několika základních pojmů, které jsou použity v tomto článku, bez jejich definice si nelze učinit představu o problematice NS.
2. Vysvětlení základních pojmů používaných v novorozeneckém screeningu. 
Historie a principy novorozeneckého screeningu
Zakladatelem NS je profesor Robert Guthrie (1916–1995) z univerzity v Buffalu ve státě New York, USA. V roce 1963 vynalezl [8] a následně i zavedl do celoplošného provádění jednoduchou, levnou a spolehlivou metodu (založenou na inhibici růstu bakterií) pro novorozenecký screening fenylketonurie [9].
Zahájení celoplošného screeningu si vyžádalo formulování obecných pravidel pro jeho provádění, což učinili zadáním Světové zdravotnické organizace Wilson a Junger v roce 1968 [10]. Předpoklady pro zahájení celoplošného screeningu lze shrnout podle ISNS do následujících bodů [7, 10]:
- Vyšetřovaná choroba musí být jasně definována – musí existovat jednoznačný diagnostický nástroj k potvrzení či vyloučení choroby.
- Choroba představuje významný zdravotně sociální problém. Jak individuálně, tak i celospolečensky.
- Choroba je častá, má v dané populaci určitou incidenci. Hranice incidence je relativní a je ovlivněna především klinickou závažností choroby, možnostmi léčby a faktory ekonomickými. Ve vyspělých zemích lze v současné době spatřovat tuto hranici v incidenci 1 : 50 000 až 100 000.
- Zachycení choroby v jejím časném, presymptomatickém stadiu umožňuje taková terapeutická opatření, která zásadním způsobem pozitivně ovlivní průběh choroby, či dokonce sníží její mortalitu. Terapeutická opatření musí být dostupná a zajistitelná pro všechny zachycené jedince. Péče o pacienty je většinou soustřeďována do specializovaných center.
- Existuje obecně uznaný screeningový test. Tj. choroba je v preklinickém stadiu detekovatelná obecně (odbornou veřejností) uznaným laboratorním testem v suché kapce krve s dostatečnou senzitivitou a specificitou.
Hlavními měřítky věrohodnosti screeningového testu jsou:
- Obecně přijatá hranice negativity (“cut-off”) a pozitivity.
- Akceptovatelná zátěž zdravé populace jednak frekvencí opakování odběru NS pro nejasný výsledek – (“recall rate“) a především falešnou pozitivitou (PPV). Při zvažování hraje klíčovou roli, co falešná pozitivita u té které choroby pro zdravého jedince konkrétně představuje.
- Akceptovatelná falešná negativita.
- Společnost je schopna zajistit provádění laboratorního testu u všech svých novorozenců po stránce organizační a ekonomické.
- Přínos NS má být pozitivní vůči jeho nákladům (pozitivní poměr „benefit/costs“).
- Zavedený NS je kontinuální proces, jeho věrohodnost a účinnost – efektivita musí být trvale sledovány a vyhodnocovány.
Je patrné, že řada uvedených tvrzení je relativní, závislá především na ekonomické síle společnosti. Technologický pokrok přináší i některé nové etické otázky v NS, na které není zatím jednoznačná konsensuální odpověď – např. zda důvodem k NS může být pouhá znalost diagnózy – z důvodů informované reprodukce či ušetření diagnostického martyria. Rozhodování o některých nových NS je značně komplikované a musí být učiněno až po proběhlé pilotní studii v logistice systému NS konkrétního státu. S narůstající praktickou zkušeností s NS nabývá pro nás na stále větším významu bod akceptovatelné zátěže zdravé části populace opakováním screeningu – „recall rate“ a především falešnou pozitivitou. Jedná se o řešení etického dilematu, do jaké míry jsme oprávněni zatížit zdravé novorozence a jejich rodiny ve jménu záchytu skutečně nemocného jedince. Problém je o to palčivější, že uvedené jevy jsou kumulativní s každou nově zařazenou chorobou do spektra NS. Důkazem probíhající diskuse o tomto etickém problému je řada publikací [11–16]. Komunikace s rodinami s falešnou pozitivitou je časově a psychicky velmi náročná. Cílem je dosažení správného pochopení situace a přístupu k problému, aby se minimalizovala stigmatizace nové rodiny. Velmi nápomocná je předcházející adekvátní informovanost rodičů o NS, nejlépe písemně formou letáku, který bohužel v logistice NS v ČR stále chybí.
Pravidelně prováděné celoplošné novorozenecké screeningy
V ČR je zmíněným metodickým pokynem [5] ustanoven a z prostředků veřejného zdravotního pojištění hrazen NS fenylketonurie, kongenitální hypotyreózy a kongenitální adrenální hyperplazie. Přehled laboratoří začleněných do systému NS je uveden v tabulce 3 i se základními informacemi o procentuálním pokrytí populace novorozenců, spádové oblasti, metodikách a parametrech „cut-off“ a pozitivních nálezů.
3. Přehled laboratoří novorozeneckého screeningu v České republice, jejich spádové oblasti, používané metodiky a hodnot „cut-off“ a pozitivních nálezů. 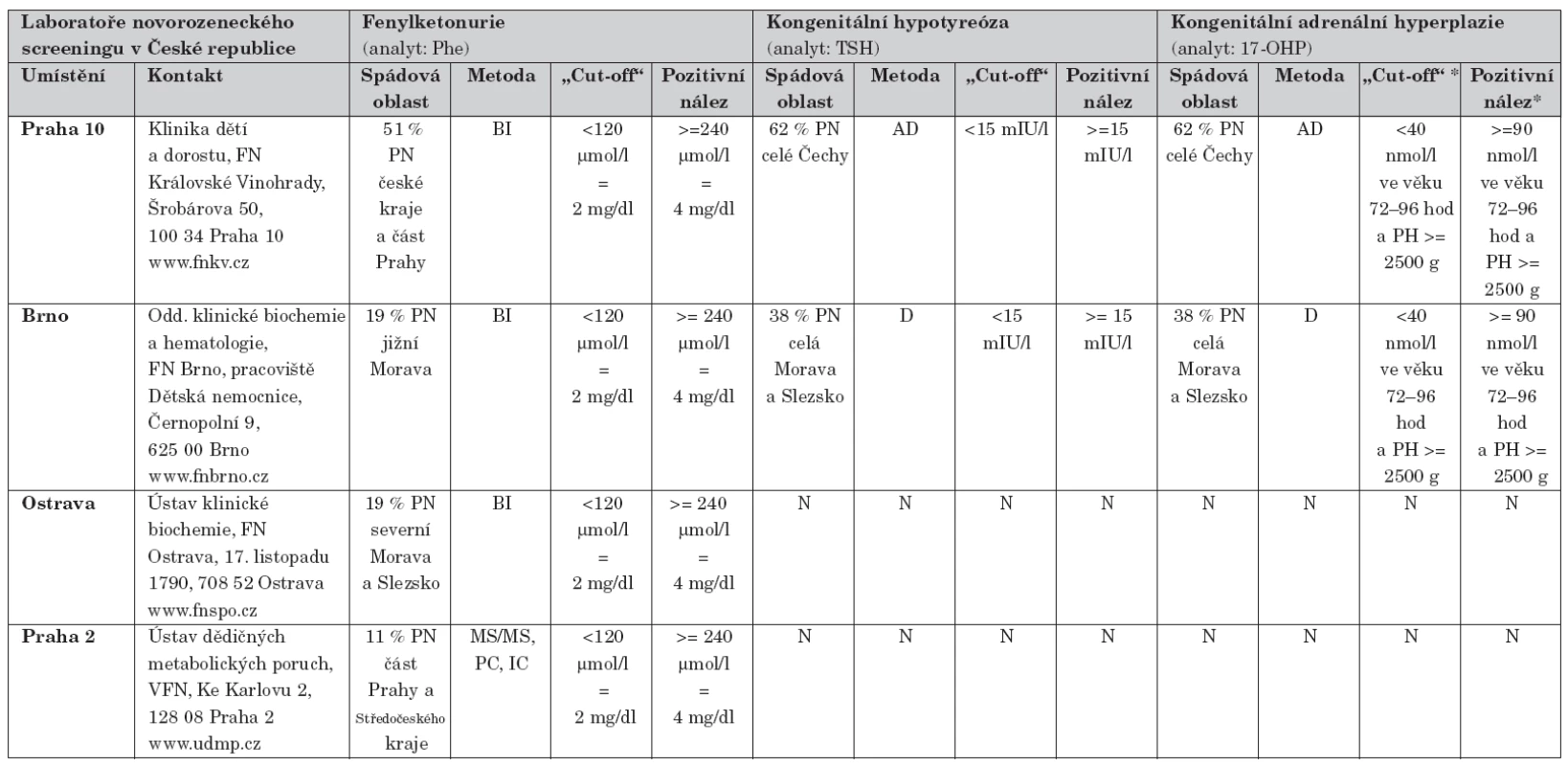
Vysvětlivky: Phe = fenylalanin, TSH = tyreotropní hormon, 17-OHP = 17- hydroxyprogesteron, PN = populace všech novorozenců v České republice, BI = semikvantitativní metoda (tzv. Guthrieho) s inhibicí růstu bakterií, MS/MS = tandemová hmotnostní spektrometrie, PC = papírová chromatografie, IC = iontoměničová chromatografie, AD = fluoroimunoesej autoDelfia®, D = fluoroimunoesej Delfia®, N = laboratoř neprovádí; * hodnoty „cut-off“ a pozitivních nálezů 17-OHP jsou významně závislé na stupni zralosti novorozence (resp. porodní hmotnosti) a věku při odběru vzorku NS fenylketonurie
NS fenylketonurie je založen na měření koncentrace fenylalaninu (Phe) v suché kapce krve (semikvantitativně – mikrobiologickým bakteriálně inhibičním testem, tzv. Guthrieho metodou, nebo kvantitativně – chromatograficky, fluoro - či enzymo-imunoesejí, či tandemovou hmotnostní spektrometrií). Ve světě nastal jeho rozvoj po roce 1965. Hlavním smyslem včasné léčby je dietními opatřeními udržet normální hladinu Phe v plazmě a zabránit tím ireverzibilnímu poškození CNS.
V ČR je prováděn od roku 1970 [17, 18]. V tabulce 4 je uveden přehled výsledků NS fenylketonurie v ČR za pětileté období 2002–2006. Kalkulované náklady NS na jednoho diagnostikovaného pacienta činily 86 tisíc Kč.

4. Přehled výsledků novorozeneckého screeningu fenylketonurie. 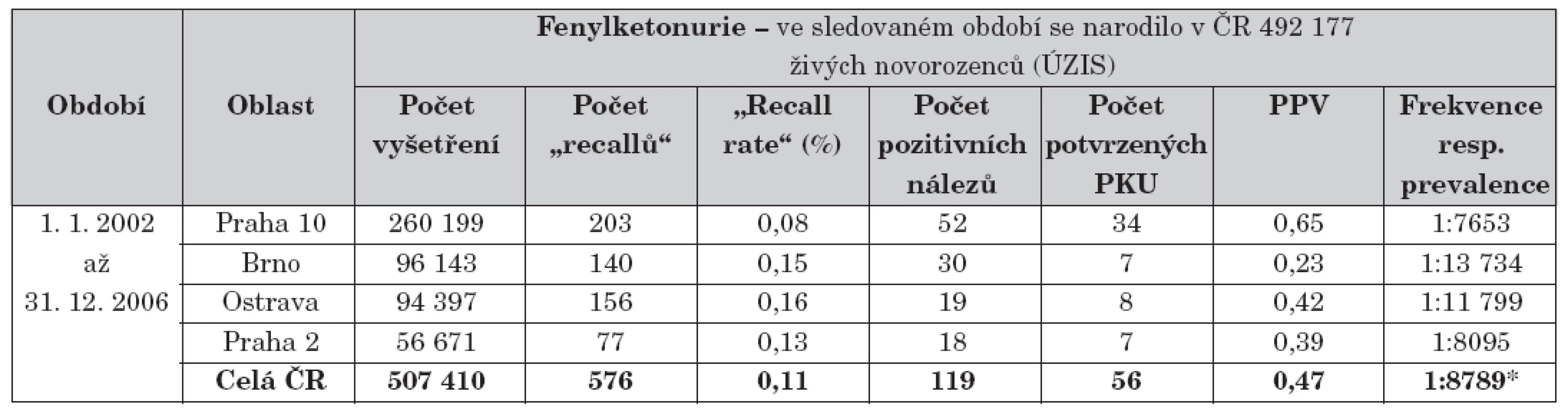
Vysvětlivky: ÚZIS = Ústav zdravotnických informací a statistiky ČR; PKU = klasická forma fenylketonurie; PPV = pozitivní prediktivní hodnota; frekvence PKU = vztaženo na počet vyšetření v dané oblasti; * prevalence PKU v ČR = vztaženo na počet živě narozených podle ÚZIS Pozn.: Pozitivní nálezy vedle skutečných klasických PKU zčásti zahrnují i tranzitorní hyperfenylalaninémie, kde přechodná dietní léčba je rovněž přínosem. Počet provedených vyšetření převyšuje počet živě narozených podle ÚZIS z důvodu částečného započítání povinného druhého screeningu u novorozenců s porodní hmotností 2500 g a méně. NS kongenitální hypotyreózy
NS kongenitální hypotyreózy je založen na měření koncentrace tyroxinu (T4) a/nebo tyreotropního hormonu (TSH) v suché kapce krve (radio-, fluoro - či enzymo - imunoesejí). Ve světě se začal zavádět ve druhé polovině 70. let 20. století [19, 20, 21]. Hlavním smyslem je substitucí hormonů štítné žlázy zabránit ireverzibilnímu poškození CNS.
V ČR je celoplošně prováděn od roku 1985 [22]. V tabulce 5 je uveden přehled výsledků. Náklady na jednoho zachyceného pacienta představovaly 278 tisíc Kč.
5. Přehled výsledků novorozeneckého screeningu kongenitální hypotyreózy. 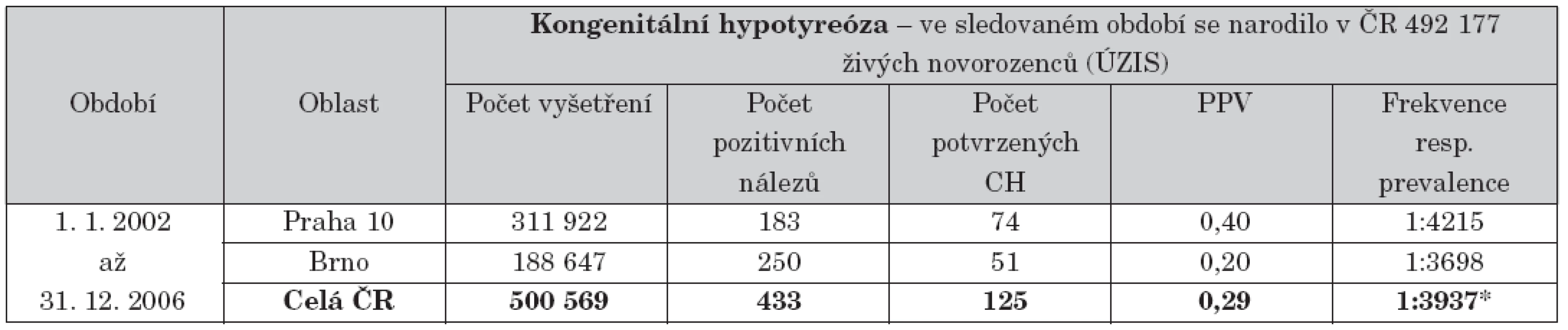
Vysvětlivky: ÚZIS = Ústav zdravotnických informací a statistiky ČR; CH = permanentní kongenitální hypotyreóza; PPV = pozitivní prediktivní hodnota; frekvence CH = vztaženo na počet vyšetření v dané oblasti; * prevalence CH v ČR = vztaženo na počet živě narozených podle ÚZIS Pozn.: V případě novorozeneckého screeningu CH neexistuje opakování odběru suché kapky krve pro nejasný výsledek („recall“ a „recall rate“). Všechny pozitivní nálezy nad „cut-off“ jsou předávány klinickým pracovištím k potvrzení či vyloučení diagnózy. Pozitivní nálezy vedle skutečných permanentních hypotyreóz z části zahrnují i tranzitorní hypotyreózy, kde přechodná substituční léčba je rovněž přínosem. Počet provedených vyšetření převyšuje počet živě narozených podle ÚZIS z důvodu zčásti započítaného povinného druhého scree ningu u novorozenců s porodní hmotností 1500 g a méně. NS kongenitální adrenální hyperplazie
NS kongenitální adrenální hyperplazie je založen na měření koncentrace 17-hydroxyprogesteronu (17-OHP) v suché kapce krve (fluoro - či enzymo - imunoesejí). Počátky tohoto screeningu se ve světě datují od konce 70. let minulého století [23]. S cílem snížit „recall rate“ (tj. zvýšit specificitu) se recentně objevují snahy o zavedení druhého stupně – analýzy celého steroidního spektra pomocí tandemové hmotnostní spektrometrie ve spojení s kapalinovou chromatografií ve vzorcích s koncentrací 17-OHP mezi „cut off“ a pozitivní hodnotou [24]. Hlavním smyslem screeningu je substitucí hormonů nadledvin zabránit život ohrožujícímu metabolickému rozvratu a rozvoji předčasné puberty.
Na základě pilotní studie [25] je celoplošně prováděn od roku 2006. Tabulka 6 shrnuje průběžné výsledky tohoto NS, náklady na zachycení jednoho pacienta činily 1 388 tisíc Kč.
6. Přehled průběžných výsledků novorozeneckého screeningu kongenitální adrenální hyperplazie od jeho celoplošného zahájení v roce 2006. 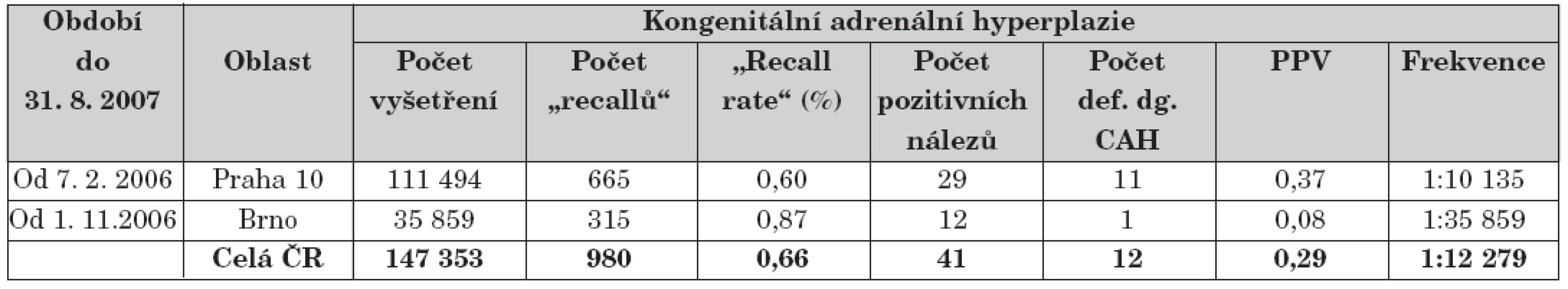
Vysvětlivky: CAH = kongenitální adrenální hyperplazie; PPV = pozitivní prediktivní hodnota; frekvence = vztaženo na počet vyšetření v dané oblasti Pro přehled screeningových programů v jiných evropských státech uvádíme tabulku 1 vytvořenou na základě různých zdrojů [6, 26–31]. V tabulce jsou uvedeny pouze pravidelně prováděné celoplošné NS, které podléhají vývoji, změny či neúplnost informací jsou proto možné.
V systému NS v ČR pociťujeme aktuálně následující hlavní problémy, které by měly být urychleně vyřešeny.
V preanalytické části:
- Absence tištěného informačního letáku o systému NS pro rodiče. Leták by byl nápomocný všem novorozeneckým pracovištím při získávání informovaného souhlasu k odběru suché kapky krve a i pro pochopení rodin event. potřeby opakování screeningu či dokonce falešné pozitivity. Návrh textu letáku je uveden v tabulce 7 a lze ho najít i na internetu (www.fnkv.cz).
- Nepoužívání speciálních odběrových kopíček (lancet), které svou konstrukcí na základě neurofyziologické teorie brány činí odběr bezbolestným s poskytnutím dostatečného množství kapilární krve.
- V první polovině r. 2007 proběhlé skokové zdražení (z 5 na 30 Kč) screeningových kartiček výrobcem.
7. Návrh textu informačního letáku o novorozeneckém screeningu pro rodiče. 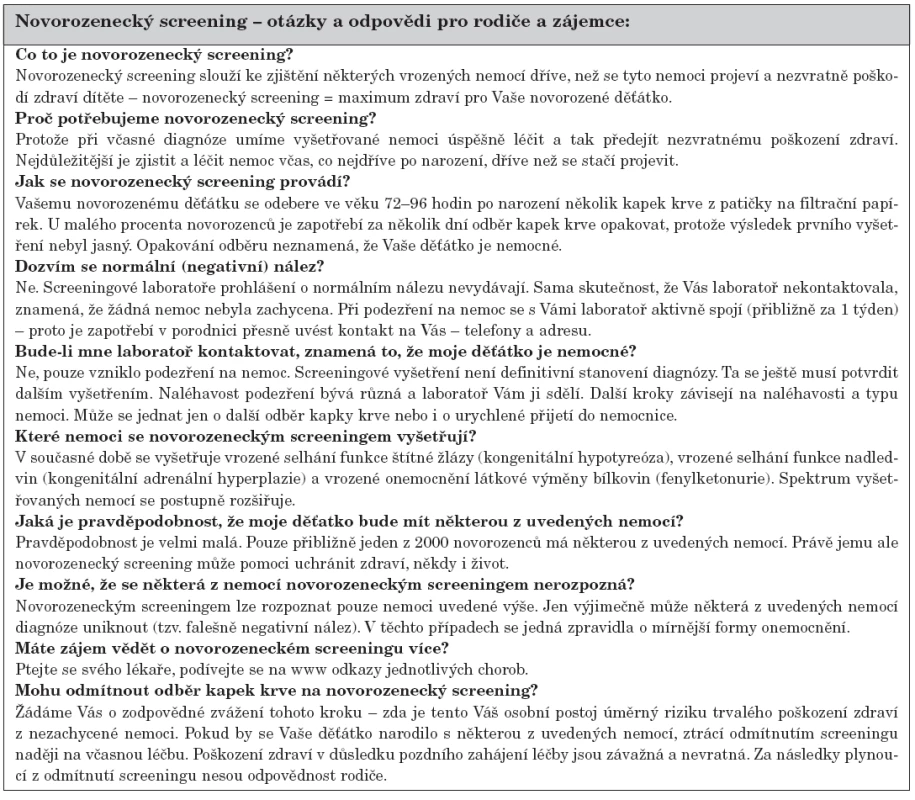
Řešení uvedených problémů je podmíněno ekonomicky. Snažíme se navrhnout a zavést nový výkon „Odběr novorozeneckého screeningu“ pro neonatologická pracoviště a pediatry, který by finančně pokryl všechny náklady s odběrem NS spojené. V ideálním případě by měl být distribuován „kit novorozeneckého screeningu“ s letákem, odběrovými pomůckami, návodem k odběru, screeningovou kartičkou a obálkou pro odeslání do spádové laboratoře.
V analytické části:
- Z hlediska imunoesejí (TSH a 17-OHP) není významný problém.
- Semikvantitavní bakteriálně inhibiční metoda pro měření PHE není sice z hlediska NS zdiskreditovaná, ale je „historicky přežitá“ a ve většině státu již nahrazena metodami kvantitativními.
- Měl by být zaveden jednoznačný systém zevní kontroly kvality a certifikace (podle normy ISO) laboratoří [32, 33]. Tento způsob zabezpečení validity výsledků a sdílení spoluodpovědnosti za ně je ekonomicky náročný, ale do budoucna nutný.
V postanalytické části:
- Dlouhodobé vyhodnocování NS. Částečně saturováno tímto sdělením a mělo by se stát do budoucna pravidlem.
- Zdánlivě okrajovým problémem je způsob skladování a retrospektivní použití suchých kapek krve. Měla by být přijata jednoznačná pravidla [34].
Pilotní novorozenecké screeningy
Díky vědeckému a technologickému pokroku se značně navýšil počet chorob, které je možno diagnostikovat ze suché kapky krve na filtračním papírku. V současné době je to několik desítek chorob. Rozhodnutí o zavedení nového NS do jeho pravidelného celoplošného provádění se stává komplikovaným a musí být založeno na základě vyhodnocení jeho potřebnosti, proveditelnosti, účinnosti a zátěže zdravé části populace v podmínkách daného státu. Za tímto účelem probíhají pilotní studie.
V ČR probíhají pilotní studie cystické fibrózy a rozšířeného NS dědičných metabolických poruch pomocí tandemové hmotnostní spektrometrie. V některých evropských státech se již tyto NS pravidelně provádí – tabulka 1. Jejich event. celoplošné pravidelné provádění v ČR je předmětem aktuálního jednání odborných společností, MZ ČR a pojišťoven. Rozhodnutí lze očekávat v brzké době.
NS cystické fibrózy (CF) je založen na stanovení koncentrace imunoreaktivního trypsinogenu (IRT) pomocí imunoeseje. IRT je dostatečně senzitivní, ale málo specifický, proto se provádí ještě druhý stupeň screeningu – stanovení mutací genu pro CF (gen CFTR) přímo v těch kapkách krve, kde byla zjištěna hladina IRT nad „cut-off“ [35]. Smyslem NS je včasné (do 2 měsíců věku) zahájení léčby a tím významné zlepšení průběhu a prognózy choroby a i snížení nákladů na léčbu komplikací vzniklých z pozdní diagnostiky [36–38]. Česká pilotní studie již byla ukončena [39].
Rozšíření NS dědičných metabolických poruch (DMP) pomocí tandemové hmotnostní spektrometrie je založeno na komplexním rozboru celého spektra analytů rozdělených podle hmotového čísla jedním analytickým úkonem pomocí tandemové hmotnostní spektrometrie (MS/MS). Spektrum analytů umožňuje zachytit až několik desítek DMP. Nejčastěji se MS/MS používá k detekci DMP ze skupiny aminoacidopatií včetně fenylketonurie, poruch β-oxidace mastných kyselin, organických acidurií, poruch cyklu močoviny, peroxizomálních a lyzozomálních onemocnění aj. [29, 40–43]. Hlavním smyslem je zachytit takové choroby, u kterých lze terapeutickými postupy předejít život ohrožujícímu energetickému či metabolickému rozvratu a/nebo dlouhodobému poškození zdraví (především CNS). V ČR probíhá pilotní studie v Ústavu dědičných metabolických poruch Všeobecné fakultní nemocnice, Praha [44, 45].
Pro dokreslení přehledu NS uvádíme některé další choroby, jejichž screeningové programy jsou v zahraničí zavedeny či zvažovány v pilotních studiích: galaktosémie, deficit biotinidázy, deficit glukózo-6-fosfát dehydrogenázy, srpkovitá anémie, syndrom prodlouženého QT intervalu, Krabbeho choroba, Fabryho choroba, mukopolysacharidózy, těžká kombinovaná imunodeficience, riziko rozvoje diabetes mellitus I. typu, vrozené myopatie, AIDS, toxoplazmóza, hepatitida C aj.
Tím však nejsou možnosti NS vyčerpány. Začínají se uplatňovat nové technologie typu multiplexních mikropolí „microarrays“ pro rozbor analytu a/nebo DNA. Jednoduchost použití těchto nástrojů naznačuje další možný směr vývoje NS – diagnostiku přímo u lůžka novorozence [46–49]. Není nereálný ani NS z krve odebrané matce před porodem po izolaci DNA plodu.
Závěr
Je patrné, že díky technologickému pokroku podléhají systémy NS neustálému vývoji a změnám. Rychlost změn se zvyšuje. To lze dokumentovat jak expanzí počtu screenovaných chorob, tak i pouhým porovnáním počtu publikací na téma NS v letech 1980–1986 (280 titulů), 1990–1996 (1212 titulů) a 2000–2006 (2626 titulů). Tento pokrok generuje i nové, především etické otázky. Základní smysl novorozeneckého screeningu – pomoc včasným záchytem choroby postiženým novorozencům – zůstává beze změny.
Poděkování
Naše poděkování za poskytnutí použitých dat a za spolupráci při vzniku tohoto přehledu patří spolupracovníkům v novorozeneckých screeningových laboratořích v ČR:
Ing. P. Kračmar, CSc., Klinika dětí a dorostu FN Královské Vinohrady, Praha 10; Prim. MUDr. S. Šťastná, CSc., Ing. P. Chrastina, Ústav dědičných metabolických poruch, VFN, Praha 2; MUDr. H. Vinohradská, FN Brno, pracoviště Dětská nemocnice, Brno; RNDr. Z. Švagera, PhD., Ústav klinické biochemie FN, Ostrava.
Práce vznikla za podpory VZ MSM 0021620814.
Doc. MUDr. Felix Votava, PhD.
Klinika dětí a dorostu UK 3. LF
FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: votava@fnkv.cz
Sources
1. Magnusson G, Persson U. Screening for congenital cataracts: a cost-consequence analysis of eye examination at maternity wards in comparison to well-baby clinics. Acta Paediatr. 2005;94(8): 1089–1095.
2. Magnusson G, Thiringer K. Screening for congenital cataract is best done at the obstetrical department. Complementary examination at the child health center is recommended. Lakartidningen. 2002;99(7): 620–625.
3. Fitzpatrick E, Durieux-Smith A, Eriks-Brophy A, et al. The impact of newborn hearing screening on communication development. J. Med. Screen. 2007;14(3): 123–131.
4. Scott JE, Lee RE, Hunter EW, et al. Ultrasound screening of newborn urinary tract. Lancet 1991;338(8782–8783): 1571–1573.
5. Zajištění celoplošného novorozeneckého laboratorního screeningu a následné péče. Věstník MZ ČR, VII, 2003;částka 7 : 14–24.
6. Loeber JG. Neonatal screening in Europe; the situation in 2004. J. Inherit. Metab. Dis. 2007;30(4):430–438.
7. Autti-Ramo I, Makela M, Sintonen H, et al. Expanding screening for rare metabolic disease in the newborn: an analysis of costs, effect and ethical consequences for decision-making in Finland. Acta Paediatr. 2005;94(8): 1126–1136.
8. Guthrie R, Susi A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics 1963;32 : 338–343.
9. Guthrie R. Screening for phenylketonuria. Triangle 1969;9(3): 104–109.
10. Wilson JMC, Jungner G: Principles and Practice of Screening for Disease. Publ. Health Pap. 1968;WHO 34.
11. Tarini BA, Christakis DA, Welch HG. State newborn screening in the tandem mass spectrometry era: more tests, more false-positive results. Pediatrics 2006;118(2):448–456.
12. Hewlett J, Waisbren SE. A review of the psychosocial effects of false-positive results on parents and current communication practices in newborn screening. J. Inherit. Metab. Dis. 2006;677–682. Epub 2006 Aug 17.
13. Gurian EA, Kinnamon DD, Henry JJ, et al. Expanded newborn screening for biochemical disorders: the effect of a false-positive result. Pediatrics 2006;117(6): 1915–1921.
14. Waisbren SE, Albers S, Amato S, et al. Effect of expanded newborn screening for biochemical genetic disorders on child outcomes and parental stress. JAMA 2003;290(19): 2564–2572.
15. Giannetta T. Oh, no! The newborn screen is positive! J. Pediatr. Health Care 2007;21(1): 69–71.
16. Hewlett J, Waisbren SE. A review of the psychosocial effects of false-positive results on parents and current communication practices in newborn screening. J. Inherit. Metab. Dis. 2006;29(5):677–682.
17. Blehová B, Pažoutová M, Bloudková D, et al. Zhodnocení screeningu fenylketonurie za šest let trvání laboratoře. Čes.-slov. Pediat. 1976;31(7): 399–400.
18. Čechák P, Hejcmanová L, Procházková D, et al. Výsledky screeningu hyperfenylalaninémií v českých zemích v letech 1970–2000. Čes.-slov. Pediat. 2001;56(11): 667–670.
19. Larsen PR, Merker A, Parlow AF. Immunoassay of human TSH using dried blood samples. J. Clin. Endocrinol. Metab. 1976;42(5): 987–990.
20. Irie M, Enomoto K, Enomoto H, et al. Microdetermination of TSH in dried blood spot — its use in the mass-screening for congenital or juvenile primary hypothyroidism. Nippon Naibunpi Gakkai Zasshi 1976;52(3): 243–247.
21. Larsen PR, Merker A, Parlow AF. Immunoassay of human TSH using dried blood samples. J. Clin. Endocrinol. Metab. 1976;42(5): 987–990.
22. Hníková O, Kračmar P, Zelenka Z, et al. Screening of congenital hypothyroidism in newborns in Bohemia and Moravia. Endocrinol. Exp. 1989;23(2): 117–123.
23. Pang S, Hotchkiss J, Drash AL, et al. Microfilter paper method for 17 alpha-hydroxyprogesterone radioimmunoassay: its application for rapid screening for congenital adrenal hyperplasia. J. Clin. Endocrinol. Metab. 1977;45(5): 1003–1008.
24. Torresani T, Biason-Lauber A. Congenital adrenal hyperplasia: diagnostic advances. J. Inherit. Metab. Dis. 2007;30(4): 563–575.
25. Votava F, Kračmar P, Rákosníková V, et al. Novorozenecký screening kongenitální adrenální hyperplazie v České republice – výsledky roční pilotní studie u chlapců. Čes.-slov. Pediat. 2002;57(12): 690–696.
26. Riepe FG, Sippell WG. Recent advances in diagnosis, treatment, and outcome of congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Rev. Endocr. Metab. Disord. 2007; Sept21: [Epub ahead of print].
27. Hoffmann G, Pollitt R, Torresani T, et al. Focus on neonatal screening. J. Inherit. Metab. Dis. 2007;30(4): 417.
28. Howell RR, Engelson G. Structures for clinical follow-up: newborn screening. J. Inherit. Metab. Dis. 2007;30(4): 600–605.
29. Bodamer OA, Hoffmann GF, Lindner M. Expanded newborn screening in Europe 2007. J. Inherit. Metab. Dis. 2007;30(4): 439–444.
30. van der Hilst CS, Derks TG, Reijngoud DJ, et al. Cost-effectiveness of neonatal screening for medium chain acyl-CoA dehydrogenase deficiency: the homogeneous population of The Netherlands. J. Pediatr. 2007;151(2): 115–120.
31. Cipriano LE, Rupar CA, Zaric GS. The cost-effectiveness of expanding newborn screening for up to 21 inherited metabolic disorders using tandem mass spectrometry: results from a decision-analytic model. Value Health 2007;10(2): 83–97.
32. Webster D. Quality performance of newborn screening systems: strategies for improvement. J. Inherit. Metab. Dis. 2007;30(4): 576–584.
33. Elvers LH, Loeber JG, Dhondt JL, et al. First ISNS Reference Preparation for Neonatal Screening for thyrotropin, phenylalanine and 17alpha-hydroxyprogesterone in blood spots. J. Inherit. Metab. Dis. 2007;30(4): 609.
34. Olney RS, Moore CA, Ojodu JA, et al. Storage and use of residual dried blood spots from state newborn screening programs. J. Pediatr. 2006;148(5): 618–622.
35. Wilcken B. Newborn screening for cystic fibrosis: techniques and strategies. J. Inherit. Metab. Dis. 2007;30(4): 537–543.
36. Sims EJ, Clark A, McCormick J, et al. United Kingdom Cystic Fibrosis Database Steering Committee: Cystic fibrosis diagnosed after 2 months of age leads to worse outcomes and requires more therapy. Pediatrics 2007;119(1): 19–28.
37. Sims EJ, Mugford M, Clark A, et al. Cystic Fibrosis Database Steering Committee: Economic implications of newborn screening for cystic fibrosis: a cost of illness retrospective cohort study. Lancet 2007;369(9568): 1187–1195.
38. Comeau AM, Accurso FJ, White TB, et al. Guidelines for implementation of cystic fibrosis newborn screening programs: Cystic Fibrosis Foundation workshop report. Pediatrics 2007;119(2): 495–518.
39. Holubová A, Balaščáková M, Skalická V, et al. Novorozenecký screening cystické fibrózy v České republice: závěry pilotní studie. Čes.-slov. Pediat. 2007;62(4): 187–195.
40. Millington DS, Kodo N, Norwood DL, et al. Tandem mass spectrometry: a new method for acylcarnitine profiling with potential for neonatal screening for inborn errors of metabolism. J. Inherit. Metab. Dis. 1990;13(3): 321–324.
41. Chace DH, Millington DS, Terada N, et al. Rapid diagnosis of phenylketonuria by quantitative analysis for phenylalanine and tyrosine in neonatal blood spots by tandem mass spectrometry. Clin. Chem. 1993;39(1): 66–71.
42. Rashed MS, Ozand PT, Bucknall MP, et al. Diagnosis of inborn errors of metabolism from blood spots by acylcarnitines and amino acids profiling using automated electrospray tandem mass spectrometry. Pediatr. Res. 1995;38(3): 324–331.
43. Turecek F, Scott CR, Gelb MH. Tandem mass spectrometry in the detection of inborn errors of metabolism for newborn screening. Methods Mol. Biol. 2007;359 : 143–157.
44. Chrastina P, Šťastná S, Myšková H, Zeman J. Tandemová hmotnostní spektrometrie – budoucnost novorozeneckého screeningu dědičných metabolických poruch. Čes.-slov. Pediat. 2003;7 : 464–467.
45. Chrastina P, Košťálová E, Paulová H, et al. Experience with screening by tandem mass spectrometry in the Czech Republic. The 5th European ISNS Congresss in Newborn Screening, June 10–12th 2007, Reykjavík, Island, Abstracts Book, p. 41.
46. Dhondt JL. Neonatal screening: from the ‘Guthrie age’ to the ‘genetic age’. J. Inherit. Metab. Dis. 2007;30(4): 418–422.
47. Alexander D, van Dyck PC. A vision of the future of newborn screening. Pediatrics 2006;117(5): S350–S354.
48. Green NS, Pass KA. Neonatal screening by DNA microarray: spots and chips. Nat. Rev. Genet. 2005;6(2): 147–151.
49. Tachibana S, Suzuki M, Asano Y. Application of an enzyme chip to the microquantification of l-phenylalanine. Anal. Biochem. 2006;359(1): 72–78.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2008 Issue 2-
All articles in this issue
- Associate Professor Věra Vávrová and History of Cystic Fibrosis
- Current Diagnostic Strategies and Overview of Preimplantation, Prenatal and Postnatal DNA Diagnostics of Cystic Fibrosis in the Czech Republic
- Modern Management of Cystic Fibrosis and Its Influence upon General Health and Survival of Czech Patients
- Role of Novel Microbiological Diagnostics in the Care for Patients with Cystic Fibrosis
- Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
- Newborn Screening in the Czech Republic and in Europe
- Present International Projects in the Area of Diagnostics and Therapy of Cystic Fibrosis: Participation of Specialists from the Czech Republic into the Problem Solving
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Newborn Screening in the Czech Republic and in Europe
- Current Diagnostic Strategies and Overview of Preimplantation, Prenatal and Postnatal DNA Diagnostics of Cystic Fibrosis in the Czech Republic
- Associate Professor Věra Vávrová and History of Cystic Fibrosis
- Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

