-
Medical journals
- Career
Pyoderma gangrenosum u těhotné pacientky – popis případu
Authors: A. Bártlová 1; M. Salavec 1
Authors‘ workplace: Klinika nemocí kožních a pohlavních, Fakultní nemocnice a Lékařská fakulta v Hradci Králové, přednosta doc. MUDr. Miloslav Salavec, CSc.
Published in: Čes-slov Derm, 95, 2020, No. 6, p. 212-217
Category: Case Reports
Overview
Autoři popisují případ gravidní 34leté nemocné s potvrzenou diagnózou pyoderma gangrenosum. Systémová kortikoidní terapie nevedla k ústupu obtíží, proto byla zahájena kombinovaná imunosupresivní léčba (kortikoidy, cyklosporin A a mykofenolát-mofetil), která vedla k postupnému hojení projevů. Komplikací byl vznik gestačního a steroidního diabetu. Po roce a půl od počátku kožních potíží došlo k manifestaci ulcerózní kolitidy. Léčba infliximabem vedla k remisi pyoderma gangrenosum a ulcerózní kolitidy a k ukončení ostatní imunosupresivní léčby. Článek poskytuje přehled současných poznatků o diagnostice a možnostech terapie tohoto onemocnění.
Klíčová slova:
pyoderma gangrenosum – gravidita – kombinovaná imunosupresivní léčba – biologická terapie
ÚVOD
Pyoderma gangrenosum (PG) je relativně vzácná, chronická, neinfekční, zánětlivá, ulcerující dermatóza. Má charakteristický klinický obraz, ale nespecifický histologický nález – podle něj se řadí mezi tzv. neutrofilní dermatózy [16]. Postihuje obě pohlaví, s mírnou predominancí u žen, nejčastěji ve věkovém rozmezí 25–54 let [7]. Článek uvádí diagnostiku, průběh a terapii PG u gravidní pacientky, u které byla později diagnostikována i ulcerózní kolitida.
POPIS PŘÍPADU
V červnu 2017 byla přijata na oddělení Kliniky nemocí kožních a pohlavních 34letá pacientka pro vředy na předloktích trvající od února téhož roku. Projevy zpočátku začaly ve formě mokvavých puchýřů až nodulů, které se postupně rozpadaly v ulcerace. Pacientka byla bez alterace celkového stavu, předchozí trauma negovala. Zprvu byla léčena ve spádové kožní ambulanci, kde bylo vysloveno podezření na hlubokou mykózu, čemuž odpovídala i úvodní terapie. Osobní anamnéza byla bez pozoruhodností, léky trvale neužívala, alergie negovala, nekouřila, v rodinné anamnéze udávala revmatoidní artritidu u matky. Pacientka byla při přijetí v 15. týdnu gravidity, v minulosti absolvovala již dva spontánní předčasné porody. Při přijetí měla pacientka vředy na extenzorových stranách předloktí, vpravo velikosti 8 x 6,5 cm a vlevo 3,5 x 3 cm, spodina byla masivně pokryta žlutočernými nekrotickými hmotami, okraje byly navalité (obr. 1a, b). Dále jsme pozorovali i drobné růžové papuly a jednu drobnou ulceraci na zádech. Bylo vysloveno podezření na diagnózu pyoderma gangrenosum, provedeny byly dvě průbojníkové excize z okrajů obou ulcerací, kde podle závěru byla popisována akutní neutrofilní nekrotizující dermatóza s perivaskulární lymfoidní proliferací bez patrného aberantního fenotypu. V laboratorních výsledcích se zjistily pouze menší odchylky ve smyslu sideropenické anémie, mírná elevace zánětlivých parametrů, revmatologický screening (ASCA, ANA, ENA, RF, ANCA) vykázal pozitivitu u ANCA atypických protilátek (atypická perinukleární ANCA fluorescence s intranukleárním barvením -p-ANCA [22]), sérologie na lues byla negativní. V dalším průběhu byla doplněna imunofenotypizace z periferní krve i z kožní biopsie, která neprokázala hematologické malignity. Celková terapie kortikosteroidy byla kon-zultována s gynekologem – v úvodu jsme podali bolusy Solu-Medrolu 125 mg i. m. po 2 dny, s následným přechodem na p. o. formu kortikosteroidů (Prednison à 20 mg tbl.) v úvodní dávce 1 mg/kg/den. Lokálně jsme aplikovali obklady se superoxidovanými roztoky (Aqvitox®, Octenilin®) a zprvu antiseptické krytí (Bactigras®), následně krytí s obsahem oktenidinu a kyseliny hyaluronové (Sorelex®). Pro zlepšování klinického nálezu a hojení ulcerací kribriformní jizvou (obr. 2) byla pacientka po 19 dnech propuštěna k domácí léčbě, dávka Prednisonu byla snížena pouze minimálně (na 0,8 mg/kg/den). V 26. týdnu gravidity se u pacientky rozvinul diabetes (kombinace gestačního a steroidního) a zavedla se léčba inzulinem. V 32. týdnu gravidity porodila císařským řezem zdravou holčičku. Ve snaze snížit vysoké dávky kortikoidů byla zvážena celková terapie cyklosporinem A, ale bohužel, v prosinci 2017 se stav zkomplikoval extrémní elevací jaterních enzymů (ALT 70 µkat/l – norma do 0,83, AST 27 µkat/l – norma do 0,85) a byla diagnostikována hepatitida E. Pacientka byla hospitalizována na Klinice infekčních nemocí, stav se zvládl jaterní šetřící dietou, bez nutnosti systémové léčby, s normalizací jaterních enzymů v březnu 2018.
Image 1. Vředy při přijetí a – pravé předloktí, b – levé předloktí 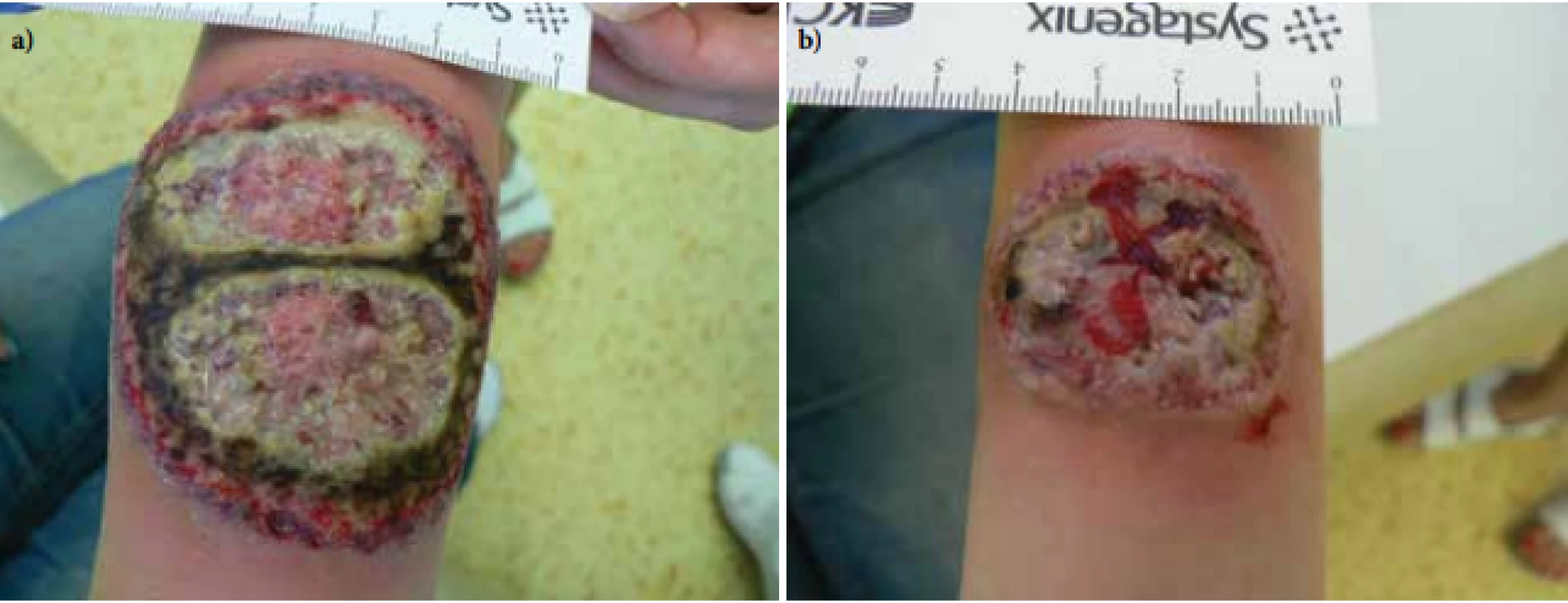
Image 2. Stav po 19 dnech hospitalizace 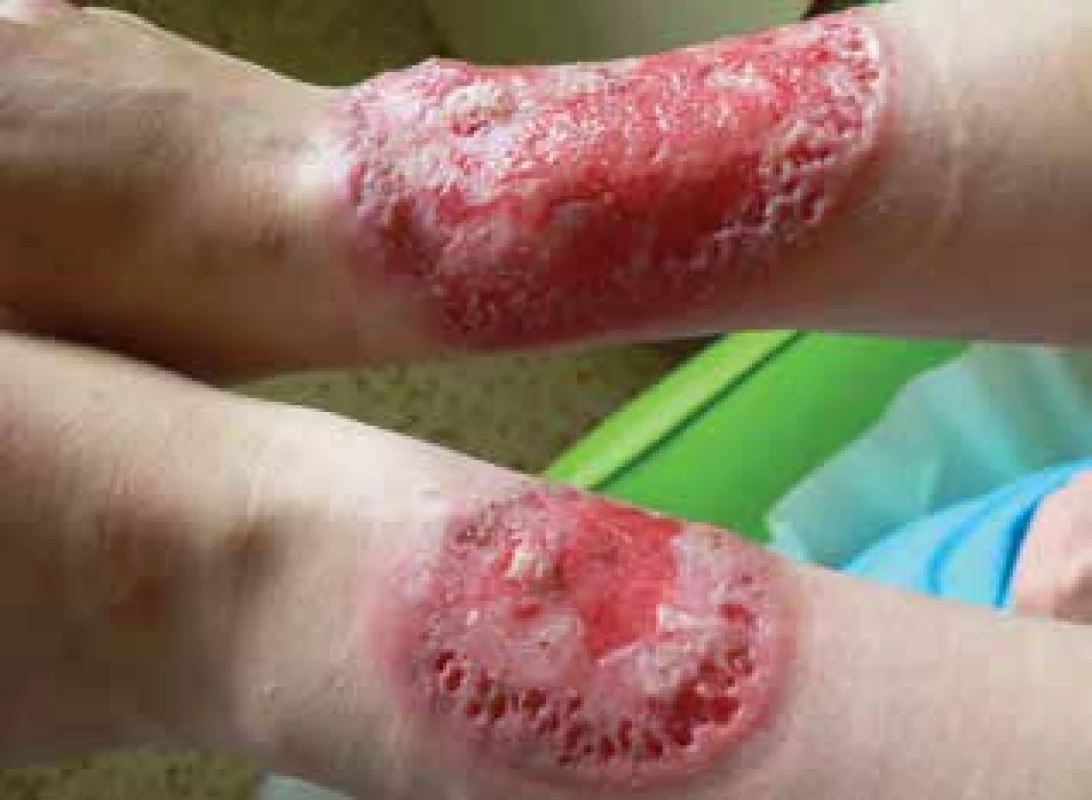
Při ambulantní kontrole v lednu 2018 byly ulcerace na předloktích téměř zhojené, dávka Prednisonu snížena na 0,5 mg/kg/den, ale při další redukci dávky se objevila tendence k zhoršování projevů. Po normalizaci jaterních enzymů v březnu 2018 byla proto zahájena léčba cyklosporinem A v dávce 5 mg/kg/den. Od července 2018 došlo k opětovnému vzniku vředů v původních jizvách na předloktích. Do kombinované léčby jsme proto přidali třetí imunosupresivum – mykofenolát mofetil v dávce 1 g/den [8]. Pacientka udávala průjmovité potíže trvající asi 2 týdny (stolice asi 5krát denně). Laboratorně přetrvávala pozitivita ANCA atypických protilátek, ASCA protilátky byly negativní, kalprotektin ze stolice byl vysoce pozitivní. Kolonoskopie prokázala těžkou kolitidu s ušetřením rekta a mírnou terminální ileitidu, podle provedených více etážových biopsií spíše charakteru ulcerózní kolitidy. Pacientka byla následně předána do péče spádového gastroenterologa, pacientce nebyla v úvodu zahajována žádná specifická léčba kolitidy. V dalším průběhu se postupně opatrně snižovaly dávky imunosupresivní terapie až na: Prednison 0,2–0,3 mg/kg/den, cyklosporin A 3–4 mg/kg/den a mykofenolát mofetil na 500 mg/den. Klinický nález se zlepšoval, přechodné zhoršení s tvorbou nové ulcerace na pravém bérci se zvládlo krátkým zvýšením dávky imunosupresiv. Kožní ulcerace se zcela zhojily v prosinci 2019 (obr. 3a, b). Gastroenterologie v lednu 2020 zahájila biologickou léčbu infliximabem (v dávce 5 mg/kg v režimu: v týdnu 0, 2, 6, a pak à 8 týdnů) s postupným úplným ukončením ostatní imunosupresivní léčby. Pacientka je dosud bez kožních projevů a pokračuje v biologické léčbě infliximabem v stejném režimu.
Image 3. Zhojení jizvou 2,5 roku od začátku léčby a – extenzorové strany předloktí, b – flexorové strany předloktí 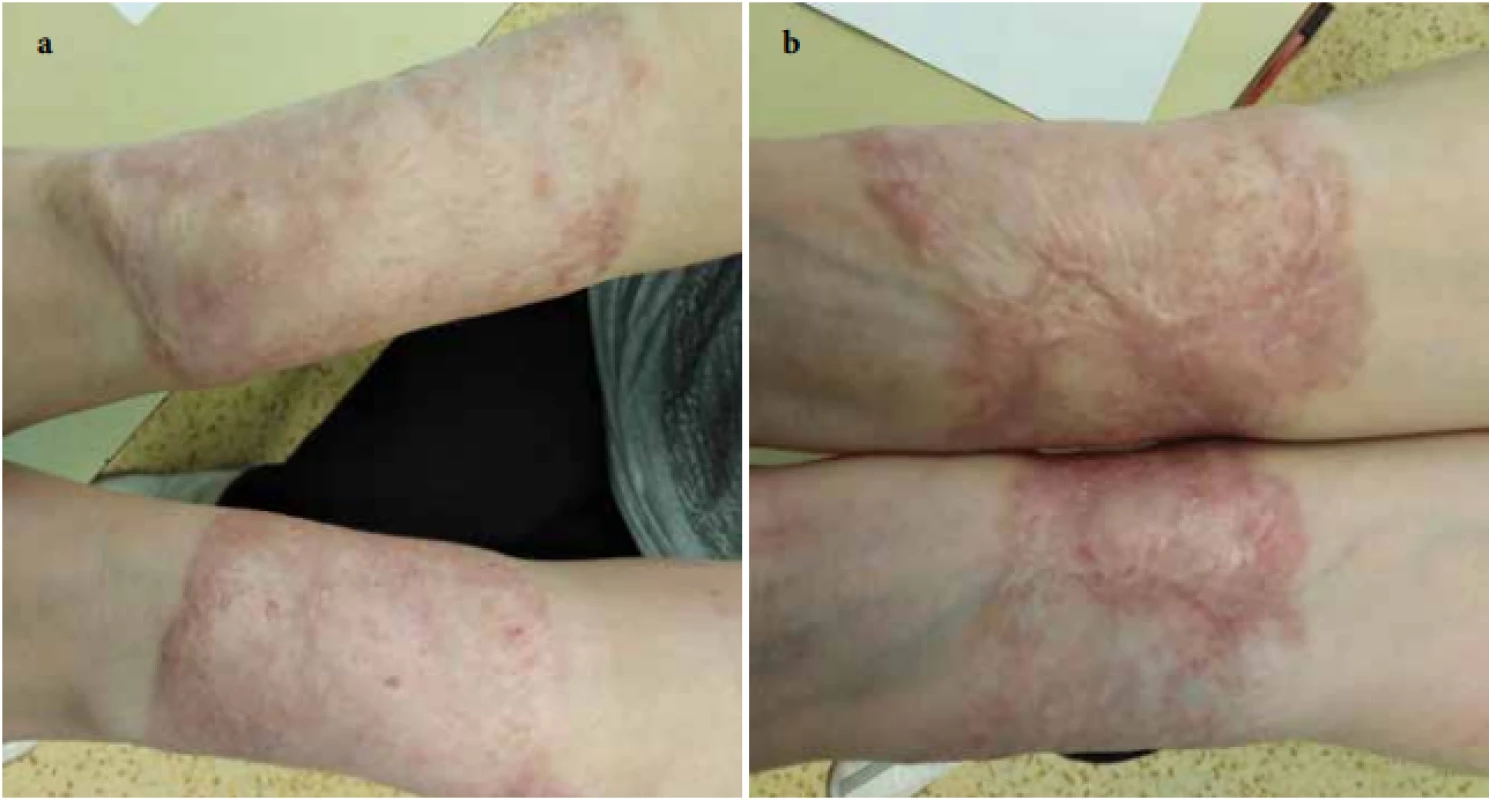
DISKUSE
Pyoderma gangrenosum je závažné kožní onemocnění, často spojené i s onemocněním systémovým.
Současný výskyt systémových onemocnění u PG se vyskytuje u 50–78 % pacientů, nejčastěji jde o nespecifické střevní záněty (morbus Crohn, colitis ulcerosa), polyartritidy (séropozitivní i séronegativní), hematologické malignity [1, 4, 7, 10, 15, 17, 21]. PG může přitom těmto nemocem předcházet, vzniknout současně nebo následně [7]. V současné době se za příčinný faktor považuje určitá imunitní dysfunkce, pro což svědčí i konkomitantní výskyt jiných imunologicky podmíněných onemocnění [5, 7]. Patogeneticky je v podezření autoinflamatorní geneze, o čemž svědčí nejen četné systémové autoimunitní/autoinflamatorní komorbidity, ale i exprese prozánětlivých cytokinů.
V diferenciální diagnostice musíme vzít v úvahu řadu onemocnění – akutní febrilní neutrofilní dermatózu (Sweetův syndrom), chancroid, kožní spinocelulární karcinom, kožní manifestaci eozinofilní granulomatózy s polyangoitidou (Churg-Strauss syndrom), kožní manifestaci sporotrichózy, verukózní karcinom, ecthyma gangrenosum, kožní příznaky morbus Behcet, hidradenitis suppurativa, syndromické formy pyoderma gangrenosum, jako je např. PAPA syndrom (pyogenní sterilní arthritis, PG a akné) nebo PASH (PG, akné a hidradenitis) a PAPASH syndrom (pyogenní arthritis, PG, akné, hidradenitis suppurativa), impetigo či kousnutí hmyzem. Onemocnění se může manifestovat i extrakutánními projevy s postižením sleziny, plicního traktu (zánětlivé infiltráty abscess-like, granulomatózní změny), očního systému (nodulární skleritis, vaskulitida sítnice), kostního systému, CNS a lymfatických uzlin [2, 3, 6, 10, 11, 13].
Klinický obraz u ulcerující formy je v úvodu charakterizován výsevem papul, papulopustul až vezikul, které následně spontánně ulcerují. Vředy jsou bolestivé, s purulentní spodinou, podminovanými okraji a fialovošedým lemem [1, 4, 7, 17, 21]. Existují další formy PG – pustulózní, bulózní, vegetující. U jednoho pacienta se můžou formy kombinovat [7]. Nemocní udávají často i bolesti kloubů a únavu. Typický je i fenomén patergie, tj. možný vznik nových ulcerací i po mírném traumatu kůže (štípnutí hmyzem, subkutánní aplikace léků u jedinců s již přítomným onemocněním; asi u 30 % nemocných) [7, 11]. Spouštěčem mohou být i léky (inhibitory tyrozin kinázy, inhibitory epidermálního růstového faktoru aj.).
V diagnostice tohoto onemocnění neexistují specifická laboratorní vyšetření (pouze nespecifické ukazatele zánětlivého procesu bez zvýšení hladin prokalcitoninu), diagnóza je především klinická. Histologický obraz je nespecifický (infiltrace neutrofily, vaskulitida, granulační tkáň, pseudoepiteliomatózní hyperplazie [21], je nutné vyloučit asociovaná onemocnění.
Diagnóza PG je v současnosti „vylučovací diagnózou“, neslučitelnou s klinickým rozhodováním a se vstupními kritérii klinických studií. Na základě tzv. Delphi konsenzu mezinárodních odborníků publikovaném Maverakisem et al. v roce 2018 bylo stanoveno 1 hlavní kritérium a 8 vedlejších kritérií. Hlavní kritérium představuje biopsie z okraje vředu prokazující neutrofilní infiltrát. K vedlejším kritériím se řadí následující zjištění: vyloučení infekčního původu; patergie; anamnéza IBD nebo zánětlivé artritidy; anamnéza vzniku papul, pustul a vezikul s ulcerací 4 dny od vzniku; periferní erytém, podminovaný okraj a citlivost v místě ulcerace; vícečetné ulcerace s přítomností alespoň 1 na přední ploše dolních končetin; kribiformní jizvy v místě odhojení vředů; redukce velikosti vředu do 1 měsíce od zahájení imunosupresivní terapie. Přítomnost 4 z 8 kritérií maximalizuje schopnost rozlišení s dosažením 86% senzitivity a 90% specificity [12]. Nutné je dále vyloučení jiných dalších příčin obdobných kožních ulcerací – maligních stavů, vaskulitid a vaskulopatií, chorob pojiva a cév, diabetu a traumat. Provádí se následující vyšetření – základní hematologické a biochemické vyšetření, VDRL test, antifosfolipidové protilátky, protilátky proti Saccharomyces cerevisiae (ASCA) v IgG a IgA třídách, p-ANCA, fekální kalprotektin (marker non-invazivních diagnostických postupů u IBD – nespecifických střevních zánětů, jde o protein v cytosolu zánětlivých buněk, uvolňuje se při aktivaci leukocytů [9]), elektroforéza, RTG hrudníku, kolonoskopické vyšetření apod. K vedlejším diagnostickým kritériím patří: patergie v anamnéze nebo klinický nález kribriformního jizvení, přítomnost asociovaných systémových onemocnění (zejména zánětlivá onemocnění střev a artritidy), rychlá odpověď na imunosupresivní terapii a histopatologický nález neutrofilního infiltrátu [5].
Atypické ANCA protilátky jsou zjišťovány u některých zánětlivých střevních onemocnění (IBD – Inflammatory bowel disease). U ulcerózní kolitidy vykazují senzitivitu 44% a specificitu v 86 %. Takzvané „atypical perinuclear anti-neutrophil cytoplasmic antibodies (atypical-P-ANCA) vyšetřované metodou nepřímé imunofluorescence mohou být považovány za sérologický marker IBD. Nicméně podle studie Mokhtarifara et al. nejsou atypické P-ANCA protilátky vhodným markerem pro screening IBD, ale slouží jako parametr rozlišení ulcerózní kolitidy a Crohnovy choroby [14]. ANCA protilátky jsou též spojovány s vaskulitidami malých cév (Wegenerova granulomatóza, mikroskopická polyangiitis, eventuálně s omezeným postižením ledvin, dále Churg–Strauss syndrom a některé léky-indukované vaskulitidy) [18].
Vznik PG v průběhu gravidity je vzácný a neobvyklý. Je dokázané, že během gravidity dochází k fyziologickým změnám zahrnujícím zvýšenou tvorbu granulocyty-makrofágy kolonie stimulujícího faktoru 2 (granulocyte-macrophage colony-stimulating factor, GM-CSF), který je známým spouštěčem neutrofilního zánětu a také zvýšení hladiny neutrofilů, které může imitovat jiné zánětlivé poruchy a vzniká zvýšené riziko vzniku PG, a to i v souvislosti s lokálním traumatem (např. i rána po císařském řezu) [19].
Terapie se zaměřuje na léčbu asociovaného systémového onemocnění, dosažení remise závisí na úspěšnosti léčby dané komorbidity. Lokálně se využívají silné kortikoidy a imunomodulátory (takrolimus, pimekrolimus, sodná sůl kromoglykátu) [1]. Ulcerující formy se léčí podle principů vlhkého hojení ran [7]. Z důvodu patergie je žádoucí vyhnout se chirurgickému ošetření. Někteří autoři uvádí možnost lokální aplikace krytí s obsahem stříbra a jódu v prevenci super infekcí [20], jiní je nedoporučují, neudávají ale důvody [5, 15, 17]. Vedle kortikoidů udává Sullivan i užití lokálně aplikovaného takrolimu, dapsonu u PG [20]. Indikací k systémové léčbě je selhání lokální léčby či postižení hlubších podkožních struktur, genitálií, mimokožních orgánových systémů a diseminovaná forma PG [7].
Vzhledem k vzácnému výskytu zatím jednotný léčebný standard pro systémovou léčbu neexistuje.
Léky s nejlépe zdokumentovaným účinkem jsou kortikoidy a další imunosupresiva, jako je cyklosporin A, azathioprin, sulfasalazin, metotrexát, mykofenolát mofetil aj. [7, 21]. Při sekundární bakteriální infekci jsou indikována antibiotika. Péče o pacienty léčené celkovými imunosupresivy je náročná, vyžaduje pečlivé, pravidelné klinické a laboratorní monitorování a dlouhodobou komplexní léčbu a péči. V odborné literatuře se udává i léčba s použitím vysokých dávek intravenózně podaných imunoglobulinů (IVIG) [16]. V posledních letech se s dobrým efektem odzkoušela i řada léků ze skupiny biologik: anti TNF – infliximab, adalimumab, etanercept, certolizumab, anti IL-23 ustekinumab, antagonista receptoru pro IL-1 (IL-1Ra) anakinra či kanakinumab (monoklonální protilátka proti IL-1β) [7, 16]. Nejlepší EBM (Evidence based medicine) data v otázkách terapie jsou dostupná pro prednison, cyklosporin A a infliximab (zejména u PG se současnou přítomností ulcerózní kolitidy nebo Crohnovy choroby). Příznivé odpovědi na vysoce dávkovaný imuglobulin (IVIG) a na canakinumab (anti IL-1 β protilátka) byly dokumentovány menšími počty kazuistik, u canakinumabu i prospektivní multicentrickou studií. Obdobně u nasazení adalimumabu, anakinry (anti IL-1 protilátka) a ustekinumabu (anti IL-12/23 protilátka) šlo vždy o individuální publikované kazuistiky [16].
Námi zvolena kombinace cyklosporinu A a mykofenolát mofetilu se používá vzácně (4 publikované práce), jako první již v roce 1997 publikoval Hohenleutner et al. práci o nasazení této kombinované léčby na terapii rezistentní PG s velmi bolestivými projevy v oblasti kalvy [8]. V efektu šlo spíše o kumulativní účinek imunosuprese, rozdílné účinky v mechanismu navození imunosuprese nejsou autory zmiňovány.
Průběh onemocnění je těžko předvídatelný, recidivující a závisí na typu a závažnosti doprovodných systémových chorob, které mohou být i příčinou úmrtí (malignity).
ZÁVĚR
Uvedený případ ukázal, že kožní projevy mohou předcházet manifestaci systémového onemocnění, jež je v pozadí. Vznik PG během gravidity je sice velmi neobvyklý, ale možný. V rutinní praxi je PG diagnostikována podle klinického obrazu doplněného o histologické vyšetření. Laboratorně je při podezření na IBD citlivější vyšetření kalprotektinu ze stolice nebo lépe rovnou provedení kolonoskopického vyšetření než stanovení ASCA protilátek (ty mohou být vzhledem k imunosupresi falešně negativní). Z terapeutického hlediska je důležité včasné zahájení účinné systémové terapie i v období gravidity, při neúspěšné léčbě i kombinací více imunosupresiv, a nezbytnost mezioborové spolupráce při péči o takto nemocné. Zvolená výjimečná kombinace cyklosporinu A a mykofenolát-mofetilu byla popisována v literatuře jako vhodná u úporných průběhů PG. Průběh onemocnění u naší pacientky potvrzuje tendenci k refrakternosti tohoto onemocnění vůči léčbě a dokumentuje, jak může být terapie obtížná a zdlouhavá než se odhalí související možné komorbidity jako možné příčiny úpornosti průběhu.
Prohlašuji, že jsem v souvislosti s tématem této práce v posledních 12 měsících nespolupracovala s žádnou farmaceutickou firmou.
Do redakce došlo dne 21. 10. 2020.
Adresa pro korespondenci:
MUDr. Andrea Bartlová
Kovárenská 87
530 02 Pardubice
e-mail: andrea.bartlova@gmail.com
Sources
1. BALATAZAR, D., HAAG, C., GUSTA, A. S. et al. Comprehensive Review of Local Pharmacologic Therapy for Pyoderma Gangrenosum. Wounds, 2019 Jun;31(6). p. 151–157.
2. BATALLA, A., PÉREZ-PEDROSA, A., GARCÍA-DOVAL, I. et al. Lung involvement in pyoderma gangrenosum: a case report and review of the literature. Actas Dermosifiliogr, 2011 Jun;102 (5), p. 373–377.
3. BRAHIMI, N., MAUBEC, E., BOCCARA, O. et al. Pyoderma gangrenosum with aseptic spleen abscess. Ann Dermatol Venereol., 2009 Jan;136 (1), p. 46–49.
4. BOLOGNA, J. L., SCHAEFFER, J. V., DUNCAN, K. O. et al. Dermatology Essentials. Elsevier 2014; p. 202–205. ISBN 978-1-4557-0841-3.
5. FEJEROVÁ, M. Pyoderma gangrenosum. www. https://zezdravotnictvi.cz/profi-medicina/pyoderma-gangrenosum/, 2019.
6. GADE, M., STUDSTRUP, F., ANDERSEN, A. K. et al. Pulmonary manifestations of pyoderma gangrenosum: 2 cases and a review of the literature. Respir Med., 2015 Apr;109 (4), p. 443–4450. doi: 10.1016/j.rmed.2014.12.016. Epub 2015 Jan 14.
7. HERCOGOVÁ, J. et al. Klinická dermatovenerologie. 1. díl, Praha: Mladá fronta 2019, p. 229–232. ISBN 978-80-204-5321-1.
8. HOHENLEUTNER, U., MOHR, V. D., MICHEL, S., LANDTHALER, M. Mycophenolate mofetil and cyclosporin treatment for recalcitrant pyoderma gangrenosum. Lancet, 1997 Dec 13;350(9093), p. 1748.
9. CHATZIKONSTANTINOU, M., KONSTANTOPOULOS, M., STERGIOPOULOS, S. et al. Calprotectin as a diagnostic tool for inflammatory bowel diseases. Biomed Rep., 2016 Oct; 5(4), p. 403–407.
10. JACKSON, J. M. Pyoderma gangrenosum. Updated Mar 09, 2020, https://emedicine.medscape.com/article/1123821-overview.
11. JARČUŠKOVÁ, D., BENEČOVÁ, K., FICOVÁ, M. et al. Pyoderma gangraenosum – klinické aspekty, léčba. Čes-slov Derm, 2002, No. 2, p. 80–83.
12. MAVERAKIS, E., MA, CH., SHINKAI, K. et al. Diagnostic Criteria of Ulcerative Pyoderma Gangrenosum. A Delphi Consensus of International Experts. JAMA Dermatol., 2018, 154 (4), p. 461–466.
13. MISEROCCHI, E., MODORATI, G., FOSTER, C. S. et al. Ocular and Extracutaneous Involvement in Pyoderma Gangrenosum. Ophtalmology, 2002 Oct, 109(10):1 p. 941–943.
14. MOKHTARIFAR, A., GANJI, A., SADRNESHIN, M. et al. Diagnostic Value of ASCA and Atypical p-ANCA in Differential Diagnosis of Inflammatory Bowel Disease. Middle East J Dig Dis., 2013 Apr, 5 (2), p. 93–97.
15. NAVRÁTILOVÁ, Z., SEMRÁDOVÁ, V. Pyoderma gangraenosum – možnosti terapie. Čes-slov Derm., 2000, No. 5, p. 238–240.
16. QUIST, S. R., KRAAS, L. Treatment options for pyoderma gangrenosum. JDDG, Volume15, Issue 1, January 2017, p. 34–40.
17. PETRÁŠOVÁ, D. Pyoderma gangrenosum. Dermatologie pro praxi, 2013, 7(3), p. 134–135.
18. SAVIGE, J., DAVIES, D., FALK, R. J. et al. Antineutrophil cytoplasmic antibodies and associated diseases: A review of the clinical and laboratory features. Perspectives in Renal Medicine, Volume 57, ISSUE 3, p. 846–862.
19. STIEGLER, J. D., LUCAS C. T., SAMI, N. Pyoderma gangrenosum in pregnancy successfully treated with infliximab and prednisone. JAAD Case Rep., 2017, Sep, 3 (5), p. 387–389.
20. SULLIVAN, M. G. Attack Pyoderma Gangrenosum with an Array of Treatment Options. Dermatology News, https://www.mdedge.com/dermatology/article/17917/wounds/attack-pyoderma-gangrenosum-ar-ray-treatment-options.
21. ŠTORK, J. et al. Dermatovenerologie. 2. vyd. Praha: Galén, 2013, p. 320–321, ISBN 978-80-7262-898-8.
22. TERJUNG, B., HERZOG, V., WORMA, W. J. et al. Antineutrophil Cytoplasmic Antibodies With Perinuclear Fluorescence in Chronic Inflammatory Bowel Diseases and Hepatobiliary Disorders Colocalize with Nuclear Lamina Proteins. Hepatology, 1998 Aug, 28 (2), p. 332–340. https://pubmed.ncbi.nlm.nih.gov/?term=%22Hepatology%22%5Bjour%5Dhttps://www.ncbi.nlm.nih.gov/nlmcatalog?term=%22Hepatology%22%5bTitle+Abbreviation%5dhttps://pubmed.ncbi.nlm.nih.gov/9695994/.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology
2020 Issue 6
Most read in this issue- Lichen Sclerosus. Review
- Bleeding Nodule in the Navel
- Pyoderma Gangrenosum in a Pregnant Patient. Case Report
- Textile Clothing as a Part of Comprehensive Skin Care
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

