-
Medical journals
- Career
Zoonotické dermatofytózy: klinický obraz, diagnostika, etiologie, léčba, epidemiologická situace u nás
Authors: V. Hubka 1,2; A. Čmoková 1,2; A. Peano 3; T. Větrovský 4; R. Dobiáš 5,6; N. Mallátová 7; P. Lysková 6,8; K. Mencl 9; H. Janouškovcová 10; J. Stará 11; I. Kuklová 11; J. Doležalová 12; P. Hamal 6; L. Svobodová 6; J. Koubková 13; M. Kolařík 1,2
Authors‘ workplace: Katedra botaniky, Přírodovědecká fakulta, Univerzita Karlova, Praha, vedoucí katedry doc. RNDr. Yvonne Němcová, Ph. D. 1; Laboratoř genetiky a metabolismu hub, Mikrobiologický ústav, Akademie věd České republiky, v. v. i., Praha, vedoucí laboratoře Mgr. Miroslav Kolařík, Ph. D. 2; Department of Veterinary Sciences, School of Veterinary Medicine, University of Turin, Turin, Italy 3; Laboratoř environmentální mikrobiologie, Mikrobiologický ústav, Akademie věd České republiky, v. v. i., Praha, vedoucí laboratoře RNDr. Petr Baldrian, PhD. 4; Oddělení bakteriologie a mykologie, Centrum klinických laboratoří, Zdravotní ústav se sídlem v Ostravě, vedoucí oddělení RNDr. Vladislav Holec 5; Ústav mikrobiologie, Lékařská fakulta Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc, přednosta ústavu prof. MUDr. Milan Kolář, Ph. D. 6; Pracoviště parazitologie a mykologie, Centrální laboratoře Nemocnice České Budějovice a. s., České Budějovice, ředitel nemocnice MUDr. Břetislav Shon 7; Laboratoř lékařské mykologie, oddělení parazitologie, mykologie a mykobakteriologie Praha, Zdravotní ústav se sídlem v Ústí nad Labem, Praha, vedoucí oddělení Ing. Josef Čermák, Ph. D. 8; Oddělení klinické mikrobiologie, Pardubická krajská nemocnice, a. s., Pardubice, primář oddělení MUDr. et Mgr. Eva Zálabská, Ph. D. 9; Ústav mikrobiologie, Fakultní nemocnice Plzeň, přednosta ústavu RNDr. Karel Fajfrlík, Ph. D. 10; Centrum pro dermatomykózy, Dermatovenerologická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze, přednosta kliniky prof. MUDr. Jiří Štork, CSc. 11; Oddělení klinické mikrobiologie a imunologie, Centrum laboratorní medicíny, Krajská nemocnice Liberec, a. s., přednostka Centra: MUDr. Renata Procházková, Ph. D. 12; Labvet. cz, s. r. o., veterinární laboratoř, Praha, vedoucí laboratoře MVDr. Hana Prausová 13
Published in: Čes-slov Derm, 93, 2018, No. 6, p. 208-235
Category: Reviews (Continuing Medical Education)
Overview
Zoofilní dermatofyty jsou nejdůležitějšími původci povrchových mykóz u domácích a hospodářských zvířat, z nichž jsou často přenášeny na člověka. Tato skupina zahrnuje přibližně deset specializovaných parazitických hub, které náleží do rodů Trichophyton a Microsporum. Zatímco u zvířat mají infekce často mírný až asymptomatický průběh, při nákaze člověka se typicky projevují jako silně zánětlivé infekce kůže nebo kštice. Nejčastěji postiženou skupinou jsou děti. Cílem tohoto sdělení je podat ucelený mezioborový přehled o klinickém obraze a diagnostice těchto infekcí u člověka i domácích zvířat, a také o hlavních původcích a jejich prevalenci u zvířat, což jsou základní předpoklady nutné k pochopení dynamiky přenosu na člověka a epidemiologické situace u nás i ve světě. Samostatné podkapitoly jsou věnovány léčbě infekcí u člověka a prevenci šíření zoonotických nákaz. Dále je prezentována analýza pětiletých epidemiologických dat, která zahrnuje 2 361 případů tiney corporis (1 004 zoonotického původu) a 79 případů tiney capitis (60 zoonotických) u českých pacientů.
Klíčová slova:
Microsporum canis – tinea capitis – tinea corporis – Trichophyton benhamiae – zoofilní dermatofyty
ÚVOD
Dermatofyty jsou nejúspěšnějšími patogenními houbami, které způsobují povrchové mykózy (dermatofytóza, tinea, ringworm) u lidí a zvířat. Dermatofytózy se často vyskytují u domácích, hospodářských i volně žijících zvířat. Infekce způsobené zoofilními dermatofyty jsou u zvířat obvykle mírné a dobře reagují na léčbu. Přenos se uskutečňuje přímým kontaktem s nakaženým jedincem, nebo kontaminovanými předměty [57, 108]. Prevalence infekcí a spektrum patogenů u zvířat (a sekundárně též u člověka) vykazuje velké geografické rozdíly. Vliv mají lokální zvyklosti a trendy v chovu hospodářských a domácích zvířat, obchod se zvířaty, transport zvířat pro reprodukční, výstavní a sportovní účely. Kromě lokálního spektra chovaných zvířat a prevalence jednotlivých patogenů, závisí riziko zoonózy také na lokálních hygienických standardech, preventivních opatřeních (např. vakcinace zvířat) a socioekonomických faktorech. Dermatofytózy jsou silně nakažlivé a zvířata chovaná ve stádech nebo větších skupinách jsou ohrožena epidemickým šířením infekce, i když je do komunity začleněn jeden nebo několik infekčních jedinců. Prostředí obývané nakaženými zvířaty (často s mírnými příznaky nebo bez viditelných symptomů) představuje potenciální zdroj infekce pro člověka [16, 57, 84].
Výskyt dermatomykóz je spojen celosvětově s vysokými náklady na prevenci, diagnostiku a léčbu infikovaných zvířat i lidských pacientů [29]. Přímé ekonomické ztráty v zemědělství a některých odvětvích průmyslu jsou důsledkem neprospívání a snížených výnosů nakažených hospodářských zvířat a nepříznivého estetického efektu lézí (např. kožešinový a kožedělný průmysl). Infekce také do určité míry brání obchodu se zvířaty a jsou překážkou pro výstavy a sportovní aktivity [57]. Ve velké části vyspělých zemí jsou zoofilní dermatofyty hlavními původci tiney capitis a tiney corporis, hlavně u dětské populace. Zoonotické dermatofytózy jsou ale i nezanedbatelnou příčinou infekcí pracovníků v živočišné výrobě, veterinářství, zverimexech, laboratorních pracovníků, zootechniků a jiných profesí, které vyžadují kontakt se zvířaty [16, 46, 76]. Prevalence dermatofytóz např. u pracovníků na farmách může být překvapivě vysoká. Některé studie z oblastí, kde se takřka neprovádí vakcinace skotu, odhalily 30–45% prevalenci zoonotických dermatofytóz u pracovníků se skotem [2, 80]. Podobně bylo v jiné studii zjištěno, že na italských králičích farmách zoonotickou dermatomykózu prodělalo 77 % pracovníků [131].
Většina zoofilních dermatofytů je poměrně úzce specializovaná na jeden nebo několik druhů zvířat, ale obvykle si zachovávají schopnost nakazit i různě široké spektrum dalších hostitelů včetně člověka. Jedná se zhruba o 10 patogenních hub, z nichž některé druhy jsou velmi vzácné a nevýznamné pro náš region. Přehled zoofilních dermatofytů, jejich hostitelů a geografického rozšíření uvádí tabulka 1.
Table 1. Přehled zoofilních dermatofytů, jejich přirozených hostitelů a rozšíření 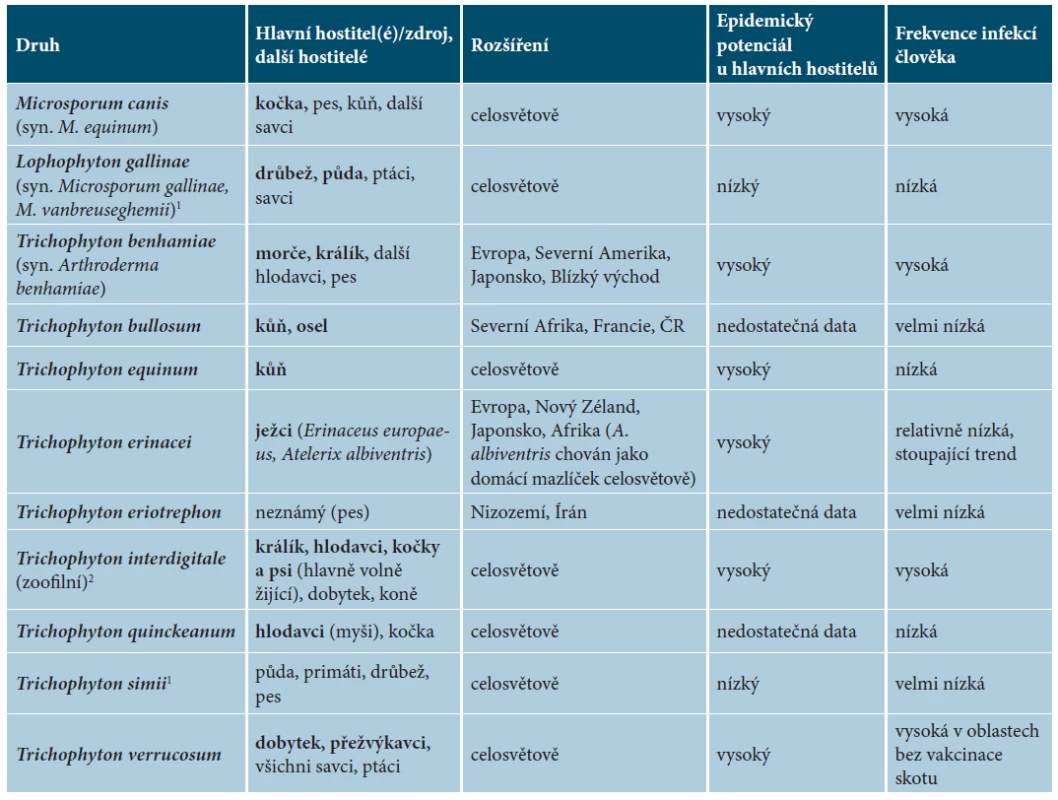
1Existuje řada náznaků, že se nejspíše jedná o geofilní druhy – splňují řadu charakteristik typických pro geofilní dermatofyty: nízká hostitelská specificita; nízká incidence případů, které se objevují náhodně bez jasné souvislosti mezi sebou (výjimkou je kontakt s kontaminovanou půdou) u různých hostitelů; velmi omezený nebo žádný potenciál k vyvolání epidemií u nejběžnějších hostitelů (nízká nakažlivost); geografický výskyt nekoreluje s výskytem známého hostitele; existují záznamy o izolaci druhů z půdy.
Pozn. Podobným případem jsou i druhy Nannizzia persicolor (syn. Microsporum persicolor) a Nannizzia nana (syn. Microsporum nanum), které jsou některými autory označovány za zoofilní, ačkoliv i jejich fylogenetická pozice svědčí o geofilní ekologii – více viz Hubka et al. [53]
2V současné taxonomické revizi dermatofytů de Hoog et al. [24] zavedli „alternativní“ neotyp pro Trichophyton mentagrophytes a prosazují opětovné používání tohoto jména pro „zoofilní kmeny T. interdigitale“. Vzhledem k tomu, že tato změna není v souladu s pravidly nomenklatorického kódu a druhový koncept T. interdigitale/T. mentagrophytes je nedořešený, pokračujeme v používání označení „zoofilní T. interdigitale“, jak jsme dříve navrhli [52].Výrazné epidemiologické změny v prevalenci a spektru zoofilních dermatofytů na rozsáhlých geografických územích probíhají většinou v dlouhém časovém měřítku (desetiletí) a lze je odhalit pouze tehdy, jsou-li k dispozici dlouhodobé epidemiologické údaje. Tyto změny mohou být navíc snadno přehlédnuty u hlavních zvířecích hostitelů dermatofytů, kde jsou infekce běžně asymptomatické u vysokého procenta infikovaných zvířat a případný screening by tedy měl zahrnovat i zdánlivě zdravá zvířata. Rozsáhlejší a dlouhodobé epidemiologické studie jsou ve veterinární medicíně raritní, a proto jsou změny v etiologii a prevalenci dermatofytóz u domácích zvířat často zjištěny sekundárně z epidemiologických studií na lidské populaci. Výjimečně dochází k velkým změnám v krátkém časovém měřítku. Například epidemické šíření druhu Trichophyton benhamiae (syn. Arthroderma benhamiae) v Evropě bylo v posledních letech zřejmě nejvýznamnější událostí v epidemiologii zoonotických dermatomykóz, která zdůraznila potřebu užší mezioborové spolupráce mezi veterináři, dermatology, epidemiology a obchody se zvířaty [53, 132].
Znalost lokální epidemiologické situace je důležitá, protože rozdíly v etiologii těchto infekcí jsou značné nejen mezi kontinenty, ale dokonce i mezi geograficky blízkými státy. V našich podmínkách se zoonotické infekce kůže vyskytují často a mělo by na ně být pomýšleno především u dětí a dospívajících s tineou capitis a mykózami hladké kůže, podobně jako ve většině rozvinutých zemí. Microsporum canis bývá uváděn jako převládající původce. Studie z vyspělých regionů Evropy a Asie naznačují, že antropofilní dermatofyty jako původci tiney capitis zde byly téměř vymýceny a jejich vysoký výskyt je nyní vázán na oblasti s nízkým socioekonomickým statusem. Výjimkou je tinea capitis působená T. tonsurans v Severní Americe. Přesto je nyní v některých evropských městských oblastech, např. ve Velké Británii, Francii, Švédsku a Švýcarsku, pozorován u tiney capitis opět posun směrem antropofilním druhům (Trichophyton tonsurans, Trichophyton soudanense a Microsporum audouinii). Tato změna bývá přičítána změnám v etnickém složení obyvatelstva, a zvyšujícímu se počtu imigrantů z Afriky a karibské oblasti. Antropofilní druhy nadále zůstávají hlavní příčinou tiney capitis v mnoha asijských a afrických zemích, ačkoliv významný posun směrem k zoonotické etiologii, kterým si evropské země prošly v minulosti, je v rozvinutějších regionech také pozorován. Detailně byl tento jev popsán např. v některých provinciích Číny [48, 50, 60, 92, 93, 112, 132, 142]. Zcela výjimečně mohou být dominantními původci tiney capitis jiné zoofilní druhy než M. canis, např. zoofilní Trichophyton interdigitale nebo Trichophyton verrucosum (některé oblasti Číny, Středního východu nebo Afriky) [5, 77, 92, 142].
Etiologie tiney corporis je v porovnání s tineou capitis daleko méně studována. Hlavní patogeny zodpovědné za tineu corporis ale většinou poměrně přesně odrážejí lokální spektrum původců tiney capitis. Antropofilní druhy ve vyspělých i v rozvojových zemích obvykle způsobují infekce ve vyšších věkových skupinách, zatímco zoofilní druhy (např. M. canis a zoofilní T. interdigitale) spíše doplňují toto spektrum, a bývají více zastoupeny u dětí. Microsporum canis jako původce tiney corporis stále často dominuje nad antropofilními druhy v jihoevropských zemích, ačkoliv v posledních studiích byl pozorován nárůst druhů antropofilních. Trichophyton verrucosum a zoofilní T. interdigitale zůstávají převládajícími původci v rolnických oblastech Středního východu [50, 55, 88].
Pro efektivní léčbu a prevenci šíření dermatofytóz je důležité správně stanovit původce onemocnění na úroveň druhu, což umožňuje nejen indikovat vhodnou terapii, ale současně i odhalit pravděpodobný zdroj infekce. Správná identifikace je také nepostradatelným předpokladem pro sledování změn frekvence jednotlivých druhů, pomáhá hodnotit výsledky preventivních opatření a intervencí, a je základním požadavkem pro přípravu epidemiologických studií. Nestabilní taxonomie dermatofytů, problematický druhový koncept a nesnadná morfologická identifikace některých zoofilních dermatofytů omezují porovnatelnost současných a minulých epidemiologických studií. Ve druhé polovině 20. století byly dermatofyty obvykle klasifikovány do tří rodů, Trichophyton, Epidermophyton a Microsporum, ale s nimi spojené pohlavní stadium bylo řazeno do rodu Arthroderma [140, 141]. Nástup molekulárních metod výrazně přispěl k pochopení biodiverzity těchto patogenů, a zpochybnil předchozí klasifikaci na základě morfologických a nutričních testů. Po úplném zrušení duální nomenklatury a při současné dostupnosti mnohagenové fylogeneze, byl počet rodů zvýšen [24], ale nejdůležitější primárně patogenní druhy zůstaly ve třech výše zmíněných rodech. Naproti tomu geofilní druhy byly převedeny do rodů Arthroderma, Nannizzia a Paraphyton, a dále bylo také „oživeno“ rodové jméno Lophophyton, do kterého byl přesunut druh Microsporum gallinae [24]. Přes významné změny v taxonomii a pokroky v molekulárně genetické diagnostice však standardem pro identifikaci dermatofytů u zvířat i člověka nadále zůstávají tradiční fenotypové metody založené na kultivaci.
Cílem tohoto souborného článku je shrnout současné poznatky o infekcích působených zoofilními dermatofyty z pohledu dermatovenerologie i veterinární medicíny. Přiblížen je klinický obraz infekcí u člověka i zvířat, diagnostické metody, léčba a nejvýznačnější trendy v epidemiologii těchto infekcí u nás i ve světě. Jedině mezioborový pohled na tuto problematiku vede k pochopení epidemiologické situace a umožňuje nastavit preventivní opatření proti výskytu a dalšímu šíření těchto nákaz nejen mezi lidmi, ale také mezi zvířaty, která bývají často asymptomatickými zdroji infekce. Zodpovědnost za prevenci zoonotických infekcí, včetně vzdělávání veřejnosti o rizicích, je v rukou praktických lékařů, dermatologů, veterinářů, hygienických stanic, a také obchodů se zvířaty.
KLINICKÝ OBRAZ ZOONOTICKÝCH DERMATOFYTÓZ U ČLOVĚKA
Na rozdíl od zvířat, kde mají infekce často nenápadný, nebo chronický průběh, se u člověka zoonotické infekce působené dermatofyty projevují zpravidla jako silně zánětlivé kožní léze typu tinea corporis a tinea capitis. Chronické nákazy a infekce s minimem symptomů jsou typicky působeny specifickými lidskými patogeny – antropofilními dermatofyty. Infekce způsobené zoofilními dermatofyty jsou mnohem častější v dětské populaci, kdežto u dospělé populace výrazně převažují jako původci druhy antropofilní (hlavně onychomykóza, tinea pedis a tinea cruris). Primární ložisko vzniká v místě kontaktu odhalené pokožky s nemocným zvířetem nebo kontaminovaným předmětem, tedy nejčastěji na končetinách, krku a obličeji. Děti bývají při hrách v mnohem užším kontaktu s domácími mazlíčky a léze jsou tedy často lokalizované i na trupu, ve vlasaté části hlavy, a nezřídka i na genitálu. Inkubační doba infekcí bývá nejčastěji 3–4 týdny (ale i delší), a je proto třeba pátrat po kontaktu se zvířaty v domácím i venkovním prostředí přibližně 1–2 měsíce před začátkem prvních příznaků. Ačkoliv jsou nakažená zvířata pro člověka poměrně značně infekční, k dalšímu šíření zoonotické infekce mezi lidmi navzájem dochází jen vzácně [90, 122].
Tinea corporis postihuje proximální části končetin (k zápěstím a kotníkům), trup, krk a obličej (tinea faciei). Projevuje se anulárními ložisky s navalitým zánětlivým lemem a s centrálním odhojováním. Zánětlivější ložiska mívají lem posetý vezikulami nebo pustulami. Léze mohou být drobné až rozsáhlé (nepravidelný, mapovitý tvar). Olupování kůže může být lokalizováno jak na obvodu, tak v centru ložisek, kde zánět již ustupuje. Poměrně často bývá přítomno svědění [33, 90].
Tinea barbae je lokalizována ve vousech obličeje a krku mužů a téměř vždy je zoonotického původu. Manifestuje se jako folikulárně vázané červené papulopustuly až bolestivé abscesy s hnisavou sekrecí. Často bývá doprovázena krční lymfadenopatií a někdy i zvýšenou teplotou. Jizvy nebo alopetická ložiska zůstávají jen zřídka [110].
Tinea capitis je v našich podmínkách ze tří čtvrtin zvířecího původu a vyskytuje se hlavně u dětí. Pokud se vyskytne u dospělých, bývá zpravidla způsobena antropofilními dermatofyty. Klinický vzhled bývá variabilní a závisí na typu invaze vlasu a intenzitě zánětu. Může se jednat jen o několik polámaných vlasů s mírným olupováním kůže, což je zjistitelné jen při pečlivém vyšetření, v nejtěžších případech se naopak může onemocnění manifestovat jako hnisavé, zánětlivé a bolestivé abscesy (kerion Celsi, tinea capitis profunda), které mohou pokrývat značnou část hlavy. Vážnější případy často doprovází lymfadenopatie a zvýšená teplota. Obecně se tinea capitis dá rozdělit do čtyř klinických typů. Pokud je původcem M. canis, projevuje se typicky okrouhlými, mírně šupinatými ložisky s vlasy ulámanými 3–5 mm od pokožky (vzhled strniště); zánět bývá minimální (u menší části pacientů je ale různý stupeň zánětu přítomen – od zarudnutí přes mokvání až po kerion Celsi). Na pahýlech vlasů lze pod lupou sledovat šedavý nebo žlutobílý povlak mycelia. Právě tyto pahýly jsou cenným materiálem pro mykologické vyšetření. Trichophyton benhamiae mnohem častěji než M. canis vyvolává silně zánětlivé keriony, které mohou někdy vyústit v jizevnatou alopecii, na rozdíl od mikrosporie, kde ložiska prakticky vždy zarůstají ad integrum. Dalším typem tiney capitis je ložisková alopecie s tzv. černými body (“black dots”), která je charakteristická vlasy ulámanými těsně u povrchu hlavy, a je většinou způsobena antropofilními druhy Trichophyton. Třetím typem je zmiňovaný kerion, zpravidla způsobený zoofilními nebo geofilními dermatofyty. Posledním typem je favus, charakteristický tvorbou skutul, který se u nás v podstatě nevyskytuje a je způsobený antropofilním Trichophyton schoenleinii.
Sekundární bakteriální infekce nejsou běžné, dokonce ani u kerion Celsi [33, 49, 90, 120, 123]. Někdy jsou ve spojitosti se silně zánětlivou tineou capitis popisovány mykidové reakce, které se projevují vyrážkou (hlavně trup a končetiny), ekzematózními lézemi nebo jako erythema nodosum [19, 130].
KLINICKÁ MANIFESTACE INFEKCÍ U ZVÍŘAT
Dermatofytóza zůstává jedním z nejčastějších kožních onemocnění u koček, psů, koní, skotu, králíků a některých hlodavců (zejména morčat a činčil). U těchto zvířat je na mykózu třeba pomýšlet vždy při difuzním nebo ložiskovém vypadávání chlupů. Vzhled kožních lézí u koček je velice variabilní, proto by dermatofytóza měla být zahrnuta do diferenciální diagnostiky veškerých kožních onemocnění. Klinické příznaky u psů mohou připomínat bakteriální folikulitidu a lokalizovanou demodikózu; poměrně vzácná pustulózní dermatofytóza psů může napodobovat pemphigus foliaceus. Diferenciální diagnostika u skotu a koní by měla zahrnovat i další příčiny nesvědivé alopecie, zejména dermatofilózu. Při postižení končetin je v diferenciální diagnostice nutné u domácích zvířat zvažovat pododermatitidu.
Klinický obraz dermatofytóz u vybraných domácích zvířat shrnuje tabulka 2. Infekce může být lokalizována na kterékoli části těla zvířete. Predilekčními místy jsou zejména u drobných domácích zvířat hlava a tlapy. Pokud je u zvířete nákaza klinicky manifestní, projevuje se typicky jako pravidelná, kruhovitá léze, obvykle doprovázená alopecií, deskvamací a erytémem. Léze se mohou spojovat do větších ložisek s nepravidelnými okraji. Mohou být erytematózní po celém povrchu, ale především je tomu tak na jejich obvodu, který bývá vyvýšený. Mohou být pokryté pustulami a později exsudátem a krustami; přítomny mohou být hyperpigmentace. Mezi další, nepravidelně přítomné klinické příznaky, patří svědění doprovázené škrábáním a změnou chování zvířat. Při postižení drápů bývá změněn tvar nehtu a často i barva a struktura. Atypické nodulární formy dermatofytózy reprezentuje kerion (erytematózní, alopetický, kopulovitý, exsudativní uzlovitý útvar; histologicky charakteru granulomu nebo pyogranulomu) a pseudomycetom (uzel s tendencí k tvorbě píštělí, ulcerací, se serózním až purulentním obsahem a mykotickými zrny).
Table 2. Klinická manifestace dermatofytóz u vybraných domácích zvířat s významným zoonotickým potenciálem v České republice 
1Řazeno sestupně podle incidence zoonotických infekcí člověka v České republice. Imunologicky naivní, obvykle mladí jedinci nebo naopak stará zvířata mohou být silně napadena, a infekce má v takovém případě výrazný dopad na zdravotní stav a růst. Mnohočetné a difuzní léze jsou často pozorovány u zvířat se současně přítomným dalším kožním onemocněním, systémovou chorobou, nebo u zvířat ve stresu (např. chov ve velkých počtech, změna prostředí apod.). Nakažená zvířata mohou často vykazovat jen nenápadné známky infekce nebo působit jako zdánlivě zcela asymptomatičtí nosiči dermatofytů (tab. 2). Specifickým problémem je mechanické přenašečství artrospor na srsti domácích zvířat při pohybu v zamořeném prostředí (viz diagnostika u zvířat) [28, 57, 79, 81, 84].
DIAGNOSTIKA INFEKCÍ U ČLOVĚKA
Klinická diagnóza tiney corporis je obvykle snadná, pokud jsou ložiska typicky vyvinutá, v opačném případě může být diferenciální diagnostika poměrně široká. Především infekce působené M. canis vykazují častěji variabilní obraz a mohou imitovat např. pityriasis rosea Gibert, pyodermii nebo impetigo contagiosa. Dále je v diferenciální diagnostice možné uvažovat o seboroické dermatitidě, numulárním ekzému, anulární psoriáze, erythema multiforme nebo fixním lékovém exantému. Diferenciální diagnostika tiney capitis je obtížnější. V úvahu přichází seboroická dermatitida, psoriáza kštice, pseudotinea amiantacea, folliculitis decalvans, pseudopelade, chronický diskoidní erytematodes, alopecia areata, lichen planus a pyodermie. Kerion Celsi s hnisáním může být zaměněn za bakteriální infekci a nesprávně léčen antibiotiky, incizemi či excizí, což se u mykotických infekcí nedoporučuje. Včasně nasazená a účinná perorální léčba obvykle vede ke zhojení ad integrum bez zániku folikulů [33, 120, 129]. Diferenciální diagnostika tiney barbae zahrnuje folikulitidu, furunkl, karbunkl, acne vulgaris, rosaceu, eczema herpeticatum, vážnou kontaktní dermatitidu, aktinomykózu, kožní tuberkulózu, tumor, sporotrichózu a jiné vzácné mykózy [110].
Diagnostika dermatomykóz je stále na většině pracovišť založena na konvenčních metodách, jako jsou přímá mikroskopie a kultivace. Kvalita odběru materiálu a jeho množství definuje úspěch těchto vyšetření. Před odběrem by měla být vynechána jakákoliv antimykotická perorální léčba alespoň na tři měsíce a lokální antimykotika alespoň na dva týdny. Vzorek je odebírán z okraje infiltrované oblasti (aktivní zóna). Někteří autoři doporučují před odběrem vyčistit místo alkoholem, aby se odstranily kontaminanty jako bakterie nebo konidie saprofytických hub. Léze na kůži by měly být oškrábány tupou kyretou nebo skalpelem; stěry tampónem mají většinou nízkou výtěžnost. Při infekci vlasů by měla být kštice před odběrem ideálně vyšetřena Woodovou lampou, což je velmi užitečné a rychlé screeningové vyšetření pro infekci M. canis. Při tomto vyšetření napadené vlasy žluto-zeleně fluoreskují. Ostatní druhy dermatofytů většinou nefluoreskují. Odběr materiálu ze kštice může být proveden řadou způsobů: odstřižením poškozených vlasů nůžkami, vytržením epilační pinzetou, oškrábáním tupou stranou skalpelu, třením postižené oblasti vlhkým sterilním tampónem, nebo kartáčkem [44, 90, 101]. Při tinee barbae je doporučeno pro vyšetření vytrhnout vousy z postižené oblasti a kožní šupiny spolu s dalšími vousy získat seškrábnutím skalpelem [110].
Přímé mikroskopické vyšetření je efektivní screeningovou technikou, neboť při pozitivitě a korespondujícím klinickém obraze umožňuje rychlou reakci lékaře, který může předepsat antifungální léčbu dříve, než je dostupný výsledek kultivace. Jedná se o jednoduchou a levnou techniku vhodnou pro všechny typy materiálu, která může odhalit specifické mikroskopické rysy některých mykóz, jako např. pravidelně septované hyfy, nebo vlákna rozpadající se na artrokonidie u dermatofytů (obr. 1a-c), pseudomycelium a blastospory u kvasinek, nepravidelné mechýřkovitě nafouklé hyfy u nedermatofytických vláknitých hub. Kvalita vzorku a zkušenosti vyšetřující osoby určují úspěšnost. Falešně negativní výsledky bývají zaznamenávány u 15–30 % případů [90, 101]. Základním typem preparátu je nebarvený louhový preparát, který se připraví macerací materiálu ve 20% KOH (pro vlasy lze použít 10% KOH). Preparát se nechává macerovat 30–60 min. Pro zvýraznění houbových struktur lze použít louhový preparát přibarvený chlorazolovou černí, bavlnovou modří (viz obr. 1a-b). Pokud je k dispozici fluorescenční mikroskop s příslušnými filtry (modrý filtr, 400–440 nm), mohou být k detekci houbových struktur použita fluororescenční barviva vážící se na chitin, např. kalkofluor nebo blankofor (viz obr. 1c), které dovedou zkrátit dobu vyšetření, zvláště u méně zkušených pracovníků [101, 121].
Image 1. Laboratorní diagnostika dermatofytóz pomocí přímé mikroskopie a histologie. 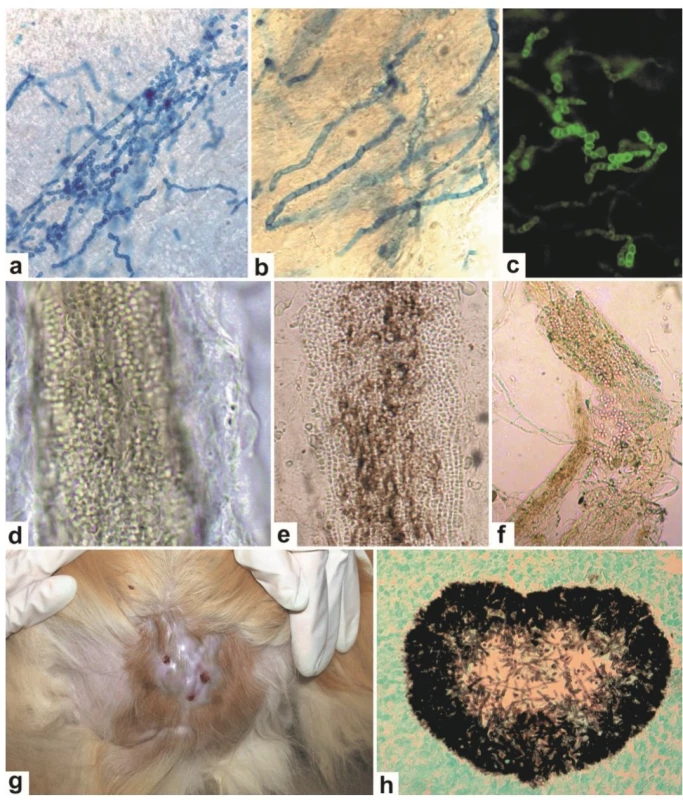
Dermatofytická vlákna a artrokonidie při přímém mikroskopickém vyšetření lidské kůže: barvení bavlnovou modří (a, b) a fluorescenční barvení blankoforem (c). Artrokonidie při přímém mikroskopickém vyšetření napadených chlupů zvířat (digesce NaOH): Microsporum canis (d), Trichophyton benhamiae (e), Trichophyton verrucosum (f). Histopatologické vyšetření při pseudomycetomu kočky: klinický obraz (g), histologický preparát (barvení Gomoriho-Grocotta) (h). Alternativní technikou, pro jejíž širší použití v diagnostice tiney capitis ještě chybí komparativní studie, je dermatoskopie. Vyšetření dokáže podle charakteru napadených vlasů rozeznat základní původce onemocnění a stanovit provizorní diagnózu postačující k zahájení léčby [115].
Kultivace stále zůstává zlatým standardem v diagnostice dermatofytóz navzdory tomu, že může trvat i několik týdnů. Zoofilní dermatofyty až na výjimky rostou poměrně rychle a kultura bývá k dispozici v řádu dnů. Použití selektivního média je nezbytné, aby se zabránilo kontaminaci bakteriemi, kvasinkami nebo saprofytickými houbami přítomnými na kůži a vlasech. Sabouraudův agar (SGA) s antibiotiky (obvykle chloramfenikol a cykloheximid) se proto běžně používá pro primární izolaci spolu SGA bez antibiotik (záchyt nedermatofytických hub). Kultivace většinou probíhá při 25–30 °C, vyšší teploty mohou brzdit růst některých druhů (při podezření na T. verrucosum je ideální část materiálu kultivovat při 37 °C, kde tento druh lépe roste). Obecně je doporučováno kultivovat dermatofyty až 4 týdny kvůli některým pomalu rostoucím druhům (např. T. verrucosum). Studie na 5459 izolátech dermatofytů ale ukázala, že při kultivaci trvající 17 dní je zachyceno téměř 99 % izolátů [101, 105].
Ve většině laboratoří probíhá identifikace dermatofytů stále na základě makro - a mikromorfologických znaků, případně s doplňujícími nutričními, fyziologickými a biochemickými testy. Rostoucí využití hmotnostní spektrometrie MALDI-TOF a molekulárně genetických metod (PCR) by mělo usnadnit identifikaci druhů dermatofytů z kultur, zejména v případě atypických izolátů [68, 138]. V případě hmotnostní spektrometrie MALDI-TOF se neustálým vylepšováním extrakčních protokolů daří zkracovat intervaly kultivace nutné pro identifikaci do rodu/druhu. Slibné výsledky u dermatofytů přinesla studie identifikující dermatofyty do rodu již po dvou dnech kultivace [58].
Citlivost přímého mikroskopického vyšetření a kultivace závisí na kvalitě odběru, zvolené přípravě preparátu a na druhu patogenní houby. Mikroskopické vyšetření sice neumožňuje přesnou identifikaci agens, ale na rozdíl od kultivace, která může trvat týdny, lze vzorek posuzovat téměř okamžitě. Kultivace, která bývá poměrně často i přes pozitivní mikroskopický nález neúspěšná, může být nahrazena testy založenými na PCR. Řada takových testů, které významně snižují čas diagnostiky (hodiny), je nyní k dispozici pro přímou detekci dermatofytů z klinických vzorků. Tyto metody mohou vhodně doplnit nebo v některých případech dokonce nahradit klasická diagnostická schémata díky své vysoké citlivosti a specifičnosti. S výhodou se tyto metody dají použít především v případech, kdy klinický obraz jasně ukazuje na dermatofytózu. Pozitivní průkaz pomocí PCR ale nezbytně neznamená aktivní infekci, protože fungální DNA z neviabilního patogena může být zjištěna i po úspěšném vyléčení, což v případě humánní medicíny hrozí hlavně u onychomykózy. Stejně tak může být průkaz PCR pozitivní u zvířat, která jsou mechanickými nosiči spor. PCR je tedy nevhodnou metodou pro monitorování úspěchu léčby v krátkodobém časovém měřítku. Naopak negativní výsledek PCR po léčbě ukazuje na vyléčení. V nejasných případech, při subklinických a atypických formách infekce, a také při odlišení mechanického nosičství u zvířat, je přímá mikroskopie a kultivace nezastupitelná. U nodulárních lézí, kde je kultivace z aspirátu nebo biopsie běžně neúspěšná, je PCR často jedinou možností, jak dospět k identifikaci původce. Byla vypracována i metodika detekce dermatofytů z parafínových histologických bločků [32, 126].
Molekulárně genetické metody jsou představovány jednak konvenční PCR, a dále RT-PCR nebo složitějšími metodikami (PCR-ELISA, PCR-RLB, microarrays). Nabízejí obvykle možnost detekovat DNA dermatofytů bez identifikace do druhu. Novější testy však již dokáží určit relativně široké spektrum druhů včetně hlavních zoofilních druhů, a to přímo z lidských a zvířecích klinických vzorků bez nutnosti kultivace [6, 15, 23, 66, 103, 109, 137, 138].
SPECIFIKA DIAGNOSTIKY DERMATOFYTÓZ
U ZVÍŘAT
Klinický obraz lézí u zvířete spolu s důkladnou anamnézou (zjištění doby a průběhu infekce, informace o kontaktu s dalšími zvířaty) a také výskytem ložisek mykózy u majitelů zvířete může být vodítkem pro diagnózu. Diagnostické testy jsou však vždy nezbytné.
Potvrzení infekce vlasových folikulů nebo epidermis u zvířat je komplikováno několika faktory. Prvním je obtížnost detekce lézí pod srstí zvířat; u minimálně symptomatických nebo asymptomatických zvířat může být problémem vybrání vhodné části těla pro odběr. Infikované chlupy mohou být zakryté zánětlivými krustami a vzhled lézí může být změněn předchozí léčbou. Dalším problémem je mechanické přenašečství artrospor na srsti (hlavně dlouhosrstá plemena koček a psů), které jsou na ní zachyceny kvůli kontaktu s nakaženým zvířetem nebo předměty v prostředí, kde se nakažení jedinci pohybují. To může vést k falešně pozitivní kultivaci dermatofytů bez přítomnosti aktivní infekce u daného zvířete. Zejména tedy u psů a koček se diagnostika dermatofytóz potýká s problematikou rozeznání mechanického přenašečství a aktivní infekce, které je určující pro rozhodnutí o léčbě, či karanténě.
Odběr šupin a chlupů může být proveden seškrábáním skalpelem a může být povrchový nebo hluboký. Pro odhalení případných ektoparazitů, jako např. roztoči Demodex, Notoedres a Sarcoptes, kteří mohou působit podobné léze jako dermatofyty (a také se spolu s nimi často vyskytují), je doporučováno, aby léze byly oškrábány do větší hloubky (až po vznik drobného kapilárního krvácení). Chlupy a šupiny/krusty z postižené lokality je možné vytrhnout pomocí zahnutého peánu (vytržena má být skupina chlupů chycených u báze). Nejrozšířenější technikou odběru pro detekci dermatofytů je dnes použití zubních kartáčků (měkký), nebo kousků sterilního koberce. Tato technika je jednoduchá, atraumatická a rychlá. Za rovnocenné je považováno provedení 20 tahů kartáčkem, 2–3 minuty kartáčování nebo takové kartáčování, dokud nejsou štětiny plné chlupů. Metoda je velmi citlivá a falešná pozitivita kultivace u mechanických nosičů bývá častá (viz níže). Méně běžné je používání lepicí pásky (délka asi 4 cm), která se přitlačí na lézi a poté na povrch kultivační plotny. Citlivost této metody je podobná jako u metody se zubním kartáčkem [28, 57, 84].
Přímé mikroskopické vyšetření chlupů a šupin patří mezi základní diagnostické testy, navíc je rychlé a levné (obr. 1d–f). Preparáty mohou být připraveny v minerálním oleji, roztoku KOH (10 % nebo 20 %), případně NaOH, nebo chlorfenolu. Barviva jako např. bavlnová modř mohou být použita k lepší vizualizaci houbových struktur v KOH preparátu, případně se dají použít fluorescenční barviva (viz výše). Na rozdíl od ostatních pozorovacích médií vyžadují louhové preparáty 10–20 minut inkubace (změkčení a projasnění chlupů a kožních šupin) před vlastním mikroskopickým vyšetřením, které následně musí být neodkladně provedeno kvůli zamezení vzniku artefaktů. Absence projasnění při použití minerálního oleje neovlivňuje vizualizaci spor a hyf. Výhodou minerálního oleje a chlorfenolu je možnost pozorovat vzorek okamžitě i s odkladem. Minerální olej také na rozdíl od KOH a chlorfenolu nepoškozuje z dlouhodobého hlediska optiku mikroskopu. Díky zmíněným výhodám bývá minerální olej doporučován jako nejvhodnější médium pro přímé mikroskopické vyšetření ve veterinární praxi. Charakter shluků artrokonidií a jejich velikost se liší v závislosti na druzích dermatofytů. Shluky malých artrokonidií (2–4 μm) jsou nacházeny u M. canis, řetízky artrokonidií různé velikosti jsou přítomny u většiny druhů rodu Trichophyton: 2–3 μm u zoofilních kmenů T. interdigitale, variabilní velikost u T. equinum, velké artrokonidie (až 12 μm) u T. verrucosum [57]. U psů, skotu a koní s tlustými a tmavě pigmentovanými chlupy je zapotřebí pečlivější pozorování (a prodloužená doba inkubace v KOH) [28, 57, 79, 84].
Vyšetření Woodovou lampou u domácích mazlíčků je velmi užitečné pro detekci infekce druhem M. canis. Napadené žlutozeleně fluoreskující chlupy jsou vhodné pro mikroskopické a kultivační vyšetření. Metoda má velmi vysokou pozitivní prediktivní hodnotu. Výsledky vyšetření je vždy nutné potvrdit mikroskopicky nebo kultivačně.
Kultivace zůstává jednou z nejspolehlivějších metod diagnózy, přestože ve veterinární praxi má některá úskalí. V závislosti na lokalizaci a vzhledu lézí mohou být na kultivační půdy inokulovány různé typy klinického materiálu: chlupy, šupiny, krusty, drápy a biopsie tkání (pseudomycetom). Nejčastěji se pro kultivaci používá SGA s cykloheximidem a dalším antibiotikem, nebo tzv. Dermatophyte Test Medium (DTM). Inkubace je doporučována při teplotě 25–30 °C. Zvýšení výtěžnosti diagnostiky a spolehlivější interpretace je dosaženo při souběžné kombinaci s přímým vyšetřením vzorku mikroskopicky, vyšetřením Woodovou lampou a případně také počítáním počtu kolonií (cfu) tam, kde hrozí mechanické nosičství. Na základě počtu cfu na kultivační agarové půdě je většinou možné rozlišení mezi subklinicky infikovanými zvířaty a mechanickými přenašeči, kde v prvním případě bývá počet kolonií dermatofytů mnohem vyšší. Při využití kartáčku či koberce pro odběr materiálu se doporučuje půdu v Petriho misce (průměr 90 mm) inokulovat vpichováním štětin do povrchu agaru ve 4–5 oblastech tak, aby byl viditelný otisk. Neléčené zvíře s aktivní infekcí, nebo zvíře ve velmi časné fázi léčby vykazuje obvykle při kultivaci růst velkého počtu kolonií (> 10 cfu/půda). S postupující léčbou se počet kolonií snižuje na jednotky, což je indikátor úspěšné léčby. Vyléčená zvířata nevykazují žádný růst, nebo růst jednotek kolonií (≤ 4 cfu/půda). Podobně nízké počty kolonií jsou typické i pro mechanické přenašeče. Samotná informace o pozitivní kultuře není tedy v řadě případů ve veterinární praxi dostatečná pro stanovení diagnózy, monitorování léčby nebo využití pro screeningové studie. Určitá kvantifikace počtu kolonií (cfu/půda) je často nezbytná pro správnou interpretaci. V prostředí, kde je velká koncentrace zvířat (např. útulky), se jako kritérium vyléčení (“mycological cure”) považují dva po sobě jdoucí negativní kultivační výsledky a pro screening je užívána metoda počítání cfu [57, 79, 84].
Histologické vyšetření je indikováno poměrně vzácně, a to v případě neobvyklých klinických projevů (obr. 1g-h). Nejčastěji se k němu přistupuje v případech chronických, nehojících se lézí a uzlů (kerion, pseudomycetom), při suspektním pemfigu a u atypických lézí nejasné příčiny. Z hlediska vizualizace houbových struktur jsou vhodná barvení PAS, nebo stříbření podle Grocotta (GMS). Využití Giemsova barviva je vhodné pro cytologické vyšetření aspirátu [57, 84].
HLAVNÍ PŮVODCI A JEJICH ZOONOTICKÝ
POTENCIÁL
Znalost prevalence jednotlivých patogenů u domácích zvířat má zásadní význam pro pochopení změn v etiologii a incidenci těchto infekcí u člověka. Informace o prevalenci asymptomatických nosičů infekce jsou také neocenitelné, protože právě taková zvířata bývají klíčová v horizontálním šíření infekce a snadno nakazí nic netušícího majitele. Aktuální data pro domácí zvířata v ČR bohužel takřka chybí, proto je nutné vycházet ze zahraničních studií. Údaje o prevalenci dermatofytóz mezi domácími zvířaty a o hlavních zjištěných původcích jsou shrnuty v tabulce 3. Většina veterinárních studií se zabývá prevalencí dermatofytů v populaci „zdravých i nemocných“ zvířat, nebo prevalencí dermatofytóz mezi zvířaty s kožní lézí/suspektní dermatofytózou. Druhý jmenovaný typ studií tedy dává spíše informaci o tom, v jaké míře se dermatofytózy podílí na kožních onemocněních daných zvířat a jak široká je diferenciální diagnostika. Studií, které mapují výskyt dermatofytóz mezi asymptomatickými zvířaty, bohužel není mnoho.
Table 3. Prevalence dermatofytóz a jejich hlavní původci u vybraných domácích zvířat 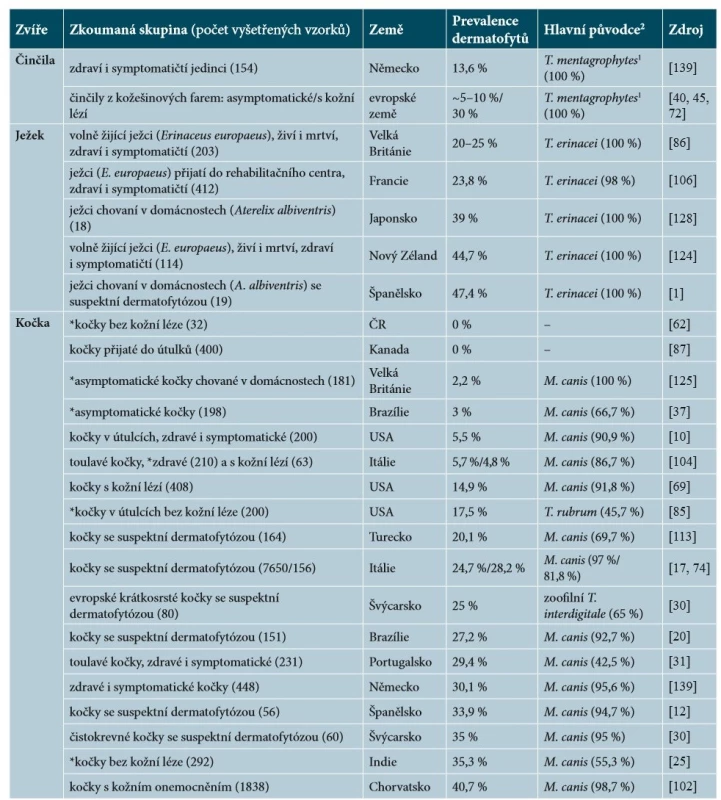

1Pod označením T. mentagrophytes (komplexu) v těchto studiích se podle dnešní taxonomie skrývá T. benhamiae (hlavní původce dermatofytóz morčat) a zoofilní T. interdigitale (králíci, psi, kočky); vzhledem k taxonomickým změnám a měnícímu se spektru dermatofytů nelze zvláště u starších studií skutečného původce určit.
2Použité zkratky rodových jmen dermatofytů: M. – Microsporum, N. – Nannizzia, T. – Trichophyton
*Studie označené hvězdičkou zjišťují prevalenci asymptomatických přenašečů infekce nebo mechanických přenašečů.Významné epidemiologické změny v dermatomykologii zpravidla nastávají pomalu. Na našem území byli po několik desetiletí hlavními původci zoonotických dermatofytóz M. canis a zoofilní T. interdigitale (dříve T. mentagrophytes komplex). Hlavní zoonotické riziko bylo tedy spojeno především s kontaktem s kočkami a se psy. Krátce před rokem 2010 se situace výrazně změnila kvůli extrémnímu rozšíření druhu T. benhamiae, který se stal u nás a v Německu [54, 132] nejdůležitějším původcem zoonotických kožních mykóz (a pravděpodobně i v dalších zemích, kde detailní epidemiologická data chybí). Hlavním rezervoárem tohoto druhu v Evropě jsou morčata, z menší části též králíci a hlodavci. Studie z posledních let ukázaly, že prevalence zmíněného dermatofyta mezi morčaty je vysoká (8,5–93 %) a značná část jedinců je asymptomatická (viz tab. 3), což značně usnadňuje nákazu majitelů. Jiná je situace v Japonsku, kde se tento patogen vyskytuje hlavně u králíků a v USA hlavně u psů [61, 116]. Taxonomická studie napříč izoláty z různých geografických oblastí a různých hostitelů ale ukázala, že T. benhamiae je pravděpodobně komplex čtyř druhů, z nichž se tři vyskytují v Evropě včetně ČR [22, 53]. Původcem evropské epidemie jsou kmeny se žlutými koloniemi (tzv. žlutý fenotyp), které se v Evropě rozšířily mezi roky 2000–2010 a působí zhruba 80 % všech infekcí člověka a morčat u nás. Kmeny s bělavými koloniemi produkujícími červený pigment (tzv. bílý fenotyp) jsou geneticky i morfologicky různorodé, a zodpovědné za zbývajících 20 % infekcí u morčat a člověka u nás, a část nákaz u králíků a také za většinu infekcí v Japonsku a USA. Kmeny bílého fenotypu se u nás vyskytovaly již v minulosti a nejsou zodpovědné za současnou epidemii (pravděpodobně byly dříve identifikovány jako „T. mentagrophytes komplex“). Klinický obraz infekcí působených T. benhamiae u morčat a člověka ukazuje obrázek 2.
Image 2. Klinický obraz infekcí způsobených Trichophyton benhamiae u morčat a člověka 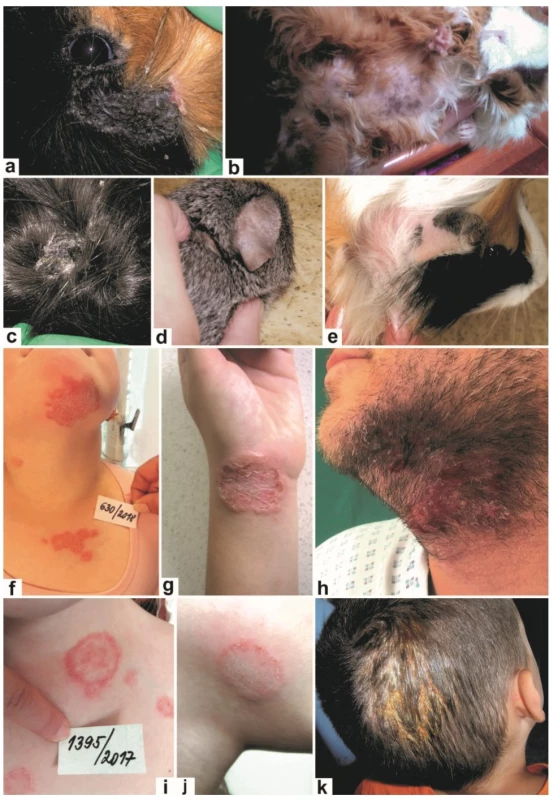
Mokvající léze pod okem morčete (a); alopetické oblasti na břiše a končetinách (b); šupící se ložisko s výraznou hyperkeratózou na zádech morčete (c); oblasti jemného šupení na boltci a za ním (d); alopetické ložisko za boltcem (e); mnohočetná erytematózní ložiska (tinea corporis et tinea faciei) na hrudníku, krku a bradě (f); tinea corporis v oblasti předloktí a zápěstí (g); tinea barbae (h; archiv kožního oddělení Fakultní nemocnice Ostrava); mnohočetná ložiska na hrudníku a v podklíčkové oblasti (i); tinea faciei (j); tinea capitis (k). Microsporum canis je nejvýznamnějším původcem dermatofytóz u koček a psů (obr. 3a-i), přičemž kočky jsou považovány za jeho nejdůležitější rezervoár. Infekce u zvířat jsou velmi pleomorfní a u koček se obvykle nejedná o lokalizované onemocnění, ačkoliv vzhled lézí pro to často svědčí [26]. Nakažené kočky s minimálními symptomy a kontaminované prostředí hrají důležitou roli v šíření nákazy. Dostupná data ukazují, že M. canis působí > 90 % dermatofytóz koček ve většině zemí (viz tab. 3). U psů a volně žijících koček se ve větší míře uplatňují i další původci, jako např. zoofilní T. interdigitale. Studie u koček a psů s kožní lézí/supektní dermatofytózou ukazují, že jen u poměrně malé části těchto zvířat se dermatofytóza prokáže (viz tab. 3), což odráží nesnadnou a širokou diferenciální diagnostiku. Microsporum canis je také často nacházen u koní, králíků (obr. 3j) a příležitostně u dalších zvířat (viz tab. 1), a jeho celosvětový zoonotický význam je značný. Je nejčastějším původcem tiney capitis (obr. 3n, p) ve velké části evropských zemí, Jižní Americe a Číně; běžně působí infekce hladké kůže (obr. 3k-m, o) a nepříliš často i onychomykózu [39, 112, 119, 132, 142]. Výjimečná situace je v současnosti v Německu, kde se dominantním původcem tiney capitis stal druh T. benhamiae [132]. V České republice je situace srovnatelná s většinou evropských zemí, tj. M. canis je hlavním původcem tiney capitis a jedním z hlavních zoonotických původců tiney corporis.
Image 3. Klinická manifestace infekcí způsobených Microsporum canis u zvířat a člověka 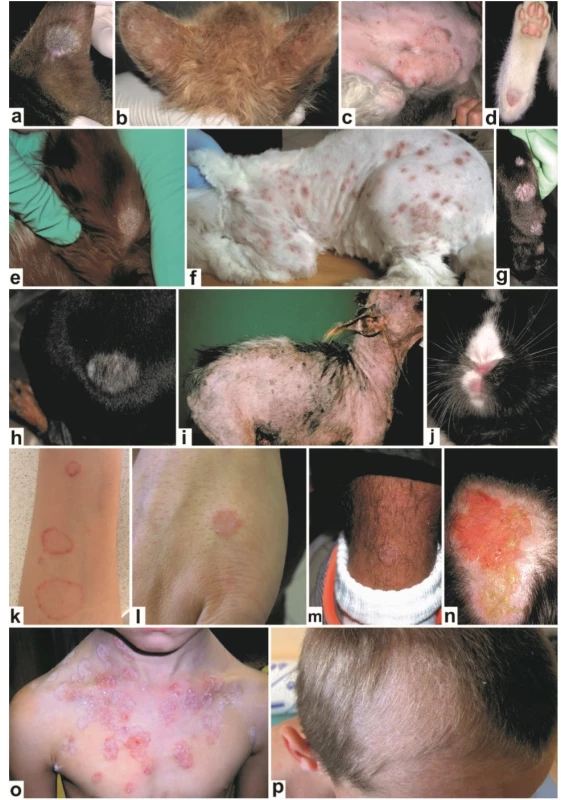
Okrouhlé, alopetické, šupící se ložisko na uchu kočky (a); mnohočetná, drobná ložiska alopecie na uších kotěte (b); olupující se mapovité ložisko ohraničené erytematózním lemem na břiše a stehně perské kočky (c); ložisko na bérci kočky (d); šupící se alopetické ložisko na uchu psa (e); mnohočetná erytematózní ložiska na trupu a končetinách psa, viditelná po částečném oholení srsti (f); mnohočetná ložiska na tlapě a bérci psa (g); alopetické ložisko v bederní oblasti psa (h); generalizované postižení kůže u jorkšírského teriéra (i); erytematózní ložisko na horním pysku králíka (j); tinea corporis lokalizovaná na předloktí (k), hřbetu ruky (l) a bérci (m); tinea capitis (n); mnohočetná ložiska s deskvamací, erytematózním lemem a pustulami (tinea corporis) (o); tinea capitis s ulámanými vlasy a typickým vzhledem strniště (p). Rezervoárem zoofilních kmenů T. interdigitale jsou u nás především králíci (obr. 4a-c), hlodavci, a také volně žijící psi (obr. 4d) a kočky (spíše než doma chované). U králíků a hlodavců, kromě morčat, se jedná o dominantního původce, který působí významné ekonomické ztráty především na králičích farmách [14, 18, 51, 64]. Rozsáhlé dermatofytózy u mladých králíků silně ovlivňují zdraví a růst zvířat spolu s bakteriálními superinfekcemi [81]. Prevalence u králíků bývá někdy extrémně vysoká, ale bývá přehlížena kvůli vysokému procentu asymptomatických zvířat (viz tab. 3). Celosvětově patří tento druh k nejvýznamnějším původcům zoonóz mezi dermatofyty a u člověka převážně působí zánětlivé infekce hladké kůže (obr. 4e-g), méně často jiné subtypy tiney [16, 38]. Opakovaná onemocnění jsou častá u pracovníků na farmách [131, 135].
Image 4. Klinická manifestace infekcí způsobených zoofilními kmeny Trichophyton interdigitale (a-g) a Trichophyton verrucosum (h-k) u zvířat a člověka 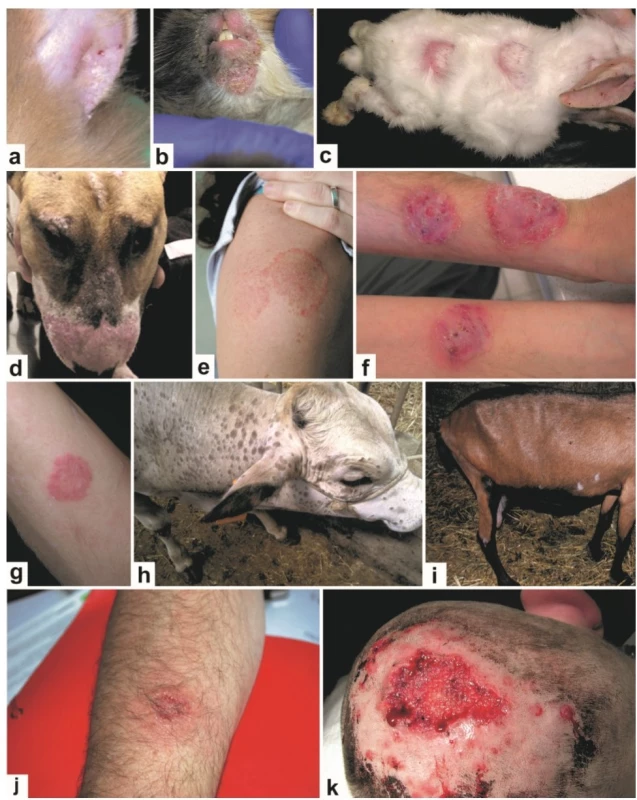
Olupující se ložiska na uchu (a) a cirkumorálně (b) u králíka; mnohočetná, kruhovitá, erytematózní ložiska na zádech, krku a končetinách králíka (c); erytematózní, alopetická ložiska na čenichu, čele a periokulárně u psa (d); erytematózní, okrouhlá ložiska (tinea corporis) na paži (e) a předloktích (f-g); mnohočetná, kruhovitá ložiska na hlavě a krku krávy (h); alopetická ložiska na bocích a zadní končetině kozy (i); tinea corporis předloktí (j); tinea capitis způsobená T. verrucosum: infekce postihla oblast hlavy dříve ošetřenou po úrazu, na obrázku je situace po snesení nekrotických částí (léčba byla dokončena perorálními antimykotiky – viz Mallátová et al. [73]) (k). Trichophyton verrucosum se typicky vyskytuje u skotu (obr. 4h), ale nákazy jsou známy takřka u všech savců a dokonce i ptáků (viz tab. 1). Ve vyspělých zemích jsou hlavním rezervoárem farmy zaměřené na intenzivní chov skotu, přičemž infekce zde mohou mít dopad jak na produkci mléka a masa, tak na kvalitu kůže určené pro zpracování [8, 57]. Prevalence u skotu a sekundárně i u člověka se odvíjí od lokální míry proočkovanosti skotu. Ve většině evropských zemí je dnes výskyt T. verrucosum nízký (výjimkou je např. Itálie), naopak v oblastech bez vakcinace je prevalence extrémně vysoká (viz tab. 3), především u mladých zvířat, kde bývá zastoupeno velké procento asymptomatických nosičů (viz tab. 2). Zoonotický potenciál T. verrucosum je velmi vysoký, hlavně u farmářů, veterinářů a dalších pracovníků v živočišné produkci. Vysoký podíl T. verrucosum na celkovém počtu dermatofytóz člověka je znám z některých oblastí Afriky a Středního východu (jde o desítky procent), kdežto v Evropě je tento podíl většinou jen 0–2 % [21, 48, 81, 112]. Nízká incidence infekcí člověka v ČR odráží poměrně důsledné provádění vakcinace skotu. Při nákaze člověka se obvykle objevují agresivní zánětlivé kožní léze, lokalizované nejčastěji na končetinách nebo hlavě (obr. 4j-k), které mohou být doprovázeny systémovými příznaky jako je horečka a lymfadenopatie [21, 117]. Tinea barbae a capitis jsou poměrně časté klinické formy, které se nezřídka hojí jizvou se vznikem ireverzibilní alopecie.
Jediným rezervoárem druhu Trichophyton erinacei jsou ježci. Patogen je nalézán u divoce žijícího ježka západního (Erinaceus europaeus), který se vyskytuje v západní a severní Evropě a také ve Velké Británii, a který byl zavlečen do volné přírody na Novém Zélandu a v Japonsku [128]. Dále je T. erinacei běžný u ježka bělobřichého (Atelerix albiventris), který je původem z Afriky, ale je chován po celém světě jako domácí mazlíček [124, 127]. Prevalence patogena u obou druhů ježků je vysoká – desítky procent (viz tab. 3) a většina nakažených jedinců má minimální nebo žádné symptomy. Člověk a další zvířata, nejčastěji psi, se nakazí přímým kontaktem s infikovaným ježkem, nebo hnízdy ježků, kde zůstávají artrospory viabilní až jeden rok [34, 35, 67, 100]. Díky stoupající popularitě ježků jako domácích mazlíčků mají počty infekcí člověka stoupající trend po celém světě [53]. Výjimkou není ani ČR, kde je obliba chovu ježků teprve v počátcích a T. erinacei je stále vzácným zoonotickým patogenem. Mírně se zvyšující incidence případů v posledních letech potvrzuje tento trend (2013–2014 : 0, 2015 : 2krát, 2016 : 2krát, 2017 : 4krát). Vybraným případům se podrobněji věnuje samostatná publikace [70].
Trichophyton quinckeanum je druh historicky spjatý především s infekcemi u myší a hlodavců a zřídka izolovaný ze člověka. Se stále se zlepšujícím životním standardem je logické, že se tento druh v současnosti ve vyspělých zemích v podstatě nevyskytuje. Jedinou výjimkou je nedávný záznam o výskytu 62 infekcí člověka (tinea corporis a capitis) diagnostikovaných v Německu v letech 2013–2017 v jediné laboratoři [133]. Kočky byly identifikovány jako zdroj infekce u osmi pacientů. U nás evidujeme jediný případ infekce z konce roku 2016 (ložisko na bradě u 23leté ženy), kde bylo druhové určení potvrzeno sekvenací oblasti ITS rDNA; zdroj infekce nebyl zjištěn. Podobně i druh Trichophyton equinum u nás působí infekce člověka jen velmi vzácně. Tento druh je celosvětově nejběžnějším původcem infekcí u koní (viz tab. 3). Infekce koní a oslů kmeny podobnými T. verrucosum jsou z části působeny druhem Trichophyton bullosum, který byl zjištěn i u koně v České republice [71] a v dalších několika zemích (viz tab. 1). Žádný případ přenosu na člověka u nás zatím nebyl zaznamenán. Geograficky nejblíže byly takové případy diagnostikovány ve Francii [111, 118]. O výskytu ostatních zoofilních druhů uvedených v tabulce 1 chybí na našem území evidence potvrzená molekulárními daty.
EPIDEMIOLOGICKÁ SITUACE V ČESKÉ REPUBLICE
Popis epidemiologické situace uvedený v následujících odstavcích vychází z výsledků epidemiologické studie lidských dermatofytóz provedené na území České republiky v pětiletém období (1. 7. 2011 až 31. 6. 2016). Všechny dermatofyty kromě T. rubrum byly určeny pomocí molekulárních metod, převážně sekvenací oblasti ITS rDNA. Pro detailní údaje o sběru dat a metodice identifikace odkazujeme na dříve publikované dvouleté výsledky studie [54]. Během sledovaného období bylo zaznamenáno celkem 1004 zoonotických případů tiney corporis (tab. 4), 60 zoonotických případů tiney capitis (tab. 5) a 24 onychomykóz způsobených zoofilními dermatofyty.
Table 4. Původci tiney corporis 1 v České republice v období červenec 2011 až červen 2016 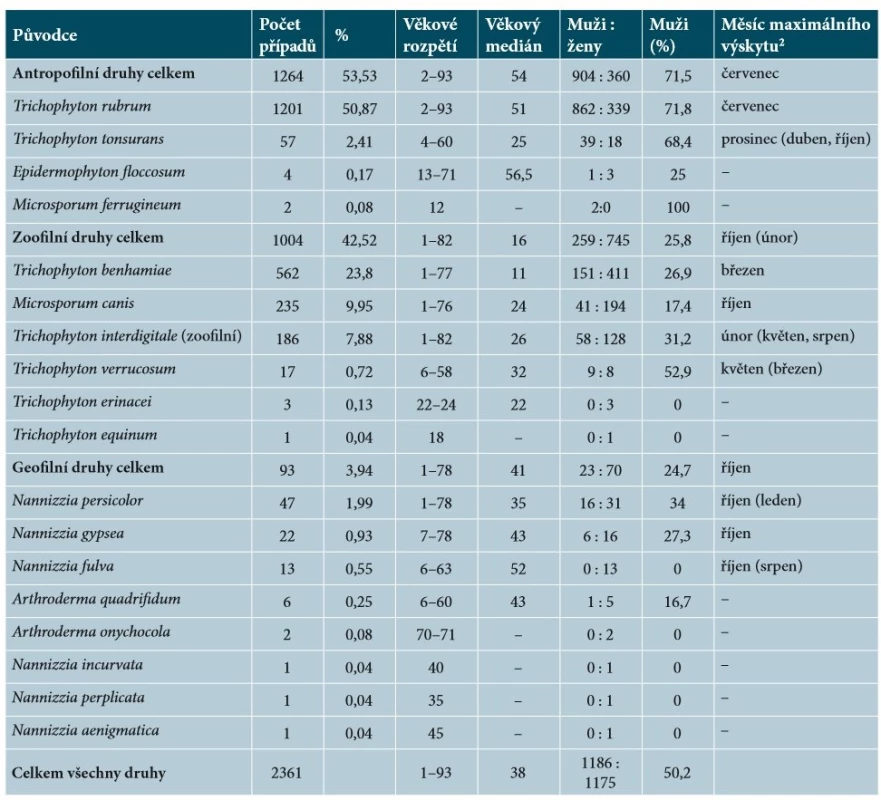
1včetně klinických subtypů tinea faciei, tinea gladiatorum a tinea cruris
2Uvedeno jen pro druhy zastoupené ve studii alespoň 10 izoláty. Pokud je v průběhu roku přítomno několik podobně výrazných maxim výskytu, jsou nižší maxima uvedena v závorce.Tinea corporis je nejběžnější klinickou jednotkou vyvolanou dermatofyty přenesenými ze zvířat. Zoofilní dermatofyty působí 42,5 % všech dermatofytóz hladké kůže; ostatní případy jsou působeny antropofilními a geofilními druhy (obr. 5a, tab. 4). Mezi zoofilními dermatofyty je nejběžnějším původcem T. benhamiae, následovaný M. canis a zoofilními kmeny T. interdigitale. Incidence tiney corporis se v průběhu pětiletého období výrazněji neměnila mezi sledovanými roky (celkově je vidět nepatrný klesající trend; obr. 5c). Stejně tak nejsou patrné výraznější výkyvy v incidenci jednotlivých zoonotických patogenů (obr. 5c). Zajímavé je, že incidence infekcí působených T. benhamiae, který se na našem území objevil krátce před rokem 2010, nedosáhla pravděpodobně svého vrcholu a stále je patrný mírně rostoucí trend. Naproti tomu počty infekcí působených M. canis mírně klesají (obr. 5c). Vzhledem k rozdílným hostitelům těchto dvou druhů nemůže být příčinou vytlačování jednoho patogena druhým. Vysvětlením tedy mohou být měnící se preference chovatelů zvířat ve prospěch drobnějších mazlíčků, jako jsou morčata a králíci. Na vině může být i zvyšující se prevalence T. benhamiae mezi chovanými hlodavci nebo klesající prevalence M. canis u chovaných koček a psů. Data, která by tyto hypotézy potvrdila, ale nejsou k dispozici. Narůstající trend může být v případě T. benhamiae alespoň z části přičítán šíření nového virulentního genotypu tohoto patogena mezi morčaty, který se v Evropě začal šířit až po roce 2000 a u nás byl poprvé zaznamenán krátce před rokem 2010 [22, 53].
Graph 1. Epidemiologická analýza 2361 případů tiney corporis diagnostikovaných během pětileté studie (VII. 2011-VI. 2016) 
Zahrnuty jsou i podjednotky tinea faciei, tinea cruris a tinea gladiatorum. Ekologie původců tiney corporis (a) – zoonotický zdroj nákazy byl zjištěn u 42,5 % případů. Věková struktura pacientů a hlavní původci tiney corporis (b) – zoonotické nákazy dominují v nižších věkových kategoriích. Množství případů tiney corporis diagnostikovaných v jednotlivých pololetích (I. – leden až červen; II. – červenec až prosinec) v průběhu studie (c), přerušovaná čára vyznačuje lineární trend za celé pětileté období – u všech druhů kromě Trichophyton benhamiae je patrný setrvalý, nebo mírně klesající trend. Incidence případů tiney corporis během jednotlivých měsíců za pětileté období (d) – absolutní maximum v říjnu je podmíněno vysokým výskytem Trichophyton rubrum, Microsporum canis a geofilních druhů (viz podobrázek e). Incidence případů působených hlavními patogeny během jednotlivých měsíců roku (e). Incidence tiney corporis se výrazně mění během roku, přičemž nejvyšší počet infekcí bývá diagnostikován v letních měsících a na začátku podzimu s maximem v říjnu (obr. 5d). Toto celkové rozložení je ale podmíněno především infekcemi vyvolanými antropofilním druhem T. rubrum (obr. 5e). Infekce působené T. benhamiae se výrazně častěji vyskytují v únoru a březnu, což souvisí s poměrně častým pořizováním morčete či králíka jako vánočního dárku pro děti. Vzhledem k inkubační době, která je zhruba jeden měsíc, a další prodlevě před návštěvou lékaře jsou tyto a další zoonotické infekce diagnostikovány většinou v horizontu dvou měsíců od nákazy. Na rozdíl od T. benhamiae má incidence infekcí působených M. canis své maximum v říjnu. To zřejmě souvisí s častějším kontaktem lidí s volně žijícími kočkami v letních měsících a také s návraty z dovolených ve Středozemí, kde je vysoký výskyt toulavých koček s vysokou prevalencí nákaz druhem M. canis. Tinea corporis působená geofilními druhy má také maximum výskytu v říjnu, což má zřejmě souvislost s pracemi na zahradě a častějšími návštěvami lesa v letních měsících (obr. 5e).
Různí původci tiney corporis se vyznačují rozdílnou stratifikací v populaci co do věku a pohlaví pacientů. Antropofilní druhy se vyskytují častěji u mužů (71,5 %) a incidence infekcí roste s věkem. Výjimkou je T. tonsurans, který má maximum výskytu u mužů ve věkové kategorii 20–30 let (obr. 5b). Nejběžnějším původcem tiney corporis zůstává T. rubrum, který se takřka nevyskytuje u dětí do 10 let, ale ve věkových kategoriích nad 50 let působí 74–91 % všech infekcí (obr. 5b). Naproti tomu geofilní druhy, které působí 4 % infekcí hladké kůže, se výrazně častěji vyskytují u žen (75,3 %) a věková stratifikace není tak výrazná. Přibližně stejně často se tyto druhy vyskytují u věkových kategorií v rozmezí 30–60 let (věkový medián pacientů 41 let), ale ani infekce v jiném věku nejsou výjimkou (obr. 5b). Podobně i zoonotické infekce se mnohem častěji vyskytují u žen (74,2 %). Na rozdíl od antropofilních a geofilních druhů je incidence zoonotických infekcí kůže výrazně vyšší u mladších věkových skupin (věkový medián 16 let). Tato skutečnost je nejvýraznější u druhu T. benhamiae, který působí 70 % infekcí u dětí do 10 let a 56 % infekcí ve věkové skupině 10–20 let; u dospělé populace výskyt tohoto patogena výrazně klesá (obr. 5b). Naopak M. canis se nejčastěji vyskytuje ve věkové kategorii 20–29 let (věkový medián 24 let). Infekce působené zoofilními kmeny T. interdigitale jsou bez výraznějšího rozdílu rozprostřeny v populaci od dětského věku až do 40 let (obr. 5b), u starších dospělých incidence klesá. Trichophyton verrucosum se vymyká ostatním zoofilním druhům tím, že rovnoměrně postihuje muže i ženy, přičemž pacienti mají nejvyšší věkový medián – 32 let (viz tab. 4).
Tinea capitis je v ČR poměrně málo častou klinickou jednotkou, která je převážně zoonotického původu (75,9 % případů, obr. 6a) a ve sledovaném období měla incidence mírně klesající trend (obr. 6c). Hlavními původci jsou M. canis (40,5 %) a T. benhamiae (31,6 %). Antropofilní dermatofyty jako T. rubrum, T. tonsurans a T. soudanense se na našem území uplatňují jako původci tiney capitis vzácně (viz tab. 5), a to zejména u etnických menšin a cizinců. Další ve světě běžný původce tiney capitis, Microsporum ferrugineum, se u nás téměř nevyskytuje a ve sledovaném období byl diagnostikován pouze ve dvou případech tiney corporis, které jsou z let 2015 a 2016. Za zmínku ale stojí pět případů tiney capitis u dětí do 10 let diagnostikovaných v letech 2017 a 2018 (nezahrnuté do analyzovaného období). Je tedy zřejmé, že je nutno s tímto patogenem, který u nás takřka vymizel, při diagnostice opět počítat.
Table 5. Původci tiney capitis v České republice v období červenec 2011 až červen 2016 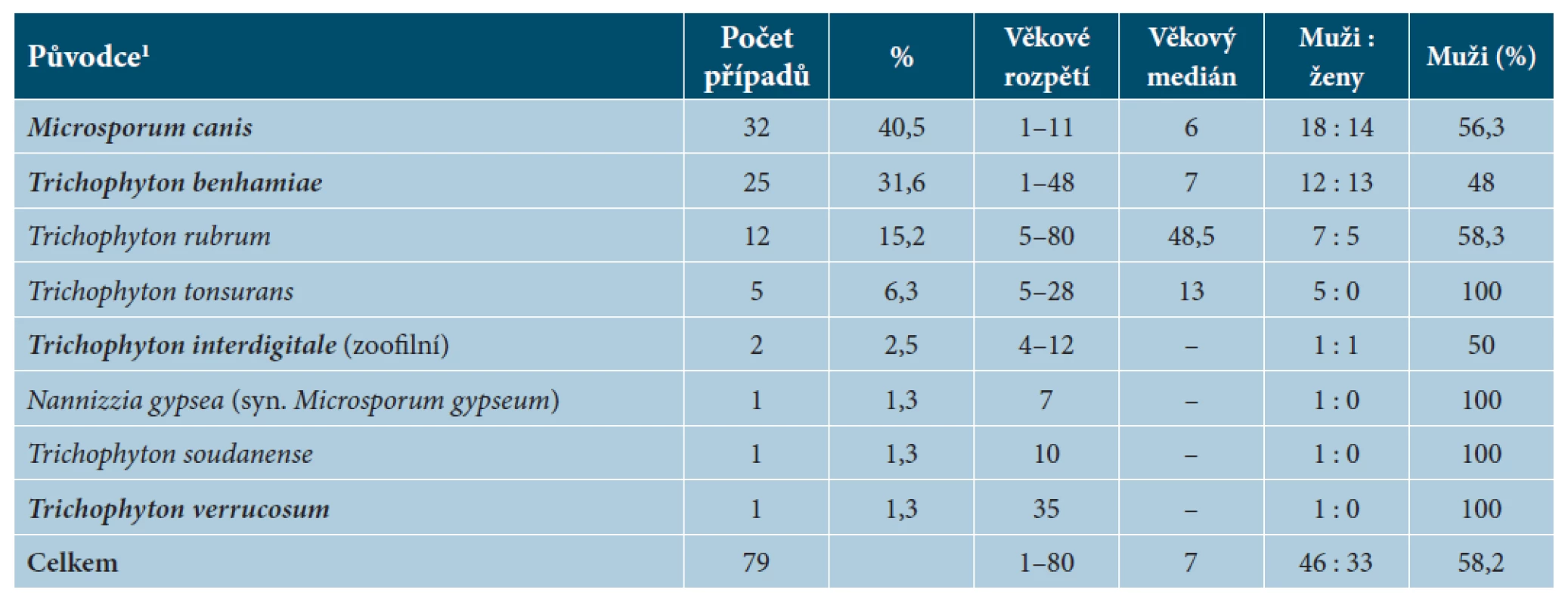
1Zoofilní druhy jsou zvýrazněny tučně. Image 5. Epidemiologická analýza 79 případů tiney capitis diagnostikovaných během pětileté studie (VII. 2011 až VI. 2016) 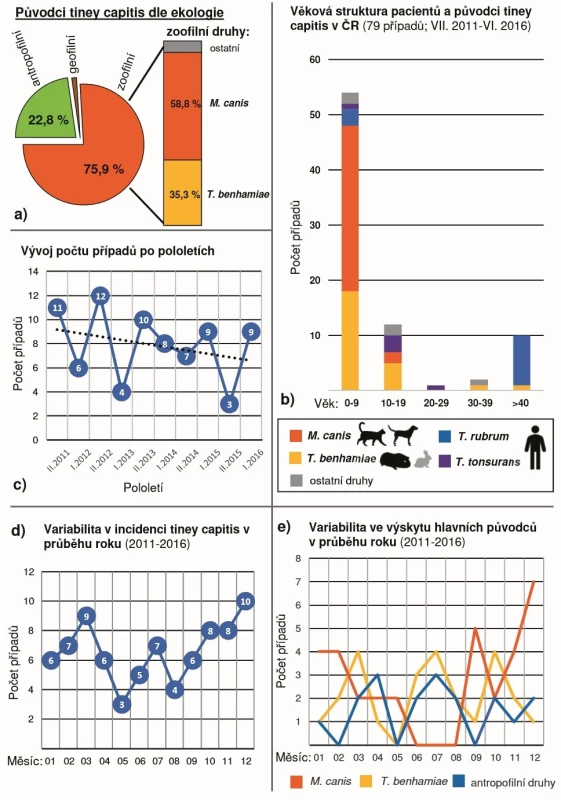
Ekologie původců tiney capitis (a) – zoonotický zdroj nákazy byl zjištěn u 75,9 % případů. Věková struktura pacientů a hlavní původci tiney capitis (b) – 68,4 % případů bylo diagnostikováno u dětí do 10 let, kde silně dominují druhy Microsporum canis a Trichophyton benhamiae. Množství případů tiney capitis diagnostikovaných v jednotlivých pololetích (I. – leden až červen; II. – červenec až prosinec) v průběhu studie (c) – přerušovaná čára vyznačuje lineární trend za celé pětileté období. Incidence případů tiney corporis během jednotlivých měsíců roku za pětileté období: všechny případy (d), případy dle etiologie (e). Sezonní incidence tiney capitis u nás měla v průběhu roku několik maxim – prosinec, březen, červenec (obr. 6d). Případy způsobené M. canis byly běžnější během podzimních a zimních měsíců, zatímco T. benhamiae vykazoval maxima v březnu, červenci a říjnu (obr. 6e). Vzhledem k relativně nízkému počtu případů je přesná interpretace těchto výkyvů obtížná, ale vysvětlení některých sezonních maxim se shoduje s tineou corporis (viz výše).
Výskyt tiney capitis je u nás výrazně věkově stratifikovaný a většina případů se vyskytuje u malých dětí (věkový medián 7 let). Z celkového počtu 79 případů zachycených ve studii bylo u dětí do 10 let diagnostikováno 68,4 % případů; 83,5 % případů se vyskytlo v populaci do 20 let. Případy u starších pacientů jsou poměrně vzácné a byly způsobeny převážně T. rubrum (viz tab. 5). Dominance zoofilních druhů u dětí a dospívajících je velmi výrazná. U dětí do 10 let působí M. canis 55,6 % infekcí a T. benhamiae 33,3 % infekcí, ve věkové skupině 10–19 let je M. canis příčinou 16,7 % případů, T. benhamiae 41,7 % a T. tonsurans 25 % (obr. 6b). Případy vyvolané zoofilními druhy byly zhruba rovnoměrně zastoupeny u chlapců a dívek (viz tab. 5) na rozdíl od tiney corporis (viz tab. 4).
Onychomykóza způsobená zoofilními dermatofyty je velmi vzácná a za pětileté období bylo identifikováno pouze 24 případů (původci: T. benhamiae 16krát, M. canis 7krát, T. verrucosum 1krát), které tvořily pouze 0,6 % onychomykóz z celkového počtu 3 998 případů v tomto období. Druhy T. rubrum a T. interdigitale (antropofilní kmeny) byly původci 98,9 % onychomykóz na našem území; zbylé případy byly způsobeny geofilními druhy. Věk pacientů trpících onychomykózou způsobenou antropofilními druhy se výrazně nelišil od případů působených druhy zoofilními: věkový medián 53, respektive 47 let. Výrazné rozdíly se dají mezi těmito dvěma skupinami najít v pohlaví pacientů a lokalizaci infekce. Zoofilní dermatofyty častěji postihují nehty rukou (37,5 % případů) a jsou častější u žen (66,6 %). Naproti tomu jsou antropofilní druhy na nehtech rukou nacházeny vzácněji (7,1 % případů) a ženy tvoří jen 37 % případů.
LÉČBA
Tinea corporis bývá zvládnutelná lokálními antimykotiky, která se obvykle 1–2krát denně roztírají v tenké vrstvě na ložisko i jeho okolí (lem o šířce cca 2 cm). Léčba obvykle trvá 2–4 (–8) týdny a má pokračovat ještě 1–2 týdny po vymizení příznaků. Její úspěšnost je vysoká. K dispozici je široká paleta lokálních preparátů v podobě krémů, gelů a roztoků, které obsahují účinné imidazolové (ekonazol, ketokonazol, klotrimazol, mikonazol, oxikonazol, tiokonazol), allylaminové (terbinafin, naftifin), pyridinové (ciklopiroxolamin) nebo morfolinové deriváty (amorolfin). Ekonazol nebo naftifin lze použít od nejútlejšího věku, většina dalších lokálních antimykotik se doporučuje až pro starší děti. Bezpečnost léčby je vysoká, protože sérové hladiny léků při lokální aplikaci jsou nízké. Většina nežádoucích účinků jsou kožní reakce v místě aplikace, které bývají mírné a přechodné. Perorální terapie může být zapotřebí u rozsáhlejších lézí, tiney barbae nebo při postižení kůže v okolí očí. V této indikaci je u tiney corporis s úspěchem užíván terbinafin (250 mg/den, 2–4 týdny), itrakonazol (200 mg/den, 1 týden nebo 100 mg/den, 2 týdny) nebo flukonazol (150–300 mg/1krát týdně; 2–4 týdny). U dětí je možno podávat terbinafin v dávce 6 mg/kg/den po dva týdny [43, 98, 120, 122]. Perorální léčba tiney barbae terbinafinem nebo triazoly většinou trvá 6–8 (–12) týdnů [9, 110].
Tineu capitis je nutno léčit perorálními antimykotiky. Případy vyvolané zástupci rodu Microsporum vyžadují většinou dlouhodobější terapii a vyšší dávkování oproti rodu Trichophyton. Evropská doporučení v dávkování účinných léků a léčebné režimy jsou shrnuty v tabulce 6. Léčba v ČR je však svébytná a neřídí se evropskými, ani americký doporučeními, a je dokonce odlišná i od praxe v Německu [44, 59, 89]. U nás je k léčbě tiney capitis u dětí povolen pouze terbinafin, takže možnost volby v této věkové skupině odpadá. U ostatních doporučených antimykotik naráží léčba dětí na indikační omezení (viz tab. 6) nebo chybějící registraci léků (griseofulvin). Terbinafin je u nás k dispozici ve formě tablet, které je nutno dělit, což způsobuje poměrně nepřesné dávkování. Hmotnost dítěte je dobré zaokrouhlovat směrem nahoru vzhledem k rychlejšímu metabolismu léku u dětí. Navíc u infekcí působených M. canis dochází při nižším dávkování často k selhání terapie [11, 120, 122]. Vyšší dávky (dokonce i 7–12,5 mg/kg/den) jsou dětmi dobře snášeny [27]. Délka léčby je individuální a závisí také na původci. U infekcí způsobených M. canis trvá 6–12 týdnů, u nákaz vyvolaných zástupci rodu Trichophyton obvykle 4 týdny. Na základě zkušeností od nás a z Německa je terbinafin velmi efektivní, pokud je původcem T. benhamiae. Léčba trvá standardně 4 týdny a u purulentních abscedujících forem až 8 týdnů [91, 123]. Nemocné děti nemusí být izolovány a po započetí léčby mohou do kolektivu (tinea capitis vyvolaná více infekčními antropofilními druhy vyžaduje alespoň týden izolace doma).
Table 6. Perorální léčba tiney capitis podle doporučení Evropské společnosti pro pediatrickou dermatologii [59]1 ![Perorální léčba tiney capitis podle doporučení Evropské společnosti pro pediatrickou dermatologii [59]<sup>1</sup>](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ac5feedad38bdef8ff9ef3de8d181471.png)
1Modifikováno podle Gupta & Cooper [43], Nenoff et al. [89] a Gupta et al. [44]; přidána lokální doporučení (poznámka) Metaanalýzy řady studií ukázaly, že griseofulvin a terbinafin jsou stejně efektivní a vykazují největší procentuální podíl pacientů vyléčených ad integrum. Terbinafin je účinnější v léčbě infekcí způsobených rodem Trichophyton, kdežto griseofulvin je účinnější proti rodu Microsporum. Itrakonazol a flukonazol jsou vhodné jako alternativy ke dvěma zmiňovaným antimykotikům [44, 56].
Lokální léčba má u tiney capitis doplňkový význam a slouží k odstranění krust s vlákny a sporami z povrchu ložisek a k zabránění rozsevu infekce do okolí ložiska (u infekcí antropofilními dermatofyty brání přenosu na další osoby). Doporučuje se mýt vlasy 2–3krát týdně antimykotickým šampónem s imidazolem (nechá se působit 5 min), a potírat ložiska dvakrát denně antimykotikem z jiné chemické skupiny v roztoku nebo krému [49, 59, 122]. U kerion Celsi se doporučuje odstranit krusty kompresemi vlhkým tampónem, což urychluje hojení a snižuje riziko bakteriální superinfekce. U těžkých případů s mykidovými reakcemi je možné zvážit podání perorálních steroidů [49].
Vyšetření a léčba podezřelého zvířete je vždy žádoucí a rodinu je nutné poučit o nutnosti dezinfekce prostředí (pelechu a dalších prostor, kde se zvíře pohybuje, čištění a luxování čalouněného nábytku apod.). Ačkoliv u dermatofytóz zvířat často dochází k spontánnímu uzdravení, je léčbou dosaženo rychlejší klinické odpovědi s minimalizací kontaminace prostředí a s tím souvisejícím rizikem přenosu na další hostitele včetně člověka. Zvířata, která byla v kontaktu s nakaženým jedincem, by měla být také vyšetřena, a to i v případě, že symptomy chybí, protože se může jednat o bezpříznakové nosiče infekce. Aplikací perorálních antimykotik zvířeti není vyloučen přenos na člověka, a proto se doporučuje léčbu kombinovat s lokálními antifungálními přípravky, především šampony. Při adekvátním léčení a dodržování hygienických opatření může zvíře v rodině zůstat [57, 84, 89].
Léčba zvířat vyžaduje individuální přístup s ohledem na druh postiženého zvířete a přesahuje možnosti této publikace. Proto odkazujeme na dostupná doporučení pro léčbu dermatofytóz u koček a psů [84], morčat [63], a dalších domácích a hospodářských zvířat [107, 114].
PREVENCE ŠÍŘENÍ ZOONOTICKÝCH NÁKAZ
Obecně jsou významné epidemie způsobené zoofilními dermatofyty považovány za vzácné, zejména ve srovnání s jinými patogeny, jako jsou bakterie a viry. Menší epidemie se však vyskytují velmi často a obvykle s omezeným počtem zasažených jedinců (tj. méně než 20 lidí a/nebo zvířat), ale v některých případech jsou čísla mnohem vyšší. Lokální epidemie v domácnostech a zvířecích chovech jsou časté po celém světě, ačkoli v literatuře jsou jen sporadicky hlášené, protože dermatofytóza u lidí i zvířat není ve většině zemí onemocněním podléhajícím hlášení. Mezi faktory, které přispívají k výskytu takových epizod, patří špatné povědomí lidí o úloze zvířat, zejména domácích mazlíčků, jako přenašečů mykotické infekce. Ve většině případů jsou nově získaná, infikovaná zvířata začleněna do domácnosti, či chovu bez jakýchkoli opatření (např. karanténní období, veterinární vyšetření apod.).
Mnoho zoonotických infekcí dnes souvisí se zverimexy a dalšími způsoby prodeje zvířat (chovné stanice, množírny zvířat, chovatelé jednotlivci apod.). Tyto infekce mohou mít za následek nejen onemocnění zaměstnanců, či zákazníků, případně celých rodin, ale pravděpodobný je i přenos na další zvířata v obchodě a v důsledku toho na velký počet osob rozprostřených na geograficky nezanedbatelném území [46]. Obchody se zvířaty tedy mohou být ohniskem pro poměrně rozsáhlé epidemie infekcí, jako se tomu stalo a stále děje v případě nákaz druhem T. benhamiae přenášeným na člověka hlavně z morčat. Z tohoto důvodu by preventivní opatření v obchodech měla spočívat v karanténě nových zvířat v čistém prostředí a získání materiálu pro průkaz dermatofytů (kultivací, případně PCR) před tím, než jsou začleněna mezi ostatní jedince. Umístění různých druhů zvířat do jedné klece není vhodné (zejména u králíků a morčat). Při pozitivním výsledku kultivace, či PCR by zvířata před prodejem měla být léčena. Pragmatičtějším a levnějším přístupem může být profylaktické mytí nových zvířat enilkonazolem [78, 96].
Použité klece mají být čištěny a dezinfikovány vhodnými prostředky ničícími artrospory dermatofytů [83]. Při manipulaci se zvířaty je třeba zvážit hygienická opatření (minimalizace rizika pro personál vybráním jediného správce, který se zvířaty manipuluje; používání rukavic a dezinfekce rukou po práci; nevyměňování materiálu a předmětů, např. misek, mezi klecemi apod.) [96]. Majitelé prodejen jsou zodpovědní za vzdělávání veřejnosti a za prevenci šíření nákaz, proto by zaměstnanci i zákazníci měli být informováni o rizicích zoonotických infekcí. Praxe je v tomto ohledu většinou velmi odlišná, jak ukázal např. průzkum v holandských zverimexech, kde 77 % zaměstnanců neznalo pojem „zoonóza“ a 27 % neprošlo žádným školením v těchto prodejnách [134]. Situace v České republice není známá, ale i vzhledem k vysokým počtům dokumentovaných infekcí způsobených T. benhamiae a dalšími patogeny, se nedá očekávat výrazně lepší úroveň. Z tohoto důvodu je zahájení vzdělávání na úrovni prodejen zvířat zásadním faktorem v boji proti šíření zoonotických infekcí u nás, zejména infekcí působených T. benhamiae. Podobná opatření se týkají i útulků.
Snahy o vývoj vakcín proti dermatofytóze u různých druhů zvířat neustále probíhají, ale výsledky často nejsou uspokojivé. Byly vyvinuty inaktivované i atenuované očkovací látky, dále monovalentní a multivalentní vakcíny proti dermatofytóze u hospodářských i domácích zvířat, nejsou však celosvětově dostupné [57]. Největší efektivity dosáhla živá atenuovaná vakcína proti trichofycii skotu, jejíž užívání se stalo pravidlem v řadě zemí a přineslo téměř úplnou eradikaci T. verrucosum v oblastech, kde se po desetiletí očkování provádělo. Spolu s tím se rapidně snížil i počet infekcí člověka v těchto zemích. K dosažení optimálních výsledků se vakcinace musí týkat všech zvířat ve stádu, dále jsou pak očkována jen telata (mezi 2. týdnem a 4. měsícem) a nově začlenění jedinci [41, 57, 112]. Studie u koní, v níž byla použita inaktivovaná vakcína z T. equinum, prokázala nižší míru ochrany (75–87 %) očkovaných koní proti dermatofytóze [99].
V současné době neexistuje vakcína proti M. canis, která by byla bezpečná a vysoce efektivní v profylaxi infekce. Bylo vyvinuto nejméně deset vakcín pro použití u koček a psů, které na rozdíl od in vitro experimentů v praxi selhávaly, některé z nich je však možné využít jako adjuvantní terapii [84]. Vakcína, která získala licenci k použití u koček v USA v roce 1994, vykazovala neuspokojivé výsledky a není již komerčně dostupná. V některých evropských zemích jsou v současnosti dostupné širokospektré dermatofytické vakcíny (např. proti zoofilnímu T. interdigitale a M. canis) pro využití u domácích a kožešinových zvířat.
ZÁVĚR
Zoonotické dermatofytózy zůstávají důležitým zdravotním problémem v rozvinutých i rozvojových zemích. Infekce získané od domácích mazlíčků a v menší míře i hospodářských zvířat jsou u nás častou příčinou kožních onemocnění. Diagnostika dermatofytóz u člověka i zvířat se stále opírá hlavně o konvenční metody, jakými jsou přímá mikroskopie a kultivace agens, případně doplněné o další testy. Veterinární diagnostika se navíc musí vypořádat s nevýraznými klinickými příznaky, či asymptomatickými infekcemi u nezanedbatelné časti zvířat, a dále také s mechanickým přenašečstvím artrospor na srsti zvířat.
Microsporum canis je hlavní příčinou dermatofytózy u koček a psů, a je také převažujícím původcem tiney capitis ve většině vyspělých zemí. Společně s dalšími zoofilními dermatofyty je významnou příčinou infekcí hladké kůže. Trichophyton verrucosum a zoofilní T. interdigitale působí celosvětově značné ekonomické ztráty a vysokou míru morbidity hlavně ve velkochovech králíků a skotu. Dodržování doporučených preventivních opatření včetně vakcinace účinně snižuje výskyt těchto patogenů u zvířat i člověka. Druhy T. benhamiae a T. erinacei jsou příkladem nově se šířících zoonotických patogenů, jejichž rostoucí význam má souvislost s výskytem nového, virulentnějšího genotypu T. benhamiae mezi morčaty a se zvyšující se oblibou chovu ježků v případě T. erinacei. Prevalence těchto patogenů u zvířat a incidence případů infekcí u chovatelů vyžaduje pečlivé sledování. Preventivní opatření zabraňující šíření těchto nákaz by měla být přijata především na úrovni obchodů se zvířaty, kde bývá prevalence těchto patogenů v řádu desítek procent.
Tinea corporis je v České republice z více než 40 % zoonotického původu, tinea capitis z více než 75 %. Obě klinické jednotky se výrazně častěji vyskytují v nižších věkových kategoriích, hlavně u dětí. Dominantními zoonotickými původci jsou v obou případech T. benhamiae a M. canis, jejichž incidence v průběhu roku má výrazně odlišná maxima. Léčba tiney corporis většinou nečiní problémy a bývá zvládnutelná lokálními antimykotiky. Naproti tomu je perorální terapie u tiney capitis nutností a lokální má jen doplňkový význam. Léčba trvá různě dlouho v závislosti na původci a závažnosti klinického obrazu.
Poděkování
Studie byla podpořena projekty AZV 17-31269A, GAUK 600217 a výzkumným centrem Univerzity Karlovy (Charles University Research Centre program No. 204069).
Děkujeme doc. Magdaleně Skořepové a dr. Janě Hanzlíčkové za účast na sběru materiálu a dat v úvodních letech projektu, také děkujeme dr. Miladě Chudíčkové a Aleně Gabrielové za jejich neocenitelnou asistenci v laboratoři (MBÚ AV ČR).
Vít Hubka děkuje za podporu Československé mikroskopické společnosti (ČSMS stipendium, 2016).
Do redakce došlo dne 14. 12. 2018.
Adresa pro korespondenci:
MUDr. Mgr. Vít Hubka, Ph.D.
katedra botaniky, Přírodovědecká fakulta
Univerzita Karlova
Benátská 2,
128 01 Praha 2
e-mail: hubka@biomed.cas.cz
Sources
1. ABARCA, M., CASTELLÁ, G., MARTORELL, J. et al. Trichophyton erinacei in pet hedgehogs in Spain: occurrence and revision of its taxonomic status. Med. Mycol., 2017, 55, p. 164–172.
2. AGNETTI, F., RIGHI, C., SCOCCIA, E. et al. Trichophyton verrucosum infection in cattle farms of Umbria (Central Italy) and transmission to humans. Mycoses, 2014, 57, p. 400–405.
3. AHDY, A. M., SAYED-AHMED, M. Z., YOUNIS, E. E. et al. Prevalence and potential risk factors of dermatophytosis in Arabian horses in Egypt. J. Equine Vet. Sci., 2016, 37, p. 71–76.
4. AL-ANI, F., YOUNES, F., AL-RAWASHDEH, O. Ringworm infection of cattle and horses in Jordan. Acta Vet. Brno, 2002, 71, p. 55–60.
5. AL-DUBOON, A., MUHSIN, T., AL-RUBAIY, K. Tinea capitis in Basrah, Iraq. Mycoses, 1999, 42, p. 331–333.
6. ÁLVAREZ-MOSQUERA, I., HERNÁEZ, S., SÁNCHEZ, J. et al. Diagnosis of superficial mycoses by a rapid and effective PCR method from samples of scales, nails and hair. Mycopathologia, 2018, 183, p. 777–783.
7. BALOGUN, R., JEGEDE, H., JIBRIL, A. et al. Prevalence and distribution of dermatophytes among domestic horses in Kwara state, Nigeria. Sokoto J. Vet. Sci., 2017, 15, p. 1–6.
8. BOND, R. Superficial veterinary mycoses. Clin. Dermatol., 2010, 28, p. 226–236.
9. BONIFAZ, A., RAMÍREZ‐TAMAYO, T., SAÚL, A. Tinea barbae (tinea sycosis): experience with nine cases. J. Dermatol., 2003, 30, p. 898–903.
10. BOYANOWSKI, K. J., IHRKE, P. J., MORIELLO, K. A. et al. Isolation of fungal flora from the hair coats of shelter cats in the Pacific coastal USA. Vet. Dermatol., 2000, 11, p. 143–150.
11. BUCHTA, V., SLEZÁK, R., ŠPAČEK, J. et al. Současné možnosti léčby kožních a slizničních mykóz. Med. Pro Praxi, 2009, 6, p. 155–164.
12. CABAÑES, F., ABARCA, M. L., BRAGULAT, M. R. Dermatophytes isolated from domestic animals in Barcelona, Spain. Mycopathologia, 1997, 137, p. 107–113.
13. CABAÑES, F., ABARCA, M. L., BRAGULAT, M. R. et al. Seasonal study of the fungal biota of the fur of dogs. Mycopathologia, 1996, 133, p. 1–7.
14. CAFARCHIA, C., CAMARDA, A., COCCIOLI, C. et al. Epidemiology and risk factors for dermatophytoses in rabbit farms. Med. Mycol., 2010, 48, p. 975–980.
15. CAFARCHIA, C., GASSER, R. B., FIGUEREDO, L. A. et al. An improved molecular diagnostic assay for canine and feline dermatophytosis. Med. Mycol., 2013, 51, p. 136–143.
16. CAFARCHIA, C., IATTA, R., LATROFA, M. S. et al. Molecular epidemiology, phylogeny and evolution of dermatophytes. Infect. Genet. Evol., 2013, 20, p. 336–351.
17. CAFARCHIA, C., ROMITO, D., SASANELLI, M. et al. The epidemiology of canine and feline dermatophytoses in southern Italy. Mycoses, 2004, 47, p. 508–513.
18. CAFARCHIA, C., WEIGL, S., FIGUEREDO, L. A. et al. Molecular identification and phylogenesis of dermatophytes isolated from rabbit farms and rabbit farm workers. Vet. Microbiol., 2012, 154, p. 395–402.
19. CASTRIOTA, M., RICCI, F., PARADISI, A. et al. Erythema nodosum induced by kerion celsi of the scalp in a child: a case report and mini‐review of literature. Mycoses, 2013, 56, p. 200–203.
20. COPETTI, M. V., SANTURIO, J. M., CAVALHEIRO, A. S. et al. Dermatophytes isolated from dogs and cats suspected of dermatophytosis in southern Brazil. Acta Sci. Vet., 2006, 34, p. 119–124.
21. COURTELLEMONT, L., CHEVRIER, S., DEGEILH, B. et al. Epidemiology of Trichophyton verrucosum infection in Rennes University Hospital, France: A 12-year retrospective study. Med. Mycol., 2017, 55, p. 720–724.
22. ČMOKOVÁ, A., HUBKA, V. New and emerging zoophilic dermatophytes in Europe. Med. Mycol., 2018, 56, p. S54.
23. DĄBROWSKA, I., DWORECKA-KASZAK, B., BRILLOWSKA-DĄBROWSKA, A. The use of a one-step PCR method for the identification of Microsporum canis and Trichophyton mentagrophytes infection of pets. Acta Biochim. Pol., 2014, 61, p. 375–378.
24. DE HOOG, G. S., DUKIK, K., MONOD, M. et al. Toward a novel multilocus phylogenetic taxonomy for the dermatophytes. Mycopathologia, 2017, 182, p. 5–31.
25. DEBNATH, C., MITRA, T., KUMAR, A. et al. Detection of dermatophytes in healthy companion dogs and cats in eastern India. Iran J. Vet. Res., 2016, 17, p. 20–24.
26. DEBOER, D., MORIELLO, K. Dermatophytosis. In Greene C (eds), Infectious diseases of the dog and cat, 3rd edn. St. Louis: Elsevier; 2006, p. 550–565.
27. DEVLIOTOU‐PANAGIOTIDOU, D., KOUSSIDOU--EREMONDI, T. Efficacy and tolerability of 8 weeks’ treatment with terbinafine in children with tinea capitis caused by Microsporum canis: a comparison of three doses. J. Eur. Acad. Dermatol. Venereol., 2004, 18, p. 155–159.
28. DONNELLY, T. M., RUSH, E. M., LACKNER, P. A. Ringworm in small exotic pets. Semin. Avian Exotic Pet Med., 2000, 9, p. 82–93.
29. DRAKE, L. A., DINEHART, S. M., FARMER, E. R. et al. Guidelines of care for superficial mycotic infections of the skin: tinea corporis, tinea cruris, tinea faciei, tinea manuum, and tinea pedis. J. Am. Acad. Dermatol., 1996, 34, p. 282–286.
30. DROUOT, S., MIGNON, B., FRATTI, M. et al. Pets as the main source of two zoonotic species of the Trichophyton mentagrophytes complex in Switzerland, Arthroderma vanbreuseghemii and Arthroderma benhamiae. Vet. Dermatol., 2009, 20, p. 13–18.
31. DUARTE, A., CASTRO, I., DA FONSECA, I. M. P. et al. Survey of infectious and parasitic diseases in stray cats at the Lisbon Metropolitan Area, Portugal. J. Feline Med. Surg., 2010, 12, p. 441–446.
32. ECKERT, J., ERTAS, B., FALK, T. et al. Species identification of dermatophytes in paraffin‐embedded biopsies with a new polymerase chain reaction assay targeting the internal transcribed spacer 2 region and comparison with histopathological features. Brit. J. Dermatol., 2016, 174, p. 869–877.
33. ELY, J. W., ROSENFELD, S., STONE, M. S. Diagnosis and management of tinea infections. Am. Fam. Physician, 2014, 90, p. 702–711.
34. ENGLISH, M. P., EVANS, C. D., HEWITT, M. et al. Hedgehog ringworm. Br. Med. J., 1962, 1, p. 149–151.
35. ENGLISH, M. P., MORRIS, P. Trichophyton mentagrophytes var. erinacei in hedgehog nests. Sabouraudia, 1969, 7, p. 118–121.
36. FEHR, M. Zoonotic potential of dermatophytosis in small mammals. J. Exot. Pet Med., 2015, 24, p. 308–316.
37. FRAGA, C. F., SPANAMBERG, A., FERREIRO, L. et al. Dermatophytes in cats without dermatopathies in the metropolitan area of Florianópolis, Brazil. Acta Sci. Vet., 2017, 45, p. 1430.
38. FREALLE, E., RODRIGUE, M., GANTOIS, N. et al. Phylogenetic analysis of Trichophyton mentagrophytes human and animal isolates based on MnSOD and ITS sequence comparison. Microbiology, 2007, 153, p. 3466–3477.
39. GINTER‐HANSELMAYER, G., WEGER, W., ILKIT, M. et al. Epidemiology of tinea capitis in Europe: current state and changing patterns. Mycoses, 2007, 50, Suppl. 2, p. 6–13.
40. GRAHAM, I. Study of chinchilla fur chewing. Vet. Bull., 1961, 31, p. 699.
41. GUDDING, R., LUND, A. Immunoprophylaxis of bovine dermatophytosis. Can. Vet. J., 1995, 36, p. 302–306.
42. GUILLOT, J., DECAUDIN, B., BULLIOT, C. et al. Emergence of Trichophyton benhamiae in guinea pigs: a retrospective study from the mycology laboratory of the veterinary college of Alfort. Med. Mycol., 2018, 56, p. S55.
43. GUPTA, A. K., COOPER, E. A. Update in antifungal therapy of dermatophytosis. Mycopathologia, 2008, 166, p. 353–367.
44. GUPTA, A. K., MAYS, R. R., VERSTEEG, S. G. et al. Tinea capitis in children: a systematic review of management. J. Eur. Acad. Dermatol. Venereol., 2018, 32, p. 2264–2274.
45. HAGEN, K., GORHAM, J. Dermatomycoses in fur animals: chinchilla, ferret, mink and rabbit. Vet. Med. Small Anim. Clin., 1972, 67, p. 43–48.
46. HALSBY, K. D., WALSH, A. L., CAMPBELL, C. et al. Healthy animals, healthy people: zoonosis risk from animal contact in pet shops, a systematic review of the literature. PLoS One, 2014, 9, p. e89309.
47. HAMEED, K., RIAZ, F. C., NAWAZ, M. A. et al. Trichophyton verrucosum infection in livestock in the Chitral District (Pakistan). J. Inf. Develop. Countries, 2017, 11, p. 326–333.
48. HAVLICKOVA, B., CZAIKA, V., FRIEDRICH, M. Epidemiological trends in skin mycoses worldwide. Mycoses, 2008, 51, Suppl. 4, p. 2–15.
49. HAY, R. Tinea capitis: current status. Mycopathologia, 2017, 182, p. 87–93.
50. HAYETTE, M.-P., SACHELI, R. Dermatophytosis, trends in epidemiology and diagnostic approach. Curr. Fungal Infect. Rep., 2015, 9, p. 164–179.
51. HOPPMANN, E., BARRON, H. W. Rodent dermatology. J. Exot. Pet Med., 2007, 16, p. 238–255.
52. HUBKA, V., ČMOKOVÁ, A., SKOŘEPOVÁ, M. et al. Současný vývoj v taxonomii dermatofytů a doporučení pro pojmenovávání klinicky významných druhů. Čes-slov. Derm., 2014, 89, p. 151–165.
53. HUBKA, V., PEANO, A., CMOKOVA, A. et al. Common and Emerging Dermatophytoses in Animals: Well-Known and New Threats. In Seyedmousavi S, et al. (eds), Emerging and Epizootic Fungal Infections in Animals. Cham: Springer; 2018, p. 31–79.
54. HUBKA, V., VĚTROVSKÝ, T., DOBIÁŠOVÁ, S. et al. Molekulární epidemiologie dermatofytóz v České republice: výsledky dvouleté studie. Čes-slov. Derm., 2014, 89, p. 167–174.
55. CHADEGANIPOUR, M., MOHAMMADI, R., SHADZI, S. A 10‐year study of dermatophytoses in Isfahan, Iran. J. Clin. Lab. Anal., 2016, 30, p. 103–107.
56. CHEN, X., JIANG, X., YANG, M. et al. Systemic antifungal therapy for tinea capitis in children: an abridged Cochrane review. J. Am. Acad. Dermatol., 2017, 76, p. 368–374.
57. CHERMETTE, R., FERREIRO, L., GUILLOT, J. Dermatophytoses in animals. Mycopathologia, 2008, 166, p. 385–405.
58. INTRA, J., SARTO, C., TIBERTI, N. et al. Genus‐level identification of dermatophytes by MALDI‐TOF MS after 2 days of colony growth. Lett. Appl. Microbiol., 2018, 67, p. 136–143.
59. KAKOUROU, T., UKSAL, U. Guidelines for the management of tinea capitis in children. Pediatr. Dermatol., 2010, 27, p. 226–228.
60. KIELIGER, S., GLATZ, M., COZZIO, A. et al. Tinea capitis and tinea faciei in the Zurich area–an 8‐year survey of trends in the epidemiology and treatment patterns. J. Eur. Acad. Dermatol. Venereol., 2015, 29, p. 1524–1529.
61. KIMURA, U., YOKOYAMA, K., HIRUMA, M. et al. Tinea faciei caused by Trichophyton mentagrophytes (molecular type Arthroderma benhamiae) mimics impetigo: a case report and literature review of cases in Japan. Med. Mycol. J., 2015, 56, p. E1–E5.
62. KOMAREK, J., WURST, Z. Dermatophytes in clinically healthy dogs and cats. Vet. Med. (Praha), 1989, 34, p. 59–63.
63. KRAEMER, A., HEIN, J., HEUSINGER, A. et al. Clinical signs, therapy and zoonotic risk of pet guinea pigs with dermatophytosis. Mycoses, 2013, 56, p. 168–172.
64. KRAEMER, A., MUELLER, R., WERCKENTHIN, C. et al. Dermatophytes in pet guinea pigs and rabbits. Vet. Microbiol., 2012, 157, p. 208–213.
65. KUPSCH, C., BERLIN, M., GRÄSER, Y. Dermophytes and guinea pigs: An underestimated danger? Hautarzt, 2017, 68, p. 827–830.
66. KUPSCH, C., OHST, T., PANKEWITZ, F. et al. The agony of choice in dermatophyte diagnostics–performance of different molecular tests and culture in the detection of T. rubrum and T. interdigitale. Clin. Microbiol. Infect., 2016, 22, p. 735.e11–735.e17.
67. KURTDEDE, A., HAYDARDEDEOGLU, A., ALIHOSSEINI, H. et al. Dermatophytosis caused by Trichophyton mentagrophytes var. erinacei in a dog: a case report. Vet. Med. (Praha), 2014, 59, p. 349–351.
68. L‘OLLIVIER, C., CASSAGNE, C., NORMAND, A.-C. et al. A MALDI-TOF MS procedure for clinical dermatophyte species identification in the routine laboratory. Med. Mycol., 2013, 51, p. 713–720.
69. LEWIS, D. T., FOIL, C. S., HOSGOOD, G. Epidemiology and clinical features of dermatophytosis in dogs and cats at Louisiana State University: 1981–1990. Vet. Dermatol., 1991, 2, p. 53–58.
70. LYSKOVÁ, P., DOBIÁŠ, R., KUKLOVÁ, I. et al. Pět případů lidských dermatofytóz vyvolaných zoofilním druhem Trichophyton erinacei přeneseným z ježků. Čes-slov. Derm., 2018, 6, 237–243.
71. LYSKOVÁ, P., HUBKA, V., PETŘIČÁKOVÁ, A. et al. Equine dermatophytosis due to Trichophyton bullosum, a poorly known zoophilic dermatophyte masquerading as T. verrucosum. Mycopathologia, 2015, 180, p. 407–419.
72. MALE, O., FRITSCH, P. Trichophyton mentagrophytes-caused epidemic and enzootic disease in a chinchilla farm. Mykosen, 1966, 4, p. 74–84.
73. MALLÁTOVÁ, N., UTTLOVÁ, K., SMRČKA, V. et al. Trichophyton verrucosum jako neobvyklý původce infekce rány ve vlasaté části hlavy. Čes.-slov. Pediat., 2009, 64, p. 476–479.
74. MANCIANTI, F., NARDONI, S., CECCHI, S. et al. Dermatophytes isolated from symptomatic dogs and cats in Tuscany, Italy during a 15-year-period. Mycopathologia, 2002, 156, p. 13–18.
75. MAURICE, M. N., KAZEEM, H. M., KWANASHIE, C. N. et al. Equine dermatophytosis: a survey of its occurrence and species distribution among horses in Kaduna State, Nigeria. Scientifica, 2016, 2016, ID 8309253.
76. MCALLER, R. An epizootic in laboratory guinea pigs due to Trichophyton mentagrophytes. Aust. Vet. J., 1980, 56, p. 234–236.
77. METIN, A., SUBAŞI, Ş., BOZKURT, H. et al. Tinea capitis in Van, Turkey. Mycoses, 2002, 45, p. 492–495.
78. MILLER, L., HURLEY, K. Infectious disease management in animal shelters. Hoboken: Wiley-Blackwell, 2009, 400 p.
79. MILLER, W. H., GRIFFIN, C. E., CAMPBELL, K. L. Fungal and algal skin diseases: dermatophytosis. In Miller WH, et al. (eds), Muller and Kirk‘s Small Animal Dermatology, 7th ed. St. Louis: Elsevier; 2013, p. 231–243.
80. MING, P. X., TI, Y. L. X., BULMER, G. S. Outbreak of Trichophyton verrucosum in China transmitted from cows to humans. Mycopathologia, 2006, 161, p. 225–228.
81. MORETTI, A., AGNETTI, F., MANCIANTI, F. et al. Dermatophytosis in animals: epidemiological, clinical and zoonotic aspects. G. Ital. Dermatol. Venereol., 2013, 148, p. 563–572.
82. MORETTI, A., BONCIO, L., PASQUALI, P. et al. Epidemiological aspects of dermatophyte infections in horses and cattle. J. Vet. Med. Ser. B, 1998, 45, p. 205–208.
83. MORIELLO, K. A. Kennel disinfectants for Microsporum canis and Trichophyton sp. Vet. Med. Int., 2015, 2015, Article ID 853937.
84. MORIELLO, K. A., COYNER, K., PATERSON, S. et al. Diagnosis and treatment of dermatophytosis in dogs and cats. Vet. Dermatol., 2017, 28, p. 266–268.
85. MORIELLO, K. A., KUNKLE, G., DEBOER, D. J. Isolation of dermatophytes from the haircoats of stray cats from selected animal shelters in two different geographic regions in the United States. Vet. Dermatol., 1994, 5, p. 57–62.
86. MORRIS, P., ENGLISH, M. P. Trichophyton mentagrophytes var. erinacei in British hedgehogs. Sabouraudia, 1969, 7, p. 122–128.
87. MOZES, R., PEARL, D. L., ROUSSEAU, J. et al. Dermatophyte surveillance in cats in three animal shelters in Ontario, Canada. J. Feline Med. Surg., 2015, 19, p. 66–69.
88. NASERI, A., FATA, A., NAJAFZADEH, M. J. et al. Surveillance of dermatophytosis in northeast of Iran (Mashhad) and review of published studies. Mycopathologia, 2013, 176, p. 247–253.
89. NENOFF, P., KRÜGER, C., PAASCH, U. et al. Mycology – an update Part 3: Dermatomycoses: topical and systemic therapy. J. Dtsch. Dermatol. Ges., 2015, 13, p. 387–410.
90. NENOFF, P., KRÜGER, C., SCHALLER, J. et al. Mycology – an update Part 2: Dermatomycoses: Clinical picture and diagnostics. J. Dtsch. Dermatol. Ges., 2014, 12, p. 749–777.
91. NENOFF, P., SCHULZE, I., UHRLAß, S. et al. Kerion Celsi durch den zoophilen Dermatophyten Trichophyton species von Arthroderma benhamiae bei einem Kind. Hautarzt, 2013, 64, p. 846–850.
92. NWEZE, E. Dermatophytosis in Western Africa: a review. Pak. J. Biol. Sci., 2010, 13, p. 649–656.
93. NWEZE, I., EKE, I. Dermatophytosis in Northern Africa. Mycoses, 2016, 59, p. 137–144.
94. OLLHOFF, R. Exame micologico e acompanhamento clinico de bovinos infectados pela forma latente do Trichophyton verrucosum (Bodin, 1902). Arch. Vet. Sci, 2003, 8, p. 205–208.
95. OUDAINA, W., BIOUGNACH, H., RIANE, S. et al. Epidemiology of tinea capitis in outpatients at the Children‘s Hospital in Rabat (Morocco). J. Mycol. Med., 2011, 21, p. 1–5.
96. OVERGAAUW, P., VAN AVERMAETE, K., MERTENS, C. et al. Prevalence and zoonotic risks of Trichophyton mentagrophytes and Cheyletiella spp. in guinea pigs and rabbits in Dutch pet shops. Vet. Microbiol., 2017, 205, p. 106–109.
97. PAPINI, R., NARDONI, S., FANELLI, A. et al. High infection rate of Trichophyton verrucosum in calves from Central Italy. Zoonoses Public Health, 2009, 56, p. 59–64.
98. PARENT, D., DECROIX, J., HEENEN, M. Clinical experience with short schedules of itraconazole in the treatment of tinea corporis and/or tinea cruris. Dermatology, 1994, 189, p. 378–381.
99. PIER, A., ZANCANELLA, P. Immunization of horses against dermatophytosis caused by Trichophyton equinum. Equine Pract., 1993, 15, p. 23–27.
100. PIÉRARD-FRANCHIMONT, C., HERMANNS, J.-F., COLLETTE, C. et al. Hedgehog ringworm in humans and a dog. Acta Clin. Belg., 2008, 63, p. 322–324.
101. PIHET, M., LE GOVIC, Y. Reappraisal of conventional diagnosis for dermatophytes. Mycopathologia, 2017, 182, p. 169–180.
102. PINTER, L., JURAK, Z., UKALOVIC, M. et al. Epidemiological and clinical features of dermatophytoses in dogs and cats in Croatia between 1990 and 1998. Vet. Arh., 1999, 69, p. 261–270.
103. PIRI, F., ZAREI MAHMOUDABADI, A., RONAGH, A. et al. Assessment of a pan‐dermatophyte nested‐PCR compared with conventional methods for direct detection and identification of dermatophytosis agents in animals. Mycoses, 2018, 61, p. 837–844.
104. PROVERBIO, D., PEREGO, R., SPADA, E. et al. Survey of dermatophytes in stray cats with and without skin lesions in Northern Italy. Vet. Med. Int., 2014, 2014, ID 565470.
105. REZUSTA, A., DE LA FUENTE, S., GILABERTE, Y. et al. Evaluation of incubation time for dermatophytes cultures. Mycoses, 2016, 59, p. 416–418.
106. RISCO-CASTILLO, V., LE BARZIC, C., DENAES, C. et al. Trichophyton erinacei in European hedgehogs admitted to wildlife rehabilitation centers: results of a prospective epidemiological survey in Ile-de-France, France. Med. Mycol., 2018, 56, p. S82.
107. ROCHETTE, F., ENGELEN, M., VANDEN BOSSCHE, H. Antifungal agents of use in animal health–practical applications. J. Vet. Pharmacol. Ther., 2003, 26, p. 31–53.
108. ROUZAUD, C., HAY, R., CHOSIDOW, O. et al. Severe dermatophytosis and acquired or innate immunodeficiency: A review. J. Fungi, 2016, 2, p. 4.
109. RUDRAMURTHY, S. M., SHAW, D. Overview and update on the laboratory diagnosis of dermatophytosis. Clin. Dermatol. Rev., 2017, 1, p. 3–11.
110. RUTECKI, G. W., WURTZ, R., THOMSON, R. B. From animal to man: tinea barbae. Curr. Infect. Dis. Rep., 2000, 2, p. 433–437.
111. SABOU, M., DENIS, J., BOULANGER, N. et al. Molecular identification of Trichophyton benhamiae in Strasbourg, France: a 9-year retrospective study. Med. Mycol., 2017, 56, p. 723–734.
112. SEEBACHER, C., BOUCHARA, J.-P., MIGNON, B. Updates on the epidemiology of dermatophyte infections. Mycopathologia, 2008, 166, p. 335–352.
113. SEKER, E., DOGAN, N. Isolation of dermatophytes from dogs and cats with suspected dermatophytosis in Western Turkey. Prev. Vet. Med., 2011, 98, p. 46–51.
114. SEYEDMOUSAVI, S., WIEDERHOLD, N. P., EBEL, F. et al. Antifungal use in veterinary practice and emergence of resistance. In Seyedmousavi S, et al. (eds), Emerging and Epizootic Fungal Infections in Animals. Cham: Springer; 2018, p. 359–402.
115. SCHECHTMAN, R. C., SILVA, N. D. V., QUARESMA, M. V. et al. Dermatoscopic findings as a complementary tool in the differential diagnosis of the etiological agent of tinea capitis. An. Bras. Dermatol., 2015, 90, p. 13–15.
116. SIEKLUCKI, U., OH, S. H., HOYER, L. L. Frequent isolation of Arthroderma benhamiae from dogs with dermatophytosis. Vet. Dermatol., 2014, 25, p. 39–41.
117. SILVER, S., VINH, D. C., EMBIL, J. M. The man who got too close to his cows. Diagn. Microbiol. Infect. Dis., 2008, 60, p. 419–420.
118. SITTERLE, E., FREALLE, E., FOULET, F. et al. Trichophyton bullosum: a new zoonotic dermatophyte species. Med. Mycol., 2012, 50, p. 305–309.
119. SKERLEV, M., MIKLIĆ, P. The changing face of Microsporum spp infections. Clin. Dermatol., 2010, 28, p. 146–150.
120. SKOŘEPOVÁ, M. Dermatofytózy u dětí. Pediatr. Praxi, 2008, 9, p. 177–180.
121. SKOŘEPOVÁ, M. Dermatomykologie v obrazech. Praha: Galén, 2008, 95 p.
122. SKOŘEPOVÁ, M. Možnosti farmakoterapie kožních mykóz. Remedia, 2017, 27, p. 226–230.
123. SKOŘEPOVÁ, M., HUBKA, V., POLÁŠKOVÁ, S. et al. Naše první zkušenosti s infekcemi vyvolanými Arthroderma benhamiae (Trichophyton sp.). Čes--slov. Derm., 2014, 89, p. 192–198.
124. SMITH, J., MARPLES, M. J. Trichophyton mentagrophytes var. erinacei. Sabouraudia, 1964, 3, p. 1–10.
125. SPARKES, A., WERRETT, G., STOKES, C. et al. Microsporum canis: inapparent carriage by cats and the viability of arthrospores. J. Small Anim. Pract., 1994, 35, p. 397–401.
126. SUNDERKÖTTER, C., BECKER, K., KUTZNER, H. et al. Molecular diagnosis of skin infections using paraffin‐embedded tissue–review and interdisciplinary consensus. J. Dtsch. Dermatol. Ges., 2018, 16, p. 139–147.
127. TAKAHASHI, Y., HARITANI, K., SANO, A. et al. An isolate of Arthroderma benhamiae with Trichophyton mentagrophytes var. erinacei anamorph isolated from a four-toed hedgehog (Atelerix albiventris) in Japan. Jap. J. Med. Mycol., 2002, 43, p. 249–255.
128. TAKAHASHI, Y., SANO, A., TAKIZAWA, K. et al. The epidemiology and mating behavior of Arthroderma benhamiae var. erinacei in household four--toed hedgehogs (Atelerix albiventris) in Japan. Jap. J. Med. Mycol., 2003, 44, p. 31–38.
129. THOMA‐GREBER, E., ZENKER, S., RÖCKEN, M. et al. Surgical treatment of tinea capitis in childhood. Mycoses, 2003, 46, p. 333–336.
130. TOPALOĞLU DEMIR, F., KARADAG, A. S. Are dermatophytid reactions in patients with kerion celsi much more common than previously thought? A prospective study. Pediatr. Dermatol., 2015, 32, p. 635–640.
131. TORRES-RODRIGUEZ, J., DRONDA, M., ROSSELL, J. et al. Incidence of dermatophytoses in rabbit farms in Catalonia, Spain, and its repercussion on human health. Eur. J. Epidemiol., 1992, 8, p. 326–329.
132. UHRLAß, S., KRÜGER, C., NENOFF, P. Microsporum canis: Aktuelle Daten zur Prävalenz des zoophilen Dermatophyten im mitteldeutschen Raum. Hautarzt, 2015, 66, p. 855–862.
133. UHRLAß, S., SCHROEDL, W., MEHLHORN, C. et al. Molecular epidemiology of Trichophyton quinckeanum–a zoophilic dermatophyte on the rise. J. Dtsch. Dermatol. Ges., 2018, 16, p. 21–32.
134. VAN DAM, A., RIETVELD, A., VAN HOEVEN, S. et al. Are Dutch pet shops and animal shelters playing a role in zoonoses education? Inf. Bull., 2016, 27, p. 173–174.
135. VAN ROOIJ, P., DETANDT, M., NOLARD, N. Trichophyton mentagrophytes of rabbit origin causing family incidence of kerion: an environmental study. Mycoses, 2006, 49, p. 426–430.
136. VANGEEL, I., PASMANS, F., VANROBAEYS, M. et al. Prevalence of dermatophytes in asymptomatic guinea pigs and rabbits. Vet. Rec., 2000, 146, p. 440–441.
137. VERRIER, J., JEANNEAU-IMPARATO, L., GUILLET, C. et al. PCR-terminal restriction fragment length polymorphism for direct detection and identification of dermatophytes in veterinary mycology. Med. Mycol., 2018, p. doi: 10.1093/mmy/myy058.
138. VERRIER, J., MONOD, M. Diagnosis of dermatophytosis using molecular biology. Mycopathologia, 2017, 182, p. 193–202.
139. WEIß, R., BÖHM, K. H., MUMME, J. et al. 13 Jahre veterinärmedizinische mykologische Routinediagnostik. Dermatophytennachweise in den Jahren 1965 bis 1977. Sabouraudia, 1979, 17, p. 345–353.
140. WEITZMAN, I., MCGINNIS, M., PADHYE, A. et al. The genus Arthroderma and its later synonym Nannizzia. Mycotaxon, 1986, 25, p. 505–518.
141. WEITZMAN, I., SUMMERBELL, R. C. The dermatophytes. Clin. Microbiol. Rev., 1995, 8, p. 240–259.
142. ZHAN, P., LI, D., WANG, C. et al. Epidemiological changes in tinea capitis over the sixty years of economic growth in China. Med. Mycol., 2015, 53, p. 691–698.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2018 Issue 6-
All articles in this issue
- Efektivní léčebná modulace poškozujícího zánětu u nemocných s psoriázou guselkumabem cílícím na specifickou podjednotku p19 IL-23 regulační osy IL-23/Th17
- Identifikace dermatofytů pomocí MALDI-TOF hmotnostní spektrometrie
- Využití PCR-HRMA při přímé detekci a identifikaci původců dermatofytóz z klinických vzorků
- Možnosti terapie onychomykózy nízkoteplotním plazmatem
- Zoonotické dermatofytózy: klinický obraz, diagnostika, etiologie, léčba, epidemiologická situace u nás
- Pět případů lidských dermatofytóz vyvolaných zoofilním druhem Trichophyton erinacei přeneseným z ježků
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zoonotické dermatofytózy: klinický obraz, diagnostika, etiologie, léčba, epidemiologická situace u nás
- Pět případů lidských dermatofytóz vyvolaných zoofilním druhem Trichophyton erinacei přeneseným z ježků
- Identifikace dermatofytů pomocí MALDI-TOF hmotnostní spektrometrie
- Možnosti terapie onychomykózy nízkoteplotním plazmatem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


