-
Medical journals
- Career
Naše první zkušenosti s infekcemi vyvolanými Arthroderma benhamiae (Trichophyton sp.)
Authors: M. Skořepová 1; V. Hubka 2,3; Simona Polášková 1; J. Stará 1; A. Čmoková 2
Authors‘ workplace: Dermatovenerologická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze přednosta prof. MUDr. Jiří Štork, CSc. 1; Katedra botaniky, Přírodovědecká fakulta, Univerzita Karlova v Praze vedoucí doc. RNDr. Yvonne Němcová, Ph. D. 2; Laboratoř genetiky a metabolismu hub, Mikrobiologický ústav, Akademie věd České republiky, v. v. i., Praha vedoucí Mgr. Miroslav Kolařík, Ph. D. 3
Published in: Čes-slov Derm, 89, 2014, No. 4, p. 192-198
Category: Case Reports
Overview
Trichophyton sp. anamorfa od Arthroderma benhamiae je relativně nový původce dermatofytóz na našem území. V období od 1. 1. 2012 do 31. 12. 2013 byl tento zoofilní dermatofyt izolován v laboratoři Dermatovenerologické kliniky u 25 pacientů. Určení druhu bylo potvrzeno molekulárně genetickou analýzou. U 15 pacientů byl sledován také klinický průběh a efekt léčby. Šlo o 12 dětí ve věku 2–10 let a jen 3 dospělé. Zdrojem infekce bylo v 9 případech morče, ve 2 případech přicházeli v úvahu jiní hlodavci a ve 3 případech pes. Inkubační doba byla 3–4 týdny. Klinický obraz nejevil odlišnosti oproti jiným infekcím vyvolaným zoofilními dermatofyty, až fluorescenci lézí ve Woodově světle, což je jinak charakteristické pro rod Microsporum, nikoli pro Trichophyton. V lokální léčbě se nejlépe uplatnily naftifin a ciklopiroxolamin. Klotrimazol se ukázal jako neúčinný. Léze ve kštici se zhojily po 4–8 týdnech léčby perorálním terbinafinem.
Klíčová slova:
dermatofytózy – Arthroderma benhamiae – diagnóza – terapieÚVOD
Do roku 1999 jsme byli zvyklí, že komplex Trichophyton mentagrophytes se dělil na řadu variet, z nichž jedna (T. mentagrophytes var. interdigitale) byla čistě antropofilní, další (T. mentagrophytes var. mentagrophytes, T. mentagrophytes var. asteroides, T. mentagrophytes var. granulosum, T. mentagrophytes var. quinckeanum, T. mentagrophytes var. erinacei, T. mentagrophytes var. nodulare, aj.) byly zoofilní. Dále bylo všeobecně přijímáno, že k této nepohlavní (anamorfní, imperfektní) formě, pojmenované T. mentagrophytes, existují dvě formy pohlavní (teleomorfní, perfektní), které dostaly v minulosti jména Arthroderma benhamiae a Arthroderma vanbreuseghemii [2].
Původní materiál (použitý původním autorem k popisu druhu) se od většiny dobře známých druhů dermatofyt, včetně T. mentagrophytes, nezachoval a bylo nutné nově ustanovit vhodný typový materiál, podle kterého by se mohla taxonomie řídit. V roce 1999 byl takto ustanoven nový typový materiál (neotyp) pro většinu klinicky významých druhů [4]. Podle nového konceptu není T. mentagrophytes příbuzný ani s jedním ze svých domnělých pohlavních stadií, tedy ani s A. benhamiae, ani s A. vanbreuseghemii (nejblíže má k T. simii a T. schoenleinii – už Sabouraud zařadil Achorion quinckeanum do stejného rodu s Achorion schoenleinii) [4, 5, 14]. Z některých variet se staly samostatné druhy, např. T. erinacei a T. interdigitale (druhý zmíněný druh má kmeny jak antropofilní, tak zoofilní, které se do značné míry liší morfologicky, hostitelskými preferencemi a klinickou manifestací). Zoofilní kmeny T. interdigitale podle dnešního pojetí odpovídají morfologicky i klinickou manifestací infekcí izolátům, které byly dříve označovány jako T. mentagrophytes [5, 14], ten je dnes klinicky takřka bezvýznamným druhem. Arthroderma vanbreuseghemii je druh považovaný za velmi blízký, ne-li identický druh s T. interdigitale [5, 14, 17]. Arthroderma benhamiae je také samostatný druh, jméno pro nepohlavní stadium ale po jejím odloučení od T. mentagrophytes dosud nebylo vytvořeno, a tak je tento druh nazýván jako „Trichophyton sp. anamorfa od A. benhamiae“, nebo jen „A. benhamiae“ [5, 14, 18].
V období od 1. 1. 2012 do 31. 12. 2013 jsme v mykologické laboratoři Dermatovenerologické kliniky 1. LF UK a VFN v Praze zachytili celkem 25 pacientů infikovaných tímto druhem. Z toho 15 pacientů se na naší klinice i léčilo, takže se můžeme podělit o zkušenosti s diagnostikou a léčbou infekcí vyvolaných A. benhamiae.
MATERIÁL A METODY
Soubor pacientů
Soubor pacientů léčených na klinice zahrnoval 15 pacientů, 5 mužského a 10 ženského pohlaví ve věku 2–76 let. Šlo o děti staré 2–10 let a tři dospělé ženy ve věku 30, 65 a 76 let.
Vyšetření
Vedle běžné anamnézy a aspexe byli čtyři pacienti vyšetřeni také ve Woodově světle. Ode všech pacientů byly odebrány šupiny nebo vlasy na mykologické vyšetření. Pro mikroskopické vyšetření byl zhotoven louhový preparát s 20% KOH. Další část materiálu byla určena ke kultivaci.
Kultivace, morfologie a uchovávání izolátů
Část materiálu byla přímo při odběru naočkována na Sabouraudův glukózový agar s chloramfenikolem (SGAC; Sabouraud Chloramphenicol Agar, Bio-Rad, Marnes-la-Coquette, France). Kultivace probíhala při pokojové teplotě po dobu 3 týdnů. Druhová identifikace probíhala na základě makromorfologických a mikromorfologických charakteristik a později byla potvrzena molekulárně genetickými metodami. U izolátu od pacienta č. 15 byla vyzkoušena diferenciace na chromogenním agaru (CandiSelect 4, Bio-Rad, Marnes-la-Coquette, France) navrhovaná Mayserem et al. [13].
Kultivace za účelem popisu makromorfologie kolonií probíhala při 25 °C ve tmě na následujících médiích: Sabouraudův glukózový agar s chloramfenikolem a cykloheximidem (SGACC; TRIOS, Praha, ČR), Sabouraudův glukózový agar (SGA; Himedia, Milano, Itálie), malt extrakt agar (MEA; Oxoid, Basingstoke, UK) a Takashio médium (TAK; 1 g peptonu, 2 g glukózy, 1 g MgSO4 x 7 H2O, 1 g KH2PO4 a 20 g agaru a 1 litr destilované vody). Mikromorfologie byla sledována na MEA. Většina izolátů zkoumaných v této studii byla uložena do Sbírky kultur hub (CCF; Culture Collection of Fungi) na katedře botaniky Přírodovědecké fakulty University Karlovy v Praze.
Molekulárně genetické metody
DNA byla izolována ze 7–14 dní starých kultur za použití komerčního kitu ArchivePure DNA yeast and Gram2+ kit (5 PRIME Inc., Gaithersburg, Maryland) podle pokynů výrobce, ale s modifikovanými časy inkubace („lytic enzyme solution“, 2 h, 37 °C; „cell lysis solution“, 4 h, 64 °C). Izoláty byly identifikovány na základě vzoru proužků získaného metodou PCR-fingerprintingu s primerem M13-core (5' - GAGGGTGGCGGTTCT) podle dříve popsané metodiky [7] a následovalo porovnání tohoto vzoru s izolátem dříve určeným na základě ITS rDNA sekvence. U části izolátů byla provedena sekvenace ITS oblasti rDNA za použití primerů ITS5 (5' - GGAAGTAAAAGTCGTAACAAGG) a ITS4S (5' - CCTCCGCTTATTGATATGCTTAAG). Úsek byl namnožen primery za podmínek popsaných dříve [8]. Oba koncové primery byly použité k sekvenaci. Tyto izoláty byly identifikovány na základě shody ITS sekvence s ex-typovým kmenem A. benhamiae CBS 623.66 (Z98015) při použití serveru BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Sekvence reprezentativního kmenu CCF 4800 byla uložena do EMBL databáze (European Molecular Biology Laboratory) pod přístupovým číslem LK054798.
Terapie
První volbou byla léčba lokální, při postižení kštice nebo při nedostatečném účinku lokálních antimykotik byla nasazena perorální terapie terbinafinem v dávce 125 mg/den u dětí, 250 mg/den u dospělých. Před léčbou a po 4 týdnech léčby byly vyšetřeny jaterní testy.
VÝSLEDKY
Klinické vyšetření
Klinické údaje o pacientech jsou shrnuty v tabulce 1. Dvanáct pacientů mělo léze jen na hladké kůži, dva na kůži i ve kštici, jeden pouze ve kštici. U 5 pacientů byl postižen obličej. Léze ve kštici nabyla ve dvou případech formu kerionu (obr. 1). Ložiska na hladké kůži byla erytematoskvamózní s infiltrovaným, živě červeným lemem. Ve dvou případech jsme na lemu pozorovali pustuly, v jednom vezikuly (obr. 2). Fluorescence lézí ve Woodově světle byla pozitivní u 3 ze 4 vyšetřovaných případů. Při pátrání po predispozičních faktorech jsme u všech tří dospělých pacientek zjistili, že trpěly chronickou dermatózou léčenou intermitentně kortikoidními externy (pacient č. 2 dermatitis seborrhoica capillitii, č. 4 eczema nummulare, č. 8 lichen ruber planus). Z 12 dětí byly 4 atopické, což je jen lehce nad hranicí udávaného výskytu atopie v běžné populaci (25–30 %).
Table 1. Klinické a epidemiologické údaje o pacientech infikovaných <i>Arthroderma benhamiae</i> 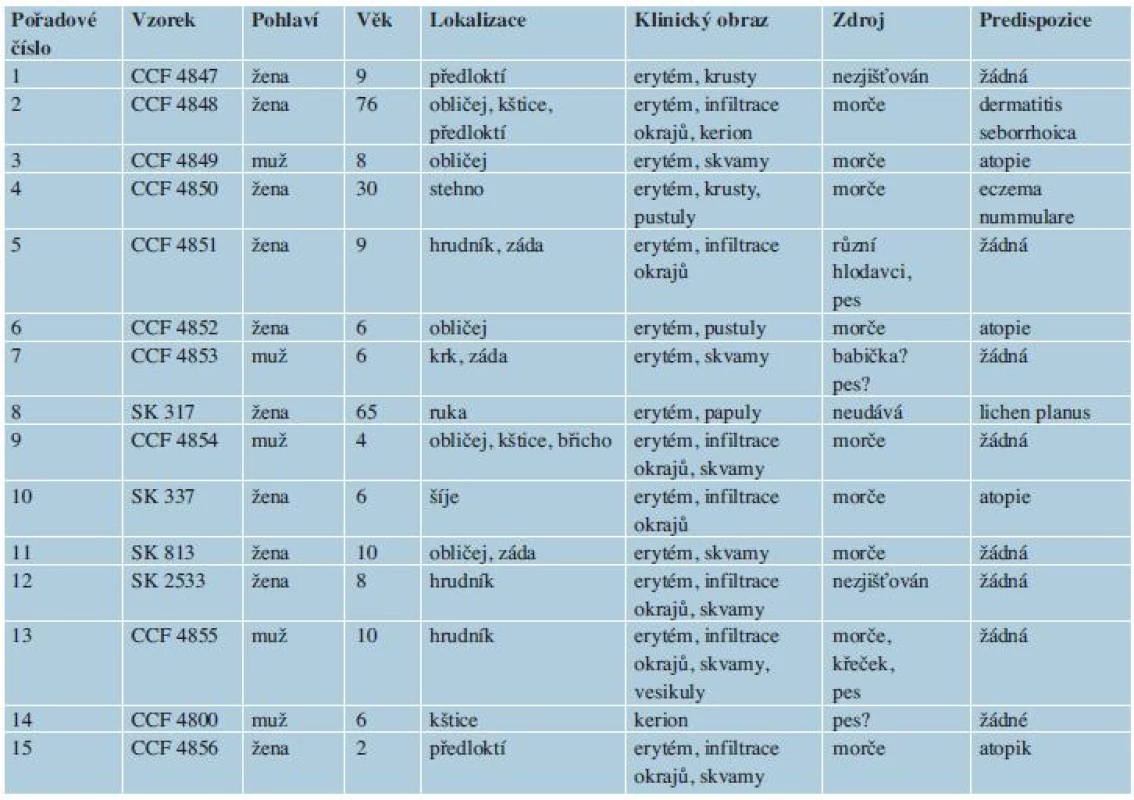
Image 1. Tinea capitis vyvolaná <i>A. benhamiae</i> (kerion Celsi) 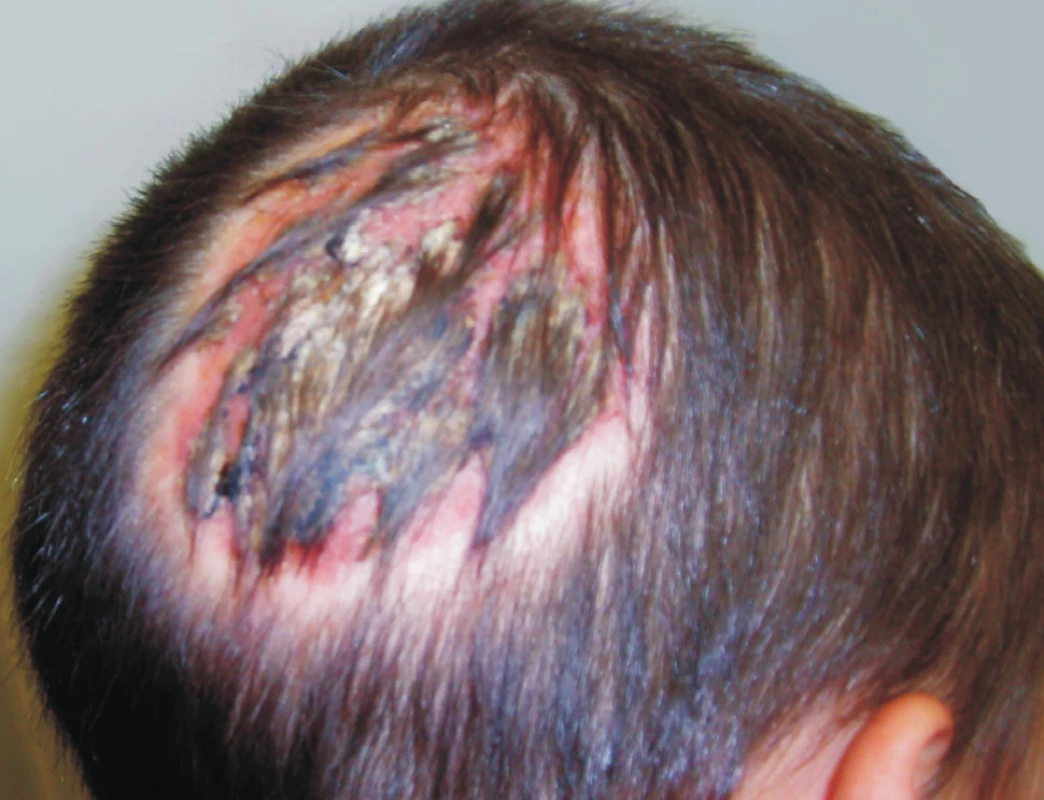
Image 2. Tinea faciei vyvolaná <i>A. benhamiae</i> 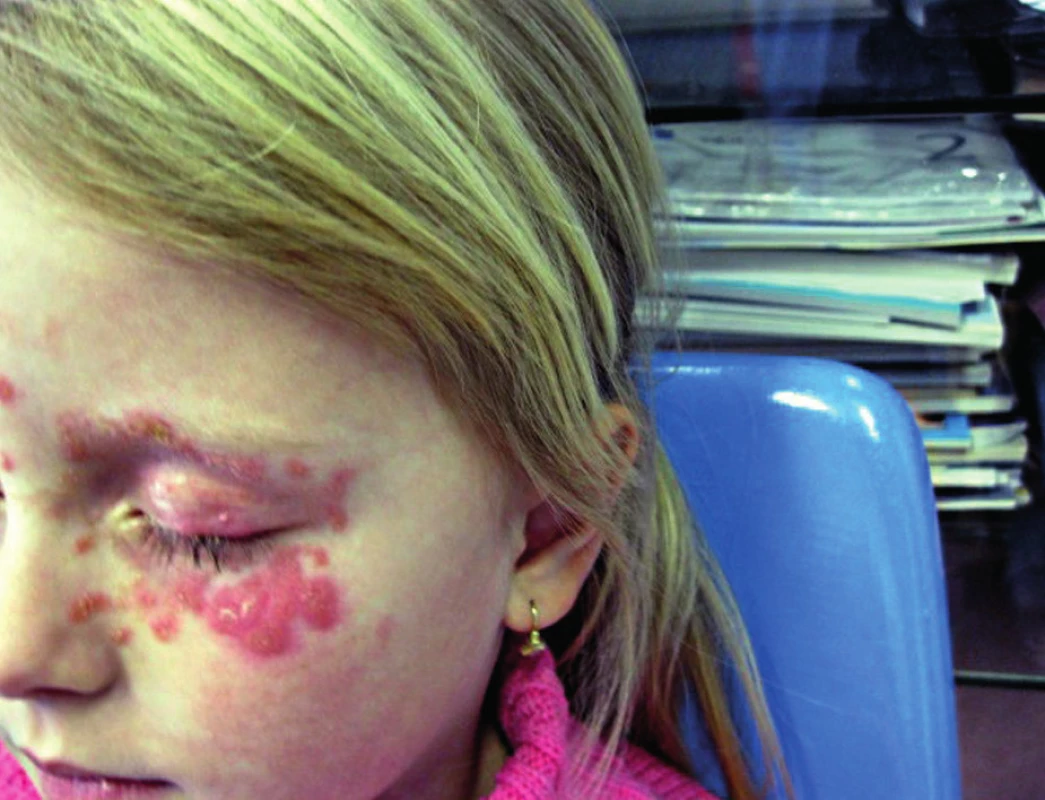
Epidemiologické šetření
V devíti případech bylo zdrojem infekce morče, ve 2 případech byli v rodině ještě další hlodavci. Ve 2 případech mohl být zdrojem infekce i pes, laboratorně jsme si to však nemohli ověřit. U pacienta č. 7 přichází v úvahu pes jako jediný známý zdroj – asi 3 týdny před propuknutím nemoci byla v rodině na návštěvě babička se psem, kterého si měsíc předtím pořídila z útulku. Babička měla rovněž erytematoskvamózní lézi na bradě. Interhumánní přenos v rodinách jsme nepozorovali. Ve 2 případech bylo možno z anamnézy stanovit i inkubační dobu – 3 až 4 týdny.
Morfologie
Mezi izoláty A. benhamiae se dají rozeznat dvě velmi odlišné fenotypové varianty, které jsou v literatuře nazývány jako žlutý a červený (případně bílý) fenotyp [11, 18]. Názvy pramení z produkce žlutého nebo červeného pigmentu. Rozdílné pigmenty mohou být u obou fenotypů současně pozorovány na MEA, žlutý pigment je nejvýraznější na SGAC nebo na SGACC (obr. 3). Obě varianty se podstatně liší ve svém makroskopickém vzhledu na všech zkoumaných médiích (viz obr. 3). Zatím nebyl popsán, a ani my jsme nezaznamenali, žádný vztah mezi fenotypem a genotypem ITS rDNA. Oba fenotypy mají i identický profil proužků při PCR-fingerprintingu s M13-core primerem. Mezi českými pacienty je zastoupený s výraznou převahou žlutý fenotyp (zhruba 4–5 : 1).
Image 3. Kolonie žlutého a červeného fenotypu A. benhamiae po 3 týdnech kultivace při 25 °C na různých médiích 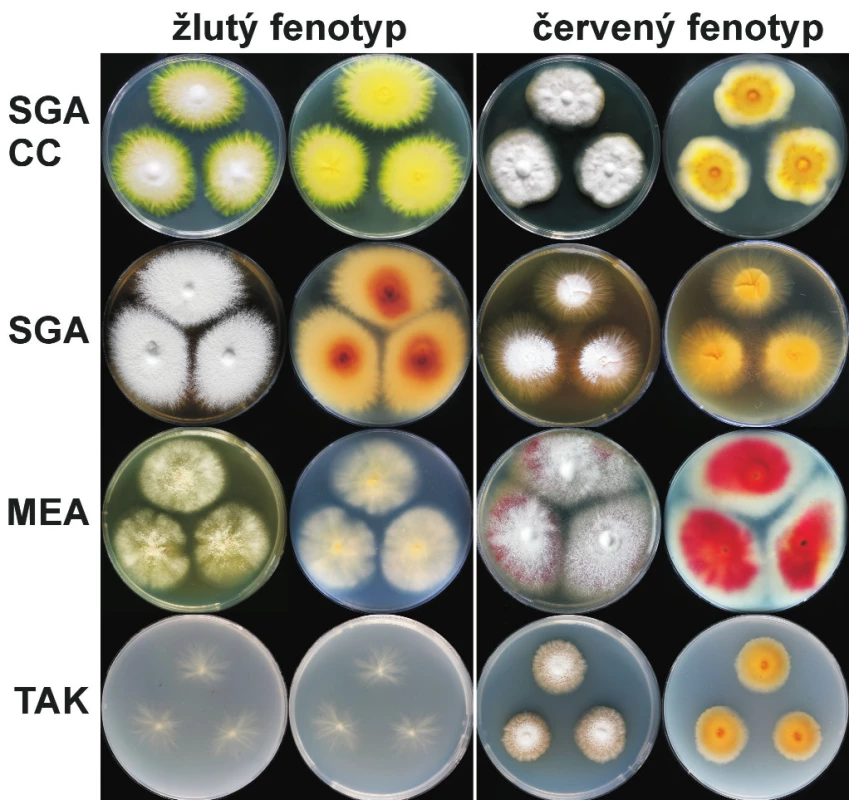
SGACC, Sabouraudův glukózový agar s chloramfenikolem a cykloheximidem; SGA, Sabouraudův glukózový agar; MEA, malt extrakt agar; TAK, Takashio médium. Třítýdenní kolonie žlutého fenotypu na SGAC a na SGACC jsou ploché, v centru chmýřité, bílé, na okraji roste kolonie převážně pod povrchem agaru a je žlutá s paprsčitým okrajem, spodní strana je zářivě žlutá až zlatožlutá (viz obr. 3 a 4). Makromorfologie může silně připomínat Microsporum canis (obr. 4). Morfologie kolonií na SGA bez přidaných antibiotik se podstatně mění a kolonie jsou u obou fenotypů bělavé a výrazně granulární (viz obr. 3). Kolonie na MEA jsou bílé, jemně až hrubě granulární, spodní strana je žlutě, nebo červeně zabarvená. Na Takashio médiu rostou oba fenotypy velmi odlišně, žlutý fenotyp roste paprsčitě a převážně pod povrchem agaru, kdežto kolonie červeného fenotypu jsou granulární (viz obr. 3). Na agaru CandiSelect 4 jsme po 3 dnech pozorovali stopy modrého zbarvení na spodině kolonie A. benhamiae, po týdnu je rozdíl oproti M. canis naprosto zřetelný. Kolonie A. benhamiae je světle modrá, kolonie M. canis zůstává bílá (viz obr. 4).
Image 4. Srovnání kolonií M. canis a A. benhamiae 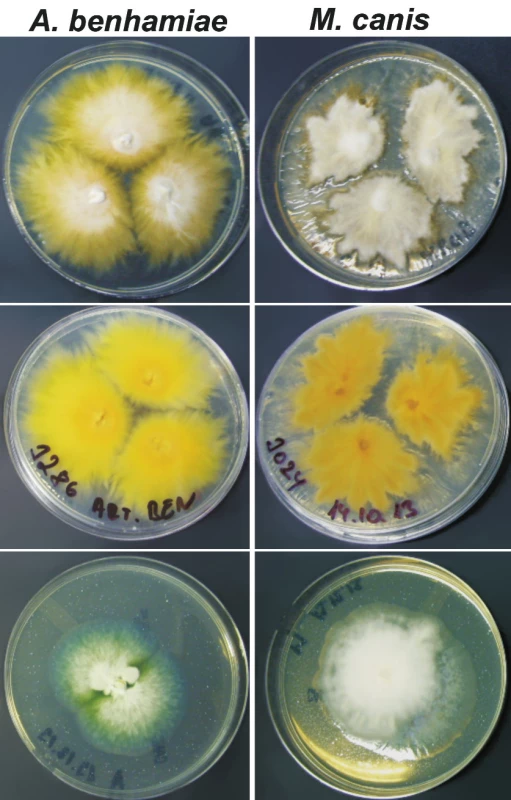
První řada: kolonie na Sabouraudově glukózovém agaru s chloramfenikolem po 3 týdnech kultivace při 25 °C; druhá řada: reverz kolonií; třetí řada: zabarvení na chromogenním agaru Candiselect 4. V mikrokultuře jsou patrné četné kulaté, kapkovité, hruškovité, z menší části též cylindrické mikrokonidie (obr. 5g) uspořádané hroznovitě na spoře větvených konidioforech. Terminální hyfy konidioforů se zužují a působí zašpičatělým vzhledem (obr. 5a,b,e), na vrcholu každě takové větve bývá terminální konidie. V kultuře jsou přítomna i spirální vlákna (obr. 5d) a u některých kmenů také doutníkovité makrokonidie s tenkou hladkou stěnou (obr. 5f). Naproti tomu většina kmenů M. canis produkuje velké množství vřetenovitých, tlustostěnných, bradavčitých makrokonidií (obr. 5h,i), mikrokonidie jsou produkovány obvykle v menších množstvích, jsou přisedlé na nediferencovaných hyfách (konidioforech) a protáhlejší (obr. 5j,k) než u A. benhamiae.
Image 5. Mikromorfologie A. benhamiae (a–g) a M. canis (h–k) 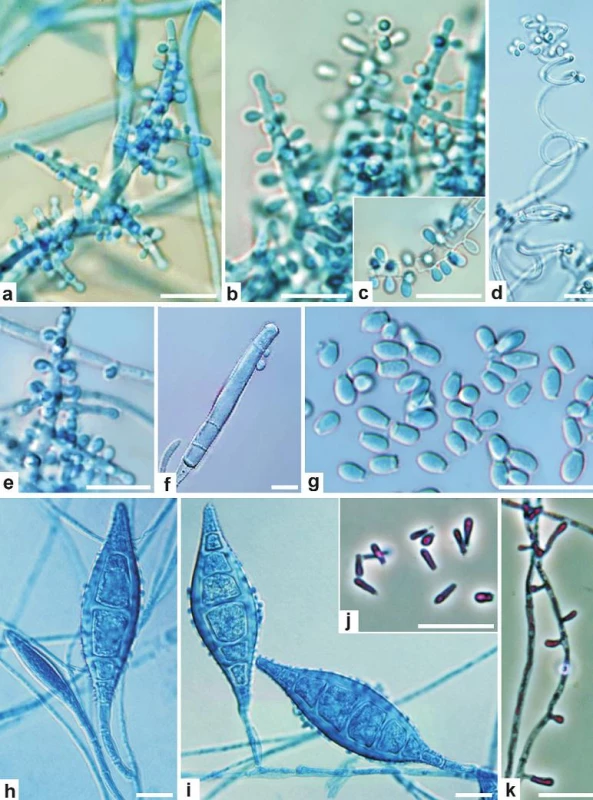
A. benhamiae: (a–c, e) konidiofory, (d) spirální vlákna, (f) makrokonidie, (g) mikrokonidie. M. canis: (h–i) makrokonidie, (j) mikrokonidie, (k) konidiofor nesoucí mikrokonidie. Terapie
Výsledky lokální léčby jsou shrnuty v tabulce 2. Většina pacientů byla léčena 2% ciklopiroxolaminem, ke zhojení došlo po 5–10 týdnech. Rychlejší hojení bylo pozorováno u dvou pacientů léčených 1% naftifinem – 2–3 týdny. Za povšimnutí stojí, že pacienti č. 3 a 5 byli ještě před mykologickým vyšetřením léčeni 1% klotrimazolem. Klotrimazol nejenže nenavodil hojení, ale ani neovlivnil životaschopnost A. benhamiae při kultivaci.
Table 2. Výsledky lokální léčby 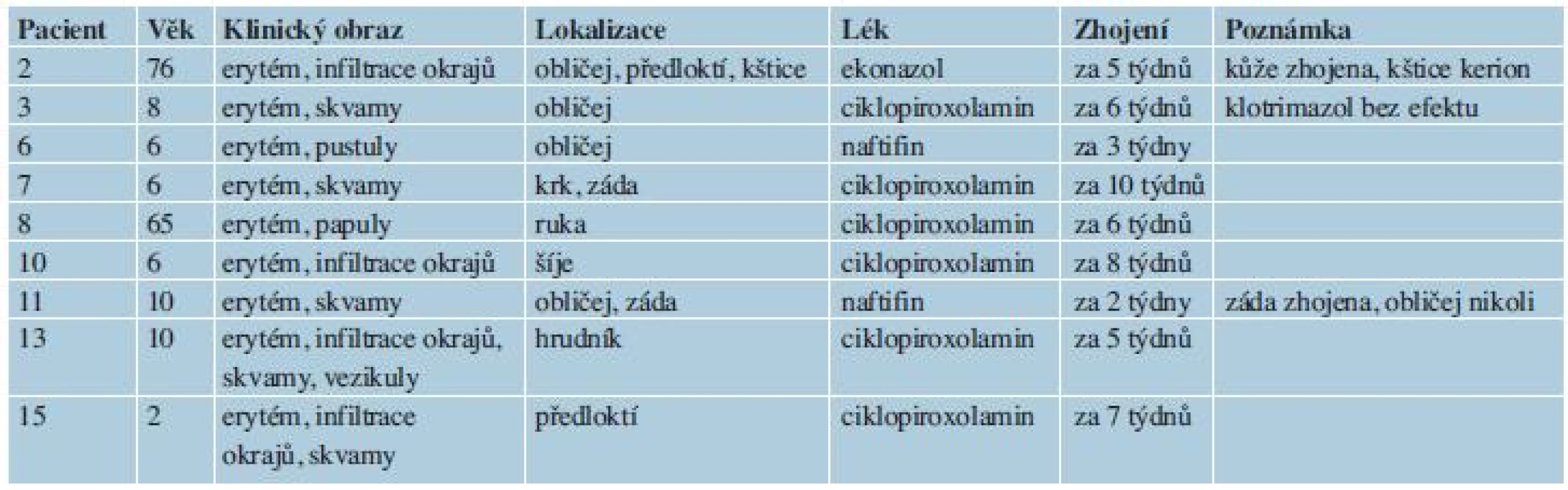
Výsledky celkové léčby terbinafinem jsou shrnuty v tabulce 3. Doba podávání byla u ložisek na hladké kůži 1–2 týdny, u jedné pacientky 8 týdnů, ke klinickému zhojení kožních lézí došlo po 3–8 týdnech. Při postižení kštice byl terbinafin podáván 4–8 týdnů, ke klinickému zhojení došlo po 4–8 týdnech. Zvýšení jaterních testů nebylo pozorováno. U pacientky č. 1 musel být terbinafin vysazen po týdnu pro bolesti hlavy. Tato pacientka byla však ještě 4 měsíce po vysazení terbinafinu opakovaně vyšetřována na neurologii pro chronickou cefaleu, souvislost s terbinafinem je proto nejasná. U pacientky č. 4 se po 10 dnech užívání terbinafinu objevil svědivý výsev charakteru pityriasis rosea. Přetrvával i po ukončení léčby a po zhojení mykózy, kdy plynule přešel do podoby numulárního ekzému, kterým pacientka trpěla již před mykózou. Z kliniky nevyplývá, zda šlo o lékový exantém nebo o mykid. Pacientka č. 5. měla makulozní mykid na pažích, dlaních a ploskách ještě před nasazením léčby.
Table 3. Výsledky perorální léčby 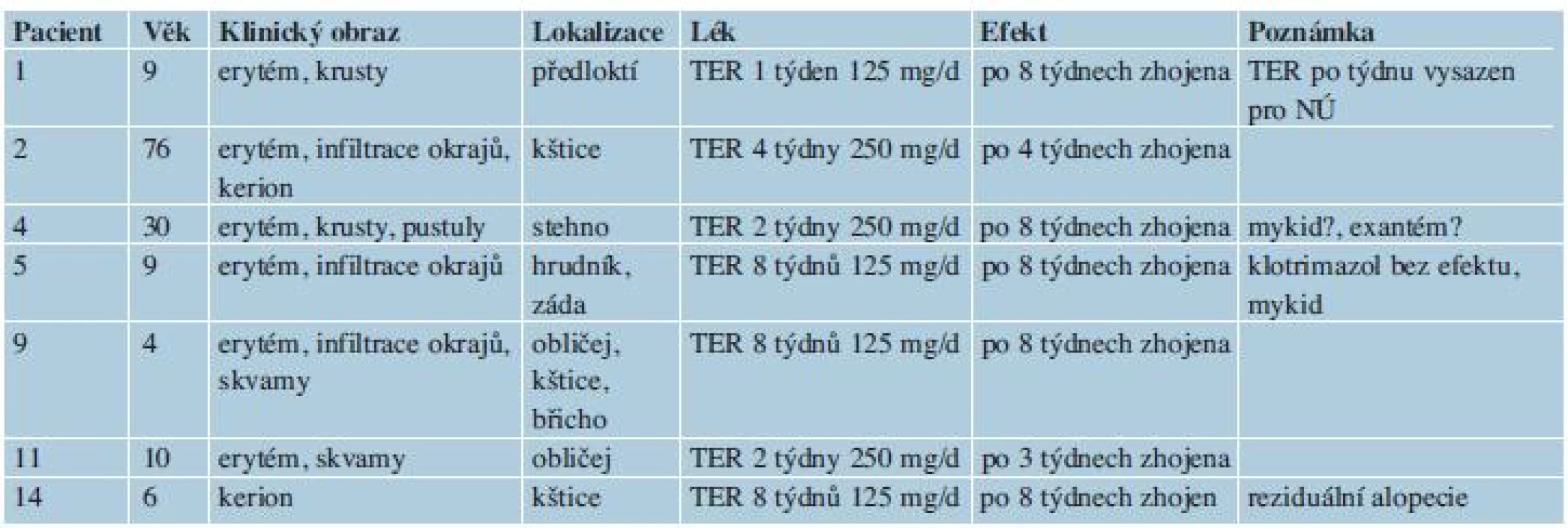
Vysvětlivky: TER = terbinafin, NÚ = nežádoucí účinky DISKUSE
Arthroderma benhamiae je pro klinické mykology u nás novým druhem. Přitom chov morčat má v ČR dlouhou tradici a druh A. benhamiae byl mezi morčaty u nás v minulosti dokumentován [6], ale jeho izolace z lidského klinického materiálu je zcela nová a v ČR zatím nepublikovaná. V našich kulturách se první žlutě pigmentující izoláty, které makroskopicky vypadaly jako M. canis, ale infekce byla získaná od morčete, začaly objevovat v roce 2011.
Zprávy o vysokém výskytu zoonózy způsobené A. benhamiae přichází zejména z Německa [12]. Časovou ohraničenost výskytu zoonózy v Evropě dobře dokumentuje popis vůbec prvního případů ve Švýcarsku v roce 2004 [3]. Velmi pečlivé epidemiologické studie z Japonska [19] ukazují, že v této zemi v roce 1980 nebyla A. benhamiae ještě přítomna. Poprvé byl druh A. benhamiae v Japonsku popsán u králíka v roce 1997 [9], v návaznosti na to se objevily i první případy tinea corporis u lidí [10]. Jako zdroj infekce se v německé literatuře uvádějí morčata, v japonské hlavně králíci [1, 10, 15]. V našem souboru se jako možné zdroje objevili i psi. Nejnovější veterinární studie zjistila, že u psů s dermatofytózou se A. benhamiae nachází poměrně často [16]. Většinou jde o psy loveckých plemen, kteří se často pohybují venku.
Braun et al. [1] se zmiňují o tom, že A. benhamiae může být v kultuře snadno zaměněna za jiné žlutě pigmentující druhy dermatofyt – M. canis nebo T. erinacei. K záměně s M. canis může přispět i skutečnost, že léze fluoreskují ve Woodově světle. K odlišení od M. canis je třeba hodnotit nejen makroskopický vzhled, ale ověřit si i mikroskopický obraz kultury. Naštěstí většina kmenů A. benhamiae ochotně sporuluje už v primokultuře. U nesporulujících kmenů nastává problém, protože ověření identifikace molekulárními metodami není u nás v dermatomykologii běžná praxe. Jako slibná a pro rutinní laboratoř dostupná metoda se jeví diferenciace na chromogenním agaru CandiSelect 4, kde se A. benhamiae barví tyrkysově modře, kdežto M. canis se barví růžově až fialově [13]. Shody a rozdíly mezi A. benhamiae a M. canis jsou shrnuty v tabulce 4.
Table 4. Shody a rozdíly mezi <i>Arthroderma benhamiae</i> a <i>Microsporum canis</i> 
Správná identifikace původce není důležitá jen z hlediska epidemiologického, ale i z hlediska terapeutického. Podle německých autorů je druh M. canis málo citlivý na terbinafin a doporučují k léčbě spíše griseofulvin, flukonazol nebo itrakonazol, kdežto pro léčbu infekcí A. benhamiae doporučují terbinafin v kombinaci s externí aplikací ciklopiroxolaminu [1]. U nás je k léčbě tinea capitis u dětí povolen pouze terbinafin, takže možnost volby odpadá. V našem souboru byl terbinafin podáván po dobu 1–2 týdnů u infekcí hladké kůže, po dobu 4–8 týdnů u infekce kštice. U pacientů jsme ale pozorovali rozdíly v délce léčby u antimykotických extern v rozmezí 5–8 týdnů při aplikaci ciklopiroxolaminu, kdežto jen 2–3 týdny při aplikaci naftifinu. Klotrimazol aplikovaný u dvou pacientů ještě před mykologickým vyšetřením byl zjevně neúčinný.
Léze na hladké kůži nebyly mimořádně zánětlivé ve srovnání s infekcemi M. canis nebo T. interdigitale. Ve kštici však A. benhamiae vyvolává často silně zánětlivé keriony [1, 15] (viz obr. 1). Na rozdíl od mikrosporie, kde ložiska prakticky vždy zarůstají ad integrum, se po infekci A. benhamiae může objevit jizevnatá alopecie [15], v našem souboru u pacienta č. 14. Včasné stanovení správné diagnózy a původce je tedy důležité i jako prevence trvalých následků. V průběhu infekce jsme pozorovali výskyt mykidu, který může být těžko odlišitelný od lékového exantému.
Závěrem lze shrnout důležitá fakta:
- A. benhamiae může být v laboratoři snadno zaměněna za M. canis.
- Zdrojem infekce je zpravidla morče, ale může jím být i králík, činčila, nebo pes.
- Léze fluoreskují ve Woodově světle žlutozeleně.
- Na hladké kůži klinický obraz odpovídá běžné tinea corporis, ve kštici je tendence k tvorbě kerionů.
- K lokální léčbě doporučujeme naftifin nebo ciklopiroxolamin; klotrimazol je zřejmě neúčinný.
- U kerionu je potřeba celková terapie terbinafinem v délce 4–8 týdnů.
Poděkování: Molekulárně genetická část byla podpořena projektem GAUK1344214.
Do redakce došlo dne 16. 7. 2014.
Adresa pro korespondenci:
Doc. MUDr. Magdalena Skořepová, CSc.
Dermatovenerologická klinika 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: mykologie.vfn@seznam.cz
Sources
1. BRAUN, S., JAHN, K., WESTERMANN, A., BRUCHGERHARZ, D., REIFENBERGER, P. D. J. Tinea barbae profunda durch Arthroderma benhamiae. Hautarzt, 2013, 64, p. 720–722.
2. FRAGNER, P., HEJTMÁNEK, M. Určování dermatofytů. Olomouc: Univerzita Palackého v Olomouci, 1990, 190 p.
3. FUMEAUX, J., MOCK, M., NINET, B., et al. First report of Arthroderma benhamiae in Switzerland. Dermatology, 2004, 208, p. 244–250.
4. GRÄSER, Y., KUIJPERS, A. F. A., PRESBER, W., DE HOOG, G. S. Molecular taxonomy of Trichophyton mentagrophytes and T. tonsurans. Med. Mycol., 1999, 37, p. 315–330.
5. GRÄSER, Y., SCOTT, J., SUMMERBELL, R. The new species concept in dermatophytes – a polyphasic approach.
Mycopathologia, 2008, 166, p. 239–256.
6. HEJTMÁNEK, M., HEJTMÁNKOVÁ, N. Hybridization and sexual stimulation in Trichophyton mentagrophytes. Folia Microbiol., 1989, 34, p. 77–79.
7. HUBKA, V., KOLAŘÍK, M. ß-tubulin paralogue tubC is frequently misidentified as the benA gene in Aspergillus section Nigri taxonomy: primer specificity testing and taxonomic consequences. Persoonia, 2012, 29, p. 1–10.
8. HUBKA, V., KUBATOVA, A., MALLATOVA, N. et al. Rare and new aetiological agents revealed among 178 clinical Aspergillus strains obtained from Czech patients and characterised by molecular sequencing. Med. Mycol., 2012, 50, p. 601–610.
9. KANO, R., NAKAMURA, Y., YASUDA, K., et al. The first isolation of Arthroderma benhamiae in Japan. Microbiol. Immunol., 1998, 42, p. 575–578.
10. KAWASAKI, M., ASO, M., INOUE, T., et al. Two cases of tinea corporis by infection from a rabbit with Arthroderma benhamiae. Jap. J. Med. Mycol., 1999, 41, p. 263–267.
11. KAWASAKI, M., ANZAWA, K., TAKEDA, K., et al. Genetic and phenotypic variations among F1 progenies of Arthroderma benhamiae. Jap. J. Med. Mycol., 2008, 49, p. 103–110.
12. KRAEMER, A., HEIN, J., HEUSINGER, A., MUELLER, R. Clinical signs, therapy and zoonotic risk of pet guinea pigs with dermatophytosis. Mycoses, 2013, 56, p. 168–172.
13. MAYSER, P., BUDIHARDJA, D. A simple and rapid method to differentiate Arthroderma benhamiae from Microsporum canis. J. Dtsch. Dermatol. Ges., 2013, 11, p. 322–327.
14. NENOFF, P., HERRMANN, J., GRÄSER, Y. Trichophyton mentagrophytes sive interdigitale? A dermatophyte in the course of time. J. Dtsch. Dermatol. Ges., 2007, 5, p. 198–202.
15. NENOFF, P., SCHULZE, I., UHRLASS, S., KRÜGER, C. Kerion Celsi durch den zoophilen Dermatophyten Trichophyton species von Arthroderma benhamiae bei einem Kind. Hautarzt, 2013, 64, p. 846–850.
16. SIEKLUCKI, U., OH, S. H., HOYER, L. L. Frequent isolation of Arthroderma benhamiae from dogs with dermatophytosis. Vet. Dermatol., 2014, 25, p. 39–41.
17. SYMOENS, F., JOUSSON, O., PLANARD, C., et al. Molecular analysis and mating behaviour of the Trichophyton mentagrophytes species complex. Int. J. Med. Microbiol., 2011, 301, p. 260–266.
18. SYMOENS, F., JOUSSON, O., PACKEU, A., et al. The dermatophyte species Arthroderma benhamiae: intraspecies variability and mating behaviour. J. Med. Microbiol., 2013, 62, p. 377–385.
19. TAKEDA, K., NISHIBU, A., ANZAWA, K., MOCHIZUKI, T. Molecular epidemiology of a major subgroup of Arthroderma benhamiae isolated in Japan by restriction fragment length polymorphism analysis of the nontranscribed spacer region of ribosomal RNA gene. Jpn. J. Infect. Dis., 2012, 65, p. 233–239.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2014 Issue 4-
All articles in this issue
- Současný vývoj v taxonomii dermatofytů a doporučení pro pojmenovávání klinicky významných druhů
- Molekulární epidemiologie dermatofytóz v České republice – výsledky dvouleté studie
- Detekce, identifikace a typizace dermatofytů molekulárně genetickými metodami
- Případ tinea corporis vyvolaný Microsporum incurvatum, geofilním druhem příbuzným M. gypseum
- Naše první zkušenosti s infekcemi vyvolanými Arthroderma benhamiae (Trichophyton sp.)
- Arthroderma benhamiae jako původce tinea capitis profunda a tinea corporis u dětských pacientů
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Naše první zkušenosti s infekcemi vyvolanými Arthroderma benhamiae (Trichophyton sp.)
- Případ tinea corporis vyvolaný Microsporum incurvatum, geofilním druhem příbuzným M. gypseum
- Arthroderma benhamiae jako původce tinea capitis profunda a tinea corporis u dětských pacientů
- Současný vývoj v taxonomii dermatofytů a doporučení pro pojmenovávání klinicky významných druhů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

