-
Medical journals
- Career
Epidermálna bariéra u atopickej dermatitídy a jej hodnotenie meračom transepidermálnej straty vody
: Z. Kozáčiková; E. Březinová
: I. dermatovenerologická klinika FN u sv. Anny v Brně a LF MU prednosta prof. MUDr. Vladimír Vašků, CSc.
: Čes-slov Derm, 89, 2014, No. 2, p. 65-69
: Clinical and laboratory Research
Atopická dermatitída je komplexné ochorenie, ktoré je výsledkom vzájomnej interakcie genetickej predispozície, vplyvov vonkajšieho prostredia, neuro-imunologickej dysbalancie a porušenej epidermálnej bariéry. Tento článok je zameraný na poruchy epidermálnej bariéry u atopického ekzému a možnosti jej objektívneho merania pomocou merača transepidermálne straty vody.
Kľúčové slová:
atopická dermatitída – epidermálna bariéra – transepidermálne straty vodyÚVOD
Atopická dermatitída (AD) je chronické zápalové ochorenie, charakterizované pruritom, suchosťou kože a ekzémovými léziami s typickým vývojom klinického obrazu od detstva až do dospelosti [43]. Jedná sa o ochorenie komplexné, ktoré je výsledkom vzájomnej interakcie genetickej predispozície, vplyvov vonkajšieho prostredia, neuro-imunologickej dysbalancie a porušenej epidermálnej bariéry. Naša práca popisuje poruchy epidermálnej bariéry u atopického ekzému a možnosti jej objektívneho merania pomocou TEWL metra (meranie transepidermálych strát vody).
Najdôležitejšou morfologickou štruktúrou epidermálnej bariéry je stratum corneum conjunctum. Počas epidermálnej proliferácie a diferenciácie začínajúcej v stratum basale dochádza k mnohým biochemickým procesom, vrátane syntézy keratínu [5]. Keratinocytmi tvorená bunková membrána granulárnej vrstvy sa stáva viac priepustná pre ionty kalcia, ktoré aktivujú peptidázy a premenu profilagrinu na filagrin [2]. Filagrin je intermediálnymi vláknami tvorený proteín, ktorý sa nachádza v keratohyalinových granulách a aktivuje enzýmy triacylglycerázy a agreguje keratínové filamenty do mikrofibríl [10]. S degeneráciou bunkových jadier sa bunky oploštujú a keratínové molekuly sa zoraďujú paralelne, spojené extracelulárnymi lipidmi. Sila súdržnosti tejto vrstvy závisí na formácii kovalentnej väzby lyzín-glutaminátu, v mieste ktorej sa do keratínu inkorporujú prekurzorové proteíny – involukrin, malé na prolin bohaté peptidy, kornifin, lorikrin, keratolin a desmozomálne proteíny ako envoplakin a periplakin [4, 37]. Fosfolipidy, glycosylceramidy, cholesterol sulfát sa akumulujú v lamelárných Odlandových telieskach spolu s hydrolytickými enzýmami beta-glucosylcerebrosidázou a sphyngomyelinázou. Odlandové telieska vypudzujú svoj obsah do medzibunečných priestorov, kde enzymatickým hydrolytickým štiepením vznikajú voľné mastné kyseliny, cholesterol a glycerol s následnou organizáciou do lamelárnych diskov (lipidových dvojvrstiev) [28]. Výsledkom týchto dejov je nepriepustná hydrofóbna bariéra, preto prestup látok je možný len intercelulárnymi priestormi, ktoré sú tvorené lipidovými dvojvrstvami, ktoré vznikajú v procese diferenciácie [5]. U AD dochádza k poruche niektorých z týchto procesov, ktoré vedú k poškodeniu epidermálnej bariéry.
Dysfunkciou tejto bariéry je uľahčený prienik alergénov, iritancií, mikróbov a iných agens do epidermis a súčasne dochádza k stratám vody a dehydratácii kože. Štúdia Bohme et al. vedená s 221 atopickými deťmi zreteľne ukazuje, že xeróza sa vyskytuje u 100 % atopických detí a je združená s deficienciou funkcie epidermálnej bariéry [3]. Porucha epidermálnej bariéry spočíva nielen v štrukturálnych, ale aj funkčných abnormalitách. Spočiatku sa u atopickej dermatitídy predpokladalo, že hlavnú úlohu zohráva porucha funkcie lipidov, presnejšie ceramidov. Novšie štúdie poukazujú i na ďalšie faktory, okrem často diskutovaného filargrinu, boli popísané i mutácie génov pre klaudin, lokrin, involukrin, a poruchy enzýmov zúčastňujúcich sa diferenciácie keratynocytov a formovaní epidermálnej bariéry [6, 29].
Ceramidy
Porucha ceramidov spočíva v kvantitatívnych i kvalitatívnych zmenách. Imokawa et al. dokázali, že lipidová frakcia je ochudobnená najme o ceramid 1 EOS [7, 16]. Funkčná porucha spočíva najmä v zníženej funkcie sfingomyelinázy, ktorá zabezpečuje konverziu sfingomyelínu na ceramid [18, 24]. Ďalej je popísaná oslabená schopnosť pohotovo navýšiť množstvo extracelulárnych lipidov pri poškodení stratum corneum [5]. V patogenéze poruchy epidermálnej bariéry tiež zohráva úlohu zvýšená expresia enzýmu sfingomyleín deacylázy, ktorá so sfingomyelinázou súťaží o substrát sfingomyelín, ktorý hydrolyticky znehodnocuje [12, 17, 26]. Ďalšími faktormi podieľajúcimi sa na zníženej tvorbe ceramidov sú zvýšená aktivita ceramidázy ako dôsledok bakteriálnej kolonizácie kože atopikov [25]. Porucha exkrécie lamelárnych teliesok do extracelulárneho priestoru tiež môže negatívne ovplyňovať vznik lipidových dvojvrstiev [9].
Esenciálne mastné kyseliny
V koži atopikov boli zistené zvýšené koncentrácie kyseliny linolenovej, zníženie koncentrácie kyseliny gamalinolenovej, dihomogamalinolenovej a arachidonovej [15]. Schafer et al. dokázali, že zmeny v množstve nenasýtených kyselín spočívajú v poruche transformácie fosfolipidov na ostatné lipidy [36].
Proteázy
Fyziologicky vedie proteázový systém k terminálnej deskvamácii kože. Dôsledkom jeho narušenia, či už vplyvom zvýšenej aktivity proteáz alebo nedostatočnou funkciou inhibičných systémov tzv. inhibítorov serínových proteáz je nadmerná dezintegrácia korneodesmozomálnych spojení a kolaps epidermálnej bariéry. Medzi kľúčové endogénne serínové proteázy patrí stratum corneum tryptáza (SCTE) a chemotryptáza (SCCE) enzým [8, 38]. Vasilopoulos at al. popísali niekoľko polymorfizmov pre SCCE na chromozóme 19q13 vedúcich k jej zvýšenej aktivite [39]. V štúdii Handdon at al. bola zachytená zvýšená expresia stratum corneum chemotryptického enzýmu [11]. Epidermálna bariéra môže byť ďalej poškodená i exogénnymi proteázami, ktoré produkujú roztoče a Staphylococus aureus [23, 40]. Zvýšená aktivita proteáz môže nastať aj v dôsledku poruchy inhibičných systémov, ako je to u mutácii SPINK 5 génu popísanej pri Nethertonovom syndróme [21].
Vyššie popísané poruchy vedú k zníženej schopnosti viazať vodu a jej nadmernému úniku, čo vedie k typickej suchej koži u atopikov.
Transepidermálne straty vody
TEWL (Transepidermálne straty vody) je jedna z metód umožňujúcich kvantifikovať poruchy kožnej bariéry. Jej hodnoty korelujú s intenzitou poškodenia stratum corneum conjuctum, ktorá je jej hlavnou anatomickou zložkou. Princíp merania spočíva vo využití modifikovaného Fickovho zákona. Samotné meranie je výsledkom rozdielu gradientov vodnej pary, ktorá uniká z kože. Transepidermálne straty vody je možné merať troma technikami: uzatvorenou komôrkovou metódou, ventilovanou komôrkovou metódou a otvorenou komôrkovou metódou, ktorá bola použitá i u meraní v našom súbore. Otvorená metóda využívá sondu otvorenú do okolitého prostredia, ktorá sa umiestni na povrch kože, pričom sonda vymezuje povrch kože 0,8–1,0 cm2 a predstavuje dno komôrky. Transepidermálna strata vody sa vypočíta zo spádu, ktorý je zaznamenaný dvoma hygrosenzormi presne nad sebou umiestnenými v púzdre [29].
Odparovanie je ovplyvnené množstvom vonkajších faktorov, preto je nutné dodržiavať štandartné podmienky pri jednotlivých meraniach. Medzi hlavné faktory ovplyvňujúce meranie, sú faktory týkajúce sa okolitého prostredia – pohyb okolitého vzduchu a vlhkosť, teplota vzduchu. K individuálnym faktorom môžme počítať potenie, teplotu kože, anatomické miesto merania. Zanedbateľné nie sú ani faktory prístroja, ktorý je nutné zahriať asi 15 minút pred meraním pre stabilizáciu elektrických obvodov, dôležitá je tiež technika merania [27, 29]. Hodnoty TEWL u normálnej kože v oblasti trupu sú 3–6 g /cm2/h, v oblasti tváre sa môžu pohybovať od 1 do 15 g/cm2/h. Tento rozsah je spôsobený rozdielnou hrúbkou kože a prekrvením [2, 27].
TEWL nie je jediná metóda, ktorá umožnuje charakterizovať funkčný stav kože a jej bariérového systému. Medzi ďalšie možnosti patrí meranie impedancie (prevrátená hodnota odporu-Dermotest) [32], hydratácie (korneometer) [30] a elasticity kože (Kutomeria) [31]. Ďalej môžeme merať kvalitatívne a kvantitatívne zmeny kožného povrchu pomocou profilometrie [33] a ultrazvuku. Podrobný popis týchto metód presahuje rámec tejto publikácie.
V našej štúdii sme merali bariérovú funkciu kože u atopikov a kontrolného súboru pomocou TEWL metra.
MATERIÁL A METÓDY
V súbore 100 pacientov s atopickou dermatitídou diagnostikovanej podľa kritérií Hanifina a Rajka bola hodnotená kvalita epidermálnej bariéry pomocou merania TEWL. Súbor sa skladal z 32 žien a 68 mužov, priemerný vek bol 30,5 roka. Meranie bolo prevádzané za štandardných podmienok s prístrojom DermLab USB v uzavretej klimatizovanej miestnosti s priemernou vlhkosťou 34,7 % a teplotou 24,7 °C z oblasti predlaktia u každého pacienta a z ďalších 1–3 miest, podľa toho kde sa nachádzalo chronické ložisko atopickej dermatitídy – kubitálna jamka (24 pacientov), dorsum ruky a čelo (20 pacientov). Hodnoty boli porovnávané s kontrolnou skupinou jedincov, ktorí netrpeli žiadnym chronickým, či generalizovaným kožným ochorením. Kontrolný súbor sa skladal z 29 pacientov s priemerným vekom 32,2 rokov, z toho 17 žien a 12 mužov. Ďalšie meranie bolo prevedené v rámci atopického súboru, kde boli porovnávané hodnoty TEWL v oblasti predlaktia medzi pacientmi s klinicky aktívnym ložiskom ekzému a zdravou kožou.
VÝSLEDKY
V súbore 100 atopických pacientov boli namerané signifikantne vyššie hodnoty TEWL vo všetkých meraných lokalitách u pacientov s atopickou dermatitídou oproti kontrolnému súboru pacientov netrpiacich žiadnym chronickým kožných ochorením. V oblasti predlaktia bola priemerná hodnota 15,75 proti 6,75 g/cm2/h u kontrolného súboru, v oblasti dorsa ruky 20,5 proti 9,4 g/cm2/h, v oblasti kubity 21,38 proti 7,59 g/cm2/h, na čele 21,15 proti 11,77 g/cm2/h (tabuľka 1, graf 1). Taktiež boli pozorované rozdielne hodnoty TEWL v oblasti predlaktia u atopických pacientov s klinicky postihnutou a nepostihnutou kožou 26,58 proti 10,62 g/cm2/h (tabuľka 2, graf 2).
1. Hodnoty TEWL atopických pacientov a kontrol 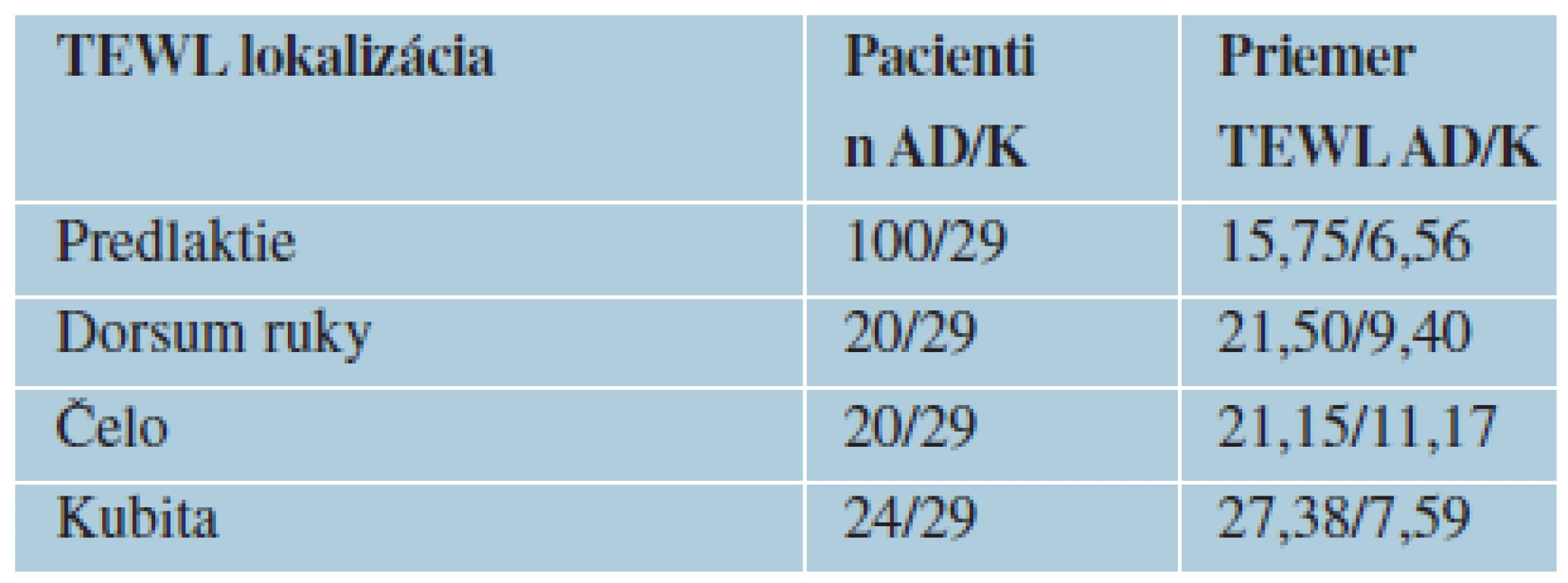
n – počet pacientov AD – atopická dermatitída K – kontrola TEWL – transepidermálne straty vody g/cm2/h 1. Hodnoty TEWL atopických pacientov a kontrol TEWL K – kontrolný súbor TEWL AD – atopická dermatitída 
2. Hodnoty TEWL v procese hojenia u pacientov s AD 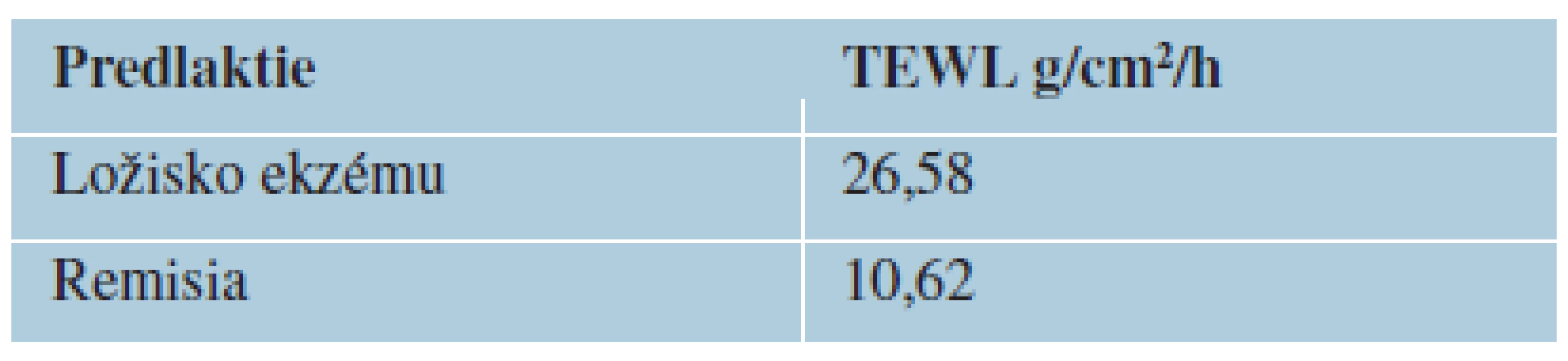
2. Hodnoty TEWL v procese hojenia u pacientov s AD 
DISKUSIA
V našom súbore boli namerané rozdielne hodnoty TEWL v oblasti postihnutej i nepostihnutej kože na predlaktí v rámci atopického súboru. Taktiež sme zistili zvýšené hodnoty TEWL v oblasti ľavého predlaktia – postihnutého i nepostihnutého ekzémom, a v oblasti ďalších ložisiek oproti kontrolám. Niektoré štúdie poukazujú na to, že hodnoty TEWL sú zvýšené aj u pacientov s atopickým ekzémom v oblastiach nepostihnutej kože, čo vysvetľujú už vrodenou poruchou epidermálnej bariéry, ktorá je detailnejšie popísaná v úvode článku [33, 41]. Matsumoto et al. vysvetľujú tieto rozdiely tým, že meranie síce bolo prevedené na zdravej koži, ale z oblasti predlaktia nachádzajúceho sa v blízkosti kubitálnej jamky, ktorá je považovaná za jednu z najčastejších predilekcií atopického ekzému. Aktívny ekzém ovplyvňuje bariérovú funkciu v anatomicky blízkych lokalitách [22]. Boli publikované aj výsledky štúdii, ktoré popisujú normálne hodnoty TEWL u pacientov s atopickým ekzémom v štádiu remisie, pokiaľ trvala dostatočne dlho [20]. Na miestach mimo predilekcií sa zistili zvýšené hodnoty TEWL, len ak bola koža klinicky suchá. Pozitívna korelácia medzi intenzitou atopického ekzému u detí a aj dospelých a taktiež vyššie hodnoty v porovnaní s kontrolami boli zistené v štúdii Kim et al. [19]. Zvýšení hodnoty TEWL proti kontrolám boli popísané aj v ďalších štúdiách Watanabe et al., Holm et al. [14, 41]. Pozitívna korelácia bola zistená aj medzi hodnotami TEWL a hodnotami IgE, intenzitou pruritu a závažnosťou astmy [1]. Tieto výsledky poukazujú na to, že vyšetrenie TEWL poskytuje hodnoty závislé na anatomickom mieste merania, štádiu a intenzite klinických prejavov a je zaťažené veľkým interindividuálnym rozptylom. Intraindividuálna variabilita je však malá a umožňuje spoľahlivé monitorovanie zmeny stavu epidermálnej bariéry.
ZÁVER
Atopická dermatitída je chronické ochorenie, na ktorého patogenéze sa podieľa porucha kožnej bariéry, ktorá vedie k zvýšeným stratám vody. Jednou z neinvazívnych metód, ktorými možno objektívne hodnotiť stav kožnej bariéry je meranie TEWL. Vyššie hodnoty korelujú so závažnosťou atopického ekzému, a preto toto meranie možno použiť na monitorovanie stavu a funkcie kožnej bariéry, na posúdenie účinnosti emolientií, hodnotenie účinnosti liečby, k objektivizácii kožnej diagnózy, k sledovaniu efektu kozmetík a liečiv. Nutnosť zachovať pri meraní štandardné podmienky je však v praxi limitujúca. Uplatnenie v experimente je nesporné a rozšírenie metódy TEWL v klinickej praxi je žiaduce.
Do redakce došlo dne 11. 11. 2013.
Adresa pro korespondenci:
MUDr. Zuzana Kozáčiková
FN u sv. Anny
Pekařská 53
656 91Brno
e-mail: zuzana.kozacikova@azet.sk
Sources
1. ADDOR, F. A., TAKAOKA, R., RIVITTI, E. A. et al. Atopic dermatitis: correlation between non-damaged skin barrier function and disease activity. Int. J. Dermatol., 2012, 51, p. 672–676.
2. ADDOR, F. A., AOKI, V. Skin barrier in atopic dermatitis. An Bras Dermatol., 2010, 85, 2, p. 184–194.
3. BÖHME, M., SVENSSON, Å., KULL, I. et al. Hanifin’s and Rajka’s minor criteria for atopic dermatitis: which do 2-year-olds exhibit? Journal of the American Academy of Dermatology, 2000, 43, 5, p. 785–792.
4. CANDU, E., SCHMIDT, R., MELINO, G. The cornified envelope:a model of cell death in the skin. Nature Reviews Molecular Cell Biology, 2005, 6, 4, p. 328–340.
5. CHROMEJ, I. Atopický ekzém. 1. Vydanie, Banská Bystrica: Dali-BB, 2007, 240 s., ISBN 9788089090259.
6. DE JONGH, G. J., ZEEUWEN, P. L., KUCHAREKOVA, M. et al. High expression levels of keratinocyte antimicrobial proteins in psoriasis compared with atopic dermatitis. J. Invest. Dermatol., 2005, 125, 6, p. 1163–1173.
7. DI NARDO, A., WERTZ, P., GIANNETI, A. et al. Ceramide and cholesterol composition of the skin of patients with atopic dermatitis. Acta Derm Venereol-Stockh., 1998, 78, p. 27–30.
8. EGELRUD, T., LUNDSTRÖM, A. A chymotrypsin-like proteinase that may be involved in desquamation in plantar stratum corneum. Arch. Dermatol. Res., 1991, 283, 2, p. 108–112.
9. FARTASCH, M., BASSUKAS, I. D., DIEPGEN, T. L. Disturbed extruding mechanism of lamellar bodies in dry non eczematous skin of atopics. Br. J. Dermatol., 1992, 127, 3, p. 221–227.
10. GAN, S. Q. et al. Organization, structure, and polymorphisms of the human profilaggrin gene. Biochemistry, 1990, 29, 40, p. 9432–9440.
11. HANSSON, L., BÄCKMAN, A., NY, A. et al. Epidermal overexpression of stratum corneum chymotryptic enzyme in mice: a model for chronic itchy dermatitis. J. Invest. Dermatol., 2002, 118, 3, p. 444–449.
12. HARA, J., HIGUCHI, K., OKAMOTO, R. et al. High-Expression of Sphingomyelin Deacylase is an Important Determinant of Ceramide Deficiency Leading to Barrier Disruption in Atopic Dermatitis1. J. Invest. Dermatol., 2000, 115, 3, p. 406–413.
13. HEGYI, J. Využitie ultrasonografie v diagnostike kožných chorôb. Dermatol. Praxi, 2007, 1, 3, p. 102–103.
14. HOLM, E. A., Wulf, H. C., Thomassen, L. et al. Instrumental assessment of atopic eczema: validation of transepidermal water loss, stratum corneum hydration, erythema, scaling, and edema. J. Am. Acad. Dermatol., 2006, 55, 5, p. 772–780.
15. HORROBIN, D. F. Essential fatty acid metabolism and its modification in atopic eczema. Am. J. Clinic Nutr., 2000, 71, 1, p. 367–372.
16. IMOKAWA, G., ABE, A., JIN, K. et al. Decreased level of ceramides in stratum corneum of atopic dermatitis: an etiologic factor in atopic dry skin? J. Invest. Dermatol., 1991, 96, 4, p. 523–526.
17. IMOKAWA, G. A possible mechanism underlying the ceramide deficiency in atopic dermatitis: Expression of a deacylase enzyme that cleaves the N-acyl linkage of sphingomyelin and glucosylceramide. J. Dermatol. Sci., 2009, 55, 1, p. 1–9.
18. JENSEN, J. M., FÖLSTER-HOLST, R., BARANOWSKY, A. et al. Impaired sphingomyelinase activity and epidermal differentiation in atopic dermatitis. J. Invest. Dermatol., 2004, 122, 6, p. 1423–1431.
19. KIM, D. W., PARK, J. Y., NA, G. Y. et al. Correlation of clinical features and skin barrier function in adolescent and adult patients with atopic dermatitis. Int. J. Dermatol., 2006, 45, 6, p. 698–701.
20. LÖFFLER, H., EFFENDY, I. Skin susceptibility of atopic individuals. Contact Dermatitis, 1999, 40, 5, p. 239–242.
21. MÄGERT, H. J., KREUTZMANN, P., DRÖGEMÜLLER, K. et al. The 15-domain serine proteinase inhibitor LEKTI: biochemical properties, genomic organization, and pathophysiological role. Eur. J. Med. Res., 2002, 7, 2, p. 49.
22. MATSUMOTO, M., SUGIURA, H., UEHARA, M. Skin barrier function in patients with completely healed atopic dermatitis. J. Dermatol. Sci., 2000, 23, 3, p. 178.
23. MIEDZOBRODZKI, J., KASZYCKI, P., BIALECKA, A. et al. Proteolytic activity of Staphylococcus aureus strains isolated from the colonized skin of patients with acute-phase atopic dermatitis. European Journal of Clinical Microbiology and Infectious Diseases, 2002, 21, 4, p. 269–276.
24. MURATA, Y., OGATA, J., HIGAKI, Y. et al. Abnormal expression of sphingomyelin acylase in atopic dermatitis: an etiologic factor for ceramide deficiency? J. Invest. Dermatol., 1996, 106, 6, p. 1242–1249.
25. OHNISHI, Y., OKINO, N., ITO, M. et al. Ceramidase activity in bacterial skin flora as a possible cause of ceramide deficiency in atopic dermatitis. Clinical and diagnostic laboratory immunology, 1999, 6, 1, p. 101–104.
26. OKAMOTO, R., ARIKAWA, J., ISHIBASHI, M. et al. Sphingosylphosphorylcholine is upregulated in the stratum corneum of patients with atopic dermatitis. J. Lipid. Res., 2003, 44, 1, p. 93-102.
27. PINNAGODA, J., TUPKEK, R. A., AGNER, T. et al. Guidelines for transepidermal water loss (TEWL) measurement. Contact Dermatitis, 1990, 22, 3, p. 164–178.
28. PROKSCH, E., FOLSTER-HOLST, R., JANSEN, J. M. Skin barrier function, epidermal proliferation and differentiation in eczema. J. Dermatol. Sci., 2006, 43, 3, p. 159–169.
29. RESL, V., LEBA, M., RAMPL, I. Měření transepidermální ztráty vody (TEWL). Čs. Derm., 2008, roč. 83, č. 6, s. 319–324, ISSN: 0009-051481.
31. RESL, V. Bioinženýrské metody v dermatovenerologii I. Přístrojové metody ke stanovení různých parametrů kůže. Čs. Derm., 2002, 77, 3, p. 133–138.
32. ROVENSKÝ, V., HANUŠ, M. Měření elektrické vodivosti jako metoda hodnocení barierové funkce kůže Čs. Derm., 1985, 60, 3, p. 183–188.
33. RESL, V., CETKOVSKÁ, P. et al, I. Profilometrie. Čs. Derm., 2006, 81 (3), p. 169–173.
34. SEIDENARI, S., GIUSTI, G. Objective assessment of the skin of children affected by atopic dermatitis: a study on pH, capacitance and TEWL in eczematous and clinically uninvolved skin. Acta Derm. Venereol. (Stockh)., 1995, 75, p. 429–433.
35. SEGUCHI, T., CHANG-YI, C., KUSUDA, S. et al. Decreased expression of filaggrin in atopic skin. Arch. Dermatol. Res., 1996, 288, 8, p. 442–446.
36. SCHÄFER, L., KRAGBALLE, K. Abnormalities in epidermal lipid metabolism in patients with atopic dermatitis. J. Invest. Dermatol., 1991, 96, 1, p. 10–15.
37. STEINERTD, P. M., MAREKOV, L. N. The proteins elafin, filaggrin, keratin intermediate filaments, loricrin, and small proline-rich proteins 1 and 2 are isodipeptide cross-linked components of the human epidermal cornified cell envelope. J. Biol. Chem., 1995, 270, p. 17702–17711.
38. SUZUKI, Y., NOMURA, J., KOYAMA, J. et al. The role of proteases in stratum corneum: involvement in stratum corneum desquamation. Arch. Dermatol. Res., 1994, 286, 5, p. 249–253.
39. VASILOPOULOS, Y., CORK, M. J., MURPHY, R. et al. Genetic association between an AACC insertion in the 3′ UTR of the stratum corneum chymotryptic enzyme gene and atopic dermatitis. J. Invest. Dermatol., 2003, 123, 1, p. 62–66.
40. YASUEDA, H., Mita, H., Akiyama, K. et al. Allergens from Dermatophagoides mites with chymotryptic activity. Clinical and experimental allergy. J. Brit. Soc. Allergy Clin. Immunol., 1993, 23, 5, p. 384.
41. WATANABE, M., TAGAMI, H., HORII, I. et al. Functional analyses of the superficial stratum corneum in atopic xerosis. Arch. Dermatol., 1991, 127, 11, p. 1689.
42. WERNER, Y. L. V. A., LINDBERG, M. Transepidermal water loss in dry and clinically normal skin in patients with atopic dermatitis. Acta Dermatol Venereol., 1985, 65, 2, p. 102.
43. WILLIAMS, H. C. Clinical practice. Atopic dermatitis. N. Engl. J. Med., 2005, 352, p. 2314–2324.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2014 Issue 2
Most read in this issue- Urticaria: Classification, Diagnosis and Treatment
- Acute Hemorrhagic Edema of Infancy – Leucocytoclastic Vasculitis
- Chronic Gonococcal Proctitis
- Epidermal Barrier in Atopic Dermatitis and Its Measurement by Transepidermal Water Loss Meter
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

