-
Medical journals
- Career
Folikulostimulační hormon a jeho účinky na kost a chrupavku
Authors: K. Brábníková Marešová
Authors‘ workplace: Revmatologický ústav Praha
Published in: Čes. Revmatol., 30, 2022, No. 4, p. 166-170.
Category: Review Article
Overview
Prevalence osteoporózy a osteoartrózy stoupá v období menopauzy a je spojena se změnami sérových hodnot estrogenů a folikuly stimulujícího hormonu (FSH). Postupu osteoporózy i osteoartrózy u žen po menopauze účinně brání léčba estrogeny, jejichž možné nežádoucí účinky však odrazují od širšího užívání hormonální substituční léčby pro prevenci osteoporózy a osteoartrózy. Folikuly stimulující hormon může kostní remodelaci a metabolismus chrupavky ovlivňovat nezávisle na estrogenech. Takto se uplatňoval FSH v regulaci kostní remodelace u žen s polymorfismem receptoru pro FSH (FSHR). Receptor pro FSH byl prokázán v osteoklastech. Blokováním FSHR lze u ovariektomovaných myší utlumit osteoresorpci a zvýšit kostní hmotu obratlů. V kloubní chrupavce se FSH váže na specifický receptor a tlumí syntézu proteinů extracelulární matrix. Tento účinek lze blokovat. Využití experimentálních a klinických poznatků o FSH může být dalším směrem v prevenci postmenopauzální osteoporózy a osteoartrózy.
Klíčová slova:
chrupavka – kost – menopauza – FSH – receptor pro FSH
ÚVOD
Osteoporóza a osteoartróza jsou nejčastějšími onemocněními pohybového aparátu. Prevalence těchto onemocnění stoupá v závislosti na věku. Osteoporózou i osteoartrózou trpí až 40 % osob starších 65 let (1, 2). U žen je zvýšení prevalence těchto onemocnění v období menopauzy asociováno se změnami sérových hodnot estrogenů a FSH. Naopak hormonální substituční léčba (hormone replacement therapy – HRT) zabraňuje u žen po menopauze postupu osteoporózy (3) i osteoartrózy (4). U žen užívajících HRT se zvyšuje množství kostní hmoty a klesá riziko fraktur nejen obratlů (5) a proximálního femuru (6), ale, na rozdíl od aminobisfosfonátů (7), také riziko zlomenin distálního předloktí, které jsou první závažnou komplikací postmenopauzální osteoporózy. Ve studii OSTPRE bylo u žen pravidelně užívajících HRT adjustované riziko zlomeniny distálního předloktí významně sníženo v porovnání s kontrolní skupinou neléčených žen (RR 0,41, 95% CI, 0,26–0,67) (8).
Hormonální substituční léčba brání postupu osteoartrózy jak v experimentálních modelech (9), tak u žen po menopauze. V prospektivní, randomizované, dvojitě zaslepené, placebem kontrolované studii WHI bylo bazálně vyšetřeno 16 608 postmenopauzálních žen ve věku 50–79 let, které užívaly HRT nebo placebo. Hormonální substituční léčba zabraňovala nástupu muskuloskeletálních symptomů včetně symptomů osteoartrózy, jako je bolest kloubu a ztuhlost kloubu. Bolesti a ztuhlost kloubů prospektivně byly po roce sledování nižší ve skupině žen léčených HRT oproti placebu (OR 0,68, 95% CI 0,66–0,71) (4).
Hormonální substituční léčba však může mít řadu nežádoucích účinků, které odrazují od širšího užívání HRT v prevenci osteoporózy a osteoartrózy u žen po menopauze. Jakkoliv individuální poměr přínosů a rizik podávání estrogenů závisí na typu, dávkách a trvání HRT, jakož i na individuálním rizikovém profilu každé ženy (10, 11), je každý typ HRT, s výjimkou vaginálních estrogenů, spojen s vyšším rizikem nádorového onemocnění prsu, a toto riziko se zvyšuje s délkou užívání léků (12). Mezi rizika HRT patří rovněž riziko trombembolické choroby, cévní mozkové příhody, koronární choroby u žen nad 60 let, zvýšení rizika karcinomu endometria při použití samostatných estrogenů a mírné zvýšení rizika nádorů ovaria (13). Naopak HRT příznivě ovlivňuje klimakterický syndrom a snižuje nejen riziko diabetu mellitu 1. i 2. typu, ale snižuje i riziko karcinomu tlustého střeva (13). HRT ovlivňuje hladiny FSH: po zahájení HRT klesají hodnoty FSH v závislosti na dávce estrogenu až k premenopauzálním hodnotám.
Cílem tohoto článku je upozornit na účinky folikuly stimulujícího hormonu na kostní remodelaci a na metabolismus chrupavky a na možné využití těchto účinků v prevenci osteoporózy a osteoartrózy u žen po menopauze.
FOLIKULOSTIMULAČNÍ HORMON A KOST
Fyziologicky jsou sérové hodnoty estrogenů a FSH spřažené (14), proto je obtížné odlišit účinky obou hormonů na změny kostní hmoty. Problém neřeší ani použití selektivních modulátorů receptorů pro estrogeny, osvědčených v prevenci postmenopauzální osteoporózy a nádorového onemocnění prsu a při experimentální revmatoidní artritidě (15–18), protože se při podávání těchto léků mění i hodnoty FSH. Přesto některé experimentální i klinické studie podporují hypotézu, že se v regulaci kostní remodelace může uplatňovat FSH nezávisle na estradiolu. Receptor pro FSH (FSHR) byl prokázán v CD14+ buňkách a v osteoklastech u myší (19). V lidských CD14+ prekurzorech osteoklastů a osteoklastech je FSHR exprimován převážně jako specifická izoforma (20). Vazbou na FSHR navozuje FSH zvýšení osteoklastogenních cytokinů (tumor necrosis factor alpha, interleukin 1beta a interleukin 6) (21, 22) a zvýšení počtu osteoklastů in vitro i in vivo (18). Důsledkem je zvýšení kostní resorpce (23, 24). Pokud u ovarektomovaných myší chyběl receptor FSHR, nedocházelo k očekávanému zvýšení osteoresorpce a úbytku kostní hmoty (23). Významné snížení sérové koncentrace FSH u eugonadálních heterozygotních FSH± myší bylo spojeno s poklesem osteoklastické resorpce a se zvýšením kostní hmoty. V souhlasu s uvedenými studiemi svědčí pro přímé a na estrogenu nezávislé ovlivnění osteoklastů prostřednictvím FSH také výsledky podávání protilátek proti FSHR ovarektomovaným myším. Blokování účinků FSH snižuje osteoklastogenezi a zvyšuje novotvorbu kostní hmoty obratlů nezávisle na estradiolu (20, 25).
Asociace změn sérových koncentrací FSH a změn kostní remodelace a kostní hmoty je uváděna v řadě klinických studií. Věk menopauzy, tělesná váha a FSH jsou nezávislými prediktory ztráty kostní hmoty (26). Sérové hodnoty C-terminálního telopeptidu kolagenu typu I (βCTX) a osteokalcinu koreluji s hodnotami FSH a nárůst FSH v perimenopauzálním období je asociován se zrychlením resorpce kosti (27). U žen v perimenopauzálním období jsou ukazatele kostní remodelace a změny hodnoty BMD významně asociovány se změnami FSH (28). U žen v perimenopauzálním období se sérové hodnoty FSH a biomarkeru osteoresorpce v séru zvyšují dříve, než se projeví výraznější pokles sérových koncentrací estradiolu (29). Uvedení klinická data ale nedovolují rozhodnout, zda se FSH může uplatňovat v regulaci kostní remodelace nezávisle na estradiolu. Takovou možnost však podporuje nález nižší denzity kostního minerálu (BMD) bederní páteře u žen s hypergonadotropickou amenoreou oproti ženám s hypogonadotropickou amenoreou, kdy negativní korelace mezi FSH a BMD byla zjištěna pouze u žen s hypogonadotropickou amenoreou (30). Pro přímý vliv FSH na kostní hmotu a kostní remodelaci svědčí také zjištění, že u žen s polymorfismem genu pro receptor pro FSH (FSHR) byla nižší BMD krčku femuru a celého těla a současně vyšší sérové hladiny biomarkerů remodelace kosti (31).
FOLIKULOSTIMULAČNÍ HORMON A CHRUPAVKA
Degenerace kloubní chrupavky je dominantní charakteristikou osteoartrózy. Novější studie však svědčí pro důležitou roli FSH v metabolismu kloubní chrupavky. Bylo již uvedeno, že v perimenopauzálním období zvýšení hladiny FSH předchází poklesu hladin estrogenů (29). U 79 žen ve věku 50–60 let s gonartrózou byly sérové hodnoty FSH vyšší než 40 IU/l asociovány se zhoršením kvality chrupavky, hodnocené jak magnetickou rezonancí, tak histologickým vyšetřením. Asociace mezi kvalitou chrupavky a sérovými hodnotami estradiolu nebyly u těchto žen prokázány (32). Ostatně také u pacientek s revmatoidní artritidou byly v porovnání se zdravými kontrolami zjištěny zvýšené hodnoty FSH, které pozitivně korelovaly s aktivitou onemocnění (33).
Uvedené klinické výsledky zdůvodňují potřebu experimentálních studií úlohy FSH v patofyziologii rozvoje osteoartrózy u žen po menopauze. V chondrocytech byl prokázán receptor pro FSH (34). Podání FSH a jeho vazba na specifický receptor v chondrocytech tlumí expresi proteinů extracelulární matrix (kolagenu typu II a agrekanu) v chondrocytech (35). Tato regulace se uskutečňuje prostřednictvím dráhy serinové/threoninové kinázy/proteinu vázajícího se na responzivní element cyklického adenosinmonofosfátu/genu SOX 9 (PAK/CREB/SOX9), přičemž SOX 9 je v chondrogenezi klíčový transkripční faktor (35). Heterozygotní mutace lidského genu pro SOX 9 způsobuje letální dysplazii, která se projevuje hypoplazií chrupavky a kostí (36). Transkripce kolagenu typu II a agrekanu je aktivována interakcí mezi SOX 9 a SOX 5 a 6 (37, 38).
Logickým dalším krokem bylo blokování účinků FSH v chondrocytech. Experimentální studie in vitro a u myší s posttraumatickou osteoartrózou prokázala, že odstranění FSHR nebo blokování FSHR specifickou siRNA (známou buď jako small interfering RNA, short interfering RNA, silencing RNA, či siFSHR) dokáže zvrátit negativní vliv FSH na syntetické funkce chondrocytů (obr. 1). Pro siRNA je typická RNA interference, kdy v tomto případě transfekcí krátké RNA molekuly pro FSHR do buněk chondrocytů je docíleno vyblokování receptoru pro FSH a tím jeho fyziologických účinků. Bylo prokázáno, že pokud se výše popsaným způsobem deaktivuje FSHR, toto vypnutí je spojeno se zvýšením exprese agrekanu a kolagenu typu II v kloubní chrupavce a tím s účinným oddálením rozvoje posttraumatické OA (35).
Image 1. Deaktivace receptoru FSH upravuje útlum syntézy extracelulární matrix chrupavky in vitro (upraveno podle (35)) 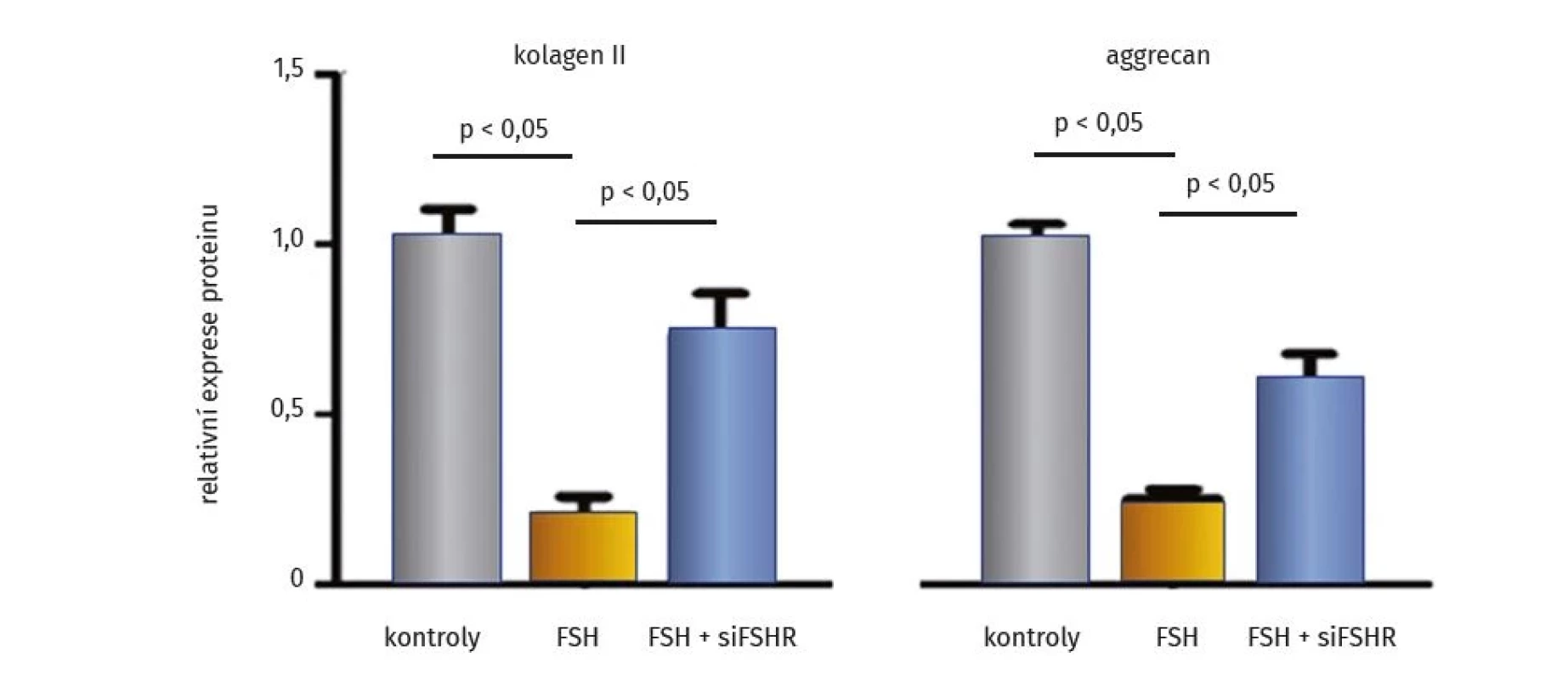
FSH – folikuly stimulující hormon, siFSHR – deaktivace receptoru pro folikuly stimulující hormon pomocí RNA interference krátkou molekulou RNA V experimentálních studiích se blokování účinků FSH uplatnilo nejen úpravou stavu kostní hmoty a kloubní chrupavky, ale také zlepšením kognitivních funkci a fenotypu Alzheimerovy choroby u myší (39). Vysvětluje se to přímým účinkem FSH na neurony hipokampu a kortexu a na ukládání depozit beta amyloidu a Tau. Akcentuje se tak význam diverzity makrofágů, které rychle a účinně reagují na vnější signály a mění svůj fenotyp. Makrofágy ovlivňují fagocytózu, odstraňování buněčných a cizorodých zbytků, regeneraci tkání, remodelaci kosti, vývoj zánětu. U osteoporózy se uplatňují makrofágy kostní dřeně a makrofágy přítomné v kostech, ve chrupavce se uplatňují synoviální makrofágy, u Alzheimerovy choroby mikroglie (40).
ZÁVĚR
FSH se uplatňuje v regulaci kostní hmoty přímým působením na osteoklastickou osteoresorpci. V regulaci metabolismu chrupavky FSH účinkem na specifický receptor na chondrocytech tlumí tvorbu proteinů extracelulární matrix chondrocytů. Experimentální studie potvrzují, že při regulaci funkcí osteoklastů a chondrocytů, ale také neuronů, se FSH může uplatňovat nezávisle na estradiolu. Experimentální studie svědčí pro možnost tyto účinky na kost, chrupavku i na neurony blokovat. Pro využití těchto poznatků v humánní medicíně budou nezbytné kontrolované klinické studie.
Poděkování
Děkuji panu prof. MUDr. Janu Štěpánovi. DrSc. za cenné konzultace nad diskuzí článku.
Adresa pro korespondenci:
MUDr. Kristýna Brábníková Marešová, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: brabnikova@revma.cz
Autoři prohlašují, že nejsou v konfliktu zájmů.
Do redakce doručeno: 24. 8. 2022
Podpořeno projektem NV18-05-00394 z Programu grantové podpory 2018 Ministerstva zdravotnictví České republiky. Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00023728 (Revmatologický ústav).
Čes. Revmatol. 2022; 30(4): 166–170
Sources
1. Hernlund E, Svedbom A, Ivergård M, Compston C, Cooper C, Stenmark J, et al. Osteoporosis in the European Union: medical management, epidemiology and economic burden. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch Osteoporos 2013; 8(1): 136.
2. Arden N, Nevitt MC. Osteoarthritis: epidemiology. Best Pract Res Clin Rheumatol 2006; 20(1): 3–25.
3. Barrett-Connor E, Wehren LE, Siris ES, Miller P, Ya-Ting Chen YT, Abbott TA 3rd, et al. Recency and duration of postmenopausal hormone therapy: effects on bone mineral density and fracture risk in the National Osteoporosis Risk Assessment (NORA) study. Menopause 2003; 10(5): 412–419.
4. Barnabei VM, Cochrane BB, Aragaki AK, Nygaard I, Williams RS, McGovern PG, et al. Menopausal symptoms and treatment-related effects of estrogen and progestin in the Women’s Health Initiative. Obstet Gynecol 2005; 105(5 Pt 1): 1063–1073.
5. Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of vertebral fractures: a meta-analysis of randomised trials. BMC Musculoskelet Disord 2001; 2 : 7.
6. Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of nonvertebral fractures: a meta-analysis of randomized trials. JAMA 2001; 285(22): 2891–2897.
7. Freemantle N, Cooper C, Diez-Perez A, Gitlin M, Radcliffe H, Shepherd S, et al. Results of indirect and mixed treatment comparison of fracture efficacy for osteoporosis treatments: a meta-analysis. Osteoporos Int 2013; 24(1): 209–217.
8. Randell KM, Honkanen RJ, Kröger H, Saarikoski S. Does hormone - replacement therapy prevent fractures in early postmenopausal women? J Bone Miner Res 2002; 17(3): 528–533.
9. Sniekers YH, Weinans H, Bierma-Zeinstra SM, van Leeuwen JP, van Osch GJ. Animal models for osteoarthritis: the effect of ovariectomy and estrogen treatment – a systematic approach. Osteoarthritis Cartilage 2008; 16(5): 533–541.
10. Manson JE, Chlebowski RT, Stefanick ML, Aragaki AK, Rossouw JE, Prentice RL, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA 2013; 310(13): 1353–1368.
11. Santen RJ, Allred DC, Ardoin SP, Archer DF, Boyd N, Braunstein GD, et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab 2010; 95(7 Suppl 1): s1–s66.
12. Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet 2019; 394(10204): 1159–1168.
13. Mehta J, Kling JM, Manson JE. Risks, Benefits, and Treatment Modalities of Menopausal Hormone Therapy: Current Concepts. Front Endocrinol (Lausanne) 2021; 12 : 564781.
14. Bjørnerem A, Straume B, Midtby M, Fønnebø V, Sundsfjord J, Svartberg J, et al. Endogenous sex hormones in relation to age, sex, lifestyle factors, and chronic diseases in a general population: the Tromsø Study. J Clin Endocrinol Metab 2004; 89(12): 6039–6047.
15. Siris ES, Harris ST, Eastell R, Zanchetta JR, Goemaere S, Diez - Perez A, et al. Skeletal effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J Bone Miner Res 2005; 20(9): 1514–1524.
16. Cauley JA, Norton L, Lippman ME, Eckert S, Krueger KA, Purdie DW, et al. Continued breast cancer risk reduction in postmenopausal women treated with raloxifene: 4-year results from the MORE trial. Multiple outcomes of raloxifene evaluation. Breast Cancer Res Treat 2001; 65(2): 125–134.
17. Silverman SL, Christiansen C , Genant HK, Vukicevic S, Zanchetta JR, de Villiers TJ, et al. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3-year, randomized, placebo-, and active-controlled clinical trial. J Bone Miner Res 2008; 23(12): 1923–1934.
18. Jochems C, Lagerquist M, Håkansson C, Ohlsson C, Carlsten H. Long-term anti-arthritic and anti-osteoporotic effects of raloxifene in established experimental postmenopausal polyarthritis. Clin Exp Immunol 2008; 152(3): 593–597.
19. Sun L, Peng Y, Sharrow AC, Iqbal J, Zhang Z, Papachristou DJ, et al. FSH directly regulates bone mass. Cell 2006; 125(2): 247–260.
20. Zhu LL, Tourkova IL, Yuen T, Robinson LJ, Bian Z, Zaidi M, et al. Blocking FSH action attenuates osteoclastogenesis. Biochem Biophys Res Commun 2012; 422(1): 54–58.
21. Iqbal J, Sun L, Kumar TR, Blair HC, Zaidi M. Follicle-stimulating hormone stimulates TNF production from immune cells to enhance osteoblast and osteoclast formation. Proc Natl Acad Sci USA 2006; 103(40): 14925–14930.
22. Cannon JG, Cortez-Cooper M, Meaders E, Stallings J, Haddow S, Kraj B, et al. Follicle-stimulating hormone, interleukin-1, and bone density in adult women. Am J Physiol Regul Integr Comp Physiol 2010; 298(3): R790–798.
23. Sun L, Zhang Z, Zhu LL, Peng Y, Liu X, Li J, et al. Further evidence for direct pro-resorptive actions of FSH. Biochem Biophys Res Commun 2010; 394(1): 6–11.
24. Wang J, Zhang W, Yu CH, Zhang X, Zhang H, Guan Q, et al. Follicle-stimulating hormone increases the risk of postmenopausal osteoporosis by stimulating osteoclast differentiation. PLoS One 2015; 10(8): e0134986.
25. Zhu LL, Blair H, Cao J, Yuen T, Latif R, Guo L, et al. Blocking antibody to the β-subunit of FSH prevents bone loss by inhibiting bone resorption and stimulating bone synthesis. Proc Natl Acad Sci USA 2012; 109(36): 14574–14579.
26. Cheung E, Tsang S, Bow C, Soong C, Yeung S, Loong C, et al. Bone loss during menopausal transition among southern Chinese women. Maturitas 2011; 69(1): 50–56.
27. García-Martín A, Reyes-García R, García-Castro JM, Rozas - Moreno P, Escobar-Jiménez F, Muñoz-Torres M. Role of serum FSH measurement on bone resorption in postmenopausal women. Endocrine 2012; 41(2): 302–308.
28. Sowers MR, Zheng H, Greendale GA, Neer RM, Cauley JA, Ellis J, et al. Changes in bone resorption across the menopause transition: effects of reproductive hormones, body size, and ethnicity. J Clin Endocrinol Metab 2013; 98(7): 2854–2863.
29. Randolph, JF, Jr ., Sowers M, Bondarenko IV, Harlow SD, Luborsky JL, Little RJ. Change in estradiol and follicle-stimulating hormone across the early menopausal transition: effects of ethnicity and age. J Clin Endocrinol Metab 2004; 89(4): 1555–1561.
30. Devleta B, Adem B, Senada S. Hypergonadotropic amenorrhea and bone density: new approach to an old problém. J Bone Miner Metab 2004; 22(4): 360–364.
31. Rendina D, Gianfrancesco F, De Filippo G, Merlotti D, Esposito T, Mingione A, et al. FSHR gene polymorphisms influence bone mineral density and bone turnover in postmenopausal women. Eur J Endocrinol 2010; 163(1): 165–172.
32. Liu Y, Zhang M, Kong D, Wang Y, Li J, Liu W, et al. High follicle-stimulating hormone levels accelerate cartilage damage of knee osteoarthritis in postmenopausal women through the PI3K/AKT/ NF-κB pathway. FEBS Open Bio 2020; 10(10): 2235–2245.
33. Zhang X, Qiao P, Guo Q, Liang Z, Pan J, Wu F, et al. High Folliclestimulating hormone level associated with risk of rheumatoid arthritis and disease activity. Front Endocrinol (Lausanne) 2022; 13 : 862849.
34. Kong D , Guan Q, Li G, Xin W, Qi X, Guo Y, et al. Expression of FSHR in chondrocytes and the effect of FSH on chondrocytes. Biochem Biophys Res Commun 2018; 495(1): 587–593.
35. Zhang M, Wang Y, Huan Z, Liu Y, Zhang W, Kong D, et al. FSH modulated cartilage ECM metabolism by targeting the PKA/ CREB/SOX9 pathway. J Bone Miner Metab 2021; 39(5): 769–779.
36. Wagner T, Wirth J, Meyer J, Zabel B, Held M, Zimmer J, et al. Autosomal sex reversal and campomelic dysplasia are caused by mutations in and around the SRY-related gene SOX9. Cell 1994; 79(6): 1111–1120.
37. Ng NJ, Wheatley S, Muscat GE, Conway-Campbell J, Bowles J, Wright E, et al. SOX9 binds DNA, activates transcription, and coexpresses with type II collagen during chondrogenesis in the mouse. Dev Biol 1997; 183(1): 108–121.
38. Sekiya I, Tsuji K, Koopman P, Watanabe H, Yamada Y, Shinomiya K, et al. SOX9 enhances aggrecan gene promoter/enhancer activity and is up-regulated by retinoic acid in a cartilage-derived cell line, TC6. J Biol Chem 2000; 275(15): 10738–10744.
39. Xiong J, Kang SS, Wang Z, Liu X, Kuo TCH, Korkmaz F, et al. FSH blockade improves cognition in mice with Alzheimer’s disease. Nature 2022; 603(7901): 470–476.
40. Xu Y, Yan H, Zhang X, Zhuo J, Han Y, Zhang H, et al. Roles of altered macrophages and cytokines: implications for pathological mechanisms of postmenopausal osteoporosis, rheumatoid Arthritis, and Alzheimer’s disease. Front Endocrinol (Lausanne) 2022; 13 : 876269.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2022 Issue 4-
All articles in this issue
- ÚVODNÍK
- Prof. MUDr. Ctibor Dostál, DrSc.
- Prof. MUDr. Stanislav Havelka, CSc.
- Validation of the Czech version of the questionnaire evaluating the early detection of intestinal and extraintestinal manifestations in patients with axial spondyloarthritis at risk of developing idiopathic intestinal inflammation: IBD screening criteria for patients with SpA
- Radiographic progression in patients with rheumatoid arthritis treated with JAK inhibitors
- Follicle-stimulating hormone and its effects on bone and cartilage
- Chronické rány jako komplikace revmatologických onemocnění
- MUDr. Marie Macků oslavila významné životní jubileum
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chronické rány jako komplikace revmatologických onemocnění
- Follicle-stimulating hormone and its effects on bone and cartilage
- Radiographic progression in patients with rheumatoid arthritis treated with JAK inhibitors
- Validation of the Czech version of the questionnaire evaluating the early detection of intestinal and extraintestinal manifestations in patients with axial spondyloarthritis at risk of developing idiopathic intestinal inflammation: IBD screening criteria for patients with SpA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

