-
Medical journals
- Career
Možnosti diagnostiky revmatické polymyalgie a obrovskobuněčné arteritidy pomocí FDG PET a PET/CT zobrazení – dvanáctileté zkušenosti jednoho diagnostického centra
Authors: Z. Řehák 1,2; Z. Fojtík 3; J. Vašina 1; R. Koukalová 1; Z. Bortlíček 4; A. Vavrušová 5; P. Němec 6
Authors‘ workplace: Oddělení nukleární medicíny a PET centrum, Masarykův onkologický ústav, Brno 1; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 2; Revmatologická ambulance, Interní hematologická a onkologická klinika, FN Brno a Lékařská fakulta Masarykovy univerzity, Brno 3; Institut biostatistiky a analýz, Lékařská fakulta Masarykovy univerzity, Brno 4; Interní oddělení, Nemocnice Třebíč 5; Revmatologická ambulance, II. interní klinika, FN U sv. Anny, Lékařská fakulta Masarykovy univerzity, Brno 6
Published in: Čes. Revmatol., 26, 2018, No. 3, p. 122-130.
Category: Original article
Overview
Revmatická polymyalgie (PMR) je chronické, zánětlivé onemocnění neznámé příčiny. Obrovskobuněčná arteritida (OBA) představuje systémovou vaskulitidu postihující střední a velké tepny, jako jsou temporální arterie nebo aorta a její odstupy. Možností, jak diagnostikovat tyto dvě klinické jednotky, by mohla představovat metoda 18F-FDG PET/CT. Potenciál této vyšetřovací metody spočívá v možnosti zachycení časných zánětlivých změn, které lze léčebně ovlivnit ještě před rozvojem změn trvalého charakteru.
Do sledování bylo zařazeno celkem 89 pacientů, 36 (40,4 %)mužů a 53 (59,6 %) žen ve věkovém rozmezí 47–83 let s mediánem 69 let, kteří splňovali kritéria revmatické polymyalgie. Vaskulární postižení bylo detekováno u 33 (37,1 %) pacientů, a to ve 2–7 (medián 4) měřených oblastech velkých tepen. Obraz postižení proximálních kloubů byl zaznamenán celkem u 81 (91,0 %) pacientů, přičemž zastoupení jednotlivých kloubních oblastí bylo následující: ramenní klouby 78 (87,6 %) pacientů, kyčelní klouby 65 (73,0 %) a sternoklavikulární skloubení 45 (50,6 %) pacientů. Obraz postižení extraartikulárních synoviálních struktur byl detekován u 75 (84,3 %) pacientů zejména v těchto lokalizacích: sedací hrboly, resp. ischiogluteální burzy u 48 (53,9 %) pacientů, oblast mezi spinózními výběžky bederní páteře u 42 (47,2 %) pacientů, oblast mezi spinózními výběžky krční páteře u 27 (30,3 %) pacientů, subtrochantericky u 41 (46,1 %) pacientů, symfýza u 23 (25,8 %) pacientů.
FDG PET/CT se zdá být výhodným „one-step“ vyšetřením, kterým lze detekovat rozsah aktivity v celé snímané oblasti, může zobrazit PMR či OBA v mnoha podobách těchto nemocí a současně je schopno podat důkaz o nepřítomnosti nádorového onemocnění.
Klíčová slova:
FDG, PET, PET/CT, revmatická polymyalgie, obrovskobuněčná arteritida
Úvod
Revmatická polymyalgie (PMR) je chronické, zánětlivé onemocnění neznámé příčiny. Typicky se vyskytuje u jedinců nad 50 let věku. Onemocnění je charakterizováno bolestí a dlouhotrvající ranní ztuhlostí v oblasti svalů krku, ramenního pletence a kyčelního pletence. Zdá se, že tyto symptomy PMR jsou způsobeny zánětlivými procesy v periartikulárních strukturách (1). Obrovskobuněčná arteritida (OBA, giant cell arteritis – GCA) představuje systémovou vaskulitidu postihující střední a velké tepny, jako jsou temporální arterie nebo aorta a její odstupy (2).
PMR se vyskytuje téměř výhradně u jedinců starších 50 let, průměrný věk vzniku klinických projevů je okolo 73 let a výskyt se zvyšuje se zvyšujícím se a prodlužujícím se věkem (3). Jedná se o časté zánětlivé revmatické onemocnění v pozdním věku s životním rizikem vzniku 2,4 % pro ženy a 1,7 %pro muže (4). Incidence onemocnění se liší dle geografického uspořádání, v oblasti Skandinávie a severních oblastech Evropy byla pozorovaná incidence 112,6/100 000 obyvatel nad 50 let (5), ve Velké Británii a Dánsku byla incidence v rozmezí 41,3 – 84/100 000 obyvatel (6, 7). V jižních částech Evropy se incidence pohybuje okolo 12,7/100 000 v oblasti Itálie (8) a v případě Turecka pouze 3,15/100 000 obyvatel v dané věkové skupině, tedy jedinců nad 50 let (9).
Přestože se obě onemocnění vyskytují u jedinců nad 50 let věku poměrně často, je v současnosti v literatuře k dispozici málo informací týkajících se diagnostiky a léčby, založených na výsledcích randomizovaných kontrolovaných studií.
Určitý nedostatek dat je podpořen i faktem, že doposud není určen jednoznačný diagnostický test a zejména diagnóza PMR je založena na klinických projevech a na přítomnosti sérových zánětlivých parametrů. Ultrasonografické vyšetření (USG) ramenních a kyčelních kloubů s nálezem burzitidy a tenosynovitidy může tuto diagnózu dále podpořit (10). Z těchto důvodů je provádění diferenciální diagnostiky založeno na postupném ověřování jiných možných onemocnění a záleží i na osobních zkušenostech ošetřujícího lékaře.
PMR a OBA spolu sdílí řadu charakteristik, jako jsou věk při vzniku onemocnění, převažující ženské pohlaví, obdobné geografické rozložení dle epidemiologických studií, že lze předpokládat, že se může jednat o rozdílné klinické projevy jednoho onemocnění. Souvislost mezi PMR a OBA byla vyslovena již před více než 50 lety (11, 12) a zdá se, že v některých případech lze u stejného pacienta určit obě dvě klinické jednotky buď současně, nebo postupně (13). Klinicky má 40–60 % pacientů s OBA projevy PMR a naopak u 16–21 % pacientů s PMR lze pozorovat charakteristiky OBA (2, 14).
Jako jednu z možností, jak odlišit tyto dvě klinické jednotky (respektive jednu možnou klinickou jednotku s různými klinickými projevy), by mohla představovat metoda celotělové pozitronové emisní tomografie (PET), dnes již v kombinaci s výpočetní tomografií (CT) jako PET/CT vyšetření s použitím 18F fluorodeoxyglukózy (FDG) (15).
Vzhledem k těmto nejasnostem jsme se rozhodli retrospektivně analyzovat nálezy PMR pacientů, kteří byli vyšetřeni v našem PET centru za období 12 let, a určit rozsah možné zánětlivé aktivity.
Cíle práce
Vzhledem k překrývání klinických i laboratorních charakteristik u PMR a OBA bylo cílem našeho sledování retrospektivně analyzovat PET a PET/CT nálezy a určit u pacientů s vysloveným podezřením na PMR možný obraz rozložení zánětlivé aktivity hodnocené pomocí akumulace FDG. Zaměřili jsme se na akumulaci FDG nad synoviálními strukturami proximálních kloubních skupin, tedy ramenních a kyčelních kloubů a synovitidy extraartikulárních struktur, dále jsme se snažili určit přítomnost vaskulární aktivity typické pro OBA.
Pacienti a metodika
Všichni pacienti byli vyšetřeni v letech 2004 až 2015 (12 let). Nejčastěji uváděným důvodem odeslání k vyšetření byla horečka neznámého původu, zvýšené hodnoty reaktantů akutní fáze a klinické projevy PMR. Tyto klinické projevy PMR mohou mít i paraneoplastický původ, proto bylo cílem tohoto vyšetření i nepotvrzení, resp. vyloučení malignity.
Pro diagnózu PMR byla navržena řada diagnostických a klasifikačních kritérií, založená na kombinaci věku (obvykle více než 50 let), oboustranné bolestivosti ramenních pletenců a abnormální sedimentace erytrocytů nebo zvýšení C-reaktivního proteinu. V našem sledování jsme použili kritéria dle Healeyho vzhledem k jejich jednoduchosti a velmi dobré senzitivitě a specificitě pro PMR (tab. 1) (16).
Table 1. Kritéria revmatické polymyalgie dle Healey (16). 
Do sledování bylo zařazeno celkem 89 pacientů, z toho 36 (40,4 %) mužů a 53 (59,6 %) žen ve věkovém rozmezí 47–83 let s mediánem 69 let (tab. 2). Pacienti splňovali zvolená kritéria PMR, někteří měli celkové příznaky, jako jsou anémie, váhový úbytek, teploty a celkově neprospívali. U všech pacientů byla léčba zahajována prednisonem, u 2 pacientů v kombinaci s methotrexátem. PET či PET/CT vyšetření byla provedena vždy ještě před zahájením léčby prednisonem s vědomím, že obraz zánětlivého postižení by mohl být léčbou ovlivněn a pacienti, kteří v době provedení PET či PET/CT již byli léčeni glukokortikoidy, nebyli do sledování zařazeni.
Table 2. Základní charakteristika skupiny. 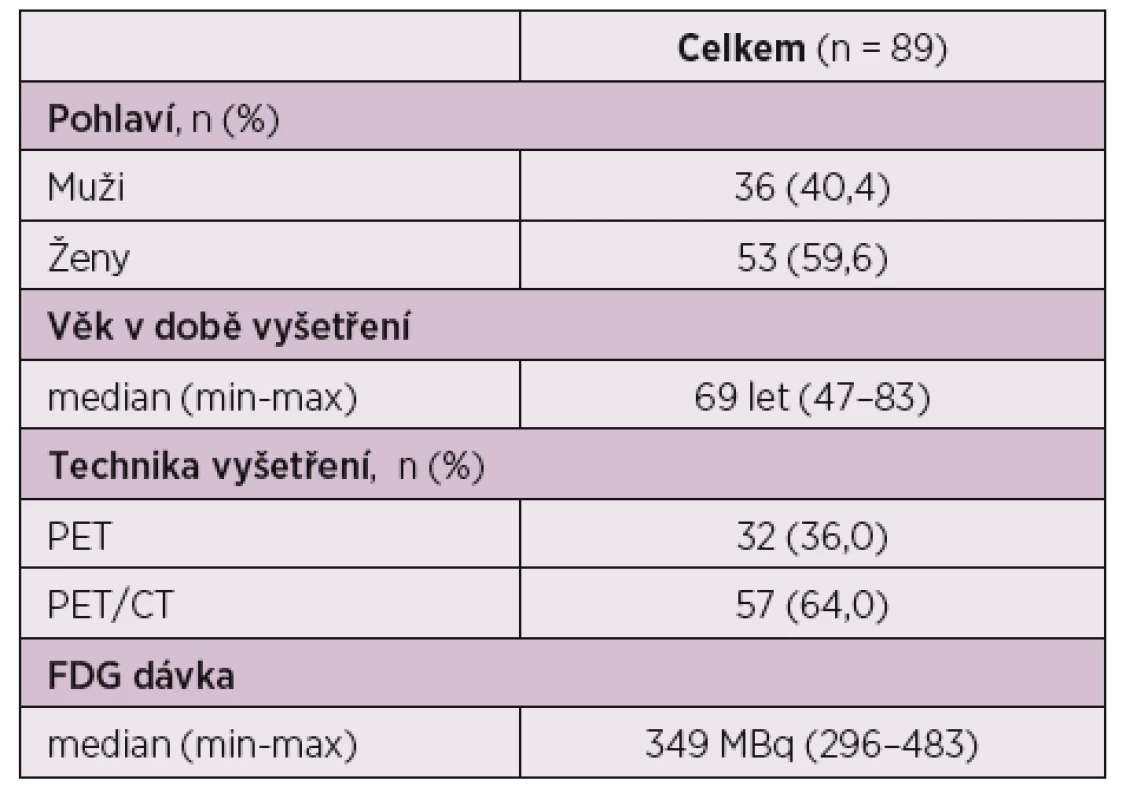
Pacienti byli vyšetření na PET skeneru (ECAT ACCEL SIEMENS, Erlangen, Německo – 32 pacientů, 47,8 %,od roku 2004 do konce roku 2013), nebo na hybridním PET/CT skeneru (Biograph 64, True Point HR, SIEMENS, Erlangen, Německo – 57 pacientů, 64 %, od roku 2008 do konce roku 2015). Pokud byla vyšetření provedena na hybridním skeneru, pak v režimu low dose (LD) nebo high dose (HD) CT s podáním i.v. kontrastní látky Iomeron 400.
Vyšetření byla prováděna standardním postupem. Pacienti byli nalačno, měli euglykémii a bylo jim intravenózně podáno radiofarmakum, jehož aplikovaná aktivita FDG byla v rozmezí 296–483 MBq. Po akumulační fázi (v rozmezí 55–75 minut) bylo provedeno snímání v rozsahu proximální třetina stehen až baze lební. Vyšetření mimo tento rozsah (hlava nebo celé dolní končetiny) nebyla hodnocena, protože nebyla provedena u všech pacientů.
Akumulace FDG byla hodnocena vizuálně, v místech zvýšené akumulace, v zakreslené oblasti zájmu (ROI) pak i semikvantitativně se stanovením Standardized uptake value (SUVmax). Ke každé studii byla hodnocena i akumulace jaterní tkáně jako referenční oblast (SUVmax liver). Vychytávání (akumulace) FDG v jednotlivých oblastech bylo hodnoceno jako pozitivní, pokud přesahovalo akumulaci jaterní. Zaměřili jsme se na vaskulární oblasti, oblast proximálních kloubů a extraartikulárních struktur.
Při hodnocení oblasti proximálních kloubů byly sledovány ramenní, kyčelní a sternoklavikulární klouby. Tyto oblasti byly hodnoceny jako pozitivní, pokud akumulace přesahovala akumulaci referenčního jaterního parenchymu, a to alespoň na jedné straně.
V rámci vaskulární oblasti bylo hodnoceno těchto 7 oblastí: aorta ascendens, aorta descendens, aorta abdominalis, truncus brachiocephalicus, arteria subclavia, arteria iliaca communis, arteria femoralis communis a současně byl evidován i počet aktivních cévních oblastí (0–7).
Akumulace FDG v oblastech extraartikulárních synoviálních struktur byla rovněž hodnocena jako pozitivní, pokud přesahovala akumulaci referenčního jaterního parenchymu. Místa sledování byla zvolena na základě vizuálního hodnocení v předpokládaných oblastech, jakou jsou spinózní výběžky obratlů krční, hrudní a bederní páteře, hrboly sedacích kostí, oblast velkých trochanterů a okolí symfýz. V případě párových míst byla hodnocena vyšší akumulace.
V rámci statistického zhodnocení byla významnost rozdílů v nálezu mezi muži a ženami, resp. mezi výsledky PET a PET/CT stanovena pomocí Fisherova exaktního testu. Zastoupení mužů a žen a zastoupení PET a PET/CT nálezů je charakterizováno četností výskytu jednotlivých kategorií a příslušným procentuálním zastoupením. Věk při vyšetření je charakterizován pomocí mediánu, minima a maxima.
Výsledky
U pacientů splňujících kritéria PMR byly zjištěny tyto následně popsané obrazy zvýšené akumulace FDG (tab. 3).
Table 3. Nálezy při PET, PET/CT vyšetření. 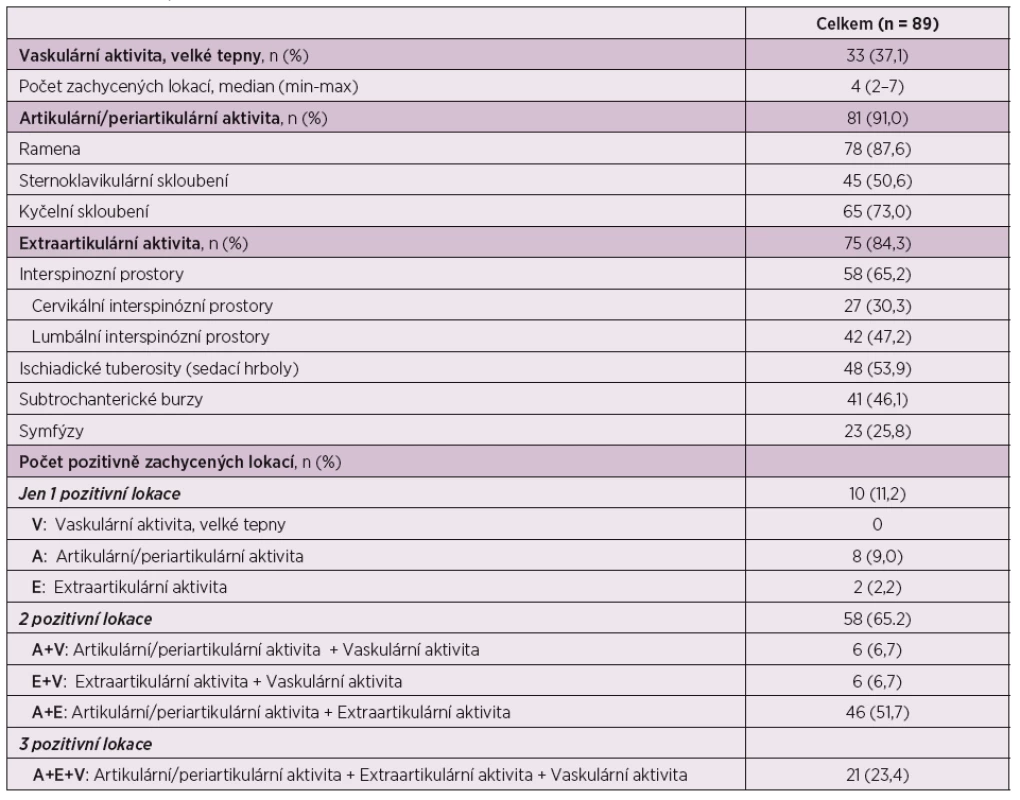
Vaskulární postižení bylo detekováno u 33 (37,1 %) pacientů, a to ve 2–7 (medián 4) měřených oblastech velkých tepen. U žádného z pacientů nebyl zjištěn izolovaný obraz vaskulárního postižení.
Obraz postižení proximálních kloubů byl zjištěn celkem u 81 (91,0 %) pacientů, přičemž zastoupení jednotlivých kloubních oblastí bylo následující: ramenní klouby u 78 (87,6 %) pacientů, kyčelní klouby u 65 (73,0 %) a sternoklavikulární skloubení u 45 (50,6 %) pacientů. Samostatné postižení proximálních kloubů bylo nalezeno u 8 (9,0 %) pacientů.
Obraz postižení extraartikulárních synoviálních struktur byl detekován u 75 (84,3 %) pacientů. Vysokou akumulaci FDG jsme zjistili zejména v těchto lokalizacích: sedací hrboly, resp. ischiogluteální burzy u 48 (53,9 %) pacientů, v oblasti mezi spinózními výběžky u 58 (65,2 %) pacientů, a to v úseku L páteře u 42 (47,2 %) pacientů, mezi spinózními výběžky C páteře u 27 (30,3 %) pacientů, subtrochantericky u 41 (46,1 %) pacientů a při symfýzách u 23 (25,8 %) pacientů. Samostatné postižení extraartikulárních synoviálních struktur jsme nalezli u 2 pacientů (2,2 %).
V rámci kombinací byly zjištěny všechny 3 možné typy nálezů postižení: artikulární + vaskulární u 6 (6,7 %) pacientů, artikulární + extraartikulární synoviální struktury u 46 (51,7 %) pacientů, vaskulární + extraartikulární synoviální struktury u 6 (6,7 %) pacientů.
Byla zachycena i trojkombinace nálezů, tedy vaskulární + kloubní + postižení extraartikulárních synoviálních struktur u 21 (23,4 %) pacientů.
Bylo zaznamenáno více pozitivních nálezů v oblasti tepen u žen než u mužů (p = 0,025), zatímco při hodnocení postižení proximálních kloubních skupin a extraartikulárních synoviálních struktur nebyly statisticky významné rozdíly mezi pohlavími pozorovány (p = 0,136, resp. p = 0,999) (tab. 4).
Table 4. Výsledky vyšetření dle pohlaví. 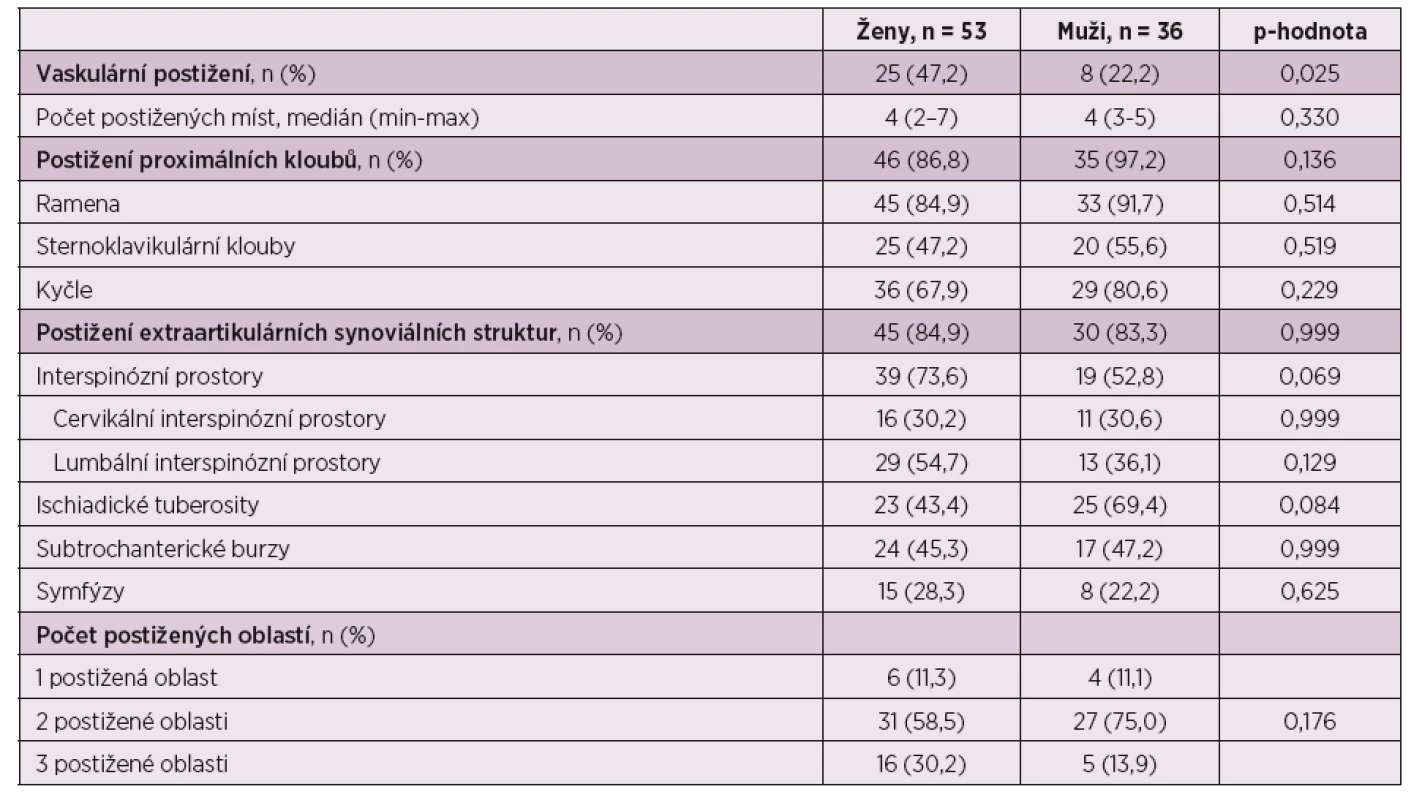
Statisticky významné rozdíly nebyly pozorovány v případě pacientů vyšetřených pouze PET (32 pacientů) a PET/CT (57 pacientů) při hodnocení aktivity v oblasti postižení tepen a proximálních kloubních skupin (p = 0,999, resp. p = 0,451). Při hodnocení extraartikulárních synoviálních struktur byl nalezen statisticky významný rozdíl mezi oběma vyšetřovacími metodami (p < 0,001), kdy ve skupině vyšetřované pomocí PET/CT byl zaznamenán pozitivní nález u 56 z 57 pacientů (98,2 %), zatímco ve skupině vyšetřované pomocí PET pouze 19 z 32 pacientů (59,4 %). Tento nález podporuje předpoklad větší senzitivity PET/CT vyšetření pro detekci zánětlivých změn (tab. 5).
Table 5. Výsledky vyšetření dle zobrazovací metody. 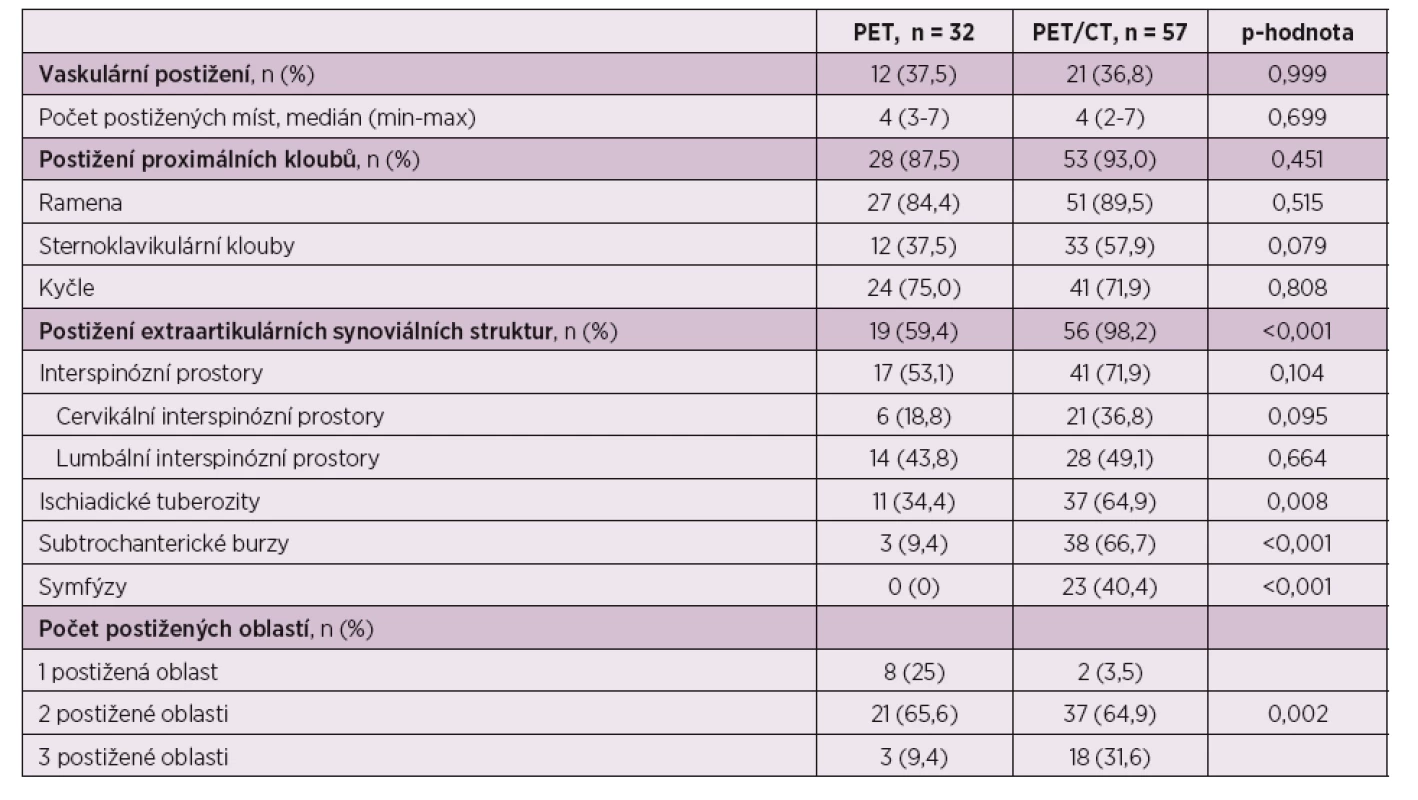
Diskuse
V našem souboru byli všichni pacienti starší 47 let, byly více zastoupeny ženy s klinickými a laboratorními příznaky, všichni nemocní splňovali kritéria PMR. Tito pacienti byli vyšetřováni vzhledem k významné symptomatologii a většinou v rámci diferenciální diagnostiky teplot nejasné etiologie, mimo jiné i k vyloučení nádorového onemocnění. Do souboru byli zařazeni pacienti s potvrzenou diagnózou PMR od revmatologa a u všech zařazených pacientů byla potvrzena klinická i laboratorní odezva na terapii glukokortikoidy nebo kombinací s methotrexátem.
K průkazu synovitidy ramenních i kyčelních kloubů a zánětlivých změn v periartikulárních přilehlých oblastech lze využívat ultrasonografii (USG) i MR. Relativně častými nálezy jsou subakromiální a subdeltoidální burzitidy, tenosynovitida dlouhé hlavy bicepsu či glenohumerální synovitida při vyšetření ramenních kloubů; v případě kyčelních kloubů pak synovitidy a burzitidy trochanteru. USG i MR jsou v této indikaci přibližně rovnocennými vyšetřeními a změny při kloubním postižení lze prokázat se senzitivitou i specificitou nad 90 % (17–20).
Při vyšetření PET či PET/CT prokázali Blockmans a kol. na studii 35 pacientů s PMR vysokou akumulaci FDG v oblasti ramenních a kyčelních kloubů u 94 %, resp. 89 % pacientů (21). Dalšími autory byla prokázána akumulace FDG v oblasti ramenního kloubu a kyčle u 86 % (12 z 14 pacientů) (22). V našem souboru jsme zjistili postižení proximálních kloubů jak v rámci samostatného, tak i kombinovaných obrazů s obdobným procentuálním podílem jako publikovali autoři v předcházejících studiích (ramena u 87, 6 %, kyčle u 73,0 %).Z PET obrazu však v oblasti ramen ani kyčlí nelze přesně rozlišit jednotlivé struktury, zda se jedná o aktivitu synoviální výstelky kloubů, burzitidu či periartikulární akumulaci FDG, protože vyšší akumulace FDG plynule přechází kolem kloubního pouzdra i na okolní struktury. Nález akumulace FDG v oblasti sternoklavikulárních kloubů jsme zachytili u 45 z 89 (50,6 %) pacientů. Informace o postižení těchto kloubů ve vztahu k PMR jsou minimální, pouze Yamashita a kol. nacházeli akumulaci FDG v této lokalizaci u 43 % (6/14) pacientů (22).
Vztah mezi PMR a OBA je velmi těsný a je možné, že se jedná o různé projevy téže nemoci. Svědčí pro to starší věk nemocných, většinou zvýšení reaktantů akutní fáze, velmi obdobné klinické projevy i rychlá odezva na léčbu glukokortikoidy. V řadě studií bylo prokázáno určité prolínání obou jednotek, kdy asi 16–21 % pacientů s PMR může mít zánětlivé postižení tepen a opačně 40-60 % pacientů s postižením velkých tepen má klinické příznaky PMR (2, 13, 14). V roce 2004 byl publikován soubor 12 pacientů s klinickými projevy PMR, kdy autoři popisují zvýšené vychytávání FDG právě jen ve velkých tepnách (23). Z dnešního pohledu se zdá, že se spíše jednalo o pacienty s OBA. V letech 2006 a 2007 autoři Blockmans a kol. publikovali dvě studie. V první sledovali 35 pacientů s OBA (24). PET obraz vaskulitidy velkých tepen (LVV – large vessel vasculitis) byl zjištěn u 83 % těchto pacientů a současně u 11 (31 %) byly zaznamenány klinické projevy PMR (24). V dalším hodnocení stejní autoři sledovali (opět) 35 pacientů, ale tentokrát s PMR. U 11 (31 %) pacientů prokázali postižení velkých tepen (21). Tyto studie ukázaly, že obraz vaskulitidy (středních nebo velkých tepen), nebo akumulace FDG v proximálních kloubech, se nachází jak u pacientů s OBA, tak i PMR, což dokládá těsný vztah obou nemocí.
V současné době je k dispozici dostatek informací o přínosu PET či PET/CT v diagnostice OBA (25–27). Obě tyto metody mají výhodu v možnosti vizualizace všech potenciálně postižených tepen (s určitou limitací temporálních a renálních tepen). Falešně pozitivní výsledky mohou být pozorovány v případech významných aterosklerotických změn, falešně negativní výsledky se mohou vyskytnout v případech podání glukokortikoidů delší dobu před vyšetřením. Hladké a symetrické změny tepen znamenají většinou vaskulitidu, zatímco asymetrické a ložiskové nálezy bývají u aterosklerotických změn (29).
Z vyšetřovacích metod pro detekci zánětlivého postižení stěn extrakraniálních arterií lze použít barevnou dopplerometrickou ultrasonografii (Doppler USG), PET, MR nebo CT, přičemž Doppler USG má limitní možnosti pro detekci aortitidy, ale lze ho použít k detekci kraniálních změn (27).
Hlavními výhodami PET či PET/CT vyšetření se ukázala možnost detekce OBA dříve než morfologickými zobrazovacími metodami (CT angiografie, MR angiografie) nebo pomocí histologického rozboru bioptované arteria termporalis superficialis. Další výhodou může být určení rozsahu vaskulitidy, zejména v extrakraniální oblasti (25, 26). K vyšetření arteria temporalis superficialis je doporučováno využít Doppler USG a MR, i když za použití Brain protokolu snímání na hybridním PET/CT skeneru lze prokázat i postižení temporálních nebo okcipitálních tepen (28).
V našem souboru jsme nalezli postižení velkých tepen u 33 z 89 (37,1 %) pacientů s PMR, což je obdobný nález jako u jiných autorů (24). V případě naší skupiny pacientů bylo postižení tepen vždy v kombinaci s jinými typy postižení, nikoli jako samostatný nález (tab. 3, obr. 1).
Image 1. FDG PET vyšetření trupu u 77leté pacientky s klinickým obrazem PMR a nálezem na PET/CT. MIP PET (černobílý) obraz pootočen, aby nedošlo k sumaci nálezů při střední čáře. Dále detaily hybridních PET/CT obrazů na jednotlivá místa postižení (axiální a sagitální roviny). Artikulární/periartikulární zobrazení (ramena, sternoklavikulární skloubení) – žluté šipky. Extraartikulární nálezy (cervikální a lumbální interspinózní prostory, okolí sedacích hrbolů, velkých trochanterů, symfýzy) – zelené šipky. Vaskulární zobrazení (extrakraniální tepny, aorta a její odstupy) – červené šipky. 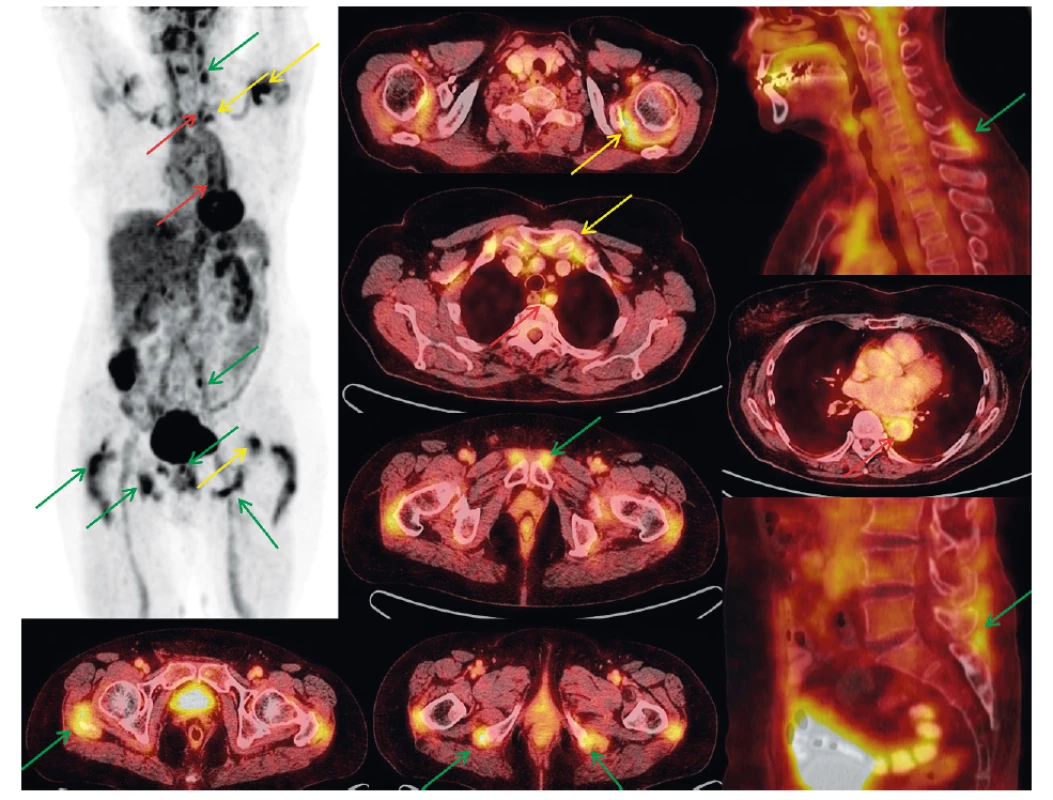
Pomocí USG a MR lze zjistit přítomnost burzitidy trochanteru, v některých případech lze zachytit i iliopsoatické a ischiogluteální burzitidy u pacientů s PMR (18). Dalšími autory byly pomocí MR prokázány burzitidy v úseku C5–7 páteře, respektive v cervikálních interspinózních prostorech (30). V další studii byla hodnocena akumulace FDG ve velkých tepnách, proximálních kloubech a současně byla zaznamenána akumulace v oblasti spinózních výběžků obratlů bederní, hrudní a krční páteře u poloviny nemocných (18 z 35, 51 %) (21).Některé kazuistiky již na hybridních PET/CT skenerech popisují rovněž akumulaci FDG mezi spinózními výběžky obratlů a v dalších extraartikulárních synoviálních strukturách (burzy v okolí symfýzy, v pubické oblasti, v oblastech sedacích hrbolů a nad femorálními trochantery) (38), a to jak v kombinaci s postižením proximálních kloubů, tak s vaskulitidou (31–35).
Teorie interspinózní burzitidy jako projevu PMR podmiňující ztuhlosti a citlivost v oblasti C páteře byla zkoumána pomocí MRI a ukazuje se, že aktivních burzitid v oblasti C5-7 je významně více pacientů s PMR než u kontrolní skupiny (30). Interspinózní burzitida byla také ověřena u PMR pacientů pomocí MRI i na bederním úseku páteře (36). V našem souboru jsme zaznamenali pomocí PET známky metabolicky aktivní interspinózní burzitidy s morfologickým korelátem pomocí CT jak v cervikálním, tak i v bederním úseku páteře (obr. 1). Zdá se, že nález extraartikulární burzitidy pomocí PET/CT by mohl být pro PMR pacienty typický zejména při akumulaci FDG alespoň ve 2 z těchto 3 míst – sedací hrboly, velké trochantery femuru a oblasti spinózních výběžků páteře (22).
Jak dosud publikované údaje (12, 13), tak i naše výsledky ukazují, že aktivní PMR může být současně (nebo postupně) provázena metabolicky aktivním zánětem extraartikulárních synoviálních struktur a burz a extrakraniální či kraniální formou vaskulitidy. Všechny tyto formy postižení PMR lze zachytit a dobře zobrazit pomocí FDG PET i PET/CT vyšetření. Potenciál těchto vyšetřovacích metod spočívá v možnosti zachycení časných zánětlivých změn, které lze léčebně ovlivnit ještě před rozvojem změn trvalého charakteru, jako jsou ztluštění cévní stěny, vznik aneuryzmat a disekcí, komplikace, které mohou být asociovány se zvýšením mortality. Dalšími výhodami je neinvazivní postup a možnost relativně snadného sledování léčebné odezvy. Pro zhodnocení akumulace FDG zejména v oblasti tepen se nejčastěji užívá „aorta-to-liver ratio“, tedy vizuální metoda založena na porovnání akumulace s jaterní tkání. V případě vyšší akumulace, než je akumulace FDG v játrech, je výsledek hodnocen jako pozitivní (37).
Recentně bylo publikováno doporučení vyšetřovacího postupu v případě podezření u pacientů s vaskulitidou velkých tepen, ke kterým lze řadit i OBA (26). Zobrazovací metody (USG, PET/CT, MR nebo CT) je možné užít pro detekci zánětlivých změn cévní stěny či intraluminálních změn extrakraniálních arterií a podpořit diagnózy OBA, resp. vaskulitidy velkých cév (26).
Závěr
PMR a OBA jsou onemocnění, která jsou většinou provázena nápadnými celkovými příznaky, jako jsou teploty, váhový úbytek a laboratorně zvýšením reaktantů akutní fáze. Možnosti sofistikovaných zobrazovacích vyšetřovacích technik, kam řadíme FDG PET či PET/CT, patří k metodám, kterými lze detekovat tři hlavní oblasti postižení u pacientů s PMR, tedy aktivitu nad proximálními kloubními skupinami, extraartikulární postižení a zejména postižení středních a velkých tepen. Nálezy mohou být jen parciální charakter (např. unilaterální postižení extraartikulárních synoviálních struktur) a různě vyjádřenou míru akumulace FDG. FDG PET/CT se zdá být výhodným „one-step“ vyšetřením, kterým je možno detekovat rozsah zánětlivých změn v celé snímané oblasti a může zobrazit PMR či OBA v mnoha podobách těchto nemocí a současně podat důkaz o nepřítomnosti nádorového onemocnění. Tato metoda má i své určité nevýhody, ke kterým patří horší dostupnost, vyšší náklady na vyšetření a větší radiační zátěž. Role této metody u pacientů s PMR či OBA spočívá jak v diagnostice těchto chorob, tak v možnosti sledování a hodnocení léčebné odezvy i případných relapsů. Z těchto důvodů byla tato metoda recentně uvedena do doporučení v rámci vyšetřovacího postupu u pacientů s OBA a vaskulitidou velkých tepen.
Podpora:
MZ ČR – RVO (MOÚ, 00209805) a projekt LO 1413.
MUDr. Zdeněk Fojtík, PhD.
Revmatologická ambulance,
Interní hematologická a onkologická klinika,
FN Brno
Jihlavská 20
625 00 Brno
E-mail: fojtik.zdenek@fnbrno.cz
Sources
1. Salvarani C, Cantini F, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008; 372 : 234-45.
2. Salvarani C, Pipitone N, Versari A, Hunder G. Clinical Features of polymyalgia rheumatica and giant cell arteritis. Nat Rev Rheumatol 2012; 8 : 509–21.
3. Doran MF, Crowson CS, O´Fallon WM, et al. Trends in the incidence of polymyalgia rheumatica over a 30-year period in Olmsted County, Minnesota, USA. J Rheumatol 2002; 29 : 1694–7.
4. Crowson CS, Matteson EL, Myasoedova, E et al. The lifetime risk of adult-onset rheumatoid arthritis and other inflammatory autoimmune rheumatic diseases. Arthritis Rheum 2011; 63 : 633–9.
5. Gran JT, Myklebust G. The incidence of polymyalgia rheumatica and temporal arteritis in the county of Aust Agder, south Norway: a prospective study 1987-94. J Rheumatol 1997; 24 : 1739–43.
6. Smeeth L, Cook C, Hall AJ. Incidence of diagnosed polymyalgia rheumatica and temporal arteritis in the United Kingdom, 1990-2001. Ann Rheum Dis 2006; 65 : 1093–8.
7. Kermani TA, Warrington KJ. Polymyalgia rheumatica. Lancet 2013; 381 : 63–72.
8. Salvarani C, Macchioni P, Zizzi F, et al. Epidemiologic and immunogenetic aspects of polymyalgia rheumatica and giant cell arteritis in northern Italy. Arthritis Rheum 1991; 34 : 351–6.
9. Pamuk ON, Donmez S, Karahan B, et al. Giant cell arteritis and polymyalgia rheumatica in northwestern Turkey. Clinical features and epidemiological data. Clin Exp Rheumatol 2009; 27 : 830–3.
10. Dasgupta B, Cimmino MA, Maradit-Kremers H, Schmidt WA, Schirmer M, Salvarani C, et al. 2012 provisional classificatio criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2012; 71(4): 484–92.
11. Paulley JW, Hughes JP. Giant cell arteritis, or arteritis of the aged. BMJ 1960; 2 : 1562–67.
12. Wilske KR, Healey LA. Polymyalgia rheumatica: a manifestation of giant cell arteritis. Ann Intern med 1967; 66 : 77–91.
13. Blockmans D. Where does polymyalgia rheumatica end and giant cell arteritis begin? Lesson from positron emission tomography studies. Acta Clin Belg 2012; 67 : 389–3.
14. Salvarani C, Gabriel SE, O´Fallon WM, Hunder GG. The incidence of giant cell arteritis in Olmsted county, apparent fluctuation in a cyclic pattern. Ann Intern Med 1995; 123 : 192–4.
15. Blockmans D, Maes A, Stroobants S, et al. New arguments for a vasculitic nature of polymyalgia rheumatica using positron emission tomography. Rheumatology (Oxford) 1999; 38 : 444–7.
16. Healey LA. Long-term follow-up of polymyalgia: evidence for synovitis. Semin Arthritis Rheum 1984; 13 : 322–8.
17. Cantini F, Salvarani C, Olivieri I et al. Shoulder ultrasonography in the diagnosis of polymyalgia rheumatica: a case-control study. J Rheumatol 2001; 28 : 1049–55.
18. Cantini F, Nicolli L, Nanini C et al. Inflammatory changes of hip synovial structures in polymyalgia rheumatica. Clin Exp Rheumatol 2005; 23 : 462–8.
19. Macchioni P, Catanoso MG, Pipitone N, Boiardi L, Salvarani C.Longitudinal examination with shoulder ultrasonography of patients with polymyalgia rheumatica. Rheumatology 2009; 48 : 1566–9.
20. Patil P, Adizie T, Jain S, Dasgupta B. Imaging indications in polymyalgia rheumatica. Int J Clin Rheumatol 2013; 8(1): 39–48.
21. Blockmans D, De Ceuninck L, Vanderscheueren S, Knockaert D, Mortelmans L, Bobbaers H. Repetitive 18-fluorodeoxyglucose positron emission tomography in isolated polymyalgia rheumatica: a prospective study in 35 patients. Rheumatology 2007; 46 : 672–7.
22. Yamashita H, Kubota K, Takahashi Y, Minaminoto R, Morooka M, Ito K, et al. Whole-body fluorodeoxyglucose positron emission tomography/computed tomography in patients with active polymyalgia rheumatica: evidence for distinctive bursitis and large-vessel vasculitis. Mod Rheumatol 2012; 22 : 705–11.
23. Moosig F, Czech N, Mehl C, Henze E, Zeuner RA, Kneba M, et al.Correlation between 18-fluorodeoxyglucose accumulation in large vessels and serological markers of inflammation in polymyalgia rheumatica: a quantitative PET study. Ann Rheum Dis 2004; 63 : 870–3.
24. Blockmans D, De Ceuninck L, Vanderschueren S, et al. Repetitive 18F-Fluorodeoxyglucose positron emission tomography in giant cell arteritis: a prospective study in 35 patients. Arthritis Rheum 2006; 55(1): 131–7.
25. Fuchs M, Briel M, Daikeler T, Walker UA, Rasch H, Berg S, et al. The impact of 18F-FDG PET on the management of patients with suspected large vessel vasculitis. Eur J Nucl Med Mol Imaging 2012; 39 : 344–53.
26. Glaudemans AWJM, de Vries EFJ, Galli F, Dierckx RAJO, Slart RHJA, Signore A. The Use of 18F-FDG-PET/CT for diagnosis and treatment monitoring of inflammatory and infectious diseases. Clin Dev Immunol 2013; 2013: Article ID 623036.
27. Dejaco CH, Ramiro S, Duftner CH, Besson FL, Bley TA, Blockmans D et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis 2018; 0 : 1–8.
28. Řehák Z, Szturz P, Křen L, Fojtík Z, Staníček J. Upsampling from aorta and aortic branches. PET/CT hybrid imaging identified 18F-FDG hypermetabolism in inflamed temporal and occipital arteries. Clin Nucl Med 2014; 39(1): e84–6.
29. Muratore F, Pazzola G, Pipitone N, Boiardi L, Salvarani C. Large-vessel involvement in giant cell arteritis and polymyalgia rheumatica. Clin Exp Rheumatol 2014; 32 : 106-11.
30. Salvarani C, Barozz L, Cantini F et al. Cervical interspinous bursitis in active polymyalgia rheumatica. Ann Rheum Dis 2008; 67 : 758–61.
31. Toriihara A, Seto Y, Yoshida K, Umehara I, Nakagawa T, Liu R, Iwamoto I. F-18 FDG PET/CT of Polymyalgia Rheumatica. Clin Nucl Med 2009; 34 : 305–6.
32. Kotani T, Komori T, Kanzaki Y, Takeuchi T, Wakura D, Iimori A, Hirano-Kuwata S, Makino S, Hanafusa T, Ukimora A. FDG-PET/CT of polymyalgia rheumatica. Mod Rheumatol 2011; 21 : 334-6.
33. Adams H, Raijmakers P, Smulders Y. Polymyalgia Rheumatica and Interspinous FDG Uptake on PET/CT. Clin Nucl Med 2012;37 : 502-5.
34. Řehák Z, Szturz P. Comment on: FDG PET in the early diagnosis of large-vessel vasculitis. Eur J Nucl Med Mol Imaging 2014; 41(3): 579–80.
35. Williams M, Jain S, Patil P, Dasgupta B. Contribution of Imaging in Polymyalgia Rheumatica. Joint Bone Spine 2013; 80(2): 228-9.
36. Salvarani C, Barozzi L, Pipitone N, Bajocchi GL, Macchioni PL, Catanoso M, et al. Lumbar interspinous bursitis in active polymyalgia rheumatica. Clinical and Experimental Rheumatology 2013; 31(4): 526–31.
37. Lensen KDF, van Sijl AM, Voskuyl AE, van der Laken CJ, Heymans MW, Comans EFI, et al. Variability in quantitative analysis of atherosclerotic plaque inflammation using 18F-FDG PET/CT. PLoS One. 2017; 12(8): e0181847.
38. Rehak Z, Sprlakova-Pukova A, Bortlicek Z, Fojtik Z, Kazda T,Joukal M, et al. PET/CT imaging in polymyalgia rheumatica: praepubic 18F-FDG uptake correlates with pectineus and adductor longus muscles enthesitis and with tenosynovitis. Radiol Oncol 2017; 51(1): 8–14.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 3-
All articles in this issue
- Možnosti diagnostiky revmatické polymyalgie a obrovskobuněčné arteritidy pomocí FDG PET a PET/CT zobrazení – dvanáctileté zkušenosti jednoho diagnostického centra
- Inhibitory Janusových kináz v terapii revmatoidní artritidy
- Utlumení chronického zánětu cvičením nebo úpravou střevní mikrobioty jako kauzální opatření při involuční osteoporóze
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inhibitory Janusových kináz v terapii revmatoidní artritidy
- Možnosti diagnostiky revmatické polymyalgie a obrovskobuněčné arteritidy pomocí FDG PET a PET/CT zobrazení – dvanáctileté zkušenosti jednoho diagnostického centra
- Utlumení chronického zánětu cvičením nebo úpravou střevní mikrobioty jako kauzální opatření při involuční osteoporóze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

