-
Medical journals
- Career
Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
Authors: K. Pavelka; K. Hejduk; H. Mann
Authors‘ workplace: Revmatologický ústav a Klinika revmatologie 1. LF UK
Published in: Čes. Revmatol., 21, 2013, No. 3, p. 132-139.
Category: Original Papers
Overview
Tocilizumab je monoklonální protilátka proti IL-6R, která je registrována pro léčbu středně a vysoce aktivní revmatoidní artritidy v prvé i druhé linii biologické léčby. Tocilizumab byl registrován na základě řady randomizovaných studií fáze III klinického zkoušení. Další cenná data se získávají z registrů biologické léčby. Jeden z faktorů, který je diskutovaný, je také otázka prediktivních faktorů účinnosti tocilizumabu.
Metodologie:
Byla provedena observační studie účinnosti tocilizumabu (TCZ) v běžné klinické praxi. Pacienti zařazení do studie splňovali kritéria České revmatologické společnosti pro aplikaci biologické léčby a byli zavedeni do národního registru ATTRA. Ve studii byly sledovány následující ukazatele: demografická charakteristika pacienta, předcházející a současná léčba, přítomnost RF a anti-CCP protilátek (ACPA), DAS 28, sérová hladina C-reaktivního proteinu (CRP), sedimentace erytrocytů (FW), terapeutická odpověď dle EULAR, dosažení nízké aktivity choroby (low disease activity – LDA) po 6 a 12 měsících (DAS 28 < 3,2), dosažení remise (DAS 28 < 2,6). Byly vyhodnoceny faktory predikující před zahájením léčby dosažení stavu nízké aktivity po 6 a 12 měsících.Statistické metody:
V prvním kroku byla provedena jednorozměrná logistická regrese hodnotící vliv všech faktorů k dosažení LDA. Pro hlavní faktory byla provedena ROC analýza za účelem identifikace mezní hodnoty, která daný faktor dělí nejlépe ve smyslu predikce dosažení LDA.Výsledky:
Do registru bylo zařazeno 151 pacientů, jejichž výsledky byly zhodnoceny z hlediska bezpečnosti. Pro zhodnocení účinnosti léčby byly použity údaje 113 pacientů, kteří měli nově nasazen TCZ na začátku sledování. U zbývajících 38 pacientů nebyla účinnost hodnocena, protože šlo o pacienty, kteří pokračovali v léčbě v registru po ukončení klinických studií. Do sledování byli zařazeni pacienti s pokročilou chorobou s průměrným trváním 11 let a s vysokou aktivitou (DAS 28 5,9; průměrná hodnota CRP 24,1 mg/l). Celé šestiměsíční sledování dokončilo 88 % pacientů současně léčených chorobu modifikujícími léky (DMARDs) a 85 % pacientů na monoterapii TCZ. Terapeutické odpovědi dle EULAR dosáhlo za 6 měsíců 88–89 % pacientů. Po 12 měsících léčby docílilo nízké aktivity onemocnění 67 % pacientů a v remisi bylo 48 % pacientů. Nebyly shledány žádné rozdíly v dosažení LDA a remise mezi skupinou na monoterapii nebo na kombinaci TCZ + DMARDs. Jediný signifikantní prediktivní ukazatel dosažení nízké aktivity onemocnění (LDA) po 12 měsících léčby byl počet oteklých kloubů. Výskyt nežádoucích účinků byl stejný mezi skupinou léčenou monoterapií a kombinací TCZ + DMARDs.Závěr:
Výsledky naší studie ukazují dobrou účinnost TCZ u pacientů s revmatoidní artritidou v běžné klinické praxi. V účinnosti ani bezpečnosti nebyl prokázán rozdíl mezi nemocnými léčenými monoterapií nebo kombinací s DMARD. Jediným prediktivním ukazatelem odpovědi léčby TCZ byl počet oteklých kloubů.Klíčová slova:
Revmatoidní artritida, biologická léčby, predikce odpovědi, tocilizumabÚvod
Interleukin 6 (IL-6) je důležitý cytokin, který má výrazné prozánětlivé funkce v organismu. Je účasten na diferenciaci a růstu mnoha buněk, stimuluje syntézu reaktantů akutní fáze v játrech, je zodpovědný za systémové projevy revmatoidní artritidy a přímo aktivuje osteoklasty k resorpci kosti (1). Váže se na svůj receptor (IL-6R), který se sestává z části, která váže cytokin (IL-6Rα), a druhé části (gp = 130), která přenáší signály do buňky.
Tocilizumab (TCZ) je humanizovaná protilátka proti IL-6R, která váže selektivně a kompetitivně solubilní i membránově vázaný receptor pro IL-6. Jde v současné době o jediný registrovaný preparát s tímto mechanismem účinku. Tocilizumab byl nejprve zkoušen na experimentálních modelech artritidy a dále pak v rozsáhlém programu klinického zkoušení fází I-III, přičemž pro registraci byly zásadní především velké, randomizované studie fáze III. Tocilizumab byl zkoušen u širokého spektra pacientů s revmatoidní artritidou (RA), a to jak v kombinaci s MTX (a dalšími DMARD), tak v monoterapii. V klinickém hodnocení OPTION byl TCZ aplikován u nemocných se selhávajícím MTX (2) a v klinickém hodnocení TOWARD pak se selhávajícími DMARD včetně MTX (3). V klinickém hodnocení RADIATE byl TCZ aplikován nemocným se selháním nejméně jednoho anti-TNF (4). Naopak do klinického hodnocení AMBITION byli zařazeni nemocní, kteří byli naivní na léčbu MTX nebo dostávali MTX v minulosti s dobrým efektem (5). V tomto klinickém hodnocení byl zkoušen TCZ v monoterapii oproti monoterapii MTX. AMBITION je první studie, která prokázala u této subpopulace nemocných s RA větší účinnost monoterapie biologickým lékem oproti léčbě MTX. V klinickém hodnocení LITHE byla prokázána schopnost TCZ zpomalovat rentgenovou progresi RA (6). V klinickém hodnocení ADACTA, prvním přímém srovnání monoterapie dvěma různými biologiky, byl TCZ v monoterapii účinnější než anti-TNF preparát adalimumab (12). Důležitou informaci, která doplňuje poznatky z randomizovaných, dvojslepých studií, poskytují i registry biologické léčby. Potvrdily dobrý bezpečnostní profil TCZ a prokázaly i rychlou a mohutnou účinnost v podmínkách běžné klinické praxe (7).
Biologická léčba je jednoznačně nejúčinnější alternativou léčby RA, je však relativně nákladná. Bylo by tedy velmi výhodné podávat tuto léčbu pacientům, u kterých je větší pravděpodobnost úspěchu léčby, jinými slovy znát prediktivní faktory odpovědi na léčbu.
Cílem naší studie bylo jednak vyhodnotit účinnost a bezpečnost TCZ u pacientů v běžné klinické praxi národního registru, jednak se pokusit vyhodnotit prediktivní faktory terapeutické odpovědi.
Metodologie
Jednalo se o otevřenou, dlouhodobou observační studii pacientů zařazených do celonárodního registru ATTRA.
Pacienti: Biologickou léčbu může dostat v ČR pacient, který splňuje indikační kritéria České revmatologické společnosti (8). Ve stručnosti: pacientovi musí selhat léčba alespoň jedním DMARD, kterým by měl být přednostně methotrexát, v dávce minimálně 25 mg týdně (pokud je tolerován) a dále aktivita onemocnění podle DAS 28 musí být vyšší než 3,9. TCZ je podáván většinou jako biologický lék 2. volby (po selhání jednoho anti-TNF), ale může být podáván i jako biologický lék první volby. Zvláště je doporučován jako první lék u nemocných, kteří netolerují žádné DMARD a biologický lék dostávají v monoterapii.
Lék TCZ byl podáván v dávce 8 mg/kg v intravenózní infuzi každé 4 týdny. V případě navození stavu remise (DAS 28 méně než 2,6) bylo možné snížit dávku na 4 mg/kg/ á 4 týdny. Lék byl podáván pouze v centrech biologické léčby a každý pacient byl zařazen do celonárodního registru ATTRA. TCZ mohl být přidán k již aplikovanému DMARD, nebo podáván jako monoterapie. Toto rozhodnutí bylo zcela na ošetřujícím lékaři a nebylo upraveno žádným protokolem.
U všech pacientů byl před zahájením léčby TCZ proveden screening latentní tuberkulózy dle doporučení České revmatologické společnosti.
Sledované ukazatele: Kromě demografických údajů byly u pacientů sledovány následující ukazatele: délka trvání onemocnění, předcházející léčba DMARD, biologickými léky, glukokortikoidy a výsledky této léčby (selhání, nežádoucí účinky), DAS 28, CRP mg/l, FW, odpověď dle EULAR, dosažení nízké aktivity (LDA/DAS 28 < 3,2) dosažení remise (DAS 28 < 2,6). Na základě těchto údajů byly zjišťovány prediktivní faktory dosažení LDA po 6 a 12 měsících.
Statistické metody: V prvním kroku byla provedena jednorozměrná logistická regrese hodnotící vliv všech uvažovaných faktorů na dosažení LDA. Pro jednotlivé faktory byly vypočítány poměry šancí (odds ratio, OR) a statistická významnost (p-hodnota). Pro hlavní faktory byla provedena ROC analýza za účelem identifikace mezní hodnoty, která daný faktor dělí nejlépe ve smyslu dosažení LDA. Hlavní faktory byly dále analyzovány v rámci vícerozáměrového logistického modelu. Kvalita modelu je popsána pomocí senzitivity, specificity, pozitivní prediktivní hodnoty a negativní prediktivní hodnoty.
Výsledky
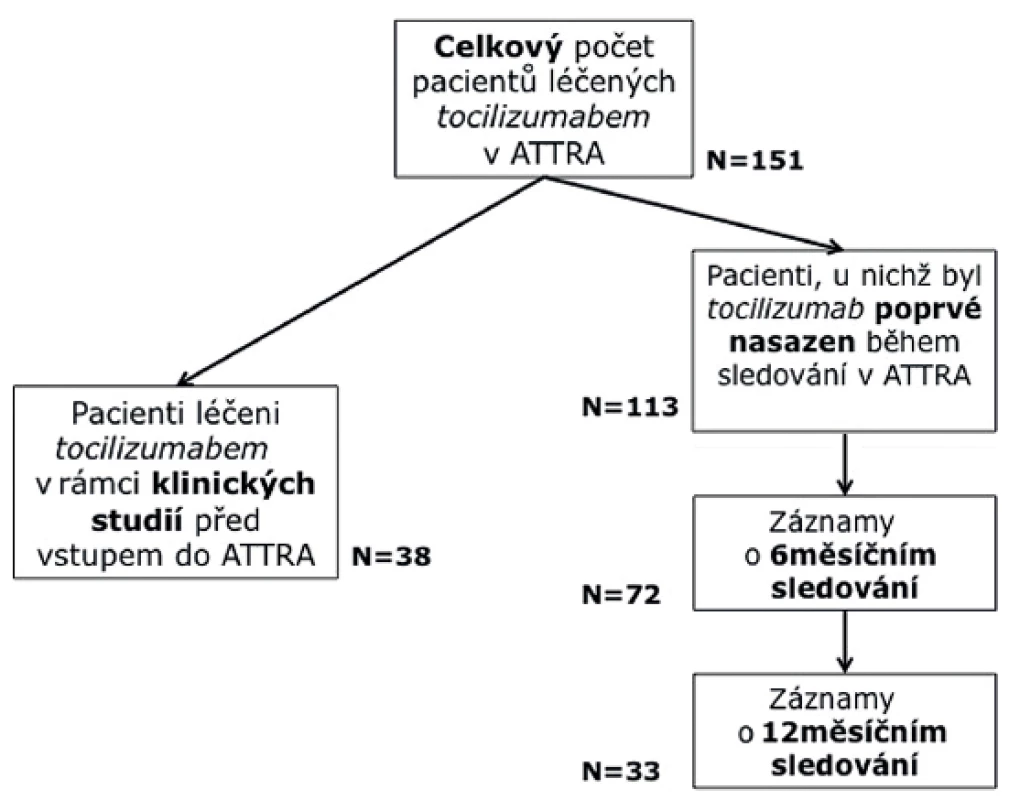
Do studie bylo zařazeno celkem 151 pacientů (obr. 1). 113 z nich bylo nově zařazeno do léčby z důvodů vysoké aktivity RA, 38 pacientů bylo zařazeno po ukončení lékové studie s tocilizumabem, přičemž interval od ukončení studie nebyl delší než 2 měsíce. Tyto dvě skupiny pacientů se liší statisticky ve všech parametrech aktivity (tab. 1). Pro účely určení účinnosti a prediktivních faktorů byly využity pouze nemocní s nově nasazeným TCZ. Celá skupina pak byla použita pro hodnocení ukazatelů bezpečnosti.
Table 1. Charakteristika pacientů ve studii 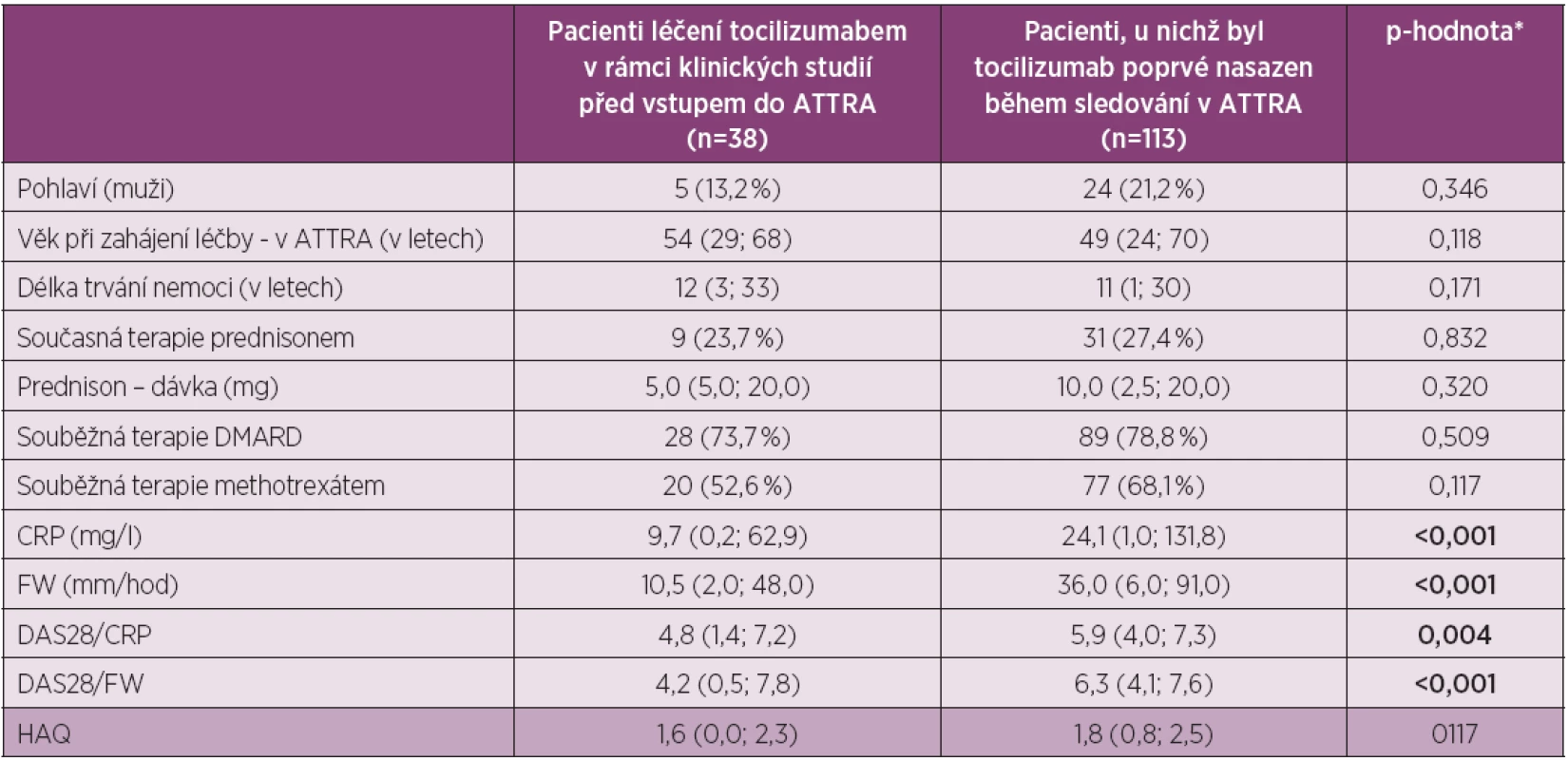
* Pro spojité proměnné je uveden medián (5%; 95% percentil) a p-hodnota odpovídá významnosti Mann-Whitney U testu; pro kategoriální proměnné jsou uvedeny jejich absolutní (relativní) četnosti a p-hodnota významnosti Fisherova exaktního testu Do hodnocené skupiny (N = methotr 113) bylo zařazeno 24 mužů (21,2 %) a 89 žen (78,2 %), průměrný věk byl 49 let (24–70) a průměrné trvání nemoci 11 let (11–30). Léčbu TCZ v kombinaci s DMARD užívalo 78,8 %, v nichž dominoval methotrexát (68 %). Prednison užívalo současně 27 % pacientů. Průměrná hodnota DAS 28 (FW) na začátku léčby byla 6,3 (4,0–7,6), průměrná hodnota DAS 28 (CRP) pak 5,9 (4–7,3), průměrná hodnota CRP byla 24,1 mg/l (1–131,8) a průměrná hodnota FW pak 36 mm/hod (6–91). Všechny tyto ukazatele svědčí o vysoké aktivitě onemocnění. Průměrná hodnota HAQ na začátku léčby byla 1,8 (0,8 – 2,5), což odpovídá významnému funkčnímu postižení.
Po 6 měsících setrvávalo na léčbě TCZ 88 % léčených v kombinaci s DMARD a 85 % pacientů na monoterapii. Po 12 měsících setrvávalo na léčbě 75 % pacientů léčených kombinací s DMARD a 85 % na monoterapii TCZ. U 38 pacientů, kteří ukončili léčbu, byla nejčastější příčinou neúčinnost (32 %), nežádoucí účinky (21,4 %), přání pacienta (14 %), remise onemocnění (4 %), jiný důvod ukončení (21,4 %). Ve sledované skupině došlo k jednomu úmrtí, které dle názoru ošetřujícího lékaře nesouviselo s léčbou (obr. 2).
Image 2. Setrvání na léčbě tocilizumabem* * K odhadu setrvání pacientů na léčbě byla použita metoda analýzy přežití dle Kaplana-Meiera. 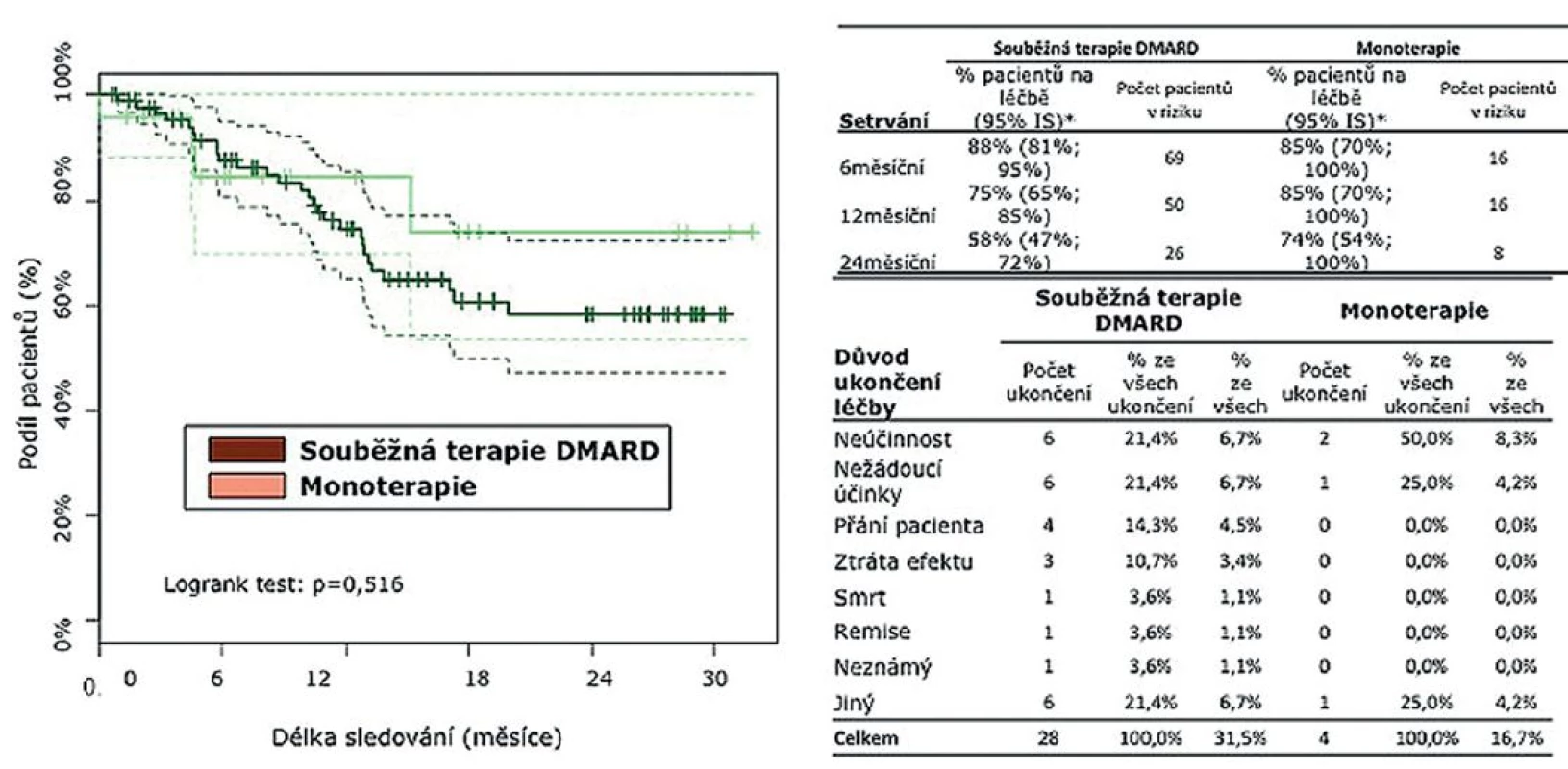
Terapeutické odpovědi dle EULAR (pokles DAS 28 o více než 1,2) dosáhlo za 6 měsíců 89 % a za 12 měsíců 88 % pacientů (obr. 3). Nízké aktivity onemocnění (LDA – DAS 28 < 3,2) docílilo za 6 měsíců 53 % a za 12 měsíců 67 % pacientů. V remisi (DAS 28 < 2,6) bylo po 6 měsících léčby 53 % nemocných a po 12 měsících 48 % nemocných.
Image 3. Aktivita onemocnění během 12 měsíců 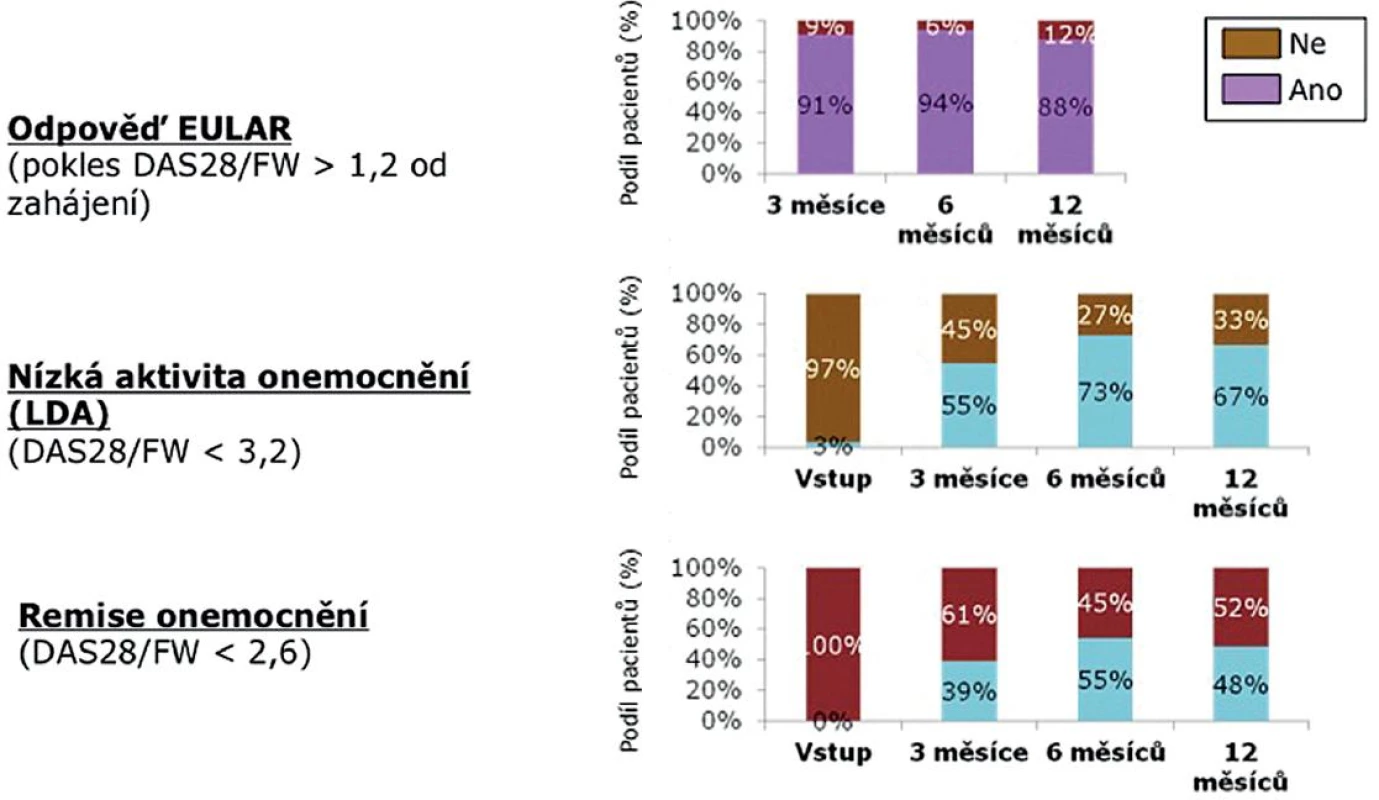
Dále jsme porovnali skupinu nemocných léčených současně TCZ s DMARD (N = 89) a skupinu léčenou monoterapií TCZ (24). Statisticky se obě skupiny nelišily, i když numericky byli pacienti na monoterapii starší (medián 59 vs. 47 let) a měli nižší CRP (medián 14,5 vs. 27,5 mg/l) (tab. 2). Rovněž medián počtu předcházejících DMARD (3) a předcházejících biologik (1) byl identický. V účinnosti nebyl shledán žádný signifikantní rozdíl mezi monoterapií a kombinovanou léčbou, přičemž odpovědi dle EULAR po 6 měsících dosáhlo 91 % nemocných na monoterapii a 89 % pacientů léčených kombinovanou léčbou. Stav nízké aktivity (LDA) byl dosažen u 73 % pacientů na monoterapii a 62 % nemocných ve skupině léčené kombinací (p = 0,73). Remise onemocnění dosáhlo 73 % pacientů na monoterapii a 49 % pacientů léčených kombinací s DMARD (p = 0,19) (obr. 4).
Image 4. Aktivita onemocnění během 6 měsíců 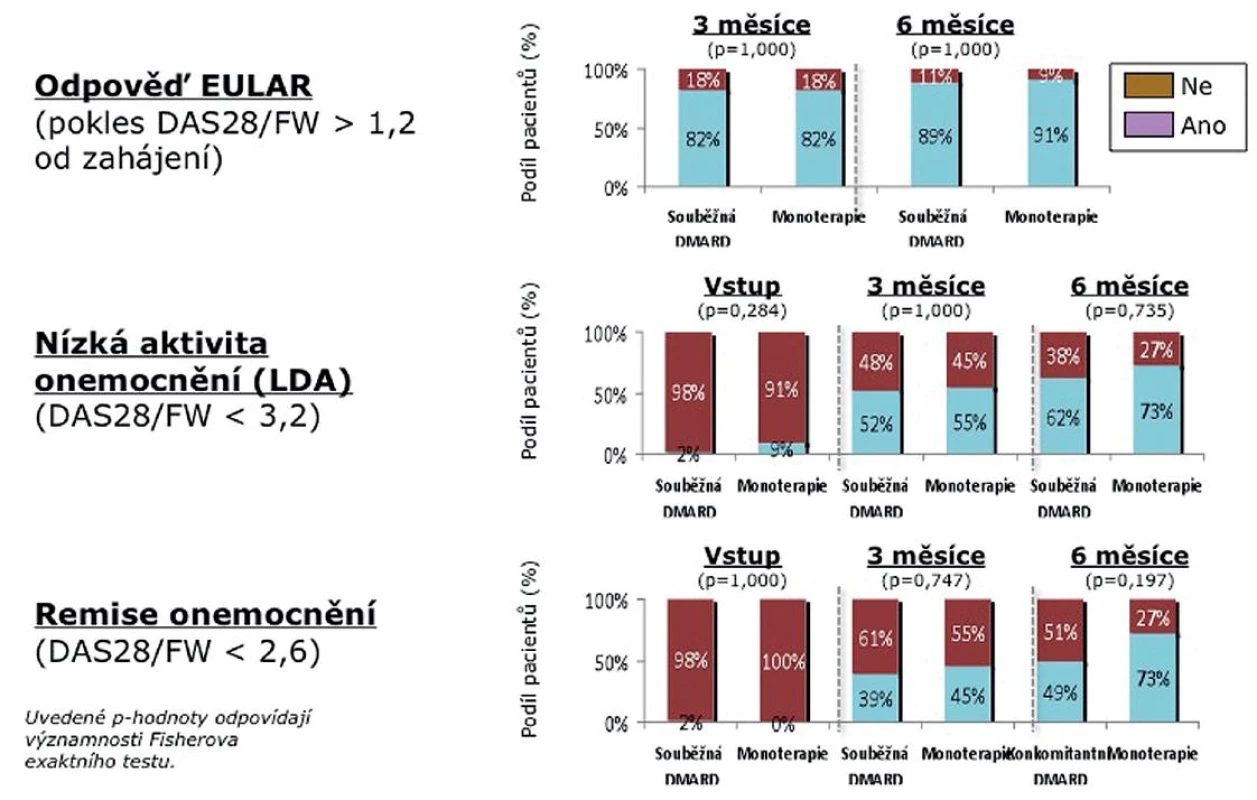
Nejvýznamnějším prediktivním ukazatelem dosažení nízké aktivity onemocnění po 6 či 12 měsících léčby se ukázal být počet oteklých kloubů při zahájení léčby. Při počtu 10 a více oteklých kloubů byla signifikantně snížena pravděpodobnost dosažení stavu nízké aktivity (LDA) (OR = 0,06; 0,01–0,32), (p < 0,001). Pozitivní prediktivní hodnota tohoto modelu byla 80,9 % a negativní prediktivní hodnota 93,8 %. Uvedené více rozměrové modely však popisují především vztah v rámci použitých dat a z důvodu malého počtu pacientů a absence použití validizačních technik je nelze uvažovat jako zobecnitelné predikční modely (obr. 5).
Image 5. Prediktivní faktory dosažení LDA* po 12 měsících * Dosažení nízké aktivity onemocnění (LDA – „low disease activity“) je definováno jako aktuální DAS28 < 3,2. 
Hodnocení výskytu nežádoucích účinků bylo ovlivněno malým počtem pacientů ve skupině na monoterapii. Celková expozice byla 104,8 paciento-roků ve skupině kombinované léčby a 21,7 paciento-roků ve skupině na monoterapii. Výskyt závažných NÚ ve skupině kombinační byl 6,7 % a ve skupině na monoterapii TCZ pak 0 %. Výskyt nezávažných NÚ byl 29,2 % ve skupině kombinované léčby a 20,8 % ve skupině léčené monoterapií. Mezi závažnými NÚ byly: 1 závažná infuzní rekace, 1 kardiovaskulární příhoda, 1 gastrointestinální reakce, 1 CNS projevy a dva jiné. Mezi nezávažnými NÚ dominovaly infekce (9,5 na 1 000 paciento-roků) (obr. 5).
Diskuse
Observační studie z národního registru ATTRA prokázala dobrou klinickou účinnost TCZ v běžné klinické praxi. Odpovědi EULAR dosáhlo po 6 a 12 měsících u 90 % pacientů, stavu nízké aktivity pak kolem 65 % pacientů a remise kolem 50 % pacientů. Tyto výsledky zhruba odpovídají výsledkům např. klinického hodnocení ACT - Sure, což je mezinárodní, multicentrická studie podobného typu fáze III B (7).
Biologická léčba RA může být podávána v kombinaci s MTX či jinými DMARD s výjimkou infliximabu a golimumabu, které musí být podávány v kombinaci s MTX. V klinickém hodnocení (PREMIER) (9) s adalimumabem se však ukázala kombinace anti TNF s MTX významně účinnější než monoterapie anti-TNF a od té doby je doporučována biologická léčba pokud možno v kombinaci s MTX nebo v případě jeho nesnášenlivosti s jiným DMARD. Nicméně v běžné klinické praxi se ukazuje, že 20–30 % pacientů nesnáší žádné DMARD a že jedinou možností je pro ně léčba monoterapií biologickým lékem. Tocilizumab je prvním biologickým lékem, u kterého byla prokázána větší účinnost v monoterapii ve srovnání s MTX (5) nebo jinými DMARD (10). Dále bylo prokázáno, že TCZ v kombinaci s MTX není významně účinnější než monoterapie TCZ (Studie ACT-RAY) (11). Recentně dokončená studie ADACTA pak ukázala větší účinnost TCZ v monoterapii oproti monoterapii adalimumabem. Naše výsledky tedy plně odpovídají zkušenostem z těchto zásadních studií (12).
Z výše uvedených poznatků vyplývá, že nejlepší data o účinnosti monoterapie má TCZ, který by měl být proto u nemocných indikovaných k monoterapii biologiky lékem první volby. Jak tedy postupovat u pacienta, který je na zavedené dávce MTX, kterou toleruje, ale nemá dostatečný efekt? Přidat TCZ k MTX nebo MTX vysadit a zahájit monoterapii TCZ? Výsledky studie ACT-RAY by podporovaly druhou alternativu. Nicméně se domníváme, že by toto rozhodnutí o pokračování či nepokračování v léčbě MTX (DMARD) mělo být individuální u každého pacienta. Je nutné vyčkat také dalších studií s delším trváním a s designem, který přinese na tuto specifickou otázku jasnou odpověď. Na základě vlastních dlouhodobých zkušeností a v souladu s SPC zatím spíše přidáváme TCZ k zavedené léčbě MTX, než bychom MTX vysazovali. Tolerance léčby a riziko přerušení léčby je dle provedených sledování obdobné při léčbě monoterapií TCZ nebo kombinací s MTX, event. jinými DMARD.
Biologická léčba je bezpochyby velmi účinná, ale je také drahá. Úkolem prediktivních modelů je identifikovat pacienty, kteří mají potenciálně nejhorší prognózu a kteří mohou z biologické léčby profitovat nejvíce. Prediktivní studie se snaží hledat jednak prediktivní faktory strukturální progrese, prediktivní faktory funkční progrese a dále prediktivní faktory odpovědi na léčbu a event. přerušení léčby (13). Někdy se také hovoří o tzv. personalizované medicíně, která bude získávat na důležitosti s tím, jak přibývají nové biologické léky. Velmi perspektivní je i hledání nových biomarkerů, které by mohly sloužit pro predikci odpovědi na léčbu. Biomarkery lze rozdělit do několika skupin: klinometrické, cytometrické, metabolické, genomické a proteomické (14). Byly provedeny stovky studií, které však zatím nepřinesly jednoznačný výsledek. Autoimunitní onemocnění a jeho léčba představují multifaktoriální děj a lze předpokládat, že i budoucí funkční biomarkery budou multifaktoriální. Na druhé straně je jasné, že příliš složité vyšetřování nemůže být nikdy proveditelné v běžné klinické praxi (15). Je tedy pravděpodobné, že v současné době se budou používat pro predikci odpovědi na biologickou léčbu i nadále především demografické a klinické ukazatele, reaktanty akutní fáze, autoprotilátky (revmatoidní faktory a ACPA protilátky), navíc pak některé ukazatele morfologické (rentgenové poškození, MRI). Hladiny cytokinu TNFα v séru nejsou schopné predikovat odpověď na anti-TNF léčbu (14). Pozitivita revmatoidních faktorů a ACPA protilátek zvyšuje pravděpodobnost odpovědi na rituximab, nikoliv však na anti-TNF léčbu (16). Studie z velkých randomizovaných studií a z registrů biologické léčby nedávají konzistentní výsledky. Např. v dánském registru DANBIO byly negativními prediktory odpovědi na anti-TNF léčbu vyšší věk, horší funkční stav na začátku léčby a současné používání prednisonu. Žádný prediktivní význam nemělo mužské pohlaví, trvání nemoci, současná léčba MTX a počet předchozích DMARD (17). Velice zajímavý se zdá koncept, že odpověď na anti-TNF léčbu po 12 týdnech léčby predikuje odpověď na léčbu po 1 roce léčby, jak bylo prokázáno ve studiích s certolizumabem (18).
Zatím není mnoho dat o predikci odpovědi na léčbu tocilizumabem v běžné klinické praxi. Naše pilotní studie ukázala, že jediným prediktivním faktorem odpovědi na léčbu v naší skupině, byl počet oteklých kloubů. Tím více se do popředí dostává otázka jak optimálně hodnotit oteklé klouby, zda subjektivní klinické hodnocení nedoplnit objektivnější a senzitivnější metodou, jako je např. ultrazvukové vyšetření kloubů.
Limitací našich výsledků je počet hodnocených pacientů, který je dán množstvím pacientů hrazených zdravotními pojišťovnami a zařazených do souboru.
Tato práce byla podpořena projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Adresa pro korespondenci:
MUDr. K. Pavelka
Revmatologický ústav a Revmatologická klinika 1. LF UK v Praze
Na Slupi 4
128 50 Praha 2
Sources
1. Redlich K, Smolen JS, et al. Inflammatory bone loss: pathogenetic and therapeutic intervention. Nat Rev Drug Discov 2012;11 : 234-250.
2. Smolen J, Beaulieu A, Rubbert-Roth A, et al. Effect of interleukin-6 inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double blind, placebo-controlled, randomised study. Lancet 2008;371 : 987-97.
3. Genovese M, McKay JD, Nasonov E, et al. Interleukin - 6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to DMARD. Arthritis Rheum 2008;58 : 2968-2980.
4. Emery P, Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti. tumour necrosis factor biologicals: results from a 24 week multicentre, randomised placebo controlled study. Ann Rheum Dis 2008;67(11):1516-23.
5. Jones G, Sebba A, Gu J, et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patients with moderate to severe rheumatoid arthritis. Ann Rheum Dis 2010;69(1):88-96.
6. Kremer JM, Blanco R, Brzosko M, et al. Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with inadequate responses to methotrexate: results from the double-blind treatment phase of a randomized placebo-controlled trial of tocilizumab safety and prevention of structural joint damage at one year. Arthritis Rheum 2011;63(3):609-21.
7. Bykerk VP, Ostor AJ, Alvaro-Gracia J, Pavelka K, et al. Tocilizumab in patients with active rheumatoid arthritis and inadequate responses do DMARDs / or TNF inhibitors: a large, open label, study close to clinical practise. Ann Rheum Dis 2012 in print.
8. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Čes Revmatol 2012;20 : 182-112.
9. Vencovský J. Bezpečnost biologické léčby – Doporučení České revmatologické společnosti. Čes Revmatol 2009;17 : 146-160.
10. Nishimoto N, Miysaka N, Yamamoto K, et al. Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endothelial growth factor by IL-6 receptor inhibition therapy. Mod Rheumatol 2009;19 : 12-19.
11. Dougados M, Kissel K, Sheeran T, et al. Adding tocilizumab or switching to tocilizumab monotherapy in MTX inadequate responders: 24 - week symptomatic and structural results of a 2 year randomized, controlled strategy trial in RA (ACT-RAY). Ann Rheum Dis 2013;72(1):43-50.
12. Gabay C, Emery P, Vollenhoven R, et al. Tocilizumab monotherapy is superior to adalimumab monotherapy in reducing disease activity in patients with RA: 24 week data from the phase IV. study ADACTA trial. Abstract. Ann Rheum Dis 2012;71(Suppl.3):152.
13. Conaghan PC. Predicting outcomes in rheumatoid arthritis. Clinical Rheumatol 2011;30(Suppl.1):41-47.
14. Marotte H, Miossec P. Biomarkers for prediction of TNF alpha blockers response in rheumatoid arthritis. Joint Bone Spine 2010;77 : 297-305.
15. Ortea I, Roschitzki B, Ovalles JG, et al. Discovery of serum proteomic biomarkers for prediction of response to infliximab (a monoclonal anti-TNF antibody) treatment in rheumatoid arthritis. An exploratory analysis. J Proteomics 2012;77 : 372-82.
16. Klaasen R, Cantaert T, Wijbrandts CA, et al. The value of rheumatoid factor and anti-citrullinated protein antibodies as predictors of response to infliximab in rheumatoid arthritis: an exploratory study. Rheumatology 2011;50 : 1487-1493.
17. Sokka T, Hetland ML, Mäkinen H, et al. Remission and Rheumatoid Arthritis. Data on Patients Receiving usual Care in Twenty-Four Countries. Arthritis Rheum 2008;9 : 2642-51.
18. Curtis J, Luijtens K, Kavanaugh A. Predicting future response to certolizumab pegol in rheumatoid arthritis patients: features at 12 weeks associated with low disease activity at 1 year. Arthritis Care Res 2012;64 : 658-67.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2013 Issue 3-
All articles in this issue
- Doporučení ČRS pro léčbu nemocných se SLE
- Zdravím podmíněná kvalita života u pacientů s revmatoidní artritidou v průběhu prvního roku anti-TNF léčby (hodnocení dotazníkem SF-36 a srovnání se vzorkem všeobecné populace České republiky) – výsledky z registru biologické léčby ATTRA
- Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Doporučení ČRS pro léčbu nemocných se SLE
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
- Zdravím podmíněná kvalita života u pacientů s revmatoidní artritidou v průběhu prvního roku anti-TNF léčby (hodnocení dotazníkem SF-36 a srovnání se vzorkem všeobecné populace České republiky) – výsledky z registru biologické léčby ATTRA
- Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career