-
Medical journals
- Career
Abatacept a jeho použití v České republice v léčbě RA – údaje z registru ATTRA
: P. Horák 1; M. Skácelová 1; K. Hejduk 2; K. Pavelka 3
: III. interní klinika – nefrologická, revmatologická, endokrinologická, Lékařská fakulta Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc, 2Institut biostatistiky a analýz, Masarykova univerzita v Brně, 3Revmatologický ústav Praha, 1. Lékařská 1
: Čes. Revmatol., 20, 2012, No. 4, p. 163-169.
: Original Papers
Český národní registr ATTRA soustřeďuje údaje o biologické léčbě pacientů s revmatoidní, psoriatickou a juvenilní idiopatickou artritidou a ankylozující spondylartritidou. Sbírá údaje o účinnosti a bezpečnosti léčby a soustředí se také na sledování ukazatelů kvality života. Abatacept má v současné době pozici biologického léku RA druhé linie, který se nasazuje po selhání TNFα inhibitorů. Do hodnocení byly zařazeny záznamy 162 pacientů, jejich průměrný věk byl 51,0 ± 12,2 let, věkový medián 53,1 let (19–74 let). Průměrná délka trvání onemocnění RA byla 14 ± 9,1 let, medián 11,3 (0–41 let). V souboru bylo 130 žen (80,2 %). Vstupní skóre DAS28 bylo v týdnu 0 (T0) 5,9 ± 1,1, v T16 4,1 ± 1,4, v T24 3,8 ± 1,2, v T36 3,6 ± 1,3 a v T 52 3,5 ± 1,2. V týdnu 0 byla přítomna remise dle DAS28 skóre v 0,6 % případů, v týdnu T16 z 15,8 %, v týdnu T24 v 10 % v týdnu 36 v 20,9 % a v týdnu T 52 v 20,8 % registrovaných a hodnocených pacientů. Pokud měli pacienti hodnotu DAS28 < 2,6 (remise) v T16, v T52 měli hodnotu DAS28 < 2,6 v 58,3 %. Pacienti s hodnotami DAS28 >5,1 (vysoká aktivita choroby) v T16 měli hodnoty DAS28 > 5,1 v T52 v 41,7 % případů. Perzistence na léčbě činila po jednom roce 82 %. Celkem bylo hlášeno 50 nezávažných nežádoucích účinků u 36 pacientů (22 % registrovaných pacientů) a 11 závažných nežádoucích účinků u 10 pacientů (6 % pacientů). Nejčastějšími nezávažnými nežádoucí účinky byly infekce (31) a kožní projevy (5), byla hlášena pouze 1 nezávažná alergická reakce. Data z registru potvrzují dobrou účinnost i bezpečnost abataceptu u pacientů s RA s velmi dobrou perzistencí na léčbě.
Klíčová slova:
revmatoidní artritida, registry, abataceptÚvod
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění, které postihuje přibližně 0,5 % dospělé populace v naší zemi. Jedná se o onemocnění charakterizované polyartikulárními kloubními záněty, prolongovanou ranní ztuhlostí, rozvojem kloubních deformit, poruchou až ztrátou funkce pohybového aparátu a často také ztrátou práceschopnosti a soběstačnosti. Onemocnění je charakterizované také řadou závažných mimokloubních projevů zahrnujících široké spektrum postižení kardiovaskulárního, plicního, kožního či nervového systému.
Abatacept je biologický lék interagující s kostimulačním systémem při aktivaci T lymfocytů. Aktivace vyžaduje dva signály – jednak prezentaci antigenu prostřednictvím antigenů MHC II. třídy (hlavní histokompatibilní systém II) antigen prezentujícími buňkami T lymfocytům disponujícím TCR (T buněčný receptor), jednak vazbu tzv. kostimulačních molekul, které poskytnou „druhý signál“. Existují dva hlavní kostimulační systémy, první je tvořený molekulami CD28 a CD80/ CD86, druhý CD40 a ligandem CD40 (CD40L). Kostimulační systémy jsou regulovány rovněž negativní zpětnou vazbou, kterou v případě CD28-CD80/86 představuje molekula CTLA4 (cytotoxic T lymphocyte associated antigen). CTLA4 vazbou na molekulu CD80/86 druhý signál blokuje a tím tlumí aktivaci T buněk (1). Abatacept je solubilní fuzní protein kombinující Fc fragment IgG1 a CTLA4 bránící vazbě CD28 k molekule CD80/CD86 (2).
Abatacept je v současné době v České republice předepisován revmatology v centrech biologické léčby při selhání TNFalfa inhibitorů či dalších biologických léků v léčbě revmatoidní artritidy. Aplikuje se formou 30minutové intravenózní infuze. Po prvním podání se abatacept podává dále po 2 a 4 týdnech od první infuze a poté vždy po 4 týdnech. U nemocných s hmotnosti do 60 kg se podává intravenózně 500 mg, s hmotností mezi 60–100 kg 750 mg, nad 100 kg pak 1000 mg abataceptu. Na českém trhu se objevil v roce 2008.
Projekt ATTRA zastřešuje řadu klinických registrů, které jsou od roku 2001 vedeny pod odbornou garancí České revmatologické společnosti (3). Jedná se o multicentrický systém pro hodnocení průběhu a výsledků biologické léčby zánětlivých revmatických onemocnění. Na projektu spolupracuje řada revmatologických pracovišť. Registrace dat má centrální úložiště a metodické vedení, které umožňuje analýzu účinnosti a i bezpečnosti nasazovaných biologik. ATTRA zahrnuje registry jednotlivých biologických léků užívaných v léčbě revmatoidní artritidy, psoriatické artritidy, ankylozující spondylitidy a juvenilní idiopatické artritidy. Všechna práva pacientů jsou plně zachována a centrální sběr dat probíhá anonymně, tedy bez osobních údajů a po podpisu informovaného souhlasu. Prezentovaná práce vyhodnocuje údaje z registru ATTRA týkající se užití abataceptu.
Metodika
Metoda: Jedná se o observační, otevřenou, dlouhodobou studii u pacientů z registru ATTRA.
Skupina pacientů: Do hodnocení byly zařazeny záznamy 162 pacientů, jejich průměrný věk byl 51,0 ± 12,2 rok, věkový medián 53,1 let (19–74 let). Průměrná délka trvání onemocnění RA byla 14 ± 9,1 let, medián 11,3 (0–41 let). V souboru bylo 130 žen (80,2 %).
Sledované ukazatele: V rámci statistického hodnocení byl sledován vývoj skóre DAS28 - Disease activity score 28 (4) a hodnocení efektu terapie lékařem i pacientem. Za vysokou aktivitu (HDA) bylo považováno skóre DAS28>5,1, za střední aktivitu (MDA) DAS 28 v rozmezí 3,2 až 5,1, za nízkou aktivitu (LDA) hodnoty skóre 2,6–3,2 a za remisi choroby hodnoty pod 2,6 (5, 6). Pomocí dotazníků EuroQol, SF36 (7, 8) byla sledována kvalita života. HAQ (Health Assessment Questionair) byl použit pro hodnocení funkčního postižení (9). Byla sledována perzistence pacientů na léčbě, důvody předčasného ukončení terapie, biologická léčba používaná před i po nasazení abataceptu. V rámci sledování bezpečnosti terapie byl hodnocen výskyt závažných i nezávažných vedlejších účinků terapie.
Komedikace: U 132 (81,5 %) pacientů figurovaly v současné léčbě glukokortikoidy, údaj o současně užívaných chorobu modifikujících lécích byl přítomen u 128 pacientů (79,0 %), z toho u 99 nemocných (61,1 %) se jednalo o terapii methotrexátem.
Statistické zpracování: Výsledky byly zpracovány programem Statistica. StatSoft, Inc. (2011) STATISTICA (data analysis software system), version 10. Popisnou charakteristiku spojitých parametrů tvoří průměr, směrodatná odchylka (SD), medián, 95% interval spolehlivosti (95% IS) a rozsah hodnot (min-max). U kategoriálních parametrů je to potom absolutní a relativní četnost.
Časový průběh hodnot byl hodnocen z důvodu neparametrického rozložení dat využitím Friedmanovy ANOVY na hladině významnosti 5%.
Výsledky
Postup registrace: V roce 2008 bylo registrováno 38 pacientů, v roce 2009 a 2010 padesát tři respektive padesát čtyři pacienti a v roce 2011 17 pacientů (graf 1).
1. V roce 2008 bylo zaregistrováno celkem 38 pacientů, 54 v roce 2009 a 53 v roce 2010, v roce 2011 bylo registrováno 17 pacientů. Celkem bylo k 14. 9. 2011 zaregistrováno 162 pacientů. Celkem 33 pacientů (20,4%) bylo registrováno bez předchozí léčby v rámci registru ATTRA. 
Účinnost: Vstupní skóre DAS28 bylo v týdnu 0 (T0) 5,9 ± 1,1, v T16 4,1 ± 1,4, v T24 3,8 ± 1,2, v T36 3,6 ± 1,3 a v T 52 3,5 ± 1,2, jak ukazuje graf 2. V týdnu 0 byla přítomna remise dle DAS28 skóre v 0,6 % případů, v týdnu T16 v 15,8 %, v týdnu T24 v 10 %, v týdnu 36 v 20,9 % a v týdnu T 52 v 20,8 % registrovaných a hodnocených pacientů (graf 3). Z grafu 3 rovněž vyplývá, že hodnocení aktivity nemocných bylo v týdnu T52 dostupné u 79 nemocných.
2. V průběhu léčby docházelo k postupnému poklesu DAS28 skóre. Pokles mezi T0 a T16 byl statisticky významný (p < 0,001). 
3. Kategorie aktivity onemocnění byly stanoveny podle hodnoty DAS 28 skóre v příslušném týdnu: Remise = DAS28 < 2,6; LDA (low disease activity - nízká aktivita choroby) = DAS28 2,6-3,2; MDA (moderate isease activity - střední aktivita choroby) = DAS28 >3,2 – 5,1; HDA (hight disease activity - vysoká aktivita choroby) = DAS28 > 5,1. Nejvyšší zastoupení pacientů v remisi bylo v T36 a T52 (20,9%). 
V průběhu léčby došlo ke zlepšení kvality života. Nárůst v EuroQol skóre a pokles v HAQ skóre mezi T0 a T16 byl statisticky významný (p < 0,001) a přetrvával až do týdne 52, stejně jako pozitivní změny v indexu SF36, jako dokumentují grafy 4 a 5. V T52 byla účinnost léčby hodnocena lékařem a pacientem jako výborná v 15,5 % (respektive v 16,9 %), jako velmi dobrá v 40,8 % (46,5 %), dobrá v 35,2 % (19,6 %), zbytek hodnotil efekt léčby jako střední či mírný.
Graf 4, 5. V průběhu léčby dochází k výraznému zlepšení kvality života. Nárůst v EuroQol skóre a pokles v HAQ skóre mezi T0 a T16 byl statisticky významný (p < 0,001). Maximální hodnota EuroQol je 1,0 (nejlepší možný výsledek), maximální hodnota HAQ je 3,0 (nejhorší možný výsledek). 
Predikce účinnosti: Prediktivní vliv hodnot DAS28 v T16 na hodnoty DAS28 v týdnu T52 byl stanovený u 69 pacientů (42,6 % registrovaných pacientů) se známými údaji v obou týdnech. Pokud měli pacienti hodnotu DAS28 < 2,6 (remise) v T16, v T52 měli hodnotu DAS28 < 2,6 v 58,3 %. Pacienti s hodnotami DAS28 > 5,1 (HDA) v T16 měli hodnoty DAS28 >5,1 v T52 v 41,7 % případů (graf 6). Změna stavu onemocnění mezi T16 a T52 byla stanovená celkem u 45 pacientů (31 % registrovaných pacientů) se známými údaji v obou týdnech. Ke zlepšení stavu onemocnění v T52 oproti T16 došlo u 9 pacientů (20 %), stejný stav onemocnění v obou týdnech mělo 24 pacientů (53,3%) a ke zhoršení došlo u 12 pacientů (26,7 %).
4. Vliv hodnot DAS 28 v T16 na hodnoty DAS 28 v T52 byl stanovený celkem u 69 pacientů (42,6% registrovaných pacientů) se známými údaji v obou týdnech. Pokud měli pacienti hodnotu DAS 28<2,6 (remise) v T16, v T52 měli hodnotu DAS 28 <2,6 v 58,3% (celkem 7 pacientů). Pacienti s hodnotami DAS 28 >5,1 (HDA) v T16 měli hodnoty DAS 28 >5,1 v T52 v 41,7% případů (5 z 12 pacientů). HDA high disease activity, MDA moderate disease activity, LDA low disease activity. 
Perzistence na léčbě, důvody ukončení: Dle dostupných údajů byla také hodnocena perzistence na léčbě, která činila po jednom roce 82 %, zatímco zatím medián nešlo stanovit, 25 % kvartil perzistence byl 17 měsíců.
Důvodem přerušení léčby byla nejčasněji nedostatečná účinnost u 25 nemocných (44,6 % předčasně ukončených) následovaná vedlejšími účinky u 11 přerušení (19,6 %) (tab. 1).
1. Důvody ukončení terapie abataceptem v rámci registru ATTRA 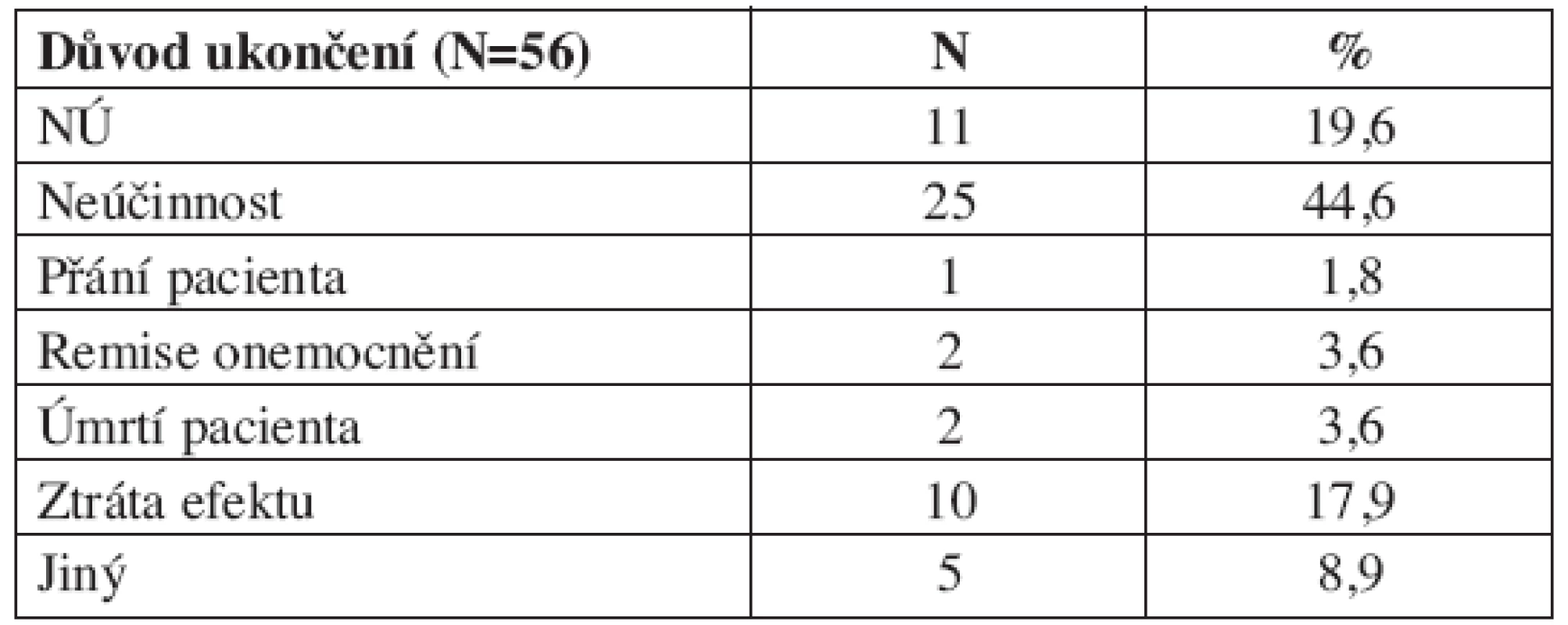
Postavení mezi ostatními biologiky: Z údajů v registru vyplývá, že u 33 pacientů (20,4 %) byl abatacept nasazen jako první biologický lék, jako druhý či třetí biologický lék byl nasazen u 69 (42,6 %), resp. u 40 (24,7 %) pacientů, jako čtvrtý či pátý biologický lék v pořadí u 15 (9,3 %), resp. u 5 (3,0 %) pacientů. U 40 pacientů (24,7 % zařazených) existují údaje o změně léčby (switch) z abataceptu na další biologické léky, u 33 pacientů jsou záznamy o použití jednoho lék, u 6, respektive u 1 pacienta o použití dalších dvou či tří biologických preparátů. Nejčastěji byl u pacientů po abataceptu nasazen tocilizumab (12x, 30 %), rituximab (10x, 25 %) či etanercept (8x, 20 %).
Bezpečnost: Celkem bylo hlášeno 50 nezávažných nežádoucích účinků u 36 pacientů (22 % registrovaných) a 11 závažných nežádoucích účinků u 10 pacientů (6 % registrovaných). V souvislosti se závažnými nežádoucími účinky se vyskytla dvě úmrtí (dále v textu). Nejčastějšími nezávažnými nežádoucí účinky byly infekce (31) a kožní projevy (5), byla hlášena pouze 1 nezávažná alergická reakce. Mezi hlášenými závažnými nežádoucími účinky figurovaly dvě infekce (dvě pleuropneumonie, v jednom případě s průkazem Klebsiella pneumoniae), dva kardiovaskulární projevy (infarkt myokardu s rupturou stěny a úmrtím pro srdeční tamponádu, srdeční selhání), čtyři neurologické nežádoucí příhody (kořenový syndrom L5 vpravo, a tři cerebrovaskulární příhody, v jednom případě s úmrtím), dva nádory (karcinom prsu, podezření na metastatické postižení jater - na přání pacienta nebylo došetřováno) a gastrointestinální projevy (benigní restenóza Vaterské papily spojená s iritací pankreatu (tab. 2 a 3).
Tab. 2 a 3. Nezávažné a závažné nežádoucí účinky hlášené v registru ATTRA při léčbě abataceptem. Celkem bylo v rámci sledování 162 nemocných hodnoceno 234 paciento-roků. Nezávažné vedlejší účinky byly hlášeny v 50 případech u 36 nemocných (22%), závažné pak v 11 případech u 10 nemocných (6%). <sup>#</sup> Pozitivita quantiferonového testu či kožního tuberkulinového testu. 
Diskuse
Soubor nemocných představuje ve velké většině případy etablované revmatoidní artritidy s průměrnou dobou trvání choroby 14 let. Dle údajů z registru se ve velkém procentu jedná o refrakterní případy choroby s anamnézou selhání terapie DMARDs a předcházející biologické léčby. U 20 % nemocných byl abatacept použit jako první biologický lék, s velkou pravděpodobností se jednalo zejména o nemocné, kteří do registru přešli z klinických studií. Předložená data ukazují jasně na velmi dobrou účinnost abataceptu v léčbě nemocných s revmatoidní artritidou, bez ohledu na to, že se bezesporu jedná o skupinu dlouhodobě etablovaných revmatoidní artritid. Vývoj DAS28 skóre je charakterizován signifikantním a setrvalým poklesem a má až do 52 týdne stále mírně klesající tendenci. Určitou limitaci tohoto hodnocení představuje absence údajů od některých pacientů v registru z pohledu aktivity choroby v pozdějších fázích sledování. V týdnu T52 bylo hodnoceno z pohledu aktivity chorob 79 záznamů. Během ročního sledování narůstal podíl pacientů v remisi a s nízkou aktivitou choroby, který činil v 52. týdnu 36,1 %. Je to méně než počet velmi dobrých léčebných odpovědí například ve studii AIM (44%), je si však třeba uvědomit rozdílnou populaci zařazených pacientů, kdy studie AIM (Abatacept in Inadequate Responders to Methotrexate) zařazovala pacienty biologicky naivní (10, 11). Výskyt uspokojivé léčebné odpovědi v registru ATTRA neodpovídá zcela principům „treat to target“, které kladou mnohem náročnější požadavky na dosažení remise či nízké aktivity choroby (12). Sběr dat však odráží algoritmus léčby před zavedením tohoto principu a lze předpokládat, že po jeho zavedení se situace bude dále zlepšovat. Druhým důvodem těchto nálezů je charakter pacientů, u kterých je léčba abataceptem aplikována často po selhání několika biologických léků. Charakteristice pacientů z registru ATTRA se blížila populace studie ATTAIN (Abatacept Trial in Treatment of Anti-TNF INadequate Responders), která hodnotila efekt léčiva u nemocných s aktivní revmatoidní artritidou nedostatečně reagujících na léčbu TNF alfa inhibitory primárně po šesti měsících léčby (13, 14). V této studii byl podíl pacientů v remisi po 6 měsících 10 % a s nízkou aktivitou choroby 17,1 %, což jsou srovnatelná data s výstupy z registru ATTRA (remise v 24. týdnu 10 %, LDA 20,2 % pacientů).
Nízká aktivita či remise po léčbě abataceptem v týdnu 16 predikovala v registru ATTRA významně stav v týdnu 52 – pacienti v remisi v týdnu 16 vykazovali remisi či nízkou aktivitu choroby v 52. týdnu v 91,6 % případů. Na druhou stranu se ukázalo, že i u pacientů se střední aktivitou v týdnu 16, existuje stále ještě cca 26 % šance na dobrou klinickou odpověď (remise či LDA) v týdnu 52. Tato analýza koresponduje s nálezy M. Dougadose et al. při subanalýze studie AIM (15).
U nemocných léčených abataceptem se statisticky signifikantně zlepšuje, tedy snižuje, funkční skóre HAQ, a to v průměru o 0,29 bodu mezi počátkem sledování v registru a 52. týdnem, což nachází paralelu i v údajích registračních studií či jejich extenzí (16, 17, 18). Ve studii ATTAIN funkční schopnosti byly významně zlepšeny u 47,3 % pacientů léčených abataceptem a pouze u 23,3 % léčených placebem (p < 0,001) (14). Rovněž skóre hodnotící kvalitu života (EuroQol, SF36) se v registru ATTRA signifikantně zlepšují podobně jako v rámci klinických studií s abataceptem (19, 20, 21).
Registr ATTRA ukazuje na vysokou perzistenci pacientů na léčbě při nasazení abataceptu, která dosahuje během jednoho roku 82 procent. Medián setrvání na léčbě zatím nešlo stanovit pro nedostatečný počet pacientů, kteří by terapii abataceptem z jakéhokoliv důvodu ukončili. Dvacátý pátý kvartil byl stanoven na 17 měsíců. Perzistence na léčbě abataceptem byla vysoká rovněž při analýze extenzí klinických studií. Čtyřleté přežívání na léčbě dosahovalo 73% (22). Mezi důvody ukončení terapií abataceptem byla na prvním místě nedostatečná účinnost. Na druhou stranu o tom, že toho cíle je často těžké dosáhnout, vypovídá mimo jiné i průměrná hodnota DAS28 skóre v týdnu 52 (3,6), které je ještě přece jen vzdálená hodnotě remise (2,6) či LDA (3,2). Je však třeba zdůraznit, že se zde jedná o skupinu převážně dlouhotrvajících revmatoidních artritid s průměrnou dobou trvání 14 let a ve velké většině s anamnézou selhání biologické léčby.
Bezpečnostní profil abataceptu je všeobecně příznivý a léčivo je velmi dobře tolerováno. Údaje o bezpečnosti se opírají o výsledky předcházejících studií a také o výsledky studie ARRIVE (Abatacept Study of Safety in Use with other Rheumatoid arthritis thErapies) týkající se bezpečnosti u nemocných se selháním anti-TNF alfa terapie (23, 24, 25). Kumulativní data z 8 studií u 4150 pacientů zahrnující 10,365 pacient-roků svědčí pro lehce vyšší výskyt závažných infekcí oproti placebu a pro minimální výskyt oportunních infekcí včetně tuberkulózy (26). Jako velmi rizikové se z hlediska infekcí jeví kombinace abataceptu s dalšími biologickými léky, zejména s anakinrou či etanerceptem z hlediska rizika infekcí (25). Nebyla zatím zjištěna zvýšená incidence malignit. Zdá se, že incidence infekcí ani malignit se rovněž nezvyšuje při prolongaci léčby (27). Zvýšenou pozornost je třeba věnovat pacientům s chronickou obstrukční bronchopulmonální chorobou, u kterých je terapii abataceptem spojena s vyšším rizikem nežádoucích účinků z hlediska respiračních infekcí i závažně probíhajících (25). V jiné rizikové skupině, u diabetiků, nebylo podávání abataceptu spojeno s větší frekvencí nežádoucích účinků (26).
Rovněž v registru jsou sledovány nežádoucí účinky, které jsou hlášeny přímo v internetové verzi registru či v případě závažných nežádoucích účinků jsou hlášeny bezprostředně telefonicky faxem či e-mailem do ústředí ATTRA s následným vyplněním formuláře CIOMS (Councill for international organizations of medical science, 28) Pro velmi dobrou bezpečnost svědčí i nová Cochranská analýza biologické léčby, dle které vykazuje abatacept spolu s anakinrou z pohledu všech závažných nežádoucích účinků srovnatelně nejlepší bezpečnost, z pohledu závažných infekcí jsou pak data pro abatacept dokonce nejlepší ze všech srovnávaných biologických léků (29). Dobrý bezpečnostní profil abataceptu je podpořen i údaji z francouzského registru ORA (30).
V rámci registru ATTRA se zatím neobjevila závažná skutečnost, která by svědčila pro nový či nápadně frekventní nežádoucí účinek abataceptu. Nejčastěji se vyskytovala v souladu s epidemiologickou situací a očekáváním infekce. Ve čtyřech případech byla hlášena tvz. latentní tuberkulóza, nejednalo se o prokázané onemocnění, ale pouze o pozitivitu quantiferonového testu či kožního tuberkulinového testu, která byla dále došetřovaná. Proto je tento nález zařazen mezi nezávažné vedlejší účinky, jelikož ani v jednom z případů nebyla tbc prokázaná. Byla hlášena dvě úmrtí, je si však třeba uvědomit, že v registry vycházejí z reálné, nepříliš selektované, polymorbidní pacientské populace a obě úmrtí (infarkt myokardu s tamponádou srdeční a cévní mozková příhoda) s největší pravděpodobností neměla k terapii abataceptem žádný vztah. Je však třeba upozornit, že frekvence nežádoucích účinků je v registru ATTRA nízká, nižší než lze očekávat na základě klinických studií i zkušeností, což svědčí pro nižší compliance zúčastněných pracovišť v hlášení nežádoucích účinků léčiv.
Závěr
Prezentované údaje z registru ATTRA reflektují období čtyř let podávání přípravku abatacept v České republice. V ČR je přípravek podáván zatím v rámci úhrad plátci zdravotní péče v druhé linii biologické léčby, je však registrován pro použití i linii první (31, 32). Významným vkladem registru ATTRA je zařazení všech nemocných se sledovanými chorobami, kteří jsou v daném období v ČR biologickou léčbou léčen. Výstupy projektu ATTRA poskytují na jednu stranu potvrzení účinku léčiv v podmínkách „reálního světa“, které je důležité mimo jiné z pohledu plátců zdravotní péče, na stranu druhou rovněž údaje o bezpečnosti preparátů. Zejména z pohledu méně častých, či po dlouhé době se objevujících nežádoucích účinků mohou registry poskytnou cennou komplementární informaci k údajům z registračních studií. V rámci poctivé interpretace registrovaných dat je však také třeba zmínit úskalí a problémy českého národního registru ATTRA, kterými jsou zejména pozdě a nekompletně doplněná data a výrazná „pod-reportovanost“ nežádoucích účinků. Před vedením registru ATTRA stojí nelehký úkol změny struktury dat a soustavný monitorovací tlak a motivace jednotlivých center ke kompletnímu a včasnému zadávání sledovaných údajů a hlášení nežádoucích účinků. Autoři předloženého článku se však domnívají, že prezentovaná data přípravku abatacept i přes uvedená úskalí představují velmi cenou sondu do tohoto segmentu pacientů s revmatoidní artritidou a poskytují nové informace ohledně použití přípravku abatacept.
Práce podpořena grantem LF-2012-016
Prof. MUDr. Pavel Horák, CSc.
III. interní klinika - nefrologická, revmatologická,
endokrinologická, LF UP a FN Olomouc
I. P. Pavlova 6
772 00 Olomouc
Sources
1. Kremer JM, Westhovens R, Leon M, et al. Treatment of rheumatoid arthritis by selective inhibition of T-cell activation with fusion protein CTLA4Ig. N Engl J Med 2003;349 : 1907-1915.
2. Linsley PS, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med 1991; 174 : 561–569.
3. Tegzová D, Vencovsky J, Dusek L, Pavelka K. Clinical register of TNF alpha blocking therapy of Czech rheumatologic society. Project ATTRA. Results of study: Clinical efficacy and safety. Ann Rheum Dis 2004; 63(Suppl.1) S263.
4. Prevoo MLL, van ‘t Hof MA, Kuper HH, et al. Modified disease activity scores that includes twenty eight - joint counts: development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum 1995;38 : 44–48.
5. Van Gestel AM, Prevoo MLL, van ‘t Hof MA, et al. Development and validation of the European League against Rheumatism response criteria for rheumatoid arthritis. Arthritis Rheum 1996; 39 : 34-40.
6. Prevoo MLL, van Gestel AM, van ‘t Hof MA, et al. Remission in a prospective study of patients with rheumatoid arthritis. Br J Rheumatol 1996;35 : 1101–1105.
7. The EuroQol Group.EuroQol-a new facility for the measurement of health-related quality of life. Health Policy. 1990;16 : 199-208.
8. Jenkinson C, Coulter A, Wright L. Short form 36 (SF36) health survey questionnaire: normative data for adults of working age. BMJ 1993;306 : 1437-1440.
9. Pincus T, Summey JA, Soraci SA Jr, Wallston KA, Hummon NP. Assessment of patient satisfaction in activities of daily living using a modified Stanford Health Assessment Questionnaire. Arthritis Rheum 1983;26 : 1346-1353.
10. Kremer JM, Dougados M, Emery P, et al. Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept: twelve month results of a phase IIb, double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2005; 52 : 2263–2271.
11. Kremer JM, Genant H, Moreland L, et al. Effects of abatacept in patients with methotrexate-resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med 2006; 144 : 865–876.
12. Burmester GR. remission. Nat Rev Rheumatol 2012. [Epub ahead of print] doi: 10.1038/nrrheum.2011.201.
13. Genovese MC, Becker JC, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor in inhibition. N Engl J Med 2005;353 : 1114-1123.
14. Genovese MC, Schiff M, Luggen M, et al. Sustained efficacy and safety through 2 years in patients with rheumatoid arthritis (RA) in the long-term extension of the ATTAIN trial. Arthritis Rheum 2006; 54(Suppl. 9)S247.
15. Dougados M, Schmidely N, Le Bars M, et al. Evaluation of different methods used to assess disease activity in rheumatoid arthritis: analyses of abatacept clinical trial data. Ann Rheum Dis 2009;68 : 484-489.
16. Westhovens R, Luggen M, Russell A, et al. Abatacept provides durable improvements in RA disease status and a consistent safety profile through 3 years in the aim and attain trials. Rheumatology 2008; 47 (Suppl.2)S46.
17. Emery P, Kremer JM, Moreland R, et al. Long-term efficacy and safety of abatacept through 5 years of treatment in rheumatoid arthritis patients with an inadequate response to methotrexate. Rheumatology 2008, 47 (Suppl.2) S48.
18. Kremer JM, Russell AS, Emery P, et al. Long-term safety, efficacy and inhibition of radiographic progression with abatacept treatment in patients with rheumatoid arthritis and an inadequate response to methotrexate: 3-year results from the AIM trial. Ann Rheum Dis 2011;70 : 1826–1830.
19. Schiff M, Bessette L. Evaluation of abatacept in biologic-naēve patients with active rheumatoid arthritis. Clin Rheum 2010;29 : 583-519.
20. Vital EM, Emery P. Abatacept in the treatment of rheumatoid arthritis. Ther Clin Risk Manag 2006; 2 : 365–375.
21. Russel AS, Wallenstein GV, Li T, et al. Abatacept Improves both the physical and mental health of patients with rheumatoid arthritis who have inadequate response to methotrexate treatment. Ann Rheum Dis 2007;66 : 189-194.
22. Hetland ML, Christensen IJ, Tarp U, et al. Direct comparison of treatment responses, remission rates, and drug adherence in patients with rheumatoid arthritis treated with adalimumab, etanercept, or infliximab: results from eight years of surveillance of clinical practice in the nationwide Danish DANBIO registry. Arthritis Rheum 2010; 62 : 22-32.
23. Schiff M, Keiserman M, Codding C, et al. Efficacy and safety of abatacept or infliximab vs placebo in ATTEST: a phase III, multi-centre, randomized, double-blind, placebo-controlled study in patients with rheumatoid arthritis and an inadequate response to methotrexate Ann Rheum Dis 2008;67 : 1096-1103.
24. Schiff M, Keiserman M, Codding C, et al. The efficacy and safety of abatacept or infliximab in RA patients with an inadequate response to MTX: results from a 1-year double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2006; 54 (Suppl.1)S43.
25. Schiff M, Pritchard C, Teng J, et al. The safety of abatacept in patients with active rheumatoid arthritis and an inadequate response to anti-TNF therapy: results from the ARRIVE trial. Ann Rheum Dis 2007; 66 (Suppl. 2) S89.
26. Smitten A, Simon R, Qi K, et al. Hospitalized infections in the abatacept RA clinical development program: An epidemiological assessment with > 10,000 person-years of exposure. Arthritis Rheum 2008, 58(Suppl.)S786-S787.
27. Weinblatt M, Combe B, Covucci A, et al. Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum 2006; 54 : 2807–2816.
28. WHO: The evaluation of drugs: whose responsibility? CIOMS Round Table Conference, October 1968. WHO Chron. 1969;23 : 256-263.
29. Singh JA, Wells GA, Christenses R, et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev 2011 : 16;2:CD008794
30. Gottenberg JE, Ravaud P, Bardin T, et al. Prospective follow-up of abatacept treatment in 920 patients with refractory rheumatoid arthritis: Tolerance and efficacy data from French ORA (Orencia and rheumatoid arthritis) registry. Ann Rheum Dis 2010;69(Suppl3) S386.
31. CastaĖeda S, Martínez Calatrava MJ, Herrero-Beaumont G. [Alternatives in the treatment of rheumatoid arthritis: reasons for using abatacept.]Rev Clin Esp. 2011[Epub ahead of print]
32. Souhrn údajů o přípravku: Orencia. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-Product_Information/human/000701/WC500048935.pdf, 8.2.2012.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2012 Issue 4
Most read in this issue- Adult onset Still’s disease – a case report
- Osteoimmunology
- Genes of major histocompatibility complex are not only transplantation antigens
- Abatacept and its use for the treatment of rheumatoid arthritis in the Czech Republic – data from the ATTRA registry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

