-
Medical journals
- Career
Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
Authors: Zb. Hrnčíř; J. Tomš
Authors‘ workplace: Hradec Králové ; II. interní klinika, oddělení revmatologie a klinické farmakologie, Lékařská fakulta UK a Fakultní nemocnice
Published in: Čes. Revmatol., 17, 2009, No. 3, p. 168-172.
Category: Overview Reports
Overview
Vaskulární endotelový růstový faktor (VEGF) je mohutný stimulátor angiogeneze (AG) a cévní permeability. VEGF je významným činitelem ve fyziologii embryogeneze, hojení ran a v menstruačním cyklu. Za patologických okolností má význam zejména pro růst solidních tumorů, ale také u zánětlivých stavů, vč. širokého spektra revmatických nemocí. Vysoké hodnoty VEGF v séru byly pozorovány zejména u nemocných s aktivní formou těchto chorob (např. u systémového lupus erythematodes s korelací ke SLAM skóre). VEGF má závažnou roli v AG proliferativní synovitidy u revmatoidní artritidy (RA), cévních změn u systémové sklerodermie, lokální hypoxii u polymyozitidy/dermatomyozitidy aj. U RA, vč. časné RA, bylo zjištěno, že hodnoty VEGF v séru korelují s poškozením kloubů (radiografické studie, „power“ ultrasonografie aj.). Odpověď na terapii (DMAID, anti-TNF-alfa) je u RA provázena poklesem zvýšených hodnot VEGF v séru. Klinická zkušenost z onkologie, patofyziologie revmatoidní synovitidy a některá experimentální data jsou předpokladem k tomu, aby se dala hodnotit blokáda AG jako možná cesta k nové strategii v terapii RA.
Klíčová slova:
vaskulární endotelový růstový faktor, angiogeneze, zánětlivá revmatická onemocnění, revmatoidní artritida, systémový lupus erythematodesÚvod
Aktuální síť krevních a mízních cév je výsledkem dynamické rovnováhy angiogenetických a angiostatických faktorů. Angiogeneze (AG) je koordinovaný proces proliferace a migrace endotelových buněk s tvorbou kapilárních tub, depozicí bazální membrány, proliferací/migrací pericytů a buněk hladké svaloviny. Výstavbu cévní sítě završuje tvorba anastomóz (1, 2). Současně probíhá její průběžná reorganizace s regresí nadbytečných cév apoptózou endotelových buněk. V celkově komparativním pohledu má cévní tkáň vysokou vitalitu. Vedle nervových buněk patří endotelové buňky k nejdéle žijícím buňkám těla. Při fyziologické AG lze průřezově zastihnout ve fázi dělení jenom 0,01 % z nich; např. u buněk střevního epitelu to je 14 % (3).
Existence AG faktorů byla původně postulována na základě pozorování, že experimenty s transplantací nádorů vedou k silné neovaskulární odpovědi. Následně se ukázalo, že také normální tkáně jsou zdrojem AG aktivity (4). Názvy a symboly hlavních pozitivních regulátorů AG jsou v tabulce 1. Fyziologická AG umožňuje řadu aspektů embryogeneze/organogeneze a reprodukční cykly u žen. AG je garantem tkáňové reparace po traumatu a součástí patogenetických mechanismů u širokého spektra nemocí, od solidních nádorů přes některé (chorio-) retinopatie, chronickou gingivitidu a psoriázu, až k proliferativní synovitidě a k dalším projevům u revmatických nemocí.
Table 1. Hlavní pozitivní regulátory angiogeneze (upraveno podle A. E. Kochové; 3). 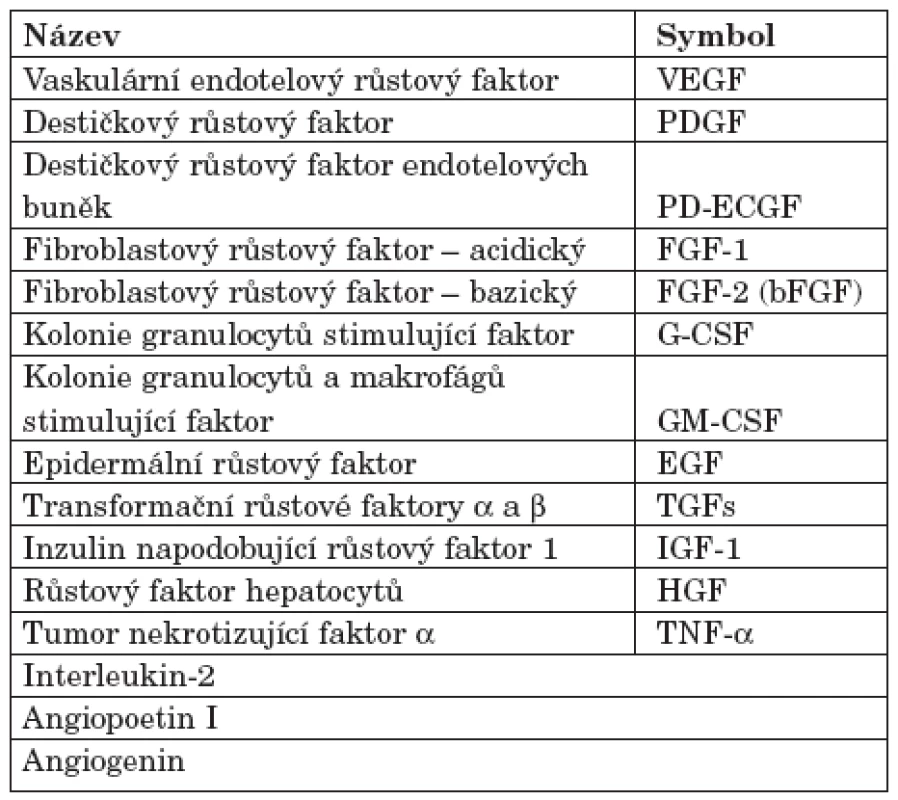
Rodina VEGF (vaskulární endotelový růstový faktor) je nejlépe definovaný angiogenetický systém. Nativní VEGF je heparin vázající homodimerický glykoprotein o mol. hm. 45 kDa. Původně (1983) byl VEGF izolován jako faktor vaskulární permeability (VPF) z ascitické tekutiny a supernatantu buněčné kultury morčecího hepatocelulárního karcinomu. VEGF má dvě hlavní biologické aktivity: je specifickým mitogenem buněk cévního endotelu a mediátorem vzestupu cévní permeability. VEGF je produkován endotelovými buňkami, fibroblasty, makrofágy a buňkami hladké svaloviny. VEGF gen je umístěn na chromozomu 6p.21. Klíčovou roli v regulaci genové exprese VEGF má expozice nízké tenzi kyslíku a hlavním mediátorem je hypoxií indukovaný faktor (HIF). Rodina VEGF má společnou strukturu osmi cysteinových zbytků VEGF homologní domény: VEGF-A má navíc šest izoform s nestejnými AG funkcemi. Biologickou aktivitu VEGF umožňují specifické tyrozinkinázové receptory VEGFR-1, VEGFR-2 a VEGFR-3. VEGFR-3 a jeho ligandy (VEGF-C a VEGF-D) jsou spjaty s lymfangiogenezou a placentární růstový faktor (P1GF) s arteriogenezou (4, 5). Některá pozorování nasvědčují tomu, že VEGF je potenciálním modulátorem produkce autoprotilátek u autoimunitních nemocí (6). Dynamická rovnováha induktorů a inhibitorů AG se vyznačuje za normálního stavu převahou inhibitorů AG (obr. 1); u zánětu, reparace poranění a nádorového růstu je tomu naopak (3).
Image 1. Rovnováha induktorů a inhibitorů angiogeneze (upraveno podle A.E. Kochové; 3). 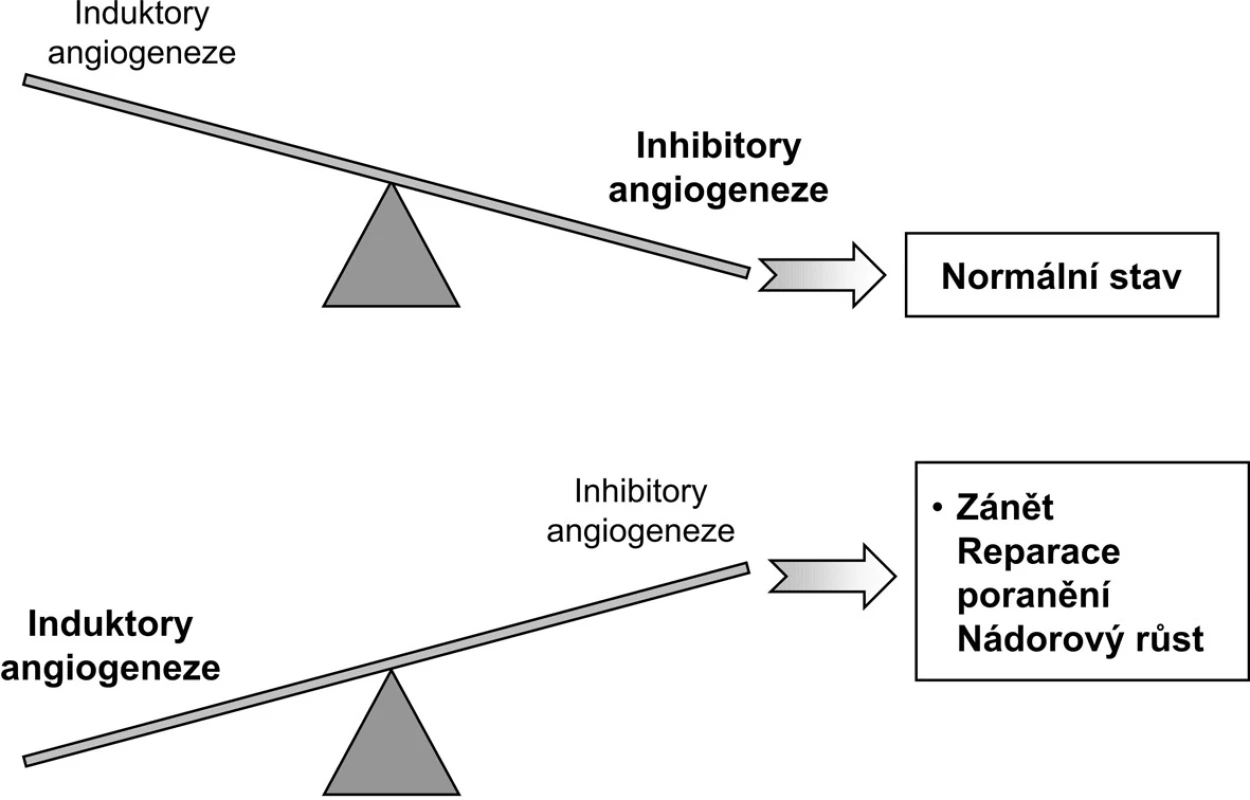
VEGF u revmatoidní artritidy (RA)
AG koncept má význačné místo v patogenezi RA synovitidy. Dynamická rovnováha AG je posunuta ve prospěch induktorů AG. Spouštěcím mechanismem je hypoxie synoviální tkáně s poklesem tenze kyslíku pod hodnoty v normálním kloubu (3). Předpokládá se, že to je důsledek vzestupu intra-artikulárního tlaku v RA kloubech, který převyšuje hodnoty tlaku v synoviálních kapilárách a umožňuje pohybem indukovanou okluzi s periodou relativní hypoxie. Perfuzní insuficience je často spjata s kompenzační neovaskularizací, při které je VEGF dominantním mediátorem. Genovou transkripci VEGF stimulují hypoxií indukované transkripční faktory HIF-1 a HIF-2. Transkripční změny v hypoxickém prostředí RA kloubu a paralelní metabolická náročnost kloubního zánětu tak přispívají k perpetualizaci synovitidy u RA (1). Nutno dodat, že výsledná exprese VEGF u RA synovitidy je multifaktoriální provenience a významně se na ní podílejí také prozánětlivé cytokiny a fyzikální interakce aktivovaných leukocytů a synoviálních fibroblastů.
O účasti VEGF při neovaskularizaci artritických kloubů svědčí údaje o detekci VEGF v polymorfonukleárech (PMN) synoviální tekutiny (ST): obsahovaly signifikantně více VEGF a jeho mRNA než PMN periferní krve těchže nemocných nebo PMN v ST z osteoartrotických kloubů (7). Imunochemická šetření ukázala, že ve zbytnělé synovialis artritických kloubů je u RA výrazně exponován zejména VEGF-C; v přilehlých cévách byly zjištěny receptory VEGFR-2 a VEGFR-3. Průkaz zralé formy VEGF-C v buňkách obklopujících kapilární síť revmatoidní synovialis a exprese VEGFR-3 svědčí o významu lymfangiogeneze u RA (8), signalizují zvýšenou filtraci tekutiny, tkáňový edém a ztuhlost kloubů (9). Z VEGF izoform generovaných via VEGF mRNA je v RA synovialis konstitutivně exprimována izoforma VEGF(121) a fakultativně izoforma VEGF(165). Signifikantně větší mikrovaskulární denzita byla pozorována u revmatoidní synovialis s expresí VEGF(165) (10). Cílená pozornost (11) byla v rodině VEGF věnována významu P1GF pro revmatoidní synovitidu. P1GF je 25.kd dimerický protein s vysokou homologií VEGF: má tři izoformy a specifický ligand pro VEGF receptor 1 (flt-1). Imunochemickými analýzami a průtokovou cytometrií se zjistilo, že RA synovialis vysoce exprimuje P1GF i jeho flt-1 receptor a spouští tak tvorbu prozánětlivých cytokinů.
V průřezových studiích byly opakovaně zjištěny signifikantně vyšší koncentrace VEGF v séru u RA než u kontrol (p < 0,01) nebo u nemocných se systémovým lupus erythematodes, Sjögrenovým syndromem a s osteoartrózou (p < 0,05) (1, 12, 13). U RA byly sérové hodnoty VEGF v signifikantním vztahu ke klinickým a laboratorním ukazatelům aktivity. V longitudinální studii (14) byl v časovém rozmezí 12 měsíců sledován vztah mezi VEGF v séru a RTG progresí podle Sharpova skóre (modifikace van den Heide) u pacientů s časnou RA: výsledkem bylo zjištění významné pozitivní korelace (r = 0,58, p < 0,01). Mikrovaskulaturu erozivního cévního pannusu lze prokazovat zobrazovacími metodami. Bylo zjištěno, že změny při dynamické magnetické rezonanci s gadoliniem a „power“ Dopplerovské ultrasonografii korelují s histologicky doloženou vaskularitou synoviální tkáně. U časné RA byla pozorována výrazná asociace mezi nálezy kloubních erozí při vysokorozlišující ultrasonografii a cévním signálem „power“ Dopplerovského modu (1). Sofistikovaný přístup s využitím moderních zobrazovacích metod tak umožňuje dobře dokumentovat cévní pannus v erozivní fázi u časné RA. Tato pozorování podporují předpoklad, že AG indukující molekuly, především pak VEGF systému, představují perspektivní cíle pro nové možnosti v terapii RA.
Příznivá odpověď na remisi indukující terapii aktivní RA je spojena s významným poklesem sérové koncentrace VEFG (12). V experimentální rovině bylo doloženo, že methotrexat, aurothiomalát a některé další chorobu modifikující léky tlumí produkci VEGF v kulturách synoviálních buněk RA nemocných (15).Cyklosporin A je dobře znám svojí schopností inhibice transkripčních faktorů: bylo to prokázáno i ve vztahu k transkripčním faktorům VEGF (16). Redukce VEGF byla zjištěna při ústupu aktivity RA synovitidy během terapie anti-TNF-alfa (17).
Lze tedy konstatovat, že příznivá odpověď na některé chorobu modifikující léky nebo na anticytokinovou terapii je spojena s redukcí VEGF, nejde však o odpověď na cíleně koncipovanou anti-angiogenetickou léčbu. Idea této terapie deklaruje novou možnost v léčebných přístupech k RA. Vychází z předpokladu, že AG s dominancí VEGF má kritický význam při neovaskularizaci u revmatoidní synovitidy, agresivitě pannusu a vzniku erozí, a to jak v iniciální (spoušťové), tak v následné (perpetualizační) fázi. Takto cílená antiangiogenetická terapie by měla být namířena proti VEGF, resp. VEGFR.
Anti-VEGF terapie u RA má motivaci z experimentální zkušenosti a z klinické analogie u kolorektálního karcinomu. Principiálním požadavkem je ovlivnit jak iniciální fázi RA, tak i perzistenci/progresi etablovaného onemocnění. Experimentální data naplňují zatím tento předpoklad jenom částečně. Myším kmene C57BL6/J a DBA-L s kolagenem indukovanou artritidou byla podávána do peritonea monoklonální anti-VEGF-B protilátka (VEGF-B je strukturní analog VEGF-A) neutralizující vazbu na VEGFR-1 receptor. U obou myších kmenů byl prokázán profylaktický efekt, ale žádný přínos tam, kde už došlo k manifestní artritidě. Svědčí to o významu VEGF-B/VEGFR-1 systému pro časnou fázi kloubního zánětu, ale ne pro klinicky manifestní formu kolagenem indukované artritidy u myšího modelu RA (18).
Kolorektální karcinom je onemocnění, u kterého byl prvně s klinickým úspěchem použit inhibitor AG, jakým je rekombinantní anti-VEGF protilátka (anti-VEGF mAb) bevacizumab (19). Následovalo rozšíření na další onkologická onemocnění a také na mimoonkologické indikace, zvláště v oftalmologii. Intravitreální instilace bevacizumabu se osvědčila u chorioideální neovaskularizace (20), makulární teleangiektazie (21), diabetické retinopatie aj. V onkologii (solidní tumory, mnohočetný myelom) se používá také anti-VEGF terapie založená na inhibici tyrozin-kinázového receptoru VEGF (22). Synoviální AG revmatoidních kloubů a tendosynovie je východiskem k úvahám o využití zmíněných přístupů inhibice VEGF mediované AG také v terapii RA.
VEGF u systémového lupus erythematodes (SLE), systémové sklerodermie (SSc) a polymyozitidy/dermatomyozitidy (PM/DM)
Historie výzkumu VEGF u SLE, SSc a PM/DM se odvíjí od pilotních informací o signifikantně zvýšené koncentraci VEGF v séru u všech těchto chorob (23). U SLE byl VEGF zkoumán především ve vztahu k aktivitě a k některým orgánovým projevům, zejména k lupusové nefritidě (LN). Byla zjištěna signifikantní korelace mezi VEGF v séru a SLE aktivitou podle SLAM skóre (24). Vysoké hodnoty VEGF byly zaznamenány zejména u LN s renální dysfunkcí. Vyšetřování VEGF u LN vyústilo k vypracování neinvazivní metody cíleného šetření buněk moče testem kvantitativní detekce mRNA VEGF genu. Ve skupině 26 LN tak bylo možno odlišit LN ve třídě IV s 85% senzitivitou a 94% specificitou (25). VEGF byl u SLE zkoumán také ve vztahu k chronické deformující artropatii ručních kloubů (26).
Cévní abnormality v kůži nemocných SSc indukují představu o deficitní AG; experimentální a klinická data však nepotvrdila tento předpoklad. Imunohistochemická šetření naopak ukázala nekontrolovanou nadprodukci VEGF a jeho receptorů VEGFR-1 a VEGFR-2, která není mediována transkripčním faktorem HIF-1 (27). Klinicky zajímavá jsou zjištění významně vyšší koncentrace VEGF v séru u kožně difuzní SSc než u kožně limitované formy, signifikantní korelace k rozsahu kožní sklerózy podle modifikovaného Rodnanova skóre, k plicní fibróze s redukcí plicních funkcí a k anti-Scl-70 protilátkám; signifikantní inverzní korelace byla zjištěna ve vztahu k denzitě kapilár nehtového lůžka (5, 23, 28, 29).
U PM/DM byly v séru nemocných opětovně zjišťovány vyšší hodnoty VEGF než u zdravých kontrol (23, 30). Přínosem pro patofyziologii jsou poznatky o expresi VEGF mRNA ve svalové tkáni z bioptických vzorků. Významně zvýšená exprese VEGF mRNA byla prokázána jak u časné myozitidy bez zánětlivého infiltrátu, tak u etablované myozitidy se zánětlivým inflitrátem (30): lokální hypoxie byla hodnocena jako hlavní motiv těchto nálezů.
Zánětlivá revmatická onemocnění s kusými údaji o VEGF
Některá pozorování VEGF u takto vymezené skupiny revmatických nemocí jsou zajímavým příspěvkem k jejich patogeneze, jiná mají spíše popisný a/nebo vyhledávací význam. Do první skupiny patří zpráva o signifikantně vyšší sérové koncentraci VEGF u syndromu remitující symetrické séronegativní synovitidy s měkkým otokem (RS3PE) než u srovnávaných difuzních nemocí pojiva (RA, SLE, PM/DM, vaskulitické syndromy). Syndrom RS3PE se tak nabízí jako modelové onemocnění k demonstraci VEGF jako činitele podporujícího cévní permeabilitu a synoviální zánět (31). Obdobně je zajímavá zpráva o imunohistochemické detekci VEGF v okrscích zánětu srdečních chlopní u revmatické horečky (5).
U ankylozující spondylitidy (AS) byla pozorována signifikantní korelace VEGF v séru k ukazatelům aktivity (BASDAI, SE, CRP); vysvětluje se to zvýšenou vaskularitou u aktivní AS. V porovnání s nálezy u zdravých kontrol byly pozorovány významně zvýšené hodnoty VEGF v séru u primárního antifosfolipidového syndromu a některých systémových nekrotizujících vaskulitid, zvl. u polyarteritis nodosa, Wegenerovy granulomatózy a dalších (5).
Podpořeno Výzkumným záměrem MZ ČR 00179906.
Prof. MUDr. Zbyněk Hrnčíř, DrSc.
II. interní klinika LF UK a FN
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: hrncir@fnhk.cz
Sources
1. Taylor PC. VEGF and imaging of vessels in rheumatoid arthritis. Arthritis Res 2002; 4 Suppl 3: S99–S107.
2. Naňka O, Grim M. Utváření cévního řečiště: přehled molekulárních mechanismů a možností terapeutického ovlivnění. Čas Lék čes 2009; 148 : 158–63.
3. Koch AE. Angiogenesis. Implication for rheumatoid arthritis. Arthritis Rheum 1998; 41 : 951–62.
4. Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nature Med 2003; 9 : 669–76.
5. Carvalho JF, Blank M, Shoenfeld Y. Vascular endothelial growth factor (VEGF) in autoimmune diseases. J Clin Immunol 2007; 27 : 246–56.
6. Tian S, Chyou S. VEGF as potential mediator of antibody responses. Arthritis Rheum 2008; 58: S628.
7. Kasama T, Kobayashi K, Yajima N, et al. Expression of vascular endothelial growth factor by synovial fluid neutrophils in rheumatoid arthritis (RA). Clin Exp Immunol 2000; 121 : 533–38.
8. Wauke K, Nagashima M, Ishiwata T, et al. Expression and localization of vascular endothelial growth factor-C in rheumatoid arthritis synovial tissue. J Rheumatol 2009; 29 : 34–38.
9. Paavonen K, Mandelin J, Partasen T, et al. Vascular endothelial growth factors C and D and their VEGFR-2 and 3 receptors in blood and lymphatic vessels in healthy and arthritic synovium. J Rheumatol 2002; 29 : 39–45.
10. Ikeda M, Hosoda Y, Hirose S, et al. Expression of vascular endothelial growth isoforms and their receptors flt-1, KDR, and neutrophillin-1 in synovial tissue of rheumatoid arthritis. J Pathol 2000; 191 : 426–33.
11. Yoo SA, Yoon NJ, Kim HS, et al. Role of placenta growth factor and its receptor flt-1 in rheumatoid inflammation. Arthritis Rheum 2009; 60 : 345–54.
12. Harada M, Mitsuyama K, Yoshida H, et al. Vascular endothelial growth factor in patients with rheumatoid arthritis. Scand J Rheumatol 1998; 27 : 377–80.
13. Lee SS, Joo YS, Kim WU, et al. Vascular endothelial growth factor levels in the serum and synovial fluid of patients with rheumatoid arthritis. Clin Exp Rheumatol 2001; 19 : 321–24.
14. Ballara S, Taylor PC, Reusch P, et al. Raised serum vascular endothelial growth factor levels are associated with destructive change in inflammatory arthritis. Arthritis Rheum 2001; 44 : 2055–64.
15. Nagashima M, Asaho G, Yoshino S. Imbalance in production between vascular endothelial growth factor and endostatin in patients with rheumatoid arthritis. J Rheumatol 2000; 27 : 2339–42.
16. Hernandez GL, Volpert OV, Iniguez MA, et al. Selective inhibition of vascular endothelial growth factor-mediated angiogenesis by cyclosporin A: roles of the nuclear factor of activated T cells and cyclooxygenase 2. J Exp Med 2001; 193 : 607–20.
17. Paleolog EM, Young S, Stark AC, et al. Modulation of angiogenetic vascular endothelial growth factor (VEFG) by TNF-alfa and IL-1 in rheumatoid arthritis. Arthritis Rheum 1998; 41 : 1258–65.
18. Mould AW, Scotney P, Greco SA, et al. Prophylactic but not therapeutic activity of a monoclonal antibody that neutralizes the binding of VEGF-B to VEGFR-1 in a murine collagen-induced arthritis model. Rheumatology 2008; 47 : 263–66.
19. Khong TL, Larsen H, Raats Y, et al. Angiogenesis as a therapeutic target in arthritis. Learning the lessons of the colorectal cancer experience. Angiogenesis 2007; 10 : 243–58.
20. Arias L, Planas N, Prades S, et al. Intravitreal bevacizumab (Avastin) for choroidal neovascularisation secondary to pathological myopia: 6-month results. Br J Ophtalmol 2008; 92 : 1035–39.
21. Kovach JL, Rosenfeld PJ. Bevacizumab (Avastin) therapy for idiopathic macular teleangiectasia type II. Retina 2009; 29 : 27–32.
22. Sloan B, Scheinfeld NS. Pazopanib, a VEGF receptor tyrosine kinase inhibitor for cancer therapy. Curr Opin Invest Drugs 2008; 9 : 1324–35.
23. Kikuchi K, Kubo M, Kadono T, et al. Serum concentrations of vascular endothelial growth factor in collagen diseases. Brit J Dermat 1998; 139 : 1049–51.
24. Robak E, Wozniacka A, Sysa-Jedrzejowska A, et al. Circulating angiogenesis inhibitor endostatin and positive endothelial growth factors in patients with systemic lupus erythematosus. Lupus 2002; 11 : 348–55.
25. Avihingsanon Y, Phumesin P, Benjachat T, et al. Measurement of urinary chemokine and growth factor messenger RNAs: a noninvasive monitoring of lupus nephritis. Kidney Int 2006; 69 : 747–53.
26. Hrncir Z, Drahosova M, Andrys C, et al. Angiogenetic growth factors in systemic lupus erythematosus with deforming arthropathy of small hand joints. Ann Rheum Dis 2009; 68 (suppl 1).
27. Distler O, Distler JWH, Scheid A, et al. Uncontrolled expression of vascular endothelial growth factor and its receptors leads to insufficient skin angiogenesis in patients with systemic sclerosis. Circ Res 2004; 95 : 109–16.
28. Distler O, del Rosso A, Giacomelli R, et al. Angiogenic and angiostatic factors in systemic sclerosis: increased levels of vascular endothelial growth factor are a feature of the earliest disease stage and are associated with the absence of finger ulcers. Arthritis Res 2002; 4 (6): R11.
29. Choi JJ, Min DJ, Cho ML, et al. Elevated vascular endothelial growth factor in systemic sclerosis. J Rheumatol 2003; 30 : 1529–33.
30. Grungtman C, Tham E, Ulfgren AK, et al. Vascular endothelial growth factor is highly expressed in muscle tissue of patients with polymyositis and patients with dermatomyositis. Arthritis Rheum 2008; 58 : 3224–38.
31. Arima K, Origuchi T, Tamai M, et al. RS3PE syndrome presenting as vascular endothelial growth factor associated disorder. Ann Rheum Dis 2005; 64 : 1653–55.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2009 Issue 3-
All articles in this issue
- Konkomitující fibromyalgie u pacientů s revmatoidní artritidou
- Rituximab v rukou nefrologa – první zkušenosti
- Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu
- Bezpečnost biologické léčby – doporučení České revmatologické společnosti
- Současný pohled na etiopatogenezi fibromyalgie
- Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
- Akcelerovaná ateroskleróza u systémového lupus erythematodes
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu
- Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
- Konkomitující fibromyalgie u pacientů s revmatoidní artritidou
- Bezpečnost biologické léčby – doporučení České revmatologické společnosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

