-
Medical journals
- Career
Muskuloskeletální projevy při celiakii
Authors: L. Franeková; T. Philipp; M. Sedláčková
Authors‘ workplace: Revmatologické a rehabilitační oddělení Fakultní Thomayerovy nemocnice, Praha
Published in: Čes. Revmatol., 15, 2007, No. 4, p. 190-196.
Category: Overview Reports
Overview
Celiakie je autoimunitní onemocnění navozené gliadinovou frakcí lepku (proteinu obsaženého v zrnech pšenice, žita, ječmene a ovsa) u geneticky disponovaných osob. Onemocnění primárně postihuje střevní sliznici. Pro diagnózu celiakie je rozhodující histologický průkaz lymfoplazmocytárního infiltrátu a různého stupně atrofie sliznice s hyperplazií krypt. Klinické projevy jsou značně variabilní – od průjmovitých stolic s únavou, hmotnostním úbytkem a dalšími projevy malabsorpce až po zcela necharakteristické obtíže (meteorismus, bolesti břicha) nebo nemusí být zažívací obtíže vůbec vyjádřeny. Jediným projevem onemocnění může být osteoporóza, osteomalacie, neurologické poruchy, gynekologické, kožní či kloubní postižení – nejčastěji neerozivní symetrické polyartritidy postihující ramena, kolena a kyčle a možným axiálním postižením. Autoři se v článku věnují využití pro celiakii specifických protilátek v diagnostice celiakie, muskuloskeletálním projevům (zejména osteoporóze a kloubním projevům) a výskytu celiakie mezi pacienty se systémovými onemocněními pojiva.
Klíčová slova:
celiakie, osteoporóza, osteomalacie, artritida, protilátkyÚVOD
Celiakie (celikální sprue, glutenová enteropatie) je onemocnění postihující především sliznici tenkého střeva a projevující se různě těžkým malabsorpčním syndromem. Existuje i celá řada mimostřevních orgánových projevů tohoto onemocnění – kožních, kardiálních, neurologických, kloubních či gynekologických. Jedná se o autoimunitní onemocnění navozené gliadinovou frakcí glutenu (lepku), proteinu obsaženého v zrnech pšenice, žita, ječmene a ovsa, u geneticky disponovaných osob – nositelé HLA antigenu DQ2 nebo DQ8 (1, 2).
Prevalence celiakie v Evropě je 1 : 200–250 (2). Celiakie se nejčastěji manifestuje mezi 1.–2. rokem a mezi 30.–40. rokem života. Častěji jsou postiženy ženy a příbuzní pacientů s celiakií (3).
Pro stanovení diagnózy je nutné provedení biopsie, kde nacházíme v histologickém obraze střevní sliznice příznačnou atrofii klků jejuna, lymfoplazmocytární infiltraci, hypertrofii krypt a zvýšený počet intraepiteliálních lymfocytů (1, 4).
V séru nemocných prokazujeme protilátky proti gliadinu, endomyziu, tkáňové transglutamináze a retikulinu, které jsou pro toto onemocnění vysoce specifické a umožnují tak odhalit pacienty s nevyjádřenými střevními klinickými projevy onemocnění. V evropské populaci bylo toto onemocnění donedávna diagnostikováno přibližně u jedné osoby z tisíce. Prevalenční sérologické screeningové studie spočívající ve vyhledávání nemocných na základě stanovení specifických protilátek prokázaly skutečnost, že celiakie je všeobecně poddiagnostikované onemocnění – přibližně na každého jednoho diagnostikovaného nemocného s celiakií připadá dalších 5–10 s nediagnostikovaným onemocněním (2). Důvodem je značná variabilita klinických projevů a také fakt, že se na toto onemocnění zejména u dospělých pacientů nemyslí. S rozvojem sérologických sceeningových metod průkazu protilátek se situace v diagnostice rapidně zlepšuje (2, 5).
Nediagnostikované onemocnění představuje pro nemocného s celiakií řadu rizik. Ohrožen je osteoporózou a tím vznikem osteoporotických fraktur a zejména vyšším sklonem k malignitám trávicího traktu (lymfom či adenokarcinom tenkého střeva). Také pacienti s neurologickými, kloubními projevy či pacientky s neplodností nejsou adekvátně léčeni a tato nekauzální léčba má i menší naději na úspěch.
Základem terapie je přísná bezlepková dieta, nutriční péče a úprava deficitu minerálů a vitaminů, zpočátku zejména v parenterální formě (6, 7). V nedávných studiích u pacientů na bezlepkové dietě byl povrzen výskyt malignit trávicího traktu na úrovni ostatní populace (2, 8, 9). Ze strany gastroenterologů je proto doporučováno aktivní vyhledávání nemocných prováděním screeningu protilátkami v rizikových skupinách osob (10, 11).
Cílem článku je seznámit revmatology s muskuloskeletálními projevy při celiakii a upozornit na problém diagnostiky tohoto onemocnění.
Etiopatogeneze celiakie
V současné době je celiakie považována jednoznačně za autoimunitní onemocnění. Vzniká u osob geneticky disponovaných – jde pouze o nositele HLA antigenu II. třídy DQ2 nebo DQ8 (12). Důkazem genetické dispozice je i častější výskyt mezi příbuznými pacientů s celiakií (5–15 %) a u jednovaječných dvojčat (70–75 %).
Lepek je protein obsažený v zrnech pšenice, žita, ječmene a ovsa. Gliadin, který je součástí lepku, se uplatňuje jako spouštěč autoimunitní reakce, resp. jeho toxické produkty štěpení, tzv. glutenové peptidy po deamidaci tkáňovou transglutaminázou jsou společně s HLA antigeny DQ2 nebo DQ8 na povrchu antigen prezentujících buněk předkládány CD4 T lymfocytům. Dochází k jejich aktivaci a rozvoji Th 1 imunitní odpovědi s produkcí prozánětlivých cytokinů (zejména IFNγ) a metaloproteináz.
Na poškození sliznice se podílí jak mechanismy specifické imunity, tak imunity nativní (přirozené), pro což svědčí důkazy o epiteliálních změnách objevivších se u nemocných do čtyřech hodin po expozici lepku. Zkoumána z tohoto pohledu je funkce intraepiteliálních lymfocytů (obr. 1) (1, 2). Výsledkem je destrukce enterocytů, ztráta klkovité struktury, lymfoplazmocytární infiltrace a kompenzační prohloubení krypt.
Image 1. Patogenetické mechanismy poškození střevní sliznice při celiakii. Poškození střevní sliznice probíhá dvěma mechanismy: uvolněním prozánětlivých cytokinů antigen specifickými T lymfocyty a přímo intraepiteliálními lymfocyty. Gluten je štěpen až na glutenové peptidy toxické povahy, které jsou odolné vůči proteázám. Glutenový peptid p 31–43 nebo 31–49 je schopen indukovat produkci interleukinu 15 (IL-15) enterocyty a dendritickými buňkami. Působením IL-15 dochází ke zvýšené expresi MICA stresových molekul na povrchu enterocytů. Tyto molekuly jsou rozpoznány intraepiteliálními lymfocyty (IEL) pomocí receptorů NKG2D. Intraepiteliální lymfocyty jsou schopny fenotypické přeměny v přirozené zabíječe a následného zničení enterocytu. Jiný peptid p 57–73 je po deamidaci tkáňovou transglutaminázou prezentován CD4 T lymfocytům na povrchu antigen prezentujících buněk v komplexu s HLA antigenem DQ2 nebo DQ8. Aktivací T lymfocytů dochází k rozvoji Th1 imunitní reakce s uvolněním prozánětlivých cytokinů (zejména IFNγ) a metaloproteináz s poškozujícím účinkem na střevní sliznici. 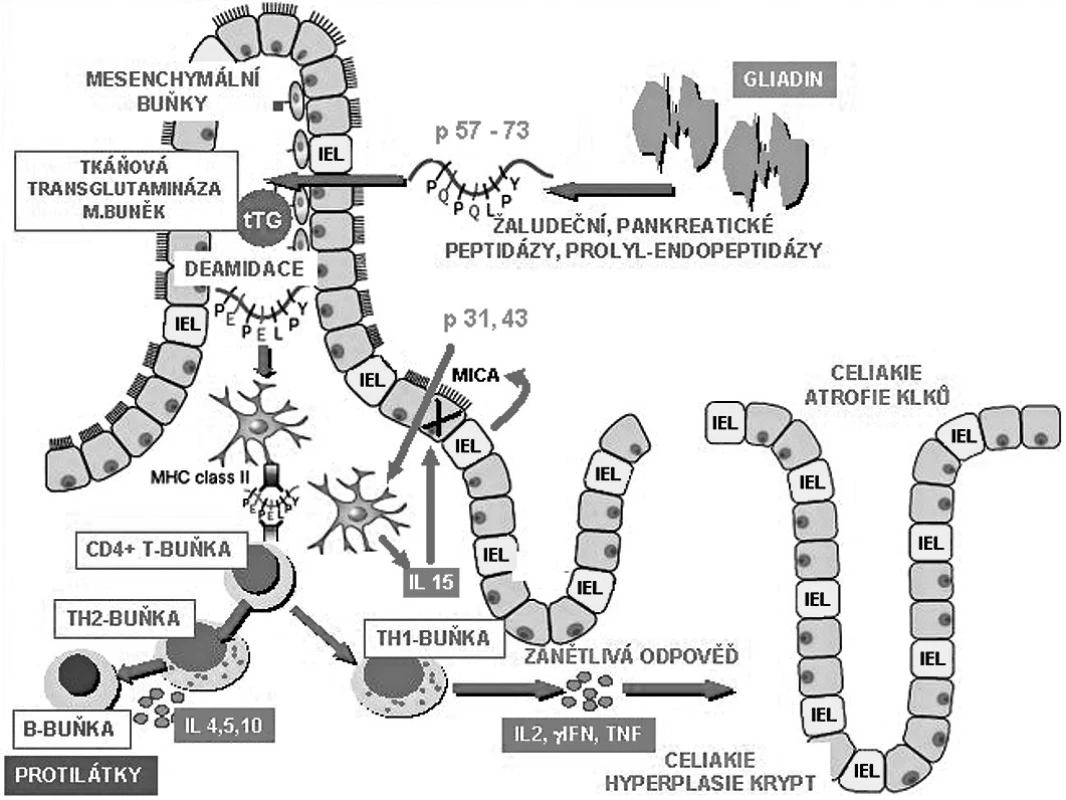
I když přesný etiopatogenetický mechanismus tohoto onemocnění není znám, je v této souvislosti zmiňována infekce, jako možný spouštěcí moment autoimunitní reakce (1). Prokázána byla závislost na době zařazení obilovin do stravy kojenců (13).
Důležitou charakteristikou tohoto autoimunitního onemocnění je produkce autoprotilátek. Za hlavní autoantigen je považována tkáňová transglutamináza. Přesný patogenetický mechanismus účinku těchto protilátek není znám, ale jejich průkaz je pro celiakii vysoce specifický i vysoce senzitivní. Protilátky antigliadinové jsou pro celiakii jen málo specifické (14).
Studie prokazující vysokou prevalenci neurologických poruch, kožních, kloubních projevů či infertility u pacientů s celiakií a jejich ústup či zlepšení po zavedení bezlepkové diety naznačují asociaci mezi celiakií a těmito mimostřevními orgánovými projevy. Stále nejsou známy patogenetické mechanismy těchto projevů. Předpokládá se uplatnění různou měrou jak mechanismů imunitních, tak malabsorpce.
Klonální expanzí intraepiteliálních lymfocytů dochází k rozvoji lymfomu jakožto možné komplikace celiakie (2, 8).
Celiakie se často sdružuje s jinými autoimunitními chorobami, jako Hashimotovou thyroiditidou (15), diabetem I. typu (16), psoriázou (17), ale také se systémovými onemocněními pojiva.
Klinické projevy celiakie
Podle klinických projevů rozlišujeme formy aktivní, tiché a latentní (18, 19). Aktivní formy onemocnění mají klasickou triádu malabsorpčního syndromu s průjmy (steatorhea), únavou a hmotnostním úbytkem, doprovázené karencí živin, minerálů a vitaminů, a obvykle nejsou diagnostickým problémem. Diagnóze celiakie unikají zejména pacienti s tichou či latentní formou onemocnění. Tiché formy se projevují pouze necharakteristickými dyspeptickými obtížemi (bolesti břicha, nadýmání, nechutenství, ale i zácpa). Pacienti se mohou cítit jen unavení a nebo mohou mít řadu mimostřevních projevů tototo onemocnění, např. neurologické (ataxie, polyneuropatie, epilepsie) (20), kloubní (artralgie a artritidy) (21), psychiatrické (deprese), kožní (dermatitis herpetiformis Duhring) (22), hepatální projevy (23), kardiomyopatii či poruchu plodnosti (24)–(obr. 2). Podváha u pacientů s celiakií není pravidlem, naopak v okamžiku stanovení diagnózy má až třetina pacientů nadváhu. Latentní formy onemocnění nemají žádné gastrointestinální projevy.
Image 2. Orgánové projevy celiakie. 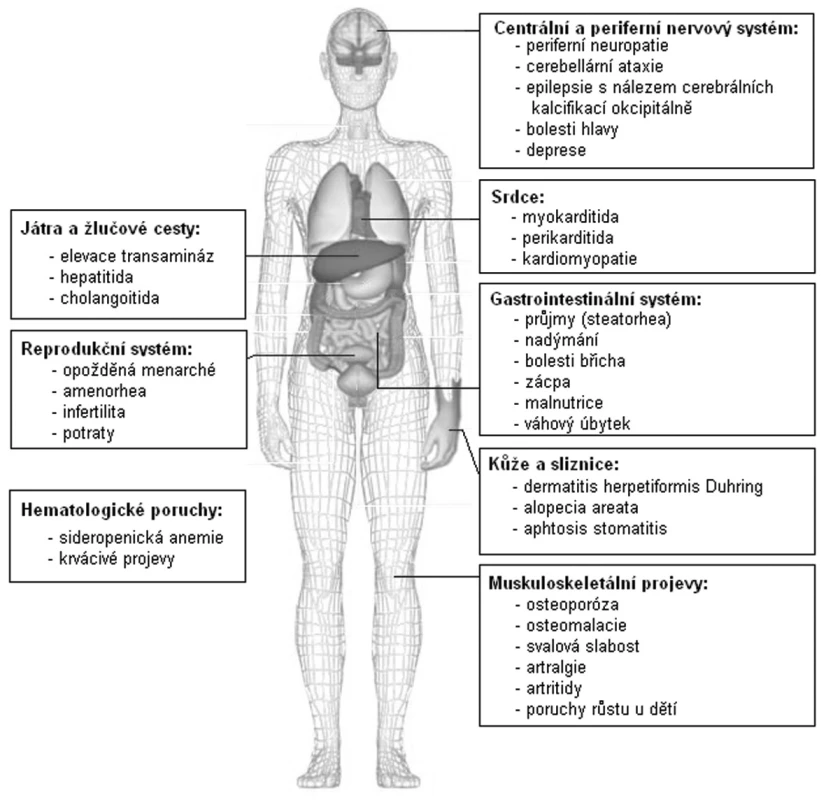
Diagnostika celiakie
Pro stanovení diagnózy je nutné provedení biopsie. U dospělých postačuje v rámci gastroskopie odběr z duodena pod oblastí Vaterské papily. V histologickém obraze střevní sliznice nacházíme různý stupeň atrofie sliznice, lymfoplazmocytární infiltraci, hypertrofii krypt a zvýšený počet intraepiteliálních lymfocytů (klasifikace Marsh I-IIIc). Histochemické vyšetření prokazuje enzymatické poruchy (1, 4). K biopsii jsou indikováni pacienti na základě hodnocení klinických a laboratorních známek malabsorpce a průkazu protilátek v séru typických pro celiakii: antigliadinových (AGA), endomyziálních (EmA), protilátek proti tkáňové transglutamináze (anti t-TG) a protilátek antiretikulinových (ARA) (11, 25–30).
Jak vyplývá z tabulky 1 antigliadinové protilátky jsou pro celiakii málo specifické, tj. bývají prokazovány i u jiných onemocnění, jako je ulcerózní kolitida a Crohnova choroba. Z hlediska specificity i senzitivity je suverénní metodou průkaz protilátek endomyziálních a proti tkáňové transglutamináze. Dříve byly AGA považovány za vysoce senzitivní protilátky pro diagnózu celiakie. Po zavedení vyšetřování EmA a anti t-TG protilátek význam antigliadinových protilátek poklesl. Senzitivita AGA je pro celiakii podle recentních studií pouze 76 % (2). Kromě těchto konvenčních testů jsou již k dispozici nové kity stanovující antigliadinové protilátky namířené pouze proti specifickým epitopům gliadinových peptidů. Senzitivita a specificita těchto protilátek pro celiakii by měla být obdobná jako u protilátek EmA a t-TG (31). EmA protilátky se prokazují nepřímou imunofluorescencí. V současné době je k tomuto vyšetření používána svalová tkáň z lidského pupečníku, čímž se tato metodika dříve využívající svalové tkáně opičích jícnů stala cenově dostupnější. Hodnocení tohoto testu samozřejmě vyžaduje dlouhodobé zkušenosti. Vyšetření protilátek proti t-TG Elisou používá buď morčecí antigeny, nebo nově lidské rekombinantní antigeny. Protilátky antiretikulinové (ARA) namířené proti komponentám extracelulární matrix hladkého svalstva trávicí trubice, periglomerulárního prostoru ledvin a periportálního prostoru jater, jsou detekovatelné pouze na tkáních hlodavců (32). Vyšetřují se jen IgA protilátky nepřímou imuno-fluorescencí, přičemž použitý substrát králičích ledvin je o něco senzitivnější než substrát myších ledvin (30). Vyšetření ARA protilátek se dnes používá spíše výjiměčně, pro celiakii jsou sice vysoce specifické, ale problémem je jejich nízká senzitivita.
Table 1. Vyšetření protilátek při celiakii. 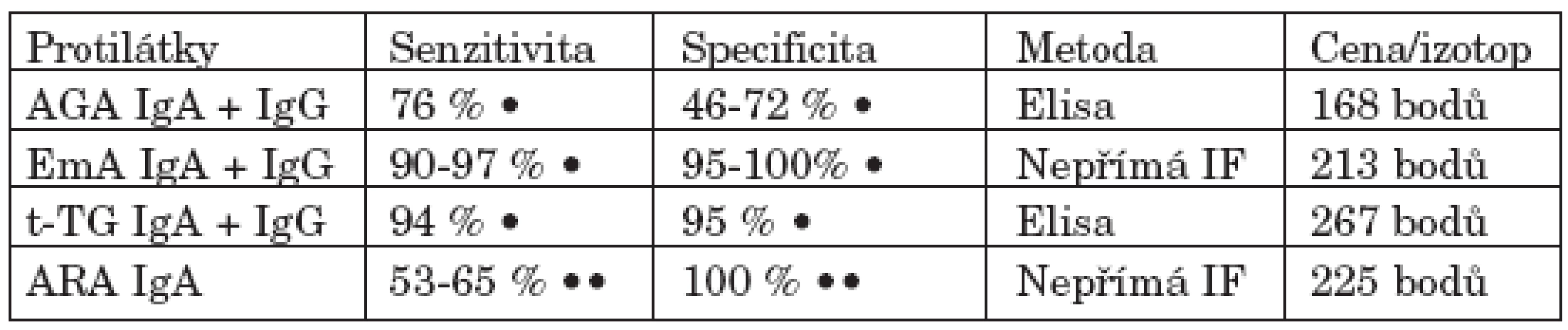
Vysvětlivky: AGA - antigliadinové protilátky EmA - endomyziální protilátky t - TG - protilátky proti tkáňové transglutamináze ARA - antiretikulinové protilátky IF - imunofluorescence • u dospělých pacientů •• u dětských pacientů (30) Jak tedy optimálně i s ohledem na cenu využít stanovení těchto protilátek ve screeningu celiakie? Nejvýhodnější se jeví ve screeningu použití protilátek endomyziálních pro jejich vysokou senzitivitu, specificitu a zároveň nižší finanční náročnost. Toto vyšetření je však náročné na dlouhodobou zkušenost vyšetřujícího. ELISA diagnostika protilátek proti t-TG je metodika jednoduchá, neklade přílišné nároky na zkušenost vyšetřujícího, jeho cena je však nejvyšší. Z důvodů finanční náročnosti lze vyšetřit pouze jeden izotyp protilátek (IgA nebo IgG). Je nutné si uvědomit, že nemocní s celiakií, kteří jsou např. IgA imunodeficitní, tyto specifické protilátky ve třídě IgA tvořit nebudou nebo jen v nesignifikantním množství.
Použijeme-li kombinace několika testů, kde jeden test je pozitivní, zvýšíme podle všeobecného pravidla senzitivitu na úkor specificity vyšetření. Při požadavku současné pozitivity všech testů, dosáhneme vyšší specificity. Z tohoto pohledu byla posuzována kombinace IgA AGA a IgA EMA v jedné studii u dětských pacientů. Vyšetřením obou těchto protilátek senzitivita dosáhla 100 %, pokud jeden výsledek byl pozitivní, specificita však byla 73 %. Při požadavku konkordance se specificita zvýšila na 93 % (25).
Rizikovými osobami, u kterých by se screennig měl provádět, jsou příbuzní pacientů s celiakií, pacienti s osteoporózou či osteomalacií, kteří kromě průjmů udávají i jiné dyspeptické obtíže a také pacienti, u kterých nemáme pro osteoporózu a osteomalacii jiné vysvětlení (muži, premeopauzální ženy). Rovněž mezi pacienty s nevysvětlenou sideropenickou anémii, se mohou skrývat nemocní s celiakií. Provádět screening u všech pacientů s osteoporózou není účelné. Screening celiakie má smysl provádět také při nevysvětlené neplodnosti (24, 33), neurologických symptomech (polyneuropatie nejasné etiologie, ataxie, epilepsie s cerebrálními kalcifikacemi okcipitálně) (20) a tzv. nediferencovaných spondylartritidách, HLA B27 neg.
Kromě screeningu je vyšetření protilátek AGA, EmA a anti t-TG používáno i ke sledování efektu terapie (6). Při dobrém efektu bezlepkové diety a compliance pacienta titry těchto protilátek klesají k normálním hodnotám. Náhlý zřetelný vzestup celkové hladiny IgA může signalizovat rozvoj maligního lymfomu.
Celiakie v ambulanci revmatologa
V jakých situacích se tedy může revmatolog setkat s pacientem s dosud nediagnostikovanou celiakií? (tab. 2). Jsou to především pacienti s osteoporózou či osteomalacií. Na celiakii je třeba myslet při vyšetření pacienta s bolestmi kloubů nejasného původu doprovázenými únavou, svalovou slabostí, zažívacími obtíže event. neurologickými obtížemi (polyneuropatie), jedná se především o depresivně laděné osoby. Artralgie mohou během několika let přejít v artritidy (34).
Table 2. Muskuloskeletální projevy při celiakii. 
Vzhledem k časté koincidenci celiakie s jinými autoimunitními chorobami (až 30 % pacientů s celiakií trpí zároveň na jiné autoimunitní onemocnění), se může revmatolog častěji setkat s celiakií u pacientů se systémovými onemocněními pojiva. Zvláštní pozornost je třeba věnovat pacientům se Sjögrenovým syndromem, protože výskyt celiakie u pacientů se Sjögrenovým syndromem je oproti běžné populaci desetinásobný (35).
Celiakie a osteoporóza
Studie zabývající se prevalencí celiakie u pacientů s nízkou BMD (denzitou kostní tkáně) zjišťují, že 0,9 až 3,4 % pacientů s osteoporózou má celiakii. Screening celiakie u dětských pacientů s nízkou BMD prokázal v 5 % diagnózu celiakie (16, 36). Přesto výsledky řady těchto studií lze obtížně interpretovat pro metodologické nedostatky. Jsou v nich totiž zahrnuti i pacienti séropozitivní bez následného bioptického potvrzení diagnózy. Ve studii provedené ve Velké Británii na 978 pacientech s nízkou hodnotou BMD, byla biopticky celiakie prokázána u 2,1 % pacientů s osteoporózou a 1,2 % s osteopenií. Pokud byli k screeningu vybráni pouze pacienti s poklesem BMD a minimálními gastrointestinálními projevy či anemičtí, prevalence celiakie byla u osteoporotických pacientů 3,9 % a u osteopenických 2,6 %. Nedoporučuje se proto provádět screening u všech pacientů s osteoporózou, efektivnější je vyčlenit ke screeningu rizikové skupiny osob (37).
V patogenezi osteoporózy a osteomalacie u pacientů s celiakií se uplatňuje steatorheou a úbytkem resorpční plochy porušená střevní absorpce vápníku a vitaminu D, ale také další mechanismy jako nízký příjem vápníku z důvodů laktózové intolerance, sekundární hyperparathyreóza a působení prozánětlivých cytokinů aktivujících osteoklasty zvýšenou expresí RANKLu (ligand pro receptor aktivující nukleární faktor kappa B) na povrchu stromálních buněk (38).
Pro osteoporózu pacientů s celiakií platí, že může vzniknout i bez průjmů, bez skeletálních bolestí, bez biochemických abnormalit a i během bezglutenové diety (v případě laktózové intolerance) (39). Pokles BMD se týká zejména periferního skeletu, důvodem je hyperparathyreóza, která relativně šetří axiální skelet. Snížená denzita v periferním skeletu přetrvává i při dobré odpovědi na léčbu a normalizaci BMD na páteři (40).
Základem terapie osteoporózy při celiakii je kromě bezlepkové diety substituce vápníku a D vitaminu (7, 41, 42). Po zavedení bezlepkové diety trvá minimálně rok (podle stupně postižení střevní sliznice) než dojde k obnově struktury střevní sliznice a normalizaci střevní absorpce Ca a D vitaminu, minimálně 2 roky trvá po zavedení bezlepkové diety remineralizace kostní tkáně. Pacientů s celiakií diagnostikovanou a léčenou od dětského věku již dosahují hodnot kostní denzity porovnatelné s běžnou populací (43).
Méně často se u pacientů s celiakií setkáváme s osteomalacií s typickou hypokalcemií, hypofosfatemií, velmi nízkou kalciurií a vysokou kostní frakcí alkalické fosfatázy (44).
Celiakie jako příčina enteropatické artritidy
Celiakie stejně jako Crohnova choroba a ulcerózní kolitida může být příčinou enteropatické artritidy. Enteropatické artritidy jsou séronegativní, neerozivní, výjimečně však dochází i k erozivnímu postižení (21). Enteropatické artritidy představují podskupinu séronegativních spondyl-artropatií (45). Kloubní postižení při enteropatických artritidách zahrnuje typicky periferní i axiální kloubní postižení – sakroileitidu s nebo bez spondylitidy, také však tendinitidy a entezopatie. Periferní kloubní postižení je klasifikováno do 2 typů. U HLA B 27 pozitivních je to především Typ 1 – pauciartikulární (postihuje méně než 5 kloubů) s asymetrickým postižením s převahou na dolních končetinách, akutním průběhem, související s relapsem střevního zánětu, self-limiting (samo odeznívajícím přibližně do 10 týdnů). Typ 2 s polyartikulárním postižením, probíhající nezávisle na aktivitě střevního zánětu, přetrvává měsíce i roky. Tento druhý typ kloubního postižení je charakteristický i pro pacienty s celiakií. Asociace s HLA B 27 u tohoto typu postižení nebyla prokázána.
Přesná patogeneze kloubních změn při zánětlivých střevních onemocněních je nejasná. Klíčovou roli zřejmě hrají cirkulující antigen specifické T lymfocyty pocházející ze střeva a pronikající do synovie kloubu. Předpokládá se uplatnění zvýšené permeability střevní sliznice a kolonizace zánětlivých lézí anaerobními bakteriemi, které vedou k absorpci prozánětlivých bakteriálních komponent stimulujících patologickou imunitní odpověď. Průkaz přítomnosti bakteriálních komponent či DNA v kloubu pacienta s enteropatickou artritidou je toho důkazem (46). Teorie imunokomplexového postižení se ukázala málo pravděpodobná, jelikož cirkulující imunokomplexy složené z bakteriálních antigenů a sekretorických IgA imunoglobulinů nebyly v synovii artritického kloubu nalezeny (21).
Poprvé byla popsána asociace celiakie s artritidou teprve Adelizzim v roce 1982 (47). Lubrano s kol. vyšetřením 200 pacientů s celiakií zjistil výskyt artritidy u 26 % z nich, přičemž periferní artritidu mělo 19 (36,5 %) pacientů, axiální 15 (28,8 %) a kombinované postižení 18 (34 %) z nich. Nezáleželo na délce trvání střevního onemocnění (48). Kloubní projevy mohou předcházet manifestaci střevního zánětu. Byla popsána řada případů axiální či periferní artritidy při absenci střevních obtíží, u nichž se jednalo o tichou formu celiakie (49–52). Nejčastěji kloubní postižení probíhá pod obrazem symetrické artritidy velkých kloubů – ramen, kyčlí a kolen (21, 34). Byly ovšem popsány i případy monoartritidy (53), oligoartritidy či artritidy drobných kloubů. Většinou mají artritidy neerozivní charakter (na rtg jsou změny pouze ve smyslu otoku měkkých tkání a zúžení kloubní štěrbiny) a přibližně u poloviny z nich jsou doprovázeny axiálním postižením – sakroileitidou, častěji jednostrannou (u 80 %), a spondylitidou. Mohou být vyjádřeny jak rentgenové, tak scintigrafické změny svědčící pro entezopatie (48, 49). Scintigraficky prokázanou sakroileitidu mělo 63,6 % pacientů s celiakií (54).
Základem terapie kloubních projevů u celiakie je zavedení bezlepkové diety, klid, terapie NSA, intraartikulární aplikace kortikoidů. V některých případech je nutné přistoupit k celkové léčbě kortikoidy. Remise artritidy byla zaznamenána u většiny pacientů po zavedení bezlepkové diety, pouze u 21 % pacientů kloubní obtíže perzistovaly (48). Opětovná expozice lepku navodila relaps artritidy či sakroileitidy (34).
Výskyt celiakie u pacientů se systémovými onemocněními pojiva
Luft v roce 2003 publikoval práci zabývající se výskytem celiakie mezi pacienty se systémovými onemocněními pojiva. K vyhledávání pacientů s celiakií byl použit screening protilátkami proti tkáňové transglutamináze, přičemž u 4 z 5 pacientů s pozitivními protilátkami byla následně celiakie potvrzena biopticky. Jak vyplývá z grafu znázorňujícího výsledky této studie, bylo jednoznačně největší zastoupení celiakie u pacientů se Sjögrenovým syndromem (graf 1) (55). I další práce potvzují zhruba desetiprocentní výskyt celiakie u dospělých pacientů se Sjögrenovým syndromem (SS) (35, 51, 56). Stagi prokázal 6,6% výskyt celiakie u dětských pacientů s juvenilní chronickou artritidou (57).
Graph 1. Průkaz protilátek proti tkáňové transglutamináze u pacientů se systémovými onemocněními pojiva (55). Vysvětlivky: SS – Sjögrenův syndrom SSc – systémová sklerodermie SLE – systémový lupus erythematodes RA – revmatoidní artritida KONTR. – kontrolní skupina 
Důvodem vysoké asociace SS a celiakie je zřejmě podobný genetický profil pacientů. I SS se častěji vyskytuje u nositelů HLA DQ2.
Na základě těchto zjištění se doporučuje provádět screening celiakie mezi pacienty se SS, minimálně u těch, kteří jsou anemičtí a stěžují si na zažívací obtíže.
ZÁVĚR
Revmatolog by měl v diferenciální diagnostice artralgií, periferních artritid, sakroileitid, osteoporózy či osteomalacie myslet i na možnost, že se setkává s pacientem s nediagnostikovanou celiakií, a to i když pacient netrpí na průjmy a ani jiné zažívací obtíže.
MUDr. Lenka Franeková
Revmatologické a rehabilitační odd.
Fakultní Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4 – Krč
e-mail: lenka.franekova@centrum.cz
Sources
1. Kagnoff MF. Overview and pathogenesis of celiac disease. Gastroenterology 2005; 128, Suppl 1 : 10–18.
2. Heel DA, West J. Recent advances in coeliac disease. Gut 2006; 55 : 1037–1046.
3. Rewers M. Epidemiology of celiac disease: What are the prevalence, incidence, and progression of celiac disease? Gastroenterology 2005; 128, Suppl 1 : 47–51.
4. Mäki M, Collin P. Celiac disease. Lancet 1997; 349 : 1755–1759.
5. Kohout P. Diagnostika a léčba celiakie. Interní Med 2006; 7 + 8 : 324–326.
6. Pietzak MM. Follow up of patient with celiac disease: achieving compliance with treatment. Gastroenterology 2005; 128, Suppl 1 : 135–141.
7. Kupper S. Dietary guidelines and implementation for celiac disease. Gastroenterology 2005; 128, Suppl 1 : 121–127.
8. Catassi C, Bearzi I, Holmes GK. Association of celiac disease and intestinal lymphomas and other cancers. Gastroenterology 2005; 128, Suppl 1 : 79–86.
9. Holmes GK, Prior P, Lane MR, et al. Malignancy in celiac disease – efect of gluten free diet. Gut 1989; 30 : 333–338.
10. Collin P. Should adults be screened for celiac disease? What are the benefits and harms of screening? Gastroenterology 2005; 128, Suppl 1 : 104–108.
11. Ilavská A, Paulovičová E, Mikulecký M. Význam vyšetrenia sérologických markerov u pacientov s celiakiou. Čas Lék čes 2002; 141(15): 487–490.
12. Liu E, Rewers M, Eisenbarth GS. Genetic testing: who should do the testin and what is the role of genetic testing in the setting of celiac disease. Gastroenterology 2005; 128, Suppl 1 : 33–37.
13. Ivarsson A. Swedish epidemic of coeliac disease explored using an epidemiological approach some lessons to be learnt. Best Pract Res Clin Gastroenterol 2005; 19 : 425–440.
14. Bureš J, Horáček J, et al. Základy vnitřního lékařství. Praha: Galén, 2003 : 294–297.
15. Fanciulli G, Tomasi PA, Caucci F, et al. Screening for celiac disease in patients with autoimmune thyroid disease: from reseach studies to daily clinical practice. Ann Ital Med Int 2005; 20 : 39–44.
16. Murray JA. Celiac disease in patients with an affected member, type 1 diabetes, iron–deficiency or osteoporosis? Gastroenterology 2005; 128, Suppl 1 : 52–56.
17. Michaelson G, Gerden B, Hagforsen E, et al. Psoriasis patients with antibodies to gliadin can be improved by a gluten-free diet. Br J Dermatol 2000; 142 : 44–51.
18. Dewar DH, Ciclitira PJ. Clinical features and diagnosis of celiac disease. Gastroenterology 2005; 128, Suppl 1 : 19–24.
19. Green PHR. The many faces of celiac disease: clinical presentation of celiac disease: clinical presentation of celiac disease in the adult population. Gastroenterology 2005;128, Suppl 1 : 74–78.
20. Bushara KO. Neurologic manifestation of celiac disease. Gastroenterology 2005;128, Suppl 1 : 92–97.
21. Holden W, Orchard T, Wordsworth P. Enteropathic arthritis. Rheum Dis Clin N Am 2003; 29 : 513–530.
22. Zone JJ. Skin manifesation of celiac disease. Gastroenterology 2005; 128, Suppl 1 : 87–91.
23. Duggan JM, Duggan AE. Liver in celiac disease. Aliment Pharmacol Ther 2005; 21 : 515–518.
24. Tata LJ, Card TR, Logan RFA, et al. Fertility and pregnancy – related events in women with celiac disease: a population – based cohort study. Gastroenterology 2005; 128, Suppl 1 : 849–855.
25. Rostom A, Dubé C, Cranney A, et al. The diagnostic accurancy of serologic tests for celiac disease: a systematic review. Gastroenterology 2005; 128, Suppl 1 : 38–46.
26. Hill ID. What are the sensitivity and specificity of serologic tests for celiac disease? Do sensitivity and specificity vary in different populations? Gastroenterology 2005; 128, Suppl 1 : 25–32.
27. Kocna P, Vaníčková Z, Perušičová J, Dvořák M. Tissue transglutaminase – serology markers for celiac disease. Clin Chem Lab Med 2002; 40 (5): 485–492.
28. Carroccio A, Cavataio F, Iacono G, et al. IgA antiendomysial antibodies on the umbilical cord in diagnosis celiac disease. Sensitivity, specificity and comparative evaluation with the traditional kit. Scand J Gastroenterol 1996; 31 : 759–763.
29. Zintzaras E, Germenis AE. Performance o antibodies againts tissue transglutaminase for the diagnosis of celiac disease: meta-analyses. Clin Vaccine Immunol 2006; 13 : 187–192.
30. Lerner A, Kumar V. Immunological diagnosis of childhood coeliac disease: comparison between antigladin, antireticulin and antiendomysial antibodies. Clin Exp Immunol 1994; 95 : 78–82.
31. Prince HE. Evolution of the INOVA diagnostics enzyme-linked immunosorbent assay kits for measuring serum immunoglobulin G (IgG) and IgA to deamidated gliadin peptides. Clin Vaccine Immunol 2006; 13 (1): 150–151.
32. Valeski JE, Kumar V, Beutner EH, et al. Immunology of celiac disease: tissue and species specifity of endomysial and reticulin antibodies. Int Arch Allergy Appl Immunol 1990; 93 : 1–7.
33. Vančiková Z, Chlumecký V, Sokol D, et al. The serologic screening for celiac disease in the general population (blood donors) and in some high-risk groups of adults (patients with autoimmune disease, osteoporosis and infertility) in the Czech Republic. Folia Microbiol 2002; 47 : 753–758.
34. Bourne JT, Kumar P, Huskisson EC, et al. Arthritis and coeliac disease. Ann Rheum Dis 1985; 44 : 592–598.
35. Szodoray P, Barta Z, Lakos G, et al. Coeliac disease in Sjögren’s syndrome – a study of 111 Hungarian patients. Rheumatol Int 2004; 24 : 278–282.
36. Dubé C, Rostom A, Sy R, et al. Prevalence of celiac disease in average-risk and at-risk Western European populations: a systematic review. Gastroenterology 2005, 128, Suppl 1 : 57–67.
37. Sanders DS, Patel D, Khan FB, et al. Case – finding for adult celiac disease in patients with reduced bone mineral density. Dig Ds Sci 2005; 50 : 587–592.
38. Keaveny AP, Freaney R, McKenna MJ, et al. Bone remodeling indices and secondary hyperparathyroidism in celiac disease. Am J Gastroenterol 1996; 91 (6): 1226–1231.
39. Marsh MN. Bone disease and gluten sensitivity: time to act, to treat, and to prezent. Am J Gastroenterol 1994; 89, 2105–2107.
40. Selby PL, Davies M, Adams JE, et al. Bone loss in celiac is related to secondary hyperparathyroidism. J Bone Miner Res 1999; 14 : 652–657.
41. Kocián J. Osteoporóza a osteomalacie. Praha: Triton, 1997 : 59–65.
42. Kocián J. Sekundární osteopenie u gastrointestinálních chorob. Vntřní Lék 1993; 39 : 125–131.
43. Mora S, Barera G, Beccio S, et al. Bone density and bone metabolism are normal after long - term gluten free diet in young celiac patiens. Am J Gastroenterol 1999; 94 : 398–403.
44. Broulík P. Osteoporóza. Praha: Maxdorf Jessenius, 1999 : 105–116.
45. Žlnay D, Mateička F, Rovenský J. Séronegativní spondylartritidy. V: Pavelka K, Rovenský J. Klinická revmatologie. Praha: Galén, 2003; 345–389.
46. Uksila J, Toivanen P, Granfors K. Enteric infections and arthritis: bacteriological aspects. In: Calin A, Taurog J. Spondylarthritides. Oxford : Oxford University Press, 1998 : 167–177.
47. Adelizzi RA, Pecora AA, Chiesa JC. Celiac disease: case report with an associated with arthropathy. Am J Gastroenterol 1982; 77 : 481–483.
48. Lubrano E, Ciacci C, Ames PRJ, et al. Arthritis of coeliac disease: prevalence and pattern in 200 adult patients. Br J Rheumatol 1996; 35 : 1314–1318.
49. Slot O, Locht H. Arthritis as presenting symptom in silent adult coeliac disease. Scand J Rheumatol 2000; 29 : 260–263.
50. Summers GD, Hankey GL, Holmes GKT. Oligoartritis – a presenting feature of occult coeliac disease. Br J Rheumatol 1993; 32 : 262.
51. Collin P, Korpela M, Hällström O, et al. Rheumatic complaints as a presenting symptom in patients with coeliac disease. Scand J Rheumatol 1992; 21 : 20–23.
52. Mäki M, Hällström O, Viander M, et al. Reticulin antibody, arthritis and coeliac disease in children. Lancet 1988; 1 : 479–480.
53. Borg AA, Dawes PT, Swan CH, et al. Persistent monoarthritis and ocult coeliac disease. Postgradual Med J 1994; 70 : 51–53.
54. Usai P, Boi MF, Piga M, et al. Adult celiac disease is frequently associated with sacroiliitis. Dig Dis Sci 1995; 40 : 1906–1908.
55. Luft LM, Barr SG, Martin LO, et al. Autoantibodies to tissue transglutaminase in Sjögren’s syndrome and related rheumatic disease. J Rheumatol 2003; 30 : 2613–2619.
56. Iltanen S, Collin P, Korpela M, et al. Celiac disease and markers of celiac disease latency in patients with primary Sjögren’s synrome. Am J Gastroenterol 1999; 94 : 1042–1046.
57. Stagi S, Giani T, Simonini G, et al. Thyroid function, autoimmune thyroiditis and coeliac disease in juvenile idiopathic arthritis. Rheumatology 2005; 44 : 517–520.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2007 Issue 4-
All articles in this issue
- Plazmatické buňky jako marker predikující odpověď na anti-TNF léčbu
- Prokalcitonin v diagnóze bakteriální infekce u nemocných s autoimunitními revmatickými chorobami
- Muskuloskeletální projevy při celiakii
- Rabdomyolýza, stručná kazuistika a komentář
- Destrukce kyčelního kloubu se sekundární synoviální osteochondromatózou u nemocné s revmatoidní artritidou
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rabdomyolýza, stručná kazuistika a komentář
- Destrukce kyčelního kloubu se sekundární synoviální osteochondromatózou u nemocné s revmatoidní artritidou
- Muskuloskeletální projevy při celiakii
- Prokalcitonin v diagnóze bakteriální infekce u nemocných s autoimunitními revmatickými chorobami
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

