-
Medical journals
- Career
Intrauterinní adheze a jejich prevence
Authors: M. Emingr; M. Halaj; M. Malčák; J. Hanáček
Authors‘ workplace: Ústav pro péči o matku a dítě, Praha
Published in: Ceska Gynekol 2023; 88(3): 210-213
Category:
doi: https://doi.org/10.48095/cccg2023210Overview
Intrauterinní adheze jsou závažnou komplikací, která vzniká po intrauterinních výkonech, nejčastěji v souvislosti s graviditou. Projevy jako amenorea, pellipatia a neplodnost jsou pro ženu závažné obzvláště v reprodukčním věku a nazýváme je spolu s intrauterinními adhezemi Ashermanovým syndromem. Důležitá je primární prevence po intrauterinních výkonech. Z publikovaných studií vyplývá, že použití gelu kyseliny hyaluronové především po abortech vede k prevenci vzniku středních a těžkých intrauterinních adhezí a zvyšuje také míru otěhotnění.
Klíčová slova:
prevence – kyselina hyaluronová – intrauterinní adheze – Asherman – potraty
Úvod
Intrauterinní adheze (IUA) jsou vazivové adhezivní pruhy způsobující částečnou nebo úplnou obliteraci dělohy [1] a byly poprvé popsány Josephem G. Ashermanem v roce 1948 [2]. Příčinou adhezí je trauma, tedy poškození bazální membrány při instrumentální revizi dutiny děložní (RCUI – revisio cavi uteri instrumentalis), při postpartálním krvácení, myomektomii anebo hysteroskopické operaci (HSK). I když mírné IUA mohou být klinicky asymptomatické, střední až těžké IUA mohou vést k Ashermanově syndromu, což je označení, které se používá v přítomnosti IUA v kombinaci s klinickými symptomy, jako je hypomenorea, habituální potrácení, amenorea, sterilita a pelvialgie [3,4]. Patofyziologie formace IUA spočívá v kombinaci několika patologických mechanizmů zahrnující fibrózu a zjizvení endometria, ztrátu nebo ztenčení endometria s různým stupněm poškození bazální vrstvy, atrofii žláz, nedostatek a hypoxii vaskulární stromální tkáně a v anemickém bledém mikroprostředí v oblasti adhezí (obr. 1) [5]. Závažnost IUA je důležité klasifikovat, protože stupeň postižení nám poskytuje informace o nejvhodnějším terapeutickém režimu a nabízí lepší predikci výsledků po léčbě. Bylo navrženo několik klasifikačních systémů. Nejčastěji se používá skórovací systém dle AFS (American Fertility Society). Klasifikace dle AFS pro IUA byla vytvořena v roce 1988 a zahrnuje tři položky:
• rozsah postižení dutiny;
• typ adhezí;
• charakter menstruace.
Image 1. Patogeneze formace intrauterinní adheze [28].
Fig. 1. Pathogenesis of intrauterine adhesion formation [28].![Patogeneze formace intrauterinní adheze [28].<br>
Fig. 1. Pathogenesis of intrauterine adhesion formation [28].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5337ac3c9409542b29a5eb59b40456b7.jpg)
Dle výsledného skóre vytváří tři prognostické klasifikace:
• stupeň I (mírné);
• stupeň II (střední);
• stupeň III (těžké) (tab. 1) [6].
Table 1. Klasifikace skórovacího systému American Fertility Society pro intrauterinní adheze.
Tab. 1. Classification of the American Fertility Society scoring system for intrauterine adhesions.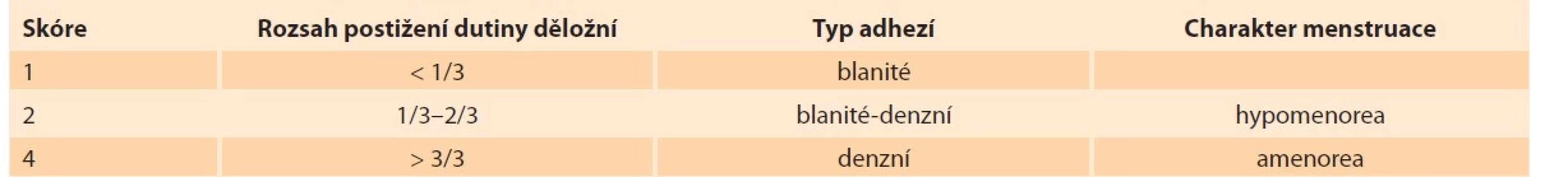
Mírné (stupeň I): skóre od 1 do 4; střední (stupeň II): skóre od 5 do 8; těžké (stupeň III): skóre ≥ 9. Poslední metaanalýza uvádí prevalenci IUA po provedeném RCUI po potratu v I. trimestru okolo 19 %, přičemž z toho ve 42 % se jedná o střední až těžké IUA dle AFS skóre [7]. Byla popsána přímá souvislost, kdy s rostoucím počtem opakujících se výkonů u jedné pacientky nebo s výkony v pokročilejší stadiích gestace (s větší velikostí nitroděložního obsahu) roste riziko formace IUA. Také po provedení RCUI po zamlklém těhotenství je větší riziko formace IUA než po výkonu pro inkompletní potrat. To je vysvětleno fibroblastickou aktivitou zbytkové placentární tkáně [8]. Pro diagnostiku IUA používáme transvaginální ultrazvuk, sonohysterografii (SHG) a diagnostickou hysteroskopii. Dynamická SHG s infuzí fyziologického roztoku do děložní dutiny (senzitivita až 62,5 % a specifita až 98 %) umožňuje vizualizaci děložní dutiny se znázorněním průchodnosti vejcovodů, přičemž zejména 3D SHG zobrazení vysoce koreluje s hysteroskopickými nálezy (morfologické abnormality, defekty ve stěně, obliterace dutiny, fibrózy a kalcifikace) [9]. V současné době se pro léčbu IUA používá hysteroskopická adheziolýza jako zlatý standard (obr. 2), nicméně je s ní spojena vysoká míra rekurence dosahující až 62,5 % [10]. Proto je důležitá prevence po intrauterinních výkonech.
Image 2. Hysteroskopická adheziolýza středně těžkých adhezí.
Fig. 2. Hysteroscopic adhesiolysis of moderate adhesions.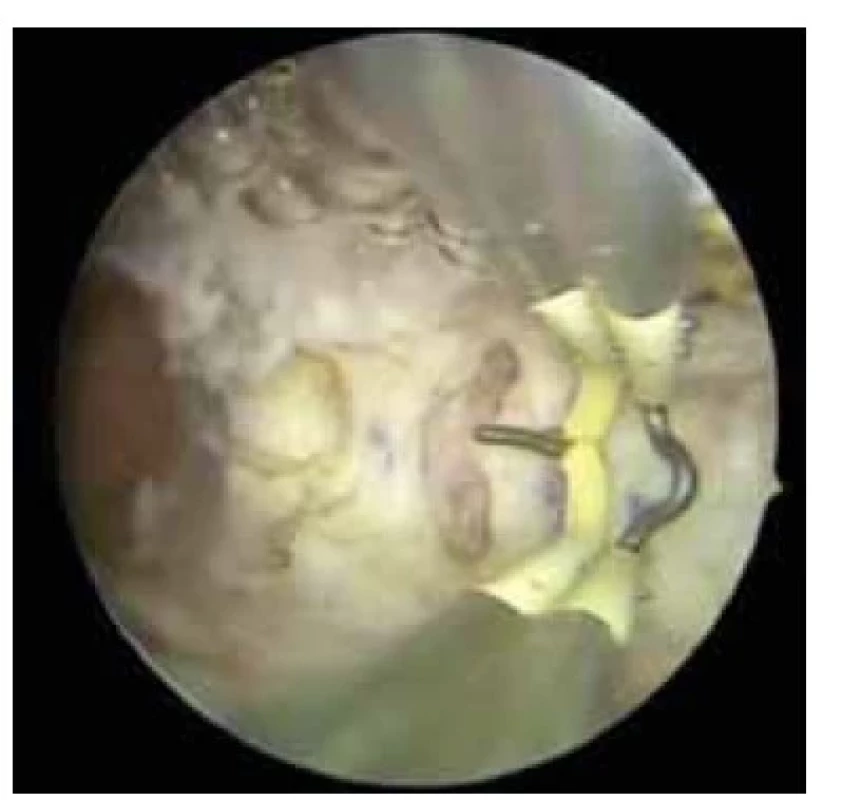
Adjuvantní terapie po intrauterinních výkonech
Gel kyseliny hyaluronové (HAG – hyaluronic acid gel) je vysoce polymerizovaný mukopolysacharid. Váže se s velkým množstvím molekul vody a zlepšuje hydrataci tkání, zvyšuje odolnost buněk vůči mechanickému poškození a snižuje tvorbu posttraumatické granulační a vazivové tkáně. Díky své jedinečné biokompatibilitě a enzymatické biodegradaci se HAG často používá k prevenci pooperačních srůstů [11]. Nyní se navíc využívá její tzv. crosslinkingová modifikace, což je efektivní způsob, který zpomaluje degradaci gelu a zvyšuje jeho viskozitu in vivo [12]. HAG je používán po intrauterinních operacích k prevenci IUA, protože její aplikace udržuje hojící se děložní stěny od sebe oddělené 5–7 dní, což je kritický čas k utvoření těchto adhezí, až poté dojde ke kompletní absorpci. HAG reguluje zánětlivé faktory a podporuje normální regeneraci endometria. Aplikace gelu do dutiny děložní je snadná přes aplikátor a stačí velmi malé množství, protože intrauterinní dutina pojme maximálně 3 ml tekutiny, poté uniká skrz dilatované hrdlo děložní.
V poslední důležité metaanalýze čítající sedm prospektivních randomizovaných studií [13–19] byl prokázán zásadní preventivní efekt HAG, protože podstatně snižuje formaci IUA (RR 0,44; CI 95%) a snižuje AFS skóre po intrauterinní operaci nezávisle na typu operace (HSK resekce či RCUI) a nezávisle na primární diagnóze. Snižuje incidenci středně těžkých a závažných adhezí (RR 0,18; 95% CI), ale nemá efekt na mírné adheze [20]. Ve dvou studiích, které se zabývaly vlivem na další těhotenství, se navíc prokázalo, že HAG zvyšuje míru otěhotnění (RR 1,94; 95% CI). Žádná z těchto studií však neuvedla další podrobnosti, jako je používání antikoncepce nebo počet živě narozených dětí [13,19]. Když se zaměříme na prevenci IUA po potratech, které vyžadují provedení RCUI, vycházíme z multicentrické randomizované prospektivní studie od Hooker et al, který zkoumal prevalenci IUA po aplikaci HAG u žen s anamnézou alespoň jedné předchozí kyretáže [14]. Po intrauterinním výkonu (RCUI) v I. trimestru aplikoval HAG do dutiny děložní. Poté následovala diagnostická hysteroskopie, která byla provedena 8–12 týdnů po RCUI. Výsledky potvrzují, že aplikace gelu po RCUI významně snížila formaci IUA (RR 0,43; 95% CI) a snížila AFS skóre oproti kontrolní skupině. Tato prospektivní studie pokračovala a její recentní závěr dokazuje, že u skupiny pacientek léčených HAG se nejenže zkrátila doba otěhotnění vedoucí k porodu živého plodu (21,9 vs. 36,2 měsíce), snížilo se riziko hypomenorey (7,5 vs. 20,3 %) a dysmenorey (14,9 vs. 34,4 %), ale také se zvýšila četnost probíhajících těhotenství (74,6 vs. 67,2 %) než u pacientek bez léčby, což naznačuje, že aplikace HAG po provedené RCUI pro potrat je prospěšná pro následnou reprodukční schopnost u žen s alespoň jednou předchozí kyretáží [21]. V předchozích letech se zkoumalo zavedení Foleyeho katétru nebo nitroděložního tělíska (IUD – intrauterine device) jako prevence IUA obecně po intrauterinním výkonech. Dosud ale neexistují žádné jasné dlouhodobé ukazatele svědčící v jejich prospěch. Je možné, že udržují anatomický tvar dutiny děložní, ale je nepravděpodobné, že obnovují normální funkci endometria [22,23]. Abu Rafea et al [24] navíc prokázali, že zavedení Foleyeho katétru nemá signifikantní vliv na míru otěhotnění. Co se týče srovnání zavedení IUD a intrauterinní aplikace HAG, studie [25] uvádí, že po hysteroskopické adheziolýze s použitím HAG vs. se zavedením IUD k obnovení normálního menstruačního cyklu dochází v 60,0 vs. v 55,5 % případů. Míra otěhotnění u pacientek s aplikovaným HAG je 77,7 %, což je významně vyšší hodnota ve srovnání s pacientkami léčenými zavedením IUD (60,0 %). Z této tuzemské studie a také z nedávné zahraniční metaanalýzy máme průkaz, že aplikace HAG zvyšuje míru otěhotnění než při zavedení IUD (RR 1,58; 95% CI) nebo Foleyeho katétru s dodatkem, že kombinace metod (aplikace HAG + zavedení IUD) se neukazuje jako statisticky signifikantní [26]. Efekt HAG po hysteroskopické adheziolýze byl prokázán už v roce 2004 prospektivní randomizovanou studií [12], kde při 3měsíčním follow-up došlo k signifikantnímu snížení formací IUA a ke snížení skóre AFS. Dlouhodobé výsledky byly také hodnoceny v nedávné retrospektivní studii, která se zabývala hysteroskopickou adheziolýzou s aplikací HAG pro střední až těžké IUA. Tato kombinace léčby signifikantně snižuje následné AFS skóre, upravuje kvalitu endometria a zvyšuje míru otěhotnění [27]. Odpověď na otázku efektivity HAG v prevenci vzniku IUA po provedeném RCUI u potratů ve II. trimestru by mohla dát právě probíhající multicentrická prospektivní randomizovaná studie (Ústav pro péči o matku a dítě, gynekologie 1. LF UK – Apolinář a gynekologie FN Bulovka).
Závěr
Ashermanův syndrom je závažná komplikace, která vzniká po intrauterinních výkonech, nejčastěji v souvislosti s graviditou. Projevy jako amenorea, pellipatia a neplodnost jsou pro ženu závažné, obzvláště v reprodukčním věku. Z publikovaných studií vyplývá, že použití HAG především po abortech vede k prevenci vzniku středních a těžkých IUA a zvyšuje také míru otěhotnění.
ORCID autorů
M. Emingr 0000-0001-5948-735X
J. Hanáček 0000-0002-7976-9079
Doručeno/Submitted: 1. 3. 2023
Přijato/Accepted: 25. 4. 2023
MUDr. Michal Emingr
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4-Podolí
Sources
1. Schenker JG, Margalioth EJ. Intrauterine adhesions: an updated appraisal. Fertil Steril 1982; 37 (5): 593–610. doi: 10.1016/s0015-0282 (16) 46268-0.
2. Vancaillie TG, Garad R. Asherman’s syndrome. Aust Nurs J 2013; 20 (8): 34–36.
3. Yamamoto N, Takeuchi R, Izuchi D et al. Hysteroscopic adhesiolysis for patients with Asherman’s syndrome: menstrual and fertility outcomes. Reprod Med Biol 2013; 12 (4): 159–166. doi: 10.1007/s12522-013-0149-x.
4. Salazar CA, Isaacson K, Morris S. A comprehensive review of Asherman’s syndrome: causes, symptoms and treatment options. Curr Opin Obstet Gynecol 2017; 29 (4): 249–256. doi: 10.1097/GCO.0000000000000378.
5. Han Q, Du Y. Advances in the application of biomimetic endometrium interfaces for uterine bioengineering in female infertility. Front Bioeng Biotechnol 2020; 8 : 153. doi: 10.3389/fbioe.2020.00153.
6. The American Fertility Society classifications of adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, Müllerian anomalies and intrauterine adhesions. Fertil Steril 1988; 49 (6): 944–955. doi: 10.1016/s0015-0282 (16) 599 42-7.
7. Hooker AB, Lemmers M, Thurkow AL et al. Systematic review and meta-analysis of intrauterine adhesions after miscarriage: prevalence, risk factors and long-term reproductive outcome. Hum Reprod Update 2014; 20 (2): 262–278. doi: 10.1093/humupd/dmt045.
8. Yu D, Wong YM, Cheong Y et al. Asherman syndrome – one century later. Fertil Steril 2008; 89 (4): 759–779. doi: 10.1016/j.fertnstert.2008. 02.096.
9. Kim MJ, Lee Y, Lee C et al. Accuracy of three dimensional ultrasound and treatment outcomes of intrauterine adhesion in infertile women. Taiwan J Obstet Gynecol 2015; 54 (6): 737–741. doi: 10.1016/j.tjog.2015.10.011.
10. Bosteels J, Weyers S, D‘Hooghe TM et al. Anti-adhesion therapy following operative hysteroscopy for treatment of female subfertility. Cochrane Database Syst Rev 2017; 11 (11): CD011110. doi: 10.1002/14651858.CD011110.pub3.
11. Salwowska NM, Bebenek KA, Żądło DA et al. Physiochemical properties and application of hyaluronic acid: a systematic review. J Cosmet Dermatol 2016; 15 (4): 520–526. doi: 10.1111/jocd.12237.
12. Liu C, Lu Q, Zhang Z et al. HyaRegen Adhesion Study Group. A randomized controlled trial on the efficacy and safety of a new crosslinked hyaluronan gel in reducing adhesions after gynecologic laparoscopic surgeries. J Minim Invasive Gynecol 2015; 22 (5): 853–863. doi: 10.1016/j.jmig.2015.04.011.
13. Fuchs N, Smorgick N, Ben Ami I et al. Intercoat (Oxiplex/AP Gel) for preventing intrauterine adhesions after operative hysteroscopy for suspected retained products of conception: double-blind, prospective, randomized pilot study. J Minim Invasive Gynecol 2014; 21 (1): 126–130. doi: 10.1016/j.jmig.2013.07. 019.
14. Hooker AB, de Leeuw R, van de Ven PM et al. Prevalence of intrauterine adhesions after the application of hyaluronic acid gel after dilatation and curettage in women with at least one previous curettage: short-term outcomes of a multicenter, prospective randomized controlled trial. Fertil Steril 2017; 107 (5): 1223. e3–1231.e3. doi: 10.1016/j.ertnstert.2017.02.113.
15. Acunzo G, Guida M, Pellicano M et al. Effectiveness of auto-cross-linked hyaluronic acid gel in the prevention of intrauterine adhesions after hysteroscopic adhesiolysis: a prospective, randomized, controlled study. Hum Reprod 2003; 18 (9): 1918–1921. doi: 10.1093/humrep/deg368.
16. Li X, Wu L, Zhou Y et al. New crosslinked hyaluronan gel for the prevention of intrauterine adhesions after dilation and curettage in patients with delayed miscarriage: a prospective, multicenter, randomized, controlled trial. J Minim Invasive Gynecol 2019; 26 (1): 94–99. doi: 10.1016/j.jmig.2018.03.032.
17. Guida M, Acunzo G, Di Spiezio Sardo A et al. Effectiveness of auto-crosslinked hyaluronic acid gel in the prevention of intrauterine adhesions after hysteroscopic surgery: a prospective, randomized, controlled study. Hum Reprod 2004; 19 (6): 1461–1464. doi: 10.1093/humrep/deh238.
18. Xiao S, Wan Y, Zou F et al. Prevention of intrauterine adhesion with auto-crosslinked hyaluronic acid gel: a prospective, randomized, controlled clinical study. Zhonghua Fu Chan Ke Za Zhi 2015; 50 (1): 32–36.
19. Tsapanos VS, Stathopoulou LP, Papathanassopoulou VS et al. The role of Seprafilm bioresorbable membrane in the prevention and therapy of endometrial synechiae. J Biomed Mater Res 2002; 63 (1): 10–14. doi: 10.1002/jbm.10040.
20. Zheng F, Xin X, He F et al. Meta-analysis on the use of hyaluronic acid gel to prevent intrauterine adhesion after intrauterine operations. Exp Ther Med 2020; 19 (4): 2672–2678. doi: 10.3892/etm.2020.8483.
21. Hooker AB, de Leeuw RA, van de Ven PM et al. Pregnancy and neonatal outcomes 42 months after application of hyaluronic acid gel following dilation and curettage for miscarriage in women who have experienced at least one previous curettage: follow-up of a randomized controlled trial. Fertil Steril 2020; 114 (3): 601–609. doi: 10.1016/j.fertnstert.2020.04.021.
22. Xu W, Zhang Y, Yang Y et al. Effect of early second-look hysteroscopy on reproductive outcomes after hysteroscopic adhesiolysis in patients with intrauterine adhesion, a retrospective study in China. Int J Surg 2018; 50 : 49–54. doi: 10.1016/j.ijsu.2017.11.040.
23. Wei M, Lin X, Zhou F et al. Safety and acceptability of intrauterine balloon stent used in uterine after hysteroscopic adhesiolysis to prevent adhesion reformation. Zhonghua Yi Xue Za Zhi 2014; 94 (39): 3095–3097.
24. Abu Rafea BF, Vilos GA, Oraif AM et al. Fertility and pregnancy outcomes following resectoscopic septum division with and without intrauterine balloon stenting: a randomized pilot study. Ann Saudi Med 2013; 33 (1): 34–39. doi: 10.5144/0256-4947.2013.34.
25. Krajčovičová R, Hudeček R, Ventruba P et al. The role of hyaluronan in Asherman‘s syndrome therapy. J Gynecol Surg 2015; 31 : 250–254. doi: 10.1089/gyn.2014.0129.
26. Unanyan A, Pivazyan L, Krylova E et al. Comparison of effectiveness of hyaluronan gel, intrauterine device and their combination for prevention adhesions in patients after intrauterine surgery: systematic review and meta-analysis. J Gynecol Obstet Hum Reprod 2022; 51 (4): 102334. doi: 10.1016/j.jogoh.2022.102334.
27. Zeng Y, Ran W, Lan Let al. Auto-cross linked hyaluronan gel enhances effects of hysteroscopic adhesiolysis treatment in patients with moderate to severe intrauterine adhesions. Adv Bioeng Biomed Sci Res 2022; 5 (1): 23–28.
28. Lee WL, Liu CH, Cheng M et al. Focus on the primary prevention of intrauterine adhesions: current concept and vision. Int J Mol Sci 2021; 22 (10): 5175. doi: 10.3390/ijms22105175.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2023 Issue 3-
All articles in this issue
- Sentinel lymph node mapping in endometrial cancer – robotic vs. laparoscopic detection system
- Prenatal detection of copy number variants in fetuses with detected congenital devolpmental disordes, from 2015 to 2020 by Multiplex Ligation-Dependent Probe Amplification and microarray analysis
- Physiotherapy in a patient with diastasis of the rectus abdominis muscle after childbirth
- Thoracopagus conjoined twins
- Obesity and assisted reproduction
- Prevention of intrauterine adhesions
- Pelvic pain in women after childbirth and physiotherapy
- Use of antipsychotics during pregnancy and their impact on congenital malformations and early neonatal adaptation
- Prof. MUDr. Zdeněk Hájek, DrSc. – 80letý
- Kompetence lékaře po úspěšném absolvování kmenové zkoušky z oboru gynekologie a porodnictví
- The role of the systemic inflammatory index in determining the length of hospital stay in patients with hyperemesis gravidarum
- Sustainability, population and reproductive ethics
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pelvic pain in women after childbirth and physiotherapy
- Physiotherapy in a patient with diastasis of the rectus abdominis muscle after childbirth
- Prevention of intrauterine adhesions
- Obesity and assisted reproduction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

