-
Medical journals
- Career
Dělohu zachovávající operace adenomyózy a její vliv na reprodukční výsledky
Authors: Kristýna Hlinecká 1; Zdeňka Lisá 1; B. Boudová 1,2; Adéla Richtárová 1; Michal Mára 1; David Kužel 1; Michael Fanta 1
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze 1; Gynekologicko-porodnické oddělení, Oblastní nemocnice Trutnov a. s. 2
Published in: Ceska Gynekol 2022; 87(4): 282-288
Category: Review Article
doi: https://doi.org/10.48095/cccg2022282Overview
Cíl: Shrnutí operačních metod cytoredukční resekce adenomyózy a jejich reprodukční výsledky. Závěr: U pacientek s adenomyózou se čím dál častěji setkáváme s infertilitou a vyšší mírou potratů než u zdravých žen. Neexistuje však žádný standardizovaný protokol pro jejich optimální léčbu, zejména u žen plánujících graviditu nebo u neplodných žen. Oproti dlouhodobě úspěšně prováděné operační léčbě myomatózy je role chirurgického zákroku u rozsáhlé děložní adenomyózy stále kontroverzní. Adenomyóza se často projevuje difuzním postižením děložní svaloviny, tudíž je kompletní odstranění patologické tkáně (v porovnání s myomektomií) prakticky nemožné. V literatuře se tedy tento operační výkon označuje jako debulking či cytoredukční. V posledních letech se ale i adenomyomektomie zařadila mezi častěji prováděné operační zákroky.
Klíčová slova:
adenomyomektomie – cytoredukční operace – myom
Úvod
Adenomyóza (AD) je mnohdy opomíjené onemocnění dělohy, i když její závažnost může mít negativní vliv na případnou reprodukční schopnost ženy. AD byla popisována zejména během 4. a 5. dekády života, tedy spíše po plodném období života, kdy ji bylo možné zvládnout prodlouženou hormonální terapií (orální nebo nitroděložní) nebo hysterektomií [1,2]. Později se zjistilo, že i u žen ve fertilním věku může být prevalence AD až 20 % [3]. Od dřívějšího označení „endometrióza“ dělohy se již ustupuje, jelikož etiopatogeneze těchto dvou modalit je nejspíše různá [4]. V současnosti existují v podstatě dvě hlavní teorie etiopatogeneze: invaginace a metaplazie. García-Solares et al tyto dvě teorie shrnuli v přehledovém článku v roce 2018 [5]. Teorie invaginace byla z velké části založena na teorii poškození a opravy tkáně (TIAR – tissue injury and repair) navržené Leyendeckerem et al [6–8]. Tato teorie je založena na dvou hlavních poznatcích – děloha se skládá ze dvou fylogeneticky odlišných částí nazývaných archimetra a neometra [9]. Archimetru tvoří endometrium, junkční zóna a stratum subvasculare, tato část vykazuje vysokou cyklickou expresi receptorů steroidních hormonů. Oproti tomu neometra vykazuje expresi těchto receptorů konstantně. Leyendeckerův model TIAR popisuje mikrotraumatizace na rozhraní endometria-myometria způsobuné poškozením tkáně, což má za následek indukovanou upregulaci cyklooxygenázy-2 (COX-2) a zvýšenou produkci prostaglandinu E2 (PGE2), což indukuje zvýšenou lokální produkci estrogenu. Zvýšené hladiny tohoto hormonu vedou k tvorbě oxytocinu/receptorů oxytocinu (OT/OTR), které následně zvyšují peristaltiku dělohy, angiogenezi a proliferaci. Hyperperistaltika dělohy má za následek invaginaci endometria, a nakonec tvorbu adenomyotických lézí [7,8,10,11].
Rizikovým faktorem je tedy předchozí prodělaný operační zákrok dělohy, parita ženy, kouření či opakované aborty v anamnéze. Hlavními příznaky jsou hypermenorea, pánevní bolesti, dysmenorea. Ve fertilním věku je u žen prokázána nižší pravděpodobnost otěhotnění (pregnancy rate) a vyšší riziko potratu (abortion rate). Přibližně 30 % pacientek je asymptomatických [12]. Prevalence mezi ženami podstupujícími asistovanou reprodukci je okolo 20–25 % [13]. Dle rozsahu postižení stěny děložní, lokalizace a histologické konfirmace nálezu rozlišujeme dvě základní formy – difuzní a fokální [14].
Diagnostika je založena na expertním ultrasonografickém vyšetření. Při nejasnosti nálezu může být doplněna magnetická rezonance (MR). V roce 2015 byla definována sonografická klasifikace adenomyózy (MUSA statement – the Morphological Uterus Sonographic Assesment). Hlavními znaky jsou: globálně zvětšená děloha, asymetrická šíře stěn myometria (přední vs. zadní stěna děložní, samozřejmě jen tehdy, není-li adenomyózou prostoupena celá děloha), přítomnost intramyometrálních cyst, echogenních subendometriálních linií, hyperechogenních ostrůvků, přítomnost paralelních stínů (Venetian blind appereance of uterus). V případě fokální formy je > 25 % okolního myometria normálního vzhledu. Pokud je léze jasně ohraničená vůči okolnímu hypertrofickému myometriu, označujeme nález jako adenomyom. Naopak difuzní forma adenomyózy téměř postrádá okolní zdravé myometrium (< 25 %) (obr. 1, 2). Vzhledem k velmi nejasnému vymezení hranic je její exaktní změření velmi nepřesné až nemožné. AD může být sonograficky klasifikována jako cystická či non-cystická forma. Vyznačuje se přítomností intramyometrálních cyst o rozměrech ≥ 2 mm. Na ultrazvukovém obraze jsou obvykle ohraničeny echogenním lemem s anechogenním či hypoechogenním obsahem (low level). V případě nálezu difuzní a fokální formy v různých částech dělohy označujeme nález jako smíšená forma AD (mixed-type adenomyosis) [15]. Další skórovací systém popisující závažnost adenomyózy popsali Lazzeri et al v roce 2018. Je s otázkou, zda tento složitější hodnoticí systém může být implementován do běžné klinické praxe [16]. Správně diagnostikovaná a popsaná forma adenomyózy je velmi důležitá. Léčebnou metodou 1. volby je medikamentózní terapie progestiny, intrauterinní kontracepce (IUD – intrauterine device) s levonorgestrelem, GnRH agonisty či podání kombinované kontracepce [17]. V případě selhání a přání zachování reprodukce referujeme pacientku k dělohu zachovávajícímu výkonu – adenomyomektomii [18]. Definitivní, radikální řešení ve smyslu hysterektomie by mělo být vyhrazeno pro ženy, u nichž selhala konzervativní terapie nebo již nemají reprodukční plány [2].
Obr. 1, 2. Ultrasonografický snímek pacientky s typickým obrazem difuzní adenomyózy zadní stěny děložní.
Fig. 1, 2. Ultrasonographic image of a patient with a typical pattern of diffuse adenomyosis of the posterior uterine wall.
Chirurgické techniky adenomyomektomie – vliv na fertilitu
První záznamy chirurgické léčby adenomyózy sahají až do roku 1952 [19]. O způsobu provedení cytoredukční resekce adenomyózy se rozhodujeme na základě výsledku zobrazovacích metod. Především objem léze nás primárně informuje, zda k operaci zvolíme primárně laparoskopický či laparotomický přístup. Všeobecně je laparoskopická resekce adenomyózy prováděna jako radikální excize adenomyotické patologické tkáně s pečlivou dvou - a vícevrstvou (počet vrstev podle hloubky defektu) suturou děložního svalstva a serózy 1–0 vstřebatelnými polyglaktinovými stehy (Vicryl; Ethicon Inc., Sommerville, NJ, USA). V závažných případech vykazujících difuzní infiltraci děložní stěny od endometria po serózu musí být provedena laparotomie k dosažení co největší cytoredukce.
„V-shape“ resekce
V minulosti se prováděla tzv. resekce ve tvaru V. Část tkáně adenomyomu zůstávala na jedné nebo obou stranách řezu [20]. Vzniklý defekt byl sešit pokračujícím stehem. Při tomto způsobu operace docházelo k časné recidivě onemocnění v důsledku ponechané adenomyomatózní tkáně. Taktéž nedošlo k výraznému ovlivnění dysmenorey a menoragie.
Technika „H-incize“
Po širokém otevření děložní stěny ve tvaru H je tkáň adenomyomu odstraněna pomocí elektrochirurgického skalpelu nebo nůžek. Uzavření defektu je provedeno v jedné nebo dvou vrstvách [21].
Tentýž autor publikoval roku 2010 článek hodnotící fertilní výsledky žen, které podstoupily adenomyomektomii touto technikou. Retrospektivně sledoval 41 žen, 31 z nich se pokusilo otěhotnět – 12 z nich (38,7 %) otěhotnělo, 5 (16,1 %) potratilo a 7 (22,5%) úspěšně porodilo [22].
Osadova „triple-flap method“
Při této metodě je na začátku operace subserózně aplikován vazokonstrikční prostředek (v našich podmínkách aplikujeme 4 ml 4% Supracainu – Zentiva, k.s., Praha, Česká republika, smíchaný s 16 ml normálního fyziologického roztoku) ke snížení intraoperačního krvácení, poté je radikálně proveden sagitální středový řez s otevřením dutiny děložní, ponecháváme 1 cm tkáně subendometriálně a 1 cm subserózně. Následně je děloha zrekonstruována pomocí vzájemného překrytí jednotlivých serózních laloků (overlapping defektu) [18,23]. Excize patologické tkáně musí být prováděna s ohledem na vejcovody, zejména v případě plánované gravidity [24]. V roce 2011 Osada et al publikovali studii hodnotící vliv této cytoredukční operace na budoucí fertilitu ženy. Provedli 104 adenomyomektomií u žen s průměrným věkem 38 let. Graviditu plánovalo 26 žen (26 %), 16 z nich otěhotnělo (pregnancy rate 61 %), dvě ženy potratily a 14 z nich porodilo (delivery rate 87,5 %) [18].
„Double-flap method“
Při této metodě provádíme incizi v místě největšího postižení dělohy až k dutině děložní. Adenomyotická tkáň je odstraňována pomocí nůžek. Endometriální dutina je sešita s použitím 2–0 vikrylu. Jedna strana serózní chlopně je použita k přiklopení subendometriálně do druhého flapu. Druhá serózní chlopeň takto překryje první chlopeň, čímž se vytvoří dostatečná šíře myometria [25].
„Four-petal method“
Tato metoda byla popsána v roce 2020. Incize dělohy je vedena do tvaru kříže v místě největšího postižení dělohy (obr. 3). Resekce adenomyózy je postupně prováděna ve všech kvadrantech, přičemž je ponecháno 10 mm tkáně subendometriálně a 5 mm subserózně. Takto postupujeme i ve zbývajících třech chlopních. Uzavření defektu provádíme přišitím serózních chlopní k subendometriální tkáni, čímž zajistíme adekvátní tloušťku myometria a snížíme riziko pooperačního krvácení (obr. 4).
Obr. 3. Peroperační snímek laparoskopicky prováděné adenomyomektomie metodou four-petal.
Fig. 3. Perioperative image of laparoscopically performed adenomyomectomy by four-petal method.
Obr. 4. Peroperační snímek uzavření defektu přišitím serózních chlopní k subendometriální tkáni.
Fig. 4. Perioperative image of defect closure by suturing serous valves to subendometrial tissue.
Diskuze
Adenomyomektomie se řadí k radikálním, fertilitu zachovávajícím výkonům. Indikace zákroku patří do rukou zkušeného reprodukčního chirurga, a to zejména v případě selhání konzervativní medikamentózní terapie a neúspěšně léčené infertility.
Vzhledem k současnému trendu odsouvání reprodukce, a tudíž i zvýšenému výskytu adenomyózy v pozdějším věku jsou pacientky s AD čím dál častěji referovány z center asistované reprodukce k tomuto výkonu. AD může být asociována s nálezem endometriózy (taktéž estrogen-dependentní), ale i myomatózy [26].
Etiopatogeneze adenomyózy není zcela jasně definována. V roce 2019 se Inoue et al pokusili definovat genomické rysy adenomyózy provedením sekvenování nové generace. Byla popsána opakující se mutace KRAS v 37,1 % případů. Podle této studie je mutace KRAS častější u pacientů s adenomyózou a/nebo endometriózou. Tyto společné molekulární znaky mohou vysvětlit jejich občasnou koincidenci. Genové mutace mohou snižovat účinnost dienogestu (DNG), a to prostřednictvím down regulace progesteronových receptorů. Tato zjištění by teoreticky mohla vést ke geneticky vedené, cílené léčbě [27].
V literatuře se také často uvádí korelace mezi sérovou hladinou CA 125 a aktivitou adenomyózy. CA 125 je velmi nespecifický marker, který jistě neslouží k diagnostice, nicméně dle některých autorů může být nápomocný k odlišení od myomatózy. V diferenciální diagnostice adenomyózy a myomu se zdá, že mezní hodnota odpovídá hladině 19 U/ml [28,29]. Úroveň CA 125 může být u adenomyózy i neočekávaně vysoká. Kazuistika z roku 2020 uvádí hodnotu přes 1 000 IU/l. Vysoká hladina zde pozitivně korelovala s velikostí léze adenomyózy [30].
Pacientky léčené kombinací adenomyomektomie a GnRHa, u nichž byl zároveň zaznamenán pokles hladiny CA 125, měly lepší pooperační klinické výsledky než ty, u kterých ke snížení nedošlo. Pooperační sérová hladina CA 125 tedy může pomoci předpovědět pravděpodobnost obnovy plodnosti a taktéž predikovat zlepšení dysmenorey [31].
Souhrnně řečeno – čím větší pokles CA 125 zaznamenáme, tím by mohlo být obnovení plodnosti a zlepšení dysmenorey pravděpodobnější [31].
Je dobře známo, že nejen onemocnění dělohy, ale i další faktory výrazně ovlivňují fertilitu ženy. Pokročilý věk je v poslední době velmi zásadní faktor, kdy pravděpodobnost otěhotnění u žen > 40 let je výrazně snížena. Okolo 42 let klesá ke 2 % a ve 45 letech se téměř blíží k nule. Pokud žena > 43 let podstoupí cyklus in vitro fertilizaci (IVF), je porodnost živého potomka < 5 %. Pro tyto ženy je jistě další možnost využití darovaného oocytu [32]. Vliv samotné adenomyózy na fertilitu ženy není i přes dostupná data prokázán. Metaanalýza z roku 2018 zahrnuje 16 studií shrnujících reprodukční výsledky žen. Pacientky s AD měly o 28 % nižší pravděpodobnost gravidity v porovnání se zdravou populací. Šest studií hodnotilo reprodukční výsledky žen po adenomyomektomii. Pregnancy rate po spontánní koncepci byl velmi nízký (18,2 %). Studie se zabývala taktéž vlivem užívání GnRH analog na budoucí fertilitu. Při jejich užívání 24 týdnů po cytoredukční operaci byla míra spontánního těhotenství vyšší (40,7 vs. 15,0 %; p = 0,002) [33].
Přehled literatury zabývající se cytoredukční resekcí adenomyózy na reprodukční výsledky žen je shrnut v tab. 1.
Table 1. Přehled literatury zabývající se reprodukčními výsledky žen po cytoredukční resekci adenomyózy.
Tab. 1. A review of the literature dealing with the reproductive outcomes of women after cytoreductive resection of adenomyosis.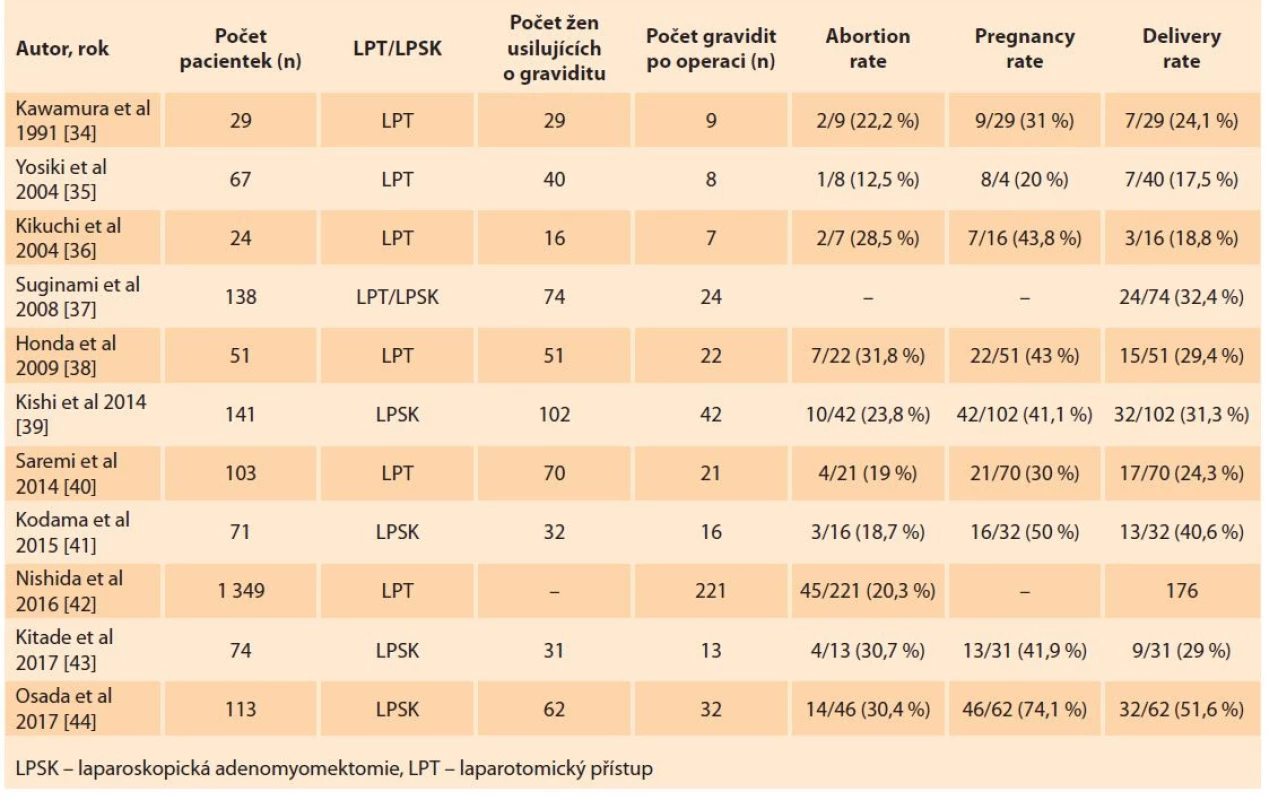
Samotným operačním zákrokem péče o pacientku nekončí. Riziko ruptury dělohy u žen po adenomyomektomii je během následné gravidity poměrně vysoké. Tyto pacientky by měly být pod pečlivým dohledem v průběhu těhotenství, nejlépe v péči perinatologického centra. Dle dostupné literatury dosahuje riziko ruptury až 6 % [34]. Na riziko má jistě vliv rozsah a velikost defektu po exstirpaci adenomyotické tkáně, metoda rekonstrukce dělohy, pooperační infekce a také zkušenost operatéra v oblasti reprodukční chirurgie [35]. Pro porovnání – vaginální porod u žen po císařském řezu zvyšuje riziko ruptury v oblasti jizvy na 0,27–0,7 % [36,37]. Jiné studie uvádí výrazně nižší riziko ruptury i u pacientek po myomektomii v porovnání s adenomyomektomií (0,26 vs. > 1 %). Frekvence ruptury u neoperované dělohy je přitom pouze 0,005 %. První publikovaná ruptura dělohy byla popsána u dvojčetného těhotenství po laparoskopicky provedené adenomyomektomii [38]. V roce 2016 publikovali Otsubo et al studii hodnotící sílu myometria po adenomyomektomiii pomocí ultrazvuku či MR. Z výsledků vyplývá korelace mezi tloušťkou myometria a rizikem ruptury. Optimální tloušťka svaloviny před graviditou by měla být mezi 9 a 15 mm, čímž snížíme riziko ruptury [39]. Pooperačně je tedy důležité sonografické zhodnocení kompaktnosti myometria. Toto vyšetření provádíme 4–6 týdnů po operaci (obr. 5) [40].
Obr. 5. Sonografický snímek hodnotící kompaktnost myometria 4 týdny po operaci.
Fig. 5. Sonographic image evaluating myometrial compactness 4 weeks after surgery.
Ruptura dělohy může být leckdy nepředvídatelná. Klinické následky pro plod i matku mohou být fatální.
Závěr
Adenomyóza je v posledních letech velmi diskutované téma. U pacientek s AD se čím dál častěji setkáváme s infertilitou a vyšší mírou potratů než u zdravých žen. Neexistuje však žádný standardizovaný protokol pro jejich optimální léčbu, zejména u žen plánujících graviditu nebo u neplodných žen. Adenomyomektomie se řadí k radikálním fertilitu zachovávajícím výkonům, které zcela jistě patří na vyšší pracoviště zabývající se reprodukční chirurgií. Zatím není zcela jasné, zda a jak různé operační techniky (double-flap, tripple-flap, four petal method) ovlivňují fertilitu a reprodukční výsledky žen. Z hlediska plánování reprodukce u žen s AD je velmi důležitá mezioborová spolupráce mezi pracovišti zaměřenými na reprodukční chirurgii a centry asistované reprodukce.
ORCID autorů
K. Hlinecká 0000-0002-8452-8333
Z. Lisá 0000-0003-4961-7063
B. Boudová 0000-0003-0444-7160
A. Richtárová 0000-0001-7635-4858
M. Mára 0000-0001-8222-3141
D. Kužel 0000-0003-4262-9766
M. Fanta 0000-0002-8759-2533
Doručeno/Submitted: 20. 1. 2022
Přijato/Accepted: 17. 2. 2022
MUDr. Kristýna Hlinecká
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
Apolinářská 18
128 00 Praha 2
Sources
1. Tan J, Moriarty S, Taskin O et al. Reproductive outcomes after fertility-sparing surgery for focal and diffuse adenomyosis: a systematic review. J Minim Invasive Gynecol 2018; 25 (4): 608–621. doi: 10.1016/j.jmig.2017.12.020.
2. Vimercati A, Scioscia M, Lorusso F et al. Do uterine fibroids affect IVF outcomes? Reprod Biomed Online 2007; 15 (6): 686–691. doi: 10.1016/s1472-6483 (10) 60536-6.
3. Devlieger R, D’Hooghe T, Timmerman D. Uterine adenomyosis in the infertility clinic. Hum Reprod Update 2003; 9 (2): 139–147. doi: 10.1093/humupd/dmg010.
4. Kissler S, Hamscho N, Zangos S et al. Uterotubal transport disorder in adenomyosis and endometriosis – a cause for infertility. BJOG 2006; 113 (8): 902–908. doi: 10.1111/ j.1471-0528. 2006.00970.x.
5. García-Solares J, Donnez J, Donnez O et al. Pathogenesis of uterine adenomyosis: invagination or metaplasia? Fertil Steril 2018; 109 (3): 371–379. doi: 10.1016/j.fertnstert.2017.12.030.
6. Leyendecker G, Bilgicyildirim A, Inacker M et al. Adenomyosis and endometriosis. Re-visiting their association and further insights into the mechanisms of auto-traumatisation. An MRI study. Arch Gynecol Obstet 2015; 291 (4): 917–932. doi: 10.1007/s00404-014-3437-8.
7. Leyendecker G, Wildt L. A new concept of endometriosis and adenomyosis: tissue injury and repair (TIAR). Horm Mol Biol Clin Investig 2011; 5 (2): 125–142. doi: 10.1515/HMBCI.2011.002.
8. Leyendecker G, Wildt L, Mall G. The pathophysiology of endometriosis and adenomyosis: tissue injury and repair. Arch Gynecol Obstet 2009; 280 (4): 529–538. doi: 10.1007/s00404-009-1191-0.
9. Leyendecker G, Kunz G, Noe M et al. Endometriosis: a dysfunction and disease of the archimetra. Hum Reprod Update 1998; 4 (5): 752–762. doi: 10.1093/humupd/4.5.752.
10. Kunz G, Noe M, Herbertz M et al. Uterine peristalsis during the follicular phase of the menstrual cycle: effects of oestrogen, antioestrogen and oxytocin. Hum Reprod Update 1998; 4 (5): 647–654. doi: 10.1093/humupd/4.5.647.
11. Guo SW, Mao X, Ma Q et al. Dysmenorrhea and its severity are associated with increased uterine contractility and overexpression of oxytocin receptor (OTR) in women with symptomatic adenomyosis. Fertil Steril 2013; 99 (1): 231–240. doi: 10.1016/j.fertnstert.2012.08.038.
12. Peric H, Fraser IS. The symptomatology of adenomyosis. Best Pract Res Clin Obstet Gynaecol 2006; 20 (4): 547–555. doi: 10.1016/ j.bpobgyn.2006.01.006.
13. Lacheta J. Uterine adenomyosis: pathogenesis, diagnostics, symptomatology and treatment. Ceska Gynekol 2019; 84 (3): 240–246.
14. Gilks CB, Clement PB, Hart WR et al. Uterine adenomyomas excluding atypical polypoid adenomyomas and adenomyomas of endocervical type: a clinicopathologic study of 30 cases of an underemphasized lesion that may cause diagnostic problems with brief consideration of adenomyomas of other female genital tract sites. Int J Gynecol Pathol 2000; 19 (3): 195–205. doi: 10.1097/00004347-200007000-00001.
15. Van den Bosch T, Dueholm M, Leone FP et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet Gynecol 2015; 46 (3): 284–298. doi: 10.1002/uog.14806.
16. Lazzeri L, Morosetti G, Centini G et al. A sonographic classification of adenomyosis: interobserver reproducibility in the evaluation of type and degree of the myometrial involvement. Fertil Steril 2018; 110 (6): 1154.e3–1161.e3. doi: 10.1016/j.fertnstert.2018.06.031.
17. Oliveira MA, Crispi CP Jr, Brollo LC et al. Surgery in adenomyosis. Arch Gynecol Obstet 2018; 297 (3): 581–589. doi: 10.1007/s004 04-017-4603-6.
18. Osada H, Silber S, Kakinuma T et al. Surgical procedure to conserve the uterus for future pregnancy in patients suffering from massive adenomyosis. Reprod Biomed Online 2011; 22 (1): 94–99. doi: 10.1016/j.rbmo.2010.09.014.
19. Van Praagh I. Conservative surgical treatment for adenomyosis uteri in young women: local excision and metroplasty. Can Med Assoc J 1965; 93 (22): 1174–1175.
20. Sun AJ, Luo M, Wang W et al. Characteristics and efficacy of modified adenomyomectomy in the treatment of uterine adenomyoma. Chin Med J (Engl) 2011; 124 (9): 1322–1326
21. Fujishita A, Masuzaki H, Khan KN et al. Modified reduction surgery for adenomyosis. A preliminary report of the transverse H incision technique. Gynecol Obstet Invest 2004; 57 (3): 132–138. doi: 10.1159/000075830.
22. Fujishita A, Hiraki K, Kitajima M et al. Shikyusenkinsho to shikyu no onzon-chiryo. Uterine adenomyosis and uterine preservation treatment. J Obstet Gynecol Prac (Tokyo) 2010; 59 : 769–776.
23. Zhu L, Chen S, Che X et al. Comparisons of the efficacy and recurrence of adenomyomectomy for severe uterine diffuse adenomyosis via laparotomy versus laparoscopy: a long-term result in a single institution. J Pain Res 2019; 12 : 1917–1924. doi: 10.2147/JPR.S205561.
24. Huang X, Huang Q, Chen S et al. Efficacy of laparoscopic adenomyomectomy using double-flap method for diffuse uterine adenomyosis. BMC Womens Health 2015; 15 : 24. doi: 10.1186/s12905-015-0182-5.
25. Kim JK, Shin CS, Ko YB et al. Laparoscopic assisted adenomyomectomy using double flap method. Obstet Gynecol Sci 2014; 57 (2): 128–135. doi: 10.5468/ogs.2014.57.2.128.
26. Molitor JJ. Adenomyosis: a clinical and pathologic appraisal. Trans Pac Coast Obstet Gynecol Soc 1970; 38 : 159–168.
27. Inoue S, Hirota Y, Ueno T et al. Uterine adenomyosis is an oligoclonal disorder associated with KRAS mutations. Nat Commun 2019; 10 (1): 5785. doi: 10.1038/s41467-019-13708-y.
28. Zhou Y, Wu B, Li H. The value of serum CA125 assays in the diagnosis of uterine adenomyosis. Zhonghua Fu Chan Ke Za Zhi 1996; 31 (10): 590–593.
29. Kil K, Chung JE, Pak HJ et al. Usefulness of CA125 in the differential diagnosis of uterine adenomyosis and myoma. Eur J Obstet Gynecol Reprod Biol 2015; 185 : 131–135. doi: 10.1016/j.ejogrb.2014.12.008.
30. Abdelazim IA, AbuFaza M, Hamed ME et al. Severe adenomyosis with unexpectedly high CA-125: report of a rare case. Prz Menopauzalny 2020; 19 (3): 144–146. doi: 10.5114/pm. 2020.99610.
31. Huang BS, Seow KM, Tsui KH et al. Fertility outcome of infertile women with adenomyosis treated with the combination of a conservative microsurgical technique and GnRH agonist: long-term follow-up in a series of nine patients. Taiwan J Obstet Gynecol 2012; 51 (2): 212–216. doi: 10.1016/j.tjog.2012.04.008.
32. Fernandez AM, Drakopoulos P, Rosetti J et al. IVF in women aged 43 years and older: a 20 - -year experience. Reprod Biomed Online 2021; 42 (4): 768–773. doi: 10.1016/j.rbmo.2020.12. 002.
33. Rocha TP, Andres MP, Borrelli GM et al. Fertility-sparing treatment of adenomyosis in patients with infertility: a systematic review of current options. Reprod Sci 2018; 25 (4): 480–486. doi: 10.1177/1933719118756754.
34. Morimatsu Y, Matsubara S, Higashiyama N et al. Uterine rupture during pregnancy soon after a laparoscopic adenomyomectomy. Reprod Med Biol 2007; (3): 175–177. doi: 10.1111/ j.1447-0578.2007.00182.x.
35. Osada H. Uterine adenomyosis and adenomyoma: the surgical approach. Fertil Steril 2018; 109 (3): 406–417. doi: 10.1016/j.fertnstert. 2018.01.032.
36. Ofir K, Sheiner E, Levy A et al. Uterine rupture: risk factors and pregnancy outcome. Am J Obstet Gynecol 2003; 189 (4): 1042–1046. doi: 10.1067/s0002-9378 (03) 01052-4.
37. Guise JM, McDonagh MS, Osterweil P et al. Systematic review of the incidence and consequences of uterine rupture in women with previous caesarean section. BMJ 2004; 329 (7456): 19–25. doi: 10.1136/bmj.329.74 56.19.
38. Wada SI, Kudo M, Minakami H. Spontaneous uterine rupture of a twin pregnancy after a laparoscopic adenomyomectomy: a case report. J Minim Invasive Gynecol 2006; 13 (2): 166–168. doi: 10.1016/j.jmig.2005.12.002.
39. Otsubo Y, Nishida M, Arai Y et al. Association of uterine wall thickness with pregnancy outcome following uterine-sparing surgery for diffuse uterine adenomyosis. Aust N Z J Obstet Gynaecol 2016; 56 (1): 88–91. doi: 10.1111/ajo.12419.
40. Kuo HH, Weng CH, Jaiswal A et al. Performing laparoscopic adenomyomectomy with the four-petal method. Fertil Steril 2020; 114 (6): 1352–1354. doi: 10.1016/j.fertnstert.2020.07.032.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2022 Issue 4-
All articles in this issue
- Bariéry českých žen v účasti na screeningu karcinomu děložního hrdla
- Gravidita v jizvě po císařském řezu – retrospektivní analýza případů z let 2012–2021
- Vaskularizovaná léze myometria
- Pacientka s primárním adenokarcinomem apendixu metastazujícím do ovaria
- SARS-CoV-2 placentitida jako příčina intrauterinního úmrtí plodu u pacientky s infekcí covid-19 a probíhajícím HELLP syndromem
- Cefalothorakoomfalopagus – vzácný typ spojených dvojčat z pohledu patologa
- Unilaterálna makrocystická dysplázia a kontralaterálna agenéza obličky u monoamniálneho dvojčaťa
- Dělohu zachovávající operace adenomyózy a její vliv na reprodukční výsledky
- Role elektrické „power“ morcelace v minimálně invazivní gynekologické operativě
- Perforace dělohy při nitroděložních výkonech a její řešení
- Srovnání protokolu zrychleného zotavení s konvenční péčí u pacientů podstupujících urogynekologickou operaci
- Embolie plodovou vodou – přehled a multicentrická případová analýza
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perforace dělohy při nitroděložních výkonech a její řešení
- Dělohu zachovávající operace adenomyózy a její vliv na reprodukční výsledky
- Embolie plodovou vodou – přehled a multicentrická případová analýza
- Gravidita v jizvě po císařském řezu – retrospektivní analýza případů z let 2012–2021
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

