-
Medical journals
- Career
Prevence tvorby de novo adhezí u pacientek s Ashermanovým syndromem
Authors: B. Boudová; Zdeňka Lisá; Adéla Richtárová; David Kužel; Michal Mára
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
Published in: Ceska Gynekol 2021; 86(4): 273-278
Category: Review Article
doi: https://doi.org/10.48095/cccg2021273Overview
Cíl: Podat aktuální pohled na problematiku prevence recidivy vzniku nitroděložních srůstů u pacientek s Ashermanovým syndromem. Metodika: Analýza literárních údajů a klinických zkušeností autorů. Výsledky: Ashermanův syndrom je iatrogenní onemocnění s problematickou terapií. Jedním z hlavních problémů léčby je nutnost opakovaných chirurgických intervencí, jelikož rekurence adhezí je velmi častá. Sekundární prevence je tedy zásadním faktorem úspěšnosti léčby těchto pacientek. Mezi užívané metody patří časná second-look hysteroskopie, hormonální terapie a různé bariérové prvky. Porovnávání účinnosti jednotlivých metod je obtížné a výsledky metaanalýz jsou rozporuplné. Závěr: Možností sekundární prevence vzniku nitroděložních srůstů je mnoho, naneštěstí žádná z nich neposkytuje dokonalé řešení. Aplikace solidních či semisolidních bariér v kombinaci s podporou regenerace endometria hormonální terapií se aktuálně jeví jako nejlepší řešení.
Klíčová slova:
Ashermanův syndrom – hysteroskopie – nitroděložní srůsty – prevence
Úvod
Nitroděložní srůsty byly poprvé popsány německým gynekologem a porodníkem Heinrichem Fritschem v roce 1894 [1]. O půl století později Joseph G. Asherman publikoval sérii článků představující komplexní syndrom charakterizovaný přítomností posttraumatických nitroděložních srůstů a klinických příznaků. Asherman se zabýval epidemiologií, etiologií a klinickými symptomy tohoto onemocnění [2–4]. Od té doby je tato klinická jednotka nazývána Ashermanův syndrom a dodnes představuje pro lékaře velkou léčebnou výzvu.
Ashermanův syndrom je konsekvencí nitroděložních výkonů, obzvláště těch spojených s těhotenstvím [5–7], nicméně může vzniknout i po výkonech, které přímo s dutinou děložní nesouvisí jako např. myomektomie či embolizace uterinních arterií [8,9]. Klinické příznaky zahrnují poruchy menstruačního cyklu (hypomenorea, amenorea), cyklické bolesti, neplodnost nebo opakované těhotenské ztráty a jiné těhotenské komplikace [10,11].
Léčba tohoto onemocnění je obtížná a nečítá mnoho možností. Expektační postup, slepá dilatace a kyretáž, hysterotomie či technika rýhování myometria byly popsány s nízkým procentem úspěšnosti [12]. Zlatým standardem v léčbě Ashermanova syndromu je hysteroskopická adheziolýza [9,13]. Jejím cílem je většinou obnovení dutiny děložní, která bude schopna donosit těhotenství.
Prevence rekurence onemocnění
Naneštěstí jedna chirurgická intervence, byť s velmi uspokojivým výsledkem na konci hysteroskopie, zpravidla není definitivním řešením. Frekvence výskytu nových adhezí je vysoká, pohybuje se v rozmezí 20–62 % a odvíjí se od tíže primárního hysteroskopického nálezu [12,14]. V literatuře je popsáno mnoho možností, které mohou pomoci předcházet rekurenci onemocnění.
Časná second-look hysteroskopie
Většina pacientek vyžaduje v rámci léčby Ashermanova syndromu opakované hysteroskopické výkony. Časná kontrolní hysteroskopie patří k metodám prevence obnovení srůstů po primární adheziolýze. Čínští autoři na svých souborech popisují příznivější hysteroskopické nálezy při časné kontrolní hysteroskopii, která je provedena do dvou měsíců od prvního zákroku [15]. Pacientky s časnou kontrolní hysteroskopií mají nejen větší pokles ve skórovacím systému přítomnosti adhezí, ale také u nich bylo popsáno vyšší procento otěhotnění (77 vs. 56 %) a vyšší podíl živě narozených dětí (77 vs. 63 %) oproti pacientkám s následnou hysteroskopií s odstupem delším než dva měsíce [16]. Na našem pracovišti zařazujeme i třetí či další hysteroskopii (obvykle již v delším odstupu od primární léčby) v případech rekurence hypomenorey a přetrvávající sterility.
Hormonální terapie
Následná hormonální léčba sloužící jako podpora regenerace endometria byla popsána již v roce 1964 Woodem a Penem a je mezi operatéry hojně používanou metodou [17]. Ve většině studií hodnotících další metody prevence je preskripce hormonální terapie samozřejmostí a nejinak je tomu i na našem pracovišti. Americké doporučené postupy navrhují pooperační podávání estrogenů s progestinem, či bez něj, avšak neuvádí doporučené dávkování [18]. Dostupné retrospektivní i prospektivní studie hovoří o pozitivním dopadu hormonální terapie nejen na prevenci opětovné tvorby nitroděložních srůstů při následné kontrolní hysteroskopii, ale také na schopnost pacientky otěhotnět, a to bez ohledu na dávkování (porovnávány byly dávky 2–10 mg estrogenu za den) [19,20]. Na našem pracovišti je pacientkám předepsáno ve většině případů 6 mg estrogenu za den, přičemž ve druhé polovině cyklu je přidán gestagen. U pacientek s již předoperačně dobře rostoucí sliznicí dle ultrazvukového vyšetření a s méně závažnými srůsty je možné dávku estrogenu upravit.
Bariérové metody
Cílem použití nitroděložních bariér je snaha o co nejšetrnější oddálení děložních stěn, a zabránění tak jejich opakovanému slepení a zjizvení. Ideální bariéra by měla oddálit stěny děložní na dostatečně dlouhou dobu, působit po celé ploše dutiny děložní a netraumatizovat zdravé endometrium.
Nitroděložní tělísko
Zavedení nitroděložního tělíska (IUD – intrauterine device) patří mezi první popsané metody v rámci prevence recidivy adhezí. Zavedení IUD má napomáhat přirozené regeneraci endometria oddalováním přední a zadní stěny dutiny děložní [21]. Výsledky studií jsou rozporuplné a není jasné, jaký typ IUD by se měl správně používat. Práce italských autorů zahrnujících 48 žen s funkční sekundární amenoreou poukazuje na obnovení menstruačního cyklu po několika týdnech od zavedení IUD s mědí u 40 žen. IUD stimuluje určitou formu zánětlivé reakce v endometriu a přes zvýšenou tvorbu prostaglandinů je pravděpodobně opět nastartován menstruační cyklus [22]. Tento fakt byl ale popsán u žen s funkční amenoreou, a naopak jiní autoři věří, že u žen s nitroděložními srůsty může tento zánětlivý proces zhoršit poškození endometria [21]. Ve studii porovnávající adheze při kontrolní hysteroskopii dva měsíce po resekci nitroděložního septa s použitím buď IUD, hormonální terapie, či bez následné terapie, nenašli autoři signifikantní rozdíly mezi jednotlivými skupinami [23]. Zavedení IUD s levonorgestrelem není v této indikaci doporučováno vůbec pro jeho tlumicí účinek na endometrium. Americká společnost pro endoskopii nedoporučuje použití IUD s mědí či IUD tvaru T pro jejich možnou indukci zánětlivé reakce a pro malý povrch, a naopak se v této indikaci kloní k využití tzv. loop IUD, které tvoří smyčky, nicméně v mnoha zemích není běžně dostupné [18]. Zavedení IUD u nás v rámci prevence rekurence adhezí nepoužíváme.
Foleyův katétr
Močový katétr se také řadí mezi první mechanické bariérové metody použité v rámci sekundární prevence. Katétr se zavede do dutiny děložní ihned po adheziolýze, naplní se 3,5–4,5 ml fyziologického roztoku a ponechá se nitroděložně po dobu 5–10 dní. Amer et al ve své prospektivní studii sice popsali rozdílný výskyt nitroděložních srůstů ve skupině pacientek se zavedeným katétrem (21,9 %) oproti pacientkám bez sekundární prevence (50 %), nicméně ve vzorku 32 žen nebyl rozdíl statisticky významný [24]. Orhue et al ve své studii porovnávali použití Foleyova katétru a pooperačně zavedeného IUD, přičemž skupina pacientek s katétrem dosáhla vyšší úspěšnosti otěhotnění oproti skupině s IUD (33,9 vs. 22,5 %) a stejně tak byl signifikantní rozdíl v dosažení normálního menstruačního cyklus (81,4 vs. 62,7 %) [25]. Ve skupině pacientek s Foleyovým katétrem byla také nižší potřeba opakovaných výkonů. Nevýhodou této adjuvantní terapie je diskomfort zavedeného katétru pro pacientky a riziko ascendentní infekce. Pacientky proto po dobu zavedení katétru užívají antibiotickou léčbu, která s sebou přináší další možné komplikace (gastrointestinální obtíže, dysmikrobie). V některých zemích je dokonce běžné pacientku po dobu zavedení katétru hospitalizovat. Další obavy také panují z možného útlaku děložních stěn a s tím spojeným horším prokrvením s následným negativním vlivem na regeneraci endometria [11]. Na našem pracovišti využíváme Foleyův katétr pouze u pacientek s adhezemi v cervikoistmické oblasti nebo u pacientek s již známou výraznou rekurencí nitroděložních srůstů.
Nitroděložní balonek
Další mechanickou bariérou, kterou je možné použít v rámci sekundární prevence nitroděložních adhezí, jsou speciálně tvarované nitroděložní balonky srdčitého či trojúhelníkového tvaru (např. silikonový Cook Medical, Indianapolis, USA), které by měly být díky svému tvaru účinnější v prevenci adhezí v rozích a hranách děložních oproti Foleyově katétru [12]. V roce 2015 Lin et al v prospektivní randomizované kontrolované studii porovnávali přítomnost adhezí při kontrolní hysteroskopii provedené 1–2 měsíce od prvního zákroku ve skupinách pacientek po zavedení speciálně tvarovaného balonku s pacientkami po zavedení IUD s mědí [26] a výsledky neukázaly významné rozdíly. V roce 2018 vyšla studie porovnávající speciálně tvarovaný nitroděložní balonek s Foleyovým katétrem na souboru 150 žen, přičemž 3 měsíce po adheziolýze byly adheze znovu přítomny u 25 % žen se speciálním balonkem oproti 35,1 % žen s katétrem, nicméně rozdíl v rekurenci adhezí nevyšel statisticky významně [27]. Signifikantně větší rozdíl byl popsán pouze u podskupiny pacientek s těžkým stupněm onemocnění dle AFS (American Fertility Society) klasifikace z roku 1988, a to ve prospěch speciálně formovaného balonku.
Amniové membrány
Amniové membrány jsou získány tupou preparací z placenty a přilehlých obalů od pacientek s plánovaným císařským řezem, následně jsou promyty fyziologickým roztokem a antibiotiky. Pilotní studii s použitím amniových membrán v kombinaci s Foleyovým katétrem publikovali Amer et al v roce 2006 u 25 pacientek se středně těžkým a těžkým Ashermanovým syndromem [28]. Do následné prospektivní randomizované studie, jejíž výsledky byly publikovány v roce 2010, bylo zahrnuto 45 pacientek s těžkými adhezemi, které byly rozřazeny do třech skupin s použitím pouze katétru, katétru a čerstvého amniového preparátu a katétru s lyofilizovaným amniovým preparátem. Všechny pacientky užívaly po dobu 50 dnů hormonální léčbu. Při kontrolní hysteroskopii bylo signifikantní zlepšení výskytu adhezí ve skupinách s amniovými membránami oproti samotnému katétru, přičemž výraznější rozdíl byl při použití čerstvé membrány. Při hodnocení obnovení menstruace a podílu otěhotnění nebylo mezi skupinami dosaženo statisticky významných rozdílů [29]. V roce 2017 byla publikována studie porovnávající Foleyův katétr s čerstvou amniovou membránou (40 pacientek) a bez čerstvé amniové membrány (80 kontrol), přičemž rekurence adhezí i obnovení menstruačního krvácení vyšly statisticky signifikantně ve prospěch testované skupiny s amniovým preparátem [30].
Antiadhezivní preparáty
Kyselina hyaluronová, přirozená složka mezibuněčné hmoty, sklivce či synoviální tekutiny, byla již studována jako protisrůstová bariéra při abdominální operativě [31]. Její antiadhezivní efekt závisí na přípravě, molekulární hmotnosti a koncentraci kyseliny hyaluronové v konečném produktu. Vysoce viskózní gely na bázi ACP (auto-cross-linked polysacharid) se vyrábí kondenzací kyseliny hyaluronové (Hyalobarrier gel, Nordic Pharma) a patří k nejpoužívanějším semisolidním bariérám. V menší míře jsou ve studiích zastoupeny membrány tvořené z modifikované kyseliny hyaluronové a karboxymetylcelulózy (HA/CMC, Seprafilm, Genzyme Corporation, Cambridge, MA) či gel z polyetylenoxidu a karboxycelulózy (Intercoat, Gyncare, division of Ethicon, Inc., Somerville, NJ).
Antiadhezivní gely/membrány jsou relativně často využívány i v rámci primární prevence, kdy jsou aplikovány po hysteroskopických operačních výkonech či po chirurgickém řešení zamlklého těhotenství či inkompletního abortu. Jejich použití po hysteroskopické adheziolýze je také oblíbeným typem sekundární prevence (obr. 1, 2). V prospektivní randomizované kontrolované studii z roku 2003 bylo dle ultrazvukového vyšetření patrné, že antiadhezivní gel na bázi ACP separoval děložní stěny po dobu 72 hod, přičemž nitroděložní srůsty byly u pacientek s aplikací gelu při následné hysteroskopii patrné v signifikantně menším množství (14,0 %) než u pacientek bez gelu (31,7 %) [32]. Retrospektivní kohortová studie z roku 2013 porovnávající použití IUD, nitroděložního balonku a kyseliny hyaluronové s kontrolami po hysteroskopické adheziolýze vyšla nejlépe pro použití balonku, zatímco použití kyseliny hyaluronové se neukázalo jako efektivní v porovnání s ostatními možnostmi prevence či dokonce v porovnání s kontrolní skupinou [33]. V metaanalýze z roku 2019 bylo použití gelu s kyselinou hyaluronouvou spojeno s možným snížením rekurence intrauterinních adhezí, avšak bez signifikantního vlivu na následné otěhotnění [34].
Image 1. Aplikace gelu s kyselinou hyaluronovou na závěr operační hysteroskopie.
Fig. 1. Application of gel with hyaluronic acid at the end of hysteroscopic surgery.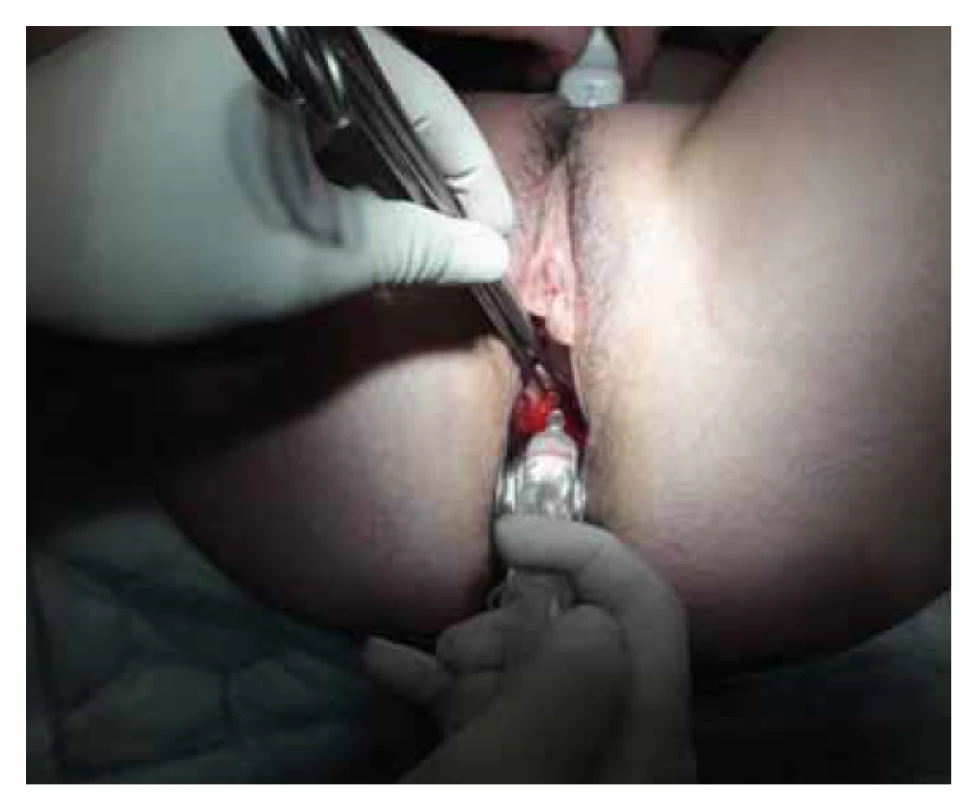
Image 2. Ultrazvukové zobrazení aplikace antiadhezivního gelu s patrnou separací stěn dutiny děložní.
Fig. 2. Ultrasound imaging of the application of antiadhesive gel with visualization of the separation of uterine walls.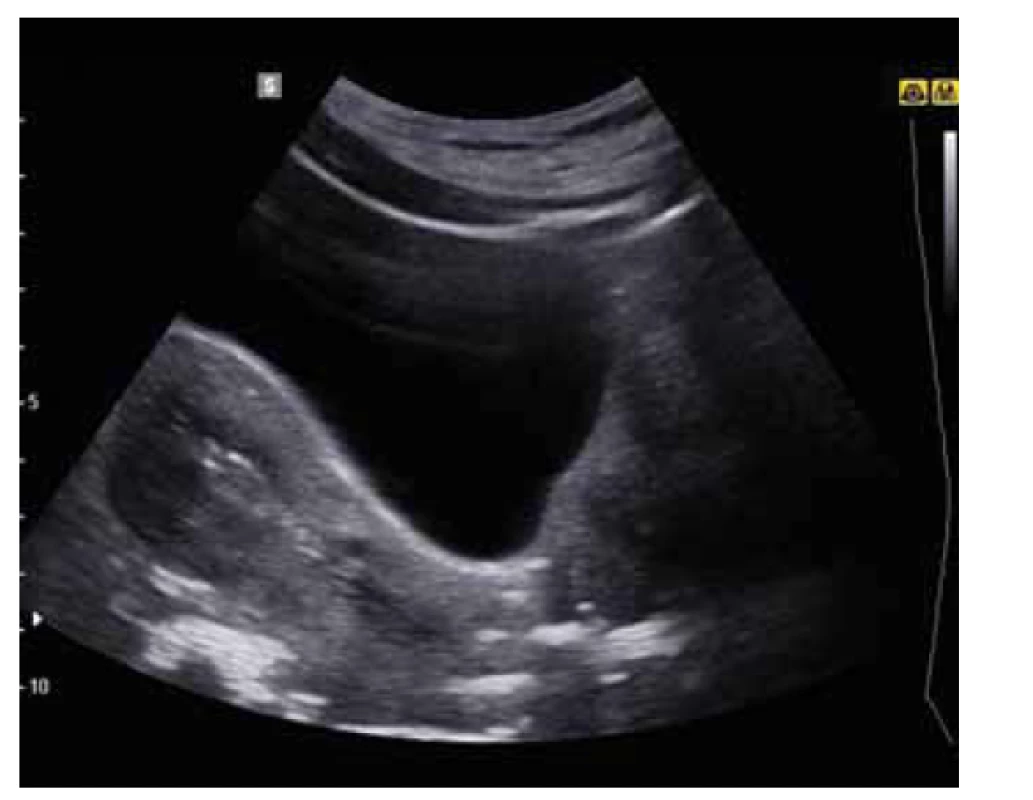
Další metody sekundární prevence
V malé klinické studii bylo vyhodnocováno použití plazmy bohaté na krevní destičky (platelet-rich plasma) aplikované po extrakci Foleyova katétru zavedeného na 2 dny po hysteroskopické adheziolýze. V porovnání s kontrolami nebyl prokázán žádný vliv na přítomnost adhezí při následné hysteroskopii ani v úpravě menstruačního cyklu [35].
Malé studie hodnotily využití různých preparátů ve snaze zvýšit perfuzi endometria jako např. aspirin, nitroglycerin či sildenafil citrát [18]. Prospektivní kohortová studie zjistila pozitivní vliv na růst endometria přidáním aspirinu k hormonální terapii a nitroděložně zavedenému balonku bez vlivu na schopnost otěhotnění [36]. Nicméně vzhledem k doposud malým číslům zatím žádný z podobných léků není odbornými společnostmi doporučován a jejich užívání v této indikaci je zatím možné pouze v rámci klinických studií.
Přestože infekce je jednou z možných patogenetických faktorů vzniku Ashermanova syndromu, perioperační aplikace antibiotik či následná antibiotická terapie po výkonu nemá podporu v žádných studiích – přesto je mnohými gynekology stále využívána, neboť je zde teoretické riziko sekundární infekce [18]. Antibiotické krytí je plošně užíváno pouze po zavedení nitroděložního balonku či katétru.
Budoucnost sekundární prevence
Doposud pouze na poli experimentálním je hodnoceno využití kmenových buněk v rámci regenerace endometria. Na zvířecích modelech a malých souborech pacientek bylo popsáno využití kmenových buněk odvozených z kostní dřeně, mezenchymálních kmenových buněk, kmenových buněk tukové tkáně, kmenových buněk z pupečníkové krve či amniální tekutiny, autologních stromálních buněk získaných z menstruační krve (menSCs – menstrual blood-derived stromal cells) či pouze sekretomu kmenových buněk [13,37–39]. MenSCs jsou adultní multipotentní vysoce proliferativní kmenové buňky většinou obsahující mezenchymální kmenové buňky a stromální fibroblasty a jejich využití je výhodné pro absenci invazivního odběru a jejich nízkou tumorogenicitu a imunogenicitu [37,39]. Cesty aplikace se ve studiích liší. Popsána byla instilace kmenových buněk katétrem do spirálních arterií, transmyometriálně do subendometriální vrstvy či přímé podání do dutiny děložní po poškrábání endometria [13]. Podle dostupných dat by léčba pomocí kmenových buněk mohla mít pozitivní vliv na tloušťku endometria, úpravu menstruačního cyklu a snad i na zlepšení reprodukčních výsledků [40]. Nicméně dat je stále ještě málo a od rutinního užívání má tato metoda ještě pořádný kus cesty.
Závěr
Bohatý výběr možností metod sekundární prevence není bohužel dokladem široké nabídky účinných nástrojů, ale spíše důkazem stálého pátrání po ideálním řešení. Provedeny byly i mnohé metaanalýzy, jež se však ve volbě optimální metody sekundární prevence rovněž neshodují. Jedním z důvodů obtížného porovnávání je nedostatek randomizovaných prospektivních studií a dále různé výstupy, které jsou ve studiích hodnoceny. Většina doporučení se shoduje na zařazení časné second-look hysteroskopie a užívání následné hormonální léčby v kombinaci se solidní či semisolidní bariérovou metodou.
Doručeno/Submitted: 20. 4. 2021
Přijato/Accepted: 17. 6. 2021
MUDr. Barbora Boudová
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
U Nemocnice 2
128 02 Praha 2
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Dedikace: Práce vznikla za podpory projektu MZ ČR – RVO (VFN: 00064165) a UK v Praze (UNCE: 204065).
Dedication: The work was supported by the Ministry of Health of the Czech Republic – RVO (VFN: 00064165) and Charles University in Prague (UNCE: 204065).
Sources
1. Fritsch H. Ein Fall von volligen Schwund der Gebaumutterhohle nach Auskratzung. Zentralbl Gynaekol 1894; 18 : 1337–1342.
2. Asherman JG. Amenorrhoea traumatica (atretica). J Obstet Gynaecol Br Emp 1948; 55 (1): 23–30. doi: 10.1111/j.1471-0528.1948.tb07045.x.
3. Asherman JG. Traumatic intra-uterine adhesions. J Obstet Gynaecol Br Emp 1950; 57 (6): 892–896. doi: 10.1111/j.1471-0528.1950.tb06053.x.
4. Asherman JG. Traumatic intrauterine adhesions and their effects on fertility. Int J Fertil 1957; 2 : 49–54.
5. Schenker JG. Etiology of and therapeutic approach to synechia uteri. Eur J Obstet Gynecol Reprod Biol 1996; 65 (1): 109–113. doi: 10.1016/0028-2243 (95) 02315-j.
6. Schenker JG, Margalioth EJ. Intrauterine adhesions: an updated appraisal. Fertil Steril 1982; 37 (5): 593–610. doi: 10.1016/s0015-0282 (16) 46268-0.
7. Hrazdirová L, Kužel D, Žižka Z. Ashermanův syndrom I – historie, prevalence, histopatologie, klasifikace, etiologie, symptomatologie a vyšetřovací metody. Ceska Gynekol 2010; 75 (6): 492–498.
8. Sebbag L, Even M, Fay S et al. Early second-look hysteroscopy: prevention and treatment of intrauterine post-surgical adhesions. Front Surg 2019; 6 : 50. doi: 10.3389/fsurg.2019.00 050.
9. Mara M, Horak P, Kubinova K et al. Hysteroscopy after uterine fibroid embolization: evaluation of intrauterine findings in 127 patients. J Obstet Gynaecol Res 2012; 38 (5): 823–831. doi: 10.1111/j.1447-0756.2011.01782.x.
10. March CM. Management of Asherman‘s syndrome. Reprod Biomed Online 2011; 23 (1): 63–76. doi: 10.1016/j.rbmo.2010.11.018.
11. Yu D, Wong YM, Cheong Y et al. Asherman syndrome – one century later. Fertil Steril 2008; 89 (4): 759–779. doi: 10.1016/j.fertnstert. 2008.02.096.
12. Hrazdirová L, Kužel D, Žižka Z. Ashermanův syndrom II – terapie, asistencní metody, prevence readhezí, komplikace a výsledky lécby. Ceska Gynekol 2010; 75 (6): 499–506.
13. Dreisler E, Kjer JJ. Asherman‘s syndrome: current perspectives on diagnosis and management. Int J Womens Health 2019; 11 : 191–198. doi: 10.2147/IJWH.S165474.
14. Hanstede MM, van der Meij E, Goedemans L et al. Results of centralized Asherman surgery, 2003–2013. Fertil Steril 2015; 104 (6): 1561–1568. doi: 10.1016/j.fertnstert.2015.08.039.
15. Li C, Wei ML, Lin XN et al. Effects of early intervention of second-look office hysteroscopy in the prevention of adhesion reformation for moderate-severe Asherman‘s syndrome. Zhonghua Yi Xue Za Zhi 2013; 93 (45): 3617–3619.
16. Xu W, Zhang Y, Yang Y et al. Effect of early second-look hysteroscopy on reproductive outcomes after hysteroscopic adhesiolysis in patients with intrauterine adhesion, a retrospective study in China. Int J Surg 2018; 50: 49–54. doi: 10.1016/j.ijsu.2017.11.040.
17. Wood J, Pena G. Treatment of traumatic uterine synechias. Int J Fertil 1964; 9 : 405–410.
18. AAGL Elevating Gynecologic Surgery. AAGL practice report: practice guidelines on intrauterine adhesions developed in collaboration with the European Society of Gynaecological Endoscopy (ESGE). Gynecol Surg 2017; 14 (1): 6. doi: 10.1186/s10397-017-1007-3.
19. Guo J, Li TC, Liu Y et al. A prospective, randomized, controlled trial comparing two doses of oestrogen therapy after hysteroscopic adhesiolysis to prevent intrauterine adhesion recurrence. Reprod Biomed Online 2017; 35 (5): 555–561. doi: 10.1016/j.rbmo.2017.07. 011.
20. Liu L, Huang X, Xia E et al. A cohort study comparing 4 mg and 10 mg daily doses of postoperative oestradiol therapy to prevent adhesion reformation after hysteroscopic adhesiolysis. Hum Fertil (Camb) 2019; 22 (3): 191–197. doi: 10.1080/14647273.2018.1444 798.
21. Conforti A, Alviggi C, Mollo A et al. The management of Asherman syndrome: a review of literature. Reprod Biol Endocrinol 2013; 11 : 118. doi: 10.1186/1477-7827-11-118.
22. Vesce F, Jorizzo G, Bianciotto A et al. Use of the copper intrauterine device in the management of secondary amenorrhea. Fertil Steril 2000; 73 (1): 162–165. doi: 10.1016/s0015 - 0282 (99) 00475-6.
23. Tonguc EA, Var T, Yilmaz N et al. Intrauterine device or estrogen treatment after hysteroscopic uterine septum resection. Int J Gynaecol Obstet 2010; 109 (3): 226–229. doi: 10.1016/j.ijgo.2009.12.015.
24. Amer MI, El Nadim A, Hassanein K. The role of intrauterine baloon after operative hysteroscopy in the prevention of intrauterine adhesion: a prospective controlled study. MEFS J 2005; 10 : 125–129.
25. Orhue AA, Aziken ME, Igbefoh JO. A comparison of two adjunctive treatments for intrauterine adhesions following lysis. Int J Gynaecol Obstet 2003; 82 (1): 49–56. doi: 10.1016/s0020-7292 (03) 00030-4.
26. Lin XN, Zhou F, Wei ML et al. Randomized, controlled trial comparing the efficacy of intrauterine balloon and intrauterine contraceptive device in the prevention of adhesion reformation after hysteroscopic adhesiolysis. Fertil Steril 2015; 104 (1): 235–240. doi: 10.1016/j.fertnstert.2015.04.008.
27. Zhu R, Duan H, Gan L et al. Comparison of intrauterine suitable balloon and foley balloon in the prevention of adhesion after hysteroscopic adhesiolysis. Biomed Res Int 2018; 2018 : 9494101. doi: 10.1155/2018/9494 101.
28. Amer MI, Abd-El-Maeboud KH. Amnion graft following hysteroscopic lysis of intrauterine adhesions. J Obstet Gynaecol Res 2006; 32 (6): 559–566. doi: 10.1111/j.1447-0756.2006.00 454.x.
29. Amer MI, Abd-El-Maeboud KH, Abdelfatah I et al. Human amnion as a temporary biologic barrier after hysteroscopic lysis of severe intrauterine adhesions: pilot study. J Minim Invasive Gynecol 2010; 17 (5): 605–611. doi: 10.1016/j.jmig.2010.03.019.
30. Peng X, Li T, Zhao Y et al. Safety and efficacy of amnion graft in preventing reformation of intrauterine adhesions. J Minim Invasive Gynecol 2017; 24 (7): 1204–1210. doi: 10.1016/j.jmig.2017.08.005.
31. Kužel D, Mára M. Prevence tvorby adhezí a jejich léčba. Ceska Gynekol 2011; 76 (1): 73–76.
32. Acunzo G, Guida M, Pellicano M et al. Effectiveness of auto-cross-linked hyaluronic acid gel in the prevention of intrauterine adhesions after hysteroscopic adhesiolysis: a prospective, randomized, controlled study. Hum Reprod 2003; 18 (9): 1918–1921. doi: 10.1093/humrep/deg 368.
33. Lin X, Wei M, Li TC et al. A comparison of intrauterine balloon, intrauterine contraceptive device and hyaluronic acid gel in the prevention of adhesion reformation following hysteroscopic surgery for Asherman syndrome: a cohort study. Eur J Obstet Gynecol Reprod Biol 2013; 170 (2): 512–516. doi: 10.1016/j.ejogrb.2013.07. 018.
34. Fei Z, Bin Z, Xin X et al. Meta-analysis on the use of hyaluronic acid gel to prevent recurrence of intrauterine adhesion after hysteroscopic adhesiolysis. Taiwan J Obstet Gynecol 2019; 58 (6): 731–736. doi: 10.1016/j.tjog.2019.09. 002.
35. Javaheri A, Kianfar K, Pourmasumi S et al. Platelet-rich plasma in the management of Asherman‘s syndrome: an RCT. Int J Reprod Biomed 2020; 18 (2): 113–120. doi: 10.18502/ijrm.v18i2.6423.
36. Chen Y, Liu L, Luo Y et al. Effects of aspirin and intrauterine balloon on endometrial repair and reproductive prognosis in patients with severe intrauterine adhesion: a prospective cohort study. Biomed Res Int 2017; 2017 : 8526104. doi: 10.1155/2017/8526104.
37. Chen L, Qu J, Xiang C. The multi-functional roles of menstrual blood-derived stem cells in regenerative medicine. Stem Cell Res Ther 2019; 10 (1): 1. doi: 10.1186/s13287-018-1 105-9.
38. Liu F, Hu S, Yang H et al. Hyaluronic acid hydrogel integrated with mesenchymal stem cell-secretome to treat endometrial injury in a rat model of Asherman‘s syndrome. Adv Healthc Mater 2019; 8 (14): e1900411. doi: 10.1002/adhm.201900411.
39. Benor A, Gay S, DeCherney A. An update on stem cell therapy for Asherman syndrome. J Assist Reprod Genet 2020; 37 (7): 1511–1529. doi: 10.1007/s10815-020-01801-x.
40. Zhao Y, Luo Q, Zhang X et al. Clinical efficacy and safety of stem cell-based therapy in treating asherman syndrome: a system review and meta-analysis. Stem Cells Int 2020; 2020 : 8820538. doi: 10.1155/2020/8820538.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2021 Issue 4-
All articles in this issue
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Kongenitální syfilis jako příčina úmrtí novorozence ve 31. týdnu gravidity – význam testování na syfilis v průběhu gravidity
- Možnosti léčby lokálně recidivujícího karcinomu vulvy
- Recidiva vzácného maligního Brennerova tumoru ovaria
- Molekulární klasifikace endometriálních karcinomů převedená do praxe
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Prevence tvorby de novo adhezí u pacientek s Ashermanovým syndromem
- Pánevní neuropatická bolest (diferenciální diagnostika)
- Historie a současné trendy v léčbě idiopatického hyperaktivního měchýře
- Matrixové metaloproteinázy MMP-2 a MMP-9 jako markery predikce preeklampsie v prvním trimestru
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pánevní neuropatická bolest (diferenciální diagnostika)
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Recidiva vzácného maligního Brennerova tumoru ovaria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

