-
Medical journals
- Career
Molekulární klasifikace endometriálních karcinomů převedená do praxe
Authors: Presl J. 1; Vaněček T. 2; Michal M. 2; Bouda J. 1; Kosťun J. 1; Vlasák P. 1; Stráník P. 1
Authors‘ workplace: Gynekologicko-porodnická klinika LF UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Published in: Ceska Gynekol 2021; 86(4): 258-262
Category: Review Article
doi: https://doi.org/10.48095/cccg2021258Overview
Cíl: Hlavním cílem článku je přehledně informovat odbornou veřejnost o podobě nově implementované molekulární klasifikace endometriálního karcinomu do praxe. Metodika: Souhrn aktuálních poznatků, doporučení a nových postupů týkajících se molekulárně genetického vyšetřování tkání pacientek s endometriálním karcinomem. Výsledky: Endometriální karcinom je v současnosti diagnostikován na základě histopatologické morfologie. Dle klasického Bokhmanova dělení rozeznáváme dvě poměrně široké skupiny nádorů rozdílných v patogenezi. Typ I – estrogen-dependentní nádory, klinicky zpravidla indolentní, a typ II – non-endometrioidní nádory, klinicky agresivní, bez závislosti na stimulaci estrogeny. Tato klasifikace splňuje didaktický účel, poskytuje snadnou orientaci pro epidemiologická data, avšak není vhodná ke stratifikaci vzhledem k prolínání klinických, patologických i molekulárních vlastností. Projekt Genomový atlas nádorů řadí endometriální tumory do čtyř skupin na základě molekulárně genetických vlastností. Závěr: Integrace histopatologického nálezu spolu s molekulární klasifikací se jeví jako nejlepší přístup pro hodnocení každého jednotlivého nádoru. Dosáhneme tím ideální stratifikace pacientek pro léčebná schémata.
Klíčová slova:
endometriální karcinom – molekulární klasifikace – projekt Genomový atlas nádorů – POLE mutace – mismatch repair-deficientní nádory – nespecifický molekulární profil – TP53 mutace
Úvod
Karcinomy endometria máme často tendenci paušalizovat jako „snadno léčitelné“ nádory. S novými poznatky a vysokou incidencí však zjišťujeme heterogenitu této diagnostické jednotky a s tím související nutnost optimalizace a individualizace léčby.
Metodika a výsledky
Endometriální karcinom je nejčastější gynekologickou malignitou. Dlouhodobě můžeme pozorovat stagnující či mírně se zvyšující incidenci. Dle dat z Národního onkologického registru (NOR) dostupných toho času z roku 2018 byla incidence 34,9 nových případů na 100 000 žen za rok, mortalita pak 8,14 na 100 000 žen za rok (obr. 1). Maximum výskytu je u postmenopauzálních žen v 6. a 7. decenniu. Většina nálezů je zachycena v prvním stadiu (65 %) vzhledem k časným příznakům ve formě krvácení či špinění. Celoživotní riziko v nezatížené populaci se pohybuje kolem 3 %, u geneticky zatížené populace pak kolem 40–60 % v případě Lynchova syndromu.
Image 1. Incidence a mortalita rakoviny těla děložního na 100 000 osob.
Fig. 1. Incidence and mortality of uterine body cancers per 100,000 persons.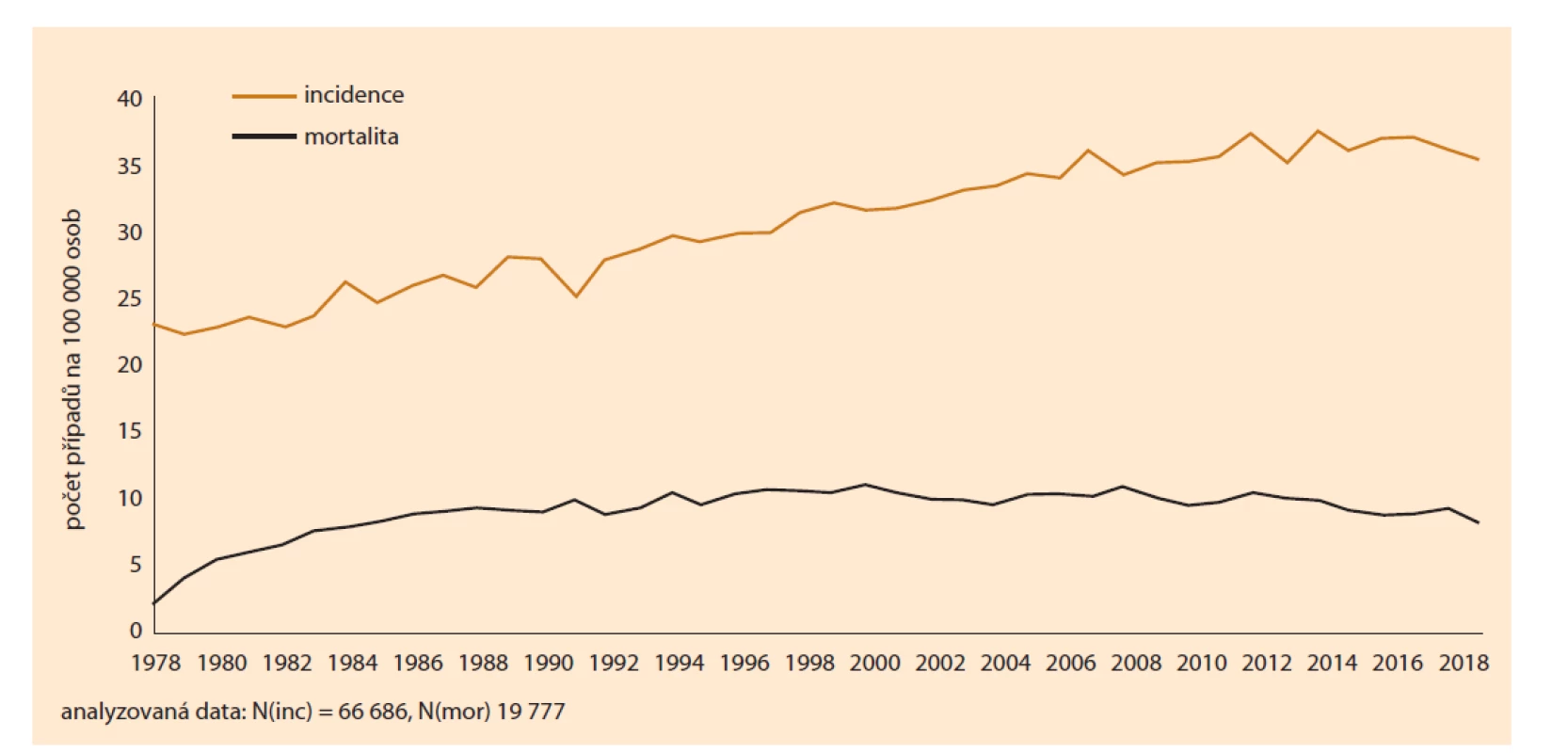
Po klinickém a ultrazvukovém vyšetření potvrzuje diagnózu definitivně biopsie z dutiny děložní. Preferovaným přístupem je hysteroskopický odběr, při krvácení pak kyretáž.
Endometriální karcinom je v současnosti diagnostikován na základě histopatologické morfologie. Dle dlouho používaného Bokhmanova dělení rozeznáváme dvě poměrně široké skupiny nádorů rozdílných v patogenezi [1]. Typ I jsou nádory estrogen-dependentní a klinicky zpravidla indolentní. Patří sem zejména endometrioidní karcinom. Typ II pak zahrnuje non-endometrioidní nádory, klinicky agresivní, bez závislosti na stimulaci estrogeny. Patří sem především serózní a světlobuněčné karcinomy. Tato klasifikace splňuje didaktický účel, poskytuje snadnou orientaci pro epidemiologická data, avšak není vhodná ke stratifikaci vzhledem k prolínání klinických, patologických i molekulárních vlastností. Nízce maligní nádory zpravidla nečiní patologovi větší potíže. Problém nastává u vysoce maligních nádorů, kde se často můžeme setkat s intra - i interobserver variabilitou.
Nově se ve většině zemí nahrazuje klasická morfologická klasifikace adenokarcinomů endometria molekulární klasifikací. První krok k této klasifikaci byl udělán objevem možnosti rozdělit nádory endometria do čtyř základních skupin podle genetických parametrů, které vyšly najevo při publikování seminární práce o Genomovém atlasu nádorů.
Genomový atlas nádorů (TGCA – The Cancer Genome Atlas) byl poprvé prezentován v roce 2013 [2]. Tato molekulárně genetická klasifikace rozlišuje čtyři skupiny nádorů, a to na základě množství somatických mutací a počtu numerických genetických alterací:
1.Ultramutované endometriální karcinomy – nesoucí mutace na exonukleázové doméně DNA polymerázy epsilon – POLE mutace.
2.Hypermutované endometriální karcinomy – mismatch repair-deficientní nádory (dMMR), s mikrosatelitární instabilitou.
3.Copy number low skupina endometriálních nádorů – non-specific molecular profile (NSMP) – nádory s nespecifickým molekulárním profilem.
4.Copy number high skupina endometriálních nádorů – nádory s TP53 mutacemi.
Rozlišení mezi těmito čtyřmi skupinami se ukázalo jako prognosticky zásadní.
1. Ultramutované endometriální karcinomy
Tvoří asi 6–12 % všech nádorů endometria. Vykazují inaktivaci DNA polymerázy ε (POLE), což rezultuje ve velký počet somatických mutací. Proto se také označují jako POLE-ultramutovaná skupina. Jedná se většinou o vysoce maligní nádory (grade 3) v časném stadiu (obr. 2), u mladších žen s nízkým BMI (body mass index). Typická je pro ně vynikající prognóza nezávislá na stadiu onemocnění [3–5] a dlouhodobé přežívání i bez adjuvantní terapie dosahující ve většině publikací 98–100 %. U této skupiny pacientů bylo zjištěno, že radioterapie a chemoterapie má na tuto skupinu nádorů minimální až žádný efekt. U těch několika výjimečných případů, kdy POLE-mutované nádory progredovaly, byla zjištěna velká citlivost těchto nádorů na imunoterapii.
Image 2. Špatně diferencovaný endometriální adenokarcinom (grade 3), mající mutace v genu POLE (c.1376C>T), p.(Ser459Phe).
Fig. 2. Poorly differentiated endometrial adenocarcinoma (grade 3) with mutations in the POLE gene (c.1376C> T), p. (Ser459Phe).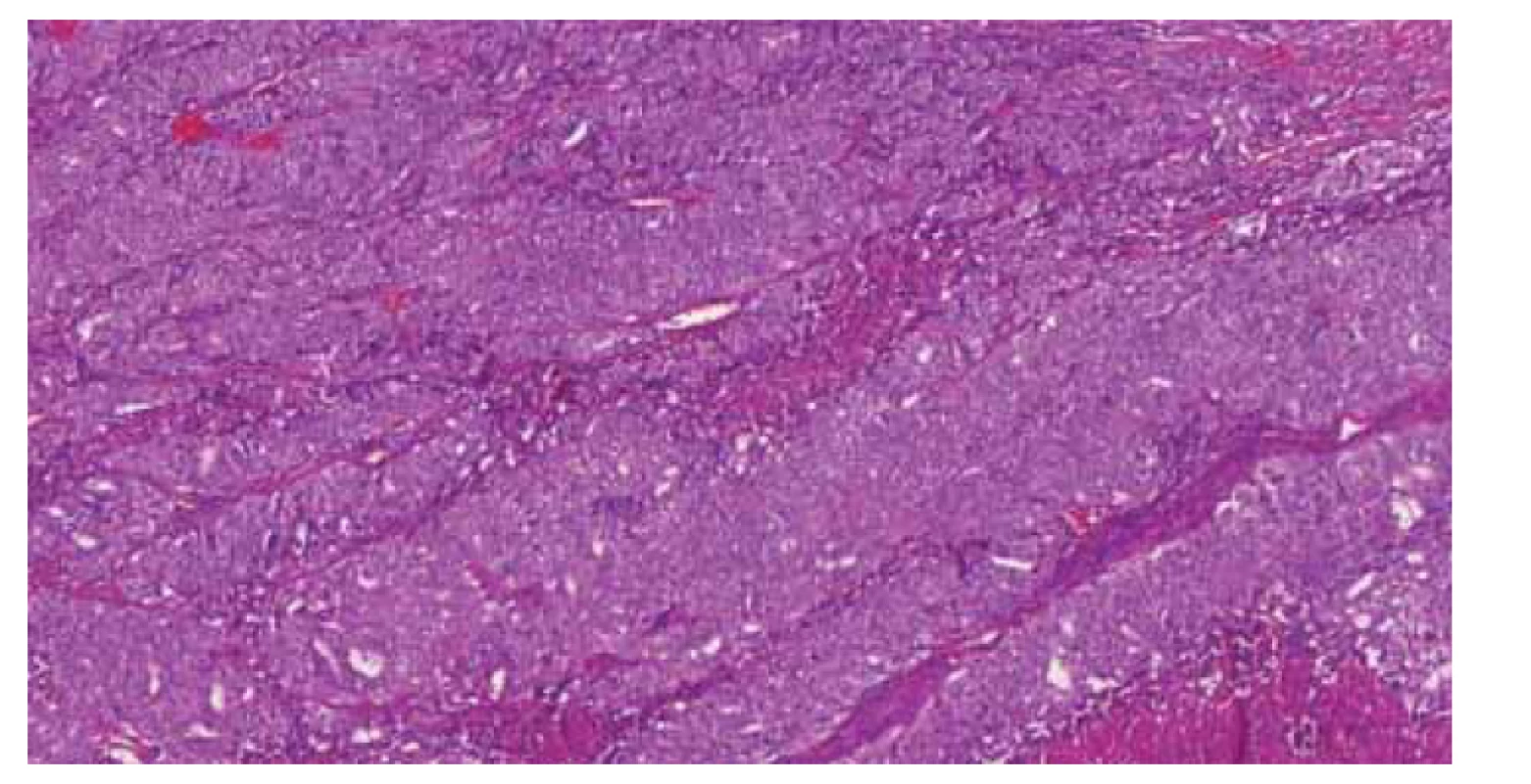
2. Hypermutované endometriální karcinomy
Tvoří kolem 25–30 % nádorů. Skupina zahrnuje MSI karcinomy (karcinomy s mikrosatelitární instabilitou) s vysokým počtem mutací. Prakticky výhradně se jedná o endometrioidní nádory všech grade stupňů, i když převažuje grade 3. Často je přítomna lymfovaskulární invaze. Jejich prognózu lze charakterizovat jako intermediální, závislou na stadiu onemocnění [4,5]. Část těchto nádorů mají pacienti s Lynchovým syndromem, kteří spadají do této skupiny. Velice důležité je to, že nádory v této skupině velmi dobře reagují na imunoterapii.
3. Copy number low endometriální karcinomy
Název odráží nízké množství početních změn chromozomů. Zahrnuje největší množství nálezů (40–60 %). Patří sem endometriální karcinomy s nízkým počtem somatických početních alterací (copy number low) a nízkou mutační náloží. Jsou také označovány jako tumory s nespecifickým molekulárním profilem (NSMP). Jedná se často o nízce maligní tumory nesoucí estrogenní i progesteronové receptory. Typická pacientka je starší žena s vysokým BMI. Její prognóza je tedy závislá na stadiu onemocnění, další charakteristice nádoru a lze ji opět označit jako intermediální až dobrou [6]. Tato skupina je, co do genetické charakteristiky, nejvíce heterogenní a je zřejmé, že se v budoucnosti nejspíš rozčlení a bude dávat vznik dalším skupinám.
4. Copy number high endometriální karcinomy
Název odráží vysoké množství početních změn chromozomů. Čítá 15–25 % nádorů endometria. Typické jsou pro ně mutace nebo delece v genu TP53. Skupina je označována jako copy number high group a patří do ní zejména serózní karcinomy, karcinosarkomy, asi 50 % světlobuněčných karcinomů a některé vysoce maligní endometrioidní karcinomy. Jedná se zpravidla o pacientky s pokročilými nálezy mající špatnou prognózou [7].
Užití molekulární klasifikace znázorňuje schéma 1.
Schéma 1. Schéma užití markerů molekulární klasifikace [14].
Scheme 1. Scheme of the use of molecular classification markers [14].![Schéma 1. Schéma užití markerů molekulární klasifikace [14].<br>
Scheme 1. Scheme of the use of molecular classification markers [14].](https://pl-master.mdcdn.cz/media/image_pdf/8678bc6edd62cff2ac556f5066a464e8.png?version=1630004587)
Diskuze
Původní koncept dělení karcinomů endometria na dva typy a z toho vycházející stratifikace pacientek dle rizika je nově překonána molekulárně genetickou klasifikací. Čtyři molekulární subtypy nádorů můžeme nalézt v obou původních skupinách a toto nové dělení přináší zásadní změnu v risk-stratifikaci pacientek a jejich nálezů co do prognózy a do budoucna přinese nové možnosti léčebných přístupů. Velmi důležitý je při detekci těchto nádorů výběr vyšetřovací metody. POLE-mutované nádory první skupiny lze detekovat jednak klasickou Sangerovskou sekvenací anebo modernější NGS (next-generation sequencing). Sangerovská sekvenace je pro detekci POLE mutací mnohem méně citlivá než NGS sekvenace a je schopna detekovat pouze poloviční množství těchto pacientů (5–6 % u Sangerovské sekvenace vs. 10–12 % u NGS sekvenace, což souvisí s vyšší analytickou citlivostí NGS). Volba panelu a jeho rozsahu je individuální. Naše pracoviště zahájilo proces molekulárně genetického vyšetřování výhradně cestou NGS a pro tento účel využíváme customizovaný NGS onkopanel od společnosti ArcherDX (Boulder, Colorado, USA) zahrnující mutace a numerické variace celkem 16 genů (BRCA1, BRCA2, BCOR, MLH1, MSH2, MSH6, PMS2, NRAS, TP53, POLE, POLD1, ARID1A1, CTNNB1, KRAS, PIK3CA, PTEN). Velkou výhodou tohoto NGS onkopanelu je nejen mnohem vyšší diagnostická citlivost než při Sangerovské sekvenaci, ale možnost současně detekovat s POLE mutacemi i jiné mutace a numerické aberace, které jsou terapeuticky ovlivnitelné – ať již nyní, tak doufejme v blízké budoucnosti, např. BRCA1, BRCA2, HER2, PIK3CA a PTEN [8,9]. NGS sekvenace navíc, díky analýze v panelu přítomných MMR (mismatch repair) genů, dovoluje geneticky posoudit přítomnost Lynchova syndromu u těchto pacientů. Nevýhodou NGS je nutnost vybavení laboratoře NGS sekvenátorem, což je finančně nákladné, a tým genetiků, který má s touto sofistikovanou metodikou zkušenosti.
Velmi důležité je geneticky rozpoznat patogenní POLE mutace od nepatogenních POLE mutací. Jako patogenní se dnes uznávají mutace POLE genu v těchto kodonech: P286R, V411L, S297F, A456P, S459F, F367S, L424I, M295R, P436R, M444K a D368Y. Je zřejmé, že množství patogenních POLE mutací bude časem přibývat. Při nálezu neznámé POLE mutace u endometriálního karcinomu se u něj posuzuje tzv. tumorózní mutační nálož a proporce C>A, T>G a C>G substitucí. Posouzení těchto parametrů se v našich podmínkách provádí následnou NGS nádorů za použití TS500 onkopanelu od firmy Illumina (San Diego, Kalifornie, USA). Ukazuje se, že takto sestavené vyšetření umožňuje získat velké množství cenných informací pro aktuální léčbu a další studování molekulárně genetického pozadí těchto nádorů. Data budou v blízké budoucnosti předmětem samostatné publikace.
Nádory druhé skupiny vykazují mutace v genech MLH1, MSH2, MSH6, PMS2 nebo hypermetylaci promotoru pro MLH1 gen. Tyto změny je možno prokázat buď geneticky NGS, anebo imunohistochemicky, neboť tyto nádory vykazují imunohistochemickou negativitu s protilátkami proti MMR proteinům (MLH1, MSH2, MSH6, PMS2).
Třetí skupina je nejvíce heterogenní. Již dnes je zde možné nalézt mutace, které mohou tuto skupinu nádorů v budoucnu dále rozdělit. Např. přítomnost mutace v CTNNB1 (β-katenin) zhoršuje prognózu pacientek a zkracuje jejich přežívání oproti NSMP nádoru bez mutace CTNNB1. Přítomnost L1CAM (L1-cell adhesion molecule) overexprese, která je silně spojena s mutacemi TP53, vysokým gradem tumorů, non-endometrioidní histologií a přítomností lymfovaskulární invaze (LVSI – lymphovascular space invasion), slouží jako nezávislý rizikový faktor lokoregionálního a vzdáleného šíření a rekurence tumoru. Amplifikace lokusu 1q32.1 je pak spojena se špatnou prognózou u NSMP tumorů [10]. Dále je možno u této skupiny nalézt mutace v genech PI3K, PTEN a KRAS.
Aberace v TP53 genu u nádorů čtvrté skupiny je možno prokázat jak geneticky, tak imunohistochemicky. Jako velice důležitý risk-stratifikační faktor se hodnotí rozsah lymfovaskulární invaze tumoru v tkáni.
Tyto nové poznatky se široce zavádějí do praxe a mají již nyní zásadní vliv na změny v přístupu k indikaci adjuvantní terapie. Pacientky s POLE-ultramutovanými nádory budou moci zůstat bez náročné adjuvantní léčby. To platí zejména pro časná stadia. Molekulárně genetickým přístupem bude možno lépe vyselektovat pacientky s nejvyšší pravděpodobností odpovědi na chemoterapii. Mělo by se jednat o skupinu nádorů s nespecifickým molekulárním profilem (NSMP) a TP53-mutované nádory.
Další novou možností cílené léčby se jeví imunoterapie checkpoint inhibitory [11], která zatím není v našich podmínkách v této indikaci schválena. Ta by přicházela v úvahu zejména u hypermutovaných endometriálních karcinomů dMMR. Do hry dále pravděpodobně vstoupí PARP inhibitory (inhibitory poly-ADP-ribóza polymerázy) u TP53-mutovaných tumorů s defektem homologní rekombinace a další cílená léčba.
Právě probíhající PORTEC-4a studie má za cíl prospektivně zjistit, jak integrovat výsledky molekulární klasifikace do rozhodnutí o adjuvantní léčbě zejména u high-intermediate risk skupiny pacientek [12]. Již nyní je největším přínosem molekulární klasifikace nádorů endometria možnost definovat skupinu až 12 % pacientek majících POLE mutaci, které nemusí podstupovat velice náročnou chemoterapii a radioterapii.
Závěr
Molekulární klasifikace endometriálních karcinomů již má své stálé místo v mezinárodních guidelines vč. Evropské společnosti pro gynekologickou onkologii (ESGO – European Society of Gynaecological Oncology) [13]. Zavedení uvedeného postupu v našich podmínkách je v režii každého pracoviště. Stávající histopatologická diagnostika musí zůstat nedílnou součástí vyšetření. Dává nám informaci o histologickém typu nádoru, gradingu a zhodnocení angioinvaze (LVSI). Integrace histopatologického nálezu spolu s molekulární klasifikací se však jeví jako nejlepší přístup pro hodnocení každého jednotlivého nádoru a ke stratifikaci pacientek pro léčebné schéma. Základní podmínkou jsou však finanční zdroje na toto nákladné komplexní vyšetření. Ideální je vyšetřovat všechny karcinomy endometria. Pokud to není možné, pak by hlavní pozornost měla být věnována vysoce maligním (grade 3, tradiční typ II) tumorům, kde právě selekce POLE-mutovaných nádorů může pacientku ušetřit náročné onkologické léčby se všemi vedlejšími účinky. Naše komplexní onkologické centrum rutinně nabízí toto komplexní vyšetření u všech žen s touto nejčastější gynekologickou malignitou.
Doručeno/Submitted: 26. 4. 2021
Přijato/Accepted: 24. 5. 2021
doc. MUDr. Jiří Presl, Ph.D.
Gynekologicko-porodnická klinika,LF UK a FN Plzeň
Alej Svobody 923/80
304 60 Plzeň-Lochotín
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Sources
1. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15 (1): 10–17. doi: 10.1016/0090-8258 (83) 90111-7.
2. Kandoth C, Schultz N, Cherniack AD et al. Cancer Genome Atlas Research Network. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497 (7447): 67–73. doi: 10.1038/nature12113.
3. van Gool IC, Eggink FA, Freeman-Mills L et al. POLE proofreading mutations elicit an antitumor immune response in endometrial cancer. Clin Cancer Res 2015; 21 (14): 3347–3355. doi: 10.1158/1078-0432.CCR-15-0057.
4. Howitt BE, Shukla SA, Sholl LM et al. Association of polymerase e-mutated and microsatellite-instable endometrial cancers with neoantigen load, number of tumor-infiltrating lymphocytes, and expression of PD-1 and PD-L1. JAMA Oncol 2015; 1 (9): 1319–1323. doi: 10.1001/jamaoncol.2015.2151.
5. Stelloo E, Nout RA, Osse EM et al. Improved risk assessment by integrating molecular and clinicopathological factors in early-stage endometrial cancer-combined analysis of the PORTEC cohorts. Clin Cancer Res 2016; 22 (16): 4215–4224. doi: 10.1158/1078-0432.CCR-15-2 878.
6. Horeweg N, de Bruyn M, Nout RA et al. Prognostic integrated image-based immune and molecular profiling in early-stage endometrial cancer. Cancer Immunol Res 2020; 8 (12): 1508–1519. doi: 10.1158/2326-6066.CIR-20-0149.
7. León-Castillo A, de Boer SM, Powell ME et al. Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: impact on prognosis and benefit from adjuvant therapy. J Clin Oncol 2020; 38 (29): 3388–3397. doi: 10.1200/JCO.20.00549.
8. Banet N, Shahi M, Batista D et al. HER-2 amplification in uterine serous carcinoma and serous endometrial intraepithelial carcinoma. Am J Surg Pathol 2021; 45 (5): 708–715. doi: 10.1097/PAS.0000000000001682.
9. Rubinstein MM, Hyman DM, Caird I et al. Phase 2 study of LY3023414 in patients with advanced endometrial cancer harboring activating mutations in the PI3K pathway. Cancer 2020; 126 (6): 1274–1282. doi: 10.1002/cncr.32677.
10. Talhouk A, McConechy MK, Leung S et al. A clinically applicable molecular-based classification for endometrial cancers. Br J Cancer 2015; 113 (2): 299–310. doi: 10.1038/bjc.2015.190.
11. Marnitz S, Waltar T, Köhler C et al. The brave new world of endometrial cancer: future implications for adjuvant treatment decisions. Strahlenther Onkol 2020; 196 (11): 963–972. doi: 10.1007/s00066-020-01632-w.
12. Wortman BG, Bosse T, Nout RA et al. Molecular-integrated risk profile to determine adjuvant radiotherapy in endometrial cancer: evaluation of the pilot phase of the PORTEC-4a trial. Gynecol Oncol 2018; 151 (1): 69–75. doi: 10.1016/j.ygyno.2018.07.020.
13. Concin N, Creutzberg CL, Vergote I et al. ESGO/ESTRO/ESP Guidelines for the management of patients with endometrial carcinoma. Virchows Arch 2021; 478 (2): 153–190. doi: 10.1007/s00428-020-03007-z.
14. Vermij L, Smit V, Nout R et al. Incorporation of molecular characteristics into endometrial cancer management. Histopathology 2020; 76 (1): 52–63. doi: 10.1111/his.14015.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2021 Issue 4-
All articles in this issue
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Kongenitální syfilis jako příčina úmrtí novorozence ve 31. týdnu gravidity – význam testování na syfilis v průběhu gravidity
- Možnosti léčby lokálně recidivujícího karcinomu vulvy
- Recidiva vzácného maligního Brennerova tumoru ovaria
- Molekulární klasifikace endometriálních karcinomů převedená do praxe
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Prevence tvorby de novo adhezí u pacientek s Ashermanovým syndromem
- Pánevní neuropatická bolest (diferenciální diagnostika)
- Historie a současné trendy v léčbě idiopatického hyperaktivního měchýře
- Matrixové metaloproteinázy MMP-2 a MMP-9 jako markery predikce preeklampsie v prvním trimestru
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pánevní neuropatická bolest (diferenciální diagnostika)
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Recidiva vzácného maligního Brennerova tumoru ovaria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

