-
Medical journals
- Career
Historie a současné trendy v léčbě idiopatického hyperaktivního měchýře
Authors: Habeš D. 1; Leško D. 1; Štěpán M. 1; Špaček J. 2; Kestřánek J. 1
Authors‘ workplace: Porodnická a gynekologická klinika LF UK a FN Hradec Králové 1; Urologická klinika LF UK a FN Hradec Králové 2
Published in: Ceska Gynekol 2021; 86(4): 284-290
Category: Review Article
doi: https://doi.org/10.48095/cccg2021284Overview
Souhrn: Cíl práce: Historie a současný pohled na léčbu hyperaktivního močového měchýře. Metodika: Článek byl vypracován s využitím databází Medline Pubmed a Scopus. Vyhledány byly články publikované do prosince 2020. Součástí článku je popis vnitřních postupů na našem pracovišti. Výsledky a Závěr: Hyperaktivní měchýř je onemocněním značně zhoršujícím kvalitu života našich pacientek. Základem léčby jsou nefarmakologické postupy, jako je cvičení pánevního dna. Efekt těchto postupů je však omezený. Znatelnou úlevu od obtíží přináší léčba farmakologická. Tu zahajujeme nasazením trospia. Při nedostatečném efektu pokračujeme propiverinem, solifenacinem, fesoterodinem, darifenacinem či mirabegronem. Až při selhání farmakologických postupů je indikována léčba elektrickou stimulací či aplikací botulotoxinu. Souhrnně lze říci, že při správně zvolené metodě nalezne úlevu od potíží každá pacientka.
Klíčová slova:
hyperaktivní močový měchýř – urgence – anticholinergika – mirabegron – elektrostimulace – botulotoxin A
Úvod
Hyperaktivní močový měchýř (OAB – overactive bladder) je definován dle Mezinárodní společnosti pro kontinenci (ICS – International Continence Society) jako soubor symptomů ukazujících na možnou dysfunkci dolních močových cest. Charakteristickým symptomem je urgence (neodolatelné nucení na močení), zpravidla doprovázená častým močením, nykturií a přibližně v jedné třetině případů urgentní inkontinencí [1–4]. OAB trpí 11,8–17,4 % žen, v kategorii nad 65 let se jedná až o 45 %. Z průzkumů vyplynulo, že symptomy OAB mají dopad na každodenní činnosti u 67 % pacientek [2,5].
Podle přítomnosti inkontinence dělíme OAB na „mokrý – OAB wet“ a „suchý – OAB dry“. Termín smíšená inkontinence je vyhrazen pro přítomnost stresové inkontinence (SUI – stress urinary incontinence) a OAB wet. V praxi se však často používá i v případě přítomnosti pouze OAB dry a SUI [1,3]. OAB můžeme podle etiologie vzniku rozdělit na primární a sekundární:
1. Primární neboli idiopatický OAB je způsoben buď inadekvátní aktivací mikčního reflexu, či samovolnou kontrakcí detruzoru. Přesný mechanizmus není objasněn.
2. Sekundární OAB je způsoben jinými patologickými stavy, jako jsou infekce či tumor močového měchýře, urolitiáza či jiné cizí těleso, stav po operačním výkonu na močovém měchýři, stav po radioterapii malé pánve atd. Před zahájením léčby OAB je nutno tyto stavy vyloučit.
Dále v textu bude termínem OAB myšleno primární OAB [3,5].
První zmínky o termínu OAB se datují do roku 1989. Výrazné zpopularizování pojmu roku 1997 je zásluhou lékařů Abramse a Weina. Nicméně OAB jako diagnóza zařazená do Mezinárodní klasifikace nemocí (MKN) byla definitivně uznána ICS až v roce 2002. Do té doby byly obtíže nyní hodnocené jako OAB dry popisovány jako „nestabilní měchýř/detruzor“ či „hyperreflexie detruzoru“ [6]. I přes relativně krátkou dobu, kterou se léčbě věnujeme, došlo k rozvoji mnoha léčebných postupů. Všechny jsou však zaměřeny na zmírnění příznaků OAB, nikoli na léčbu příčiny.
Na rozdíl od ostatních druhů inkontinence se zde uplatňuje řada farmakologických postupů. Mezi prvními léčivy užívanými k léčbě OAB byl dnes již jen zřídka užívaný oxybutynin. Důvod ústupu od užívání tohoto léku je relativně vysoký počet nežádoucích účinků (dle některých zdrojů až v 37 % případů) [7]. Vývoj se proto zaměřil především na léčiva, které svými nežádoucími účinky (NÚ) zatěžují pacientky co nejméně. Toho bylo docíleno působením na konkrétní muskarinové receptory (hlavně M3), tedy na receptory častější v močovém měchýři a méně časté v jiných částech těla, např. ve slinných žlázách. Přelomem pak bylo uvedení mirabegronu na trh – jediného preparátu, který nevyužívá cholinergní, ale b3 adrenergní receptory [8].
Zásadní změnou v přístupu k diagnostice bylo opuštění nutnosti průkazu OAB urodynamickým vyšetřením. Nejen snadnější diagnostika, ale i postupné zjednodušení preskripcí pojišťovnami umožnily širší využití jednotlivých preparátů v každodenní praxi [6]. Svou roli nepochybně hrálo i snižování ceny jednotlivých preparátů. Zcela zásadní změnou v dostupnosti léčby pro celou populaci pak bylo zrušení omezení preskripce na nespecializovaných pracovištích. Dnes již může všechna farmaka předepsat i registrující gynekolog [8].
Dokladem zvýšení informovanosti široké lékařské veřejnosti o problematice OAB dokazuje i dotazníkové šetření provedené před 10 lety na souboru lékařů, mimo jiné i 181 českých gynekologů. Dle výsledků se jejich vědomosti o diagnostice a léčbě během sledovaného pětiletého intervalu signifikantně zvýšily [9].
Co však nadále zůstává doménou specializovaných pracovišť, jsou chirurgické a invazivní postupy. Oproti západním zemím využíváme tyto postupy v ČR méně, a je tedy pravděpodobné, že právě tudy povede cesta dalšího vývoje.
Současná léčba OAB je rozdělena do tří skupin (konzervativní nefarmakologická, farmakologická a invazivní/operační léčba). Terapii se doporučuje zahájit konzervativní nefarmakologickou léčbou. Při nedostatečném efektu nasazujeme farmakologickou léčbu (případně ji s ní kombinujeme). V praxi však farmakologická léčba následuje krátce po nefarmakologické. Při selhání farmakologické léčby je ještě možnost léčby elektrostimulačními metodami, resp. botulotoxinem. Je-li zvolena správná metoda, můžeme dosáhnout úlevy od potíží prakticky u každé pacientky [10].
Konzervativní léčba
Mezi konzervativní postupy patří změna stravy a životosprávy ve smyslu vynechání dráždivých jídel, citrusů, sycených nápojů, alkoholu a kofeinu, omezení příjmu tekutin na noc apod. Dále se soustředíme na omezení příjmu tekutin do 2,2 l denně [3]. Dalším z doporučení je redukce hmotnosti, byť korelace mezi výskytem příznaků OAB a zvýšeným BMI (body mass index) nebyla potvrzena [11].
Další možností konzervativní nefarmakologické léčby je mikční trénink. Při něm se stanoví nejkratší čas, po který pacientka neudává urgence, a tím zvolíme interval pravidelného močení pro následující den. Postupné prodlužování intervalů vede k úspěšnému prodloužení rozmezí mezi urgencemi v cca 57 % případů [12].
Při posilování svalů pánevního dna, které je zaměřeno především na SUI a na prolapsu pánevních orgánů (POP – pelvic organ prolapse), se i zde prokazuje, že při cvičení kontrolovaném biofeedbackem se výsledky zlepšují [13]. Cílem je postupné osvojení si schopnosti cílené kontrakce svalů pánevního dna, optimálně v rizikových chvílích [3]. Dle některých autorů uleví od potíží posilování svalů pánevního dna až 60 % pacientek [14]. Výsledky jsou dobré zejména u žen s kombinací SUI a OAB nebo s přítomností sestupu pánevních orgánů.
Farmakologická léčba
V případě, že postupy z první linie léčby nevedou k dostatečnému efektu, uchylujeme se k léčbě medikamentózní. Léčba je založena na ovlivnění řízení jímání moči a mikce autonomním nervovým systémem. Cílem je blokáda postsynaptických receptorů svalových buněk, konkrétně cholinergních receptorů muskarinového typu, zpravidla M2 a hlavně M3. Touto cestou je parasympatikem řízena kontrakce detruzoru, transmiterem je acetylcholin. Alternativou je stimulace b3 adrenergních receptorů agonisty, která vyvolává relaxaci detruzoru. Touto cestou působí sympatikus [3,4].
Z výše uvedeného vyplývají i nejčastější vedlejší nežádoucí účiny této terapie a kontraindikace (KI). KI pro užití anticholinergik jsou glaukom s uzavřeným úhlem, myasthenia gravis, těžká ulcerózní kolitida, retence moči a těžká renální insuficience. Opatrnost platí i při snížených jaterních funkcích, kde se užívají poloviční dávky léčiv. Oproti tomu b3 agonista je kontraindikován pouze u dekompenzované arteriální hypertenze [8].
Nejčastějším důvodem přerušení léčby anticholinergiky jsou NÚ léčby, jako je nejčastěji sucho v ústech a obstipace, dále pak dyspepsie, nauzea, případně rozmazané vidění. Rovněž je popisováno ovlivnění bazálních ganglií a psychiky, a to zejména u starších pacientů. Tomuto NÚ se lze vyhnout použitím léčiva, které neprochází hematoencefalickou bariérou, např. trospium. Léčba je považována za úspěšnou při poklesu počtu urgencí, event. epizod inkontinence > 50 % a pokles počtu mikcí o > 20 %, a to po 3 měsících léčby. Toho docílíme u 60–80 % farmakologicky léčených pacientek [15].
Jednotlivá farmaka dělíme do dvou skupin. V první skupině jsou léky první volby, které obsahují léky první generace parasympatolytik, tedy oxybutynin, propiverin a trospium (tab. 1). Léky druhé volby jsou pak zástupci druhé generace parasympatolytik (solifenacin, fesoterodin, tolterodin, darifenacin) a nově i b3 sympatomimetikum mirabegron (tab. 2). Změna léčiva je možná pouze v případě výskytu NÚ nebo při jeho nedostatečném efektu (viz předchozí odstavec).
Table 1. Léky první volby.
Tab. 1. First choice drugs.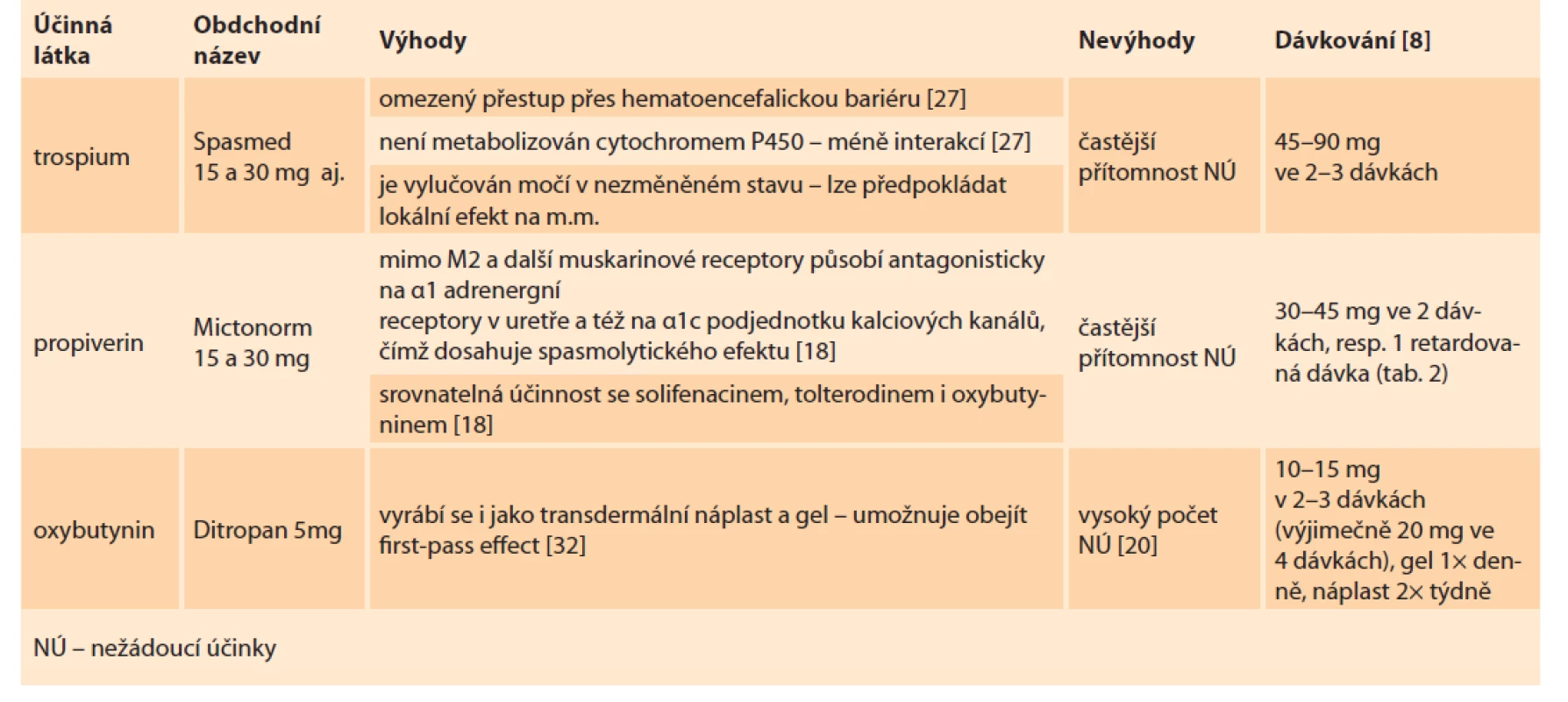
Table 2. Léky druhé volby.
Tab. 2. Second choice drugs.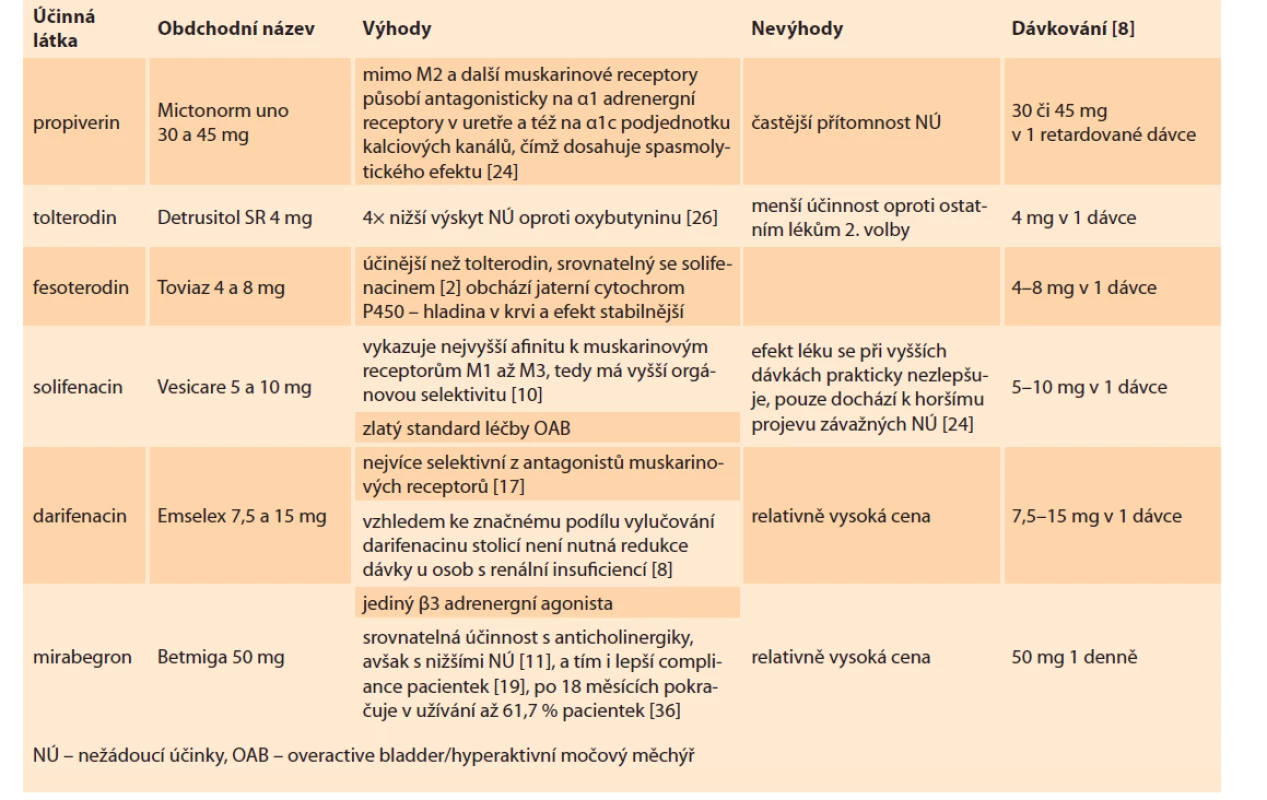
V případě neustupujících potíží je možné kombinovat i jednotlivá anticholinergika, několik studií potvrdilo zvýšený efekt proti monoterapii. Autoři studie však přiznávají, že současné studie nejsou dostačující a další výzkum je nutný [16]. Na naší klinice kombinujeme jednotlivá anticholinergika jen velmi zřídka. Naopak byl potvrzen zvýšený efekt kombinace anticholinergik a mirabergonu, optimální dávkování se doporučuje 5 mg solifenacinu a 50 mg mirabegronu [17].
Hladiny léků v krevním oběhu jsou ovlivněny stravou i ostatními užívanými farmaky. Např. grapefruit zpomaluje metabolizmus solifenacinu, tolterodinu a fesoterodinu, a tím navyšuje jejich koncentrace. To se projeví zhoršením nežádoucích projevů léčby. Z léků působí obdobným mechanizmem mj. warfarin, ranitidin, digoxin, kodein nebo diazepam [18]. Dieta s vysokým obsahem tuků výrazně zpomaluje vstřebávání trospia a mirabegronu. Proto se tyto léky musí užívat nalačno [8,19].
Hormonální terapie
Použití estrogenů v léčbě OAB je sporné. Metaanalýza z roku 2012 připouští mírné zlepšení potíží při lokálním podání, avšak přetrvávání efektu léčby po ukončení jejího podávání je nejasné. Při systémovém podání estrogenů došlo dokonce ke zhoršení příznaků [20].
Antidepresiva
Dříve bylo v léčbě rovněž využíváno tricyklických antidepresiv, např. imipraminu. Ten funguje jako neselektivní a - i b-agonista. Stimulace a receptorů vede ke kontrakci hladké svaloviny hrdla močového měchýře, stimulace b receptorů pak inhibuje detruzor [4]. Doporučoval se tedy k léčbě zejména kombinované SUI a OAB. Vzhledem k vysokému výskytu NÚ a malému efektu se tato terapie dnes užívá minimálně.
Léčba nykturií
Specificky pro nykturie (probuzení se na močení) se užívá desmopresin (Minirin). Jedná se o analog přirozeného hormonu hypofýzy a užívá se k tlumení noční produkce moči. Před zahájením léčby je nutné pacientku důkladně poučit o nutnosti omezení příjmu tekutin na noc. Zároveň je nutno dbát na přerušení léčby u systémových infekcí, průjmů či zvracení. Nasazení léku je vhodné konzultovat s ošetřujícím praktickým lékařem či internistou při souběžném výskytu interních onemocnění (arteriální hypertenze, kardiální a renální insuficience atd.) [8]. Vzhledem k možné hyponatremii je vhodná pravidelná kontrola mineralogramu. Léčbu desmopresinem je vhodné kombinovat s ostatními léky tlumícími příznaky OAB. Např. při kombinaci s tolterodinem byl potvrzen vyšší účinek léčby [21].
Invazivní a operační léčba
Mezi postupy třetí linie řadíme elektrostimulaci, použití botulotoxinu A, vzácně i chirurgické postupy.
Elektrostimulace
Rozlišujeme neurostimulaci, kdy elektrickou energií stimulujeme přímo nervová vlákna, která močový měchýř zásobují, a neuromodulaci [3]. Ta je založena na efektu vzájemného ovlivnění mezi autonomním nervstvem na postgangliové úrovni [22]. Mezi neurostimulační techniky řadíme transvaginální elektrostimulaci, sakrální neurostimulaci a stimulaci pudendálního nervu. Neuromodulací působíme na tibiální nerv.
Transvaginální elektrostimulace využívá monofázické impulzy o různé frekvenci aplikované přes vaginální kužel. Dlouhodobé zlepšení příznaků v porovnání s kontrolní skupinou bez léčby vykazuje 50–60 % pacientek [3,13].
Při sakrální neurostimulaci se chirurgicky implantuje generátor pulzů do těla pacientky. Účinnost této metody trvá několik let, je omezena životností baterie generátoru. Léčba je založena na stimulaci míšních kořenů S2–S4, čímž dochází k dráždění svalů pánevního dna, což je vyššími centry vyhodnoceno jako kontrakce uzávěrového aparátu uretry. Centrálně je pak utlumen vliv parasympatiku a naopak posílen vliv sympatiku [11,22]. Průměrně 50 % pacientek vykazuje kompletní kontinenci. Mezi nejčastější příčiny odstranění generátoru patří infekční komplikace po implantaci (5–11 %) a nedostatečný efekt léčby (6 %) [23]. V porovnání účinnosti s léčbou anticholinergiky se jeví jako přínosnější. Nežádoucí účinky léčby jsou bolesti v místě zavedení, bolesti pochvy a konečníku. Řada pacientek si stěžuje na změny ve vyprazdňujících návycích [13].
Při tibiální neuromodulaci se využívá přístupu k tibiálnímu nervu za vnitřním kotníkem, stimulace probíhá jednou týdně po 12 týdnů. Efekt této metody se časem snižuje, což vede k nutnosti jejího opakování [22]. Stimulační elektroda může být zavedena invazivně či působit pouze přes kůži. Obě metody vykazují obdobné výsledky [24]. Zmírnění příznaků udává průměrně 60 % pacientek. Výhodou této metody je minimální množství nežádoucích účinků léčby. Jedná se o brnění nohou či bolesti v místě zavedení jehly. Neuromodulace je obdobně účinná jako léčba farmakologická, ale je lépe tolerovaná [25,26]. V porovnání s vaginální elektrostimulací vykazuje lepší efekt na kvalitu života. Obzvláště dobře léčbu vnímají pacientky s anamnézou depresí či úzkostí a pacientky, které vstupně vykazovaly časté epizody urgentní inkontinence [22,27]. Slibnou novinkou je trvalá implantace generátoru pulzů, podobně jako u sakrální neurostimulace [28].
Botulotoxin A
Botulotoxin A (Dysport, Botox) se využívá pro svou schopnost blokády nervosvalového přenosu na úrovni periferního nervového zakončení. Mechanizmem je blokáda uvolňování acetylcholinu z presynaptického nervového zakončení. Efekt botulotoxinu je reverzibilní. Aplikace probíhá cystoskopicky, botulotoxin se vpravuje přímo do detruzoru [3]. Aplikuje se dávka 100 IU, vyšší dávky již účinnost nezvyšují [29]. Účinnost léčby je srovnatelná s anticholinergiky, pacientkami je ale subjektivně hodnocena lépe [13]. Poměrně často je jeho použití komplikováno močovými infekcemi, retencemi či infekcí dolních cest močových [13,19].
Chirurgické metody
Řada pacientek s OAB současně trpí různým stupněm sestupu pánevních orgánů. Podle některých prací dochází po provedení závěsné operace pro sestup pánevních orgánů k ústupu obtíží spojených s OAB až u 80 % pacientek [30–32]. Korekcí anatomicky abnormálně uloženého měchýře často odstraníme příčinu vzniku močových reziduí, což vysvětluje ústup obtíží. Nejedná se však o léčbu idiopatického OAB [5]. Jednotného názoru se ale nepodařilo dosáhnout, operaci sestupu pánevních orgánů nelze považovat za řešení OAB. V souladu s tímto tvrzením postupujeme i na naší klinice.
Z chirurgických metod přichází v úvahu parciální myektomie a augmentace močového měchýře. Tyto metody jsou využívány častěji u sekundárního OAB, např. při intersticiální cystitidě. Při myektomii se z extraperitoneálního přístupu odstraňuje část detruzoru. Úlevu od potíží udává polovina pacientek [3,33]. Alternativou je augmentace močového měchýře částí střevní kličky. Zde se úspěšnost pohybuje mezi 60 a 80 % [34]. Společným nedostatkem obou operačních metod je častá nutnost samocévkování, které je nutné až ve 40 % případů [33].
Diskuze
Vzhledem k tomu, že se incidence OAB zvyšuje společně s věkem, je nutné dbát na omezení použití jednotlivých metod a důsledně odebírat anamnézu. Většinovým důvodem pro ukončení léčby je nedostatečná účinnost postupu nebo neakceptovatelná míra vedlejších účinků. Současným ustanoveným postupem se podaří prakticky vždy nalézt metodu, která zlepší kvalitu života dané pacientky.
U řady lékařů přetrvává názor, že léky používané k mírnění příznaků OAB je oprávněn předepsat pouze lékař se specializací urologie či urogynekologie. Toto tvrzení se ale nezakládá na realitě [35].
Léčba OAB na naší klinice dodržuje současné rozdělení. Léčba první linie je účinná jen málokdy, klíčem naší terapie je druhá linie léčby. Tu zahajujeme trospiem, event. propiverinem a při nedostatečném efektu pokračujeme k solifenacinu a fesoterodinu nebo darifenacinu. Ačkoli je dnes již mirabegron řazen mezi léky druhé volby, na našem pracovišti se ve většině případů stále držíme postupu, že se mirabegron většinou nasazuje jako lék třetí volby.
Výjimku tvoří pacientky s kontraindikací léčby anticholinergiky, např. souběžná přítomnost glaukomu nebo opravdu silné nežádoucí účinky předchozí léčby anticholinergiky. Velmi dobré zkušenosti máme s užíváním mirabegronu v kombinaci s propiverinem či solifenacinem, kdy dochází k výraznému zvýšení efektu léčby a nízkému výskytu nežádoucích účinků. Poměrně hojně využíváme desmopresin. Postupy třetí linie jsou na naší klinice využívány velmi zřídka a vždy ve spolupráci s dalšími specialisty, většinou urology.
Závěr
Hyperaktivní močový měchýř je onemocněním značně zhoršujícím kvalitu života našich pacientek. Základem léčby jsou nefarmakologické postupy, jako je cvičení pánevního dna. Efekt těchto postupů je však omezený. Znatelnou úlevu od potíží přináší léčba farmakologická. Tu zahajujeme nasazením trospia či propiverinu. Při nedostatečném efektu nebo při výskytu nežádoucích vedlejších účinků změníme preparát na propiverinem s řízeným uvolňováním, solifenacinem, fesoterodinem, darifenacinem či mirabegronem. Až při selhání farmakologických postupů je indikována léčba elektrickou stimulací či aplikací botulotoxinu. Souhrnně lze říci, že při správně zvolené metodě nalezne úlevu od potíží každá pacientka.
Pro každodenní klinickou praxi se jeví jako nejdůležitější následující sdělení:
1. Ambulantní gynekologové mohou diagnostikovat a léčit OAB (nejen specialista/urogynekolog).
2. Je nutné dodržovat pravidla stanovená Státním ústavem pro kontrolu léčiv (SÚKL) pro preskripci a změnu terapie.
3. Nejčastější chybou je špatně stanovená diagnóza OAB (např. nepoznaná infekce močových cest). Při nedostatečném efektu farmakoterapie je nutno odeslat pacientku ke specialistovi, který provede mimo jiné i důkladné vyšetření moči a cystoskopii.
Doručeno/ Submitted: 15. 6. 2021
Přijato/ Accepted: 24. 6. 2021
MU Dr. Dominik Habeš
Porodnická a gynekologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Sources
1. Abrams P, Cardozo L, Fall M et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. Neurourol Urodyn 2002; 21 (2): 167–178. doi: 10.1002/nau.10052.
2. Eapen RS, Radomski SB. Review of the epidemiology of overactive bladder. Res Rep Urol 2016; 8 : 71–76. doi: 10.2147/RRU.S102 441.
3. Krhut J. Hyperaktivní močový měchýř. 1. vyd. Praha: Maxdorf 2007 : 8–9, 30–31, 67–101.
4. Špaček J, Kalousek I, Jílek P et al. Vybrané kapitoly z gynekologie. 1. vyd. Praha: Mladá Fronta 2018 : 341–352.
5. Fletcher SG, Haverkorn RM, Yan J et al. Demographic and urodynamic factors associated with persistent OAB after anterior compartent prolapse repair. Neurourol Urodyn 2010; 29 (8): 1414–1418. doi: 10.1002/nau.20 881.
6. Cardona-Grau D, Spettel S. History of the term “overactive bladder”. Curr Bladder Dysfunct Rep 2014; 9 : 48–51. doi: 10.1007/s11884-013-02 18-3.
7. Cohn JA, Brown ET, Reynolds WS et al. An update on the use of transdermal oxybutynin in the management of overactive bladder disorder. Ther Adv Urol 2016; 8 (2): 83–90. doi: 10.1177/1756287215626312.
8. AISLP. 2020 [online]. Dostupné z: https: //www.aislp.cz/.
9. Krhut J, Martan A, Gärtner A et al. Diagnostika a léčba hyperaktivního močového měchýře v České republice před pěti lety a dnes. Ceska Gynekol 2012; 77 (3): 205–210.
10. Kasman A, Stave C, Elliott CS. Combination therapy in overactive bladder-untapped research opportunities: a systematic review of the literature. Neurourol Urodyn 2019; 38 (8): 2083–2092. doi: 10.1002/nau.24158.
11. Krhut J, Martan A, Zachoval R et al. Impact of body mass index on treatment efficacy of mirabegron for overactive bladder in females. Eur J Obstet Gynecol Reprod Biol 2016; 196 : 64–68. doi: 10.1016/j.ejogrb.2015.11.018.
12. Elser DM, Wyman JF, McClish DK et al. The effect of bladder training, pelvic floor muscle training, or combination training on urodynamic parameters in women with urinary incontinence. Continence program for women research group. Neurourol Urodyn 1999; 18 (5): 427–436. doi: 10.1002/ (sici) 1520-6777 (1999) 15 : 5<427:: aid-nau3>3.0. co; 2-0.
13. Olivera CK, Meriwether K, El-Nashar S et al. Nonantimuscarinic treatment for overactive bladder: a systematic review. Am J Obstet Gynecol 2016; 215 (1): 34–57. doi: 10.1016/j.ajog. 2016.01.156.
14. Bernstein IT. The pelvic floor muscles: muscle thickness in healthy and urinary-incontinent women measured by perineal ultrasonography with reference to the effect of pelvic floor training. Estrogen receptor studies. Neurourol Urodyn 1997; 16 (4): 237–275. doi: 10.1002/ (sici) 1520-6777 (1997) 16 : 4<237:: aid-nau2>3.0.co; 2-f.
15. Scott K, Dmochowski RR, Padmanabhan P. Delivery methods for drugs used in the treatment of overactive bladder. Expert Opin Drug Deliv 2016; 13 (3): 361–371. doi: 10.1517/17 425247.2016.1130033.
16. Visco AG, Fraser MO, Newgreen D et al. What is the role of combination drug therapy in the treatment of overactive bladder? ICI-RS 2014. Neurourol Urodynam 2016; 35 (2): 288–292. doi: 10.1002/nau.22795.
17. Kelleher C, Hakimi Z, Zur R. Efficacy and tolerability of mirabegron compared with antimuscarinic monotherapy or combination therapies for overactive bladder: a systematic review and network meta-analysis. Eur Urol 2018; 74 (3): 324–333. doi: 10.1016/j.eururo.2018.03. 020.
18. Pratt TS, Suskind AM. Management of overactive bladder in older women. Curr Urol Rep 2019; 19 (11): 92. doi: 10.1007/s11934 - 018-0845-5.
19. Paśko P, Rodacki T, Domagała-Rodacka R et al. A short review of drug-food interactions of medicines treating overactive bladder syndrome. Int J Clin Pharm 2016; 38 (6): 1350–1356. doi: 10.1007/s11096-016-03 83-5.
20. Cody JD, Jacobs ML, Richardson K et al. Oestrogen therapy for urinary incontinence in post-menopausal women. Cochrane Database Syst Rev 2012; 10 (10): CD001405. doi: 10.1002/14651858.CD001405.pub3.
21. Rovner ES, Raymond K, Andruczyk E et al. Low-dose desmopressin and tolterodine combination therapy for treating nocturia in women with overactive bladder: a double-blind, randomized, controlled study. Low Urin Tract Symptoms 2018; 10 (3): 221–230. doi: 10.1111/luts.12169.
22. de Wall LL, Heesakkers JP. Effectiveness of percutaneous tibial nerve stimulation in the treatment of overactive bladder syndrome. Res Rep Urol 2017; 9 : 145–157. doi: 10.2147/RRU.S124981.
23. Siddiqui NY, Wu JM, Amundsen CL. Efficacy and adverse events of sacral nerve stimulation for overactive bladder: a systematic review. Neurourol Urodyn 2010; 29 (Suppl 1): S18–S23. doi: 10.1002/nau.20786.
24. Ramírez-García I, Blanco-Ratto L, Kauffmann S et al. Efficacy of transcutaneous sti5mulation of the posterior tibial nerve compared to percutaneous stimulation in idiopathic overactive bladder syndrome: randomized control trial. Neurourol Urodyn 2019; 38 (1): 261–268. doi: 10.1002/nau.23843.
25. Rai BP, Cody JD, Alhasso A et al. Anticholinergic drugs versus non-drug active therapies for non-neurogenic overactive bladder syndrome in adults. Cochrane Database Syst Rev 2012; 12 (12): CD003193. doi: 10.1002/14651858.CD003193.pub4.
26. Vecchioli-Scaldazza C, Morosetti C. Effectiveness and durability of solifenacin versus percutaneous tibial nerve stimulation versus their combination for the treatment of women with overactive bladder syndrome: a randomized controlled study with a follow-up of ten months. Int Braz J Urol 2018; 44 (1): 102–108. doi: 10.1590/S1677-5538.IBJU.2016. 0611.
27. Rostaminia G, Chang C, Pincus JB et al. Predictors of successful percutaneous tibial nerve stimulation (PTNS) in the treatment of overactive bladder syndrome. Int Urogynecol J 2019; 30 (10): 1735–1745. doi: 10.1007/s00192-018-38 34-9.
28. Scaldazza CV, Morosetti C, Giampieretti R et al. Percutaneous tibial nerve stimulation versus electrical stimulation with pelvic floor muscle training for overactive bladder syndrome in women: results of a randomized controlled study. Int Braz J Urol 2017; 43 (1): 121–126. doi: 10.1590/S1677-5538.IBJU.2015.07 19.
29. Ramos HL, Torres Castellanos L, Esparza IP et al. Management of overactive bladder with onabotulinumtoxin A: systematic review and meta-analysis. Urology 2017; 100 : 53–58. doi: 10.1016/j.urology.2016.10.026.
30. de Boer TA, Salvatore S, Cardozo L et al. Pelvic organ prolapse and overactive bladder. Neurourol Urodyn 2010; 29 (1): 30–39. doi: 10.1002/nau.20858.
31. Liedl B, Goeschen K, Yassouridis A et al. Cure of underactive and overactive bladder symptoms in women by 1,671 apical sling operations gives fresh insights into pathogenesis and need for definition change. Urol Int 2019; 103 (2): 228–234. doi: 10.1159/000500 329.
32. Tomoe H. Improvement of overactive bladder symptoms after tension-free vaginal mesh operation in women with pelvic organ prolapse: correlation with preoperative urodynamic findings. Int J Urol 2015; 22 (6): 577–558. doi: 10.1111/iju.12744.
33. Aslam MZ, Agarwal M. Detrusor myectomy: long-term functional outcomes. Int J Urol 2012; 19 (12): 1099–1102. doi: 10.1111/j.14 42-2042.2012.03111.x.
34. Holm J, Struckmann JR, Frimodt-Møller C. Augmentation ileo-cystoplasty in women with disabling urge incontinence. Ugeskr Laeger 1995; 157 (11): 1528–1530.
35. SÚKL. Betmiga. 2021 [online]. Dostupné z: https: //www.sukl.cz/modules/medication/detail.php?code=0194799&tab=prices.
36. Martan A, Mašata J, Krnut J et al. Persistence in the treatment of overactive bladder syndrome (OAB) with mirabegron in a multicenter clinical study. Eur J Obstet Gynecol Reprod Biol 2017; 210 : 247–250. doi: 10.1016/ j.ejogrb.2016.12.030.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2021 Issue 4-
All articles in this issue
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Kongenitální syfilis jako příčina úmrtí novorozence ve 31. týdnu gravidity – význam testování na syfilis v průběhu gravidity
- Možnosti léčby lokálně recidivujícího karcinomu vulvy
- Recidiva vzácného maligního Brennerova tumoru ovaria
- Molekulární klasifikace endometriálních karcinomů převedená do praxe
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Prevence tvorby de novo adhezí u pacientek s Ashermanovým syndromem
- Pánevní neuropatická bolest (diferenciální diagnostika)
- Historie a současné trendy v léčbě idiopatického hyperaktivního měchýře
- Matrixové metaloproteinázy MMP-2 a MMP-9 jako markery predikce preeklampsie v prvním trimestru
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pánevní neuropatická bolest (diferenciální diagnostika)
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Recidiva vzácného maligního Brennerova tumoru ovaria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

