-
Medical journals
- Career
Nové sérové nádorové markery S100, TFF3 a AIF-1 a jejich možné využití v onkogynekologii
Authors: M. Maděrka; R. Pilka; D. Neubert; J. Hambálek
Authors‘ workplace: Porodnicko-gynekologická klinika LF UP a FN, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
Published in: Ceska Gynekol 2019; 84(4): 303-308
Category:
Overview
Cíl studie: V naší práci jsme se zabývali možnými novými sérovými nádorovými markery, proteiny rodiny S100, trefoil faktorem 3 a AIF-1, a jejich možným využitím u onkogynekologických pacientek.
Typ studie: Přehledový článek.
Název a sídlo pracoviště: Porodnicko-gynekologická klinika, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc.
Metodika: Rešerše prací publikovaných v databázi PubMed do ledna roku 2019.
Výsledky: V literatuře byla prokázána asociace proteinů S100A2, S100A4, S100A6, S100A7, S100A8, S100A9 a S100A11 s karcinomem prsu. U karcinomu ovaria byla prokázána asociace s proteiny S100A2, S100A4, S100A6, S100A7A, S100A10, S100A14, S100A16, S100B, S100P (up-regulace spojena s horším přežitím) a proteiny S100A1, S100A3, S100A5, S100A13, S100G (up-regulace spojena s lepším přežitím). U karcinomu hrdla děložního byla prokázána asociace s proteinem S100A9. Byla prokázána asociace TFF3 s karcinomem endometria, karcinomem prsu (horší prognóza) a karcinomem ovaria (lepší prognóza). U AIF-1 byla potvrzena zvýšená exprese u karcinomu hrdla děložního.
Závěr: Tumor markery mohou být velmi užitečným nástrojem pro management pacientů, pokud jsou používány odpovídajícím způsobem. Je zapotřebí další výzkum v této oblasti a hledání nových nádorových markerů, jimiž mohou být i S100, TFF3 a AIF-1. Budoucí studie by se měly zaměřit nejen na jeden časový bod, ale posoudit trend tumor markerů po určitou časovou osu.
Klíčová slova:
onkogynekologie – tumor markery – S100 – TFF3 – AIF-1
ÚVOD
Tumor markery, které mohou být získány z krevního séra nebo z plazmy mají v porovnání s jinými diagnostickými nástroji poměrně nízkou cenu a minimální invazivitu. Nádorové markery se již staly standardem v managementu onkologických pacientů, a tedy i pacientek s nádory reprodukčních orgánů. Pokud používáme pouze jeden tumor marker, senzitivita i specificita jsou poměrně nízké; to je možné zlepšit použitím kombinace několika tumor markerů.
Termín tumor markery je tradičně používán pro látky, většinou proteiny, jež jsou produkovány buď samotnými nádorovými buňkami, nebo jinými buňkami v odpovědi na nádorový proces. Tumor marker může být asociován s nádorem konkrétního orgánu, nicméně většinou jsou orgánově nespecifické a jejich hladiny jsou zvýšené u nádorů různého typu a různých orgánů [10, 17, 26, 29].
Běžně používanými tumor markery v onkogynekologii jsou: CEA – karcinoembryonální antigen (karcinom prsu, karcinom endometria) [18], CA 125 (karcinom ovaria, karcinom prsu) [18], HE4 (karcinom ovaria, karcinom endometria) [18], beta-HCG (tumory z germinálních buněk, choriokarcinom) [18], alfa-fetoprotein (tumory z germinálních buněk) [18], CA 15-3 (karcinom prsu) [18], CA 72-4 (mucinózní karcinom ovaria) [18], antigen spinocelulárních buněk (spinocelulární karcinom hrdla děložního) [18] a Her-2-neu (karcinom prsu) [18]. V naší práci jsme se zabývali možnými novými nádorovými sérovými markery, proteiny S100, trefoil faktorem 3 a AIF-1, a jejich možným využitím u onkogynekologických pacientek. Za tímto účelem jsme provedli rešerši článků obsažených v databázi PubMed publikovaných do ledna roku 2019.
PROTEINY RODINY S100
V současnosti bylo objeveno již 25 proteinů rodiny S100 a první byl popsán v roce 1965 Moorem v hovězím mozku [18]. S100 je označení skupiny proteinů s poměrně nízkou molekulovou hmotností (9–13 kDa), které jsou charakterizovány přítomností dvou EF-hand domén (závit – smyčka – závit). Na obrázku 1 je znázorněna struktura proteinu S100A11. S100 proteiny vážou kalcium, některé typy mohou vázat i zinek a měď. Lokalizovány jsou především intracelulárně, některé typy S100 proteinů se vyskytují extracelulárně. Proteiny S100 mají různé funkce a jsou zastoupeny v širokém spektru biologických procesů, jako je proliferace, apoptóza, migrace, zánětlivá reakce, diferenciace a jiné. Název S100 je odvozen od vlastnosti proteinů rozpouštět se v nasyceném roztoku síranu amonného. V tabulce 1 můžeme vidět lokalizaci specifických genů S100 proteinů [18]. V tabulce 2 je shrnuta asociace S100 proteinů s různými typy nádorů.
Image 1. Struktura proteinu S100A11; upraveno podle: https:// en.wikipedia.org/wiki/S100A11#/media/File:Protein_S100A11_ PDB_1V4Z.png 
Table 1. Proteiny skupiny S100 a lokace jejich specifických genů 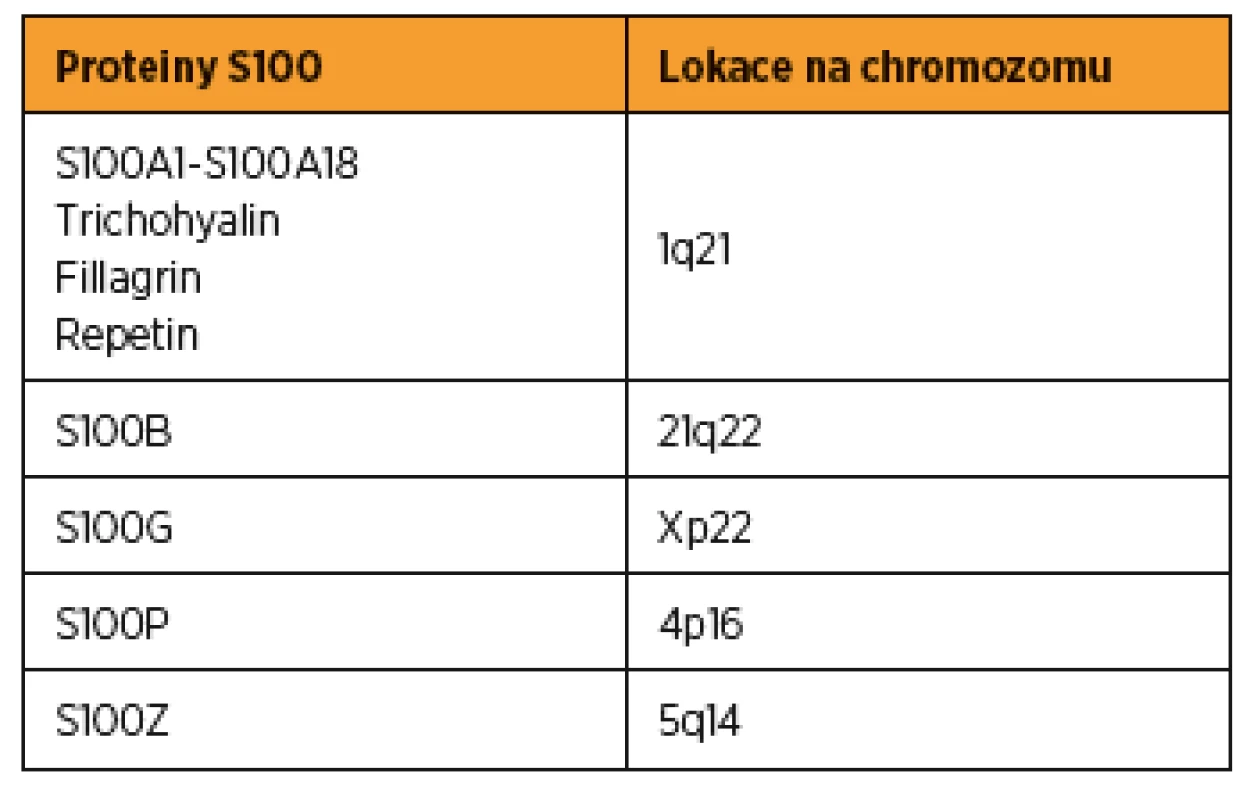
Table 2. Shrnutí asociací, které byly zaznamenány mezi různými typy nádorů a proteiny S100, v tabulce jsou zvýrazněny tumory prsu, ovaria a děložního hrdla 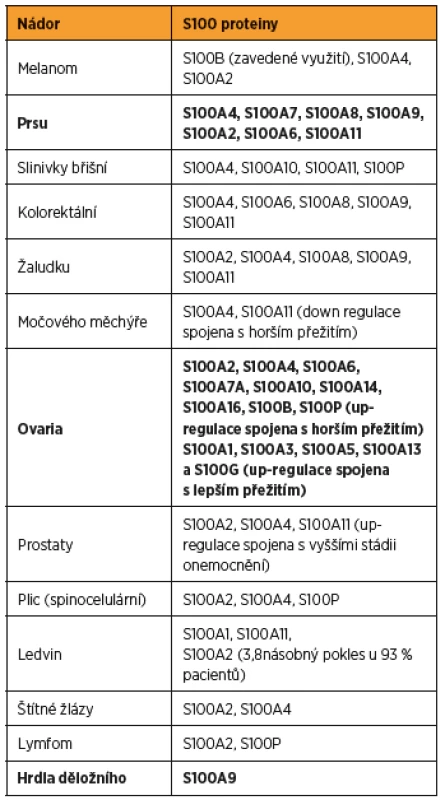
Nejvíce studovaný zástupce této rodiny proteinů, protein S100B, vykazuje neurotrofickou (při fyziologické koncentraci) nebo neurotoxickou (při vyšší koncentraci) aktivitu a jeho imunohistochemická exprese nebo hladiny v séru byly stanoveny u různých klinických poruch. Ukázalo se, že protein S100B způsobuje down-regulaci p53. Extracelulárně lokalizované S100 proteiny zasahují především do imunitních dějů, např. některé S100 proteiny působí chemotakticky, jiné mají angiogenní efekt a jiné se vážou na receptory RAGE (Receptor for Advanced Glycation Endproducts). Schematické znázornění receptorů podílejících se na přenosu signálů proteinů S100 je zobrazeno na obrázku 2 [23].
Image 2. RAGE je jedním z receptorů nacházející se v různých typech buněk. Proteiny S100A4 a S100B interagují s ligandy EGFR a s bFGF a mohou takto aktivovat EGFR a FGFR1. Proteiny S100A4, S100A8 a S100A9 interakcí s HSPG aktivují receptory spřažené s podjednotkou G alfa q. Proteiny S100A8, S100A12 a S100A15 zase mohou aktivovat receptory spřažené s G proteinem. Proteiny S100A8 a/nebo S100A9 interagují ve fagocytech s TLR4 a jako heterokomplex S100A8/S100A9 se mohou vázat ke karboxylovanému RAGE. Proteiny S100A8/ S100A9 a S100A12 také aktivují scavenger receptory. Upraveno podle [23].
RAGE – receptor for advanced glycation endproducts, EGFR – epidermal growth factor receptor, HSPG – heparan sulfate proteoglykan, TLR-4 – toll-like receptor 4, bFGF – basic fibroblast growth factor, FGFR1 – fibroblast growth factor receptor 1![RAGE je jedním z receptorů nacházející se v různých typech buněk.
Proteiny S100A4 a S100B interagují s ligandy EGFR a s bFGF a mohou takto
aktivovat EGFR a FGFR1. Proteiny S100A4, S100A8 a S100A9 interakcí s HSPG
aktivují receptory spřažené s podjednotkou G alfa q. Proteiny S100A8, S100A12
a S100A15 zase mohou aktivovat receptory spřažené s G proteinem. Proteiny
S100A8 a/nebo S100A9 interagují ve fagocytech s TLR4 a jako heterokomplex
S100A8/S100A9 se mohou vázat ke karboxylovanému RAGE. Proteiny S100A8/
S100A9 a S100A12 také aktivují scavenger receptory. Upraveno podle [23].<br>
RAGE – receptor for advanced glycation endproducts, EGFR – epidermal growth
factor receptor, HSPG – heparan sulfate proteoglykan, TLR-4 – toll-like receptor 4,
bFGF – basic fibroblast growth factor, FGFR1 – fibroblast growth factor receptor 1](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/71aac7d903209489c11fc63c31b041f2.jpeg)
V literatuře bylo již mnohokrát prokázáno, že proteiny S100 jsou asociovány s různými nádorovými onemocněními. Ačkoli ve většině případů není funkce S100 proteinů v rakovinných buňkách stále známá, specifické vzorce exprese těchto proteinů mohou být použity jako hodnotný prognostický nástroj. Přibývá důkazů o tom, že BRCA1 negativní karcinomy prsu vykazují zvýšenou expresi S100A7 [18]. S100A8 a S100A9 tvoří heterodimerový komplex, který se podílí na regulaci proliferace buněk a v metastatickém procesu (zvyšuje motilitu rakovinných buněk a usnadňuje přemístění migrujících buněk do premetastatických „výklenků“ v cílových tkáních) [12]. Proteiny S100A4 a S100B se vážou na supresorový gen p53 a inhibují jeho fosforylaci, což vede k down regulaci p53, protein S100A2 podporuje transkripční aktivitu p53 [20].
Byla již studována asociace některých S100 proteinů u pacientek s karcinomem děložního hrdla. Například exprese proteinu S100A9 v nádorových buňkách byla spojena s vyšší senzitivitou k neoadjuvantní chemoterapii u karcinomu děložního hrdla, přičemž protein S100A9 reguluje chemosenzitivitu nádorových buněk k cisplatině. V jedné studii byl použit lentivirus pro up regulaci a down regulaci exprese proteinu S100A9 v buňkách SiHa. Bylo prokázáno, že down regulace exprese proteinu S100A9 by mohla významně zvýšit míru apoptózy, což by vedlo ke zvýšení citlivosti SiHa (buněčné linie odvozené od karcinomu děložního hrdla) buněk na cisplatinu [22].
Z gynekologických nádorů byla nejvíce zkoumána asociace S100 proteinů a karcinomu ovaria. Celkem 75 % pacientek s karcinomem ovaria je diagnostikováno až v pozdním stadiu onemocnění a tento nádor je celosvětově hlavní příčinou úmrtí na gynekologické nádorové onemocnění. Role jednotlivých S100 proteinů u karcinomu ovaria je v současnosti nejasná. V roce 2018 byla publikována studie, kde byla hodnocena prognostická hodnota proteinů S100 u karcinomu ovaria. V této studii byla použita data od 1657 pacientek s karcinomem ovaria, u kterých byla hodnocena asociace exprese mRNA S100 proteinů a celkového přežití těchto pacientek u různých histotypů karcinomu ovaria. Detailní pochopení úlohy proteinů S100 může mít rozhodující roli pro diagnózu a výsledky léčby u pacientek s karcinomem ovaria. Bylo zjištěno, že vysoká exprese S100A2, S100A7A, S100A10 a S100A16 byla v signifikantní korelaci s horším celkovým přežitím u všech pacientek s karcinomem ovaria, zatímco exprese S100A1, S100A3, S100A5, S100A13 a S100G byla asociována s lepší prognózou. Dále bylo zjištěno, že sérová koncentrace S100A6 predikuje nádorové postižení peritonea a je asociována s pokročilými stadii karcinomu ovaria [24].
Exprese proteinů S100A4, S100B, S100A14 a S100P jsou spojeny se špatnou prognózou pacientek s karcinomem ovaria. Navíc zvýšené cytoplazmatické barvení S100A10 je významně spojeno se sníženým celkovým přežitím a přežíváním bez progrese u pacientek se serózním karcinomem vaječníků. Další proteiny S100, jako např. S100A3, S100A5, S100A7, S100A7A, S100A8, S100A16 a S100G, jsou u karcinomu vaječníků méně prozkoumány. Komplexní pochopení proteinů S100 může mít velký význam pro diagnózu a outcome u pacientek s karcinomem ovaria a sloužit jako cíl genetické léčby [23].
TFF3 (TREFOIL FAKTOR 3)
TFF3 je protein, který je u lidí kódován genem se stejným názvem TFF3 a byl v roce 1991 objeven u krys [27]. TFF3 je exprimován ve tkáních ženského genitálu a exprese je regulována estrogenem, nicméně chybění fluktuace sérových hladin TFF3 v průběhu menstruačního cyklu ukazuje na to, že TFF3 pochází převážně z tkání, které nejsou pod vlivem estrogenu. Trifoláty jsou skupinou malých polypeptidů bohatých na cystein, jsou exprimovány v tkáních, které obsahují buňky produkující hlen, obzvláště v gastrointestinálním traktu a jiných epiteliálních tkáních. V roce 1989 byly pojmenovány Thimem jako „trefoil“ peptidy a dosud byly identifikovány tři: TFF1, TFF2 a TFF3. Zdá se, že mají rozhodující roli v přestavbě epitelu, čehož dosahují větším počtem mechanismů, což bylo prokázáno in vitro studiemi [16].
U karcinomu gastrointestinálního traktu byla prokázána asociace TFF3 s horší prognózou. TFF3 má zřejmě roli v progresi karcinomu žaludku [31].
U karcinomu prsu je exprese TFF3 vyšší u estrogen dependentního typu. TFF3 byl identifikován jako promotor nádorové angiogeneze, což je znázorněno graficky na obrázku 3 [15]. U karcinomu prsu je exprese TFF3 spojena s horším přežitím pacientek, šířením do lymfatických uzlin a vzdálenými metastázami [19]. Existují důkazy o tom, že exprese TFF3 by u karcinomu prsu mohla být asociována s chemorezistencí [18].
Image 3. TFF3 je secernován buňkami nádoru prsu a nepřímo podporuje angiogenní chování endoteliálních buněk cestou osy IL-8/CXCR2. STAT 3 je transkripční faktor zodpovědný za zvýšenou expresi IL-8 cestou TFF3; upraveno podle [15] ![TFF3 je secernován buňkami nádoru prsu a nepřímo podporuje
angiogenní chování endoteliálních buněk cestou osy IL-8/CXCR2. STAT 3 je
transkripční faktor zodpovědný za zvýšenou expresi IL-8 cestou TFF3; upraveno
podle [15]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c58875bb7521bb02c1c6172fcaa0af27.jpeg)
V jedné ze studií byla hodnocena exprese TFF3 u 91 pacientek s karcinomem ovaria pomocí imunohistochemického vyšetření. Exprese TFF3 byla zvýšená u pacientek s lepším celkovým přežitím a s lepším přežitím bez progrese (PFS, progression free survival). Byla prokázána asociace vyššího gradingu karcinomu ovaria s negativitou TFF3. Je prokázána vysoká korelace mezi vyšší expresí TFF3 u karcinomu ovaria a nižším rizikem recidivy tohoto onemocnění [16]. Zdá se tedy, že TFF3 je u epiteliálních karcinomů ovaria spíše protektivním onkomarkerem.
V další studii bylo zkoumáno potenciální využití TFF3 jako nového nádorového markeru u špatně diferencovaného endometroidního karcinomu endometria. K hodnocení exprese TFF3 bylo využito kvantitatviní real-time PCR (qRT-PCR) a imunohistochemické vyšetření. Byla potvrzena zvýšená genová exprese i signifikantně vyšší sérové hladiny TFF3 u pacientek se špatně diferencovaným karcinomem endometria v porovnání se zdravými pacientkami [16].
V klinické praxi je ke sledování pacientek s karcinomem endometria často používán nádorový marker CA 125, který má však jen limitované využití při sledování efektu adjuvantní terapie nebo v predikci recidivy onemocnění [16]. U pacientek s endometroidním karcinomem endometria byly sérové hladiny TFF3 signifikantně vyšší než u pacientek normálními buňkami endometria, a i v porovnání s pacientkami s hyperplazií endometria. Byly analyzovány hladiny CA 125 a TFF3 u pacientek se špatně diferencovaným karcinomem endometria a u zdravých kontrol a byla takto prokázána vyšší senzitivita TFF3 v porovnání s CA 125 [16].
Naše práce ukázala, že sérové hladiny TFF3 jsou u pacientek s karcinomem endometria významně vyšší než u pacientek s endometriální hyperplazií a u kontrol [19].
AIF-1 (ALLOGRAFT INFLAMMATORY FACTOR 1)
AIF-1 je protein nacházející se v cytoplazmě buněk, který byl objeven Utansem roku 1995 u krys [17] (strukturu proteinu AIF-1 znázorňuje obr. 4). AIF-1 je specificky exprimován v makrofázích a mikrogliích a při aktivaci těchto buněk dochází k up regulaci jeho exprese. Aktivované makrofágy nacházíme obecně v zánětlivé tkáni. K up regulaci exprese AIF-1 v mikrogliích dochází následkem poškození nervu nebo ischemie CNS [17]. U lidí je AIF-1 kódován genem AIF1, který je výrazně exprimován ve varlatech a ve slezině a slabě exprimován v mozku a dále v plicích a ledvinách [8, 30]. AIF-1 dále podporuje proliferaci a aktivaci endoteliálních buněk v četných vaskulárních procesech, jako je např. hojení ran, angiogeneze nebo ateroskleróza [28].
Image 4. Struktura proteinu AIF-1; upraveno podle: https:// en.wikipedia.org/wiki/Allograft_inflammatory_factor_1#/media/ File:Protein_AIF1_PDB_2d58.png 
AIF-1 je jedním ze 20 proteinů, u kterých byla prokázaná zvýšená exprese u karcinomu děložního hrdla [11]. Nebylo dosud ovšem prokázáno, že se AIF-1 podílí na patogenezi karcinomu děložního hrdla [11].
ZÁVĚR
V literatuře byla prokázána asociace proteinů S100A2, S100A4, S100A6, S100A7, S100A8, S100A9 a S100A11 s karcinomem prsu. U karcinomu ovaria byla prokázána asociace s proteiny S100A2, S100A4, S100A6, S100A7A, S100A10, S100A14, S100A16, S100B , S100P (up-regulace spojena s horším přežitím) a proteiny S100A1, S100A3, S100A5, S100A13 a S100G (up-regulace spojena s lepším přežitím). U karcinomu hrdla děložního byla prokázána asociace s proteinem S100A9. Byla prokázána asociace TFF3 s karcinomem endometria, karcinomem prsu (horší prognóza) a karcinomem ovaria (lepší prognóza). U AIF-1 byla potvrzena zvýšená exprese u karcinomu děložního hrdla.
Přísnější hodnocení nových nádorových markerů v prospektivních klinických studiích, jež budou podloženy dostatečnými důkazy a přinesou jasné výsledky, může zvýšit šanci na přijetí těchto nových nádorových markerů do klinické praxe [26].
MUDr. Martin Maděrka
Porodnicko-gynekologická klinika
FN a LF UP
I. P. Pavlova 6
775 20 Olomouc
e-mail: maderka.m@gmail.com
Sources
1. ASCO 2006 Update of Recommendations for the Use of Tumor Markers in Gastrointestinal Cancer. J Clin Oncol. http://ascopubs.org/doi/10.1200/JCO.2006.08.2644.
2. AIF1 allograft inflammatory factor 1 [Homo sapiens (human)] – Gene – NCBI. https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=ShowDetailView&TermToSearch=199.
3. Bai, Y., Li, L-D., Li, J., et al. Prognostic values of S100 family members in ovarian cancer patients. BMC Cancer 18. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6296138/
4. Bignotti, E., Ravaggi, A., Tassi, RA., et al. Trefoil factor 3: a novel serum marker identified by gene expression profiling in high-grade endometrial carcinomas. Br J Cancer, 1999, p. 768–773.
5. Bruix, J., Sherman, M. American Association for the Study of Liver Diseases (2011) Management of hepatocellular carcinoma: an update. Hepatol Baltim Md, 2011, p. 1020–1022.
6. CA125 in ovarian cancer: European Group on Tumor Markers guidelines for clinical use. PubMed – NCBI. https://www.ncbi.nlm.nih.gov/pubmed/16174214.
7. Candidates for Tumor Markers of Cervical Cancer Discovered by Proteomic Analysis. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3524426/.
8. Cardoso, F., Costa, A., Norton, L., et al. ESO-ESMO 2nd international consensus guidelines for advanced breast cancer (ABC2). Ann Oncol Off J Eur Soc Med Oncol, 2005, 25, p. 1871–1888.
9. Cardoso, F., Costa, A., Norton, L., et al. European School of Oncology, European Society of Medical Oncology ESO-ESMO 2nd international consensus guidelines for advanced breast cancer (ABC2). Breast Edinb Scotl, 2004, 23, p. 489–502.
10. Chen, Y., Chen, C., Yang, B. Estrogen receptor-related genes as an important panel of predictors for breast cancer response to neoadjuvant chemotherapy. Cancer Lett, 2011, 302, p. 63–68.
11. Ducreux, M., Cuhna, A., Caramella, C., et al. ESMO Guidelines Committee Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol Off J Eur Soc Med Oncol, 2015, 5, p. 56–68.
12. Hoellen, F., Kostara, A., Karn, T., et al. Trefoil factor 3 expression in epithelial ovarian cancer exerts a minor effect on clinicopathological parameters. Mol Clin Oncol, 2016, 5, p. 422–428.
13. Ito, D., Imai, Y., Ohsawa, K., et al. Microglia-specific localisation of a novel calcium binding protein, Iba1. Brain Res Mol Brain Res, 1999, 57, p. 1–9.
14. Kennedy, R., Gorski, J., Quinn, J., et al. BRCA1 and c-Myc associate to transcriptionally repress psoriasin, a DNA damage-inducible gene. Cancer Res, 2005, 65, p. 10265–10272.
15. Lau, W., Pandey, V., Kong, X., et al. Trefoil Factor-3 (TFF3) Stimulates De Novo Angiogenesis in Mammary Carcinoma both Directly and Indirectly via IL-8/CXCR2. PloS One, 2016, 10, p. e0141947.
16. Menon, U., Ryan, A., Kalsi, J., et al. Risk Algorithm Using Serial Biomarker Measurements Doubles the Number of Screen-Detected Cancers Compared With a Single-Threshold Rule in the United Kingdom Collaborative Trial of Ovarian Cancer Screening. J Clin Oncol Off J Am Soc Clin Oncol, 2015, 33, p. 2062–2071.
17. Meyerhardt, J., Mangu, P., Flynn, P., et al. American Society of Clinical Oncology Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol Off J Am Soc Clin Oncol, 2015, 31, p. 4465–4470.
18. Molina, R., Marrades, R., Augé, J., et al. Assessment of a combined panel of six serum tumor markers for lung cancer. Am J Respir Crit Care Med, 2016, 193, p. 427–437.
19. Neubert, D., Ondrová, D., Hambálek J., et al. Elevated levels of TFF3 in endometrial cancer patients. Ces Gynek, 2018, 83, p. 109–114.
20. Proteins of the S100 family regulate the oligomerization of p53 tumor suppressor PNAS. https://www.pnas.org/content/102/13/4735.
21. Rafii, S., Lyden, D. S100 chemokines mediate bookmarking of premetastatic niches. Nat Cell Biol, 2006, 8, p. 1321–1323.
22. S100A9 regulates cisplatin chemosensitivity of squamous cervical cancer cells and related mechanism. https://www.ncbi.nlm.nih.gov/pubmed/30288106.
23. Sedaghat, F., Notopoulos, A. S100 protein family and its application in clinical practice. Hippokratia, 2008, 12, p. 198–204.
24. Serum S100A6 Concentration predicts peritoneal tumor burden in mice with epithelial ovarian cancer and is associated with advanced stage in patients. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0007670.
25. Sturgeon, C., Duffy, M., Stenman, U., et al. National Academy of Clinical Biochemistry National Academy of Clinical Biochemistry laboratory medicine practice guidelines for use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers. Clin Chem, 2008, 54, p. e11-79.
26. Therasse, P., Arbuck, S., Eisenhauer, E. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst, 2000, 92, p. 205–216.
27. Thim, L., Wöldike, H., Nielsen, P., et al. Characterization of human and rat intestinal trefoil factor produced in yeast. Biochemistry, 1995, 34, p. 4757–4764.
28. Tian, Y., Jain, S., Kelemen, S., et al. AIF-1 expression regulates endothelial cell activation, signal transduction, and vasculogenesis. Am J Physiol Cell Physiol 2009, 296, p. C256–C266.
29. Verslype, C., Rosmorduc, O., Rougier, P., et al. ESMO Guidelines Working Group Hepatocellular carcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol Off J Eur Soc Med Oncol, 2012, 23, Suppl. 7, p. vii41-48.
30. Watano, K., Iwabuchi, K., Fujii, S., et al. Allograft inflammatory factor-1 augments production of interleukin-6, -10 and -12 by a mouse macrophage line. Immunology, 2001, 104, p. 307.
31. Xiao, P., Ling, H., Lan, G., et al. Trefoil factors: Gastrointestinal-specific proteins associated with gastric cancer. Clin Chim Acta Int J Clin Chem, 2015, 450, p. 127–134.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2019 Issue 4-
All articles in this issue
- Diagnosis of endometriosis 1st part – Overview of diagnostic approaches
- Diagnosis of endometriosis 2nd part – Ultrasound diagnosis of endometriosis (adenomyosis, endometriomas, adhesions) in the community
- Diagnosis of endometriosis 3rd part – Ultrasound diagnosis of deep endometriosis
- Distální vaginální ageneze
- Ruptura močového měchýře po pádu u pacientky s totálním prolapsem dělohy
- Management pacientky s karcinomem prsu diagnostikovaným v těhotenství
- Retroperitoneální krvácení způsobené spontánní rupturou renálního angiomyolipomu po císařském řezu s následnou selektivní embolizací
- Nové sérové nádorové markery S100, TFF3 a AIF-1 a jejich možné využití v onkogynekologii
- Deprese, úzkost a karcinom ovaria
- Predikcia preeklampsie v prvom trimestri – pilotná štúdia
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnosis of endometriosis 3rd part – Ultrasound diagnosis of deep endometriosis
- Diagnosis of endometriosis 2nd part – Ultrasound diagnosis of endometriosis (adenomyosis, endometriomas, adhesions) in the community
- Diagnosis of endometriosis 1st part – Overview of diagnostic approaches
- Distální vaginální ageneze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

