-
Medical journals
- Career
Role ultrazvuku ve stagingu zhoubného nádoru děložního hrdla (doporučení Evropské onkogynekologické, radiační a patologické společnosti)
Authors: D. Fischerová; D. Cibula
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Published in: Ceska Gynekol 2019; 84(1): 40-48
Category:
Overview
Cíl studie: V roce 2018 Evropská společnost pro gynekologickou onkologii (ESGO), Evropská společnost pro radioterapii a onkologii (ESTRO) a Evropská společnost pro patologii (ESP) společně vypracovaly klinicky relevantní doporučení založené na recentních vědeckých datech s cílem standardizovat a zlepšit kvalitu léčby u žen se zhoubným nádorem děložního hrdla. Doporučení rovněž zahrnují racionální přístup k diagnostice a stagingu onemocnění.
Typ studie: Přehledový článek.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze.
Metodika: Literární přehled prací, které se staly podkladem mezinárodního doporučení racionální diagnostiky a stagingu zhoubného nádoru děložního hrdla.
Výsledky: V souladu s těmito doporučeními je gynekologické vyšetření s odběrem biopsie vhodné pouze ke stanovení diagnózy zhoubného nádoru, nikoliv rozsahu onemocnění. Stanovení rozsahu onemocnění a prognostických parametrů nezbytných pro plánování individualizované péče je založeno na moderních zobrazovacích metodách.
Metodou první volby v lokálním stagingu zhoubného nádoru děložního hrdla je magnetická rezonance pánve (MR). Poprvé v historii však byla akceptována role transvaginálního nebo transrektálního ultrazvuku jako efektivní alternativní metody první volby, srovnatelně přesné s magnetickou rezonancí pánve. Obě metody na základě vysokého tkáňového rozlišení v pánvi umožní přesné stanovení přítomnosti a rozsahu onemocnění v pánvi, včetně stanovení hloubky nádorového šíření do močového měchýře a rekta. Cystoskopie a rektoskopie jsou proto považovány za obsolentní vyšetření, která vedou pouze k zátěži pacientky a zbytečnému prodloužení času do zahájení léčby. Podobně vylučovací intravenózní urografie již není součástí stagingových vyšetření.
Kromě lokálního rozsahu je znalost postižení lymfatických uzlin nezbytným parametrem pro stanovení prognózy onemocnění a plánování léčby. Přesnost zobrazovacích metod v záchytu infiltrovaných lymfatických uzlin závisí na prevalenci metastáz s ohledem na stadium onemocnění a na velikosti uzlinových metastáz. V časném stadiu onemocnění (T1a, T1b1, T2a1) u pacientek s negativními pánevními uzlinami na ultrazvuku či MR je chirurgický staging pánevních lymfatických uzlin metodou volby pro záchyt malých metastáz. Je důležité zdůraznit, že ultrazvuk ani MR nezachytí drobná nádorová ložiska v uzlině, ale obě metody mají velmi nízký počet falešně pozitivních nálezů, jelikož dovedou spolehlivě posoudit přítomnost infiltrované uzliny na základě charakteristických změn.
V případě lokálně pokročilého onemocnění (T1b2 a vyšší stadium, kromě T2a1) nebo časného onemocnění s postiženými pánevními uzlinami podle ultrazvuku či MR je doporučeno doplnit CT nebo PET/CT s cílem zachytit extrapelvické vzdálené metastázy (paraaortální uzliny, hrudník). PET/CT je preferováno v případě primární chemoradioterapie. Bohužel žádná zobrazovací modalita nevyloučí přítomnost mikroskopických paraaortálních metastáz. Proto v případě negativního nálezu na CT nebo PET-CT v zobrazení paraaortálních uzlin je ke zvážení doplnění chirurgického stagingu v rozsahu paraaortální lymfadenektomie. Vzhledem k riziku falešně pozitivních nálezů v zobrazovacích metodách je v případě nejistých známek extrauterinního šíření doporučena biopsie sporné léze silnou jehlou pod ultrazvukovou nebo CT navigací.
Závěr: Přehledový článek předkládá vědecká data, která umožnila racionální změny ve stagingu zhoubného nádoru děložního hrdla.
Klíčová slova:
ultrazvuk – CT – PET/CT
ÚVOD
Současná klinická praxe, která se zaměřuje na individualizovanou léčbu zhoubného nádoru děložního hrdla, v rozporu se stagingovými vyšetřeními doporučenými Mezinárodní federací gynekologie a porodnictví (FIGO) [16] využívá moderní zobrazovací metody nejen ke stanovení rozsahu onemocnění, ale i dalších důležitých prognostických parametrů. Multicentrická studie ACRIN/GOG 183 (American Network of Radiology Imaging Network / Gynecologic Oncology Group) ukázala sporadické použití tradičních stagingových vyšetření doporučených FIGO s použitím cystoskopie (8,1 %), sigmoideoskopie (8,6 %), intravenózní vylučovací urografie (1 %) a gynekologického vyšetření v celkové anestezii (27 %) [1, 8]. Proto Evropská onkogynekologická společnost pod vedením profesora Cibuly iniciovala vznik aktualizovaných doporučení pro diagnostiku, léčbu a sledování pacientek se zhoubným nádorem děložního hrdla [2]. Tato doporučení vznikla ve spolupráci Evropské společnosti pro gynekologickou onkologii (ESGO), Evropské společnosti pro radioterapii a onkologii (ESTRO) a Evropské patologické společnosti (ESP). Autorka přehledového článku byla pozvána k účasti na přípravě těchto mezinárodních doporučení a vedla pracovní skupinu zodpovědnou za přípravu stagingových doporučení.
V souladu s doporučením ESGO-ESTRO-ESP by pacientky se zhoubným nádorem děložního hrdla měly být klasifikovány podle TNM klasifikace (T – primární nádor, N – regionální lymfatické uzliny, M – vzdálené metastázy), protože TNM staging zahrnuje stav lymfatických uzlin. TNM staging by měl být stanoven konsenzuálně v multidisciplinárním týmu, a to na základě výsledků nejpřesnější použité metody (fyzikální vyšetření, zobrazovací metoda a patologie). Současně s TNM klasifikací by měl být uveden také klinický FIGO staging [2].
ESGO-ESTRO-ESP doporučuje zdokumentovat následující prognostické faktory onemocnění:
- TNM a FIGO stadium, maximální velikost nádoru, detailní popis extracervikálního šíření, stav lymfatických uzlin (počet, velikost, lokalizace);
- histotyp a lymfangioinvaze (LVSI);
- hloubka stromální invaze a nejmenší šíře nepostiženého cervikálního stromatu;
- přítomnost či absence vzdálených metastáz.
LOKÁLNÍ STAGING ZHOUBNÉHO NÁDORU DĚLOŽNÍHO HRDLA
Podle původních doporučení FIGO je klinický staging založen na gynekologickém vyšetření, ideálně provedeném zkušeným lékařem a v celkové anestezii [16]. Přínos celkové anestezie je očekáván v případě obtížně vyšetřitelných nálezů nebo při diagnostické nejistotě týkající se postižení pochvy, parametrií anebo pánevní stěny.
V rámci stanovení velikosti nádoru při gynekologickém vyšetření studie ACRIN/GOG183 srovnávala výsledky získané při gynekologickém vyšetření s magnetickou rezonancí (MR) a počítačovou tomografií (CT) [15]. Studie probíhala ve 25 centrech u 208 pacientek s biopticky verifikovaným zhoubným nádorem děložního hrdla, u kterých byla plánována radikální hysterektomie pro časné stadium onemocnění. Korelace mezi testovanými metodami a patologií byla hodnocena Pearsonovým korelačním koeficientem (r). Nejnižší korelace velikosti nádoru s patologickými měřeními z preparátu byla zjištěna pro gynekologické vyšetření (r = 0,37), následovalo CT (r = 0,45) a MR zobrazení, které dosáhlo nejvyšší korelace (r = 0,54) [15]. Na základě těchto údajů je zřejmé, že gynekologické vyšetření je pro stanovení velikosti nádoru v děložním hrdle nepřesné, zejména neumožní stanovení kraniokaudální velikosti nádoru ani velikosti malých nádorů při nezvětšeném děložním hrdle.
Hodnocením parametriální invaze se zabývala velká metaanalýza souboru 3254 pacientek, která srovnávala gynekologické vyšetření s MR zobrazením a ukázala vysoký počet falešně negativních nálezů v rámci gynekologického vyšetření (60 %) ve srovnání s MR (16 %) [21]. Podobně neuspokojivé výsledky byly v této studii zdokumentovány pro gynekologické vyšetření v rámci stanovení lokálně pokročilého onemocnění (T1b2 a vyšší stadium s výjimkou T2a1) ve srovnání s magnetickou rezonancí (falešně negativní nález ve 47 vs. 21 %) [21].
Gynekologické vyšetření obecně vede k podcenění rozsahu onemocnění ve 30 % FIGO stadia IB, až ve 23 % FIGO stadia IIB a téměř ve 40 % FIGO stadia IIIB [1]. Nadhodnocení rozsahu onemocnění na podkladě gynekologického vyšetření je popsáno přibližně u 64 % pacientů ve FIGO stadiu IIIB [1]. Podhodnocení obvykle souvisí s přítomností nepoznaných pozitivních lymfatických uzlin, zatímco nadhodnocení spíše odráží nesprávné subjektivní hodnocení parametriálního šíření.
Na základě předložených dat je zřejmé, že gynekologické vyšetření je diagnostickou, nikoliv stagingovou metodou. Gynekologické vyšetření v rámci stagingu je nepřesné a je nahrazeno moderními zobrazovacími technikami. Od zobrazovacích metod se v rámci lokálního stagingu očekává detailní popis pánevní anatomie, určení topografie nádoru v děložním hrdle a jeho šíření do okolních struktur. Proto volba zobrazovací metody závisí na tkáňovém rozlišení dané metody, její dostupnosti, rizicích (radiační zátěž, alergická reakce) a známých kontraindikacích.
Vyšetření počítačovou tomografií (CT) má nízký tkáňový kontrast v pánvi, a proto nám neumožní spolehlivě odlišit nádor od stromatu děložního hrdla ani neposkytne detailní informace o nádorovém šíření do okolí (obr. 1). Tyto výsledky se nezlepšily ani s nástupem spirálního CT s multidetektorovým snímáním (MDCT) či po aplikaci jodových kontrastních látek. Navíc přináší nezanedbatelnou radiační zátěž, která je při opakovaných vyšetřeních spojena s potenciálním zdravotním rizikem.
Image 1. Zobrazení lokálního rozsahu nádoru
Velký nekrotický tumor odpovídá přítomnosti lokálně pokročilého dlaždicobuněčního karcinomu s prorůstáním do rekta (R) a sigmoidea (S), místo infiltrace označeno šipkou s písmenem postiženého orgánu. Nádor v sagitálním řezu zobrazen transrektálním ultrazvukem (a), nekrotická porce nádoru označena elipsou, MR v T2 vážených obrazech (b) a CT (c). Nádor v transverzální rovině v transrektálním ultrazvuku (d), MR v T2 vážených obrazech (e) a CT (f). Funkční zobrazení nádoru s využitím dopplerovského vyšetření (g), nekrotická avaskulární porce nádoru označena elipsou, DWI (h), DCE (i) a FDG-PET/CT (j), kde opět nekrotická porce nádoru je označena elipsou. MR – magnetická rezonance; CT – počítačová tomografie; PET/CT – pozitronová emisní tomografie fúzovaná s CT; FDG – fluorodeoxyglukóza; DWI – diffusion weighted imaging, difuzně vážené obrazy; DCE-MRI – dynamic contrast enhanced MR imaging, dynamické kontrastní MR zobrazení; M – močový měchýř; P – parametria; R – rektum; S – sigmoideum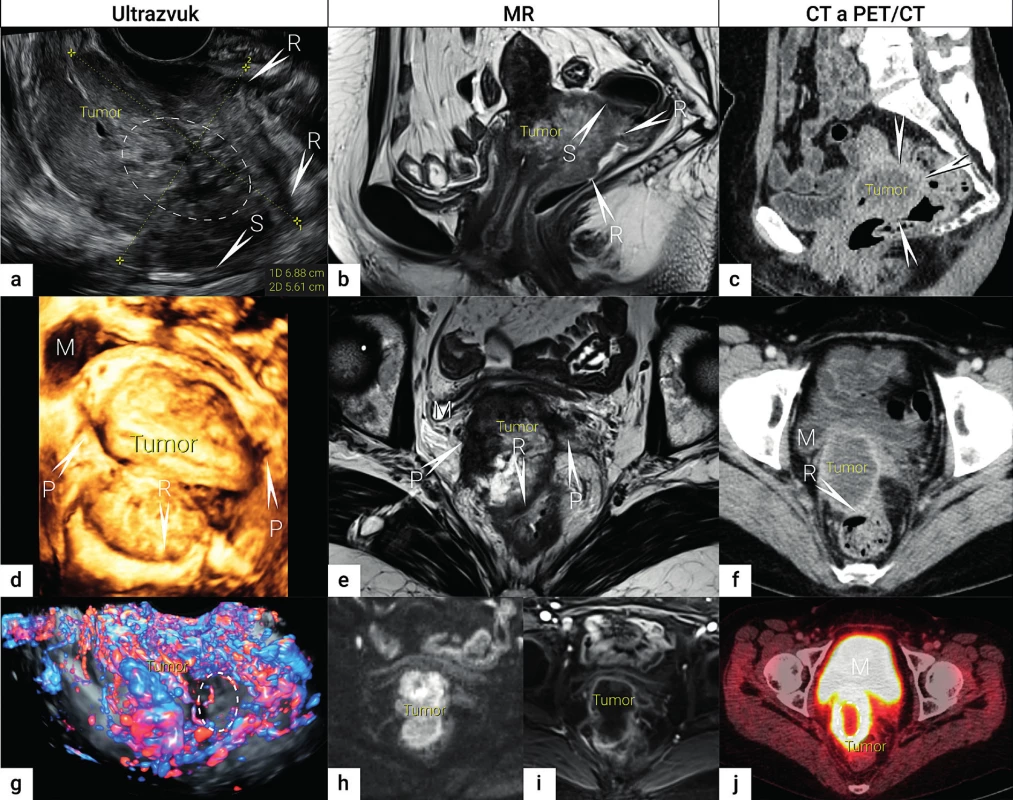
Kombinace CT s pozitronovou emisní tomografií (PET/CT) umožní během jediného vyšetření získat anatomické informace z CT obrazu a metabolické informace související s nádorovou biologií z PET s 2-[fluor-18] fluor-2-deoxy-D-glukózou (FDG). Nicméně ani PET/CT není optimální metodou v rámci stanovení lokálního stagingu, vzhledem k malému kontrastu měkkých tkání v CT zobrazení pánve a menšímu prostorovému rozlišení PET (schopnost rozlišit oddělené prostorové detaily bez rozmazání) (obr. 1). PET často vede k nadhodnocení velikosti nádoru (objemový efekt) a fyziologická akumulace FDG v močovém měchýři neumožní přesné hodnocení invaze do měchýře ani spolehlivé hodnocení přilehlých parametrií. Navíc PET/CT přináší vyšší radiační zátěž než samotné CT.
Zobrazení magnetickou rezonancí (MR) umožní nejen detailní zobrazení pánevní anatomie, ale nemá radiační zátěž (obr.1). Bohužel se jedná o méně dostupnou metodu a má své známé kontraindikace. Její přesnost a využití závisí na dostupnosti zkušeného radiologa se znalostí gynekologické onkologie. MR vyšetřovací protokol tradičně založený na morfologických sekvencích byl nedávno doplněn funkčními sekvencemi, které zahrnují difuzní zobrazení (DWI, diffusion weighted imaging) a dynamické kontrastní zobrazení (DCE, dynamic contrast enhanced) (obr. 1). Restrikci difuze pozorujeme v případě maligních (hypercelulárních) nádorů, restrikce difuze nemusí být přítomna v nekrotických částech nádorů. DWI umožní odlišit nádorovou tkáň od reaktivních změn. Vzhledem k nedostatečnému anatomickému rozlišení a nízkému prostorovému rozlišení, musí být vždy DWI obrazy hodnoceny společně s morfologickými T2 váženými obrazy. Dynamické zobrazení po podání kontrastní látky v rámci MR (DCE) slouží ke zhodnocení perfuze v nádoru a cévní permeability a pomáhá zlepšit detekci přítomnosti nádoru.
Využití ultrazvuku ve stagingu gynekologických zhoubných nádorů bylo dlouho podceňováno a u zhoubného nádoru děložního hrdla bylo jeho použití vyhrazeno pouze pro screening hydronefrózy. Důvodem byl nízký tkáňový kontrast starších ultrazvukových přístrojů, malé zorné pole, závislost na expertize operátora, vliv subjektivity při interpretaci obrazu, obtížné ukládání a vyhledávání reprezentativních snímků pro druhý názor či hodnocení efektu léčby. Ultrazvuk však prošel zlomovým technologickým vývojem během posledních desítek let. Zejména vývoj endovaginálních sond, které mají nejen vysoké rozlišení, ale současně široké zorné pole, umožnil získání srovnatelného obrazu s magnetickou rezonancí pánve (obr. 1).
Výhodou vyšetření ultrazvukem je, že je může provádět přímo gynekolog, respektive onkogynekolog s výcvikem v ultrazvukové diagnostice a znalostí onemocnění. Identická ultrazvuková endovaginální sonda může být zavedena transvaginálně nebo transrektálně. Transrektální přístup je upřednostněn u zhoubného nádoru děložního hrdla, vzhledem k riziku krvácení z křehkého nádoru v souvislosti s transvaginálním vyšetření. Transrektální ultrazvuk nevyžaduje přípravu pacientky, jako je klyzma či lačnění, a zaručuje lepší akustické podmínky pro zobrazení distální části děložního hrdla [10]. Kombinace transvaginálního nebo transrektálního ultrazvuku s transabdominálním ultrazvukem v rámci jednoho vyšetření umožňuje kompletní posouzení břicha a pánve pro staging zhoubného nádoru děložního hrdla (obr. 2) [4]. Expertní sonografisté spolehlivě zhodnotí velikost nádoru, hloubku stromální invaze a infiltraci pericervikální fascie, stupeň postižení parametrií a šíření do pánevní boční stěny včetně posouzení ilických cév, pánevních svalů a hloubky infiltrace stěny močového měchýře nebo rekta. Současně dynamický aspekt ultrazvukového vyšetření umožní posoudit infiltraci sousedních orgánů (močového měchýře a rektosigmoidea) na podkladě fixace (ztráty posunlivosti orgánů proti sobě) [9, 12]. Podobně jako MR ultrazvuk nabízí trojrozměrné zobrazení (3D), včetně snadného ukládání naměřených 3D objemů pro dokumentaci případu s následnou možností druhého čtení, plánování radioterapie anebo hodnocení efektu léčby.
Součástí ultrazvukového vyšetření je dopplerovské zobrazení, které umožní neinvazivní in vivo vyšetření nádorové angiogeneze (obr. 1). Bylo prokázáno, že dopplerovské parametry mohou predikovat klinickou odpověď na neoadjuvantní léčbu nebo primární chemoradioterapii u pacientek s lokálně pokročilým karcinomem děložního hrdla. Výhodná kombinace transrektálního/transvaginálního ultrazvuku s transabdominálním ultrazvukem hodnotí nejen přítomnost hydronefrózy, ale také detekuje intraparenchymatózní metastázy, metastázy lymfatických uzlin a peritoneální postižení v rámci jednoho vyšetření (obr. 2). Ultrazvukové vyšetření je pacientkami dobře tolerováno, je méně časově náročné, nevyžaduje přípravu, lačnění ani aplikaci kontrastní látky. Navíc ultrazvuk je široce dostupný a levnější než MR a nemá žádné známky kontraindikace.
Image 2. Ultrazvukové zobrazení zhoubného nádoru děložního hrdla
Transvaginální (a), transrektální (b) zavedení endovaginální sondy. Transabdominální konvexní sonda zobrazující jaterní metastázy (1), retroperitoneální lymfatické uzliny ilické (2) a paraortální (3). Lineární sonda zobrazující skalenové uzliny vlevo (4). TVS – transvaginální sonografie; TRS – transrektální sonografie; TAS – transabdominální sonografie
Kromě popsaných výhod ultrazvuku dalším krokem nezbytným pro implementaci ultrazvuku jako metody první volby v lokálním stagingu bylo doložit jeho přesnost ve srovnání se současnou metodou volby MR. Relevantní data dokumentující jeho přesnost ve srovnání s MR ve stejné kohortě pacientek operovaných pro časné stadium onemocnění pochází nejen z prací z jednotlivých pracovišť [6, 20], ale také z velké multicentrické Evropské studie [3]. Podle této studie ultrazvuk byl signifikantně přesnější než MR ve srovnání u patologického nálezu, a to v rámci detekce nádoru (96 vs. 89 %, p < 0,001) a hodnocení parametriální invaze (97 vs. 90 %, p = 0,001) [3]. Obě metody (ultrazvuk vs MR) byly srovnatelně přesné v hodnocení velikosti nádoru menšího než 2 cm (89 vs. 86 %) a většího než 4 cm (95 vs. 93 %) a v určení hluboké stromální invaze (91 vs. 88 %) [3]. Na základě uvedených dat se ultrazvuk etabloval jako vhodná metoda v lokálním stagingu a jako srovnatelně přesná metoda s MR v plánování individualizované léčby (typ radikální hysterektomie, fertilitu šetřící léčby, primární chemoradioterapie).
V rámci hodnocení lokálně pokročilého nádoru, kromě infiltrace parametrií a pánevní stěny se zhoubný nádor děložního hrdla často šíří do sousedních orgánů (močový měchýř, rektum). Vzhledem k vysokému tkáňovému rozlišení obou metod, ultrazvuku a MR, je možné nejen zobrazit přítomnost infiltrace těchto orgánů, ale také hloubku nádorového šíření do jejich stěny [9, 12, 17]. Vzhledem k tomu, že ultrazvuk a MR hodnotí jednotlivé stupně invaze nádoru do stěny měchýře anebo rekta (porušení endopelvické fascie, svalové vrstvy, submukózy, mukózy), poskytnou obě metody mnohem více informací než cystoskopie či rektoskopie.
Doporučení ESGO, ESTRO, ESP v rámci stanovení lokálního stagingu:
- Gynekologické vyšetření v kombinaci s biopsií nádoru jako diagnostickou, nikoliv stagingovou metodou.
- Magnetická rezonance je metodou první volby v rámci lokálního stagingu a plánování léčby.
- Transvaginální anebo transrektální ultrazvuk je efektivní alternativou k magnetické rezonanci, pokud je proveden zkušeným sonografistou.
- Cystoskopie nebo rektoskopie je zvažována pouze v případě, že je indikována biopsie suspektní léze v měchýři nebo rektu zdokumentovaná při ultrazvukovém či MR vyšetření (suspekce na duplicitní nádorové onemocnění v měchýři či rektu).
DOPORUČENÝ POSTUP V RÁMCI DETEKCE INFILTROVANÝCH LYMFATICKÝCH UZLIN A VZDÁLENÝCH METASTÁZ
Detekční schopnost zobrazovacích metod v rámci záchytu infiltrovaných uzlin závisí na prevalenci přítomnosti postižených uzlin podle stadia onemocnění (časné, pokročilé stadium) a na velikosti metastázy (mikro-/makrometastáza). Dostupná literatura přináší velmi heterogenní data týkající se volby vhodné zobrazovací metody, jelikož neodlišuje data s ohledem na různý technický vývoj zobrazovacích přístrojů, retrospektivní studie od prospektivních, přesnost hodnocení postižené uzliny v závislosti na jejím uložení. Například podle PET-CT je popsána postižená uzlina vpravo parailicky, podle histologie je naopak potvrzená uzlina na opačné straně, ale studijní hodnocení uzavírá, že PET/CT správně poznal postiženou uzlinu u pacientky bez ohledu na diskrepanci ve stranovém uložení uzliny.
Ultrazvuk hodnotí infiltrované uzliny nikoli podle velikosti, ale na podkladě změny architektury uzliny. Vzhledem k vysokému rozlišení endovaginálních sond dovede přesně zobrazit uzliny kolem vnitřních a zevních ilických cév a odlišit infiltrovanou uzlinu na podkladě změny tvaru uzliny (zakulacená), echogenity (hypoechogenní), kontury (porušení pouzdra uzliny s extrakapsulárním šířením), ztráty typické architektury (nelze rozlišit hilus, dřeň a kortex), přítomnosti nekróz a změny perfuze (periferní a centrální). Na základě hodnocení těchto morfologických a cévních parametrů dosáhl ultrazvuk nejvyšší specificity 99 % (nejnižšího počtu falešně pozitivně hodnocených uzlin) ve srovnání s dalšími metodami (PET/CT 97 %, MRI 95 % a CT 93 %), jak uvedla v roce 2017 metaanalýza zkoumající přesnost moderních zobrazovacích metod v detekci pánevních uzlin (obr. 3) [7].
CT a MR tradičně vyhodnocují infiltrované uzliny podle velikosti (krátká osa 10 mm), ale navíc je posuzují, podobně jako ultrazvuk, na základě změny jejich velikosti a morfologie. Metastatické lymfatické uzliny většinou vykazují kulatý tvar, nepravidelné okraje, nehomogenitu (nekrózy), ztrátu typické uzlinové architektury a tendenci ke zvýšení signálu po intravenózním podání kontrastní látky s restrikcí difuze uvnitř infiltrované uzliny (DWI) (obr. 3). Nedávno bylo prokázáno, že použití sekvencí DWI v MR zobrazení je užitečné při detekci metastáz lymfatických uzlin, jelikož významně zvyšuje senzitivitu záchytu uzlin ve srovnání s konvenčním MR [19]. Ve výše uvedené metaanalýze z roku 2017 bylo DWI falešně negativní v 16 %, zatímco konvenční MR v 50 % (pro úplnost ultrazvuk v 29 % a PET/CT v 32 %, CT v 53 %) [7].
PET/CT demonstruje vysokou metabolickou aktivitu související s nádorem a může také hrát důležitou roli při správné identifikaci lymfatických uzlin, které jsou zvětšeny z nenádorových důvodů (obr. 3). Problémem zůstává detekce malých metastáz (5 mm), která vede k nízké negativní prediktivní hodnotě vyšetření, jeho výsledky týkající se falešné pozitivity a negativity byly uvedeny v předchozích odstavcích [7].
Image 3. Zobrazení lymfatických uzlin
Viscerální metastatická lymfatická uzlina o velikosti 10 mm uložená v pravém sakrouterinním vazu podle transrektálního ultrazvuku (a), PET/CT (b), MR (T2WI)(c) a MR (DWI)(d). TRS – transrektální ultrazvuk; PET/CT – pozitronová emisní tomografie fúzovaná s CT; MR (T2WI) – magnetická rezonance s T2 váženými obrazy (T2WI, T2 weighted images); MR (DWI) – magnetická rezonance se zobrazením difuze (DWI – diffusion weighted images); LU – lymfatická uzlina (označena šipkou v b, c, d); R – rektum; M – močový měchýř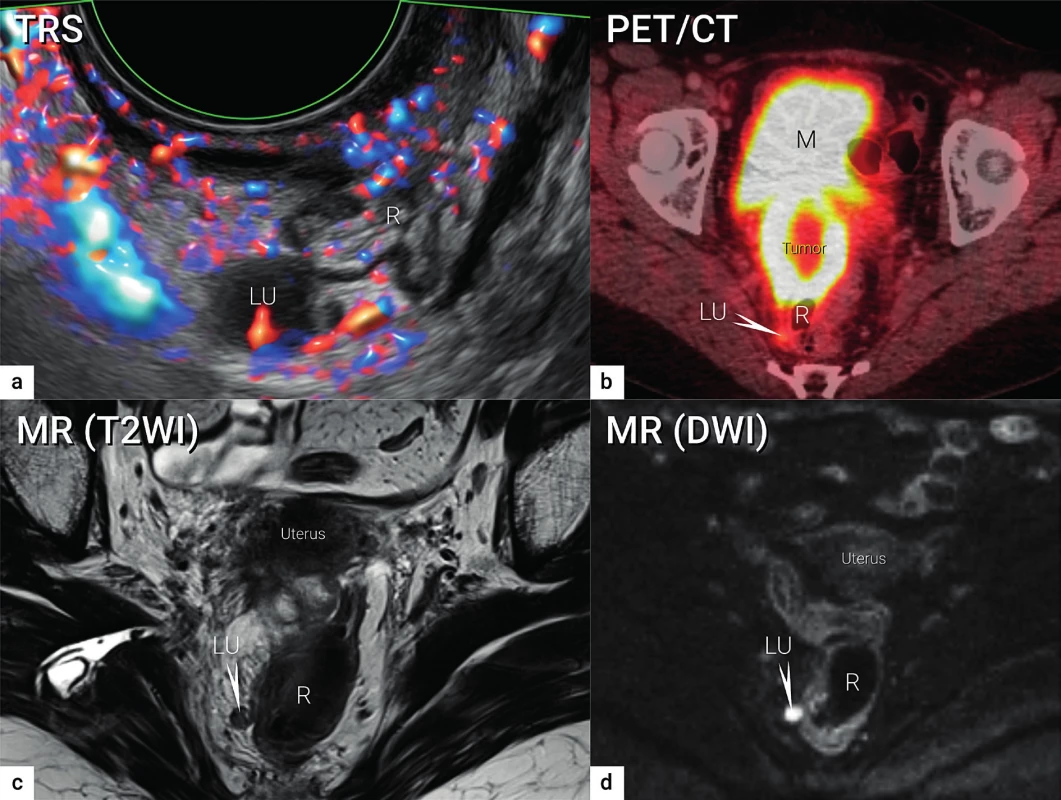
Všechny moderní zobrazovací metody (ultrazvuk, MR, CT nebo PET/CT) vykazují obecně uspokojivou specificitu v detekci lymfatických metastáz (> 90 %), ale nízkou senzitivitu při detekci mikrometastáz a malých objemových metastáz, jak bylo uvedeno výše [7]. Pro klinickou praxi to znamená, že v časných stadiích onemocnění (T1a, T1b1, T2a1) bez patrných infiltrovaných pánevních uzlin podle vstupního ultrazvukového či MR zobrazení je chirurgický staging pánevních lymfatických uzlin metodou volby v detekci malých lymfatických metastáz. Značení sentinelových uzlin zachytí infiltrovanou uzlin 20krát přesněji než MR a pětkrát přesněji než PET/CT [18].
Klíčovým problémem zůstávají pacientky s lokálně pokročilým onemocněním (T1b2 a vyšší, s výjimkou T2a1), které nejsou většinou primárně operovány. Výskyt extrapelvických metastáz se u těchto pacientek pohybuje v rozmezí od 10 % do 30 %, a to zejména v paraaortálních uzlinách a nadbráničně [13]. Dostupné metaanalýzy neposkytují dostatečné důkazy, které by měly podpořit využití PET/CT namísto CT v rámci detekce extrapelvických metastáz [11, 13]. Proto navrhuje doporučení ESGO-ESTRO-ESP provést PET/CT pouze v případě primární chemoradioterapie, kdy PET/CT lze také využít v hodnocení léčebného efektu s přesnějším odlišením perzistující léze a poradiačních změn. Podle velké metaanalýzy z roku 2010 je evidentní, že PET/CT dovede odlišit infiltrovanou uzlinu od reaktivní s vysokou specificitou 97 % (95% CI 93–99 %) [13]. Problémem zůstává jeho nízká senzitivita 34 % (95% CI 10–72 %) s nespolehlivou detekcí malých metastáz v paraaortálních uzlinách, které nejsou rutinně zavzaty v radiačním poli a nerozpoznány mohou vést k časným a mnohdy letálním recidivám [13]. Potenciální roli chirurgického stagingu u pacientek s lokálně pokročilým onemocněním a negativními paraaortálními uzlinami podle CT zobrazení potvrdila recentně publikovaná randomizovaná studie Uterus 11. V této studii chirurgický staging se srovnání s radiologickým stagingem vedl ke zhoršení stadia onemocnění (up-staging) ve 33 % zhoubných nádorů děložního hrdla stadia T2b-4 [22]. V letošním roce očekáváme výsledky této studie, zda bude mít provedení chirurgického stagingu také vliv na zlepšení přežití pacientek.
V neposlední řadě zobrazovací metody mohou vést nejen k falešně negativním, ale také k falešně pozitivním výsledkům. Proto všechny nejednoznačné (sporné) známky extrauterinního šíření by měly být ověřeny biopsií, aby se zabránilo neadekvátním změnám v léčbě (přechod z kurativní na paliativní léčbu). V těchto případech je upřednostňovaná biopsie silnou jehlou (tru-cut/core-cut) nad biopsií tenkou jehlou (FNAB, fine needle aspiration biopsy), jelikož reprezentativní bioptický vzorek z tru-cut biopsie umožní stanovení histologické diagnózy [5, 14, 23]. Biopsie tenkou jehlou umožní pouze cytologickou diagnózu [5, 14, 23]. Biopsie se obvykle provádí pod navigací ultrazvukem nebo CT kontrolou. Pozitivní bioptické nálezy potvrdí diagnózu, ale negativní nálezy by měly být dále sledovány vhodnou zobrazovací metodou, protože nelze vyloučit neadekvátní odběr a riziko falešně negativní diagnózy.
Doporučení ESGO-ESTRO-ESP v rámci stanovení stavu lymfatických uzlin a přítomnosti vzdálených metastáz:
- V časném stadiu onemocnění (T1a, T1b1, T2a1) je chirurgicko-patologický staging pánevních lymfatických uzlin metodou volby ve stanovení prognostických parametrů a plánování léčby (s výjimkou stadia T1a1 bez lymfangioinvaze).
- V případě lokálně pokročilého onemocnění (T1b2 a výše, s výjimkou T2a1) nebo v případě časného onemocnění s nálezem suspektních uzlin je doporučeno doplnit PET/CT nebo CT s cílem detekovat lymfatické uzliny a vzdálené metastázy.
- PET/CT je preferováno před CT v případě primární chemoradioterapie.
- Paraaaortální lymfadenektomie může být doplněna v případě negativních paraaortálních uzlin podle PET/CT nebo CT s cílem upřesnit staging.
- Nejednoznačný nález extrauterinního nádorového šíření by měl být biopticky ověřen s cílem ověřit nález a snížit riziko neadekvátní léčby. Tru-cut (core-cut) biopsie umožní získat histologický vzorek, a proto je preferována před biopsií tenkou jehlou.
ZÁVĚR
Přesná znalost rozsahu onemocnění a prognostických parametrů je základní podmínkou individualizované péče v onkologii. Doporučení ESGO-ESTRO-ESP představují racionální kombinaci zobrazovacích metod a chirurgického stagingu s cílem optimalizovat léčebné výsledky bez navýšení morbidity.
Tato práce byla podpořena Univerzitou Karlovou v Praze (UNCE 204065 a PROGRES Q28 / LF1), projektem Ministerstva zdravotnictví ČR (MZ CR-RVO VFN64165).
Doc. MUDr. Daniela Fischerová, Ph.D.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: daniela.fischerova@lf1.cuni.cz
Sources
1. Amendola, MA., Hricak, H., Mitchell, DG., et al. Utilization of diagnostic studies in the pretreatment evaluation of invasive cervical cancer in the United States: results of intergroup protocol ACRIN 6651/GOG 183. J Clin Oncol, 2005, 23, 30, p. 7454–7459.
2. Cibula, D., Potter, R., Planchamp, F., et al. The European Society of Gynaecological Oncology / European Society for Radiotherapy and Oncology / European Society of Pathology Guidelines for the Management of Patients With Cervical Cancer. Int J Gynecol Cancer, 2018, 28, 4, p. 641–655.
3. Epstein, E., Testa, A., Gaurilcikas, A., et al. Early-stage cervical cancer: tumor delineation by magnetic resonance imaging and ultrasound – an European multicenter trial. Gynecol Oncol, 2013, 128, 3, p. 449–453.
4. Fischerova, D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review. Ultrasound Obstet Gynecol, 2011, 38, 3, p. 2462–2466.
5. Fischerova, D., Cibula, D., Dundr, P., et al. Ultrasound-guided tru-cut biopsy in the management of advanced abdomino-pelvic tumors. Int J Gynecol Cancer, 2008, 18, 4, p. 833–837.
6. Fischerova, D., Cibula, D., Stenhova, H., et al. Transrectal ultrasound and magnetic resonance imaging in staging of early cervical cancer. Int J Gynecol Cancer, 2008, 18, 4, p. 766–772.
7. Gong, Y., Wang, Q., Dong, L., et al. Different imaging techniques for the detection of pelvic lymph nodes metastasis from gynecological malignancies: a systematic review and meta-analysis. Oncotarget, 2017, 8, 8, p. 14107–14125.
8. Hricak, H., Gatsonis, C., Chi, DS., et al. Role of imaging in pretreatment evaluation of early invasive cervical cancer: results of the intergroup study American College of Radiology Imaging Network 6651 – Gynecologic Oncology Group 183. J Clin Oncol, 2005, 23, 36, p. 9329–9337.
9. Huang, WC., Yang, JM., Yang, YC., Yang, SH. Ultrasonographic characteristics and cystoscopic correlates of bladder wall invasion by endophytic cervical cancer. Ultrasound Obstet Gynecol, 2006, 27, 6, p. 680–686.
10. Chiappa, V., Di Legge, A., Valentini, AL., et al. Agreement of two-dimensional and three-dimensional transvaginal ultrasound with magnetic resonance imaging with regard to parametrial infiltration in cervical cancer. Ultrasound Obstet Gynecol, 2014.
11. Choi, HJ., Ju, W., Myung, SK., Kim, Y. Diagnostic performance of computer tomography, magnetic resonance imaging, and positron emission tomography or positron emission tomography/computer tomography for detection of metastatic lymph nodes in patients with cervical cancer: meta-analysis. Cancer Sci, 2010, 101, 6, p. 1471–1479.
12. Iwamoto, K., Kigawa, J., Minagawa, Y., et al. Transvaginal ultrasonographic diagnosis of bladder-wall invasion in patients with cervical cancer. Obstet Gynecol, 1994, 83, 2, p. 217–219.
13. Kang, S., Kim, SK., Chung, DC., et al. Diagnostic value of (18)F-FDG PET for evaluation of paraaortic nodal metastasis in patients with cervical carcinoma: a metaanalysis. J Nucl Med, 2010, 51, 3, p. 360–367.
14. Meva, J., Chaudhary, RK., Bhaduri, D., et al. Lacunae in International Federation of Gynecology and Obstetrics (FIGO) classification for cervical carcinoma: observational study using TNM classification as comparator. Int J Gynecol Cancer, 2013, 23, 6, p. 1071–1077.
15. Mitchell, DG., Snyder, B., Coakley, F., et al. Early invasive cervical cancer: tumor delineation by magnetic resonance imaging, computed tomography, and clinical examination, verified by pathologic results, in the ACRIN 6651/GOG 183 Intergroup Study. J Clin Oncol, 2006, 24, 36, p. 5687–5694.
16. Quinn, MA., Benedet, JL., Odicino, F., et al. Carcinoma of the cervix uteri. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. Int J Gynaecol Obstet, 2006, 95, Suppl. 1, p. S43–103.
17. Rockall, AG., Ghosh, S., Alexander-Sefre, F., et al. Can MRI rule out bladder and rectal invasion in cervical cancer to help select patients for limited EUA? Gynecol Oncol, 2006, 101, 2, p. 244–249.
18. Selman, TJ., Mann, C., Zamora, J., et al. Diagnostic accuracy of tests for lymph node status in primary cervical cancer: a systematic review and meta-analysis. CMAJ, 2008, 178, 7, p. 855–862.
19. Shen, G., Zhou, H., Jia, Z., Deng, H. Diagnostic performance of diffusion-weighted MRI for detection of pelvic metastatic lymphnodes in patients with cervical cancer: a systematic review and meta-analysis. Br J Radiol, 2015, 88, 1052, p. 20150063.
20. Testa, AC., Ludovisi, M., Manfredi, R., et al. Transvaginal ultrasonography and magnetic resonance imaging for assessment of presence, size and extent of invasive cervical cancer. Ultrasound Obstet Gynecol, 2009, 34, 3, p. 335–344.
21. Thomeer, MG., Gerestein, C., Spronk, S., et al. Clinical examination versus magnetic resonance imaging in the pretreatment staging of cervical carcinoma: systematic review and meta-analysis. Eur Radiol, 2013, 23, 7, p. 2005–2018.
22. Tsunoda, AT., Marnitz, S., Soares Nunes, J., et al. Incidence of Histologically Proven Pelvic and Para-Aortic Lymph Node Metastases and Rate of Upstaging in Patients with Locally Advanced Cervical Cancer: Results of a Prospective Randomized Trial. Oncology, 2017, 92, 4, p. 213–220.
23. Zikan, M., Fischerova, D., Pinkavova, I., et al. Ultrasound-guided tru-cut biopsy of abdominal and pelvic tumors in gynecology. Ultrasound Obstet Gynecol, 2010, 36, 6, p. 767–772
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2019 Issue 1-
All articles in this issue
- Robotická paraaortální lymfadenektomie v onkogynekologii. Duální dokování daVinci S systému zvyšuje úspěšnost vysoké paraaortální lymfadenektomie u karcinomu endometria
- Porodní poranění análního sfinkteru – analýza vlastního souboru rodiček mezi lety 2015–2017
- Medicínské, eticko-morální a právní aspekty u operací Svědků Jehovových
- Kritéria pro výběr náhradní matky
- Psychosociální rizikové faktory akutního císařského řezu
- Role ultrazvuku ve stagingu zhoubného nádoru děložního hrdla (doporučení Evropské onkogynekologické, radiační a patologické společnosti)
- Děložní mikrobiom jako faktor receptivity endometria
- Cerclage – historie a současnost
- Endometrióza v těhotenství – diagnostika a management
- Diagnostika a moderní trendy v terapii poporodní deprese
- Močová inkontinence v těhotenství
- Fournierova gangréna spojená s léčbou diabetes mellitus glifloziny
- Devadesátiletí profesora Antonína Doležala
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza v těhotenství – diagnostika a management
- Diagnostika a moderní trendy v terapii poporodní deprese
- Cerclage – historie a současnost
- Děložní mikrobiom jako faktor receptivity endometria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

