-
Medical journals
- Career
Aktuální poznatky o HPV infekci
Authors: A. Mladěnka 1; A. Kubečková 2; J. Sláma 3
Authors‘ workplace: Gynekologicko-porodnická klinika FN, Ostrava, přednosta doc. MUDr. O. Šimetka, Ph. D., MBA 1; Porodnická a gynekologická klinika FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG 2; Gynekologicko-porodnická klinika VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 3
Published in: Ceska Gynekol 2016; 81(5): 369-375
Overview
Cíl studie:
Přehled aktuálních informací o HPV infekci.Typ studie:
Souhrnný přehled.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, Fakultní nemocnice Ostrava; Porodnická a gynekologická klinika, Fakultní nemocnice Hradec Králové; Gynekologicko-porodnická klinika, Všeobecná fakultní nemocnice v Praze.Metodika a výsledky:
Lidský papilomavirus (HPV) je sexuálně přenosný patogen, který způsobuje anogenitální onemocnění. Perzistence virové infekce s vysoce rizikovými genotypy HPV způsobuje prakticky všechny nádory děložního hrdla, asi 60 % nádorů vulvy, 70 % nádorů vaginy a 93 % nádorů anu.Závěr:
Objev onkogenního potenciálu HPV a znalosti etiopatogeneze HPV infekce umožnily velký pokrok v primární a sekundární prevenci prekanceróz a maligních onemocnění.Klíčová slova:
HPV, lidský papilomavirus, karcinom děložního hrdlaÚVOD
Infekce lidskými papilomaviry (Human Papilloma Virus – HPV) patří k nejčastějším sexuálně přenosným onemocněním [43, 53]. Přibližně 80 % ženské populace se do 50. roku života setká s HPV, a téměř 40 % dokonce již krátce po koitarche [3, 62]. Projevy infekce se manifestují jen u menšiny postižených žen a u 80–90 % infikovaných dojde ke spontánní clearence viru [6, 16, 18].
Dosud je známo více než 200 genotypů HPV a svůj podíl na gynekologických infekcích má přibližně 30 z nich [42]. Již před téměř 40 lety vyslovil německý virolog Harald zur Hausen hypotézu o podílu HPV v etiopatogenezi karcinomu děložního hrdla a následně bylo DNA HPV nalezeno v téměř všech biopsiích z cervikálního karcinomu [45, 66]. Tento převratný objev, oceněný v roce 2008 Nobelovou cenou za medicínu, zcela změnil pohled na kancerogenezi cervikálního karcinomu a umožnil recentní inovaci ve screeningu a vývoj preventivních vakcín proti HPV [46].
Incidence karcinomu hrdla děložního v České republice mírně klesá, v roce 2013 byla 16,7/100 000 [2]. I přesto je v porovnání s vyspělými zeměmi vysoká – například Finsko v roce 2008 mělo incidenci 5,6/100 000 [1]. V České republice je zaveden screening založený na cytologii v ročních intervalech, podobný systém funguje v mnoha zemích světa [38]. Nově se však prosazuje efektivnější screening pomocí detekce HPV DNA. Od roku 2015 je v USA schváleno použití HPV testace v primárním screeningu jako alternativy k cytologii od 25 let [20]. Od loňského roku zavedlo Nizozemsko testování HPV jako primární screeningovou metodu u žen od 30 let v pětiletých intervalech. Při pozitivitě HPV 16 nebo 18 je provedena kolposkopie, při pozitivitě jiného typu je riziko tříděno pomocí cytologie. Alternativou ambulantního testování je možnost samostatného testování doma [60].
LIDSKÝ PAPILOMAVIRUS
HPV řadíme do čeledi Papillomaviridae [42]. Z hlediska potenciálního rozvoje maligního onemocnění jsou HPV genotypy klasifikovány do dvou skupin. Genotypy nízce rizikové (low risk, LR) – HPV 6, 11, 40, 42, 43, 44, 54, 61, 72, 81 – jsou původci low grade skvamózních lézí (LSIL) genitálního traktu a kondylomatózního postižení kůže a sliznic [3]. Genotypy vysoce rizikové (high risk, HR) – HPV 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82 – jsou zodpovědné za low i high grade skvamózní léze (HSIL), žlázové léze (adenokarcinom in situ, AIS) a maligní onemocnění anogenitální oblasti [56]. Na infekci se mnohdy podílí více HPV genotypů, ale pouze nejagresivnější jsou zodpovědné za rozvoj onemocnění, které má typicky monoklonální charakter [30, 57]. HPV má ikosahedrální kapsidu obsahující 72 kapsomer [24]. Jeho genom je tvořený dvouvláknovou cirkulární DNA přibližně s 8000 bázemi, která je rozdělená do tří regionů: long control region (LCR), early region zahrnující geny E1, E2, E4, E5, E6 a E7 a late region, který se skládá z genů L1 a L2. Produkty L1 a L2 genů jsou součástí virové kapsuly. Pomocí L1 proteinu je virus schopen se vázat na membránu bazálního keratocytu [31].
Na základě nukleotidové sekvence hlavního kapsidového proteinu L1 byl vytvořen fylogenetický strom HPV s rozdělením jednotlivých typů HPV [12]. Existuje pět hlavních rodů HPV: Alfapapilomaviry, Betapapilomaviry, Gamapapilomaviry, Mu papilomaviry a Nu papilomaviry. Pouze alfapapilomaviry infikují genitální slizniční epiteliální buňky. Genotypy HPV patřící do různých rodů mají méně než 60% podobnost v nukleotidové sekvenci kapsidového proteinu L1. Nový genotyp viru musí mít méně než 90% podobnost s ostatními typy HPV [12].
MECHANISMY PŘENOSU HPV INFEKCE
Nejvýznamnějším způsobem přenosu infekce HPV je pohlavní styk [54]. Potřebný je přímý kontakt s infikovaným epitelem penisu, anu, vulvy, vaginy nebo cervixu. Další možné způsoby přenosu, například kontaminovanými předměty, či dokonce běžným kontaktem, jsou často diskutovaným tématem [31]. Při PCR testaci stěrů z vaginálních ultrazvukových sond byla prokázána 28% kontaminace HPV DNA a 3% perzistence po použití dezinfekce s kvartérními amoniovými solemi, přičemž ve dvou případech se jednalo o vysoce rizikové HPV 16 a 31 [7]. Riziko vertikálního přenosu z matky na dítě je asi 2,8 %. Velmi důležitým poznatkem je, že HPV DNA může být diagnostikována v plodové vodě již před jejím odtokem. Transplacentární přenos se děje přes placentární mikrotraumata, a HPV 16 DNA byla prokázána dokonce i v pupečníkové krvi. Novorozenec se může také nakazit při prostupu infikovanými porodními cestami [25].
PRŮBĚH INFEKCE HPV
HPV DNA je nejdříve umístěná epizomálně, extrachromozomálně. V této pozici se nachází u benigních a premaligních HPV lézí [36]. Pro karcinogenezi je důležitá perzistence HPV infekce, při které dochází ke kumulaci defektů buněčného cyklu [36, 64]. Inkubační doba infekce trvá 3–12 měsíců. E6 protein se váže na p53 tumor supresorový gen, E7 na pRb gen hostitelské buňky s následnou inaktivací genů [64, 65]. E6 je schopný onkogenní aktivity nezávislé na genu p53. Vyšší onkogenní potenciál HR HPV se vysvětluje vyšší afinitou jejich proteinů E7 k pRb genu a také neschopností E6 vazby k p53 u LR typů [65]. Dopad působení E6 a E7 zmírňuje gen E2, který reguluje jejich transkripci [36]. Rozhodující je proniknutí virového genomu do hostitelské DNA [58]. V průběhu integrace virus ztrácí E1 a E2 region a následuje nekontrolovaná a zvýšená exprese onkogenních proteinů E6 a E7. Integrace HPV DNA do hostitelského genomu je spojena s progresí prekancerózy z LSIL do HSIL a změnou z polyklonálního na monoklonální charakter procesu [36]. Do hostitelské DNA se většinou integruje pouze jeden typ HPV DNA a ostatní genotypy se nacházejí epizomálně. Intenzita replikace v bazálních buňkách je nízká, ale zvyšuje se postupem hostitelské buňky k apikálním vrstvám epitelu. Tento fenomén je způsoben ztrátou schopnosti keratinocytu realizovat buněčný cyklus a následné virové reaktivaci k zachování dostatečné syntézy a replikace virové DNA [31]. Kompletní viriony se diferencují až v terminálně diferencovaných povrchových keratinocytech [45]. Na konci procesu maturace keratinocytu vzniká v každé hostitelské buňce přibližně tisíc kopií virové DNA, která se po odloučení keratinocytu dostává do zevního prostředí [31]. Okolo 80 % HPV HR infekcí je přechodných, likvidovaných pravděpodobně působením imunitní odpovědi zprostředkované T-lymfocyty [49]. Při přetrvávající infekci, která je potřebná ke karcinogenezi, je zvýšená exprese onkoproteinů E6/E7. Testování na HPV HR E6/E7 mRNA, jako známky perzistující buněčné infekce, se ukazuje jako velmi přesný diagnostický nástroj transformující infekce [39]. Při latentní infekci může být vir přítomen v několika bazálních buňkách, u kterých nedochází k diferenciaci. Předpokládá se, že HPV DNA může být v této fázi nedetekovatelná, dokud nedojde k aktivaci buňky působením dosud neznámých stimulů [23, 33].
Zdá se, že ačkoliv jsou in vitro onkoproteiny E6 nebo E7 schopny transformovat normální buňku na nádorovou, in vivo k tomu nevede ani jejich společná interakce. Proto vznikly dvě hypotézy o transformaci bazálních buněk na zhoubné:
- Existují důkazy o samostatných signalizačních kaskádách v rámci buněk nebo mezi buňkami, které blokují progresi bazálních „nesmrtelných“ buněk na maligní [22]. Transkripce onkogenů nebo exprese virových onkoproteinů může být tímto způsobem ovlivňována přes receptor kyseliny retinové [4] nebo cytokiny například transforming growth faktorem beta [5, 63], interferonem-alfa [28] nebo tumor nekrotizujícím faktorem alfa [50].
- Změny v buněčné DNA (např. mutace p53) mohou společně s virovými onkoproteiny působit ve shodě, a umožnit tak malignizaci bazálních buněk [51]. Stejně tak může nitrobuněčná kontrola funkce virových onkoproteinů u geneticky nepoškozených buněk tuto přeměnu blokovat. Alternativně může být blokována malignizace geneticky nemodifikovaných buněk, které jsou infikovány HR HPV, nitrobuněčnou kontrolou funkce virového onkoproteinu [21].
EPIDEMIOLOGIE HPV INFEKCÍ
Do 50. roku věku se s HPV infekcí setká přibližně 80 % sexuálně aktivních žen [42]. Ve Spojených státech byla studována roční prevalence anogenitální slizniční infekce způsobené HPV v různých věkových kohortách. Ve věku 14–19 let dosahovala 24,5 %, ve věku 20–24 let dosahovala 44,8 %, ve věku 25–29 let dosahovala 27,4 %, ve věku 30–39 let dosahovala 27,5 %, ve věku 40–49 let dosahovala 25,2 % a ve věku 50–59 let stále dosahovala 19,6 %. V celé populaci od 14 do 59 let dosahovala 26,8 % [15]. Důvodem pro významně vyšší prevalenci v nízkém věku je, že virus napadá zejména metaplastický cervikální epitel, který je u adolescentní populace a v časné dospělosti dobře přístupný, a tím více vulnerabilní [35]. Mladé ženy navíc také častěji užívají hormonální antikoncepci, aniž by současně používaly bariérové kontracepční metody a nemají dlouhodobě jediného stálého sexuálního partnera. Na druhou stranu, nejvyšší pravděpodobnost spontánní clearence je právě u mladé populace do 30 let (70 % do jednoho roku a 90 % do dvou let) [42]. U ostatní dospělé populace dochází ke spontánní clearence viru v 35–50 % případů [37, 42]. Výskyt HPV infekce sice úzce souvisí se začátkem sexuálního života [42], ale v některých zemích včetně České republiky se objevuje druhý vrchol kolem 35. až 45. roku života a pravděpodobně souvisí se změnou sexuálního partnera [3, 35].
Perzistence infekce je nejdůležitějším faktorem pro manifestaci benigních lézí a pro progresi prekancerózy až k invazivnímu karcinomu [42]. Průměrný čas potřebný od infekce ke vniku karcinomu je 13 let [42]. Mezi rizikové faktory pro vznik a perzistenci HPV infekce patří rizikové sexuální chování, vyšší počet sexuálních partnerů, koitarché před 17. rokem života, rizikové sexuální chování partnera, kouření tabáku, multiparita, současná jiná sexuálně přenosná infekce (chlamydie, HSV, HIV), hormonální antikoncepce, imunodeficience, nízký socioekonomický stav, nedostatečná nutrice a deficit vitaminu C a beta-karotenu [24]. Ženy, které měly více než pět sexuálních partnerů v průběhu pěti let, mají 12krát vyšší riziko vzniku rekurentních kondylomat než ženy s jedním partnerem [17]. Pokud infikovaná žena kouří 20 cigaret denně po dobu více než šesti let, má dvojnásobné riziko vzniku cervikálního karcinomu oproti nezatížené populaci [41]. Riziko perzistentní HPV infekce se dále zvyšuje s počtem vykouřených cigaret. Pacientky, které po léčbě těžké vulvární dysplazie nepřestanou kouřit, mají 30krát vyšší riziko perzistence léze [27]. Infekce chlamydií trachomatis, zvláště G sérotypem, a herpes simplex virus jsou považovány za další kofaktory karcinogeneze. Chlamydie je schopna inhibovat apoptózu v HPV infikovaných buňkách [36]. Při současné HIV pozitivitě je až 40krát vyšší riziko vzniku dysplastických změn v porovnání s HIV negativními ženami [31]. K perzistenci HPV infekce přispívá především HIV indukovaná imunosuprese u HIV pozitivních žen [41]. In vitro studie naznačují zvýšení exprese proteinů E6 a E7 cestou HIV kodovaného tat proteinu [59].
ANOGENITÁLNÍ ONEMOCNĚNÍ VYVOLANÁ LIDSKÝMI PAPILOMAVIRY
Kondylomata acuminata (genitální bradavice, fíčky) jsou exofyticky rostoucí kožní nebo slizniční výrůstky vyskytující se predominantně na neochlupené kůži zevního genitálu, hráze, perianálně a na vaginální a cervikální sliznici [17]. Kondylomata mohou způsobovat intenzivní dyskomfort spojený s pruritem, vzácně s krvácením a sekundární infekcí erozí, zejména po škrábání [17].
Původcem onemocnění jsou převážně LR HPV. Významný podíl tvoří hlavně genotypy 6, 11, které se nacházejí v 60–80 % kondylomat [56]. V současnosti se odhaduje, že se onemocnění projevuje přibližně u 1 % populace žen mezi 15. až 45. rokem života, a představuje tak jednu z nejčastějších sexuálně přenosných nemocí genitálního traktu [17]. Odhadované celoživotní riziko výsevu dosahuje 10 % [25].
HPV se mimo vzniku karcinomu děložního hrdla podílí i na vzniku análního karcinomu z 93 % [26], karcinomu vulvy z 60 % [34] a pochvy ze 70 % [52]. Mimo anogenitální oblast je HPV infekce zodpovědná ještě za karcinom orofaryngu z 12 % a za karcinomy ústní dutiny ze 3 % [40].
Z prekanceróz zevních rodidel se podílí HPV infekce na vzniku LSIL a HSIL vulvy (dříve usual vulvar intraepithelial neoplasia, uVIN) [13]. HPV DNA bylo nalezeno u uVIN v 86,7 % případů [11]. Malá část HPV negativních lézí koreluje s nižším podílem DVIN (differentiated vulvar intraepithelial neoplasia). HPV 16 je nejběžnějším typem (77,3 %), který byl detekován v uVIN, následuje HPV 33 (10,6 %) a HPV 18 (2,5 %). Naproti vysokému nálezu HPV DNA pozitivních VIN pouze u 28,6 % invazivních karcinomů vulvy bylo potvrzeno HPV DNA [11, 58]. Tento fakt dokládá omezený progresivní potenciál HPV asociovaných vulvárních prekanceróz.
Karcinom pochvy je velmi vzácné onemocnění reprezentující asi 1 % nádorů ženského genitálu. Jeho prekancerózou je HSIL vaginy (dříve vaginální intraepiteliální neoplazie, VaIN), která však malignizuje jen v asi 5 % [45].
Nejlépe prozkoumaný je vliv HPV na etiopatogenezi cervikálních prekanceróz a karcinomu děložního hrdla. Prekancerózy děložního hrdla jsou nejčastěji diagnostikovanými dysplastickými změnami v gynekologii [8]. Metaanalýza 30 tisíc pacientek s cervikálním karcinomem potvrdila přítomnost HPV v 90,9 % případů spinocelulárního karcinomu a v 82 % u adenokarcinomu [32]. Pokud se ale provede důkladná analýza přítomnosti HPV DNA v nádoru, pak je zjištěna až v 99,7 % případů [61]. Zastoupení jednotlivých HPV genotypů se v různých světových regionech mírně liší, například v Asii je častější výskyt HPV genotypů 52 a 58, v Africe HPV 45 a v centrální a jižní Americe genotypů HPV 39 a 59 [9, 24]. V Evropské multicentrické studii analyzující více než 2700 pacientek s invazivním cervikálním karcinomem dominuje u spinocelulárního karcinomu HPV 16 (66,2 %), následováno HPV 18 (10,8 %), HPV 33 (5,3 %), HPV 45 (5,0 %), HPV 31 (4,1 %) a HPV 52 (2,0 %). U adenokarcinomu je nejčastěji zastoupeno HPV 16 (54,2 %), HPV 18 (40,4 %), HPV 45 (8,3 %) [55]. V již zmiňované metaanalýze zahrnující 30 tisíc pacientek se zastoupení mírně liší – u spinocelulárního karcinomu HPV 16 (59 %), následováno HPV 18 (13 %), HPV 58 (5 %), HPV 33 (5 %) a HPV 45 (4 %), u adenokarcinomu HPV 16 (36 %), HPV 18 (37 %), HPV 45 (5 %), HPV 31 (2 %) a HPV 33 (2 %) [32].
Riziko rozvoje high grade léze a karcinomu se liší podle typu HPV. V souboru více než 20 tisíc žen desetileté riziko vzniku high grade léze a karcinomu při nákaze HPV 16 dosahovalo 17 %, pro HPV 18 bylo toto riziko 14 %, při HPV pozitivitě jiným typem než 16 a 18 ale riziko klesá pouze na 3 % a pro HPV negativní ženy je desetileté riziko menší než 1 % [29].
MOŽNOSTI PREVENCE A DETEKCE HPV INFEKCE
Protivirová léčba dosud neexistuje, a tak je základní modalitou managementu HPV infekcí prevence. V sekundární prevenci se uplatňuje vyhledávání prekanceróz pomocí screeningu s použitím onkologické cytologie, kolposkopie a detekce HPV DNA. Ke stanovení přítomnosti HPV lze použít validovaných HPV testů, které využívají různé metodiky – hybridizaci in situ, PCR aj. Kromě toho je možno detekovat celý genom HPV nebo pouze produkt aktivní infekce,mRNA. Tradičním testem detekujícím HPV DNA je Hybrid Capture 2 test (Digene), který detekuje přítomnost HR a LR HPV bez rozlišení jednotlivých typů. Jeho hlavní nevýhodou je možnost zkřížené reaktivity. Přesto je hlavním referenčním testem s přiměřenou analytickou senzitivitou. Testem, který v současné době nejlépe naplňuje kritéria vhodného DNA testu, je Cobas 4800 HPV test (Roche), který specificky detekuje HPV 16 a 18 a současně dalších 12 HR HPV typů. Přehled validovaných testů schválených americkou FDA a přehled testů schválených v Evropě shrnuje tabulka 1. Detekce HPV DNA u žen ve vyšším věku než 25–30 let dokáže zpřesnit cytologický screening. HPV testace je v detekci HSIL signifikantně více senzitivní než cytologie (96 % proti 53 %), ale méně specifická (91 % proti 96 %) [10]. Negativní prediktivní hodnota při kombinaci cytologie a HPV testování je velmi vysoká, což může v důsledku snížit náklady na screening [14, 19, 47]. HPV DNA negativita má delší protektivní efekt než cytologie (minimálně dvakrát delší pro HSIL i cervikální karcinom), screeningové intervaly mohou být proto u HPV negativních žen významně prodlouženy [14, 44].
Table 1. Schválené HPV testy 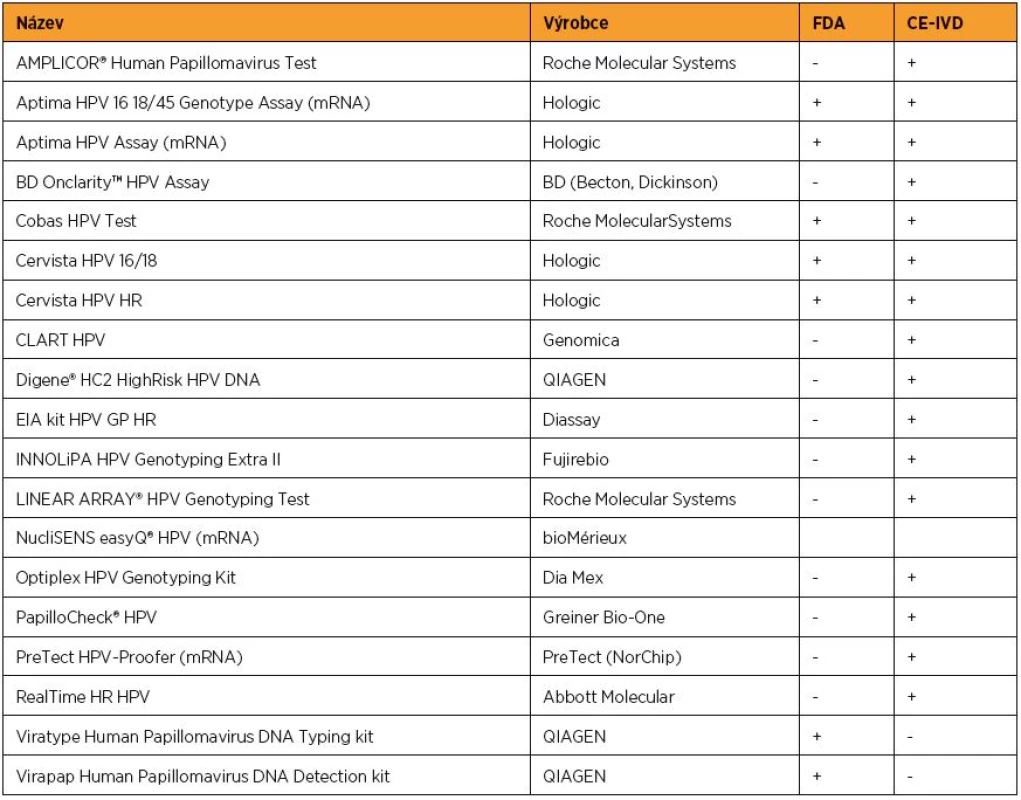
FDA – U.S. Food and Drug Administration CE-IVD – Conformité Européene (European Conformity – Evropská shoda) – in vitro diagnostika – odpovídající nařízení Evropské unie 93/68/EEC Test pro detekci mRNA HPV hledající expresi E6 anebo E7 RNA nemá prediktivní význam a nelze jej použít oproti HPV DNA ve screeningu. Je však vhodnější jako nástroj pro třídění nejasných cytologických nálezů, neboť zvyšuje specificitu detekce HSIL, a tak snižuje počet falešně pozitivních výsledků v porovnání s testem prokazujícím HPV DNA [48].
Objev HPV vakcinace otevřel nové možnosti v primární prevenci benigních, premaligních a maligních onemocnění ženského genitálu [42]. V současnosti jsou dostupné tři odlišné profylaktické vakcíny, které dokážou zabránit až 92 % všech případů zhoubných nádorů děložního hrdla a podstatné části HPV asociovaných prekanceróz vulvy, vaginy a anu a benigních kondylomat.
ZÁVĚR
HPV infekce a její následky představují celosvětový problém. Asi 5 % všech zhoubných nádorů je spojeno s HPV infekcí. Objev etiopatogeneze HPV infekce a jejího onkogenního potenciálu umožnil velký pokrok v primární a sekundární prevenci prekanceróz a maligních onemocnění vulvy, pochvy, děložního hrdla a anu.
MUDr. Aleš Mladěnka
Gynekologicko-porodnická klinika FN
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: ales.mladenka@fno.cz
Korespondující autor
doc. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: Jiri.Slama@vfn.cz
Sources
1. C53 – Hrdlo děložní – cervicis uteri, ženy, srovnání incidence v ČR s ostatními zeměmi Evropy, přepočet na 100 000 osob. 2015, Ústav zdravotnických informací a statistiky ČR, URL: http://www.svod.cz/graph/?sessid=hs4f0rfuklirjvnu08j46rqtv5&typ=zahranici_2008&diag=C53&incmor=inc&pohl=z&kraj=w&vek_od=0&vek_do=18&zobrazeni=table&incidence=1&mortalita=1&vypocet=c&obdobi_od=1977&obdobi_do=2013&stadium=&t=&n=&m=&pt=&pn=&pm=&t=&n=&zije=&umrti=&lecba=&ref=.
2. C53 – ZN hrdla děložního – cervicis uteri, ženy, časový vývoj, počet případů na 100 000 osob. 2015, Ústav zdravotnických informací a statistiky ČR, URL: http://www.svod.cz/graph/?sessid=hs4f0rfuklirjvnu08j46rqtv5&typ=incmor&diag=C53&pohl=z&kraj=&vek_od=1&vek_do=18&zobrazeni=table&incidence=1&mortalita=1&mi=0&vypocet=c&obdobi_od=1977&obdobi_do=2013&stadium=&t=&n=&m=&pt=&pn=&pm=&t=&n=&zije=&umrti=&lecba=.
3. Ault, KA. Epidemiology and natural history of human papillomavirus infections in the female genital tract. Infect Dis Obstet Gynecol, 2006, Suppl., p. 40470.
4. Bartsch, D., Boye, B., Baust, C., et al. Retinoic acid-mediated repression of human papillomavirus 18 transcription and different ligand regulation of the retinoic acid receptor beta gene in non-tumorigenic and tumorigenic HeLa hybrid cells. EMBO J, 1992, 11, 6, p. 2283–2291.
5. Braun, L., Durst, M., Mikumo, R., Gruppuso, P. Differential response of nontumorigenic and tumorigenic human papillomavirus type 16-positive epithelial cells to transforming growth factor beta 1. Cancer Res, 1990, 50, 22, p. 7324–7332.
6. Burk, RD., Ho, GY., Beardsley, L., et al. Sexual behavior and partner characteristics are the predominant risk factors for genital human papillomavirus infection in young women. J Infect Dis, 1996, 174, 4, p. 679–689.
7. Casalegno, JS., Le Bail Carval, K., Eibach, D., et al. High risk HPV contamination of endocavity vaginal ultrasound probes: an underestimated route of nosocomial infection? PLoS One, 2012, 7, 10, p. e48137.
8. Cibula, D., Petružela, L., a kolektiv. Onkogynekologie. 1. ed. Praha: Grada Publishing, 2009, s. 311–339.
9. Clifford, GM., Smith, JS., Plummer, M., et al. Human papillomavirus types in invasive cervical cancer worldwide: a meta-analysis. Br J Cancer, 2003, 88, 1, p. 63–73.
10. Cuzick, J., Clavel, C., Petry, KU., et al. Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer, 2006, 119, 5, p. 1095–1101.
11. de Sanjose, S., Alemany, L., Ordi, J., et al. Worldwide human papillomavirus genotype attribution in over 2000 cases of intraepithelial and invasive lesions of the vulva. Eur J Cancer, 2013, 49, 16, p. 3450–3461.
12. de Villiers, EM., Fauquet, C., Broker, TR., et al. Classification of papillomaviruses. Virology, 2004, 324, 1, p. 17–27.
13. De Vuyst, H., Clifford, GM., Nascimento, MC., et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta-analysis. Int J Cancer, 2009, 124, 7, p. 1626–1636.
14. Dillner, J., Rebolj, M., Birembaut, P., et al. Long term predictive values of cytology and human papillomavirus testing in cervical cancer screening: joint European cohort study. BMJ, 2008, 337, p. a1754.
15. Dunne, EF., Unger, ER., Sternberg, M., et al. Prevalence of HPV infection among females in the United States. JAMA, 2007, 297, 8, p. 813–819.
16. Figueroa, JP., Ward, E., Luthi, TE., et al. Prevalence of human papillomavirus among STD clinic attenders in Jamaica: association of younger age and increased sexual activity. Sex Transm Dis, 1995, 22, 2, p. 114–118.
17. Gall, SA. Female genital warts: global trends and treatments. Infect Dis Obstet Gynecol, 2001, 9, 3, p. 149–154.
18. Ho, GY., Bierman, R., Beardsley, L., et al. Natural history of cervicovaginal papillomavirus infection in young women. N Engl J Med, 1998, 338, 7, p. 423–428.
19. Hoyer, H., Scheungraber, C., Kuehne-Heid, R., et al. Cumulative 5-year diagnoses of CIN2, CIN3 or cervical cancer after concurrent high-risk HPV and cytology testing in a primary screening setting. Int J Cancer, 2005, 116, 1, p. 136–143.
20. Huh, WK., Ault, KA., Chelmow, D., et al. Use of primary high-risk human papillomavirus testing for cervical cancer screening: interim clinical guidance. Gynecol Oncol, 2015, 136, 2, p. 178–182.
21. Chen, TM., Pecoraro, D., Defendi, V. Genetic analysis of in vitro progression of human papillomavirus-transfected human cervical cells. Cancer Res, 1993, 53, 5, p. 1167–1171.
22. Chen, Z., Kamath, P., Zhang, S., et al. Effectiveness of three ribozymes for cleavage of an RNA transcript from human papillomavirus type 18. Cancer Gene Ther, 1995, 2, 4, p. 263–271.
23. Chow, LT., Broker, TR., Steinberg, BM. The natural history of human papillomavirus infections of the mucosal epithelia. APMIS, 2010, 118, 6–7, p. 422–449.
24. Jastreboff, AM., Cymet, T. Role of the human papilloma virus in the development of cervical intraepithelial neoplasia and malignancy. Postgrad Med J, 2002, 78, 918, p. 225–228.
25. Jayasinghe, Y., Garland, SM. Genital warts in children: what do they mean? Arch Dis Child, 2006, 91, 8, p. 696–700.
26. Joseph, DA., Miller, JW., Wu, X., et al. Understanding the burden of human papillomavirus-associated anal cancers in the US. Cancer, 2008, 113, 10, Suppl., p. 2892–2900.
27. Juckett, G., Hartman-Adams, H. Human papillomavirus: clinical manifestations and prevention. Am Fam Physician, 2010, 82, 10, p. 1209–1213.
28. Khan, MA., Tolleson, WH., Gangemi, JD., Pirisi, L. Inhibition of growth, transformation, and expression of human papillomavirus type 16 E7 in human keratinocytes by alpha interferons. J Virol, 1993, 67, 6, p. 3396–3403.
29. Khan, MJ., Castle, PE., Lorincz, AT., et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst, 2005, 97, 14, p. 1072–1079.
30. Kondo, K., Uenoyama, A., Kitagawa, R., et al. Genotype distribution of human papillomaviruses in Japanese women with abnormal cervical cytology. Open Virol J, 2012, 6, p. 277–283.
31. Laco, J. Lidské papilomaviry a jejich úloha v etiopatogenezi dlaždicobuněčného karcinomu dutiny ústní a orofaryngu. 1. ed. Praha: Galén, 2012.
32. Li, N., Franceschi, S., Howell-Jones, R., et al. Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication. Int J Cancer, 2011, 128, 4, p. 927–935.
33. Maglennon, GA., McIntosh, P., Doorbar, J. Persistence of viral DNA in the epithelial basal layer suggests a model for papillomavirus latency following immune regression. Virology, 2011, 414, 2, p. 153–163.
34. Monk, BJ., Burger, RA., Lin, F., et al. Prognostic significance of human papillomavirus DNA in vulvar carcinoma. Obstet Gynecol, 1995, 85, 5 Pt 1, p. 709–715.
35. Moscicki, AB. Conservative management of adolescents with abnormal cytology and histology. J Natl Compr Canc Netw, 2008, 6, 1, p. 101–106.
36. Motoyama, S., Ladines-Llave, CA., Luis Villanueva, S., Maruo, T. The role of human papilloma virus in the molecular biology of cervical carcinogenesis. Kobe J Med Sci, 2004, 50, 1–2, p. 9–19.
37. Myers, ER., McCrory, DC., Nanda, K., et al. Mathematical model for the natural history of human papillomavirus infection and cervical carcinogenesis. Am J Epidemiol, 2000, 151, 12, p. 1158–1171.
38. NIH. Cervical Cancer Screening Programs in 19 ICSN Countries, 2012: Organization, Policies, and Program Reach. In.: National Institutes of Health, Healthcare Delivery Research Program, Division of Cancer Control and Population Sciences, 2012.
39. Oliveira, A., Verdasca, N., Pista, A. Use of the NucliSENS EasyQ HPV assay in the management of cervical intraepithelial neoplasia. J Med Virol, 2013, 85, 7, p. 1235–1241.
40. Parkin, DM., Bray, F. Chapter 2: The burden of HPV-related cancers. Vaccine, 2006, 24, Suppl. 3, p. S3/11–25.
41. Paulo, M., Borges, AB., Duarte, G., et al. The environmental cofactors in carcinogenesis in high risk HPV/HIV-positive women. Braz J Infect Dis, 2007, 11, 2, p. 189–195.
42. Peltecu, G., Bari, M., Lancu, G., Popa, F. Human papilloma virus and cervical preinvasive disease. J Med Life, 2009, 2, 4, p. 373–377.
43. Pham, TH., Nguyen, TH., Herrero, R., et al. Human papillomavirus infection among women in South and North Vietnam. Int J Cancer, 2003, 104, 2, p. 213–220.
44. Ronco, G., Dillner, J., Elfstrom, KM., et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet, 2014, 383, 9916, p. 524–532.
45. Roztočil, A. Moderní gynekologie. 1. ed.: Praha, Grada Publishing, 2011, s. 330–343.
46. Sarid, R., Gao, SJ. Viruses and human cancer: from detection to causality. Cancer Lett, 2011, 305, 2, p. 218–227.
47. Sherman, ME., Lorincz, AT., Scott, DR., et al. Baseline cytology, human papillomavirus testing, and risk for cervical neoplasia: a 10-year cohort analysis. J Natl Cancer Inst, 2003, 95, 1, p. 46–52.
48. Schiffman, M., Wentzensen, N., Wacholder, S., et al. Human papillomavirus testing in the prevention of cervical cancer. J Natl Cancer Inst, 2011, 103, 5, p. 368–383.
49. Smith, JS., Lindsay, L., Hoots, B., et al. Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions: a meta-analysis update. Int J Cancer, 2007, 121, 3, p. 621–632.
50. Soto, U., Das, BC., Lengert, M., et al. Conversion of HPV 18 positive non-tumorigenic HeLa-fibroblast hybrids to invasive growth involves loss of TNF-alpha mediated repression of viral transcription and modification of the AP-1 transcription complex. Oncogene, 1999, 18, 21, p. 3187–3198.
51. Storey, A., Thomas, M., Kalita, A., et al. Role of a p53 polymorphism in the development of human papillomavirus-associated cancer. Nature, 1998, 393, 6682, p. 229–234.
52. Strander, B., Andersson-Ellstrom, A., Milsom, I., Sparen, P. Long term risk of invasive cancer after treatment for cervical intraepithelial neoplasia grade 3: population based cohort study. BMJ, 2007, 335, 7629, p. 1077.
53. Syrjanen, K., Syrjanen, S. Epidemiology of human papilloma virus infections and genital neoplasia. Scand J Infect Dis Suppl, 1990, 69, p. 7–17.
54. Tchernev, G. Sexually transmitted papillomavirus infections: epidemiology pathogenesis, clinic, morphology, important differential diagnostic aspects, current diagnostic and treatment options. An Bras Dermatol, 2009, 84, 4, p. 377–389.
55. Tjalma, WA., Fiander, A., Reich, O., et al. Differences in human papillomavirus type distribution in high-grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe. Int J Cancer, 2013, 132, 4, p. 854–867.
56. Turyna, R., Sláma, J. Kolposkopie děložního hrdla. 1. ed. Galén, 2010.
57. Vaccarella, S., Soderlund-Strand, A., Franceschi, S., et al. Patterns of human papillomavirus types in multiple infections: an analysis in women and men of the high throughput human papillomavirus monitoring study. PLoS One, 2013, 8, 8, p. e71617.
58. van de Nieuwenhof, HP., van Kempen, LC., de Hullu, JA., et al. The etiologic role of HPV in vulvar squamous cell carcinoma fine tuned. Cancer Epidemiol Biomarkers Prev, 2009, 18, 7, p. 2061–2067.
59. Vernon, SD., Hart, CE., Reeves, WC., Icenogle, JC. The HIV-1tat protein enhances E2-dependent human papillomavirus 16 transcription. Virus Res, 1993, 27, 2, p. 133–145.
60. Vink, MA., Bogaards, AJ., Meijer, CJ., Berkhof, J. Primary human papillomavirus DNA screening for cervical cancer prevention: Can the screening interval be safely extended? Int J Cancer, 2015, 137, 2, p. 420–427.
61. Walboomers, JM., Jacobs, MV., Manos, MM., et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol, 1999, 189, 1, p. 12–19.
62. Winer, RL., Lee, SK., Hughes, JP., et al. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol, 2003, 157, 3, p. 218–226.
63. Woodworth, CD., Notario, V., DiPaolo, JA. Transforming growth factors beta 1 and 2 transcriptionally regulate human papillomavirus (HPV) type 16 early gene expression in HPV--immortalized human genital epithelial cells. J Virol, 1990, 64, 10, p. 4767–4775.
64. Yang, HJ. Aberrant DNA methylation in cervical carcinogenesis. Chin J Cancer, 2013, 32, 1, p. 42–48.
65. Yim, EK., Park, JS. The role of HPV E6 and E7 oncoproteins in HPV-associated cervical carcinogenesis. Cancer Res Treat, 2005, 37, 6, p. 319–324.
66. zur Hausen, H. Papillomaviruses and cancer: from basic studies to clinical application. Nat Rev Cancer, 2002, 2, 5, p. 342–350.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2016 Issue 5-
All articles in this issue
- Ultrazvuková studie porovnání kvality fixace pásky a léčebného efektu pásky zaváděné z jedné incize (Ajust) a transobturatorní pásky TVT-O
- Histopatologické změny tkáně placent v souvislosti s vybranými klinickými případy v porodnictví
- Sexuální morbidita pacientek po léčbě karcinomu děložního hrdla
- Poporodní blues – česká adaptace dotazníku „Maternity Blues Questionnaire“
- Aktuální poznatky o HPV infekci
- Periferní předčasná puberta (pseudopubertas praecox)
- Nekultivační stanovení mikroorganismů v plodové vodě u pacientek s předčasným odtokem plodové vody
- Akutní infarkt myokardu komplikující graviditu u pacientky po transplantaci ledviny a osteosarkomu kolene
- Akutní inverze dělohy po porodu
- Efekt erytropoetinu při reperfuzním poškození u zánětu dělohy u krys
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Periferní předčasná puberta (pseudopubertas praecox)
- Aktuální poznatky o HPV infekci
- Sexuální morbidita pacientek po léčbě karcinomu děložního hrdla
- Akutní inverze dělohy po porodu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

