-
Medical journals
- Career
Nonavalentní HPV vakcína – nová generace očkování proti HPV
Authors: Tomáš Fait 1,2; V. Dvořák 1,4; R. Pilka 1,3
Authors‘ workplace: HPV College o. s., prezident MUDr. J. Ondruš, CSc., MIAC 1; Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 2; Porodnicko-gynekologická klinika FN a LP UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 3; Centrum ambulantní gynekologie a primární péče, Brno 4
Published in: Ceska Gynekol 2015; 80(6): 397-400
Overview
Cíl:
Zhodnotit současné znalosti o nové generaci očkování proti HPV – nonavaletní vakcíně Gardasil9.Typ studie:
Literární přehled.Výsledky:
Nonavalentní vakcína proti HPV 6/11/16/18/31/33/45/52/58 může zvýšit potenciál prevence dosažený kvadrivalentní vakcínou ze 70 % na 90 % pro karcinom děložního hrdla, navíc pokrývá 85–95 % karcinomů závislých na HPV z oblasti vulvy, vaginy a řiti. Účinek a imunogenicita proti HPV611/16/18 jsou stejné jako u kvadrivalentní vakcíny. Účinnost proti lézím spojeným s HPV 31/33/45/52/58 je 97 %.Klíčová slova:
HPV infekce, prevence, nonavalentní vakcína, karcinom děložního hrdlaÚVOD
V roce 2002 byly zahájeny pokusy s monovalentní vakcínou obsahující viriony z rekombinantně vyrobených kapsidových proteinů lidských papilomavirů (HPV) typu 16. V roce 2006 a 2007 byly na trh uvedeny kvadrivalentní vakcína (Silgard, HPV 6/11/16/18) respektive bivalentní vakcína (Cervarix, HPV 16/18). Obě jsou vysoce účinné v prevenci přednádorových genitálních lézí spojených s infekcí HPV 16 a 18, kvadrivalentní vakcína je navíc prevencí análních lézí a lézí spojených s HPV 6 a 11, tedy zejména genitálních bradavic. Díky průkazu účinnosti kvadrivalentní vakcíny na léze anální a kondylomata došlo k genderovému posunu od očkování žen k očkování obou pohlaví. Nejvyšší účinnosti dosahuje očkování u jedinců před zahájením sexuální aktivity, proto většina národních očkovacích programů pokrývá jedince ve věku 9–13 let. Recentní studie ukazují možnost přechodu z třídávkového na dvoudávkové schéma při prokazatelně stejné imunitní odpovědi.
Jistou ochranu proti dalším typům HPV přinášejí zmíněné vakcíny díky zkřížené protekci. Bohužel tato složka ochrany relativně rychle klesá [3] a není prokázána pro dvoudávkové očkovací schéma.
Proto byla vyvinuta nonavalentní vakcína (HPV 6/11/16/18/31/33/45/52/58) s vysokou ochranou proti infekci těmito typy HPV a chorobám s nimi spojenými. Eufemisticky je označována jako nová či druhá generace HPV vakcín. Dokáže chránit před 90 % všech nádorů spojených s HPV infekcí. Při rozšíření této vakcíny lze očekávat významné ovlivnění screeningového algoritmu karcinomu hrdla děložního [4].
PROČ MÁ VÝZNAM OČKOVAT PROTI VÍCE TYPŮM HPV?
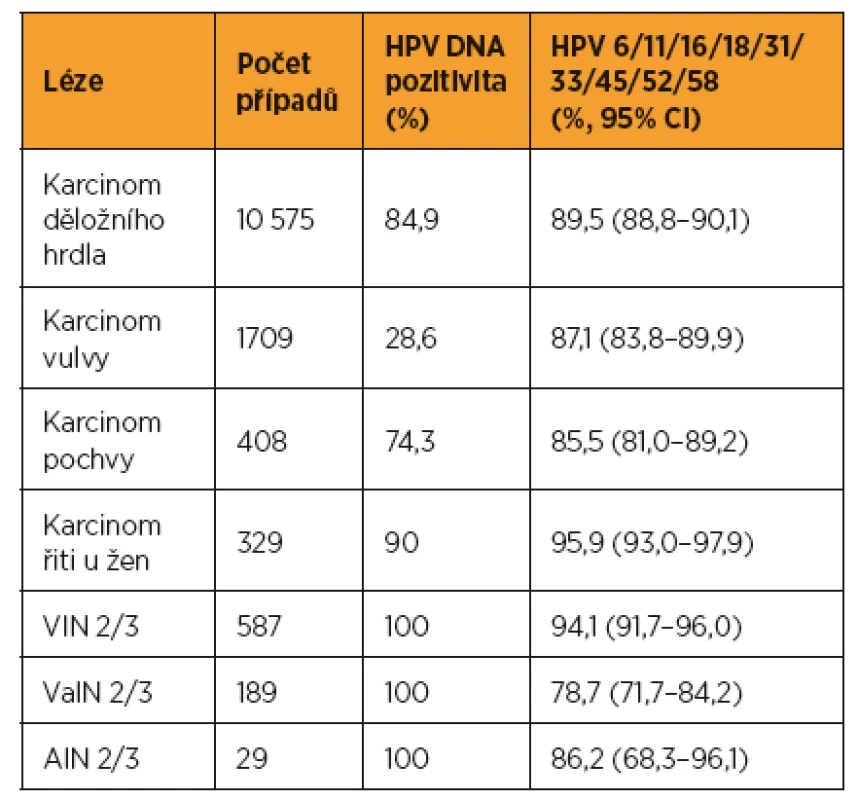
Mezinárodní studie organizovaná Catalan Institute of Oncology provedla rozbor výskytu typů HPV v nádorových lézích konsekvenčně posbíraných ze 48 zemí světa (tab. 1). Nejčastěji se ve všech lézích objevoval HPV 16, zastoupení HPV 31/33/45/52/58 kolísalo od 7,8 % (5,0–11,4) u karcinomu řiti u žen po 20,5 % (16,1–25,4) u karcinomu vaginy [8].
V metaanalýze případů 115 789 HPV pozitivních žen bylo devět zmíněných HPV typů nalezeno v 89,4 % invazivních nádorů děložního hrdla včetně 18,5 % pozitivních jen pro HPV 31/33/45/52/58, u dlaždicobuněčných karcinomů to bylo 89,1 %, u adenokarcinomů 95,5 %. HPV 16/18/45 byl zjištěn u 94,2 % adenokarcinomů. Zatímco výskyt HPV 16/18/45 s věkem klesal, výskyt HPV 31/33/52/58 se zvyšoval (p < 0,0001) [7].
Význam snahy účinně preventovat léze spojené s HPV 31/45/33/52/58 potvrzuje i česká studie. V souboru 157 dlaždicobuněčných karcinomů děložního hrdla, 695 přednádorových lézí a 64 kondylomat bylo zjištěno, že HPV 16/18 obsahuje 61 % nádorových lézí a 43 % přednádorových stadií. V 72 % benigních lézí byl zjištěn HPV 6. HPV 31/33/45/52/58 byly zjištěny v 16 % nádorů a 18 % přednádorových lézí [10].
Na základě epidemiologických dat České republiky bylo vypočítáno, že při 90% prevenci karcinomu hrdla děložního nonavalentní vakcínou by její použití v kohortě se současnou proočkovaností 65 % snížilo za 100 let výskyt karcinomu děložního hrdla o 74 %, zatímco při užití kvadrivalentní vakcíny jen o 62 %. Nonavalentní vakcina by tak zabránila dalším 33 000 případů CIN 1, 53 000 případů CIN 2/3 a 6000 karcinomům cervixu za 100 let ve srovnání s kvadrivalentní vakcínou [6].
ÚČINNOST A IMUNOGENICITA NONAVALENTNÍ VAKCÍNY
V nonavalentní vakcíně bylo navýšeno množství antigenu stávajících HPV 6/11/16/18 a přidáno dalších pět HPV 31/33/45/52/58. Navýšeno bylo i množství adjuvans (tab. 2).
Table 2. Složení nonavalentní vakcíny Gardasil9 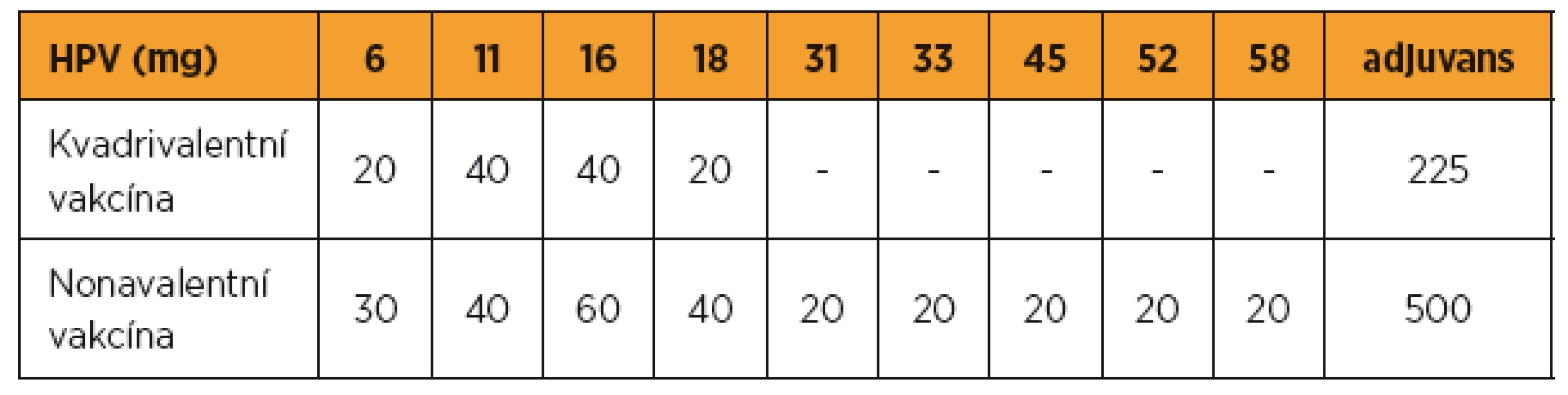
Do randomizované dvojitě slepé studie (označené 001) bylo zařazeno 14 204 žen ve věku 16–26 let, kterým byla podána kvadrivalentní nebo nonavalentní vakcína ve třech dávkách s aplikací po dvou a šesti měsících od zahájení očkování. HPV testace a liquid based cytologie byly prováděny z labií, vulvy, perinea, perianální oblasti, exocervixu i endocervixu.
Hodnoceny byly výsledky po průměrně 40 měsících (maximum 54 měsíců) od zahájení studie (tab. 3, graf 1, 2).
Table 3. Analýza účinnosti nonavalentní vakcíny proti HPV 31/33/45/52/58 v per protokol populaci 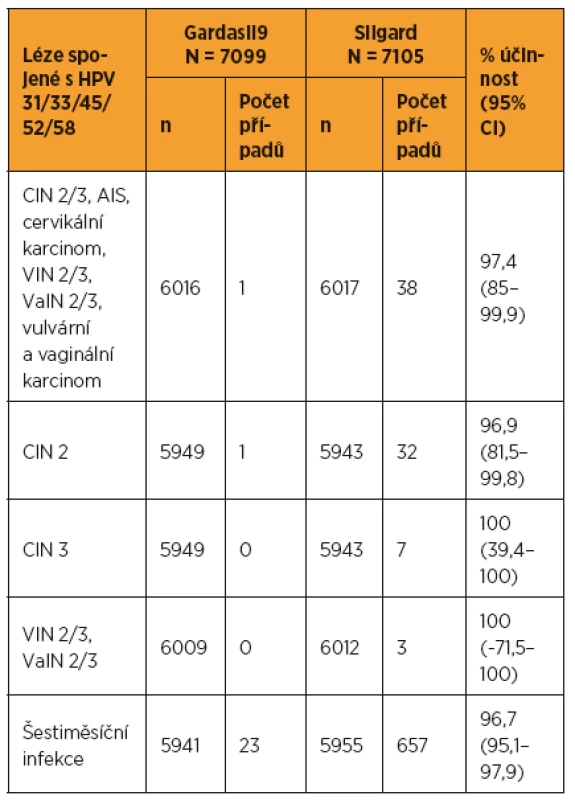
AIS – adenokarcinom in situ, CIN – cervikální intraepiteliální neoplazie, VIN – vulvární intraepiteliální neoplazie, VaIN – vaginální intraepiteliální neoplazie Graph 1. Účinnost nonavalentní vakcíny proti abnormálním bioptickým nálezům spojeným s HPV 31/33/45/52/58 a jejich operačnímu řešení – srovnání s kvadrivalentní vakcínou 
Graph 2. Účinnost nonavalentní vakcíny proti abnormálním cytologickým nálezům – srovnání s kvadrivalentní vakcínou 
High grade léze děložního hrdla, vulvy i vaginy bez ohledu na typ HPV a případnou infekci na počátku studie (intention-to-treat population) se vyskytly v obou ramenech studie s incidencí 14/1000 osoboroků.
Stejné léze spojené s HPV 31/33/45/52/58 v per protokol populaci vykázaly sníženou incidenci o 96,7 % (95% CI = 80,9–99,8) při výskytu 1,6 respektive 0,1 případu na 1000 osoboroků (30 versus 1 případ).
Účinnost proti cervikální intraepiteliální neoplazii (CIN) 2/3 byla 96,3 % (95% CI = 79,5–99,8), tj. 27 versus 1 případ, proti vulvární intraepiteliální neoplazii (VIN) a vaginální intraepiteliální neoplazii (VaIN) 2/3 100 % (3 versus 0 případů).
Nález CIN 1 vyvolané HPV 31/33/45/52/58 byl snížen o 98,6 % (95% CI = 92,4–99,9) při srovnání 1 a 69 případů.
Účinnost proti šestiměsíční perzistující infekci HPV 31/33/45/52/58 byla 96,2 % (95% CI = 94,4–97,5).
Proti vulvárním a vaginálním onemocněním způsobeným těmito pěti typy HPV dosáhl účinek 93,8 % (95% CI = 61,5–99,7), to je 1 proti 16 případům.
Nonavalentní vakcína snížila v HPV naivní populaci (sero i DNA negativní pro všech devět typů HPV obsažených ve vakcíně) riziko jakékoli cervikální léze o 47 % (95% CI = 30,6–59,7), CIN 2 o 62,8 % (95% CI = 34,8–78,8) a riziko kondylomat o 94,6 % (95% CI = 66–94,3).
Protilátková odpověď obou vakcín pro HPV 6/11/16/18 byla obdobná. Nonavalentní vakcína vykazovala vyšší počet lokálních reakcí, ostatní nežádoucí události měly stejnou frekvenci [2].
V souboru 600 dívek ve věku 9–15 let byla prokázána v 7. měsíci od zahájení očkování obdobná imunitní odpověď pro kvadrivalentní i nonavalentí vakcínu pro HPV 6/11/16/18. S výjimkou jednoho případu HPV 45 došlo k sérokonverzi u všech dívek očkovaných proti HPV 31/33/45/52/58. Také bezpečnost byla obdobná, pouze u nonavaletní vakcíny je hlášeno více lokálních reakcí po vpichu [11].
Ve studii 1103 heterosexuálních a 313 homosexuálních mužů a 1099 žen byla srovnávána imunogenicita třídávkového schématu nonavalentní vakcíny. Hladiny protilátek byly sledovány po 12 měsíců. Nebyl zjištěn rozdíl v hladině protilátek u mužů a žen, v 7. měsíci byla hladina protilátek u homosexuálních mužů nižší než u heterosexuálních. Více než 99,5 % jedinců bylo v 7. měsíci séropozitivních [11].
Vakcínu lze podávat společně s vakcínou proti meningokokům i tetravakcínou proti difterii, tetanu, pertusi a poliomyelitidě, jak bylo prokázáno v souboru 1241 adolescentů ve věku 11 až 15 let, aniž by byla vzájemně ovlivněna imunitní odpověď [1].
V šesti retrospektivních multicentrických studiích EDiTH I-VI bylo analyzováno 516 případů karcinomů děložního hrdla, 493 CIN 2/3, 397 LG SIL, 423 genitálních bradavic, 366 karcinomů řiti a 314 oropharyngeálních karcinomů. Přínos nonavalentní proti kvadrivalentní vakcíně se pohyboval od 0 do 33 % (tab. 4) [9].
Table 4. Zastoupení HPV v lézích a z toho vyplývající srovnání přínosu očkování nonavalentní vakcínou ve srovnání s kvadrivalentní 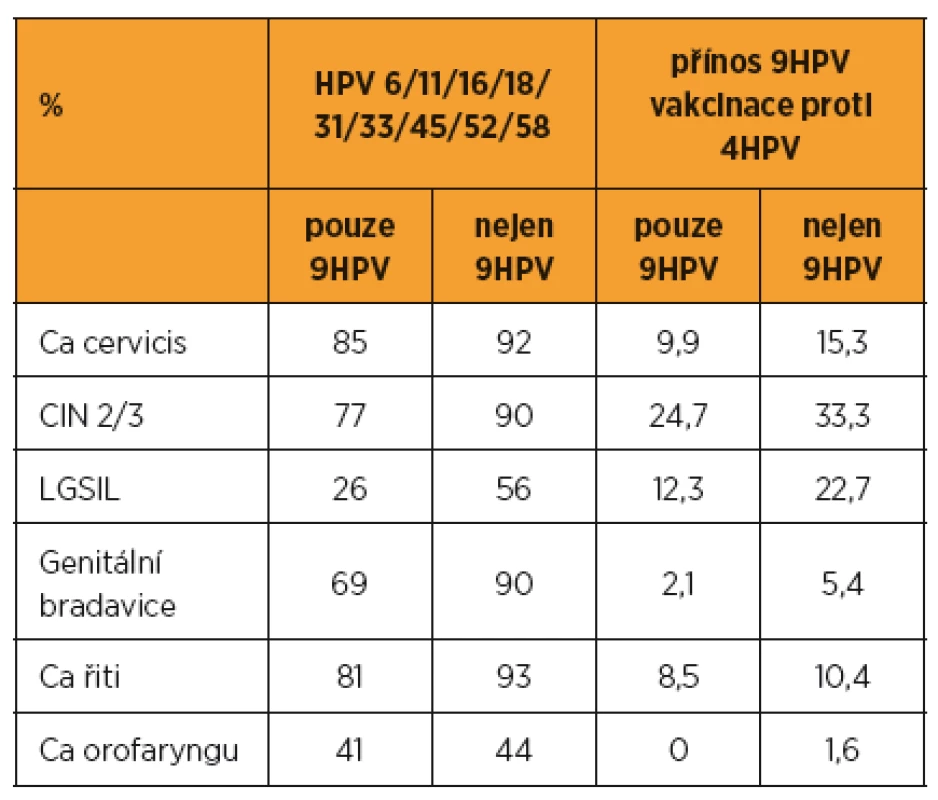
ZÁVĚR
Nonavalentní vakcína může zvýšit potenciál prevence dosažený kvadrivalentní vakcínou ze 70 % na 90 % pro karcinom děložního hrdla, navíc pokrývá 85–95 % karcinomů závislých na HPV z oblasti vulvy, vaginy a řiti. Účinnost proti lézím spojeným s HPV 31/33/45/52/58 je 97%.
Imunogenicita vakcíny klesá s věkem, nemá rozdíly v rasách, mírně vyšší imunogencita je u mužů ve srovnání se ženami bez klinického rozdílu, nižší imunogenicita je u homosexuálních mužů ve srovnání s muži heterosexuálními.
Je vysoce bezpečná.
Díky významnému rozšíření pokrytí HPV virů je v literatuře označována jako HPV vakcinace druhé generace.
Doc. MUDr. Tomáš Fait, Ph.D.
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 53 Praha 2
e-mail: tfait@seznam.cz
Sources
1. Castellsague, X., Guiliano, A., Goldstone, S., et al. Tolerability and immunogenicity of a multivalent HPV L1 virus-lik partije vaccine in 16 - to 26-year old men. Eurogin, 2015, abstract, p. 174.
2. Joura, AE., Guiliano, AR., Iversen, O., et al. A 9-valent HPV vaccne infekcion and intraepitelial neoplasia in woman. N Engl J Med, 2015, 372(8), p. 711–723.
3. Malagón, T., Drolet, M., Boily, MC., et al. Cross-protective efficacy of two human papillomavirus vaccines: a systematic review and meta-analysis. Lancet Infect Dis, 2012, 12, p. 781–789.
4. Pills, S., Joura, E. From the monovalent to the nine-valent HPV vaccine. Clin Microbiol Infect, 2015, 21(9), p. 827–333.
5. Pillsbury, M., Kyle, J., Weiss, T., Brandtmuller, A. Projecting the potential public health impact of 9-valent HPV vaccine in the Czech Republic. Eurogin, 2015, abstract, p. 239.
6. Riethmuller, D., Jacquard, AC., Lacau, SG., et al. Potential impact of a nonavalent HPV vaccine on the occurence of HPV-related diseases in France. BMC Public Health, 2015, 15(1), p. 453.
7. Serrano, B., Alemany, L., Tous, S., et al. Potential impact of a nine-valent vaccine in human papillomavirus related cervical disease. Infect Agent Cancer, 2012, 7(1), p. 38.
8. Serrano, B., deSanjosé, S., Tous, S., et al. HPV genotype attribution for HPVs 6, 11, 16, 18, 31, 33, 45, 52 a 58 in female anogenital lesions. Eur J Cancer, 2015, 51(13), p. 1732–1741.
9. Schilling, A., Parra, MM., Gutierrez, M., et al. Coadmnistration of a 9-valent HPV vaccine with meningococcal and Tdap vaccine. Pediatrics, 2015, 136(3), p. 563–572.
10. Tachezy, R., Smahelova, J., Salakova, M., et al. HPV genotype distribution in Czech women an men with diseases etiologically linked to HPV. Plos one, 2011, 6(7), p. e21913.
11. Vesikari, T., Brodszki, N., van Damme, P., et al. A randomized, double-blind, phase III study of the immunogenicity and safety of a 9-valent HPV L1 virus like particle vaccine (V503) versus Gardasil in 9-15-year-old-girls. Pediatr Infect Dis J, 2015, 34(9), p. 992–998.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2015 Issue 6-
All articles in this issue
- Nonavalentní HPV vakcína – nová generace očkování proti HPV
- Spontánní antepartální RhD aloimunizace
- Prognostický význam Pgp, MRP1 a MRP3 u pacientek s karcinomem ovaria
- Cytologicko-energetický princip vyšetřování plodové vody po předčasném předtermínovém odtoku – dosavadní zkušenosti a perspektivy
- Trombofília v tehotenstve
- Spokojenost žen s perinatální péčí v Kraji Vysočina za období říjen 2013 až září 2014
- Pilotní studie pro využití samoodběrové soupravy a molekulární diagnostiky HPV infekce pro skrínink karcinomu děložního čípku
- Hypertyreóza v graviditě, méně častá porucha štítné žlázy komplikující těhotenství – kazuistika
- Těžký ovariální hyperstimulační syndrom – kazuistika
- Farmakologické ukončení gravidity mifepristonem a misoprostolem – zhodnocení úspěšnosti, komplikací a spokojenosti pacientek
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Farmakologické ukončení gravidity mifepristonem a misoprostolem – zhodnocení úspěšnosti, komplikací a spokojenosti pacientek
- Těžký ovariální hyperstimulační syndrom – kazuistika
- Trombofília v tehotenstve
- Hypertyreóza v graviditě, méně častá porucha štítné žlázy komplikující těhotenství – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career