-
Medical journals
- Career
Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
Authors: F. Frühauf 1; M. Dvořák 2; L. Haaková 3; L. Hašlík 3; P. Herboltová 4; B. Chaloupková 5; J. Kožnarová 6; B. Kubešová 7; I. Lukáčová 8; R. Marek 9; H. Neumannová 2; R. Peschout 4; V. Přibyl 8; I. Sedláková 10; Martin Smažinka 11; P. Svobodová 7; M. Vančo 12; P. Vlasák 11; Vít Weinberger 13; Michal Zikán 1; D. Fischerová 1
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 1; Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha, přednosta prof. MUDr. M. Halaška, DrSc. 2; Ústav pro péči o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 3; Onkogynekologické centrum, Gynekologicko-porodnické oddělení Nemocnice, Jihlava primář prof. MUDr. A. Roztočil, CSc. 4; Onkogynekologické centrum, Porodnicko-gynekologické oddělení, Krajská nemocnice T. Bati, a. s., Zlín, primář MUDr. Z. Adamík, Ph. D. 5; Onkogynekologické centrum, Gynekologicko-porodnické odd. Nemocnice, České Budějovice primář MUDr. P. Sák, Ph. D. 6; Gynekologicko-porodnická klinika 3. LF UK a FNKV, Praha, přednosta doc. MUDr. E. Kučera, CSc. 7; Onkogynekologické centrum, Porodnicko-gynekologická klinika FN, Ostrava přednosta doc. MUDr. V. Unzeitig, CSc. 8; Onkogynekologické centrum, Porodnicko-gynekologická klinika LF UP a FN, Olomouc přednosta prof. MUDr. R. Pilka, Ph. D. 9; Porodnická a gynekologická klinika LF HK a FN, Hradec Králové přednosta doc. MUDr. J. Špaček, PhD., IFEPAG. 10; Onkogynekologické centrum, Gynekologicko-porodnická klinika LF UK a FN, Plzeň přednosta doc. MUDr. Z. Novotný, CSc. 11; Onkogynekologické centrum, Gynekologicko-porodnické odd., Masarykova nemocnice, Ústí nad Labem, přednosta doc. MUDr. T. Binder, CSc. 12; Onkogynekologické centrum, Gynekologicko-porodnická klinika LF MU a FN, Brno přednosta prof. MUDr. P. Ventruba, DrSc., MBA 13
Published in: Ceska Gynekol 2014; 79(6): 466-476
Overview
V případě histologicky ověřené přítomnosti endomet-riálního karcinomu závisí další léčebný postup (rozsah stagingové operace) na tom, zda se jedná o nádor vysoce, nebo nízce rizikový z hlediska extrauterinního šíření a frekvence recidiv. Kromě histologického typu nádoru a jeho gradingu je významným prognostickým faktorem rozsah lokálního postižení dělohy. Hloubku myometriální invaze a přítomnost infiltrace cervikálního stromatu, tedy lokální staging, lze stanovit sonograficky s diagnostickou přesností srovnatelnou s magnetickou rezonancí (MR). Transvaginální sonografie umožní detailní zobrazení pánevní anatomie, a proto je vhodným nástrojem pro hodnocení lokálního rozsahu endometriálního karcinomu. Při ultrazvukovém vyšetření je doporučeno dodržovat standardizovanou terminologii popisu endometriálních nálezů tak, jak byla definovaná mezinárodní pracovní skupinou IETA (International Endometrial Tumor Analysis group). V rámci ultrazvukového předoperačního stagingu zhoubného nádoru endometria má význam standardizovat rovněž metodiku vyšetření podle preformovaných protokolů.
Klíčová slova:
ultrazvuk, karcinom endometria, stagingÚVOD
Endometriální karcinom se vyznačuje maximem výskytu v postmenopauze, přičemž se v 90 % případů manifestuje krvácením nebo špiněním. Prvním diagnostickým krokem při zakrvácení v postmenopauze je transvaginální sonografie, kdy v případě nálezu vyššího endometria (původně > 4 mm, ale podle rozsáhlé metaanalýzy z roku 2010 byla doporučena nižší hranice výšky endometria, >3 mm [25]), je vždy indikována biopsie. Pokud je histologicky potvrzen zhoubný nádor endometria, je následný staging (stanovení rozsahu onemocnění) primárně chirurgický. Úkolem předoperačních vyšetření je individuálně stanovit radikalitu plánovaného stagingového výkonu. Specifickým cílem je s co největší přesností zachytit skupinu pacientek s nádory s vysokým rizikem extrauterinního šíření, pooperačních recidiv, a tedy s horší prognózou („high risk“ karcinomy). Ačkoliv názory na to, kdy indikovat lymfadenektomii a v jakém rozsahu (pánevní vs. pánevní a paraaortální), nejsou jednotné, je všeobecně akceptováno, že tyto pacientky mohou profitovat ze systematické lymfadenektomie, popřípadě radikální hysterektomie při infiltraci cervikálního stromatu. „High risk“ nádory jsou reprezentovány non-endometroidními karcinomy (s výjimkou mucinózního karcinomu) nebo špatně diferencovanými endometroidními adenokarcinomy nebo nádory s hlubokou invazí do myometria či s infiltrací cervikálního stromatu. Naopak v převládající skupině žen s „low risk“ karcinomy endometria (dobře nebo středně diferencovanými endometroidními nebo mucinózními adenokarcinomy ve stadiu IA) by extenzivní chirurgické výkony vedly ke zbytečnému nárůstu pooperační morbidity bez adekvátního zlepšení jejich prognózy [16].
Rozdělení endometriálních karcinomů do rizikových skupin jen na základě předoperační biopsie (histologického typu a stupně dediferenciace) se ukazuje jako nedostatečné, protože 42–47 % nádorů by bylo takto nesprávně označeno za „low risk“ s potřebou doplnění restagingové operace. Využijeme-li dvoustupňový diagnostický model se zapojením zobrazovací metody v druhém kroku, například transvaginální sonografie nebo magnetické rezonance, k posouzení myometriální invaze a infiltrace cervikálního stromatu, klesne významně podíl nepoznaných „high risk“ endometriálních karcinomů (pod 17 % u externě validovaného ultrazvukového modelu) [17, 26].
V současné době neexistuje jednotné doporučení pro výběr předoperační zobrazovací metody pro stanovení hloubky nádorové invaze do myometria a cervikální stromální invaze. Podle amerických doporučení NCCN (National Comprehensive Cancer Network for Uterine Neoplasms, verze 2014) je vhodné doplnit magnetickou rezonanci (MR) při podezření na postižení děložního hrdla a počítačovou tomografii (CT), pozitronovou emisní tomografii v kombinaci s CT (PET/CT) nebo MR při podezření na extrauterinní šíření (http://www.nccn.org).
Řada prospektivních prací však dokazuje, že se diagnostická přesnost expertního ultrazvuku v lokálním stagingu endometriálního karcinomu vyrovná MR [3, 11, 19]. Proto podle evropských doporučení (ESMO, European Society for Medical Oncology) je podporována role transvaginální sonografie v rámci předoperačního stagingového vyšetření u zhoubného nádoru endometria, a pouze při podezření na extrapelvické šíření je doporučeno CT nebo PET/CT [6].
Transvaginální ultrazvuk jako neinvazivní, široce rozšířená a ekonomicky dostupná zobrazovací metoda s minimálním zatížením pro pacientku hraje ve spojení s biopsií endometria (odběr pipellou, hysteroskopií nebo frakcionovanou kyretáží) zásadní roli v diagnostice endometriálního karcinomu. Onkogynekologický expertní ultrazvuk se navíc nabízí jako metoda první volby pro předoperační staging zhoubného nádoru endometria, jelikož kombinuje trans-vaginální nebo transrektální vyšetření pánve s transabdominálním vyšetřením břišní dutiny v rámci jednoho vyšetření.
METODIKA ULTRAZVUKOVÉHO VYŠETŘENÍ
Transvaginální ultrazvukové vyšetření se provádí v litotomické poloze s vyprázdněným močovým měchýřem. Transvaginální nebo trans-rektální přístup představuje optimální možnost zobrazení celé dělohy – děložního hrdla, děložní dutiny, endometria, junkční zóny, myometria, perimetria, ale také adnex a pánevního peritonea. Umožňuje zároveň zobrazit močový měchýř a rektosigmoideum, v pánvi uložené střevní kličky ilea, viscerální (parauterinní nebo mezenteriální) a parietální lymfatické uzliny v oblasti vnitřních ilických cév a obturatorní fossy. Transrektální přístup nevyžaduje speciál-ní přípravu pacientky a umožňuje srovnatelné rozlišení pánevních struktur, takže má své uplatnění u žen trpících vaginismem, s vrozenými vývojovými vadami pochvy nebo se stenotickou pochvou a rovněž při podezření na závažné postižení děložního hrdla s rizikem kontaktního krvácení (obr. 1) [5].
Image 1. Postup ultrazvukového vyšetření při předoperačním screeningu endometriálního karcinomu 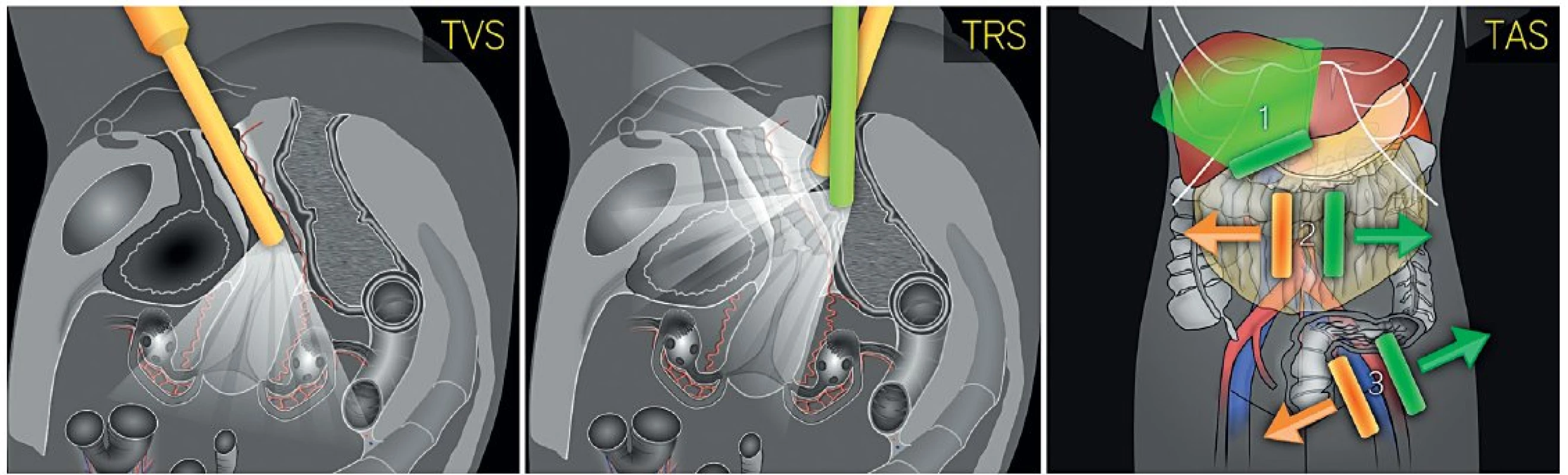
TVS – transvaginální sonografie, TRS – transrektální sonografie, TAS – transabdominální sonografie, 1 – vyšetření parenchymatózních orgánů, 2 – hodnocení peritoneálních povrchů a omenta, 3 – detekce tříselné a retroperitoneální lymfadenopatie, pozice sondy je vyznačena oranžovými a zelenými čarami, její pohyb šipkami. Zobrazení dělohy může být obtížné zvláště při napřímené děloze, při deformaci adenomyózou, myomy nebo adhezemi. V těchto situacích lze využít tlaku druhé ruky přes břišní stěnu nebo naplnění močového měchýře. Při nejasném ultrazvukovém obrazu děložní dutiny se doporučuje postupovat od endocervikálního kanálu a změnou polohy sondy docílit insonančního úhlu k endometriu blížícímu se optimálním 90 stupňům. Protože je ultrazvuk dynamické vyšetření, lze v jeho průběhu pozorovat vzájemný klouzavý pohyb jednotlivých struktur vůči sobě, nebo naopak jejich souhyb, jsou-li k sobě pevně fixovány. Je rovněž možné pozorovat pohyb hlenu, detritu či krve a koagul v děložní dutině a to využít v diferenciální diagnostice.
Transabdominální ultrazvukové vyšetření se provádí v poloze na zádech s nataženými dolními končetinami. Je vhodné zobrazovat jednotlivé anatomické struktury břišní dutiny v sagitální i transverzální rovině a přitom postupovat systematicky od pravého a levého hypochondria k hranici malé pánve a do třísel. Nejprve jsou vyšetřeny parenchymatózní orgány, kdy se zaměřujeme na vyhledávání intraparenchymatózních fokálních nebo difuzních lézí, popis infiltrace pouzdra těchto orgánů či viscerální lymfadenopatii v hilu sleziny a jater. Hodnotíme rovněž stav kalichopánvičkového systému ledvin. Dále jsou vizualizovány parietální, viscerální a mezenteriální peritoneální povrchy (šíření nádorového procesu ve formě karcinomatózy) a omentum. Na závěr jsou vyšetřeny lymfatické uzliny retroperitoneální, viscerální a tříselné – povrchové a hluboké (obr. 1). Pro zlepšení zobrazení lze pacientku polohovat, využít hlubokého inspiria či hmatu druhé ruky. Význam má i sledování bolestivosti při tlaku sondou nebo při palpaci [10].
Přidanou hodnotou ultrazvuku je zobrazení cévního zásobení energetickým dopplerovským vyšetřením (power Doppler). Po správném nastavení k docílení optimální senzitivity k cévám (frekvence nejméně 5 MHz, pulzní repetitivní frekvence 0,3–0,9 kHz a stěnový filtr 30–50 Hz) se vlastní semikvantitivní stanovení míry a typu vaskularizace provádí právě tehdy, když je gain natolik snížen, že vymizí veškeré artefakty [5].
ULTRAZVUKOVÝ PROTOKOL VYŠETŘENÍ U BIOPTICKY VERIFIKOVANÉHO ENDOMETRIÁLNÍHO KARCINOMU (tab. 1)
Table 1. Návrh protokolu standardního stagingového vyšetření pacientky s verifikovaným karcinomem endometria. Popis metodiky zobrazení jednotlivých kategorií je uveden v textu článku. 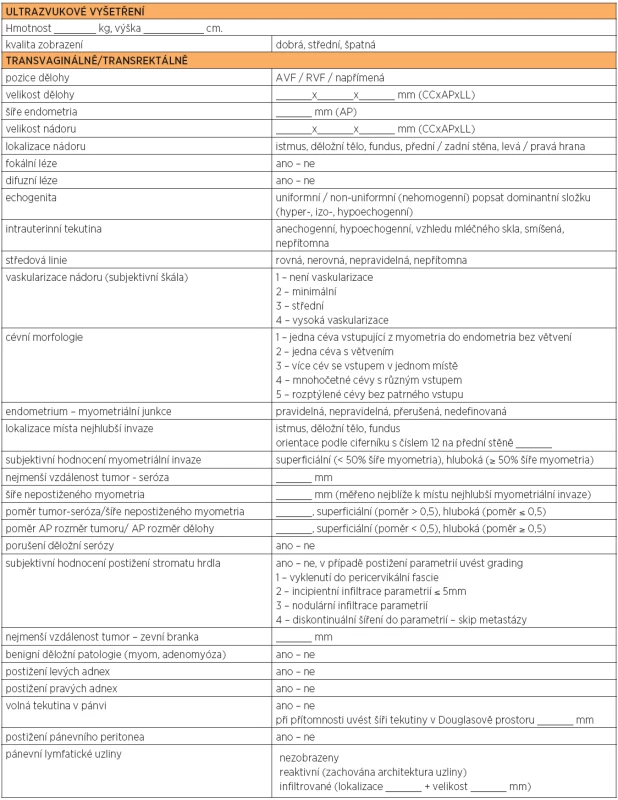
Transvaginální/transrektální ultrazvukové vyšetření zahajujeme identifikací močového měchýře a děložního hrdla k získání správné orientace v malé pánvi. U cervixu hodnotíme symetrii endocervikálního kanálu, homogenitu cervikálního stromatu a stav parametrií. Pohybem sondy z pravé do levé poševní klenby je možno v sagitální rovině podrobně vyšetřit celé děložní hrdlo. V případě masivního postižení hrdla a zároveň děložního istmu je často obtížné vyloučit, že se nejedná o primární cervikální karcinom.
Systematické zobrazení dělohy provádíme v sagitální rovině (hrdlo – istmus – tělo – fundus) od jednoho k druhému rohu děložnímu a v trans-verzálním řezu od hrdla k fundu. Po určení pozice dělohy v pánvi (AVF/RVF/napřímená) změříme její tři rozměry – kraniokaudální (CC), anteroposteriorní (AP) a laterolaterální (LL). Je doporučeno uvádět tyto hodnoty jako u všech popisovaných struktur zaokrouhleně na jedno desetinné místo. Následně zaostříme obraz na děložní tělo s optimálním zvětšením, aby zaujímalo přibližně dvě třetiny plochy obrazovky. Změříme šíři endometria a po identifikaci endometriálního karcinomu a jeho ohraničení změříme také velikost nádoru ve třech na sebe kolmých směrech (CC × AP × LL) (obr. 2). Zobrazením v sagitální a transverzální rovině zpřesníme lokalizaci léze, pokud nepostihuje kompletně celou dělohu (istmus, děložní tělo, fundus, přední nebo zadní stěna, levá nebo pravá hrana).
Image 2. Zobrazení dělohy transvaginálním ultrazvukem v sagitální a transverzální rovině 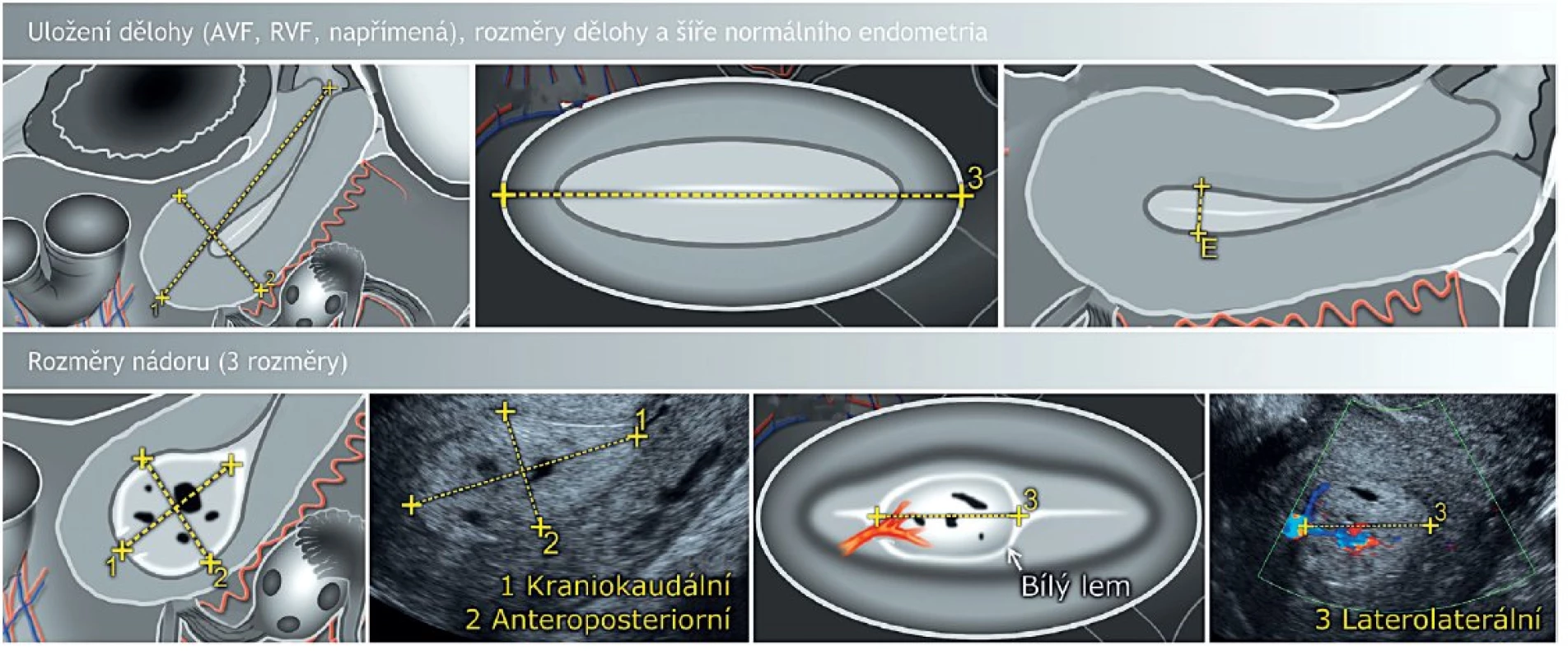
Pozn.: bílý lem je znak přítomnosti fokální endometriální léze (polypu), který vzniká na podkladě sumace signálu v místě kontaktu nádoru a okolního endometria. Při identifikace endometriálního nádoru si musíme uvědomit, že může mít buď podobu difuzní léze šířící se především infiltrativně do děložní stěny, nebo fokální (polypózní) léze rostoucí exofyticky do děložní dutiny. K detekci a vizualizaci kontur nádoru můžeme využít sonomorfologické charakteristiky (změny echogenity) nebo dopplerovské zobrazení (změny perfuze). Echogenitu nádoru posuzujeme ve srovnání s myometriem jako hyper-, izo - nebo hypoechogenní. Léze podle vnitřní struktury popisujeme jako uniformní (homogenní) nebo jako non-uniformní (nehomogenní), tvořené několika sonograficky odlišnými složkami, v tomto případě zaznamenáváme echogenitu dominantní porce. Ozřejmení nádoru endometria usnadňuje přítomnost kontrastní intrauterinní tekutiny. Sonohysterografie založená na instilaci tekutiny nebo gelu do děložní dutiny může v některých případech přispět k lepší vizualizaci nádoru. Na druhou stranu není doporučována jako standardní metoda, protože nebylo prokázáno, že by významně zvyšovala přesnost stanovení myometriální invaze nádoru [24]. Spornou otázkou zůstává rozptyl maligních buněk vejcovody do břišní dutiny [4]. Znakem, který lze použít k odhalení fokálních endometriálních lézí, je akustické zesílení v oblasti jejich kontaktu s okolním endometriem zvané světlý lem (bright edge) (obr. 2). Tento sonografický obraz vzniká na stejném principu (sumace signálu) jako střední hyperechogenní linie v místě styku dvou vrstev děložní sliznice (obr. 3). Zároveň lze zobrazit klouzavý pohyb nádoru proti podkladu při tlaku sondou (sliding sign), který je patrný již při malém množství tekutiny (hlenu) v děložní dutině. Hodnocení přechodu endometria v myometrium je důležité, protože může odhalit oblast případné myometriální invaze. Tato tzv. junkční zóna (endometrium-myometriální junkce) je v postmenopauzálním období často neostrá a hůře zobrazitelná (obr. 3).
Image 3. Sonomorfologické charakteristiky endometria a endometriálního nádoru (terminologie IETA, the International Endometrial Tumor Analysis) 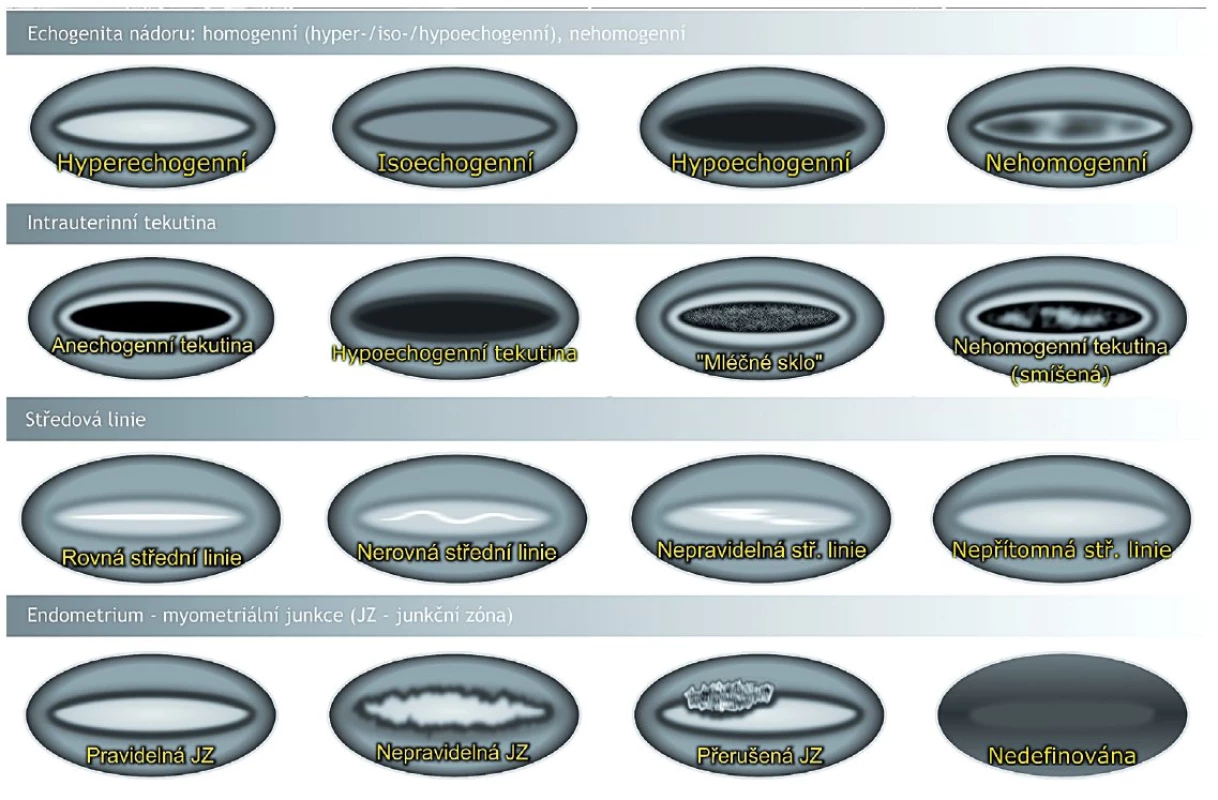
Energetický Doppler umožní posoudit stupeň a morfologii vaskularizace endometriálního nádoru. Často významně přispěje k detekci endometriální léze, především izoechogenní, kterou nelze dobře odlišit od okolních struktur jinými způsoby. Při popisu stupně perfuze a cévní architektury endometriální malignity vycházíme z terminologie stanovené Mezinárodní skupinou pro analýzu endometriálních tumorů (IETA) [13] (obr. 4).
Image 4. Stupeň perfuze a cévní morfologie endometriálního nádoru (terminologie IETA, International Endometrial Tumor Analysis) 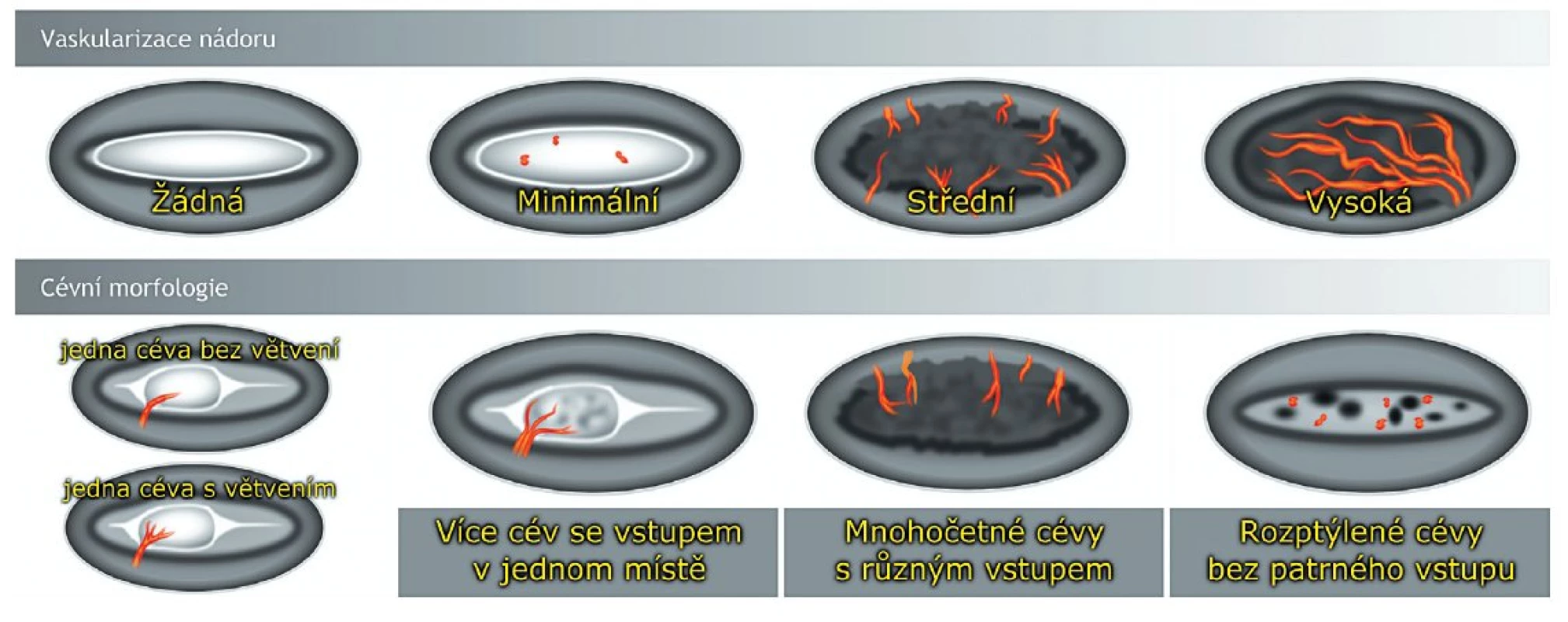
Sonomorfologie a vaskulární charakteristika endometriálních nádorů často koreluje s rozsahem nádorového postižení, stupněm dediferenciace a velikostí nádoru. Bylo prokázáno, že „high risk“ karcinomy jsou častěji hypoechogenní a/nebo non-uniformní, mají bohatou perfuzi a nejčastěji jsou zásobeny mnohočetnými cévami vstupujícími junkční zónou. Naproti tomu „low risk“ karcinomy jsou převážně hyperechogenní, jejich vaskularizace je nulová nebo nízká a zobrazujeme u nich jen jednu nebo více dominantních cév ve stopce [8].
Při hodnocení myometria v ideálním případě pozorujeme tři typické vrstvy děložní svaloviny – vnitřní hypoechogenní, střední s nejvyšší echogenitou a zevní s probíhajícími arkuátními cévami (viditelnými při jejich rozšíření), kde jsou často zobrazitelné kalcifikace nebo lakuny. Pro účely stanovení hloubky myometriální invaze (viz dále) měříme minimální zbývající lem myometria nad nádorem, tedy vzdálenost zevního okraje léze od děložní serózy v místě nejhlubší invaze a odpovídající šíři nepostiženého myometria (měřeno co nejblíže k oblasti nejhlubší invaze), je ale potřeba vyhnout se myomům, které by toto stanovení zkreslovaly. Pro lepší porozumění s patologem se osvědčilo při lokalizaci místa nejhlubší invaze nádoru do myometria využít v transverzálním řezu dělohy popis jako na hodinovém ciferníku s číslem 12 umístěným na přední stěně. Přitom oblast transverzálního řezu dělohou je patologovi anatomicky upřesněna – istmus, tělo, fundus (obr. 5). Perimetrium (děložní seróza) zobrazované jako hladká hyperechogenní kontura na povrchu dělohy může být přerušeno nejen invazí zhoubného nádoru endometria, ale také jen myomy.
Image 5. Ultrazvuková lokalizace místa nejhlubší invaze endometriálního nádoru do myometria 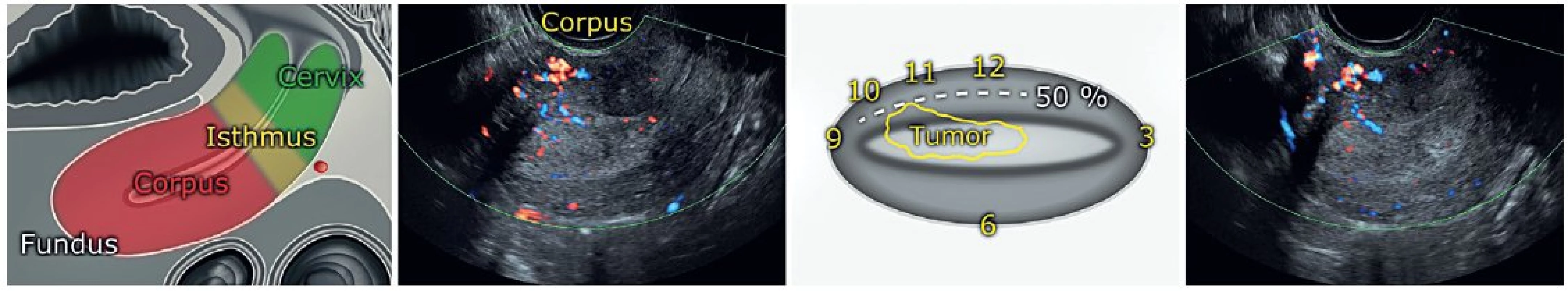
Nezbytnou součástí vyšetření je rovněž pečlivá kontrola adnex k vyloučení metastatického šíření endometriálního karcinomu nebo hormonálně aktivních ovariálních tumorů. V případě pokročilého onemocnění s nádorovým postižením zahrnujícím dělohu i adnexa je z hlediska plánování další terapie klíčové rozhodnutí, která léze je primární. K tomu může přispět tru-cut biopsie za ultrazvukové navigace. Transvaginální vyšetření pokračuje zpřehledněním dalších pánevních struktur a navazuje na něj transabdominální sonografie, jak bylo popsáno v předchozí kapitole (obr. 6).
Image 6. Ultrazvukové hodnocení extrauterinního šíření endometriálního karcinomu kombinací transvaginálního a transabdominálního přístupu 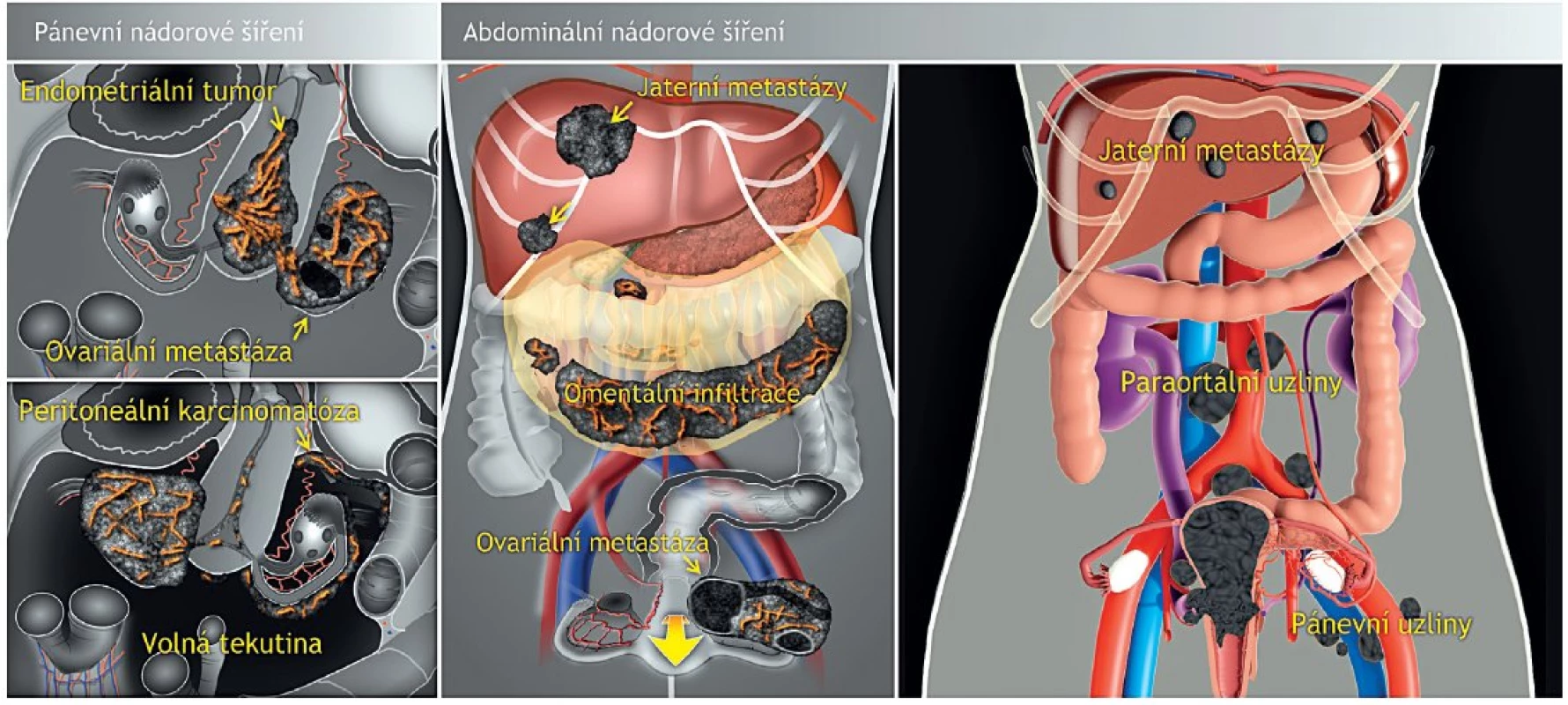
ULTRAZVUKOVÝ STAGING KARCINOMU ENDOMETRIA
Tabulka 2 uvádí platnou klasifikaci stadií nádorového postižení podle TNM klasifikace (International Union Against Cancer – UICC a Amercian Joint Committee on Cancer – AJCC) [19] se zařazením do klinických stadií I až IV (International Federation of Gynecology and Obstetrics, FIGO 2009) [18].
Table 2. Přehled klasifikace TNM a FIGO pro staging endometriálního karcinomu 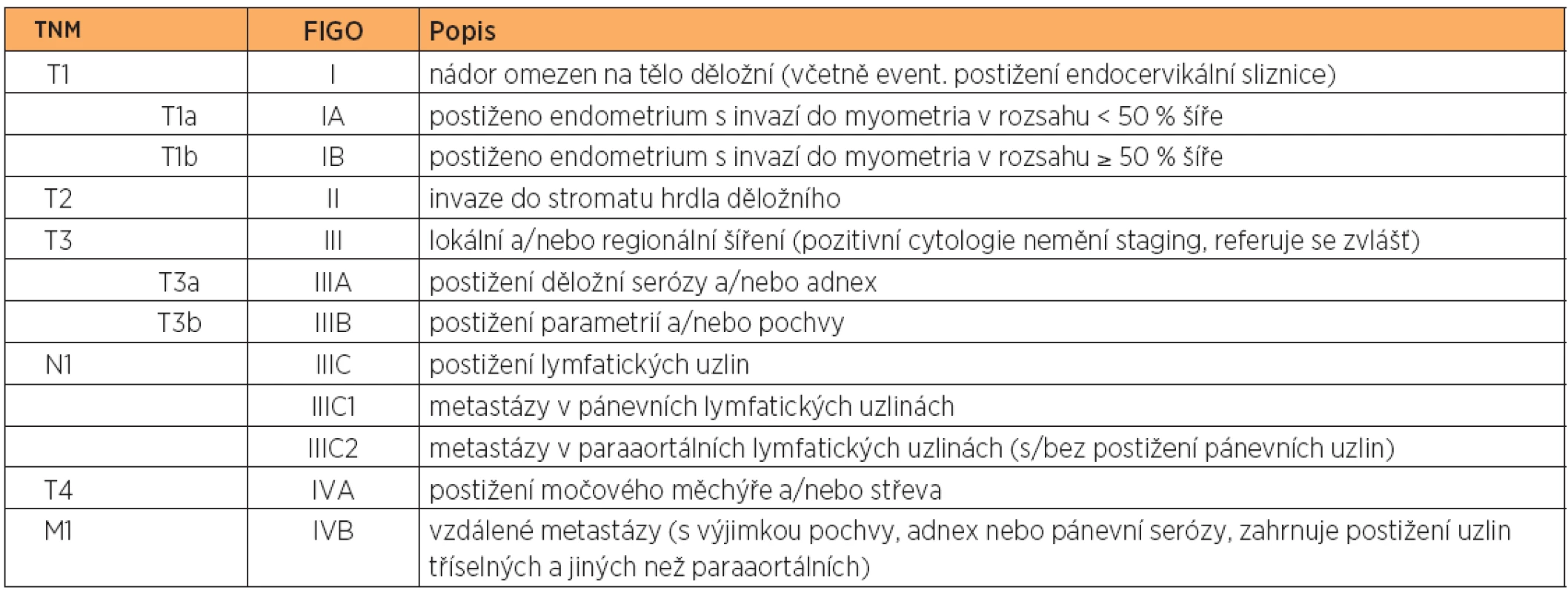
ULTRAZVUKOVÉ STANOVENÍ MYOMETRIÁLNÍ INVAZE
Po ozřejmení kontur nádoru subjektivně stanovíme, zda myometriální invaze v jakémkoliv místě zasahuje ≥ 50 % šíře myometria, a je tedy hodnocena jako hluboká (stadium T1b), nebo postihuje < 50 % šíře myometria (stadium T1a) (obr. 5). Přesnost subjektivního hodnocení myometriální invaze erudovaným lékařem dosahuje podle řady prací senzitivity v rozmezí 68–93 % a specificity82 až 83 % [ 1, 2, 15, 19, 27]. S obdobnou přesností lze určit míru invaze do myometria na základě poměru nejmenší vzdálenosti okraje endometriálního nádoru od serózy (perimetria) k nepostiženému myometriu. Pro hlubokou invazi (≥ 50 % šíře myometria) svědčí hodnoty ≤ 0,5 a invazi < 50 % šíře myometria odpovídají hodnoty > 0,5 (obr. 7). Minimální šíři lemu myometria nad tumorem lze použít i v absolutní hodnotě, protože je nezávislým prognostickým faktorem postižení lymfatických uzlin. Při vzdálenosti tumoru od serózy < 10 mm je vyšší riziko recidivy onemocnění [14, 23]. K objektivizaci stanovení hloubky myometriální invaze byl představen Karlssonem v roce 1992 poměr největšího anteroposteriorního rozměru tumoru k anteroposteriornímu rozměru dělohy s cutoff 0,5 [12], přičemž hodnota ≥ 0,5 indikuje hlubokou myometriální invazi ≥ 50 % šíře myometria, zatímco hodnota < 0,5 naznačuje invazi < 50 % šíře myometria. Ze všech testovaných objektivních ultrazvukových parametrů pro hodnocení myometriální invaze (včetně šíře endometria, vzdálenosti tumor – seróza, objemu nádoru v 3D zobrazení a poměru objemu tumoru a dělohy v 3D obraze) vykazuje právě Karlssonův poměr největší diagnostickou přesnost, srovnatelnou se subjektivním expertním hodnocením [15].
Image 7. Ultrazvukové hodnocení hloubky myometriální invaze endometriálního karcinomu 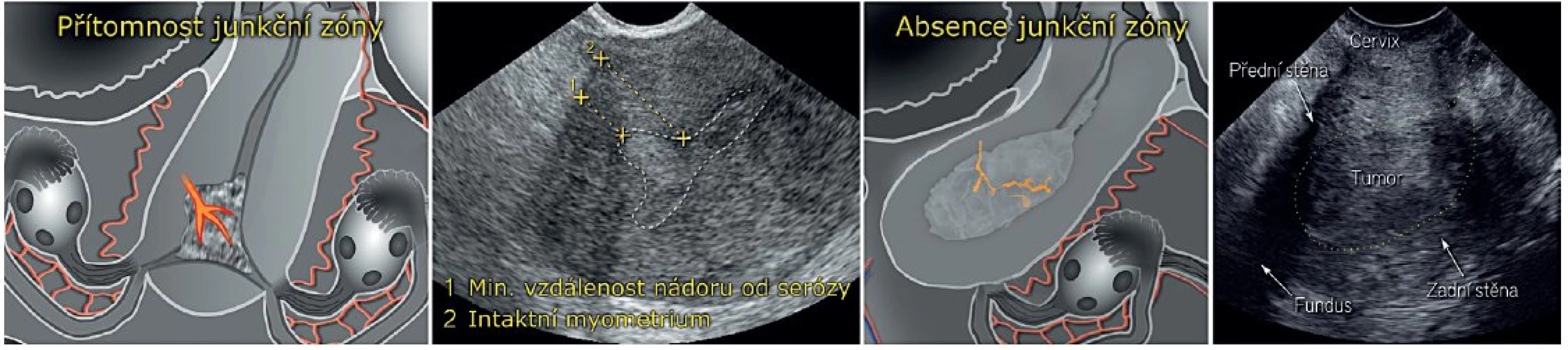
Pozn.: Poměr nejmenší vzdálenosti tumor-seróza k nepostiženému myometriu > 0,5 svědčí pro invazi do < 50 % šíře myometria, naopak poměr ≤ 0,5 svědčí pro hlubokou invazi ≥ 50 %. Přesnost ultrazvukového stanovení hloubky myometriální invaze může limitovat ztenčení myometria (v postmenopauzálním období často již tak atrofického) vlivem tlaku objemných, polypózních nádorů. U hůře zobrazitelných, polypózně rostoucích karcinomů umožňuje dopplerovské vyšetření v některých případech identifikovat jednu přívodnou cévu do nádoru, v jejímž okolí očekáváme v časných stadiích iniciální invazi, a pečlivě se zde proto zaměříme na hodnocení junkční zóny. Naopak přítomnost mnohočetných cév vstupujících z myometria do nádoru souvisí ve většině případů s hlubokou nádorovou invazí.
Výhoda MR s podáním kontrastní látky pro stanovení invaze endometriálního karcinomu do myometria spočívá ve vysokém tkáňovém kontrastu, který lze využít v případech, kdy není sonograficky možné adekvátně ohodnotit junkční zónu (napřímená děloha, akustické stíny myomů a kalcifikací). Protože magnetická rezonance i ultrazvuk mají do jisté míry podobné limitace, nemusí ani vyšetření MR vést k jasnému závěru a jako diagnostický test druhého stupně lze využít peroperační histologii (frozen section) [20].
ULTRAZVUKOVÉ STANOVENÍ CERVIKÁLNÍ STROMÁLNÍ INVAZE
Před vyšetřením infiltrace stromatu děložního hrdla je vhodné nejprve zobrazit průběh uterinnních arterií a ozřejmit místo jejich vstupu do dělohy, přibližně tak stanovíme rovinu vnitřního cervikálního ústí a odlišíme infiltraci istmu od postižení děložního hrdla na základě kontinuálního nádorového šíření (prorůstání) z děložního těla do hrdla. Druhým úkolem je odlišit pouhou protruzi nádorové masy z děložní dutiny do endocervikálního kanálu od skutečného prorůstání nádoru z endocervikálního kanálu do cervikálního stromatu (stadium T2). Při tlaku sondou v případě pouhé protruze pozorujeme vysouvání nádoru nad úroveň vnitřní branky nebo klouzavý pohyb nádorové tkáně v kanálu děložního hrdla podél endocervikální sliznice. Naopak pevná fixace léze k okolí naznačuje infiltraci a energetický Doppler pak odhalí cévy vystupující z nádoru do cervikálního stromatu v místě vnitřní branky a/nebo kaudálně od ní (obr. 8).
Image 8. Ultrazvukové hodnocení infiltrace cervikálního stromatu endometriálním karcinomem 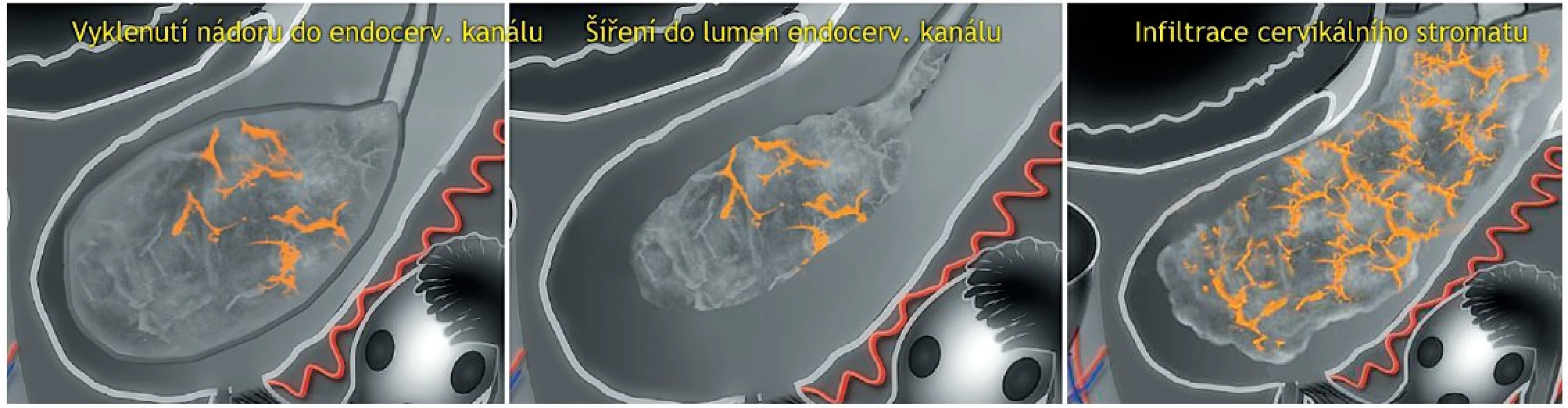
Pozn.: Tlakem ultrazvukové sondy rozlišíme vyklenutí nádoru v úrovni vnitřní branky nebo pouhou protruzi nádoru do endocervikálního kanálu (nádorová tkáň se vyklenuje v úrovni vnitřní branky nebo klouže podél endocervikální sliznice) od skutečné invaze nádoru do stromatu (pevná fixace nádorové masy a patrná vaskularizace). Subjektivní transvaginální/transrektální ultrazvukové hodnocení cervikální stromální invaze expertním sonografistou vykazuje senzitivitu 54–93 % a specificitu 85–99 % [1, 15, 19, 21], avšak této přesnosti je dosaženo jen při dostatečné erudici lékaře. Recentně publikovaná multicentrická studie prokázala srovnatelnou přesnost stanovení myometriální invaze mezi méně a více zkušenými sonografisty, ale signifikantní rozdíl v přesnosti mezi méně a více zkušenými vyšetřujícími ve stanovení cervikální stromální invaze (senzitivita 42 % vs. 57 %, specificita 83 % vs. 87 %, diagnostická shoda podle kappa 0,45 vs. 0,58) [9]. Proto je v současnosti snaha nahradit subjektivní hodnocení invaze nádoru do stromatu děložního hrdla objektivním měřením snadno detekovatelných ultrazvukových parametrů. Měření vzdálenosti dolního pólu nádoru od zevního ústí endocervikálního kanálu (jediný dosud publikovaný parametr, cutoff pro invazi 20 mm) se však svou přesností subjektivnímu stanovení nevyrovná [15].
ZÁVĚR
Článek představuje metodiku ultrazvukového vyšetření u biopticky verifikovaného endomet-riálního karcinomu se zaměřením na jeho lokální staging a stratifikaci rizika extrauterinního šíření. Kombinace transvaginálního či transrektálního a transabdominálního ultrazvuku při systematickém postupu podle rutinního schématu je základním předpokladem pro minimalizaci rizika opominutí vyšetření určité lokalizace. Při ultrazvukovém vyšetření se navíc velmi osvědčuje používat standardizované protokoly, aby každé vyšetření probíhalo shodně a aby byly odchylky v popisu nálezů mezi dvěma examinátory, při splnění základních podmínek na přístrojové vybavení, co nejmenší.
Práce vznikla za podpory grantu IGA MZ ČR NT 13070 a Univerzity Karlovy, projekty UNCE 204024 a PRVOUK P27/LF1/1.
korespondující autorka
MUDr. Daniela Fischerová, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika1. LF UK a VFN
Apolinářská 18
128 00 Praha 2
e-mail: daniela.fischerova@lf1.cuni.cz
Sources
1. Akbayir, O., Corbacioglu, A., Numanoglu, C., et al. Preoperative assessment of myometrial and cervical invasion in endometrial carcinoma by transvaginal ultrasound. Gynecol Oncol. 2011, 122, p. 600–603.
2. Alcazar, JL., Galvan, R., Albela, S., et al. Assessing myometrial infiltration by endometrial cancer: uterine virtual navigation with threedimensional US. Radiology, 2009, 250,p. 776–783.
3. Antonsen, SL., Jensen, LN., Loft, A., et al. MRI, PET/CT and ultrasound in the preoperative staging of endometrial cancer — A multicenter prospective comparative study. Gynecol Oncol, 2013, 128, p. 300–308.
4. Bese, T., Demirkiran, F., Guralp, O., et al. Transtubal transport of carcinoma cells into the peritoneal cavity after saline infusion via transcervical route in patients with endometrial carcinoma. Int J Gynecol Cancer, 2009, 19, p. 682–685.
5. Calda, P., Břešťák, M., Fischerová, D., et al. Ultrazvuková diagnostika v těhotenství a gynekologii. Praha: Aprofema, 2010, s. 380–392.
6. Colombo, N., Preti, E., Landoni, F., et al. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24, p. 33–38.
7. Creasman, WT., Odicino, F., Maisonneuve, P., et al. Carcinoma of the corpus uteri. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. Int J Gynaecol Obstet, 2006, 95 (Suppl. 1), p. 105–143.
8. Epstein, E., Van Holsbeke, C., Mascillini, F., et al. Gray-scale and color Doppler ultrasound characteristics of endometrial cancer in relation to stage, grade and tumor size. Ultrasound Obstet Gynecol, 2011, 38, p. 586–593.
9. Eriksson, LS., Lindqvist, PG., Flöter Rådestad, A., et al. Transvaginal ultrasound assessment of myometrial and cervical stroma invasion in women with endometrial cancer – interobserver reproducibility among ultrasound experts and gynaecologists. Ultrasound Obstet Gynecol. 2014 Aug 4. doi: 10.1002/uog.14645. [Epub ahead of print]
10. Fischerova, D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review. Ultrasound Obstet Gynecol, 2011, 38, p. 246–266.
11. Haldorsen, IS., Berg, A., Werner, HM., et al. Magnetic resonance imaging performs better than endocervical curettage for preoperative prediction of cervical stromal invasion in endometrial carcinomas. Gynecol Oncol, 2012, 126, p. 413–418.
12. Karlsson, B., Norstrom, A., Granberg, S., Wikland, M. The use of endovaginal ultrasound to diagnose invasion of endometrial carcinoma. Ultrasound Obstet Gynecol, 1992, 2, p. 35–39.
13. Leone, FPG., Timmerman, D., Bourne, T., et al. Terms, definitions and measurements to describe the sonographic features of the endometrium and intrauterine lesions: a consensus opinion from the International Endometrial Tumor Analysis (IETA) group. Ultrasound Obstet Gynecol, 2010, 35, p. 103–112.
14. Lindaue, J., Fowler, JM., Manolitsas, TP., et al. Is there a prognostic difference between depth of myometrial invasion and the tumor-free distance from the uterine serosa in endometrial cancer? Gynecol Oncol, 2003, 91, p. 547–551.
15. Mascillini, F., Testa, AC., Van Holsbeke, C., et al. Assessing endometrial and cervical invasion in women with endometrial cancer – comparing subjective evaluation to objective measurement techniques. Ultrasound Obstet Gynecol, 2013, 42, p. 353–358.
16. May, K., Bryant, A., Dickinson, HO., et al. Lymphadenectomy for the management of endometrial cancer. Cochrane Database Syst Rev, 2010, 1, CD007585.
17. Ortoft, G., Dueholm, M., Mathiesen, O., et al. Preoperative staging of endometrial cancer using TVS, MRI, and hysteroscopy. Acta Obstet Gynecol Scand, 2013, 92, 5, p. 536–545.
18. Pecorelli, S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet, 2009, 105, p. 103–104.
19. Savelli, L., Ceccarini, M., Ludovisi, M., et al. Preoperative local staging of endometrial cancer: transvaginal sonography vs. magnetic resonance imaging. Ultrasound Obstet Gynecol, 2008, 31, p. 560–566.
20. Savelli, L., Testa, AC., Mabrouk, M., et al. A prospective blinded comparison of the accuracy of transvaginal sonography and frozen section in the assessment of myometrial invasion in endometrial cancer. Gynecol Oncol, 2012, 124, p. 549–552.
21. Sawicki, W., Spiewankiewicz, B., Stelmachow, J., Cendrowski, K. The value of ultrasonography in preoperative assessment of selected prognostic factors in endometrial cancer. Eur J Gynaecol Oncol, 2003, 24, p. 293–298.
22. Sobin, LH., Gospodarowicz, MK., Wittekind, C. International Union Against Cancer. TNM Classifications of Malignant Tumors, 7th ed. New York: Willey-Blackwell, 2009, p. 212–216.
23. Schwab, KV., O‘Malley, DM., Fowler, JM., et al. Prospective evaluation of prognostic significance of the tumor-free distance from uterine serosa in surgically staged endometrial adenocarcinoma. Gynecol Oncol, 2009, 112, p. 146–149.
24. Takac, I. Transvaginal ultrasonography with and without saline infusion in assessment of myometrial invasion of endometrial cancer. J Ultrasound Med, 2007, 26, p. 949–955.
25. Timmerman, A., Opmeer, BC., Khan, KS., et al. Endometrial thickness measurement for detecting endometrial cancer in women with postmenopausal bleeding: a systematic review and meta-analysis. Obstet Gynecol, 2010, 11, p. 160–167.
26. Van Holsbeke, C., Ameye, L., Testa, AC., et al. Development and external validation of (new) ultrasound based mathematical models for preoperative prediction of high-risk endometrial cancer. Ultrasound Obstet Gynecol, 2014, 43, p. 586–595.
27. Weber, G., Merz, E., Bahlmann, F., et al. Assessment of myometrial infiltration and preoperative staging by transvaginal ultrasound in patients with endometrial carcinoma. Ultrasound Obstet Gynecol, 1995, 6, p. 362–367.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 6-
All articles in this issue
- Staging zhoubného nádoru děložního hrdla (stanovení předoperačního rozsahu onemocnění) – přehled výsledků nejnovějších ultrazvukových studií
- Ultrazvukový staging karcinomu děložního hrdla – návrh standardního postupu
- Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií)
- Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
- Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem
- Volba vhodné bioptické metody u primárně inoperabilního nebo recidivujícího zhoubného nádoru a metodika bioptického odběru
- Význam screeningu v onkogynekologii
- Metody bezkrevní péče v gynekologii a onkogynekologii
- Volba zobrazovací metody v onkogynekologii
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem
- Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
- Ultrazvukový staging karcinomu děložního hrdla – návrh standardního postupu
- Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


