-
Medical journals
- Career
Variabilita v načasování dělení lidských embryí monitorovaných systémem time-lapse v závislosti na věku pacientky
Authors: Radek Hampl 1; Martin Štěpán 2
Authors‘ workplace: První privátní chirurgické centrum s. r. o. Sanus Hradec Králové, primář MUDr. J. Štěpán, CSc. ; Centrum asistované reprodukce Sanus, Pardubice 1; Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG 2
Published in: Ceska Gynekol 2013; 78(6): 531-536
Category: Original Article
Overview
Cíl studie:
Za pomoci kontinuálního monitoringu (time--lapse) popsat časovou variabilitu raného embryonálního dělení. Posoudit vliv věku pacientek na embryonální růst. Porovnat pregnancy rate time-lapse selektovaných embryí s pregnancy rate embryí ze standardní kultivace.Typ studie:
Case-control studie.Název a sídlo pracoviště:
Centrum asistované reprodukce Sanus Pardubice, První privátní chirurgické centrum s.r.o. Hradec KrálovéMetodika:
Vývoj 213 embryí od 44 pacientek byl monitorován systémem PrimoVision s frekvencí záznamu1 obrázek za 12 minut. Data byla rozdělena na záznamy pocházející od pacientek ≥ 35 let (skupina ≥ 35) a porovnána s kontrolní skupinou pacientek ≤ 32 let (skupiny ≤ 32). Z natočeného materiálu byl určen čas prvního (t2) a druhého (t3) buněčného dělení a délka cyklu mezi t2 a t3 (cc2). Kritérii pro transfer bylo souměrné dělení buněk na sudý počet buněk dceřiných, časné dělení a dosažení stadia blastocysty.Výsledky:
Byly zjištěny průměrné časy sledovaných parametrů u skupiny ≥ 35: t2 = 27,0 h, t3 = 38,7 h, cc2 = 11,7 h. U skupiny ≤ 32: t2 = 27,1 h, t3 = 39,0 h, cc2 = 11,9 h bez signifikantního rozdílu mezi skupinami. Byla popsána průměrná variabilita v načasování dělení u embryí jedné pacientky jako průměrný časový rozdíl mezi začátkem dělení nejrychlejšího a nejpomalejšího embrya pro skupinu ≥ 35: t2 = 4,5 h, t3 = 5,7 h, pro skupinu ≤ 32: t2 = 4,5 h, t3 = 5,1 h bez rozdílu mezi skupinami. Mezi věkem pacientek a t2, t3 a cc2 jednotlivých embryí se nenalezla žádná závislost (p = 0,60, p = 0,81, p = 0,57). Embrya s časným dělením statisticky signifikantně setrvávala v cc2 kratší dobu než embrya pomalejší (p = 0,0001). Dosažená pregnancy rate u time-lapse selektovaných embryí byla 55 %, u embryí z běžné kultivace 47 %.Závěr:
Vliv věku pacientky na načasování prvních embryonálních dělení nebyl prokázán. Nalezla se závislost mezi časem prvního buněčného dělení a dobou setrvání embrya ve fázi cc2. Hodnotu cc2 doporučujeme jako vhodnou k selekci embrya pro embryotransfer v centrech asistované reprodukce. Studie prokázala, že výběr embryí za pomoci time-lapse zvyšuje úspěšnost léčby u pacientek s věkovým faktorem.Klíčová slova:
lidské embryo – načasování buněčného dělení – time-lapse – věkový faktor neplodnosti – asistovaná reprodukceÚVOD
Mezi hlavní výzkumné proudy v asistované reprodukci patří již dlouhodobě hledání jasně definovaných znaků poukazujících na kvalitu lidského embrya a jeho vývojový potenciál. Cílem je maximální zefektivnění léčby neplodnosti při transferu jediného vybraného embrya jakožto prevence vícečetné gravidity.
V klinické praxi se doposud nejvíce využívá sledování morfologických znaků vyvíjejícího se embrya pod světelným mikroskopem [např. 20, 21, 22]. Tato metoda umožňuje rychlou selekci kvalitního embrya bez větších technologických a finančních nároků. Nevýhodou je hodnocení embryí v pro ně nepříznivém prostředí mimo inkubátor, velký podíl subjektivního hodnocení a absence informací o dynamice a načasování růstu. Daleko objektivnější informace nám poskytuje metoda sledování metabolické aktivity vyvíjejících se embryí [např. 3, 9, 11], která používá k analýze změnu koncentrace vybraných embryonálních metabolitů v kultivačním médiu bez jakéhokoli zásahu do vývoje embrya. I přes nadějné publikované práce ale nebyl doposud nalezen levný a běžně dostupný test vhodný pro praxi CAR. Další alternativou je preimplantační genetická diagnostika [např. 16, 18] umožňující transferovat embrya bez genetické zátěže. Test se ale neobejde bez invazivního odběru embryonálních buněk s rizikem zhoršení následného vývoje embrya a je finančně náročný.
Nelze se tedy divit, že nejnovější metoda kontinuálního sledování vyvíjejících se embryí (time--lapse monitoring) nalezla rychlou cestu do embryologických laboratoří. V bezpečném prostředí inkubátoru snímá speciální kamera vývoj embryí přímo v kultivační misce a záznamy se analyzují na počítači [1, 2]. Cílem je vybrat embryo nejvíce podobné „ideálnímu embryu“ co do dynamiky růstu a načasování jednotlivých fází buněčného dělení. První publikace pomalu nastiňují znaky, které pomohou nalézt embryo schopné úspěšné implantace a růstu [např. 10, 13, 15, 25]. Vedle přínosu pro klinickou praxi se nám také otevírá unikátní možnost popsat variabilitu kinetiky buněčného dělení jednotlivých embryí v závislosti na široké škále různých faktorů.
Pochopení variability v dělení buněk embryí u jedné pacientky, která často končí například ve stejně vypadajících čtyřbuněčných embryích v určitém stacionárním čase, nám může pomoci nalézt schéma „ideálního“ buněčného dělení. Cílem předložené práce bylo určit časy prvních buněčných dělení lidských embryí za pomoci time-lapse monitoringu a dále zjistit, zda na toto načasování má vliv věk ženy. V práci byla také porovnána implantace embryí vybraných na time-lapse systému s embryi z běžné kultivace mimo monitorovací systém. Věk žen patří mezi klíčové faktory ovlivňující implantaci [4, 8, 19]. V době prodlužujícího se věku žen vstupujících do vlastní reprodukce se stává toto téma velmi aktuálním.
SOUBOR A METODIKA
Do studie bylo zařazeno 106 embryí od 22 pacientek ≥ 35 let (skupina ≥ 35). Pro statistické porovnání vlivu věku na sledované hodnoty byla vytvořena kontrolní skupina 22 mladších pacientek ≤ 32 let se 107 embryi (skupina ≤ 32). Kontrolní skupina byla stanovena záměrně s větším věkovým odstupem, tak aby na sebe věk pacientek nenavazoval. Případný vliv věku na embryonální dělení tak bude patrnější. Pacientky v obou skupinách byly do studie zařazeny konsekutivně podle svého věku. Celkem bylo tedy sledováno 213 embryí 44 pacientek v časovém období leden až prosinec 2012 v Centru asistované reprodukce Sanus Pardubice.
Pacientky byly stimulovány v antagonistickém protokolu s GnRH antagonisty (Cetrotide, Německo a Orgalutran, Holandsko). Všechny oocyty byly oplozeny metodou ICSI a kultivovány v médiích G1 (Vitrolife, Švédsko) na kultivačních miskách WOW dishes 9wells (Cryo Innovation, Maďarsko) ve standardních kultivačních podmínkách (37 °C, 6% CO2, vlhký vzduch). Vývoj embryí byl monitorován na time-lapse systému (PrimoVision, Cryo Innovation, Maďarsko, 1 obr./12 minut). Analýza byla provedena s časovým odstupem na uloženém natočeném materiálu na počítači.
Sledovali jsme tři parametry časování dělení z prvních růstových fází embrya, podrobnější definice hodnot viz [15]: začátek prvního buněčného dělení (označeno t2, vznik dvojbuněčného stadia embrya, počítáno od oplození oocytu spermií do rozdělení buněk), začátek druhého dělení (označeno t3, vznik tříbuněčného stadia, počítáno od oplození oocytu spermií do druhého buněčného dělení) a délka cyklu mezi prvním a druhým dělením (označeno cc2, vypočítána jako t3-t2).
Kritériem pro výběr embryí pro transfer u pacientek ≥ 35 let bylo: a) souměrnost dělení buněk na dceřiné buňky o stejné velikosti b) dělení buněk na časově nejrychlejší výsledný sudý počet dceřiných buněk a c) dosažení stadia blastocysty v 5. den kultivace (v den 3 byla embrya přemístěna do druhého kultivačního média G2, Vitrolife, Švédsko). V případě vyššího počtu kvalitativně podobných embryí bylo pro embryotransfer vybráno embryo dělící se jako první (tzv. early cleavage, hodnota t2). Implantace transferovaných embryí na základě time-lapse selekce byla porovnána s implantací u náhodně vybrané skupiny pacientek ve stejné věkové kategorii, u kterých nedošlo k time-lapse selekci embryí (pacientky ≥ 35 let, antagonistický protokol, stejná kultivace, embryotransferden 5 ve stadiu blastocysty). Úspěšná implantace byla potvrzena přítomností gestačního váčku a vyjádřena ve formě pregnancy rate (%).
Rozdíl v načasování dělení embryí mezi skupinami ≥ 35 a ≤ 32 byl stanoven porovnáním průměrných časů dělení embryí jednotlivých pacientek za pomoci t-testu. Data byla prezentována jako průměr ± SD. Vliv věku pacientek na časování dělení buněk u všech embryí a vliv načasování prvního dělení na dobu setrvání v cc2 fázi byly stanoveny pomoci Pearsonovy korelace. Za statisticky signifikantní byla považována hodnota p < 0,05. Statistická analýza byla provedena v programu JMP (SAS Institute 1997, USA).
VÝSLEDKY
Ve skupině ≥ 35 byl průměrný věk pacientek 38,0 ± 1,7 let. Ve skupině ≤ 32 byl průměrný věk pacientek 29,7 ± 2,4 let. V načasování prvního buněčného dělení (t2) nebyl nalezen rozdíl (skupina ≥ 35 : 27,0 h ± 3,2 vs. skupina ≤ 32 : 27,1 ± 3,0 h,p = 0,71). Čas dělení jednotlivých embryí u jednotlivých pacientek je v grafu 1. Nebyl nalezen rozdíl v průměrném časovém rozdílu mezi začátkem dělení nejrychlejšího a nejpomalejšího embrya u jedné pacientky mezi skupinami (skupina ≥ 35 : 4,5 ± 2,5 h vs. skupina ≤ 32 : 4,5 ± 2,7 h, p = 0,98). Mezi věkem všech pacientek a t2 jednotlivých embryí nebyla nalezena žádná závislost (r = 0,04,p = 0,60) (graf 2).
Graph 1. Časy začátku prvního buněčného dělení všech embryí u jednotlivých pacientek ≥35 let (n=106 embryí u 22 pacientek) 
Graph 2. Časy začátku prvního buněčného dělení všech embryí u jednotlivých pacientek ≥35 let (n=106 embryí u 22 pacientek) 
Nebyl nalezen rozdíl v času nástupu do druhého buněčného dělení (t3) od oplození mezi skupinami (skupina ≥ 35 : 38,7 ± 4,0 h vs. skupina ≤ 32 : 39,0 ± 3,4 h, p = 0,65). Nebyl nalezen rozdíl v průměrném časovém rozdílu začátku druhého dělení nejrychlejšího a nejpomalejšího embrya u jedné pacientky mezi skupinami (skupina ≥ 35 : 5,7 ± 2,7 h vs. skupina ≤ 32 : 5,1 ± 2,5 h,p = 0,45). Mezi věkem všech pacientek a t3 jednotlivých embryí nebyla nalezena žádná závislost (r = 0,02, p = 0,81).
Také nebyl nalezen rozdíl v době cc2 mezi skupinami (skupina ≥ 35 : 11,7 ± 1,4 h vs.skupina ≤ 32 : 11,9 ± 1,1 h, p = 0,63). Nebyla nalezena závislost mezi věkem všech pacientek a délkou setrvání embryí v cc2 (r = -0,04,p = 0,57). Byla nalezena pozitivní korelace mezi začátkem prvního buněčného dělení jednotlivých embryí (t2) s dobou, ve které embrya následně setrvávají v cc2 (r = 0,81,p = 0,0001). Embrya, která vstupují do prvního buněčného dělení dříve (tzv. early cleavage), setrvávají v cc2 kratší dobu než embrya pomalejší (graf 3).
Graph 3. Doba setrvání embryí ve fázi mezi prvním a druhým dělením (cc2) v závislosti na načasování prvního dělení (n=213) se statisticky signifikantním rozdílem (p=0,0001). Embrya, která vstupují do prvního dělení dříve, setrvávají v cc2 fázi kratší dobu. 
Na základě výběru nejkvalitnějších embryí z Primo-Visionu bylo transferováno průměrně 1,5 embrya ve stadiu blastocysty 22 pacientkám ze skupiny ≥ 35 let (obr. 1). Výsledná pregnancy rate byla 55,0 %. V kontrolní skupině stejně starých pacientek(n = 34) s embryi z běžné kultivace bez time-lapse selekce bylo transferováno průměrně 1,6 embrya ve stadiu blastocyty s výslednou pregnancy rate 47,1 %.
Image 1. Embrya jedné pacientky, jejichž vývoj byl monitorován na systému PrimoVision. Všechna embrya již dosáhla stadium blastocysty. Cesta k tomuto stadiu ale může být u jednotlivých embryí značně odlišná. 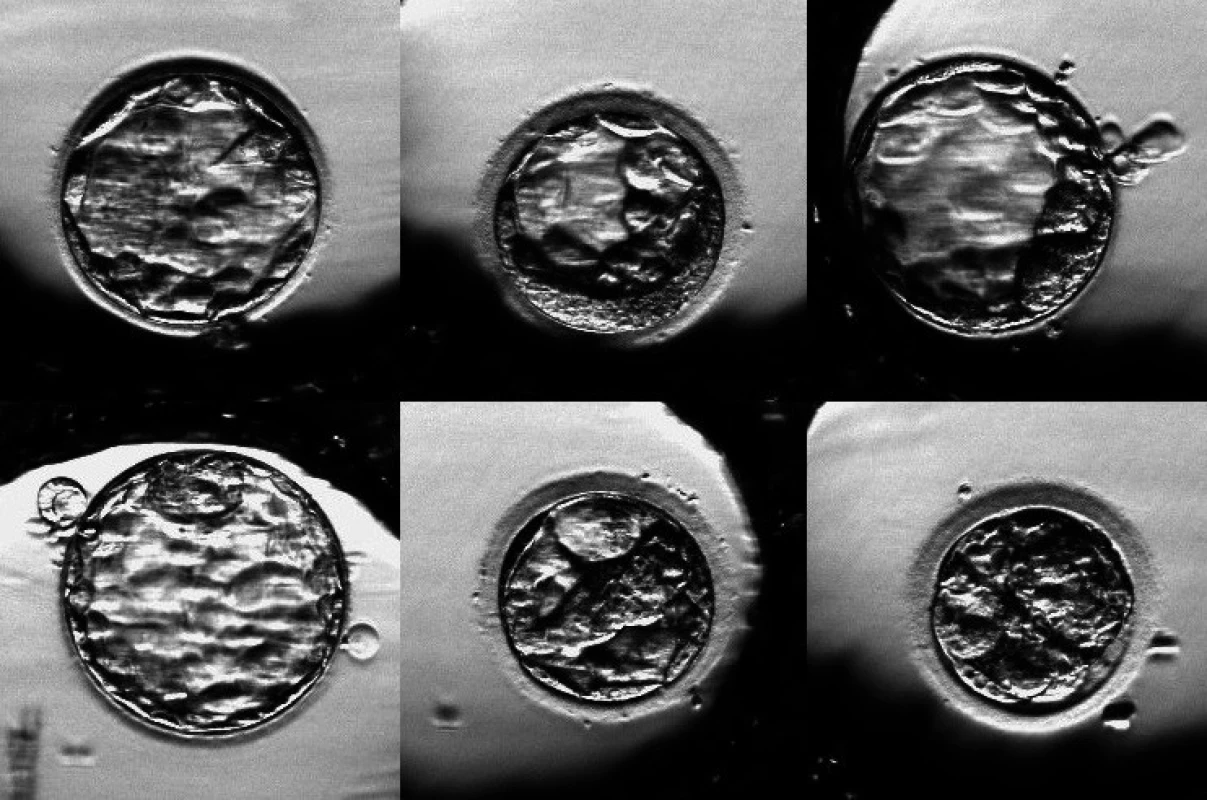
DISKUSE
Cílem práce bylo ukázat variabilitu v první fázi dělení lidských embryí pocházejících od jednotlivých pacientek za pomoci neinvazivního kontinuálního monitoringu time-lapse. Embrya vypadající v počtu buněk druhý kultivační den podobně, mohou mít za sebou velmi rozdílný vývoj. Přitom čas dělení prvních buněk a kvalita realizace buněčných dělení může poukazovat na další vývojový potenciál embrya a jeho schopnost implantace [15, 17, 25]. Meseguer et al. [15] ve své práci uvádí průměrný čas t2 pro embrya s úspěšnou implantací 25,6 h a s neúspěšnou 26,7 h, pro t3 pak pro úspěšná embrya 37,4 h a neúspěšná 38,4 h. Je zajímavé, že námi zjištěné časy se blíží méně úspěšné hodnotě, a přitom výsledná pregnancy rate je nadprůměrná. Ideální čas pro cc2 pak uvádí ≤ 11,9 h, což našim hodnotám odpovídá. Tento poznatek navíc doplňuje naše zjištění, že časná „early cleavage“ (EC) embrya setrvávají v cc2 kratší dobu. V mnoha studiích jsou EC embrya označena jako ta nadějnější pro implantaci [7, 14, 24]. Z naší práce vyplývá, že EC embrya statisticky významně setrvávají v cc2 kratší dobu před těmi pomalejšími, což tým autorů Meseguer et al. [15] označuje za znak implantační kvality. Sledování délky trvání cc2 tedy doporučujeme jako jeden z vhodných a snadno zjistitelných ukazatelů embryonální kvality při time-lapse selekci embryí pro transfer v běžné klinické praxi.
Možný vliv věku pacientky na časový průběh časného dělení embryí jsme neprokázali, i když věk patří mezi klíčové faktory ovlivňující úspěšnost léčby v programu IVF [4, 8, 19]. Věkový faktor ovšem v uváděných datech nekoreluje s časným buněčným dělením. Značná variabilita v dělení embryí pocházejících od jedné pacientky může být ovlivněna jinými faktory, v čele s kultivačními podmínkami ovlivňujícími metabolismus embryí, vlivem paternity projevující se především na S fázi buněčného cyklu či chromozomálními abnormalitami [5, 12].
Embrya u pacientek ≥ 35 let vybraná pro embryo-transfer na základě jasných a poměrně jednoduchých pravidel z time-lapse systému zvýšila výslednou pregnancy rate oproti embryím z běžné kultivace. Data mohou být ovlivněna poměrně malým sledovaným vzorkem a jistě bude potřeba potvrdit tyto závěry na větším a dlouhodobějším pozorování. Přesto každá z pozorovaných hodnot má své selekční opodstatnění v řadě odborných publikací. Např. Meseguer et al. [15] označuje synchronicitu dělení na sudý počet buněk, respektive co nejrychlejší dosažení 4buněčného stadia z 3buněčného, jako znak embryonální kvality. Dále např. [6, 23, 24 aj.]. Kultivovat a selektovat embrya na time-lapse systému na základě publikačně podložených jasných znaků může u skupiny pacientek vyššího věku zvýšit úspěšnost léčby v centrech asistované reprodukce. Po získání většího vzorku dat se v naší další práci zaměříme především na porovnání hodnot t2, t3 a cc2 u embryí s úspěšnou a neúspěšnou implantací, což pomůže zpřesnit selekční znaky embryí pro embryotransfer v běžné klinické praxi.
Poděkování
Pracovníkům CAR Sanus děkujeme za realizaci léčebných cyklů. Milanu Bartošovi, Daně Hamplové, Marianu Kacerovskému, Tomáši Maříkovi a Janu Vodičkovi děkujeme za podnětné připomínky k rukopisu.
RNDr. Radek Hampl, Ph.D.
Centrum asistované reprodukce Sanus
Rokycanova 2798
530 02 Pardubice
e-mail: hampl.radek@seznam.cz
Sources
1. Ajduk, A., Zernicka-Goetz, M. Advances in embryo selection methods. F1000 Biol Reprod, 2012, 4, p. 11.
2. Bischoff, M., Parfitt, DE., Zernicka-Goetz, M. Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions. Development, 2008, 135, p. 953–962.
3. Brison, DR., Houghton, FD., Falconer, D., et al. Identification of viable embryos in IVF by non-invasive measurement of amoni acid turnover. Hum Reprod, 2004, 19, p. 2319–2324.
4. Cetin, MT., Kumtepe, Y., Kiran, H., Seydaoglu, G. Factors affecting pregnancy in IVF: age and duration of embryo transfer. Reprod Biomed Online, 2010, 20, p. 380–386.
5. Escrich, L., Grau, N., Meseguer, M., et al. Morphologic indicators predict the stage of chromatin condensation of human germinal vesicle oocytes recovered from stimulated cycles. Fertil Steril, 2010, 93, p. 2557–2564.
6. Gardner, DK., Phil, D., Lane, M., Stevens, J., et al. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer. Fertil Steril, 2000, 37, p. 1155–1158.
7. Giorgetti, C., Hans, E., Terriou, P., et al. Early cleavage: an additional predictor of high implantation rate following elective single embryo transfer. Reprod Biomed Online, 2007, 14, p. 85–91.
8. Gomes, LM., Canha Ados, S., Dzik, A., et al. The age as a predictive factor in vitro fertilization cycles. Rev Bras Ginecol Obstet, 2009, 31, p. 230–234.
9. Haggarty, A., Wood, M., Ferguson, E., et al. Fatty acid metabolism in human preimplantation embryos. Hum Reprod, 2006, 21, p. 766–773.
10. Hlinka, D., Lazarovská, S., Rutarová, J., et al. Neinvazívne meranie dĺžky bunkového cyklu v prvých dňoch embryonálneho vývoja – objektívne merateĺný ukazovateĺ životaschopnosti ĺudských embryí. Čes. Gynek, 2012, 77, 1, s. 52–57.
11. Houghton, FD., Hawkhead, JA., Humpherson, PG., et al. Non-invasive amino acid turnover predicts human embryo developmental capacity. Hum Reprod, 2002, 17, p. 999–1005.
12. Lechniak, D., Pers-Kamczyc, E., Pawlak, P. Timing of the first zygotic cleavage as a marker of developmental potential of mammalian embryos. Reprod Biol, 2008, 8, p. 23–42.
13. Lemmen, JG., Agerholm, I., Ziebe, S. Kinetic markers of human embryo quality using time-lapse recordings of IVF/ICSI fertilized oocytes. Reprod Biomed Online, 2008, 17, p. 385–391.
14. Lundin, K., Bergh, C., Hardarson, T. Early embryo cleavage is a strong indicator of embryo quality in human IVF. Hum Reprod, 2001, 16, p. 2652–2657.
15. Meseguer, M., Herrero, J., Tejera, A., et al. The use of morphokinetics as a predictor of embryo implantation. Hum Reprod, 2011, 26, p. 2658–2671.
16. Munné, S., Chen, S., Fischer, J., et al. Preimplantation genetic diagnosis reduces pregnancy loss in women aged 35 years and older with a history of reccurent miscarriages. Fertil Steril, 2005, 84, p. 331–335.
17. Nakahara, T., Iwase, A., Goto, M., et al. Evaluation of the safety of time-lapse observations for human embryo. J Assist Reprod Genet, 2010, 27, p. 93–96.
18. Ogilvie, CM., Braude, PR., Scriven, PN. Preimplantation genetic diagnosis – an overview. J Histochem Cytochem, 2005, 53, p. 255–260.
19. Petanovski, Z., Dimitrov, G., Ajdin, B., et al. Impact of body mass index (BMI) and age on the outcome of the IVF process. Prilozi, 2011, 32, p. 155–171.
20. Ragione, T., Verheyen, G., Papanikolaou, EG., et al. Developmental top-stage on day-5 and fragmentation rate on day-3 can influence the implantation potential of quality blastocysts in IVF cycles with single embryo transfer. Reprod Biol Endocrinol, 2007, 26, p. 2.
21. Romao, GS., Araújo, MCPM., Demelo, AS., et al. Oocyte diameter as a predictor of fertilization and embryo quality in assisted reproduction cycles. Fertil Steril, 2010, 93, p. 621–625.
22. Scott, L., Finn, A., Leary, TO., et al. Morphologic parameters of early cleavage-stage embryos that correlate with fetal development and delivery: prospective and applied data for increased pregnancy rates. Hum Reprod, 2007, 22, p. 230–240.
23. Schwärzler, P., Zech, H., Auer, M., et al. Pregnancy outcome after blastocyst transfer as compared to early cleavage stage embryo transfer. Hum Reprod, 2004, 19, p. 2097–2102.
24. Terriou, P., Giorgetti, C., Hans, E., et al. Relationship between even early cleavage and day 2 embryo score and assessment of their predictive value for pregnancy. Reprod Biomed Online, 2007, 14, p. 294–299.
25. Wong, CC., Loewke, KE., Bossert, NL., et al. Non-invasive imaging of human embryos before embryonic genome activation predicts development to the blastocyst stage. Nat Biotechnol, 2010, 28, p. 1115–1121.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 6-
All articles in this issue
- Lze považovat i na začátku třetího tisíciletí primární karcinom vejcovodu za enigma?
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Jaký je aktuální stav diagnostiky vulvovaginálního dyskomfortuv České republice? Pilotní analýza
- Vezikouterinní vlasová píštěl osm let po císařském řezu – kazuistika
- Variabilita v načasování dělení lidských embryí monitorovaných systémem time-lapse v závislosti na věku pacientky
- Je diabetes mellitus rizikový faktor kvasinkového poševního zánětu?
- Proteiny rezistence LRP, Pgp,MRP1, MRP3 a MRP5 u pacientek s karcinomem ovaria
- Transuretrální aplikace polyacrylamid hydrogelu (Bulkamidu®) při léčbě ženské stresové inkontinence močia změny léčebného efektu v závislosti na čase od operace
- Incidence, etiologie a klinický význam trombocytopenie v graviditě
- Epidemiologie, etiologie a diagnostika nykturie
- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Vliv způsobu porodu na ženskou sexualitu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Vliv způsobu porodu na ženskou sexualitu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

