-
Medical journals
- Career
Solubilní Toll-like receptor 2 v pupečníkové krvi u těhotenství komplikovaných předčasným odtokem plodové vody
Authors: E. Mitášová 1; M. Kacerovský 2; J. Krejsek 1; H. Hornychová 3; C. Andrýs 1
Authors‘ workplace: Ústav klinické imunologie a alergologie LF UK a FN, Hradec Králové, přednosta prof. RNDr. J. Krejsek, CSc. 1; Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D. 2; Fingerlandův ústav patologie LF UK a FN, Hradec Králové, přednosta prof. MUDr. A. Ryška, Ph. D. 3
Published in: Ceska Gynekol 2013; 78(4): 365-372
Overview
Cíl studie:
Stanovit hladiny solubilního Toll-like receptoru 2 (sTLR2) v pupečníkové krvi novorozenců pacientek s těhotenstvím komplikovaným předčasným odtokem plodové vody (PPROM) za přítomnosti nebo absence histologické chorioamnionitidy (HCA) a funisitidy.Typ studie:
Retrospektivní studie.Název a sídlo pracoviště:
Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Hradci Králové, Ústav klinické imunologie a alergologie, Porodnická a gynekologická klinika.Metodika:
Do studie bylo zařazeno 86 žen s PPROM mezi 24. a 36. týdnem gestačního stáří. Vzorky pupečníkové krve byly odebrány z podvázaného pupečníku ihned po porodu novorozence. Vzorky placenty, plodových obalů a pupečníku byly vyšetřeny na přítomnost zánětlivých změn. Koncentrace sTLR2 v pupečníkové krvi novorozenců byla měřena metodou ELISA.Výsledky:
U žen s HCA nebyla zaznamenána rozdílná koncentrace sTLR2 v pupečníkové krvi ve srovnání s ženami bez HCA (s HCA: medián 7,6 ng/mL, interkvartilový rozsah [IQR] 5,1 – 12,3 vs. bez HCA: medián 8,0 ng/mL, IQR 6,0 – 9,4; p = 0,79). Nebyl nalezen rozdíl v koncentraci sTLR2 v pupečníkové krvi mezi skupinami pacientek s funisitidou a bez funisitidy (s funisitidou: medián 7,2 ng/mL,IQR 5,5 – 22,3 vs. bez funisitidy: medián 7,9 ng/mL, IQR 5,2 – 10,5; p = 0,31).Závěr:
Hladiny sTLR2 v pupečníkové krvi nejsou ovlivněny přítomností HCA nebo funisitidy u těhotenství komplikovaných PPROM.Klíčová slova:
funisitida – histologická chorioamnionitida – předčasný odtok plodové vody – sTLR2 – vrozená imunitaÚVOD
Předčasný porod je závažnou komplikací moderního porodnictví. Jde o porod před 37. týdnem gestačního věku. V Evropě postihuje zhruba 5 % všech těhotenství, ve Spojených státech amerických je jeho četnost více než dvojnásobná a v některých afrických státech šplhá výskyt předčasných porodů k 20 % [5]. Předčasný odtok plodové vody (preterm premature rupture of membranes, PPROM) je definován jako porušení celistvosti plodových obalů s následným odtokem plodové vody, který předchází minimálně 2 hodiny před nástupem děložních kontrakcí. Nastává mezi 24. – 37. týdnem těhotenství [12]. Faktor, který je silně asociován s PPROM, je intrauterinní infekce. Nejen samotný výskyt a působení patogenů na okolní tkáně matky a plodu, ale i narušení imunologické homeostázy může zapříčinit mnoho obtíží v těhotenství [43]. Po mikrobiální invazi amniální dutiny dochází k migraci imunokompetentních buněk do místa napadení a k zahájení obranné odpovědi [19]. Mateřská odezva na infekci koreluje s histologickou chorioamnionitidou (histological chorioamnionitis, HCA), která je definována histologickým průkazem zánětlivých změn v placentě. Pacientky s HCA jsou asymptomatické, bez horečky, bolestí v podbřišku, mateřské či fetální tachykardie [50]. Odezvou plodu na expozici patogenních agens může být v některých případech aktivace jeho imunitního systému, tzv. syndrom fetální zánětlivé odpovědi (fetal inflammatory response syndrom, FIRS) [14]. Jako morfologický korelát FIRS se někdy udává funisitida. Histologický nález funisitidy lze stanovit post partum. Zánět pupečníku je spojen se zvýšeným rizikem poškození plodu a novorozence, například mozkovou obrnou [16] nebo chronickým plicním onemocněním [8].
Klíčovou úlohu při průniku mikrobiální infekce má vrozená imunita, která u člověka zaujímá první obrannou linii. Jde o archaický způsob obrany, který je fylogeneticky konzervovaný na molekulární úrovni [28]. Porozumění jejímu vlivu na zdárný průběh těhotenství se jeví jako esenciální [26]. Součástí přirozené imunity je rodina Toll-like receptorů (Toll-like receptors, TLRs), jež hraje zásadní roli při rozpoznání a eliminaci patogenů. Nyní již známe deset lidských TLRs [52]. TLRs jsou transmembránové glykoproteiny rozpoznávající tzv. signály nebezpečí či poškození [1]. Molekulové vzory potenciálně nebezpečných mikroorganismů (např. lipopolysacharid) jsou TLRs schopné identifikovat jako vzory PAMP (pathogen associated molecular patterns) [41]. Stejně tak TLRs rozeznávají endogenní molekuly (damage-associated molecular patterns, DAMPs) uvolněné z aktivovaných či nekrotických buněk a extracelulárního matrix pod vlivem probíhajícího zánětu a infekce [39]. Jde například o stresový protein HSP70 nebo kyselinu hyaluronovou [37, 55]. Aby nedocházelo k hyperaktivaci imunitního systému při infekci, a tím možnému poškození orgánů a chronickým zánětům, musí být odpověď přísně regulována [33]. Jedním z mechanismů kontroly TLR aktivace je tvorba solubilní formy TLR (sTLR). Tato forma kompetuje o přirozené ligandy s povrchovými TLRs [40]. Solubilní forma je zřejmě produkována dvěma způsoby. První možností je pohlcení povrchových TLRs zpět do buňky, kde jsou TLRs posttranslačně modifikovány na solubilní formu a poté uskladněny v intracelulárním váčku. V případě potřeby je buňka uvolní do prostoru [10, 31]. Druhým způsobem vzniká sTLR odštěpením TLR z povrchu buňky proteázami (tzv. shedding) [58].
TLR2 zaujímá speciální místo mezi TLRs. Jeho schopnost rozeznávat patogeny je dobře probádaná a zahrnuje širokou škálu bakterií, virů, plísní, mykobakterií a parazitů [1]. Mnohostrannost v rozpoznávání ligandů je umožněna schopností TLR2 vytvářet heterodimery s TLR1 nebo TLR6 [53, 54]. TLR2 má svoji solubilní formu (sTLR2), která byla nalezena v plazmě, v mateřském mléku, ve slinách a v plodové vodě [10, 31, 51]. Hlavní důvody, proč jsme se rozhodli stanovit hladiny sTLR2 v pupečníkové krvi, byly dva. Za prvé, TLR2 je schopen rozeznat PAMP grampozitivních bakterií, jakými jsou peptidoglykany, kyselina lipo-teichoová [47] nebo lipoproteiny/lipopeptidy [30]. Právě grampozitivní bakterie se nejčastěji vyskytují při mikrobiální invazi amniální dutiny a aktivují TLR2 [57]. Za druhé, v dřívější studii byl potvrzen signifikantní nárůst sTLR2 v plodové vodě u pacientek s HCA oproti pacientkám bez HCA [3, 19]. sTLR2 v plodové vodě se ukázal být nadějným markerem HCA. Proto nás zajímalo, zda obdobná závislost platí i v pupečníkové krvi. Vzhledem k neinvazivnímu způsobu odběru pupečníkové krve by šlo o velmi šetrnou metodu, bez rizik pro matku a dítě. Cílem naší studie bylo stanovit koncentraci sTLR2 v pupečníkové krvi novorozence a určit vztah k těhotenstvím komplikovaným PPROM a HCA nebo funisitidou.
SOUBOR PACIENTEK A METODIKA
Soubor pacientek
Studie byla schválena Etickou komisí FN Hradec Králové. Všechny pacientky podepsaly informovaný souhlas. Celkem bylo odebráno 86 vzorků pupečníkové krve na porodním sále Porodnické a gynekologické kliniky Fakultní nemocnice Hradec Králové v období od června 2008 do září 2010 v gestačním týdnu 24+0 až 36+6. Ze studie byly vyloučeny pacientky s vícečetným těhotenstvím, s komplikovaným těhotenstvím (hypertenze, preeklampsie, diabetes mellitus, nemoci štítné žlázy a jiné) a/nebo s vrozenými vývojovými vadami plodu či známkami neprospívání plodu (váha plodu o 10 % nižší pro dané gestační stáří, určeno ultrazvukovým vyšetřením). Vaginální výtok a známky hypoxie plodu byly rovněž důvody k vyřazení ze studie.
PPROM byl definován jako porušení integrity plodových obalů s následným odtokem plodové vody, který předcházel minimálně 2 hodiny před nástupem děložních kontrakcí. PPROM byl potvrzen Temešváryho testem a pozitivním testem na insulin-like growth factor-binding protein (ACTIM PROM test, Medix Biochemica, Kauniainen, Finland) v poševním hlenu.
Sběr vzorků
Vzorky pupečníkové krve byly odebírány z podvázaného pupečníku novorozence před porodem placenty. Sběr pupečníkové krve proběhl pomocí uzavřeného vakuového systému pro odběr krve. Následně byly vzorky centrifugovány a jejich supernatanty uschovány v polypropylenových zkumavkách při -70 °C až do analýzy. Po porodu byly placentární tkáně fixovány v 10% neutrálně pufrovaném formalinu. Standardně byly po fixaci odebírány k dalšímu zpracování do parafinových bloků minimálně dva vzorky z placenty, dva vzorky z plodových obalů a jeden vzorek z pupečníku. Řezy byly obarveny hematoxylin-eozinem.
Diagnostika HCA a funisitidy
Diagnóza HCA byla stanovena podle klasifikace Salafia et al. [26], která hodnotí intenzitu (stupně – grade 1–4) infiltrace neutrofily v konkrétních kompartmentech placenty, pupečníku a plodových obalů. HCA byla definována jako: grade 1–4 ve tkáních amnia a/nebo grade 3–4 ve tkáních choria a deciduy a/nebo grade 3–4 v choriové ploténce a/nebo grade 1–4 ve tkáních pupečníku. Funisitida byla diagnostikována při nálezu v pupečníku – grade 1–4. Vzorky byly vyhodnoceny jedním patologem, který nebyl obeznámen s klinikou pacientek.
Stanovení sTLR2 v pupečníkové krvi
Koncentrace sTLR2 byla zjišťována metodou ELISA. Postup byl prováděn podle pokynů výrobce komerčního kitu pro lidský sTLR2 (Uscn Life Science & Technology Company, China). Detekční limit pro sTLR2 byl 0,098 ng/mL. Absorbance byla měřena na Multiskan RC ELISA reader (Thermo Fischer Scientific, USA) při vlnové délce 450 nm.
Statistika
Demografické a klinické charakteristiky znaků s kontinuální variabilitou se hodnotily parametrickým t-testem (uvedeny jako průměr ± smě-rodatná odchylka) nebo neparametrickým Wilcoxonovým testem (uvedeny jako medián [interkvartilový rozsah]). Znaky s kategorickou binární variabilitou byly hodnoceny neparametrickým Fisherovým exaktním testem a byly uvedeny jako počet (%). Normalita dat byla testována Kolmogorovovým-Smirnovovým testem a χ2 testem. Vzhledem k tomu, že koncentrace sTLR2 v pupečníkové krvi nesplňovaly normální distribuci, byl pro jejich vyhodnocení použit neparametrický Wilcoxonův test a výsledky prezentovány jako medián (interkvartilový rozsah).Za statisticky významné byly považovány rozdíly s p < 0,05. Všechny p-hodnoty byly zpracovány v softwarovém programu MedCalc (MedCalc Software, Mariakerke, Belgie).
VÝSLEDKY
Demografická a klinická charakteristika
Demografické a klinické charakteristiky žen a novorozenců jsou uvedeny v tabulce 1. Pacientky s PPROM byly rozděleny na základě přítomnosti nebo absence HCA a funisitidy. Z celkových 86 pacientek byla HCA diagnostikována u 61 (71 %) žen a funisitida u 18 (21 %) žen. Medián gestačního stáří pacientek s PPROM a HCA při porodu byl významně nižší než u pacientek s PPROM bez HCA. Rovněž medián gestačního stáří pacientek s PPROM a funisitidou při porodu byl signifikantně nižší než u žen bez známek zánětu pupečníku. Hmotnost novorozenců pacientek s PPROM a HCA a pacientek s PPROM a funisitidou byla výrazně nižší než hmotnost novorozenců žen bez HCA a bez funisitidy.
Table 1. Demografické a klinické charakteristiky pacientek s těhotenstvím komplikovaným předčasným odtokem plodové vody za přítomnosti nebo absence histologické chorioamnionitidy (HCA) a funisitidy 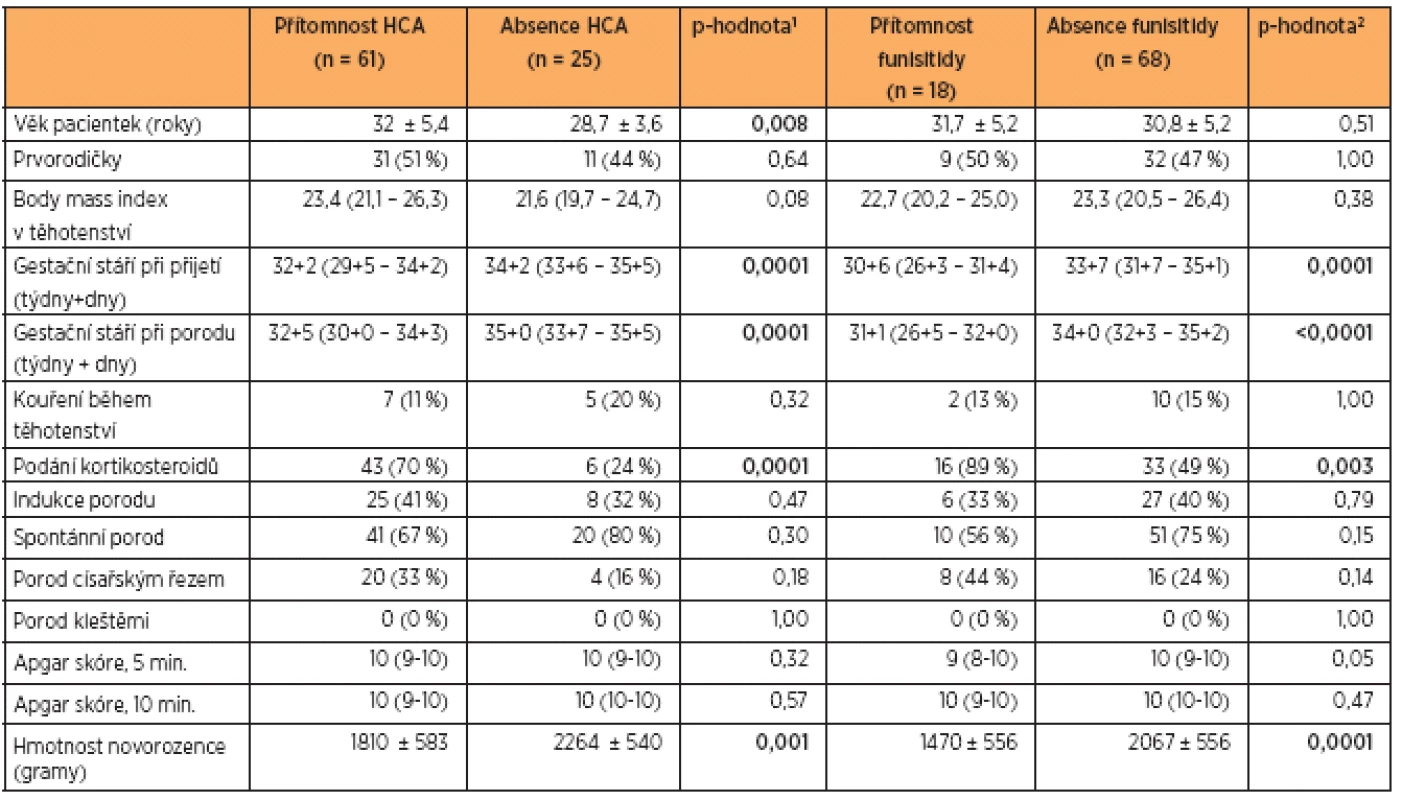
Znaky s kontinuální variabilitou byly hodnoceny parametrickým t-testem (uvedeny jako průměr ± směrodatná odchylka) nebo neparametrickým Wilcoxonovým testem (uvedeny jako medián [interkvartilový rozsah]). Znaky s kategorickou binární variabilitou byly hodnoceny neparametrickým Fisherovým exaktním testem a byly uvedeny jako počet (%). p-hodnota1 : porovnání skupiny s přítomností a absencí HCA p-hodnota2 : porovnání skupiny s přítomností a absencí funisitidy Statisticky významné výsledky jsou vyznačeny tučně. Koncentrace sTLR2 v pupečníkové krvi ve vztahu k HCA
Hladiny sTLR2 se nalezly ve všech testovaných vzorcích pupečníkové krve. Mediány koncentrace sTLR2 byly u pacientek s PPROM a HCA a u pa-cientek s PPROM bez HCA naměřeny na podobných hodnotách (s HCA: medián 7,6 ng/mL, IQR 5,1 – 12,3 vs. bez HCA: medián 8,0 ng/mL, IQR 6,0 – 9,4; p = 0,79). Statistická významnost nebyla zjištěna (graf 1, tab. 2).
Graph 1. Koncentrace sTLR2 v pupečníkové krvi u žen s předčasným odtokem plodové vody rozdělených podle přítomnosti a absence histologické chorioamnionitidy (HCA). Nenalezen signifikantní rozdíl (p = 0,79). Vodorovnou značkou jsou označeny mediány 
Table 2. Hladiny sTLR2 v pupečníkové krvi ve vztahu k přítomnosti nebo absenci HCA a funisitidy u žen s PPROM 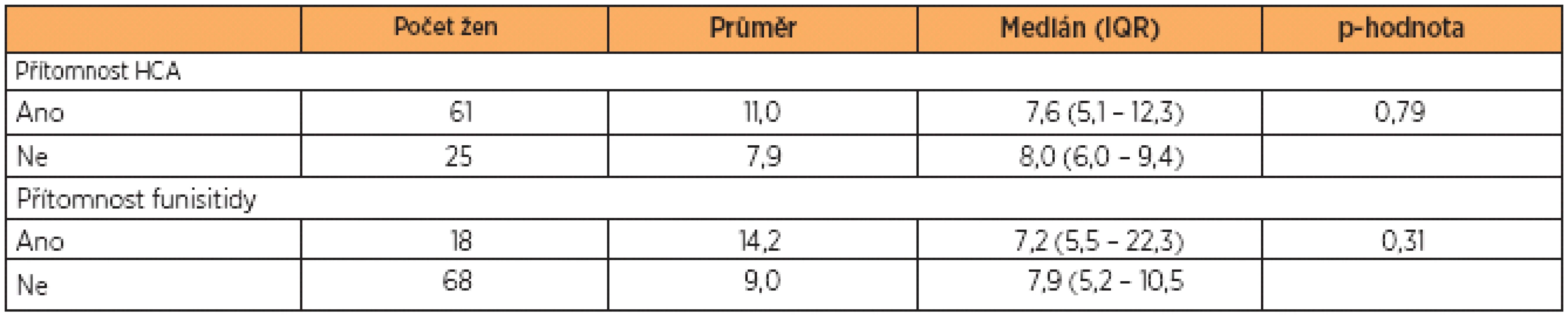
Vysvětlivky: sTLR2, solubilní Toll-like receptor 2; HCA, histologická chorioamnionitida; IQR, interkvartilový rozsah; průměr, medián a IQR prezentovány v jednotkách ng/mL. Koncentrace sTLR2 v pupečníkové krvi ve vztahu k funisitidě
Při porovnávání výsledků ve skupině pacientek s PPROM a funisitidou se skupinou pacientek s PPROM bez funisitidy nebyla nalezena statistická významnost (s funisitidou: medián 7,2 ng/mL, IQR 5,5 – 22,3 vs. bez funisitidy: medián 7,9 ng/mL, IQR 5,2 – 10,5; p = 0,31) (graf 2, tab. 2).
Graph 2. Koncentrace sTLR2 v pupečníkové krvi u žen s předčasným odtokem plodové vody rozdělených podle přítomnosti a absence funisitidy. Nenalezen signifikantní rozdíl (p = 0,31). Vodorovnou značkou jsou označeny mediány 
DISKUSE
Předčasný porod se stává velmi častým diskutovaným problémem. Jeho management je mnohdy zkomplikován přítomností HCA a funisitidy, které se podílejí na zvýšení perinatální morbidity a mortality novorozenců. Při obraně proti mikroorganismům zastávají jednu z nejdůležitějších rolí mechanismy vrozené imunity. Rozpoznání patogenů receptory PRR na povrchu buněk je první krok k jejich eliminaci. Jako jeden z regulátorů imunitní odpovědi slouží rozpustné formy receptorů, jež brání nepřiměřené zánětové reakci.
Existují důkazy, že vstup patogenů a aktivace signální cesty TLR může spustit buněčné a cytokinové aktivity, které vedou k předčasnému porodu [18, 36]. Nejčastěji dochází k navýšení hladin IL-6, IL-8, prostaglandinů, cyklooxygenázy a oxytocinových receptorů na buňkách trofoblastu [34, 49]. Již dříve naše skupina zkoumala koncentrace mnoha prozánětových molekul v plodové vodě a v pupečníkové krvi. Zde se ukázala být velmi slibná molekula solubilního vychytávacího receptoru pro hemoglobin (sCD163). Hodnoty sCD163 v plodové vodě a zároveň v pupečníkové krvi byly výrazně navýšené u pacientek s přítomnou HCA a funisitidou ve srovnání se skupinou bez zánětlivých změn [21, 24]. Mohlo by jít o potenciální marker HCA a funisitidy. V nedávné době jsme se zaměřili na koncentrace sTLR v plodové vodě v závislosti na přítomnosti nebo absenci HCA a funisitidy u žen s PPROM. Zjistili jsme, že koncentrace sTLR2 v plodové vodě významně stoupá u pacientek s PPROM s mikrobiální invazí amniální dutiny a s potvrzeným zánětem ve srovnání s pacientkami bez invaze patogenů a bez zánětu [19, 20]. Proto jsme se rozhodli k vyšetření solubilní formy Toll-like receptoru 2 v pupečníkové krvi novorozenců ve vztahu k HCA a funisitidě.
Jde o prioritní studii, jelikož koncentrace sTLR2 v pupečníkové krvi nebyla zatím nikdy zkoumána. Ve všech testovaných vzorcích byl sTLR2 přítomen. Naše výsledky nepotvrdily signifikantní nárůst koncentrace sTLR2 v pupečníkové krvi u pacientek s PPROM a s HCA nebo funisitidou oproti ženám bez HCA nebo bez funisitidy. Mediány koncentrace sTLR2 byly u všech skupin naměřeny na podobných hodnotách. Limitací naší práce je menší počet pacientek, zejména ve skupině žen s PPROM a funisitidou.
Pokud chceme hledat vysvětlení, proč se nám podařilo objevit elevaci hladin sTLR2 v plodové vodě v závislosti na zánětu, a v pupečníkové krvi nikoliv, musíme si nejprve zodpovědět otázku, jaké buňky sTLR2 uvolňují do prostoru. TLR2 je v době těhotenství u žen exprimován nejen na imunitních buňkách, tj. na dendritických buňkách, monocytech, placentálních makrofázích a děložních NK buňkách, ale i na buňkách ne-imunitní povahy. TLR2 je vyjádřen na buňkách amnionu, chorion-deciduální membrány nebo také na buňkách trofoblastu [27, 38]. Bylo prokázáno, že v případě diagnostikované HCA docházelo k výraznému nárůstu vyjádření TLR2 na povrchu buněk chorioamnionu [27]. Buněčné zdroje sTLR2 v plodové vodě mohou být velmi rozmanité, na rozdíl od pupečníkové krve, kde jsou zřejmě hlavním producentem sTLR monocyty [48]. Jak se ukázalo, vyjádření TLR2 na monocytech je poměrně stálé. Nebyl nalezen zásadní rozdíl v expresi TLR2 na monocytech u novorozenců mezi 25. až 42. týdnem porodu [44]. Určité zastoupení má TLR2 i na povrchu fetálních NK buněk, ale to je v porovnání s NK buňkami dospělého jedince zanedbatelné [33]. O vyjádření TLR2 na povrchu endoteliálních buněk je uveřejněno mnoho prací, ovšem o expresi TLR2 na endotelu cév v pupečníku se zmiňuje pouze jedna čínská studie. Ta potvrdila pouze genovou expresi mRNA molekuly TLR2 v endoteliálních buňkách pupečníkové žíly [32].
Výskyt bakterií je pro zahájení imunitní odpovědi esenciální. U žen s předčasným porodem se nejčastěji v plodové vodě vyskytovaly bakterie Mycoplasma hominis, Ureaplasma spp., Chlamydia trachomatis, Streptococcus mitis či Fusobacterium nucleatum [9]. Bylo objeveno, že exprese TLR2 na amniálních a deciduálních buňkách se signifikantně zvýšila při bakteriální či virové infekci u předčasných porodů ve srovnání s plodovými obaly bez infekce [15]. Egawa a kol. zkoumali přítomnost bakterií Ureaplasma urealyticum a Mycoplasma hominis v pupečníku u předčasně narozených dětí a pouze u 10 % z analyzovaných vzorků byla přítomna alespoň jedna z bakterií. Zároveň u těchto 10 % novorozenců byla potvrzena funisitida [11]. K invazi patogenů do pupečníku a rozsáhlé imunitní reakci dochází zřejmě jen v těch nejzazších případech. Tím by se mohla vysvětlit absence změn v koncentraci sTLR2 v pupečníkové krvi.
V neposlední řadě je potřeba zmínit možný vliv dávek kortikosteroidů na hladiny sTLR2 v pupečníkové krvi. Kortikosteroidy se využívají v porodnictví k indukci maturace plicní tkáně u nezralých plodů. Podávají se pacientkám v gestačním týdnu mladším než 33+6 [7]. Patří ovšem mezi imunosupresivní léky, jež potlačují produkci mnoha aktivačních molekul v imunitních buňkách a mohly by mít potenciální vliv na uvolňování sTLR2 [6]. K vyloučení vlivu dávek kortikosteroidů na koncentrace sTLR v pupečníkové krvi, byla provedena přídatná analýza dat (není zobrazeno). Nebyly nalezeny významné rozdíly v hladinách sTLR2 mezi pacientkami, kterým byly kortikosteroidy podány (gestační stáří ≤ 33+6), a těmi, které kortikosteroidy nedostaly (gestační stáří ≥ 34+0). Tato analýza porovnávala skupinu s HCA a skupinu bez přítomnosti HCA. Ve skupině s potvrzenou funisitidou analýza nemohla být provedena pro nízký počet vzorků.
Ač se nám nepodařilo potvrdit naši hypotézu o zvýšené koncentraci sTLR2 v pupečníkové krvi u žen postižených HCA a funisitidou, existují jiné markery, které by bylo možné použít k identifikaci zánětlivých změn. Například již zmíněný sCD163 nebo IL-6 a IL-8. Všechny tyto molekuly byly signifikantně zvýšené v pupečníkové krvi u pacientek s HCA a funisitidou oproti ženám bez známek zánětu [2, 24]. Hledání dalších ukazatelů zánětu u pacientek s PPROM touto neinvazivní metodou může napomoci včasné léčebné intervenci.
ZÁVĚR
Námi studovaný biomarker sTLR2 se vyskytoval ve všech analyzovaných vzorcích pupečníkové krve. Neprokázali jsme však změny v koncentraci sTLR2 v pupečníkové krvi při porovnání jeho hladin u žen s HCA nebo funisitidou.
Práce byla podpořena projektem „PRVOUK“, P37/10, Univerzity Karlovy v Praze, Lékařské fakulty UK v Hradci Králové a grantem NT13461-4/2012 IGA MZČR.
Mgr. Eva Mitášová
Ústav klinické imunologie a alergologie
Univerzita Karlova v Praze
LF a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: flidrova@lfhk.cuni.cz
Sources
1. Akira, S., Uematsu, S., Takeuchi, O. Pathogen recognition and innate immunity. Cell, 2006, 124, p. 783–801.
2. Andrys, C., Drahosova, M., Hornychova, H., et al. Umbilical cord blood concentrations of IL-6, IL-8, and MMP-8 in pregnancy complicated by preterm premature rupture of the membranes and histological chorioamnionitis. Neuro Endocrinol Lett, 2010, 31, p. 857–863.
3. Andrys, C., Kacerovsky, M., Drahosova, M., et al. Amniotic fluid soluble Toll-like receptor 2 in pregnancies complicated by preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med, 2012 [Epub ahead of print].
4. Arntzen, KJ., Kjøllesdal, AM., Halgunset, J., et al. TNF, IL-1,IL-6, IL-8 and soluble TNF receptors in relation to chorioamnionitis and premature labor. J Perinat Med, 1998, 26, p. 17–26.
5. Blencowe, H., Cousens, S., Oestergaard, MZ., et al. National, regional, and worldwide estimates of preterm birth rates in the year 2010 with time trends since 1990 for selected countries: a systematic analysis and implications. Lancet, 2012, 379, p. 2162–2172.
6. Blotta, MH., DeKruyff, RH., Umetsu, DT. Corticosteroids inhibit IL-12 production in human monocytes and enhance their capacity to induce IL-4 synthesis in CD4+ lymphocytes. J Immunol, 1997, 158, p. 5589–5595.
7. Brownfoot, FC., Crowther, CA., Middleton, P. Different corticosteroids and regimens for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database Syst Rev, 2008(4): p. CD006764.
8. Dessardo, NS., Mustać, E., Dessardo, S., et al. Chorioamnionitis and chronic lung disease of prematurity: a path analysis of causality. Am J Perinatol, 2012, 29, p. 133–140.
9. DiGiulio, DB., Romero, R., Amogan, HP., et al. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One, 2008, 3, p. e3056.
10. Dulay, AT., Buhimschi, CS., Zhao, G., et al. Soluble TLR2 is present in human amniotic fluid and modulates the intraamniotic inflammatory response to infection. J Immunol, 2009, 182, p. 7244–7253.
11. Egawa, T., Morioka, I., Morisawa, T., et al. Ureaplasma urealyticum and Mycoplasma hominis presence in umbilical cord is associated with pathogenesis of funisitis. Kobe J Med Sci, 2007, 53, p. 241–249.
12. Goldenberg, RL., Culhane, JF., Iams, JD., Romero R. Epidemiology and causes of preterm birth. Lancet, 2008, 371, p. 75–84.
13. Goldenberg, RL., Hauth, JC., Andrews, WW. Intrauterine infection and preterm delivery. N Engl J Med, 2000, 342, p. 1500–1507.
14. Gomez, R., Romero, R., Ghezzi, F., et al. The fetal inflammatory response syndrome. Am J Obstet Gynecol, 1998, 179, p. 194–202.
15. Hayati, AR., Mohamed, AE., Tan, GC. An immunohistochemical study of Toll-like receptors 2 and 4 in placenta with and without infection. Malays J Pathol, 2010, 32, p. 13–19.
16. Hermansen, MC., Hermansen, MG. Perinatal infections and cerebral palsy. Clin Perinatol, 2006, 33, p. 315–333.
17. Howman, RA., Charles, AK., Jacques, A., et al. Inflammatory and haematological markers in the maternal, umbilical cord and infant circulation in histological chorioamnionitis. PLoS One, 2012, 7, p. e51836.
18. Ilievski, V., Lu, SJ., Hirsch, E. Activation of toll-like receptors 2 or 3 and preterm delivery in the mouse. Reprod Sci, 2007, 14, p. 315–320.
19. Kacerovsky, M., Andrys, C., Drahosova, M., et al. Soluble Toll-like receptor 1 family members in the amniotic fluid of women with preterm prelabor rupture of the membranes. J Matern Fetal Neonatal Med, 2012, 25, p. 1699–1704.
20. Kacerovsky, M., Andrys, C., Hornychova, H., et al. Amniotic fluid soluble Toll-like receptor 4 in pregnancies complicated by preterm prelabor rupture of the membranes. J Matern Fetal Neonatal Med, 2012, 25, p. 1148–1155.
21. Kacerovsky, M., Drahosova, M., Andrys, C., et al. Amniotic fluid concentrations of soluble scavenger receptor for hemoglobin (sCD163) in pregnancy complicated by preterm premature rupture of the membranes and histologic chorioamnionitis.J Matern Fetal Neonatal Med, 2011, 24, p. 995–1001.
22. Kacerovský, M., Drahosová, M., Hornychová, H., et al. Amniotic fluid interleukin 6 levels in preterm premature rupture of membranes. Ces Gynekol, 2009, 74, p. 403–410.
23. Kacerovsky, M., Drahosova, M., Hornychova, H., et al. Value of amniotic fluid interleukin-8 for the prediction of histological chorioamnionitis in preterm premature rupture of membranes. Neuro Endocrinol Lett, 2009, 30, p. 733–738.
24. Kacerovsky, M., Drahosova, M., Hornychova, H., et al. Umbilical cord blood concentration of soluble scavenger receptor for hemoglobin, but not pentraxin 3, is of value for the early postpartum identification of the presence of histological chorioamnionitis. J Matern Fetal Neonatal Med, 2011, 24, p. 1228–1234.
25. Kacerovsky, M., Tosner, J., Drahosova, M., et al. Pentraxin 3 in amniotic fluid as a marker of intra-amniotic inflammation in women with preterm premature rupture of membranes. Int J Gynaecol Obstet, 2010, 108, p. 203–206.
26. Kim, SK., Romero, R., Chaiworapongsa, T., et al. Evidence of changes in the immunophenotype and metabolic characteristics (intracellular reactive oxygen radicals) of fetal, but not maternal, monocytes and granulocytes in the fetal inflammatory response syndrome. J Perinat Med, 2009, 37, p. 543–552.
27. Kim, YM., Romero, R., Chaiworapongsa, T., et al. Toll-like receptor-2 and -4 in the chorioamniotic membranes in spontaneous labor at term and in preterm parturition that are associated with chorioamnionitis. Am J Obstet Gynecol, 2004, 191, p. 1346–1355.
28. Kimbrell, DA, Beutler, B. The evolution and genetics of innate immunity. Nat Rev Genet, 2001, 2, p. 256–267.
29. King, AE., Kelly, RW., Sallenave, JM., et al. Innate immune defences in the human uterus during pregnancy. Placenta, 2007, 28, p. 1099–1106.
30. Kurokawa, K., Ryu, KH., Ichikawa, R., et al. Novel bacterial lipoprotein structures conserved in low-GC content gram-positive bacteria are recognized by Toll-like receptor 2. J Biol Chem, 2012, 287, p. 13170–1381.
31. LeBouder, E., Rey-Nores, JE., Rushmere, NK., et al. Soluble forms of Toll-like receptor (TLR)2 capable of modulating TLR2 signaling are present in human plasma and breast milk. J Immunol, 2003, 171, p. 6680–6689.
32. Liang, F., Huang, N., Wang, B. Human toll like receptor gene expression in human pulmonary granule epithelial cells and umbilical vein endothelial cells. Hua Xi Yi Ke Da Xue Xue Bao, 2001, 32, p. 516–518.
33. Liew, FY., Xu, D., Brint, EK., O‘Neill, LA. Negative regulation of toll-like receptor-mediated immune responses. Nat Rev Immunol, 2005, 5, p. 446–458.
34. Lindström, TM., Bennett, PR. The role of nuclear factor kappa B in human labour. Reproduction, 2005, 130, p. 569–581.
35. López, MC., Palmer, BE., Lawrence, DA. Phenotypic diffe-rences between cord blood and adult peripheral blood. Cytometry B Clin Cytom, 2009, 76, p. 37–46.
36. Murphy, SP., Hanna, NN., Fast, LD., et al. Evidence for participation of uterine natural killer cells in the mechanisms responsible for spontaneous preterm labor and delivery. Am J Obstet Gynecol, 2009, 200, p. 308.e1–9.
37. Osterholt, HC., Lundeland, B., Sonerud, T., et al. The impact of hyaluronan on monocyte Toll-like receptor expression in term infant cord blood. Acta Paediatr, 2012, 101, p. 706–713.
38. Patni, S., Synem, LP., Sester, AL., et al. Expression and Activity of Toll-Like Receptors 1–9 in the Human Term Placenta and Changes Associated with Labor at Term. Biol Reprod, 2009, 80, p. 243–248.
39. Piccinini, AM., Midwood, KS. DAMPening inflammation by modulating TLR signalling. Mediators Inflamm, 2010, p. 1–21.
40. Raby, AC., Le Bouder, E., Colmont, C., et al. Soluble TLR2 reduces inflammation without compromising bacterial clearance by disrupting TLR2 triggering. J Immunol, 2009, 183, p. 506–517.
41. Ray, A., Cot, M., Puzo, G., et al. Bacterial cell wall macroamphiphiles: Pathogen-/microbe-associated molecular patterns detected by mammalian innate immune system. Biochimie, 2013, 95, p. 33–42.
42. Romero, R., Espinoza, J., Goncalves, LF., et al. The role of inflammation and infection in preterm birth. Semin Reprod Med, 2007, 25, p. 21–39.
43. Romero, R., Gotsch, F., Pineles, B., Kusanovic JP. Infla-mmation in pregnancy: its roles in reproductive physiology, obstetrical complications, and fetal injury. Nutr Rev, 2007, 65, p. S194–202.
44. Sadeghi, K., Berger, A., Langgartner, M., et al. Immaturity of infection control in preterm and term newborns is associated with impaired toll-like receptor signaling. J Infect Dis, 2007, 195, p. 296–302.
45. Salafia, CM., Weigl, C., Silberman, L. The prevalence and distribution of acute placental inflammation in uncomplicated term pregnancies. Obstet Gynecol, 1989, 73, p. 383–389.
46. Satar, M., Turhan, E., Yapicioglu, H., et al. Cord blood cytokine levels in neonates born to mothers with prolonged premature rupture of membranes and its relationship with morbidity and mortality. Eur Cytokine Netw, 2008, 19, p. 37–41.
47. Schwandner, R., Dziarski, R., Wesche, H., et al. Peptidoglycan - and lipoteichoic acid-induced cell activation is mediated by toll-like receptor 2. J Biol Chem, 1999, 274, p. 17406–17409.
48. Shen, CM., Lin, SC., Niu, DM., Kou, YR. Labour increases the surface expression of two Toll-like receptors in the cord blood monocytes of healthy term newborns. Acta Paediatr, 2009, 98, p. 959–962.
49. Smith, R. Parturition. N Engl J Med, 2007, 356, p. 271–283.
50. Smulian, JC., Shen-Schwarz, S., Vintzileos, AM., et al. Clinical chorioamnionitis and histologic placental inflammation. Obstet Gynecol, 1999, 94, p. 1000–1005.
51. Srinivasan, M., Kodumudi, KN., Zunt, SL. Soluble CD14 and toll-like receptor-2 are potential salivary biomarkers for oral lichen planus and burning mouth syndrome. Clin Immunol, 2008, 126, p. 31–37.
52. Takeda, K., Akira, S. Toll-like receptors in innate immunity. Int Immunol, 2005, 17, p. 1–14.
53. Takeuchi, O., Kawai, T., Mühlradt, PF., et al. Discrimination of bacterial lipoproteins by Toll-like receptor 6. Int Immunol, 2001, 13, p. 933–940.
54. Takeuchi, O., Sato, S., Horiuchi, T., et al. Cutting edge: role of Toll-like receptor 1 in mediating immune response to microbial lipoproteins. J Immunol, 2002, 169, p. 10–14.
55. Terai, K., Mochizuki, N. Heat shock proteins regulates cardiomyocytes via Toll-like receptors. Circ J, 2011, 75, p. 2322–2323.
56. Tutdibi, E., Hunecke, A., Lindner, U., et al. Levels of cytokines in umbilical cord blood in relation to spontaneous term labor. J Perinat Med, 2012, 40, p. 527–532.
57. Velemínský, M., Tosner, J. Relationship of vaginal microflora to PROM, pPROM and the risk of early-onset neonatal sepsis. Neuro Endocrinol Lett, 2008, 29, p. 205–221.
58. Wypych, J., Bennett, LG., Schwartz, MG., et al. Soluble kit receptor in human serum. Blood, 1995, 85, p. 66–73.
59. Yoon, BH., Romero, R., Shim, JY., et al. C-reactive protein in umbilical cord blood: a simple and widely available clinical method to assess the risk of amniotic fluid infection and funisitis.J Matern Fetal Neonatal Med, 2003, 14, p. 85–90.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 4-
All articles in this issue
- Nepenetrující poranění močového měchýře při antiinkontinenční operaci (TVT)
- Profylaktické užití antiinfekčních léčiv v gynekologii
- Solubilní Toll-like receptor 2 v pupečníkové krvi u těhotenství komplikovaných předčasným odtokem plodové vody
- Rýchla detekcia najbežnejších chromozómových aneuploídií z plodovej vody v druhom trimestri tehotnosti využitím QF-PCR
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
- Léčba noční polyurie desmopresinem
- Aktuální otázky asistované reprodukce v České republice
- Teoretická a praktická náplň oboru klinická embryologie
- Gynekologicko-porodnická klinika FNKV před padesáti lety a dnes
- Diagnostika minimálních karcinomů prsní žlázy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Spolupráce mamologa a radiodiagnostika při managementu mamárních lézí ve FNKV
- Retrospektivní analýza efektivity diagnostiky ektopické gravidity transvaginálním ultrazvukovým vyšetřením
- Význam stanovování cirkulujících nádorových buněk v diagnostickém a léčebném procesu u karcinomu ovaria
- Postavení cílené léčby v managementu ovariálního karcinomu
- Melanom vulvy
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Melanom vulvy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Léčba noční polyurie desmopresinem
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

