-
Medical journals
- Career
Rýchla detekcia najbežnejších chromozómových aneuploídií z plodovej vody v druhom trimestri tehotnosti využitím QF-PCR
Authors: I. Švecová 1*; T. Burjanivová 2*; J. Kršiaková 3; Z. Lasabová 2; K. Biringer 1; I. Kapustová 1; P. Móricová 1; J. Danko 1
Authors‘ workplace: Autori prispeli k práci rovnakým podielom *; Gynekologicko-pôrodnícka klinika JLF UK a UNM, Martin, prednosta prof. MUDr. J. Danko, CSc. 1; Ústav molekulovej biológie JLF UK a UNM, Martin-Vrútky, prednostka doc. RNDr. Z. Lasabová, PhD. 2; Oddelenie lekárskej genetiky UNM, Martin, primárka MUDr. J. Kršiaková 3
Published in: Ceska Gynekol 2013; 78(4): 373-378
Overview
Cieľ štúdie:
Zavedenie metodiky QF-PCR pre detekciu najčastejšie sa vyskytujúcich chromozómových (trizómia 21, 18 a 13) a gonozómových aberácií na našom pracovisku z plodovej vody získanej pri amniocentéze v druhom trimestri. Overenie hypotézy možnosti detekcie chromozómových aberácií použitím STR markerov kitu Aneufast analýzou voľnej fetálnej DNA (ffDNA) izolovanej z plazmy matky s plodom postihnutým trizómiou 21.Typ štúdie:
Prospektívna klinická štúdia.Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika Jesseniovej lekárskej fakulty Univerzity Komenského a Univerzitnej Nemocnice Martin, Slovenská republika.Metodika:
Vzorky plodovej boli získané od 67 žien (3 prípady dvojplodovej tehotnosti) v druhom trimestri gravidity (15. až 22. týždeň tehotnosti (t.t.)) boli vyšetrené multiplexnou QF-PCR kitom Aneufast a v prípade pozitivity pre trizómiu 21 aj kitom Devyser Resolution 21. Všetky vzorky boli zároveň vyšetrené konvenčnou cytogenetickou karyotypizáciou. Analýza ffDNA kitom Aneufast z plazmy 3 vysokorizikových žien odobratej v druhom trimestri (17. až 21. t.t.) prebehla po izolácii ffDNA kitom QIAamp DSP VirusKit. Trizómia 21 bola u týchto plodov potvrdená karyotypizáciou amniocytov v druhom trimestri.Výsledky:
V súbore 70 vzoriek vyšetrenom pomocou QF-PCR bolo celkovo zachytených 7 patologických vzoriek z toho 6 trizómií 21 a 1 trizómia 18. U všetkých vzoriek vyšetrených metódou QF-PCR došlo ku 100% zhode s výsledkami cytogenetickej karyotypizácie. V prípade analýzy ffDNA nedošlo ku dostatočnej a teda interpretovateľnej amplifikácii potrebných úsekov chromozómu 21.Záver:
QF-PCR sa ukázala ako spoľahlivá, rýchla, pomerne jednoduchá a finančne prijateľná metodika prenatálnej diagnostiky. Napriek dostupnosti a dobrému zavedeniu práce s kitom Aneufast, výsledky analýzy ffDNA nie sú uspokojivé. Vyšetrením ffDNA izolovanej z plazmy 3 žien s plodmi s trizómiou 21 sme nezískali interpretovateľné výsledky.Kľúčové slová:
aneuploídie – QF-PCR – prenatálna diagnostika – STR – ffDNAÚVOD
Konvenčne využívanou metódou stanovenia karyotypu plodu u žien so zvýšeným rizikom chromozómovej aberácie je cytogenetická karyotypizácia, ktorá využíva invazívne získaný genetický materiál pri CVS (biopsia choriových klkov), AMC (amniocentéza), resp. pri kordocentéze. V posledných rokoch sa čoraz viac dostávajú do popredia metódy molekulovej biológie – FISH (fluorescenčná in situ hybridizácia) a QF-PCR (kvantitatívna fluorescenčná polymerázová reťazová reakcia). Ich výhoda spočíva predovšetkým v rýchlom získaní výsledkov. Najnovšie používanou metódou a predmetom vedeckého záujmu je neinvazívne prenatálne testovanie (NIPT), tzn. analýza voľnej fetálnej DNA (ffDNA) v plazme, resp. sére matky za účelom stanovenia prítomnosti chromozómovej aberácie u plodu. Jeden zo skúmaných prístupov ffDNA je rovnako ako pri vyšetrovaní amniocytov pomocou QF-PCR, analýza STR (short-tandem repeat) lokusov chromozómov najčastejšie zodpovedných za vznik aberácií (21,18,13, X a Y).
Od roku 1980 je možné rutinne vyšetrovať fetálny karyotyp z amniocytov získaných prostredníctvom amniocentézy. Kultivácia a následná karyotypizácia trvá priemerne 3–4 týždne. Tento interval bol skrátený na 2 týždne vďaka progresii cytogenetických technológií, napr. vylepšením kvality kultivačných médií. Aj napriek týmto úspechom sú dva týždne veľmi dlhá doba pre tehotnú ženu, ktorá trpí psychologickým distresom. Tento fakt bol príčinou hľadania rýchlejšieho získavania výsledkov, čo viedlo k zavedeniu metód molekulovej biológie, a teda aj kvantitatívnej polymerázovej reťazovej reakcie (QF-PCR) v prípade invazívnych vyšetrovacích techník. Výsledky analýzy karyocytov použitím QF-PCR je možné získať za 24–48 hodín [1]. Princípom QF-PCR je amplifikácia chromozómovo špecifických polymorfizmov použitím fluorescenčne značených primerov s následnou kvantitatívnou analýzou produktov za účelom určiť presný počet ich kópií. V prípade heterozygotného mikrosatelitného markeru určuje pomer vrcholov jednotlivých alel dizómiu (1 : 1) alebo trizómiu (2 : 1, 1 : 2 alebo 1 : 1:1) pre vyšetrovaný chromozóm (obr. 1). Vyšetrenie nie je informatívne v prípade, ak je zaznamenaný len jeden alelický vrchol. Pri detekcii každého chromozómu je použitých viacero markerov, ktoré sú koamplifikované v multiplexovej reakcii, pričom markery sú rozložené po celom chromozóme za účelom zvýšenia šance záchytu génovej disbalancie. Obmedzenie QF-PCR spočíva v prípade prítomnosti zriedkavých, avšak možných štrukturálnych zmien v iných chromozómoch ako v tých, na ktoré je použitý kit zameraný.
Image 1. Výsledky QF-PCR plodovej vody u plodu postihnutého trizómiou 18 – Edwardsov syndróm; a) marker D18S39133662 dialelická trizomická vzorka 2:1; b) marker D18S49943354 trialelická trizomická vzorka 1:1:1 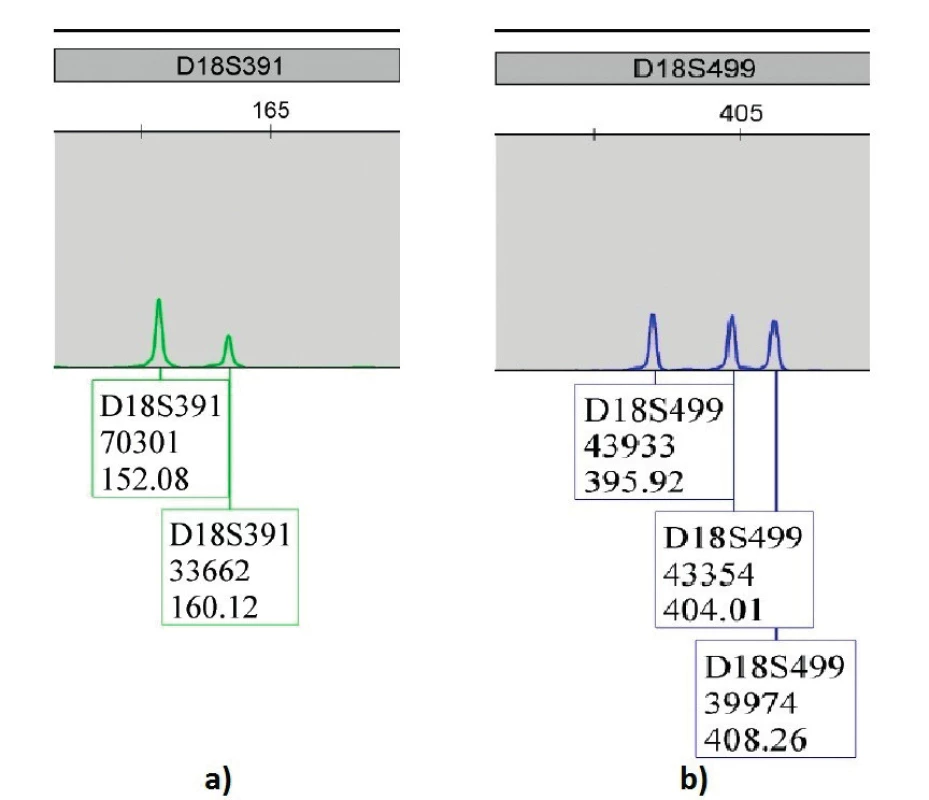
SÚBOR A METODIKA
Materiálom pre vyšetrovanie trizómie 13, 18 a 21 a stanovenie gonozómového statusu plodu boli vzorky plodovej vody od 67 žien (priemerný vek bol 34,3 r.) v druhom trimestri gravidity (15.–22. t.t.) odoslaných na invazívne prenatálne vyšetrenie po podpísaní informovaného súhlasu. Štúdia bola schválená Etickou komisiou Jesseniovej lekárskej fakulty Univerzity Komenského (EK 566/2009). Všetkých 70 vzoriek (v troch prípadoch išlo o dvojplodovú tehotnosť) boli okrem multiplexnejQF-PCR vyšetrené aj konvenčnou cytogenetickou karyotypizáciou.
Multiplex QF – PCR
Pre izoláciu DNA z plodovej vody bol použitý izolačný kit DNeasy Blood&TissueKit (Qiagen). Na detekciu aneuploídií sme použili kit Aneufast (Genomed AG, CH). Pre potvrdenie a overenie výsledkov v prípade pozitívneho výsledku v zmysle trizómie chromozómu 21 sme použili kit Devyser Resolution 21 (Devyser AB).
Pri použití kitu Aneufast prebiehala detekcia v dvoch multiplexových reakciách zahŕňajúcich STR markery chromozómov 13, 18, 21 a markery chromozómov X a Y. Multiplex S1 kitu Aneufast zahŕňa STR markery D21S1414, D21S1446, D21S1442, D18S535, D18S391, D18S976, D13S797, D13S631, D13S305 a lokusy zahŕňajúce gonozómy AMXY a DXYS267. Multiplex S2 kitu Aneufast obsahuje STR markery D21S1411, D21S1435, D13S634, D13S258, D18S386, D18S390 a markery SRY, X22, DXYS218 a HPRT na pohlavných chromozómoch.
Amplifikácia pri použití kitu Devyser Resolution 21 prebiehala v jednej skúmavke. Súprava obsahuje 9 STR markerov: D21S1435, D21S11, D21S1411, D21S1444, D21S2039, D21S1412, D21S1446, D21S1442, D21S1437.
Analýza a kapilárna elektroforéza
Vzorky sme separovali pomocou genetického analyzátora ABI PRISM 3500 Genetic Analyser v separačnom polymére a kapiláre dlhej 50 cm. Ku vzorkám sme pridali veľkostný štandard GeneScan-500 LIZ (Applied Biosystems) a denaturovali sme ich v Hi-Di (highly deionized) formamide. Podmienky kapilárnej elektroforézy pre kit Aneufast boli: 60 oC teplota gélu, konštantný nástrek 8 s, napätie behu 19 500 V a trvanie elektroforézy 23 minút. Podmienky kapilárnej elektroforézy pre kit Devyser boli: 60 oC teplota gélu, konštantný nástrek 15 s, napätie behu 19 500 V a trvanie elektroforézy 25 minút. Výsledky sme analyzovali pomocou softvéru GeneMapper Software v4.1(Applied Biosystems).
Izolácia a pokus o analýzu voľnej fetálnej DNA (ffDNA)
Na základe publikácie autorov Garfa a kol. [2], v ktorej boli uverejnené výsledky detekcie trizómie 21 z plazmy matky na základe analýzy ffDNA použitím kitu Aneufast sme sa pokúsili o reprodukciu tejto metodiky.
Analyzovali sme vzorky plazmy 3 žien so suspektným sonografickým nálezom alebo pozitívnym biochemickým skríningom, u ktorých bola trizómia plodu potvrdená cytogenetickou karyotypizáciou amniocytov po druhotrimestrovej AMC. Krvné vzorky odobraté počas 2. trimestra(17.–21. t.t.) boli v jednom prípade odobraté pred, v ďalších dvoch prípadoch po vykonaní AMC. Voľná fetálna DNA bola v týchto prípadoch izolovaná z plazmy pomocou QIAamp DSP Virus kitu (Qiagen).
VÝSLEDKY
Celkovo bolo vyšetrených 70 vzoriek. Dve vzorky boli silne kontaminované krvou matky a nebolo možné vyšetrenie STR u oboch rodičov. V analyzovanom súbore (68 vzoriek) sme dosiahli 100% konkordantné výsledky pri určovaní prítomnosti trizómií s cytogenetickou karyotypizáciou (tab. 1).
Table 1. Rozdelenie a zastúpenie jednotlivých patológií vo vyšetrovanom súbore potvrdených QF-PCR a karyotypizáciou zhodne v 100 % prípadov 
V tabuľke 2 sú uvedené indikácie, ktoré viedli ku vykonaniu druhotrimestrovej AMC. Najčastejšou indikáciou bol pozitívny biochemický skríning u 27 žien. Nasledovala veková indikácia (19 žien), pozitívny sonografický nález (8 žien) a pozitívna rodinná anamnéza spolu s výskytom chromozómovej aberácie v predchádzajúcej tehotnosti (6 žien). V súbore vyšetrenom pomocou QF-PCR bolo celkovo zachytených 7 patologických vzoriek, z toho 6 trizómií 21 a 1 trizómia 18. Vzorky, v ktorých bola kitom Aneufast potvrdená trizómia 21, boli následne vyšetrené kitom Devyser Resolution 21. U všetkých 6 vzoriek došlo ku zhode. U všetkých vzoriek vyšetrených metódou QF-PCR došlo ku 100% zhode s výsledkami cytogenetickej karyotypizácie.
Table 2. Prehľad indikácií vedúcich k vykonaniu AMC a zachytených patológií 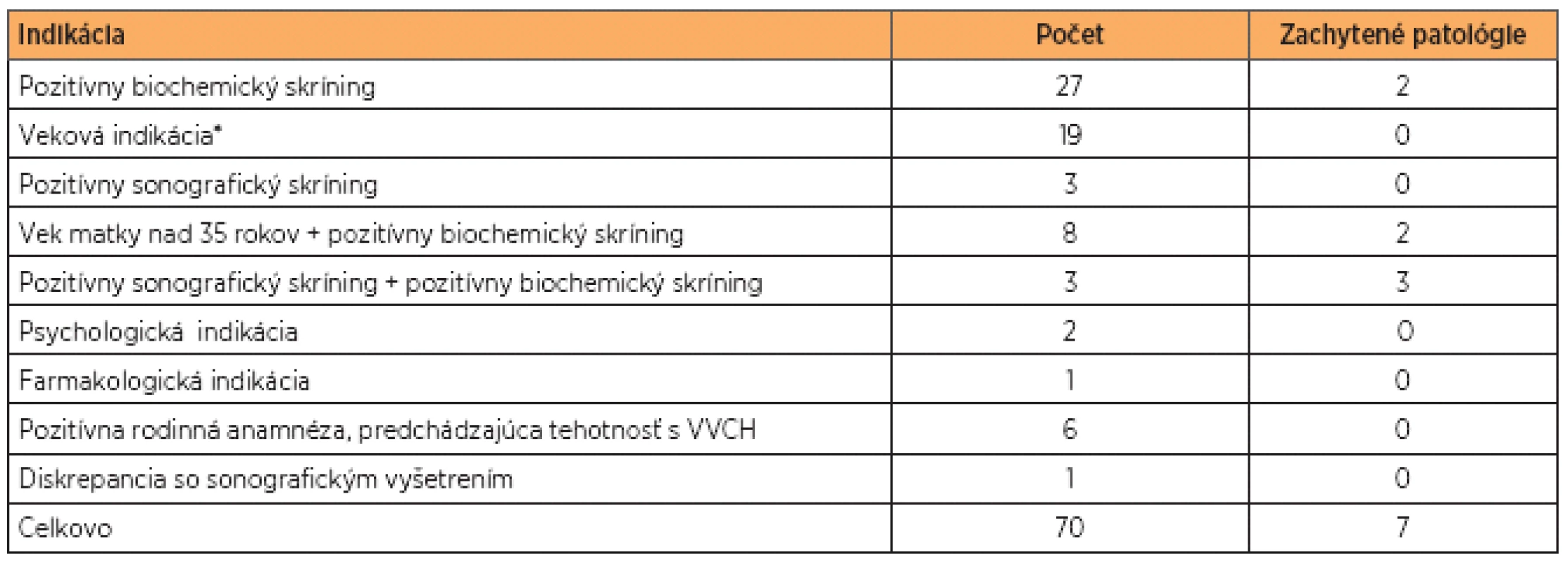
* Veková indikácia sa podľa usmernení Slovenskej spoločnosti lekárskej genetiky vzťahuje na ženy, u ktorých riziko VVCH plodu vyplývajúce čisto z veku matky je ≤1:250. (VVCH – vrodená vývinová chyba). V prípade získania neinformatívnych výsledkov (tzn. prítomnosť STR markerov v homozygotnom stave) boli na ďalšie vyšetrovanie použité „back-up“ mixy, ktorých zloženie je uvedené v tabuľke 3.
Table 3. Jednotlivé markery zahrnuté v chromozóm-špecifických „back-up“ mixoch kitu Aneufast 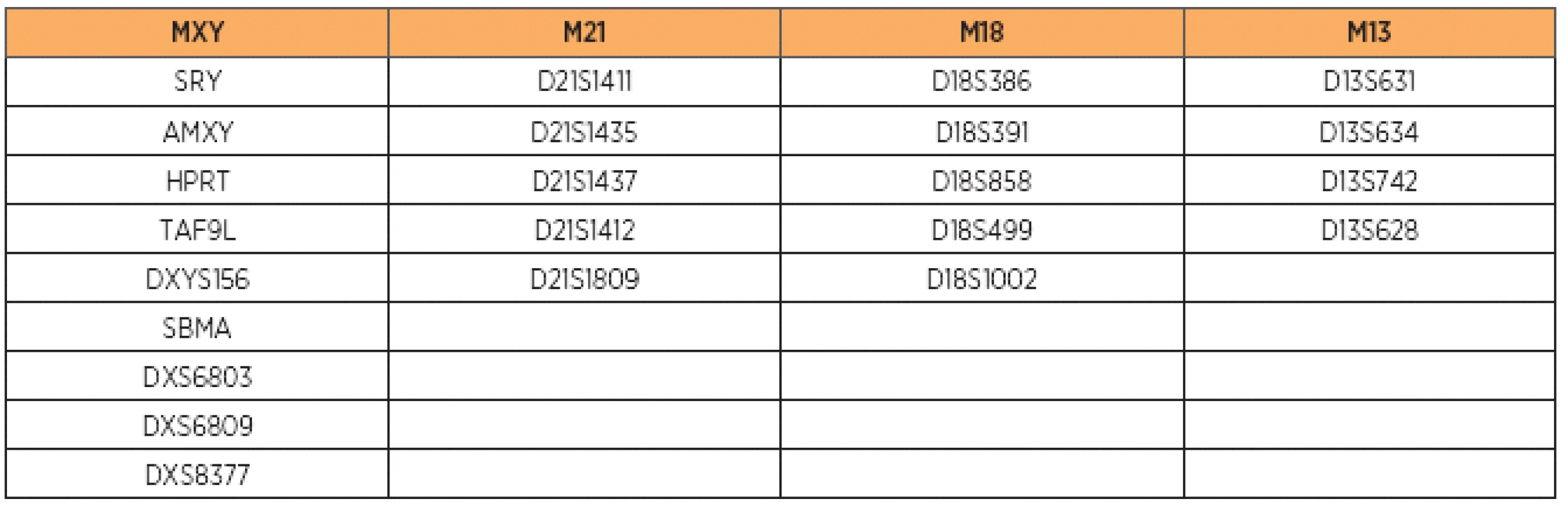
Napriek dostupnosti a dobrému zavedeniu práce s kitom Aneufast výsledky analýzy ffDNA nie sú uspokojivé. Vyšetrením ffDNA izolovanej z plazmy troch žien s plodmi s trizómiou 21 sme nezískali interpretovateľné výsledky. Nedošlo ku dostatočnej amplifikácií všetkých sledovaných lokusov a nebolo možné spoľahlivo odlíšiť fetálnu DNA od materskej DNA (obr. 2, 3). Príčin môže byť mnoho, predovšetkým silná kontaminácia materskou DNA.
Image 2. Analýza fetálnej DNA izolovanej z plazmy matky s potvrdenou trizómiou 21 u plodu (vzorka 9). Vzorku nie je možné vyhodnotiť, signál je na úrovni pozadia 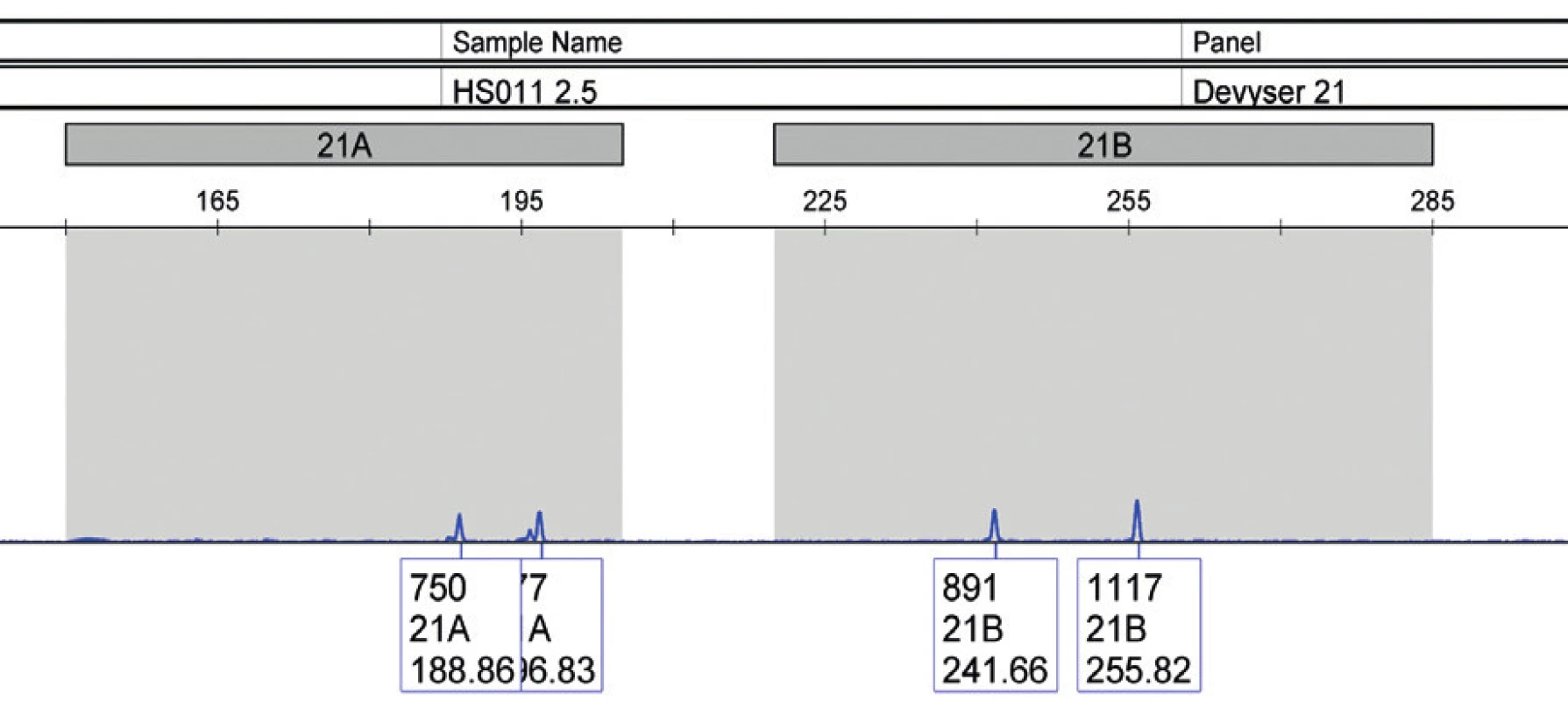
Image 3. Vzorka plodovej vody (vzorka 9), jasne potvrdená trizómia 21 u plodu 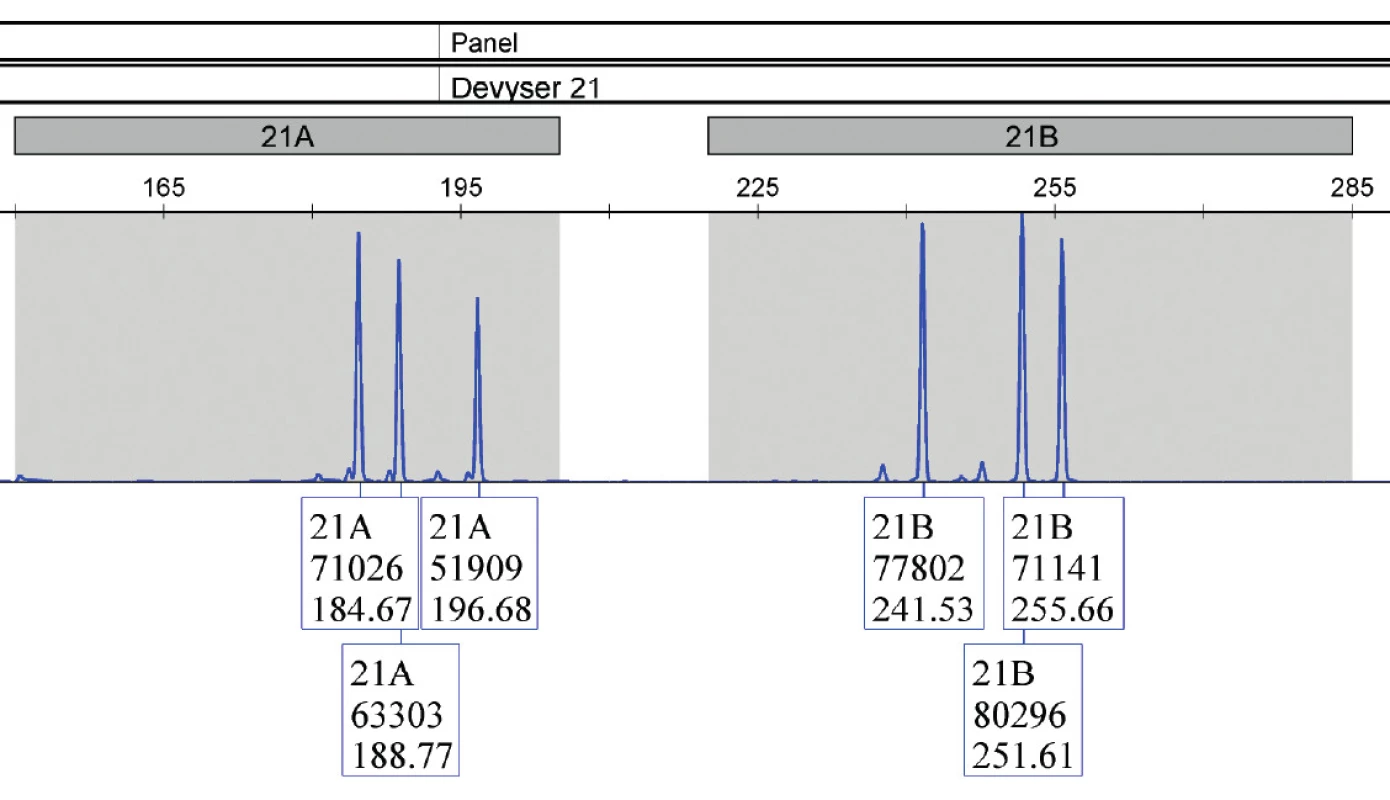
DISKUSIA
Najväčšími výhodami použitia QF-PCR pri detekcii najčastejších aneuploídií (trizómie 21, 18, 13 a gonozómové aberácie) z plodovej vody sú: malé množstvo plodovej vody postačujúce na analýzu, nevzniká potreba kultivácie amniocytov, rýchlosť získania výsledkov skôr ako za 24 hodín a taktiež „cost–effectivness“. Toto vyšetrenie by malo byť rutinnou súčasťou algoritmu prenatálnej diagnostiky na každom väčšom pracovisku vykonávajúcom invazívne prenatálne vyšetrenia. Práve z tohto dôvodu sme sa rozhodli túto metodiku zaviesť aj na Gynekologicko-pôrodníckej klinike JLF UK a UNM, čo bolo možné vďaka grantovej podpore. V porovnaní s ostatnými technikami (napr.: FISH alebo „multiple ligation – dependent probe amplification“) je detekcia kontaminácie materskými bunkami najpodstatnejším krokom. Pri prítomnosti erytrocytov, resp. iného materského materiálu vo vyšetrovanej vzorke je potrebné paralelne vyšetriť DNA plodu, matky a jeho biologického otca s použitím vhodných STR markerov. Z hodnotenej vzorky je následne možné vylúčiť prímes maternálnych alel použitím kvantifikačnej analýzy [9]. V našom prípade sme kontaminované vzorky ďalšej analýze nepodrobili. Nevýhodou QF-PCR je nezachytenie štrukturálnych aberácií a odchýlok mimo vybraných lokusov.
Až 27 % z pacientok v našom súbore odoslaných na invazívnu genetickú diagnostiku (IGD) tvoria pacientky s „vekovou indikáciou“. V minulosti boli na IGD odosielané ženy, ktoré dosiahli v čase tehotnosti vek vyšší ako 35 rokov (bez pridružených indikácií). Vzhľadom na nízky výskyt VVCH plodu v tejto skupine boli kritériá prehodnotené a hranica pre IGD sa na základe odporúčania Slovenskej spoločnosti lekárskej genetiky posunula na 37 rokov (samotné riziko VVCH dosahuje 1 : 250). V našej kohorte sme v tejto skupine nezachytili ani jednu VVCH plodu, v prípade kombinovanej indikácie (vek+pozitívny biochemický skríning) sme v osemčlennom súbore zachytili 2 aneuploídie (tzn. 25 %). Aj naše výsledky potvrdili, že čisto veková indikácia je diskutabilná z pohľadu pomeru benefitu a rizika vyplývajúceho pre plod a matku, je potrebné túto indikáciu v každom prípade dôkladne zvážiť a poučiť pacientku o možných rizikách a komplikáciách vyplývajúcich z IGD.
Hypotéza potvrdená v práci Garfa a kol. [2] nás viedla ku izolácii a následnej analýze ffDNA z plazmy matky. Na našom pracovisku sme v predchádzajúcich rokoch úspešne zaviedli neinvazívnu prenatálnu detekciu pohlavia plodu [3] a Rh statusu plodu [4], spolu s kvantifikáciou ffDNA [7]. Napriek správne vykonanej izolácii nedošlo ku dostatočnej amplifikácií všetkých sledovaných lokusov a nebolo možné spoľahlivo odlíšiť ffDNA od materskej DNA. Príčin môže byť mnoho, predovšetkým silná kontaminácia materskou DNA, parciálna degradácia už a priori malého množstva DNA a malá dĺžka fragmentov ffDNA (cca 193 bázových párov), ktorá je menšia ako produkty amplifikované použitými markermi.
Budúcnosťou detekcie najčastejších chromozómových aberácií je neinvazívne prenatálne testovanie (NIPT). Výhodou a dôvodom rýchleho rozvoja metodík v tomto smere je neinvazivita, tzn. odbúranie rizika spojeného s invazívnym získaním materiálu plodu postačujúceho na genetickú analýzu. Súčasné metódy využívajú ffDNA, ale taktiež voľnú fetálnu RNA (ffRNA).
Niektoré prístupy sa zamerali na chemické (metylačný status), resp. fyzikálne (veľkosť fragmentov) rozdiely medzi fetálnymi a maternálnymi nukleovými kyselinami. Jednou z týchto metód, vďaka ktorej bolo možné úspešne stanoviť prítomnosť plodu s aneuploídiou, je imunoprecipitácia hypermetylovanej DNA (MeDIP) nasledovaná tzv. realtime-PCR, počas ktorej dôjde ku kvantifikácii sekvencií charakteristických pre 21. chromozóm [8].
Ďalší z prístupov využíva RNA a heterozygotné jednonukleotidové polymorfizmy (SNP) prítomné v génoch vyskytujúcich sa len u plodu. Priamou detekciou RNA transkriptov chromozómu 21 je možné stanovenie pomeru alel (tzv. „allelic ratio“). Ten je u zdravého plodu 1 : 1, u plodu s trizómiou 2 : 1, resp. 1 : 2. Obmedzením tejto metódy je výber polymorfizmov, ktoré musia byť heterozygotné, a alely musia byť na podobnej úrovni sily expresie [6]. Momentálne sú v klinickej praxi používané metódy masívnej paralelnej sekvenácie (MPS), pri ktorých sa počítajú buď všetky informatívne sekvencie (tzv. „shotgun“ MPS) alebo len vybrané chromozómové sekvencie (tzv. „targeted“ MPS) [5].
Vyvíja sa metóda, ktorá využíva SNP prítomné na sekvenovanej DNA. Posúdením pomerov alel u mnohých úzko prepojených lokusov je možné posúdiť prítomnosť aneuploídie u plodu. Vďaka tomuto postupu by v budúcnosti malo byť možné i posúdenie prítomnosti monogénových porúch.
ZÁVER
Použitie QF-PCR na analýzu plodovej vody sa ukázalo ako spoľahlivá, rýchla, pomerne jednoduchá a finančne prijateľná metodika prenatálnej diagnostiky. Napriek dostupnosti a dobrému zavedeniu práce s kitom Aneufast, sa nám nepodarilo zreprodukovať metódu podľa Garfa a kol. [2] a výsledky analýzy ffDNA nie sú uspokojivé. Stanovenie prítomnosti aneuploídie plodu v plazme matky použitím STR markerov (kit Aneufast) sa ukazovalo ako veľmi výhodná a finančne perspektívna alternatíva.
Táto práca bola podporená grantom doktoranda Univerzity Komenského OPV – 26110230031/08/D/2010, projektom „Dobudovanie Centra excelentnosti pre perinatologický výskum (CEPV II)“, ITMS: 26220120036, ktorý je spolufinancovaný zo zdrojov EÚ, grantom MZ SR č.2007/60-MFN-03 a projektom APVV-0315-11.
MUDr. Iveta Švecová
Gynekologicko-pôrodnícka klinika
JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: ivetasvecova@gmail.com
Sources
1. Dudarewicz, L., Holzgreve, W., Jeziorowska, A., et al. Molecular methods for rapid detection of aneuploidy. J Appl Genet, 2005, 46, p. 207–215.
2. Garfa, WE., Osama, MA., Tamer, FT., et al. Non invasive prenatal screening of fetal aneuploidies by quantitative fluorescence PCR: evaluation of the in-vitro diagnostic test kit ‘Aneufast’ for plasma cell-free fetal DNA. Med Res J, 2011, 10(2), p. 49–52.
3. Hudecová, I., Haško, M., Švecová, I., et al. Detection of fetal Y-specific DNA markers in maternal plasma. Folia Medica Cassoviensia, 2011, 66(1), p. 76.
4. Lasabová, Z., Švecová, I., Hudecová, I., et al. Our experience with the prediction of fetal RhD in maternal plasma of D negative women from the region of Northern Slovakia. Biomed Pap Med Fac Univ Palacky, 2012, 156(2), p. 5111.
5. Lo, YMD., Lun, FMF., Chan, KCA., et al. Digital PCR for the molecular detection of fetal chromosomal aneuploidy. Proc Natl Acad Sci USA, 2007, 104, p. 13116–13121.
6. Lo, YMD., Tsui, NB., Chiu, RW., et al. Plasma placental RNA allelic ratio permits non invasive prenatal chromosomal aneuploidy detection. Nat Med, 2007, 13, p. 218–223.
7. Švecová, I., Haško, M., Mendelová, A., et al. Association of free fetal DNA levels with hypertensive disorders in pregnancy – preliminary results. Int J Gynecol Obstet, 2012, 119(3), p. 784.
8. Tsui, DW., Lam, YM., Lee, WS., et al. Systematic identification of placental epigenetic signatures for the noninvasive prenatal detection of Edwards syndrome. Plo Sone, 2010, 5, p. 15069.
9. Vrbická, D., Vodička, R., Vrtěl, R., et al. Rychlá detekce nejčastejších chromozomálních aneuploídií metodou multiplex QF-PCR v prvním trimestru gravidity. Čes Gynek, 2006, 71(4), s. 280–284.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 4-
All articles in this issue
- Nepenetrující poranění močového měchýře při antiinkontinenční operaci (TVT)
- Profylaktické užití antiinfekčních léčiv v gynekologii
- Solubilní Toll-like receptor 2 v pupečníkové krvi u těhotenství komplikovaných předčasným odtokem plodové vody
- Rýchla detekcia najbežnejších chromozómových aneuploídií z plodovej vody v druhom trimestri tehotnosti využitím QF-PCR
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
- Léčba noční polyurie desmopresinem
- Aktuální otázky asistované reprodukce v České republice
- Teoretická a praktická náplň oboru klinická embryologie
- Gynekologicko-porodnická klinika FNKV před padesáti lety a dnes
- Diagnostika minimálních karcinomů prsní žlázy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Spolupráce mamologa a radiodiagnostika při managementu mamárních lézí ve FNKV
- Retrospektivní analýza efektivity diagnostiky ektopické gravidity transvaginálním ultrazvukovým vyšetřením
- Význam stanovování cirkulujících nádorových buněk v diagnostickém a léčebném procesu u karcinomu ovaria
- Postavení cílené léčby v managementu ovariálního karcinomu
- Melanom vulvy
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Melanom vulvy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Léčba noční polyurie desmopresinem
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

