-
Medical journals
- Career
3D MR-based brachyterapie v léčbě lokálně pokročilého karcinomu děložního hrdla – časné klinické výsledky
Authors: M. Doležel 1,2,5; J. Vaňásek 1; K. Odrážka 1,2; T. Kroulík 1; K. Kudelka 1; M. Tichý 3; M. Košťál 3; Z. Vocásek 4
Authors‘ workplace: KOC, Pardubická krajská nemocnice, a. s., a Multiscan, s. r. o., Pardubice, primář doc. MUDr. J. Vaňásek, CSc. 1; 1. lékařská fakulta, Univerzita Karlova, Praha 2; Porodnicko-gynekologické oddělení, Pardubická krajská nemocnice, a. s., Pardubice 3; Porodnicko-gynekologické oddělení, Masarykova městská nemocnice v Jilemnici, Jilemnice 4; Onkologická klinika, FN, Olomouc 5
Published in: Ceska Gynekol 2012; 77(6): 507-513
Overview
Cíl studie:
Stanovit klinický význam MR-based brachyterapie využívající fúzi CT a MR obrazů.Typ studie:
Klinická studie.Název a sídlo pracoviště:
KOC, Pardubická krajská nemocnice, a.s., a Multiscan, s.r.o., Pardubice.Metodika:
Pomocí MR-based brachyterapie bylo léčeno 36 pacientek s lokálně pokročilým karcinomem (15 technikou MR-based preplanning, 21 s MR aproximací). Všechny pacientky byly sledovány v průběhu léčby i po jejím ukončení. Při každé vizitě byla hodnocena kontrola nemoci i toxicita léčby. Pozdní gastrointestinální i genitourinární symptomy byly klasifikovány pomocí Fox Chase (FC) modification of the Radiation Therapy Oncology Group (RTOG) and Late Effects Normal Tissue Task Force (LENT) toxicity criteria.Výsledky:
V průběhu procedury na MR nebyla pozorována žádná komplikace. Kumulativní incidence genitourinární a gastrointestinální toxicity druhého a vyššího stupně při mediánu sledování 30,3 měsíce byla 4,8 % a 9,5 % pro MR aproximaci a 0 %, resp. 13,3 % pro MR-based preplanning. Lokální kontroly bylo dosaženo při MR-based preplanningu u 86,7 % pacientek, při MR aproximaci u 76,2 %.Závěr:
3D MR-based brachyterapie s CT a MR fúzí obrazů přináší excelentní výsledky lokální kontroly při minimální toxicitě.Klíčová slova:
MR-based brachyterapie, karcinom děložního hrdla, klinické výsledky.ÚVOD
V roce 2007 bylo v České republice diagnostikováno 990 nemocných s karcinomem děložního čípku (incidence 18,8/100 000 žen). V témže roce zemřelo v důsledku tohoto onemocnění 314 žen (mortalita6/100 000 žen). Podle údajů ÚZIS se incidence invazivního karcinomu za posledních 40 let téměř nezměnila, přičemž mortalita v posledních 10 letech jen nepatrně klesla. Index mortalita/incidence poklesl za posledních 10 let z 0,46 na 0,4. Vzhledem k nefunkčnímu organizovanému screeningu v České republice je však stále významná část nemocných diagnostikována již v lokálně pokročilém stadiu.
Základní léčebnou metodou lokálně pokročilého karcinomu děložního čípku je radikální chemoradioterapie, jejíž nedílnou součástí je brachyterapie [8, 15, 16, 17, 20, 21, 26, 28, 31]. Bohužel konvenční plánování radioterapie (brachyterapie) přináší u těchto pacientek suboptimální výsledky. Vývoj CT/MR kompatibilních aplikátorů a plánovacího softwaru vedl v posledních letech k prudkému rozvoji 3D brachyterapie karcinomu děložního čípku. Užití CT a MR obrazů umožňuje přesné stanovení cílových objemů (vlastní makroskopický tumor – GTV, oblast klinického cílového objemu s vysokým rizikem – HR CTV, oblast klinického cílového objemu se středním rizikem – IR CTV) a konturaci rizikových orgánů (močový měchýř, rektum, sigma) s následnou cílenou optimalizací plánů s ohledem na 3D topografii [3, 6, 9, 11, 12, 18, 19, 22, 27, 29, 30]. CT obraz bohužel není přínosný při lokalizaci vlastního tumoru. Pro cílené ozáření tumoru je proto nezbytné při plánování brachyterapie použití MR [2, 23, 24].
Jednoznačný klinický benefit MR-based brachyterapie doložili Pötter a spol. Díky adaptivní brachyterapii je možno dosáhnout lokální kontroly u 96 % tumorů menších než 5 cm a u 82 % nemocných s nádorem větším než 5 cm. Využití magnetické rezonance vede u lokálně pokročilých nádorů ke zlepšení přežití bez nemoci ze 40 % na 62 % a celkového přežití z 28 % na 58 % [23]. Excelentní výsledky byly potvrzeny v pozdější aktualizaci, kdy u této skupiny nemocných bylo 3 roky po léčbě (nejspíše vlivem rostoucích zkušeností a zvýšeného použití intrakavitárně-intersticiální techniky) dosaženo lokální kontroly 92 % při celkovém přežití 65 % [24].Příčinou je skutečnost, že riziko lokální recidivy významně souvisí s aplikovanou dávkou, kterou jsme schopni díky adaptivní brachyterapii (BRT) správně aplikovat [1].
Vzhledem k faktu, že MR není standardním vybavením radioterapeutických oddělení, jsme na našem pracovišti vypracovali zcela novou techniku plánování (MR-based preplanning) s fúzí obrazu MR a plánovacího CT, která umožňuje cílené ozáření bez ohledu na umístění MR přístroje. Při ní je použito MR pánve se zavedenými aplikátory provedené po ukončení teleterapie (před první a čtvrtou frakcí brachyterapie) a CT řezy získané při jednotlivých BRT aplikacích. CT obrazů je využito ke konturaci rizikových orgánů a lokalizaci aplikátorů, MR v T2 sekvencích k zakreslení cílových objemů. Díky přesné znalosti topografie tumoru je možno ve většině případů individuálně plán upravit tak, abychom cíleně eskalovali dávku v oblasti tumoru a současně šetřili rektum, sigma a močový měchýř [4, 5] (obr. 1, 2).
Image 1. Konturace cílového objemu (GTV modře, HR CTV oranžově); GTV – makroskopický tumor, HR CTV – oblast klinického cílového objemu s vysokým rizikem 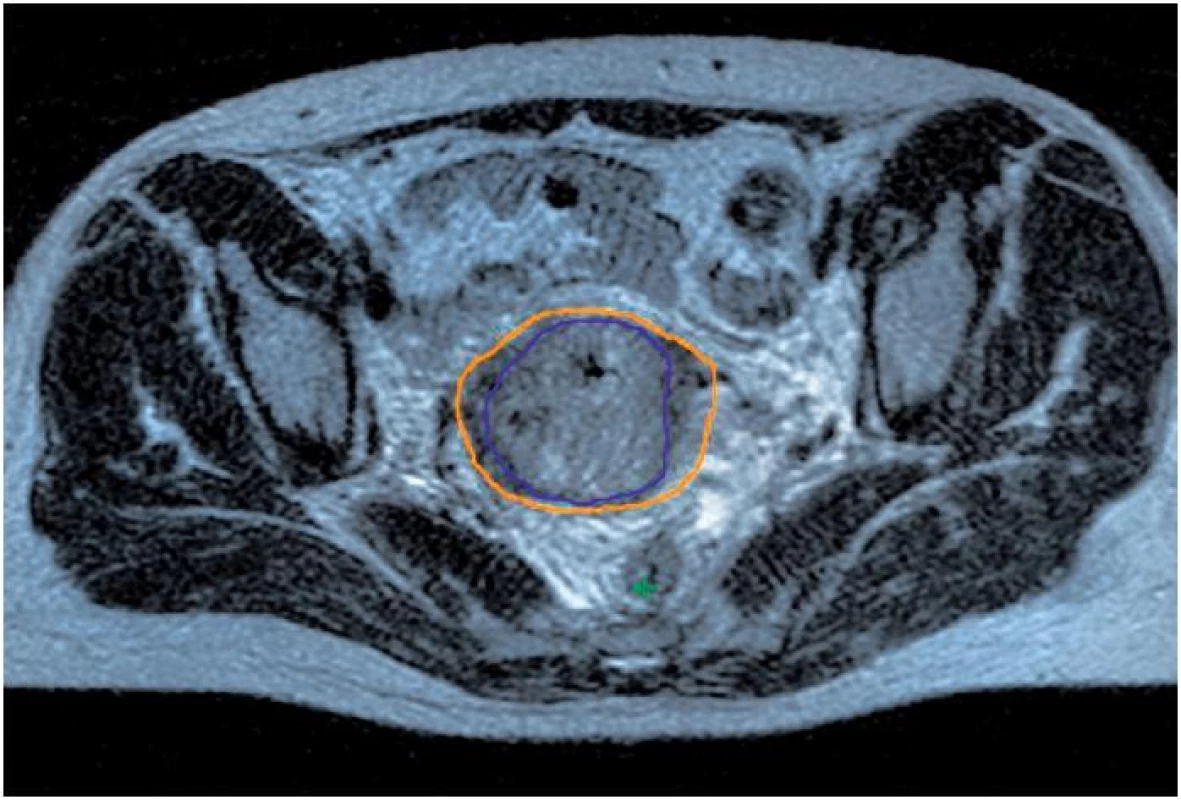
Image 2. Dávková distribuce kombinované intrakavitárně-intersticiální techniky 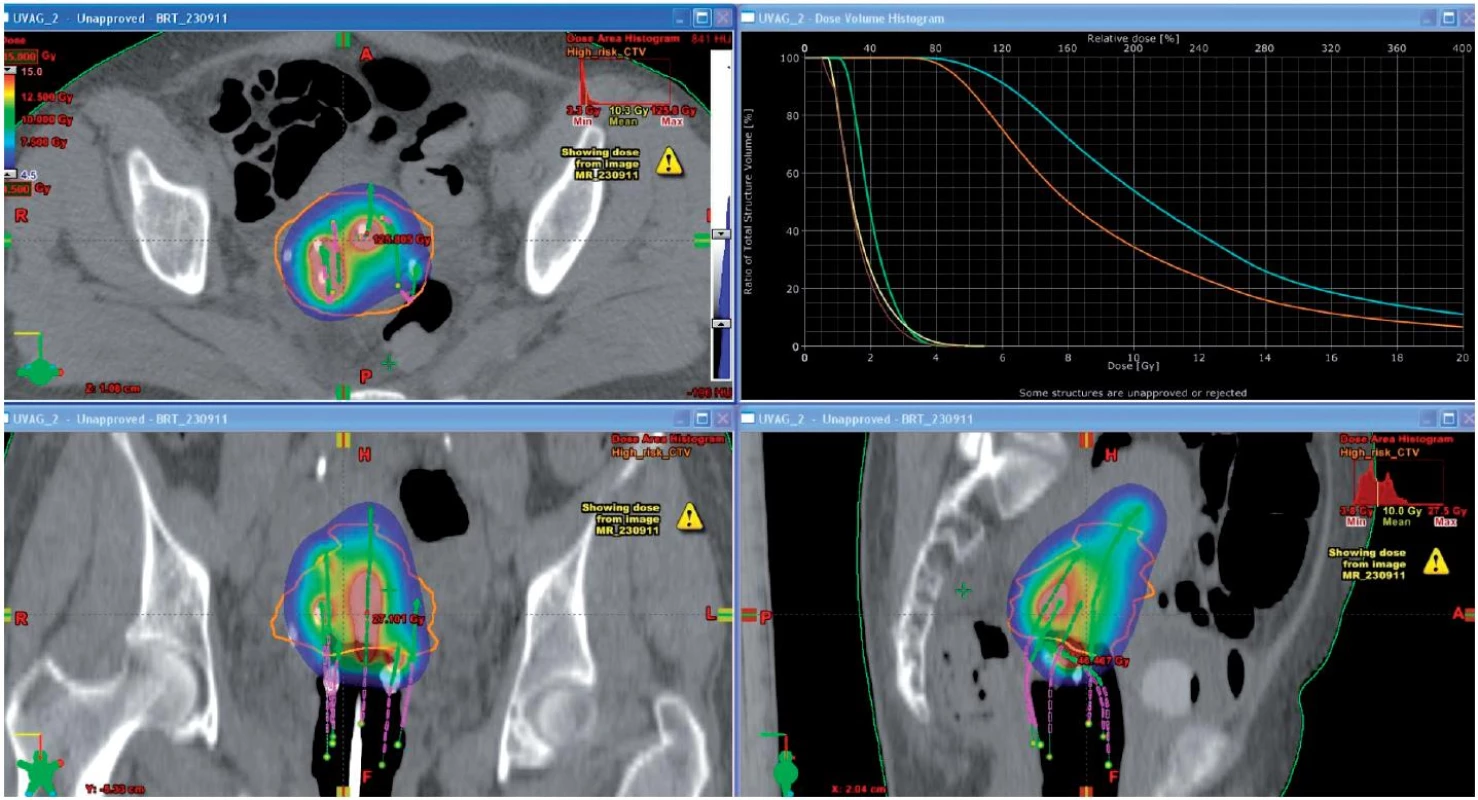
SOUBOR PACIENTEK A METODIKA
Od ledna 2007 do června 2011 bylo na našem pracovišti radikálně léčeno pomocí chemoradioterapie a 3D brachyterapie 36 pacientek pro verifikovaný lokálně pokročilý karcinom děložního čípku. Pomocí MR-based brachyterapie bylo plánováno 15 pacientek (u 7 nemocných byla provedena kombinace intrakavitárně-intersticiální techniky), 21 bylo plánováno CT-based s MR aproximací. Pacientky absolvovaly před zahájením léčby fyzikální vyšetření včetně gynekologického vyšetření, histologické vyšetření, CT břicha a malé pánve, MR pánve a RTG S+P. Všechny pacientky měly nádor lokálně pokročilý (27 ve stadiu IIIB, 8 ve stadiu bulky IIB, 1 ve stadiu bulky IB).
Nemocné podstoupily chemoradioterapii pánve technikou 3D konformní radioterapie (CRT) nebo radioterapie s modulovanou intenzitou (IMRT) dávkou LD 45 Gy a 1,8 Gy v 25 frakcích za potenciace cisplatina40 mg/m2 týdně.
Plánování brachyterapie
Po dokončení teleterapie byly pacientkám před první a čtvrtou frakcí brachyterapie zavedeny na radiodiagnostickém oddělení v paracervikální anestezii MR-kompatibilní uterovaginální aplikátory (GammaMed Fletcherstyle applicator, Varian Medical Systems, Palo Alto, CA) s modifikovanými ovoidy umožňujícími potenciální intrakavitárně-intersticiální techniku s následným provedením T2 sekvencí ve všech rovinách (fast spin echo sekvence, 3mm řezy). Po provedeném MR vyšetření byly aplikátory odstraněny. Obrazová data byla transportována do plánovacího systému a podle „Recommendations from Gynaecological (GYN) GEC ESTRO Working Group I a II“ byly konturovány cílové objemy (GTV, HR CTV a IR CTV) i rizikové orgány (močový měchýř, sigma, rektum) a následně připraven ozařovací plán [13, 25]. Optimalizace preplánu byla vytvořena manuálně za použití plánovacího systému BrachyVision 8.6. (Varian, Palo Alto, CA). Předepsaná dávka pro high-risk (HR) clinical target volume (CTV) D90 byla 6 × 5 Gy. Dávkové limity pro rizikové orgány byly 70 Gy EQD2 pro 2 cm3 rekta a sigmatu a 90 Gy EQD2 2 cm3 močového měchýře.
Následující den byly pacientkám v celkové anestezii na sálku onkologického pracoviště zavedeny aplikátory v identické topografii jako na radiodiagnostickém oddělení. Po registraci CT a MR obrazů byla provedena rekonstrukce aplikátorů za použití CT obrazu. Kontury rizikových orgánů byly modifikovány podle aktuální topografie na CT. Gross tumor volume, high-risk CTV a intermediate-risk CTV kontury byly použity z magnetické rezonance. Čas pro jednotlivé pozice zdroje byl přenesen z přípravného plánu a vzhledem k modifikaci kontur rizikových orgánů podle potřeby adaptován. Byly dodržovány stejné dávkové limity jako při preplanningu.
U části pacientek, které aplikaci na radiodiagnostickém oddělení odmítly, byl CT plán modifikován pouze podle diagnostické MR bez zavedených aplikátorůpo proběhlé chemoradioterapii (MR based aproximace). Do této skupiny pacientek byly zařazeny i ženy, které měly provedenou MR vlivem nutnosti akutního zahájení ozařování (např. při významném gynekologickém krvácení) až v průběhu radioterapie.
Sledování pacientek
Všechny pacientky byly sledovány v průběhu radioterapie i následně po jejím ukončení. V průběhu ozařování byly vyšetřeny minimálně jednou týdně a vždy rovněž současně s poslední ozařovací frakcí. První kontrola po ozáření byla za měsíc po ukončení léčby, druhá za 3 měsíce po dokončení radioterapie a další vždy v odstupu 3 měsíců po dobu prvních 2 let. Následující 3 roky se interval prodloužil na 6 měsíců a po 5 letech od ukončení radioterapie byly pacientky dispenzarizovány vždy jednou ročně.
Vyšetření sestávalo z anamnézy a gynekologického vyšetření. Při každé kontrole byla důsledně vyšetřována kontrola nemoci a tolerance léčby se zaměřením na symptomy pozdní gastrointestinální a genitourinární toxicity. Pro hodnocení toxicity byla použita Fox Chase modification of the Radiation Therapy Oncology Group and Late Effects Normal Tissue Task Force toxicity criteria. Hlavní důvod pro výběr tohoto hodnocení toxicity byl fakt, že tato škála umožňuje klinicky přesnější popis a hodnocení postradiační proktitidy (obzvláště enteroragie), hematurie a inkontinence.
VÝSLEDKY
Analýza struktury pacientů týkající se věku, TNM stadia, objemu tumoru, délky radioterapie a použití potenciace či intersticiální aplikace je popsána v tabulce 1. Inzerce aplikátorů v paracervikálním bloku na radiologickém oddělení byla úspěšná u všech pacientek. Nebyla pozorována žádná komplikace v průběhu celé procedury (inzerce, MR vyšetření, odstranění aplikátorů, transport na oddělení). Průměrná doba zavádění aplikátorů byla 15 minut. Průměrný čas konturace a preplanningu byl 77 minut (55–94 minut). Průměrný čas potřebný pro fúzi, modifikaci kontur rizikových orgánů a adaptaci plánu byl 34 minut (25–49 minut).
Table 1. Charakteristika souboru 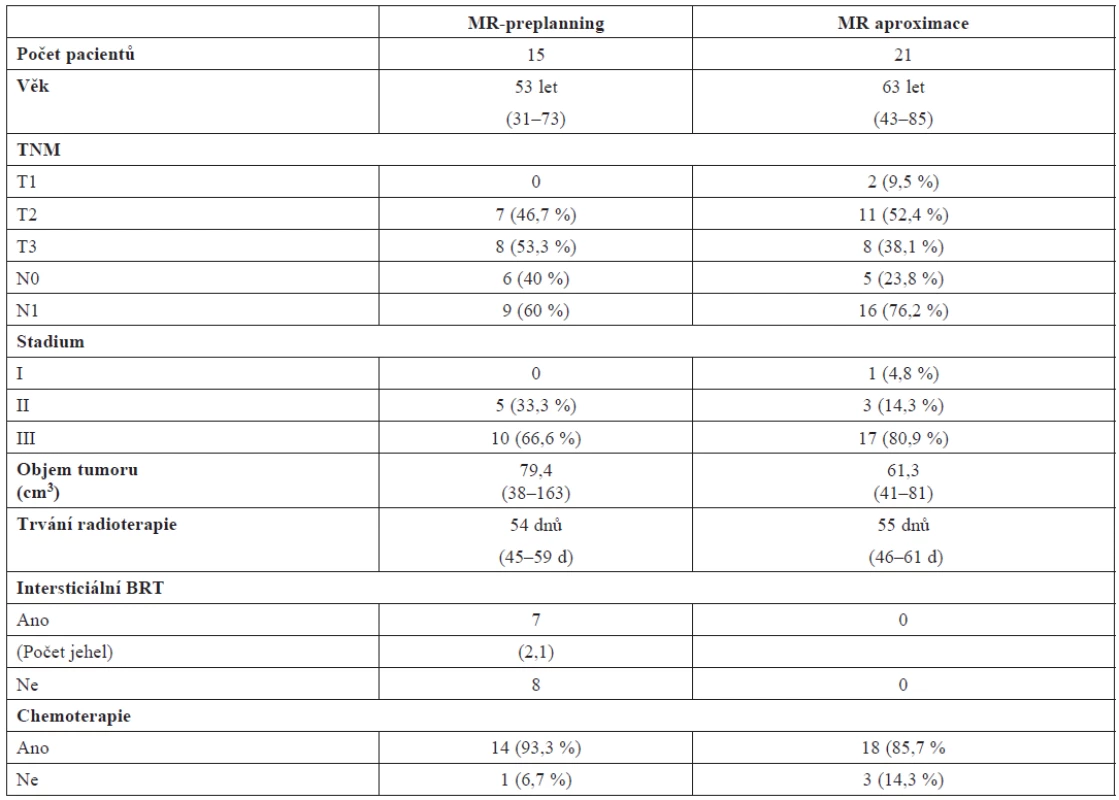
Časné klinické výsledky
Akutní genitourinární toxicita prvního a druhého stupně byla u pacientek léčených pomocí MR-preplanningu pozorována v 13,3 %, zatímco 73,4 % žen bylo bez symptomů. Akutní genitourinární (GU) toxicita prvního a druhého stupně po MR aproximaci byla 14,3 % a 9,5 %. Zcela bez obtíží bylo 76,2 % žen. Akutní gastrointestinální toxicita nultého, prvního i druhého stupně byla u žen s MR-preplanningem 33,3 %, u žen po MR aproximaci 23,8 %, 28,6 % a 47,6 % (obr. 3, 4).
Image 3. Akutní genitourinární toxicita 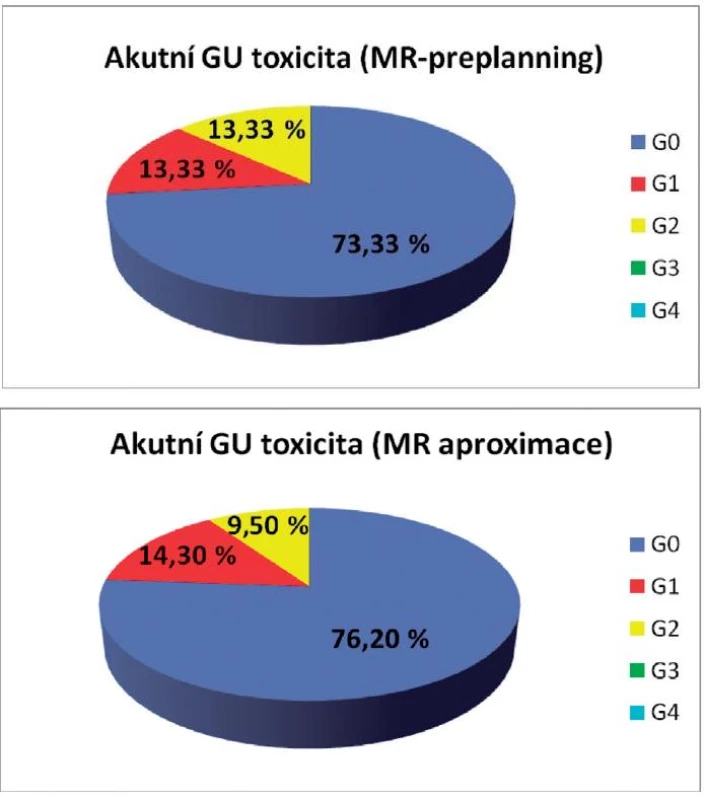
Image 4. Akutní gastrointestinální toxicita 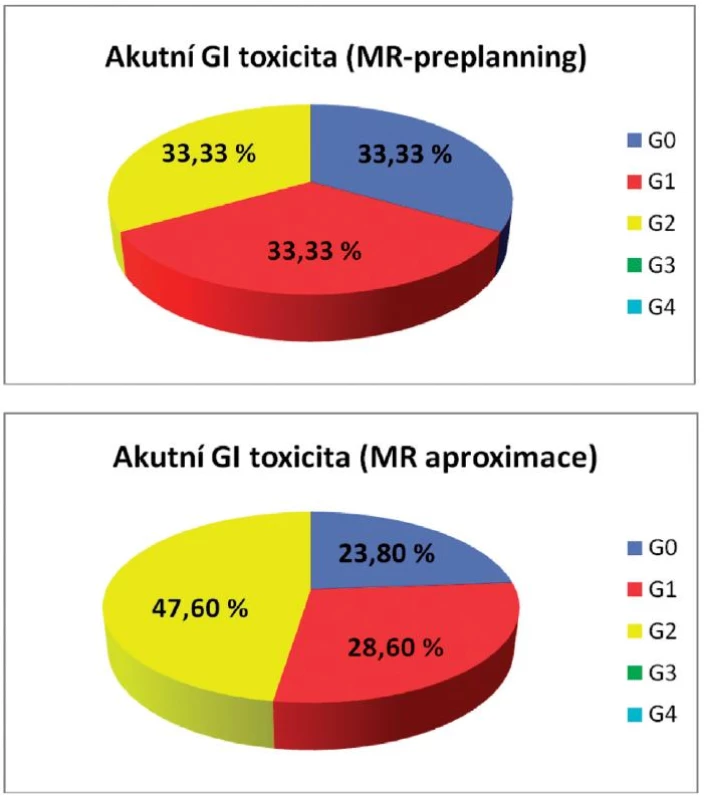
Pozdní genitourinární toxicita byla u žen s MR-preplanningem pozorována pouze u 20 %, přičemž u všech byla stupně G1. Pozdní GU toxicita po MR aproximaci byla 19 % stupně G1, 4,8 % stupně G3, 76,2 % žen bylo zcela bez genitourinárních symptomů. Pozdní gastrointestinální toxicita prvního, druhého a čtvrtého stupně byla po MR preplanningu pozorována jen u jedné pacientky (G1 6,67 %, G2 6,67 %, G4 6,67 %). Zcela bez příznaků bylo 80 % žen. Rovněž po MR aproximaci byla chronická gastrointestinální toxicita prvního, druhého i třetího stupně pozorována vždy jen u jedné ženy (G1 4,76 %, G2 4,76 %, G3 4,76 %), přičemž asymptomatických bylo 85,72 % žen (obr. 5, 6).
Image 5. Pozdní genitourinární toxicita 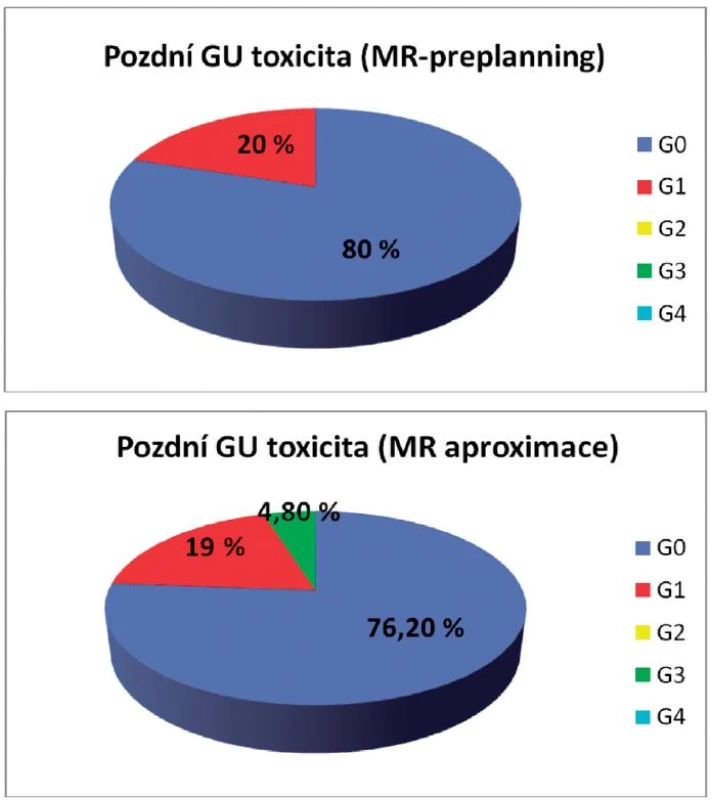
Image 6. Pozdní gastrointestinální toxicita 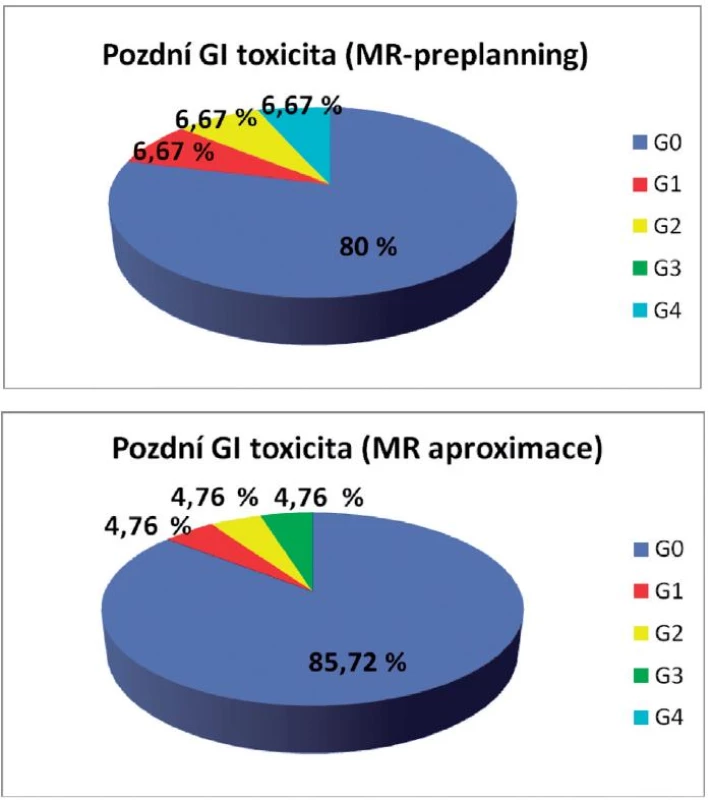
Při mediánu sledování 30,3 měsíce (9,1–61) bylo dosaženo lokální kontroly u 86,7 % pacientek, které byly léčeny pomocí MR-preplanningu, a u 76,2 % nemocných podstoupivších brachyterapii s MR aproximací. U žádné z žen, které absolvovaly kombinovanou intrakavitárně-intersticiální brachyterapii, nebyla diagnostikována lokální recidiva. Přežití bez známek nádoru bylo 73,3 % (MR-preplanning), resp. 52,3 % (MR aproximace).
DISKUSE
Základem či spíše nezbytností moderní radioterapie je použití vhodné zobrazovací techniky [7, 10, 23]. Bez exaktní znalosti lokalizace nádoru a rizikových orgánů v okolí při vlastním ozáření totiž nepřináší ani použití nejmodernější radiační technologie kýžený benefit. Konvenční plánování intrakavitární brachyterapie nádoru děložního čípku bylo po mnoho desetiletí založeno na informacích získaných ze dvou ortogonálních rentgenových snímků. Tyto informace byly skoupé na přesnou topografii rizikových orgánů a nulové stran vlastního nádoru. Technologický pokrok a vývoj CT/MR kompatibilních aplikátorů vedl k rozvoji 3D brachyterapie. Tato práce přináší první klinické výsledky inovativní plánovací techniky využívající fúze obrazů, jejíž přesnost byla verifikována v naší předchozí publikaci [5].
Objektivní hodnocení chronické toxicity, obzvláště vzhledem k ovlivnění kvality života, je velice obtížné. Mezi jednotlivými užívanými škálami pro hodnocení toxicity existují významné rozdíly. Pro hodnocení pozdní gastrointestinální a genitourinární toxicity byla použita Fox Chase (FC) modification of the Radiation Therapy Oncology Group (RTOG) and Late Effects Normal Tissue Task Force (LENT) toxicity criteria. Tato škála umožňuje velice detailně hodnotit a kvantifikovat stupeň postradiační proktitidy (obzvláště enteroragie), hematurie a inkontinence. Použití tohoto hodnocení vede ke zvýšení toxicity 3. stupně – více než 8krát při srovnání s RTOG a asi 3krát při komparaci s LENT [14]. S ohledem na zvolenou škálu jsme přesvědčeni, že pozorovaná míra toxicity druhého a vyššího stupně je neobyčejně uspokojivá. Závažná pozdní gastrointestinální toxicita čtvrtého stupně byla pozorována u jediné ženy, která pro částečnou střevní obstrukci a příměs krve absolvovala argonovou plazmakoagulaci s vícečetnými biopsiemi, po které se vyvinula rektovaginální píštěl s nutností provedení sigmoideostomie.
Vzhledem k relativně krátké době sledování je nutno brát všechny dosažené klinické výsledky jako předběžné. Přesto dosažená míra lokální kontroly (86,7 % u MR-preplanningu) je s ohledem na lokálně pokročilé vstupní nálezy léčených žen velice příznivá a zcela odpovídá literárním údajům týkajícím se použití MR v brachyterapii. MR-based preplanning vedl při srovnání s pouhou MR aproximací přes významně pokročilejší vstupní rozsah nemoci k lepším léčebným výsledkům. U žádné z žen, které absolvovaly kombinovanou intrakavitárně-intersticiální techniku, nebyla pozorována lokální recidiva. Nižší přežití bez známek nemoci ve skupině MR aproximace je bezpochyby dáno mimo suboptimálnější techniku a relativně krátkou dobu sledování i vyšším procentuálním zastoupením pacientek s pozitivními uzlinami. Definitivní klinické závěry však bude možno udělat až po delší době sledování.
Technika má velké množství výhod a pouze minimum omezení. Významnými výhodami jsou exaktní stanovení cílového objemu GTV a HR CTV, přesná rekonstrukce aplikátorů na CT obraze, redukce času potřebného pro plánování s redukcí potenciálních změn rizikových orgánů mezi provedením plánovacího CT a vlastním ozářením, časově neomezený preplanning bez stresu pro personál a pacientku, potenciální provedení kombinované intrakavitárně-intersticiální techniky a signifikantně lepší klinické výsledky léčby. Zjevnou nevýhodou je aplikace na radiodiagnostickém oddělení v paracervikálním bloku a nezbytnost dodržení identické topografie aplikátorů při použití uterovaginální sondy s ovoidy. Jsem přesvědčen, že použití této techniky umožní dosáhnout lepších klinických výsledků u všech pacientek bez ohledu na přímé diagnostické vybavení onkologického oddělení.
ZÁVĚR
MR-based brachyterapie přináší u pacientek s lokálně pokročilým karcinomem děložního čípku vynikající lokální kontrolu nemoci při minimální klinicky významné toxicitě.
Adresa pro korespondenci:
MUDr. Martin Doležel, Ph.D.
KOC Pardubická krajská nemocnice a.s.
Multiscan s.r.o.
Kyjevská 44
532 03 Pardubice
e-mail: dolezelm@email.cz
Sources
1. Dimopoulos, JCA., Lang, S., Kirisits, C., et al. Dose–volume histogram parameters and local tumor control in MR image guided cervical cancer brachytherapy. Int J Radiat Oncol Biol Phys, 2009, 75, p. 56–63.
2. Dimopoulos, JCA., Schard, G., Berger, D., et al. Systematic evaluation of MRI findings in different stages of treatment of cervical cancer: Potential of MRI on delineation of target, pathoanatomic structures, and organs at risk. Int J Radiat Oncol Biol Phys, 2006, 64, p. 1380–1388.
3. Doležel, M. 3D HDR brachyterapie v léčbě gynekologických malignit. Postgrad Med, 2009, 11, s. 315–317.
4. Dolezel, M., Odrazka, K., Vanasek, J., et al. MRI-based preplanning in patients with cervical cancer treated with 3D brachytherapy. Br J Radiol, 2011, 84, p. 850–856.
5. Dolezel, M., Odrazka, K., Zizka, J., et al. MRI-based preplanning using CT and MRI data fusion in patients with cervical cancer treated with 3D-based brachytherapy: feasibility and accuracy study. Int J Radiat Oncol Biol Phys, 2012, 84 (1), p. 146–152. DOI: 10.1016/j.ijrobp.2011.11.003
6. Doležel, M., Vaňásek, J., Odrážka, K., et al. Pokroky v léčbě karcinomu děložního hrdla – 3D plánování HDR brachyterapie pomocí CT/MR. Čes Gynek, 2008, 73, s. 144–149.
7. Doleželová, H., Slampa, P., Bolcak, K., et al. Význam PET v radioterapii karcinomu děložního hrdla – výsledky pilotní studie. Čes Gynek, 2008, 73, s. 135–140.
8. Eifel, PJ., Winter, K., Morria, M., et al. Pelvic irradiation with concurrent chemotherapy versus pelvic and paraaortic irradiation for high risk cervical cancer: an update of radiation therapy on cology group trial (RTOG) 90-01. J Clin Oncol, 2004, 22, p. 872–880.
9. Fellner, C., Pötter, R., Knocke, T., et al. Comparison of radiography-and computed tomography-based treatment planning in cervix cancer in brachytherapy with specific attention to some quality assurance aspects. Radiother Oncol, 2001, 58, p. 53–62.
10. Fischerova, D., Cibula, D., Stenhova, H., et al. Use of transrectal ultrasound and magnetic resonance imaging in the staging of early-stage cervical cancer. Čes Gynek, 2009, 74, s. 323–329.
11. Georg, P., Lang, S., Dimopoulos, JC., et al. Dose-volume histogram parameters and late side effects in magnetic resonance image-guided adaptive cervical cancer brachytherapy. Int J Radiat Oncol Biol Phys, 2011, 79, p. 356–362.
12. Haie-Meder, C., Chargari, C., Rey, A., et al. DVH parameters and outcome for patients with early-stage cervical cancer treated with preoperative MRI-based low dose rate brachytherapy followed by surgery. Radiother Oncol, 2009, 93, p. 316–321.
13. Haie-Meder, C., Pötter, R., van Limbergen, E., et al. Recommendations from the Gynaecological (GYN) GEC ESTRO Working Group: Concepts and terms in 3D-image based 3D-treatment planning in cervix cancer brachytherapy with emphasis on MRI assessment of GTV and CTV. Radiother Oncol, 2004, 74, p. 235–245.
14. Hanlon AL, Schultheiss TE, Hunt MA, et al. Chronic rectal bleeding after high-dose conformal treatment of prostate cancer warrants modification of existing morbidity scales. Int J Radiat Oncol Biol Phys, 1997, 38, p. 59–63.
15. Chiara, S., Bruzzone, M., Merlini, L., et al. for the GONO (North-West Oncologic Cooperative Group). Randomized study comparing chemotherapy plus radiotherapy versus radiotherapy alone in FIGO stage IIB-III cervical carcinoma. Am J Clin Oncol, 1994, 17, p. 294–297.
16. Christie, DRH., Bull, CA., Gebski, V., et al. Concurrent 5-fuorouracil, mitomycin C and irradiation in locally advanced cervix cancer. Radiother Oncol, 1995, 37, p. 181–189.
17. Keys, H., Bundy, B., Stehman, F., et al. Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med, 1999, 340, p. 1154–1161.
18. Kim, RY., Pareek, P. Radiography-based treatment planning compared with computed tomography (CT)-based treatment planning for intracavitary brachytherapy in cancer of thecervix: analysis of dose-volume histograms. Brachytherapy, 2003, 2, p. 200–206.
19. Kirisits, C., Pötter, R., Lang, S., et al. Dose and volume parameters for MRI based treatment planning in intracavitary brachytherapy of cervix cancer. Int J Radiat Oncol Biol Phys, 2005, 62, p. 901–911.
20. Petera, J., Odrážka, K., Doležel, M., et al. Radioterapie velkými poli a brachyterapie s vysokým dávkovým příkonem s konkomitantní chemoterapií u pacientek s lokálně pokročilým cervikálním karcinomem. Čes Gynek, 2007, 72, s. 126–130.
21. Peters, WA. III,, Liu, PY., Barrett, RJ., et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol, 2000, 18, p. 1606–1613.
22. Pötter, R., Dimopoulos, J., Bachtiary, B., et al. 3D-conformal HDR brachytherapy and external beam therapy plus simultaneous cisplatin for high-risk cervical cancer: Clinical experience with 3 year follow up. Radiother Oncol, 2006, 79, p. 80–86.
23. Pötter, R., Dimopoulos, J., Georg, P., et al. Clinical impact of MRI assisted dose volume adaptation and dose escalation in brachytherapy of locally advanced cervix cancer. Radiother Oncol, 2007, 83, p. 148–155.
24. Pötter, R., Georg, P., Dimopoulos, JC., et al. Clinical outcome of protocol based image (MRI) guided adaptive brachytherapy combined with 3D conformal radiotherapy with or without chemotherapy in patients with locally advanced cervical cancer. Radiother Oncol, 2011, 100, p. 116–123.
25. Pötter, R., Haie-Meder, C., vanLimbergen, E., et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (II): Concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose-volume parameters and aspects of 3D-image-based anatomy, radiation physics, radiobiology. Radiother Oncol, 2006, 78, p. 67–77.
26. Rose, PG., Bundy, BN., Watkins, EB., et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med, 1999, 340, p. 1144–1153.
27. Shin, K., Kim, T., Cho, J., et al. CT-guded intracavitary radiotherapy for cervical cancer: Comparison of conventional Point A plan with clinical target volume-based 3D plan using dose-volume parameters. Int J Radiat Oncol Biol Phys, 2006, 64, p. 197–204.
28. Sirák, I., Petera, J., Odrážka, K., et al. Význam intenzity chemoterapie v konkomitantní chemoradioterapii lokálně pokročilého karcinomu hrdla děložního. Čes Gynek, 2006, 71, s. 308–311.
29. Tanderup, K., Hellebust, TP., Lang, S., et al. Consequences of random and systematic reconstruction uncertainties in 3D image based brachytherapy in cervical cancer. Radiother Oncol, 2008, 89, p. 156–163.
30. Tanderup, K., Nielsen, SK., Nyvang, GB., et al. From point A to the sculpted pear: MR image guidance significantly improves tumour dose and sparing of organs at risk in brachytherapy of cervical cancer. Radiother Oncol, 2010, 94, p. 173–180.
31. Whitney, CW., Sause, W., Bundy, BN., et al. Randomized comparison of uorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage IIB-IVA carcinoma of the cervix with negative paraaortic lymph nodes: a Gynecologic Oncology Group and Southwest Oncology Group study. J Clin Oncol, 1999, 17, p. 1339–1348.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2012 Issue 6-
All articles in this issue
- Follow-up po léčbě karcinomu ovaria –opravdu bez Ca 125?
- Srovnání vybraných parametrů oxidačního stresu ve folikulární tekutině u žen s poruchou plodnosti a u zdravých fertilních dárkyň oocytů
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
- Bezpečnost domácích porodů a medicína založená na důkazech
- Domácí porody v České republice
- Štruktúrny základ transportnej funkcie vajíčkovodu
- Postižení vývoje dětí s nízkou porodní hmotnostíve 24 měsících korigovaného věku, narozených v České republice v letech 2000–2009
- Porody dětí velkých hmotností ve Fakultní nemocnici v Olomouci (1993–2010)
- Endovaskulární léčba krvácení v souvislostis porodem a těhotenstvím
- Úloha leptinu v lidské reprodukci (anorexie, bulimie)
- Dehiscencia laparotómie po hysterektómii – manažment hojenia rany
- Výskyt infekcie u novorodencov SAG pozitívnych matiek v závislosti na peripartálnej antibiotickej profylaxii a spôsobe pôrodu
- Možnosti ultrazvukové predikce placenta accreta v klinické praxi
- Nové technologie a perspektivy analýzymetabolomu embrya
- 3D MR-based brachyterapie v léčbě lokálně pokročilého karcinomu děložního hrdla – časné klinické výsledky
- Moderní chirurgická a biologická léčba karcinomu prsu
- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v Brně
-
Rychle progredující tumor dělohy
kazuistika
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Domácí porody v České republice
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
- Dehiscencia laparotómie po hysterektómii – manažment hojenia rany
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

