-
Medical journals
- Career
Analýza fragmentů volné fetální DNA v plazmě těhotných žen v průběhu těhotenství
Authors: R. Vodička; J. Böhmová; I. Dhaifalah; J. Blumenthalová; R. Kratochvílová; J. Šantavý; M. Procházka; R. Vrtěl
Authors‘ workplace: Ústav lékařské genetiky a fetální medicíny FN, Olomouc, přednosta prof. MUDr. J. Šantavý, Ph. D.
Published in: Ceska Gynekol 2010; 75(4): 312-316
Overview
Cíl studie:
Posoudit míru fragmentace volné fetální DNA v plazmě těhotných žen v průběhu těhotenství.Typ studie:
Zjištění efektivity záchytu fetálních DNA molekul s rozdílnou délkou a volné fetální DNA ve velikostních frakcích.Pracoviště:
Ústav lékařské genetiky a fetální medicíny FN Olomouc.Metodika:
1. Celkem 363 vzorků těhotných žen v rozmezí 4. až 37. t.g. bylo posouzeno v lokusech STR a AMELY analýzou efektivity QF PCR.
2. Fetální DNA rozdělená do velikostních frakcí byla kvantifikována metodou QF PCR u 91 těhotných (8. t.g. - 40. t.g.).
3. Real-time PCR (SRY/vnitřní kontrola) byla použita u 22 těhotných s plodem mužského pohlaví (9. t.g - 36. t.g.).Výsledky:
1. Efektivita QF PCR byla nepřímo úměrná délce amplifikovaných molekul.
2. Kvantifikací fragmentů fetální DNA kapilární elektroforézou nebyly kromě frakce obsahující nejdelší molekuly (frakce 500-760 bp) nalezeny odlišnosti ve vztahu k týdnu těhotenství.
3. Metodou real-time PCR byl pozorován nepřímý vztah mezi množstvím fetální DNA ve frakci 150-300 bp a stadiem gravidity.Závěr:
Rozborem všech tří postupů byl pozorován trend, který naznačuje nárůst větších fetálních molekul v průběhu těhotenství, zatímco množství menších molekul fetálního původu se nemění.Klíčová slova:
volná fetální DNA, velikostní frakce, QF PCR, real-time PCR, neinvazivní prenatální diagnostika.ÚVOD
Molekulární skladba krevní plazmy/séra těhotných žen je dnes již neodmyslitelným nástrojem biochemiků v oblasti prenatální diagnostiky. Prediktivní síla některých proteinových biochemických markerů popř. jejich součet je důležitým vodítkem při posuzování stavu plodu a gravidity. Diagnostický potenciál maternální plazmy tím ale zdaleka nekončí. Rozpadající se a apopticky degradující fetální buňky a makromolekuly DNA, které překonaly placentální (feto-maternální) bariéru a dostaly se pod vliv imunitního systému matky, nabízejí další možnosti molekulárním biologům. Někteří z nich se soustředí na objasnění zákonitostí mezi množstvím fetálních molekul a patologií placenty a plodu, jiní se věnují přímému diagnostickému potenciálu.
Práce, které se týkají charakterizace DNA fragmentů v plazmě, se orientují na míru fragmentace fetálních molekul vzhledem k maternálním v průběhu těhotenství. U těhotných žen bylo popsáno větší množství delších fragmentů ve srovnání s netěhotnými ženami [6]. Molekuly fetálního původu jsou více degradované a kratší než maternální a jejich velikost se pohybuje přibližně v rozmezí od 100 – 700 bp. [7, 8, 13]. Fragmenty nad 1 kb patří převážně matce [8].
Cílem práce je posoudit míru fragmentace volné fetální DNA v plazmě těhotných žen v průběhu těhotenství pomocí:
- Efektivity QF PCR využitím STR a AMELX/Y v systémech, které amplifikují různě dlouhé molekuly DNA.
- Kapilární elektroforézy DNA fragmentů ve velikostních frakcích pomocí lokusů genů AMELX a AMELY.
- Taqman Real-time PCR lokusu SRY a vnitřní kontroly v jednotlivých frakcích.
MATERIÁL A METODIKA
Periferní krev těhotných byla odebrána a vyšetřována po informovaném souhlasu pacientek, jehož forma i obsah byly schváleny etickou komisí FN Olomouc.
Počty vzorků se lišily v rámci jednotlivých přístupů a budou podle toho dále konkretizovány.
Zpracování a izolace DNA z plazmy byly u všech vzorků následující:
Nesrážlivá periferní krev byla ihned po odběru přenesena na led a do 4 hodin po odběru zpracována.
Plazma po centrifugaci plné krve 10 min při 1500 g byla odebrána a následovala recentrifugace 20 min při 2500 g. Poté byl vzorek zamražen při –28 °C. Vlastní izolace DNA byla provedena z 1ml plazmy kitem QiaAmp DNA mini kit (Qiagene) podle instrukcí v manuálu.
1. Efektivita QF PCR
Soubor vzorků: 363 vzorků od 258 těhotných žen se zdravým plodem v různých stadiích těhotenství v rozmezí 4. t.g. až 37. t.g.
Amplifikace a detekce
Použité primery: D21S1435 BB, D21S1446 BB, PentaD BB, AMELX/AMELY BB. Sekvence primerů včetně velikosti PCR produktů jsou volně dostupné v databázi http://www.ncbi.nlm.nih.gov. Pro amplifikaci bylo použito kitu Restorase DNA polymeráza (Sigma-Aldrich). Teplota nasedání primerů byla zvolena empiricky na 55 °C. Amplifikace byla provedena v termocykleru MJ Research. Vlastní detekce a snímání dat proběhla na kapilární elektroforéze ABI PRISM 310 ve standardních podmínkách modulu GS STR POP4 C softwarem ABI Prism 310 Collection. Analýza velikosti fragmentů byla posuzována pomocí programu 310 Gen Scan analysis.
2. Analýza DNA fragmentů ve velikostních frakcích na kapilární elektroforéze
Soubor vzorků: Celková plazmatická DNA od 91 těhotných žen s plodem mužského pohlaví v různých stadiích těhotenství v rozmezí 8. t.g. až 40. t.g.
Separace fragmentů podle velikosti
Metodika: Plazmatická DNA byla rozdělena elektroforézou. Každý vzorek byl separován do tří velikostních frakcí (150-300 bp, 300-500 bp, 500-760 bp) podle velikostního markeru kitem GenElute Agarose Spin Columns (Sigma-Aldrich).
Vzorky jednotlivých frakcí byly amplifikovány s použitím kitu Top-Bio, Combi PPP Master Mix. Gonozomální sekvence byly hodnoceny pomocí lokusů genů AMELX a AMELY (103bp/109bp).
Fragmenty volné fetální DNA byly detekovány a kvantifikovány kapilární elektroforézou stejně, jak je uvedeno výše.
3. Taqman Real-time PCR lokusu SRY a vnitřní kontroly v jednotlivých frakcích
Soubor vzorků: Plazmatická DNA od 22 těhotných žen s plodem mužského pohlaví v různých stadiích těhotenství v rozmezí 9. t.g. až 36. t.g.
Metodika: Pomocí Quantifiler Y Human Male DNA Quantification kitu (Applied Biosystems) bylo kvantifikováno množství DNA plodu mužského pohlaví izolované z mateřské plazmy v jednotlivých frakcích i v celkové plazmě. Analýza byla provedena na přístroji Stragene MX 5005P.
VÝSLEDKY
- Efektivita QF PCR byla analyzována ve vztahu k délce PCR fragmentů. Jasný trend vyšší efektivity směrem ke kratším fragmentům je znázorněn na grafu 1.
- Detekcí a kvantifikací fragmentů volné fetální DNA kapilární elektroforézou nebyly kromě frakce 500-760 bp (graf 3) nalezeny žádné odlišnosti u jednotlivých velikostních frakcí ani ve vztahu k týdnu těhotenství (grafy 2-3).
- Kvantitativní analýzy SRY sekvencí pomocí Real Time PCR (obrázek 1) v jednotlivých frakcích neodhalily žádné rozdíly, vzhledem k celkové plazmě bylo detekováno větší množství fetální DNA ve frakcích (graf 4). Při posuzování množství fetální DNA v průběhu těhotenství byla pozorována nepřímá úměra mezi množstvím fetální DNA ve frakci 150 -300 bp a týdnem gravidity. V dalších frakcích tento trend slábl a v celkové plazmě již není patrný (graf 5).
Graph 1. Znázornění efektivity záchytu fetální DNA (osa y), na délce PCR produktu (osa x) 
Graph 2. Volná fetální DNA analyzovaná kapilární elektroforézou v jednotlivých frakcích. Na ose x jsou velikostní frakce, osa y představuje relativní množství fetální DNA. Množství DNA je uvedeno v RFU jako poměr AMELX/Y 
Graph 3. Množství fetální DNA analyzované kapilární elektroforézou ve velikostních frakci 150-300 bp, 300-500 bp, 500-760 bp ve vztahu k týdnu gravidity. Na ose x jsou uvedeny týdny těhotenství, osa y představuje relativní množství fetální DNA. Množství DNA je uvedeno v RFU jako poměr AMELX/Y 
Image 1. Ukázka výstupu Real Time PCR. Volná fetální DNA je posuzovaná v jednotlivých velikostních frakcích. Šedá šipka označuje záchyt fetální DNA (SRY), kdy plod je mužského pohlaví, a černá vnitřní kontrolu PCR 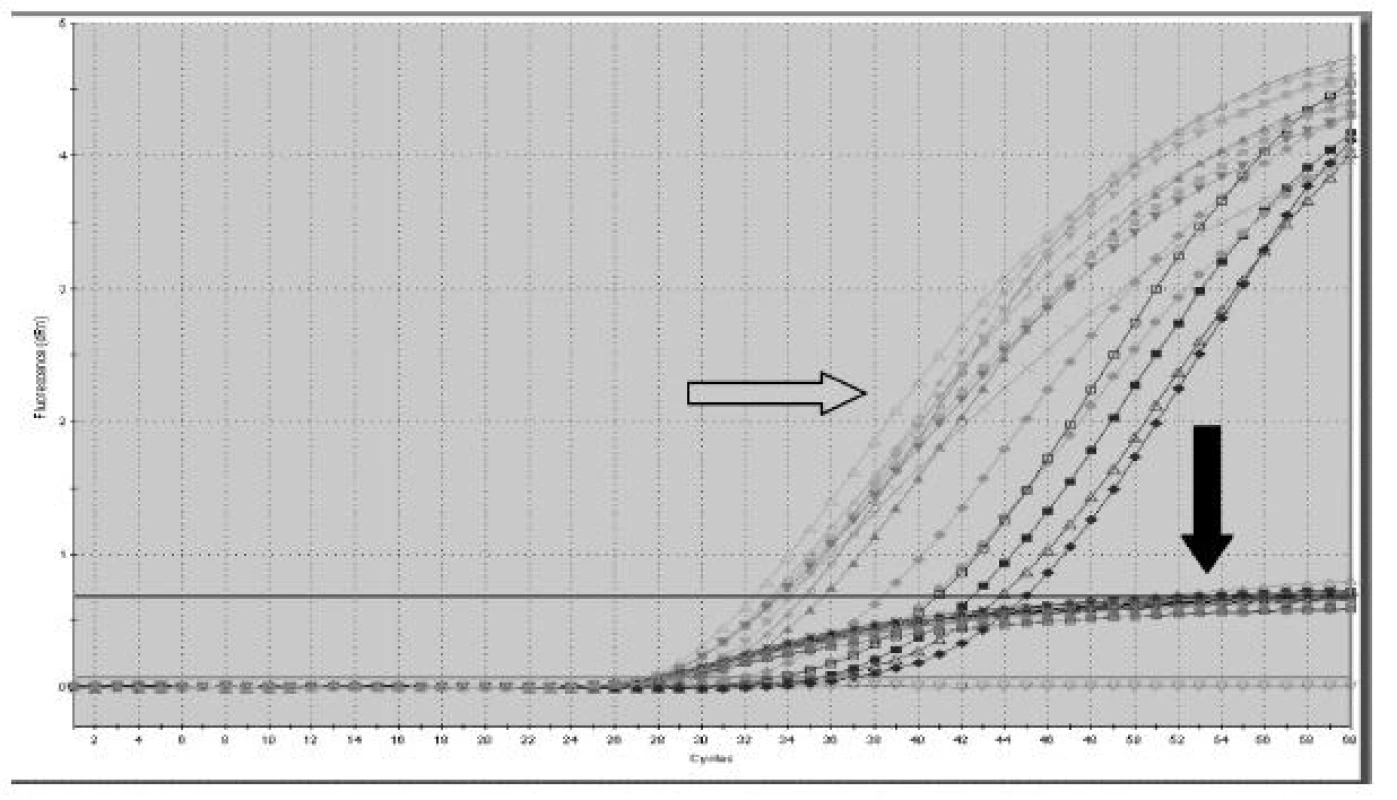
Graph 4. Množství mužské specifické fetální DNA analyzované Real Time PCR ve velikostních frakcích a celkové plazmě. Na ose x jsou velikostní frakce, osa y představuje relativní množství fetální DNA. Množství DNA je uvedeno jako rozdíl Ct hodnot (Ct(FAM)-Ct(JOE)) 
Graph 5. Množství mužské specifické fetální DNA analyzované Real Time QPCR ve velikostních frakcích a celkové plazmě ve vztahu k týdnu těhotenství. Na ose x jsou týdny těhotensví, osa y představuje relativní množství fetální DNA. Množství DNA je uvedeno jako rozdíl Ct hodnot (Ct(FAM)-Ct(JOE)) 
DISKUSE
Analýza fragmentů byla posuzována třemi metodami (kapilární elektroforéza STR lokusů, kapilární elektroforéza gonozomálních sekvencí a Real-time PCR) ze 2 různých hledisek. První se opíralo o přímou analýzu velikostních frakcí a druhé hodnotilo efektivitu PCR vzhledem k velikosti amplifikované molekuly DNA.
Kapilární elektroforéza je velmi citlivá metoda, detekční limit koncentrace DNA, určený Zhangem et al., je 0,5 ng/ml [12]. Na našem pracovišti bylo zjištěno, že tato metodika je schopná rozlišit už 1% příměs Y-chromozomálních sekvencí [11].
Nejčastěji používaným postupem při analýze fetálních DNA fragmentů je v součastné době real-time PCR [1, 2, 9]. Citlivost záchytu fetální DNA u této metody byla popsána Hondou et al., který ji stanovil na 5,38 kopií/ml periferní krve [5].
Přímá detekce fetálních molekul potvrdila velkou heterogenitu v jednotlivých frakcích pomocí kapilární elektroforézy i real-time PCR (grafy 2-5), což je v souladu s publikovanou literaturou [3]. Přímá závislost množství fetálních molekul na týdnu těhotenství byla naznačena pouze ve velikostní frakci 500-760 bp. Naše předchozí výsledky STR analýz volné fetální DNA prokázaly statisticky významný nárůst fetálního materiálu ve všech 3 STR systémech v průběhu těhotenství. Regresní modelování bylo nejpřesnější v systému pD, kde se velikost molekul pohybovala od 395 bp do 440 bp.
Statistická významnost regrese ovšem klesala směrem k menším molekulám. V systému D21S1446 byla velikost od 200 bp do 223 bp a v systému D21S1435 byly posuzovány molekuly 157-188 bp. V systému AMELY (103 bp) byla regresní analýza již neprůkazná [10]. Pokud srovnáme výše uvedená zjištění s touto studií, zjistíme, že i přes menší počet analyzovaných vzorků byl potvrzen zajímavý trend, který naznačuje nárůst větších fetálních molekul v průběhu těhotenství, zatímco množství menších molekul fetálního původu se nemění. V případě kvantifikace pomocí SRY sondy, jejíž délka je 64 bp, byl pozorován dokonce trend opačný a počet amplifikovaných molekul ve frakci 150-300 byl ve vztahu k týdnu gravidity v nepřímé úměře. U větších frakcí se tendence zmírňovala a v celkové plazmě se trend zastavil až mírně obrátil. Na základě těchto pozorování můžeme tedy předpokládat nejcitlivější detekci fetálního materiálu pomocí krátkých sond. Tyto ale nejsou vhodné pro kvantitativní analýzy. Pro posuzování množství fetálního materiálu jsou nejvhodnější frakce od 400 bp výše, přestože v těchto frakcích je relativního množství fetální DNA méně. Z diagnostického hlediska je potom význam této studie v rozhodování, zdali je významnější pouhý záchyt fetálních molekul, anebo jejich kvantita.
Optimalizace izolačních a kvantitativních analýz velikostních fragmentů fetálních molekul je jedním z důležitých cílů v prenatální diagnostice s potencionálním zásadním dopadem na počet invazivních vyšetření plodu [4].
Práce byla podpořena grantem IGA MZ ČR č. NS/9624-3.
Doc. RNDr. Radek Vrtěl, Ph.D.
Ústav lékařské genetiky a fetální medicíny
Fakultní nemocnice
I. P. Pavlova 6
775 20 Olomouc
e-mail: vrtel@fnol.cz
Sources
1. Alberry, MS., Maddocks, DG., Hadi, MA., et al. Quantification of cell free fetal DNA in maternal plasma in normal pregnancies and pregnancies with placental dysfunction. Am J Obstet Gynecol 2009, 200(1), p. 98.e1-6.
2. Ariga, H., Ohto, H., Busch, MP., et al. Kinetics of fetal cellular and cell-free DNA in the maternal circulation during and after pregnancy: implications for noninvasive prenatal diagnosis. Transfusion Med 2001, 41, p. 524?1530.
3. Farina, A., Caramelli, E., Concu, M., et al. Testing normality of fetal DNA concentration in maternal plasma at 10-12 completed weeks‘ gestation: a preliminary approach to a new marker for genetic screening. Prenat Diagn 2002, 22, 2, p. 148-152.
4. Hahn, S., Holzgreve, W. Prenatal diagnosis using fetal cells and cell-free fetal DNA in maternal blood: what is currently feasible? Clin Obstet Gynecol, 2002, 45, 3, p. 649-656.
5. Honda, H., Miharu, N., Ohashi, Y., et al. Fetal gender determination in early pregnancy through qualitative and quantitative analysis of fetal DNA in maternal serum. Hum Genet 2002, 110, 1, p. 75-79.
6. Chan, KC., Zhang, J., Hui, AB., et al. Size distributions of maternal and fetal DNA in maternal plasma. Clin Chem 2004, 50, p. 88–92.
7. Koide, K., Sekizawa, A., Iwasaki, M., et al. Fragmentation of cell-free fetal DNA in plasma and urine of pregnant women. Prenat Diagn 2005, 25, p. 604–607.
8. Li, Y., Zimmermann, B., Rusterholz, C., et al. Size separation of circulatory DNA in maternal plasma permits ready detection of fetal DNA polymorphisms. Clin Chem 2004, 50, 6, p. 1002-1011.
9. Lo, YM., Tein, MSC., Lau, TK., et al. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis. Am J Hum Genet 1998, 62, p. 768–777.
10. Vodicka, R., Vrtel, R., Dusek, L., et al. Refined fluorescent STR quantification of cell-free fetal DNA during pregnancy in physiological and Down syndrome fetuses. Prenat Diagn 2008, 28, 5, p. 425-433.
11. Vodička, R., Vrtěl, R., Schneiderová, E., a kol. Neinvazivní detekce gonozomálních DNA sekvencí v lazmě gravidních žen s yužitím kapilární elektroforézy. Čes Gynek 2008, 73, 3, s. 150-153.
12. Zhang, P., Ren, JC., Shen, ZJ. A novel method for quantification of circulating DNA in serum by capillary zone electrophoresis. Chin Chem Lett 2004, 15, 9, p. 091-1094.
13. Zhong, XY., Burk, MR., Troeger, C., et al. Fetal DNA in maternal plasma is elevated in pregnancies with aneuploid fetuses. Prenat Diagn 2000, 20, p. 795–798.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 4-
All articles in this issue
- Etika neonatální intenzivní péče
- Dystokie ramének plodu při vaginálním porodu
- Analýza fragmentů volné fetální DNA v plazmě těhotných žen v průběhu těhotenství
- DNA analýza AZF oblasti Y chromozómu u Slovákov s poruchou plodnosti
- Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen
- Aloimunizace těhotných žen non-RhD erytrocytárními antigeny: přehledový článek
- Perinatální paréza brachiálního plexu
- Sutura ruptury perinea 3. a 4.stupně
- Závažné porodnické poranění a anální inkontinence
-
Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení
Data z registru UniSeven v České republice -
Trombotická trombocytopenická purpura v těhotenství
Kazuistika - Ruptury dělohy v těhotenství – kazuistiky
- Lokální protilátky proti spermiím a celkové hladiny imunoglobulinů v ovulačním cervikálním hlenu
- Hodnocení kostní minerální denzity ultrazvukem patní kosti a duální rentgenovou absorpciometrií předloktí v klinické praxi
- Komplikace radikálních onkogynekologických operací
- Proces reprodukčního stárnutí ženy – jeho příčiny a možnosti ovlivnění v praxi
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dystokie ramének plodu při vaginálním porodu
- Sutura ruptury perinea 3. a 4.stupně
- Perinatální paréza brachiálního plexu
- Komplikace radikálních onkogynekologických operací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

